卤素
第十二章 卤素

§1. 卤素单质
一. 物理性质------熔、沸点和颜色
1.状态、颜色
状态原因:半径依次增大,分子量也增大,所以色散力也增大,所以分 别以气体—液体—固体状态存在。 显色原因:利用分子轨道能级图解释显色。卤素分子中π*和σ*反键轨道 能量相差较小,这个能差随着Z的增大而变小。 F2 电子数少,反键 π*、σ*轨道能差大△E大。 F2吸收可见光中能量高、波长短的那部分 光(蓝、紫光),而显示出长波段那部分光,复合色变成黄色。
HXO都不稳定,仅存在于水溶液中,从Cl到I 稳定性减 小,分解方式:
(3) 氧化性
HXO不稳定,表明HXO的氧化性很强。
XO- 盐比HXO酸稳定性高,所以经常用其盐 在酸性介质中做氧化剂。
2.HXO的制备
1)次氯酸酐Cl2O溶于水制得HClO
步骤: 将Cl2通到新制干燥的HgO表面,加热制得Cl2O
二 化学性质
从卤素在自然界中存在形式可以看出卤素单 质化学活泼性很强,价电子层结构,易获一个 电子达到8电子稳定结构。卤素单质是强氧化 剂,而F2最强,随Z增大,氧化能力变弱。碘 不仅以负一价的离子存在于自然界中,而且以 +5价态存在于碘酸钠中,说明碘具有一定的还 原性,它们的化学活泼性,从F2到I2依次减弱。
Cl、Br、I具有不同价态的含氧酸
X: 采取SP3杂化,O的2P电子与卤素3d空轨道间形成d-pπ键。 由于稳定性原因,只有常见的氯的含氧酸研究得多
一、次卤酸
1. 化学性质 (1) 酸性
因为随半径增大,分子中 H— O—X,X—O 结合力减小,X
对 H+ 斥力变小,导致酸性减小。
(2) 热稳定性
名词解释卤素

名词解释卤素卤素是一种有机化合物,又称作“卤化物”,是指在卤素核心部分,带有一个或多个氯原子的化合物,其化学式一般为RX,其中R表示有机部分,可以是烷烃、烯烃、烃烷或其它有机物,X表示卤素核心部分,即氯原子,也可以是氟、硫、氢等原子。
由于卤素表现出特殊的极性特性,有机物中含卤素化合物常常以溶解材料的形式存在,从而发挥重要的起到作用。
卤素溶剂具有良好的溶质丰富性、水溶性良好、酸碱性可调、极差极性可调等优点,可以作为分子排斥、聚集、自结构等晶体反应的催化剂,使反应更加有效地进行。
卤素溶剂的应用涉及到核电子传输、液晶显示器、汽车油漆等各个领域。
卤素也可以用于分离、净化、分解各种有机物质,具有优异的极性、相互作用性、水溶性和溶解性能。
卤素溶剂可以将来自某些特定环境的有机物质分解,形成各种混合物、混合溶液和混合溶胶,可以用作放射性核素的催化物。
卤素溶剂也被广泛应用于各种油品的加工、改性、提纯和氧化等工艺过程中。
此外,卤素溶剂还可以用于有机合成中,如高分子化学、合成有机分子等,可以影响有机物质的分子结构,形成新的结构,从而改变有机物质的性质。
尽管卤素溶剂具有众多优势,但在实际应用中仍存在一些不足。
首先,卤素溶剂本身具有毒性,过度接触可能对人体健康造成威胁。
其次,部分卤素溶剂具有自蒸发性,因此必须存储在完全密封的容器中,以防止析出物。
虽然有这些局限性,但卤素溶剂的应用范围仍然很广泛,正在展现出更大的潜力,而且在未来几年也将受到越来越多的重视。
总之,卤素溶剂是一种广泛应用于化学、分离、净化、合成等工艺过程中的主要有机溶剂,具有优异的极性、相互作用性、水溶性和溶解性能,可以有效地提高反应作用的效率,是一种重要的有机溶剂。
元素化学——科普向:卤素

At:这是个人工合成的元素…
by pancake
卤素单质:物理性质
常温常压下,F和Cl是气态,溴是易挥发的液体,碘在 常温下是固体,加热状态下不熔化直接升华
从F到I,颜色依次加深 F为浅黄色,Cl为黄绿色,Br为棕色,I为紫色
所有卤素均具有刺激性气味,强烈刺激眼、耳、鼻
气管等黏膜,吸入较多蒸汽时会发生严重中毒,甚
思考
电解制氟时为什么不用KF水溶液?
by pancake
思考:答案
因为氟的化学性质异常活泼,它与水激烈反应: F2+H2O=2HF+O2
by pancake
极化作用
电流通过电池或电解池时,由于电极上发生副作用而改变电极性质称 为极化作用。极化的结果是使电流减弱
by pancake
蒙乃尔合金
又称镍合金,是一种以金属镍为基体添加铜、铁、锰等其它元 素而成的合金。蒙乃尔合金耐腐蚀性好,呈银白色,适合作边丝材料。
by pancake
氯的制备
by pancake
氯的制备:实验室制法
实验室里将氧化剂MnO2、KMnO4与浓盐酸反应制氯气
MnO2 4 HCl MnCl2 2H 2O Cl2 2KMnO4 16 HCl 2 KCl 2MnCl2 8H 2O 5Cl2
第三类是氧化反应,天然物质被辐照而产生自由基或纯态氧(又称 单一氧)等中间体,这些中间体又与化合物作用而生成转化的产物。
此处的光解是指液氧和液氟中的化学键分别断裂又重新形成生成 O2F2的光解反应 by pancake
卤素氧化物:Cl2O
用新制的黄色HgO和Cl2(用干燥空气稀释或溶解在CCl4中)反应 即可制得Cl2O
by pancake
卤素

At2
具有放射性 咱不讨论- - ...
1.卤素都能跟金属起反应生成卤化物。
非金属性越强,反应越易进行,生成的卤化物越稳定。
2.卤属都能跟氢气反应生成卤化氢。
F2低温下暗处就剧烈反应甚至爆炬产生HF稳定。Cl2低温下缓慢反应需光照或加热条件下进行。Br2 I2高温下才能反应,HI不稳定可分解为H2和I2 所以为可逆反应。
随着分子量的增大,卤素分子间的色散力逐渐增强,颜色变深,它们的熔点、沸点、密度、原子体积也依次递增
卤素的化学性质都很相似,它们的最外电子层上都有7个电子,有取得一个电子形成稳定的八隅体结构的卤离子的倾向
除F外,卤素的氧化态为+1、+3、+5、+7
卤素与氢结合成卤化氢,溶于水生成氢卤酸。
卤素之间形成的化合物称为互卤化物,如ClF3、ICl。
2F2+2H2O=4HF(aq)+O2 X2+H2O=HX(aq)+HXO(aq) X=表示Cl Br I (aq)代表是溶液.
4.卤素各单质的活泼性比较。
卤素各单质的活泼性顺序:F2>Cl2>Br2>I2 前者可将后者从其金属化物中置换出来.
5.碘与淀粉反应:碘+淀粉→蓝色,检验I2或淀粉的存在。
氟、氟化氢和氢氟酸对玻璃有较强的腐蚀性。
氟是氧化性最强的元素,只能呈-1价.其没有正价.
单质氟与盐溶液的反应,都是先与水反应,生成的氢氟酸再与盐的反应,通入碱中可能导致爆炸。
化学性质活泼,能与几乎所有元素发生反应(除氦、氖)。
水溶液氢氟酸是一种弱酸。但却是稳定性、腐蚀性最强的氢卤酸,如果皮肤不慎粘到,将一直腐蚀到骨髓。
卤素

(2)物质的颜色与吸收光颜色的关系 )
物质的颜色
绿 黄 青
橙 红
白光 蓝 紫
青蓝
黄绿 黄 橙 红 紫红 紫 蓝 青蓝 青
吸收光 波长(nm) 颜色 波长(nm) 400— 紫 400—450 450— 蓝 450—480 480— 青蓝 480—490 490— 青 490—500 500— 绿 500—560 560— 黄绿 560—580 580— 黄 580—600 600— 橙 600—650 红 ) X2为非极性分子,分子间作用 为非极性分子, 力主要为┄┄ ┄┄色散力 力主要为┄┄色散力 熔沸点F 依次升高。 ∴熔沸点 2→I2 依次升高。 聚集态 F2(g)→CI2(g)→Br2(l)→I2(g) Br2:非金属中的唯一液体 I2:固体易升华,紫黑 粉红 固体易升华,紫黑→粉红
(2)与非金属作用 )
F2
反应活性 与H2反应条件 暗处 光照 Pt/350℃ 高温 ℃ F2可与所有除 O2、N2,稀有气体He和Ne外的非金属作用 稀有气体 和 外的非金属作用 直接化合成高价氟化物。 直接化合成高价氟化物。 Cl2也可与大多数非金属单质化合,但不如 2猛烈。 也可与大多数非金属单质化合,但不如F 猛烈。 2 S(s) + Cl2(g) = S2Cl2(l) 红黄色液体 S(s) + Cl2(g)(过量 = SCl2(l) 深红色发烟液体 过量) 过量 2 P(s) + 3 Cl2(g) = 2 PCl3(l) 无色发烟液体 2 P(s) + 5 Cl2(g) (过量 = 2 PCl5(l) 淡黄固体 过量) 过量 Br2和I2与许多非金属作用反应,但不如 2、Cl2激烈,不能 与许多非金属作用反应,但不如F 激烈, 氧化到最高价。 氧化到最高价。
卤素

无卤限制指令?卤素现在没有哪个国家要强制执行。
只是行业中的某类客户要求的,具体怎么做取决于客户的要求。
尽管世界各国还没有出台专门针对卤素的法规,但国际上许多非政府组织的环保机构正积极推动无卤化行动,同时一些大型跨国公司也都制定了自己的环保法规,其中就包括对卤素的限制或限量,并要求自己的供应商遵守该限制或限量从而生产出绿色环保产品。
卤素是什么?化学周期表中第VIII族元素包括氟、氯、溴、碘、砹,合称卤素。
其中砹为放射性元素,在产品中几乎不存在,前四种元素在产品中尤其在聚合物材料中以有机物形式存在。
目前用于产品中的卤素化合物主要有:PBB、PBDE、TBBP-A、PCB、六溴十二烷、三溴苯酚、短链氯化石蜡;另有用于冷冻剂、隔热材料臭氧破坏物质CFCs、HCFCs、HFCs等。
无卤指令产生的背景:根据许多科学研究显示,卤素系阻燃剂已经成为日常环境中到处扩散的污染物,且对于环境与人类的威胁日益升高。
而制造、循环回收、或抛弃家电及其它消费性产品的行为,则是造成这些污染物释放到环境的主要途径。
为保护环境,某些卤素系阻燃剂已经不能使用在电器产品和房屋建材的塑料材料部份(此泛指塑料的表面/外壳)。
塑料材料中禁用卤素系阻燃剂的原因是此种阻燃剂无法回收使用,而且在燃烧与加热过程中会释放有害物质,威胁到人类身体的健康、环境和下一代子孙。
如同其它有毒的重金属(如铅、镉、水银、六价铬等),欧盟(European Union)在欧盟电子电机中危害物资禁用(Restriction of the Use of Hazardous Substances in electrical and electronic equipment, RoHS) 指令中决定在2006 年7月1日全面禁止PBB (Polybrominated Biphenyls) 及PBDE (Polybrominated Diphenyl Ethers) 等溴系阻燃剂的使用。
卤素
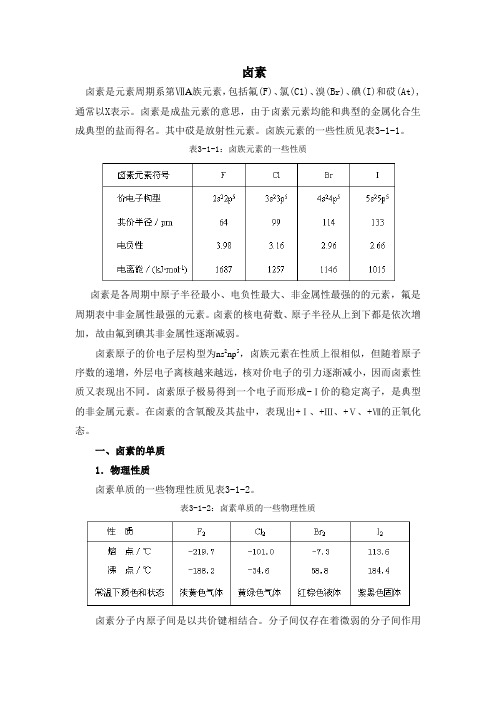
卤素卤素是元素周期系第ⅦA族元素,包括氟(F)、氯(C1)、溴(Br)、碘(I)和砹(At),通常以X表示。
卤素是成盐元素的意思,由于卤素元素均能和典型的金属化合生成典型的盐而得名。
其中砹是放射性元素。
卤族元素的一些性质见表3-1-1。
表3-1-1:卤族元素的一些性质卤素是各周期中原子半径最小、电负性最大、非金属性最强的的元素,氟是周期表中非金属性最强的元素。
卤素的核电荷数、原子半径从上到下都是依次增加,故由氟到碘其非金属性逐渐减弱。
卤素原子的价电子层构型为ns2np5,卤族元素在性质上很相似,但随着原子序数的递增,外层电子离核越来越远,核对价电子的引力逐渐减小,因而卤素性质又表现出不同。
卤素原子极易得到一个电子而形成-Ⅰ价的稳定离子,是典型的非金属元素。
在卤素的含氧酸及其盐中,表现出+Ⅰ、+Ⅲ、+Ⅴ、+Ⅶ的正氧化态。
一、卤素的单质1.物理性质卤素单质的一些物理性质见表3-1-2。
表3-1-2:卤素单质的一些物理性质卤素分子内原子间是以共价键相结合。
分子间仅存在着微弱的分子间作用力,随着相对分子质量的增大,分子的变形性逐渐增大,分子间的色散力也逐渐增强,因此,卤素单质的一些物理性质呈现规律性变化。
如卤素单质的熔点、沸点等按F—C1—Br—I的顺序依次升高。
常温下,氟和氯是气体,溴是易挥发的液体,碘为固体(易升华)。
可见卤素单质的颜色随着相对分子质量的增大而逐渐加深,这是由于从氟至碘外层电子离核越来越远,相应的外层电子更易被激发,所以外层电子被激发所需要的能量就越少,故使物质的颜色逐渐变深。
卤素单质是非极性分子,在水中的溶解度不大,易溶于有机溶剂。
氟不溶于水,它能剧烈地分解水而放出氧气。
溴在有机溶剂中的颜色随溴浓度的增加而逐渐加深,从黄色到棕红色。
碘溶于溶剂中所形成溶液的颜色随溶剂不同而有区别。
卤素单质均有刺激气味,吸人较多的蒸气会发生严重中毒,甚至造成死亡。
它们的毒性从氟到碘依次减轻。
溴易挥发,高浓度的液溴可使皮肤严重灼伤;碘的蒸气有毒,强烈刺激皮肤和眼睛;使用时要特别小心。
12-卤素

BrO4
-
BrO3
-
BrO-
Br2(l)
Br-
HI3O62- 0.65 IO3- 0.15 IO- 0.42 I2(s) 0.54 I在 0B图中,除X2/X-电对外,其余电对的电极电势虽为正值,但 均较小,即在碱性介质中,各种含氧酸盐的氧化性较含氧酸弱。
14.2.2 卤素单质物理性质
卤素单质
聚集状态 颜色 熔点/℃ 沸点/℃ 汽化热/(KJ· mol-1) 溶解度/g· (100gH2O)-1
• Cl2也可与大多数非金属化合,但不如F2猛烈。 Br2 、I2更差。 2S + Cl2 = S2Cl2 S + Cl2(过量) = SCl2
2P + 3Cl2 = 2PCl3
2P + 5Cl2(过量) = 2PCl5 2P + 3Br2 = 2PBr3 2P + 5Br2(过量) = 2PBr5
氟
气 浅黄 -219.6 -188 6.32 分解水
氯
气 黄绿 -101 -34.6 20.41 0.732
溴
液 红棕 -7.2 58.78 30.71 3.58
碘
固 紫黑 113.5 184.3 46.61 0.029
密度/(g· cm-3)
1.11(l)
1.57(l)
3.12(l)
4.93(s)
F F F I F F
Cl Cl
F F F F F I F F
I
例:ICl2 (7 + 1×2) / 2 = 4.5 (杂化轨道理论:sp3d),直线型 例:IF7 (7 + 1×7) / 2 = 7 五角双锥
对于ClF3 (7+3) 2 = 5
卤素PPT课件

05
卤素在生活生产中应用
食盐与人体健康关系探讨
食盐的化学成分及作用
主要成分为氯化钠(NaCl),是人体必需的营养元素之一,对于维持细胞内外渗透压平衡、 神经传导和肌肉收缩等生理功能具有重要作用。
食盐摄入量与健康关系
适量摄入食盐对维持人体健康至关重要,但过量摄入可能导致高血压、心血管疾病等健康问 题。世界卫生组织建议每日食盐摄入量不超过5克。
06
卤素对环境影响及治理措 施
大气中卤代烃污染现状及危害
卤代烃在大气中的来源
工业排放、汽车尾气、农药使用等。
大气中卤代烃的浓度及分布
受排放源、气象条件、地形等因素影响,浓度分布不均。
卤代烃对大气的危害
破坏臭氧层,导致紫外线辐射增强;形成光化学烟雾,危害人类健 康。
水体中卤代烃污染现状及危害
卤代烃在水体中的来源
溴和碘
物理性质
溴是一种红棕色、有刺激性气味 的液体,密度比水大,易挥发; 碘是一种紫黑色、有金属光泽的
固体,密度比水大,易升华。
化学性质
溴和碘的化学性质较为相似,都 具有氧化性,能与多种元素直接
化合生成溴化物和碘化物。
用途
溴和碘在有机合成、医药、农药 等领域有着广泛的应用。例如, 溴可用于制取溴化物、染料、灭 火剂等;碘可用于制取碘化物、
氯气可以与大多数金属直接反应,生 成相应的氯化物。
卤素性质变化规律
01
随着原子序数的增加, 卤素的非金属性逐渐减 弱,金属性逐渐增强。
02
卤素单质的颜色逐渐加 深,从氟气的浅黄绿色 到碘单质的紫黑色。
03
04
卤素单质的密度逐渐增 大,熔点和沸点也逐渐 升高。
卤素单质的氧化性逐渐 减弱,还原性逐渐增强。
卤素

9ห้องสมุดไป่ตู้
溴
液溴,在常温下为深红棕色液 体,可溶于水,100克水能溶 解约3克溴。挥发性极强,有 毒,蒸气强烈刺激眼睛、粘膜 等。水溶液称为溴水。溴单质 需要存储容器的封口带有水封, 防止蒸气逸出危害人体。有氧 化性,有多种可变化合价,常 温下与水微弱反应,生成氢溴 酸和次溴酸。加热可使反应加 快。氢溴酸是一种强酸,酸性 强于氢氯酸。溴一般用于有机 合成等方面。
13
3
化学性质
• 卤素单质的毒性,从F开始依次降低。 • 从F到At,其氢化物的酸性依次增强,但氢 化物的稳定性呈递减趋势。 • 氧化性:F₂> Cl₂> Br₂> I₂> At₂(一些单质 是否有氧化性要看具体化学反应) • 其对应的卤离子还原性依次减弱。 • 另外,卤素的化学性质都较活泼,因此卤 素只以化合态存在于自然界中。
5
化学性质
• • • • • • • • • .差异性 1.与氢气化合的能力,由强到弱 2.氢化合物的稳定性逐渐减弱 3.卤素单质的活泼性逐渐减弱 稳定性:HF>HCL>HBr>HI 酸性:HF<HCL<HBr<HI 单质氧化性:F2>CL2>Br2>I2 阴离子还原性: Fˉ<Clˉ Fˉ只有还原性, 其余既有氧化性又有还原 性。
8
氯
氯气常温下为黄绿色气体,可溶 于水,1体积水能溶解2体积氯气。 有毒,与水部分发生反应,生成 盐酸(HCl)与次氯酸(HClO), 次氯酸(HClO)不稳定,分解放 出氧气,并生成盐酸,次氯酸氧 化性很强,可用于漂白。氯的水 溶液称为氯水,不稳定,受光照 会分解成HCl与氧气。液态氯气 称为液氯。HCl是一种强酸。氯 有多种可变化合价。氯气对肺部 有强烈刺激。氯可与大多数元素 反应。氯气具有强氧化性 氯气与 变价金属反应时,生成最高金属 氯化物 。
卤素

2F₂+2OH⁻→OF₂+2F⁻+H₂O
卤的氧化物中氯原子具有多种不同氧化态,可用新制得的黄色Hgo和CI₂制取
2CI₂+2Hgo=HgCI•H₂O+CI₂O
同浓度卤酸的氧化性强弱关系比较
HBrO3、HClO3和HIO3 Br与Cl相比,外层18电子的Br吸引电子的能力大于8电子的Cl; Br与I的最外层都是18电子但Br的半径r小于I,所以Br的得电子能 力也大于I。故3种卤酸氧化性顺序为:HBrO3>HClO3>HIO HBrO4、H5IO6和HClO4 稀溶液中HClO4完全解离,ClO4-为正四面体结构,对称性高, 且不受H+反极化作用的 影响,比较稳定,所以氧化能力低。 高卤酸的标准电极势数值 排列: BrO4-/BrO3- H5IO6/IO3- ClO4-/ClO3- EAθ/V 1.85 1.60 1.20 比较卤酸的标准电极电势可知氧化性:HBrO4>H5IO6>HClO4
绝大数卤素互化物是不稳定的,熔沸点低。最稳定的XY型卤素互化物是CIF, 其物理性质介于组成元素的分子性质之间。卤素互化物都是氧化剂,与大多 数金属和非金属猛烈反应生成相应的卤化物;发生水解作用生成卤离子和卤 氧离子,其分子中较大电负性较小的卤原子生成卤氧离子。 氟的卤素互化物如CIF₃、CIF₅、BrF₃通常都作为氟化剂,使金属、非金属及金 属的氧化物以及金属的卤化物、溴化物和碘化物转变为氟化物
卤化物
卤素和电负性较小的元素形成的化合物叫做卤化物。由非金属或高氧化 态金属形成的卤化物BCl₃、CCl₄、SbCl₅、SF₆、WCl₆等,不论气相、液相或 是固相,往往形成共价型卤化分子,它们有挥发性、较低的熔点和沸点, 有的不溶于水,溶于水的往往发生强烈的水解。 碱金属、碱土金属及若干镧系和锕系元素,它们的电负性小,离子半径 大,形成的卤化物主要是离子型的。它们有高的熔点和沸点,在极性溶 剂中易溶解,其溶液有导电性,熔融状态时也能导电。同一周期各元素 的卤化物,随着金属离子半径减小和氧化数增大,离子性依次降低,共 价性依次增强,熔沸点依次降低。 同一金属的卤化物随着卤离子半径的增大,变形性也增大,按氟氯溴碘 的顺序其离子性依次降低,共价性依次增加。一般来说,金属氟化物主 要是,离子型化合物其它卤化物从氯到碘共价型化合物则逐渐增多。 不同氧化物的同一金属,其高氧化态卤化物的离子性小于低氧化态卤化 物的的离子性
卤素的解释

卤素(halogen)测试|无卤检测|卤素四项(氟F/氯Cl/溴Br/碘I)/ 卤素测试报告什么是卤素(halogen)?卤素(halogen)的应用是什么?卤素(halogen)有什么危害?卤素(halogen)测试怎么做?为什么通常是卤素(halogen)四项测试?什么是卤素测试报告?卤素(halogen)的大致应用范围是哪些?什么限制卤素(halogen)使用的相关法规?本版将就一些大家关心的问题,做个简单介绍。
一、什么是卤素(halogen)?卤素(halogen)是化学周期表中第ⅦA族非金属元素。
卤素(halogen)具体来说指的是氟(Fluorine)、氯(Chlorine)、溴(Bromine)、碘(Iodine)和砹(Astatine)五种元素,合称卤素。
由于砹(Astatine)为放射性元素,因此,人们通常所指的卤素习惯上是氟F、氯CI、溴Br、碘I四种元素。
卤素化合物经常作为一种阻燃剂应用于电子零组件与材料、产品外壳、塑胶等。
此种阻燃剂无法回收使用,而且在燃烧与加热过程中会释放有害物质,威胁到人类身体的健康、环境和下一代子孙。
二、卤素(halogen)的应用卤素(halogen)(氟Fluorine/氯Chlorine/溴Bromine/碘Iodine)大多在聚合物材料中以有机物形式存在。
用于常见产品中的卤素化合物主要有PBB、PBDE、TBBP-A、PCB、六溴十二烷、三溴苯酚、短链氯化石蜡;另有用于冷冻剂、隔热材料等的臭氧破坏物质CFCs、HCFCs、HFCs等。
一般来说,卤素化合物大多是应用于阻燃剂、制冷剂、溶剂、有机化工原料、农药杀虫剂、漂白剂、羊毛脱脂剂等。
三、其它含有卤素(halogen) (F/Cl/Br/I)的各类物质有机氯化合物:用于塑料的耐燃剂、增塑剂、印刷电路格等上的耐燃剂等;聚氯乙烯(PVC):电源电缆、連接电缆、产品内連线用塑料电线、粘合剂、高压塑料电线、退磁线圈的包里、绝缘胶带;灭蚁灵(Mirex):用于树脂、橡胶、涂料、纺织物、电气产品等的阻燃剂、防锈剂等;氯化烷烃(CP):用作含有附件产品的外框(外壳)、印刷电路板(碳链长为10 -13、含氯量为50wt%以上的短链型氯化烷烃類对象);多氯化萘(PCN):润滑油、涂料等用途(氯原子数≧3以上的多氯化萘(PCN)产品);多氯联苯(PCB / PCBs):绝缘油、润滑油、塑料耐燃剂等;其它有机溴化合物:用于塑料的耐燃剂印刷电路板等上的耐燃剂等;四溴双酚-(TBBP-A):用于塑料的耐燃剂(以PS、ABS、PC/ABS、Mppe等四种塑料最常使用半导体封装材料与体积路板基材);多溴二苯醚(PBDE),用于塑料的耐燃剂;多溴联苯(PBB):用于塑料的耐燃剂;氯化石蜡Chlorinated paraffins;氯三联苯(PCT)Polychlorinated terphenyls。
卤素

卤素(ⅦA族)氟F、氯Cl、溴Br、碘I 统称为卤素。
价电子构型:ns2np5氧化态:除氟外(-1),均可呈现0、-1、+1、+3、+5、+7卤素的存在氟:是自然界中广泛分布的元素之一,在卤素中,它在地壳中的含量仅次于氯。
氟在地壳的存量为0.072%,克拉克值0.0625,存在量的排序数为12,自然界中氟主要以萤石(Fluorite)存在,其主要成分为氟化钙(CaF2)、冰晶石(3NaF.AlF3)及以氟磷酸钙[Ca5F(PO4)3]为主的矿物。
氯:氯在地壳中的含量为0.031%,自然界的氯大多以氯离子形式存在于化合物中,氯的最大来源是海水。
矿物中有光卤石(KCl ﹒MgCl6﹒6H2O)溴:以溴化物的形式存在于海水和地壳中碘:以碘化物形式存在,南美洲智利硝石含有少量的碘酸钠。
海中的植物可以富集碘。
卤素单质物理性质氟:通常情况下氟气是一种浅黄绿色的、有强烈助燃性的、刺激性毒气,是已知的最强的氧化剂之一。
熔点-219.62℃,沸点-188.14℃。
氟的电负性最高,吸引电子能力强氯:气态氯单质俗称氯气,液态氯单质俗称液氯。
在常温下,氯气是一种黄绿色、刺激性气味、有毒的气体。
压力为101.325KPa 时,氯单质的沸点为-34.4℃,熔点为-101.5℃。
氯气可溶于水和碱性溶液,易溶于CS2和CCl4等有机溶剂,饱和时1体积水溶解2体积氯气。
溴:深棕红色、易挥发、有强烈刺激性臭味、液体密度:3.119g/cm3,熔点:-7.2℃ ,沸点:58.76℃,在常温下,是唯一的液态非金属。
碘:紫黑色晶体,具有金属光泽,性脆,易升华。
有毒性和腐蚀性。
密度4.93 克/立方厘米。
熔点113.5℃,沸点184.35℃。
加热时,碘升华为紫色蒸汽,这种蒸气有刺激性气味,有毒。
易溶于乙醚、乙醇、氯仿和其他有机溶剂,形成紫色溶液,但微溶于水(但如果水中含碘离子会使其溶解度增大:I-+I2==I3-,也溶于氢碘酸和碘化钾溶液而呈深褐色。
第12章 卤素

实验室中用化学方法制备单质氟的过程如下: 2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2 SbCl5 + 5HF = SbF5 + 5HCl K2MnF6 + 2SbF5 423K 2KSbF6 + MnF4 2MnF4 → 2MnF3 + F2
工业上用电解氧化法来制备单质氟: - - 阳极:2F = F2↑+ 2e - - - 阴极:2HF2 + 2e = H2↑+ 4F 电解总反应:2KHF2 = 2KF + F2↑+ H2↑
大量碘由碘酸钠制取: - - - - 2IO3 + 5HSO3 = 3HSO4 + 2SO42 H2O + I2 即: - - - - IO3 +HSO3 = I + 3SO42 +H+ - - IO3 + 5I + 6H+= 3I2 + 3H2O
二、卤化氢和氢卤酸
1. 卤化氢的性质 2. 氢卤酸的性质(酸性、还原性) 酸性变化规律: HF HCl HBr HI 弱 强 + - HF H +F Kao=6.6×10-4 - - HF+F HF2 Ko=5
汽化热(KJ/mol) 在水中溶解度(g/100g 水) (298K)
分解水
0.732
3.58
0.029
2. 卤素单质的化学性质(氧化性)
a、与金属作用
F2:在低温和高温下都可以和所有金属直 接作用, 生成高价氟化物。(Cu、Ni、Mg除外) Cl2: 也可与各种金属作用,反应较剧烈。氯在干燥 的情况下不与铁作用。
2. 卤素互化物
由两种卤素组成的化合物叫卤素互化物。如ICl、ICl3、 IF5、IF7 卤素互化物遇水即水解: XX′+H2O=H++X-+HXO IF5+3H2O=H++IO3-+5HF 半径较大的碱金属可形成多卤化物如KI3、KICl2、 KICl4、CsIBr2等,一般没有氟。它们在结构和性质 方面与卤素互化物近似。多卤化物不稳定,受热易分 解,分解后倾向于生成晶格更稳定的物质。
卤素

2)通人氯把溴置换出来:
Cl2 + 2Br- = Br2 + Cl-
3)再用空气把溴吹出以碳酸钠吸收:
3Na2CO3 + 3Br2 == 5NaBr + NaBrO3 + 3CO2 4)最后用硫酸酸化,单质溴又从溶液中析出。
5HBr + HBrO3 = 3Br2 + 3H2O 用此方法,从1吨海水中可制得约0.14kg的溴。
3、除氟外,氯、溴和碘均可显正氧化态,氧化数经常是+1, +3,+5的+7。
1
2-2 卤素在自然界中的分布
卤素是最活泼的非金属元素,卤素是“成盐元素”的意思,在 自然界只能以化合态的形式存在。多数以氢卤酸盐形式存在。
氟: 萤石(CaF2)、 冰晶石(Na3AlF6)、 氟磷灰石Ca5F(PO4)3
氯和溴: 大量在海水中 NaCl、NaBr 钾石盐KCl 光卤石KCl· MgCl26H2O
碘: 智利硝石(NaNO3中含有NaIO3),富集于海带、海藻中
2-3 卤素单质
1.卤素单质的物理性质:
F2
Cl2
聚集状态
g
g
分子间力
小
颜色
浅黄 黄绿
Br2 l
红棕Leabharlann I2 s大 紫(紫黑(s))
显色原因:分子中*和*反键分子轨道能差不同,吸收的可见光 波长度不同。F2吸收能量高(波长短)的光,显示波长较长光的复 合色。
364
HI 1.49 分子极性 -50.80 熔点 -35.36 沸点 -26.5 300 稳定性 299 强
电子构型 氧化态 F [He]2s22p5 -1、0 Cl [Ne]3s23p5 -1、0、+1、+3、+4、+5、+7 Br [Ar]4s24p5 -1、0、+1、+3、+4、+5、+7 I [Ar]4s24p5 -1、0、+1、+3、+4、+5、+7
第6章 卤素

一、P区元素概述 含ⅢA~ⅦA 及零族,沿B-Si-As-Te-At为 对角线, 右上方为非金属元素区,含21种 元素;左下方为10种金属元素。 特点: 1、原子结构 :价层 ns2 np1-6 2、金属性、非金属性:同一周期从左到右、 非金属性增强 ,金属性减弱 ;同族,从上 到下,除ⅦA外,均从典型非金属元素过渡 到金属元素 。 3、氧化数:⑴除零族元素外 ,常具有多种氧 化数, 除正氧化数外,还有负氧化数。
常温
Cl2 Br2 I2 ClO
BrO 3 IO 3
-
加热
ClO 3
-
低温 ClOO
PH 4
BrO 3 IO 3
-
-
BrO (0 C) PH 6
IO 3
-
PH 9
§ 11.1 p区元素概述
ⅠA
元素周期系的分区及各区的价电 子组态
ⅡA
0
ⅢA―ⅦA
S区
ⅢB―ⅦB
Ⅷ
ⅠB ⅡB
p 区
ns1–2
第11章
卤素
氧族元素
卤素
• 一. 卤素概述: • 1.第VIIA族包括氟、氯、溴、碘 和砹五种元素,总称为卤素。卤 素希腊原文为成盐元素的意思。。 • 砹是放射性元素,在自然界中仅 以微量而短暂地存在于镭、锕或 钍的蜕变产物中。
注意价电子结构和氧化数
2np5 2.价电子层结构:ns
• 导致非单质的氧化数: • 1)最低氧化数:-1 • 2)最高氧化数:F:-1;其它:+7 • 3) 氧化数都是奇数(为什么)
• 氧化还原性 F2
-
Cl2
Br2
I2
E (X 2 /X ) /V: 2.889 1.360 1.0774 0.5345
卤素

常温 强光照射
Br2
常温 600C
I2
高温
爆炸、放出大量热
缓慢
爆炸
不如氯 明显
减 小
缓慢
10.2.1.3 与H2O反应
卤素与水可发生两类反应,分别是氧化作用和歧化作用:
(1)氧化作用 2X2 + 2H2O
4HX + O2↑
(2)歧化水解 X2 + H2O
H+ + X- + HXO
F2的氧化性强,只能与水发生第一类反应,且反应激烈:
主要氧化数
氟(F) 氯(Cl) 溴(Br) 碘(I)
9
17
35
53
2s22p5 3s23p5
4s24p5 5s25p5
64
99
114
133
4.0
3.0
2.8
2.5
1681 125非1 金属性1减140弱 1008
-1、0
-1、0
-1、0
-1、0 +1、+3 +5、+1、+3 +5、 +1、+3
+7
+7
力依次减弱:F2 > Cl2 > Br2 > I2
电极电势: F2/F-
Eθ (X2/X-) 2.87
Cl2/Cl1.36
Br2/Br- I2/I1.065 0.535
10.2.1.1 与金属、非金属反应
卤素
反应物质
所有金属
F2
除氮、氧外的非金属
Cl2 Br2 、I2
与上类似
活泼金属 其他金属
反应程度
10.3.2.2 还原性
卤素

单质氟的制备
1、单质氟的制备(P459图14-2) 、单质氟的制备 图
氯单质的发现
1、单质氯的发现:氯 、单质氯的发现: 是由瑞典化学家舍勒(C.W. 是由瑞典化学家舍勒 Scheele)在1774年用软锰矿 在 年用软锰矿 (MnO2)与盐酸反应而发现的, 与盐酸反应而发现的, 与盐酸反应而发现的 氯气为黄绿色, 氯气为黄绿色,所以氯一词 希腊文原意是黄绿色。 希腊文原意是黄绿色。
氟的特殊性
氟的原子半径特别小, 氟的原子半径特别小 , 其核周围电子密 度较大, 度较大 , 当它接受外来一个电子或共用 电子对成键时, 电子对成键时 , 将引起电子间较大的斥 力 , 这种斥力部分地抵消了气态氟形成 气态氟离子, 气态氟离子 , 或氟形成单质分子时所放 出的能量。所以氟的电子亲合势小于氯. 出的能量。所以氟的电子亲合势小于氯 尽管氟的电子亲合势反常 地小于氯, 但因F 地小于氯 , 但因 2 的离解 能较小, 能较小 , F- 离子的水合能 较大, 较大 , 所以氟在卤素中仍 然是个最强的氧化剂。 然是个最强的氧化剂。
单质的化学性质
2、氯(电极电势 、 电极电势=1.358V)也能与各种金属和大多 )也能与各种金属和大多
数非金属(除氮、 数非金属(除氮、氧、稀有元素外)直接化合,但有 稀有元素外)直接化合, 些反应需要加热,反应还比较剧烈。而氯与Co、 、 些反应需要加热,反应还比较剧烈。而氯与 、S、V 氧化为: 和Bi氧化为 氧化为 CoCl2,SCl4,VCl4,BiCl3(不是最高氧化态) , , , (不是最高氧化态)
卤
卤 素 通 性 卤 素 单 质 卤 化 氢 和 氢 卤 酸 卤 化 物 卤 素 互 化 物 多 卤 化 物 元 素 电 势 图
高一化学 卤素

高一化学卤素一、介绍卤素卤素是化学元素周期表第17族的元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素在自然界中广泛存在,并且常用于许多化学和生物学应用中。
在本文中,我们将对卤素的性质、用途以及相关实验进行探讨。
二、卤素的性质1. 卤素的物理性质卤素在常温下会呈现不同的物态。
氟气和氯气都是无色气体,而溴是深红色液体,碘是紫黑色固体,砹则是放射性的固体。
卤素的沸点和熔点随着原子序数的增加逐渐升高,同时密度也逐渐增加。
2. 卤素的化学性质卤素在化学反应中表现出一系列的特性。
它们可以与金属发生反应,并形成离子化合物。
例如,氯可以与钠发生反应,生成氯化钠。
另外,卤素还可以与非金属发生反应,并形成共价化合物。
例如,氟可以与氢发生反应,生成氟化氢。
三、卤素的应用1. 工业应用卤素在工业上有着广泛的应用。
氯被用于消毒水处理、漂白剂以及合成许多化合物的原料。
溴被广泛应用于制药和农业领域,用于消毒和灭虫。
碘被用于制备碘酒、碘盐和消毒剂。
砹在放射治疗中具有一定的应用价值。
2. 生物学应用卤素在生物学中也起着重要的作用。
氯化物是人体内必需的微量元素,对维持水盐平衡和神经、肌肉正常功能发挥着重要作用。
碘是甲状腺激素的重要组成部分,对身体的生长和代谢有着重要影响。
四、相关实验1. 氯离子的检测实验材料:稀盐酸(HCl)、银氨溶液(AgNO3)、氨水(NH3)实验步骤:a. 将少量的盐酸滴加到待检测的溶液中,观察是否产生气体释放。
b. 向溶液中加入几滴银氨溶液,观察是否产生白色沉淀。
c. 加入氨水后,观察沉淀是否溶解。
实验结果:a. 如果产生气体释放,可能是盐酸与氯化物反应产生氯气。
b. 如果产生白色沉淀,可能是盐酸与氯化物反应产生氯化银。
c. 沉淀溶解则表示盐酸与氯化物反应产生了可溶性的化合物。
2. 碘离子的检测实验材料:稀盐酸(HCl)、硫酸(H2SO4)、淀粉溶液实验步骤:a. 将待检测溶液加热,观察是否发生变色。
卤素知识讲座

10.飞荣达直接客户之无卤素要求
富士康(FOXCONN): 溴(Br)<900PPM 氯(Cl)<900PPM 氯(Cl)+溴(Br)<1500PPM
对于替代阻燃剂,不允许使用以下物质: 三氧化二锑(Sb2O3) 磷酸三苯酯(TPP) 红磷
10.飞荣达直接客户之无卤素要求
智富、迈拓: 溴(Br)<900PPM 氯(Cl)<900PPM 氯(Cl)+溴(Br)<1500PPM
14.无卤产品的定义
无卤产品(Halogen Free):根据某要求, 将卤素含量控制在一定范围内的产品。此范 围将比含卤产品大大减少对环境、生命财产 的影响。
根据IEC61249-2-21:2003标准:氯小 于900PPM,溴小于900PPM,氯、溴之和 小于1500PPM的覆铜板,定义为无卤覆铜 板。
卤素溶于水,在空气中与水蒸汽结合会形成 酸雨;塑料在注塑过程中,卤素会释放出卤 化氢,腐蚀模具;PCB板在(>200度)的 高温焊接过程中也会释放出溴化氢;有机氯 和有机溴化合物燃烧时发烟大,会产生有毒 气体二恶英,破坏环境。
3.卤素的危害
二恶英(Dioxin):是一种无色无味、毒性严重的脂溶性物质,二 恶英实际上是二恶英类(Dioxins)一个简称,它指的并不是一种 单一物质,而是结构和性质都很相似的包含众多同类物或异构体 的两大类有机化合物,全称分别是多氯二苯并二恶英 (简称 PCDDs)和多氯二苯并呋喃 (简称PCDFs))这类物质非常稳定, 熔点较高,极难溶于水,可以溶于大部分有机溶剂,是无色无味 的脂溶性物质,所以非常容易在生物体内积累。自然界的微生物 和水解作用对二恶英的分子结构影响较小,因此,环境中的二恶 英很难自然降解消除。它包括210种化合物。它的毒性十分大,是 氰化物的130倍、砒霜的900倍,有“世纪之毒”之称。国际癌症 研究中心已将其列为人类一级致癌物。环保专家称,“二恶英”, 常以微小的颗粒存在于大气、土壤和水中,主要的污染源是化工 冶金工业、垃圾焚烧、造纸以及生产杀虫剂等产业。日常生活所 用的胶袋,PVC(聚氯乙烯)软胶等物都含有氯,燃烧这些物品 时便会释放出二恶英,悬浮于空气中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、卤素单质间的置换反应
实验Biblioteka 现象化学方程式将少量新制的饱和氯水分别 (1)静置后,液体
加入盛有NaBr 溶液和KI 溶液的试管中,用力振荡后 加入少量四氯化碳,振荡、
分层,上层接近无 色 ,下层 橙红色
静置。
(2)静置后,液体
分层,上层接近无
2NaBr+ Cl 2=2NaCl+Br 2 2KI+ Cl 2=2NaCl+I 2
能具有的性质是( B )
A.常温下,单质砹是白色固体 B.单质砹难溶于水
C.砹易与氢气化合
D.砹能与水剧烈反应
总结
元素位置
核电荷数 电子层数 原子半径
原子结构
相同点 不同点
得失电 子能力
元素性质
相似性 金属性 递变性 非金属性
方法模型
结构位置
预测
验证
性质
实验
F2 的氧化性最强,能与水发生反应2F2+2H2O=4HF+O2
卤素单质物理性质
问题2—1:除了化学性质外,卤素单质的物理性质是否具有相似和和递变 性?
阅读课本“卤素单质的主要物理性质”表格
单质 颜色和状态(常态) 密度
熔点 ℃
沸点 ℃
F2 淡黄绿色气体 1.69g/L -219.6 -188.1
Cl2 黄绿色气体 3.214g/L -101 Br2 深红棕色液加体 3.119g/cm增3 -7.2
-34.6
58.升78
I2 紫黑色固体深 4.93g/cm大3 113.5 184高.4
问题2—2请结合已学知识,大胆预测S的化学性质,并说出预测依据。
易得电子,单质表现氧化性,但是氧化性弱于O2 结构预测性质
问题1原—子2:核根对据最卤外素的层原电子子结的构引特力点,逐请渐你减试弱着预测氟、氯、逐渐减弱
溴、碘的化学性质,说出预测根据.
问题1—3:判断物质氧化性强弱的方法有哪些?如何设计实验 验证?
(1)与同一物质发生反应的条件、反应剧烈程度及反应生成产物的稳定性;
(2)可根据氧化学还原反应的知识:在同一个氧化还原反应中有氧化剂的 氧化性强于氧化学产物的氧化性。
色 ,下层 紫红色
将少量溴水加入盛有KI溶 液的试管中,用力振荡后加 入少量四氯化碳,振荡、静 置。
静置后,液体分层,
上层接近无色 ,下 层 紫红色
2KI+ Br 2 =2KBr+I 2
【得出结论】
(1)卤素单质的氧化性强弱F2>Cl2>Br2>I2 相应卤素离子的还原性强弱 F-<Cl-<Br-<I-
2Fe+3Cl2 点燃 2FeCl3 (3)与水反应Cl2+H2O=HCl+HClO (4)与碱反应: Cl2+2NaOH=NaCl+NaClO+H2O
运用模型:Cl2具有非金属单质的通性及 本身特性
卤素单质的化学性质
完成表格
元素名称 原子序数 原子结构示意图
氟(F)
9
氯(Cl) 溴 (Br) 碘(I)
卤族元素的原子结构与性质
• 自主学习 • 知识回顾 • 卤素单质的化学性质 • 卤素单质物理性质 • 小结
自主学习
画出F原子结构示意图,预测F2的性质。
F有较强非金属性,F2 有强氧化性 结构预测性质的模型
知识回顾
氯气具有哪些化学性质?(写出化学反应方程式) (1)与氢气反应:H₂+Cl₂ 点燃2HCl (2)与金属反应:2Na+Cl2 点燃 2NaCl
结
构
(2)卤素的非金属性强弱 F>Cl>Br>I
决
【小结】 同主族元素原子结构的相同点决定了元素性质的 相似性,原子结构的不同点决定了元素性质的 递变
定 性
性。
质
问题1—4:请分别写出Br2、 I2 与活泼金属、水以及氢氧化钠溶液的反应。
与金属反应:3Br2+2Fe=2FeBr3
加热
I2+Fe===FeI2 与水反应X2+H2O=HX+HXO (X:Cl、Br、I) 与碱反应: X2+2NaOH=NaX+NaXO+H2O(X:Cl、Br、I) 注意:I2的氧化性较弱,只能将变价金属氧化到低价态
【练习1】下列关于卤族元素的递变规律的说法中不正确的是( D )
A.氧化性: F2>Cl 2>Br2>I 2 B.稳定性: HF>HCl>HBr>HI C.还原性: F-<Cl - <Br- <I - D.熔沸点: F2>Cl 2>Br2>I 2 【练习2】砹(At)是原子序数最大的卤族元素,砹或砹的化合物可
17
35
53
最外层电子数
7
7
7
7
电子层数
2
3
4
5
原子半径
逐渐增大
问题1—1:问题1—1分析观察上表,卤族元素原子结构的共同点 是?不同点是?变化规律是?
相似性:最外层均为7个电子
易得电子,单质表现氧化性
递变性:F→Cl →Br →I
核电荷数递增 电子层数递增
结构预测性质
原子半径依次增大
单质的氧化性
