中南大学2000-2007年无机化和有机化学学考研真题答案
中南大学有机实验试卷

中南大学考试试卷2006 —2007学年上学期期末考试试题时间60分钟有机化学实验课程64学时2学分考试形式:闭卷专业年级:化工0501—0507 总分100分,占总评成绩40 %一、填空题(本题22分,每空2分)1、测定熔点使用的熔点管(装试样的毛细管)一般外径为1~1.2 mm,长为70~80 mm。
试样的高度约为(),试样应不含(),装样应()。
2、蒸馏是提纯()物质的常用方法。
当二组分沸点相差()℃以上,可用普通蒸馏的方法分离,当二组分沸点相差不大,或需高纯度,可用()分离。
一定压力下,一种纯净的()物质具有恒定的沸点,且沸程范围很小,一般为()℃。
3、测定熔点的意义主要有()和()。
4、重结晶操作过程中,若待提纯物质含有有色杂质,可用活性炭脱色,活性炭用量依颜色深浅而定,一般为待提纯物质质量的()%。
二、判断题(共15分,每小题3分,正确的在括号内打“√”,错误的打“×”)1、蒸馏时温度计水银球应毗连冷凝管的出口,若水银球位置在冷凝管出口上方,测得温度偏高。
()2、测定熔点时,使熔点偏高的因素是试样中含有杂质。
( )3、用蒸馏法测液体的沸点时,烧瓶内被测化合物的体积应占烧瓶体积的3/4。
()4、制备出的液体物质在进行蒸馏提纯前,先需要干燥,一般每10mL样品约需0.5—1.0g干燥剂。
()5、萃取是利用混合物中各组分在两种互不相溶或微溶的溶剂中溶解度或分配比的不同来达到分离提纯的一种操作。
()三、选择题(共12分,每题4分)(若为多选,少选选对适当给分,多选或选错不给分)1、适用于水蒸气蒸馏的化合物应具备的性质有()。
A、不溶或难溶于水B、在常压下蒸馏会发生分解的高沸点有机物C、在沸腾下与水不起化学反应D、在100℃左右,该化合物应有一定的蒸汽压2、抽气过滤结束时的操作顺序是()。
A、先关水泵再打开安全瓶的活塞B、先打开安全瓶的活塞再关水泵C、先关水泵再拔抽滤瓶的橡胶管D、先拔抽滤瓶的橡胶管再关水泵3、重结晶操作的一般步骤,其顺序是( )。
(NEW)中南大学《912无机化学》历年考研真题汇编(含部分答案)

第一部分 中南大学912无机化学考研真题 (含部分答案)
2013年中南大学912无机化学考研真题
2012年中南大学912无机化学考研真题
2011年中南大学912无机化学考研真题及详解
2010年中南大学912无机化学考研真题
2009年中南大学912无机化学考研真题
6.指出下列过程中ΔU、ΔH、ΔS、ΔF、ΔG何者为零?(1)非理 想体的卡诺循环;(2)理想气体的绝热节流(焦耳—汤姆逊)膨胀; (3)非理想 气体的绝热可逆膨胀;(4)在100℃,在1atm下,1mol水 蒸发成水汽;(5)在 绝热恒容的反应器中,H2和Cl2化合成HCl。
7.江河入海处,为什么常形成三角洲?
请就以下问题做简要回答(每题10分): 1.常用氧化还原滴定法有哪几类?这些方法的基本原理是什么?
2.酸碱滴定中,指示剂选择的原则是什么?
3.是就任一仪器分析方法,简要说明其原理并举例说明其应用。
4.化学热力学和化学动力学基本任务有有何不同?影响化学反应 速率大小的因 素有哪些?如何影响?
5.原电池和电解池中的能量转换方式有何不同?极化有何异同? 写出原电池的基本方程—能斯特方程,加以说明。
2008年中南大学912无机化学考研真题
2007年中南大学412无机化学考研真题及详解
2006年中南大学412无机化学考研真题
2005年中南大学412无机化学考研真题
2004年中南大学412无机化学考研真题及详解
2003年中南大学412无机化学考研真题
2001年中南大学529无机化学考研真题
2000年中中南大学无机化学考研真题及详解
第二部分 中南大学无机化学复试笔试真 题
2012年中南大学无机化学复试笔试真题(回 忆版)
2007考研有机化学真题及答案
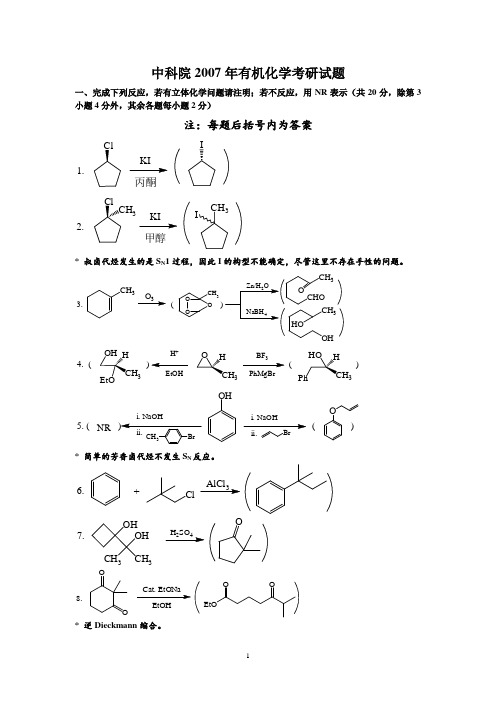
中科院2007年有机化学考研试题一、完成下列反应,若有立体化学问题请注明;若不反应,用NR 表示(共20分,除第3小题4分外,其余各题每小题2分)注:每题后括号内为答案1.丙酮I2.甲醇3CH 3I* 叔卤代烃发生的是S N 1过程,因此I 的构型不能确定,尽管这里不存在手性的问题。
3.()3CH3CH 3OO O334.()()H +EtOHBF PhMgBr3335.(()i.NaOHOHi.NaOHONR* 简单的芳香卤代烃不发生S N 反应。
6.+ClAlCl 37.OH OH CH 3CH 324O8.EtOHO OOEtOO* 逆Dieckmann 缩合。
9.Br 2H 2O二、为下列转变提供所需的试剂,必要时注明用量。
有的转变可能需要不止一步反应,请分别写出每步反应所需的试剂(20分,每小题2分)1.Br解:1 NaCN ; 2 H 3O +或 1 Mg/乙醚;2 CO 2;3 H 3O +2.()OHOH O解:1 SOCl 2; 2 LiAlH(t-BuO)3; 3 H 3O + 或1 LiAlH 4;2 H 3O +; 3 CrO 3/Py3.n -BuOHO-Bu3O解:1 SOCl 2;2 Me 2Cd 或 与过量的MeLi 反应后水解4.()NHOO解:1 NH 2OH/H +;2 H 2SO 4或PCl 5,Beckmann 重排。
5.()HONH 2O解:NaNO 2/HCl6.PhOPhO解:1 LDA (1mol );2 MeI ;必须用强碱,否则易导致自身缩合。
7.O OBr解:Br 2(1mol)/HAc8.()解:1 B 2H 6;2 H 2O 2/OH -9.()n -Bu2On -Bu CN解:P 2O 5或POCl 310.EtBrEt-NH 2解:1 NaN 3;2 LiAlH 4; 3 H 3O +三、判断题(共28分。
1、2两个小题各5分;3、4两个小题各9分) 1.指定下列各化合物手性中心的绝对构型(R/S )。
中南大学历年有机化学考试试题及答案

13下列最稳定的构象是[ ]
14下列化合物烯醇式含量最高的是[ ]
A 丙酮 B 2,5-戊二酮 C 乙酰乙酸乙酯 D 丙二酸二乙酯
15某化合物的分子式为C4H8Br2,其1H-NMR如下:δ=1.8(3H,双峰),δ=2.3(2H,多重峰),δ=3.6(2H,三重峰),δ=4.2(1H,多重峰)。该化合物是 [ ]
2.D:E:F:KMnO4(其它氧化剂也可)
G:H:
3.I:J:
4.K:L:
5.M: N: O:
(本题20分,每空格2分,写错不给分,基本正确酌情给分。)
四、鉴别题(共12分,第1小题4分,第二小题5分,第三小题3分)
(本题12分,各题每一步给分情况如上所示。注:其他方法正确相应给分。)
五、指定原料合成(注意:反应过程中所用的有机溶剂、催化剂及无机原料可任选,在反应中涉及的其他中间有机物均要求从指定原料来制备)(共15分)
三、完成下列化学反应(只要求写出主要产物或条件( A~O),每空1分,共15分)
1.
(A)(C)
2. + CH3COCl(D)(E)
(G)(H )
3.(I)(J)
4.(K)(L)
四、鉴别题(共12分,第1小题4分,第二小题5分,第三小题3分)
2、 (A)苄胺 (B)N-乙基苯胺 (C)苄醇 (D)对甲苯酚
1.沸点最高的是()。
A:丁酸B:丁醛C:丁醇D:2-丁酮E:1-丁烯
2.某烷烃的分子式为C5H12,只有二种二氯衍生物,那么它的结构为( )。
A:正戊烷B:异戊烷C:新戊烷D:前A、B、C均可E:不存在这种物质
3.下列化合物不具有芳香性的是( )。
38、中南大学无机化学题库答案:问答题(7-9)

15.该溶胶的胶粒应带正电 ,电泳方向是向负极 。 因为题目给出的电解质正离子相同 ,而负离子不同 ,相同浓度时聚沉能力不同 ,显然 是负离子起聚沉作用 ,则胶粒必然是带正电的 。
16.根据题意
n( A g N3 O ) =100×0.01=1.0(m mol)
n(CrO2 ) =50×0.005=0.25(m mol)
胶核 电位离子 吸附层 胶粒 胶团 扩散层 反离子 反离子
由于胶粒带正电荷 ,所以电泳时胶粒向负极(阴极)移动 。 6.沸点由低至高的顺序排列如下 :⑥ < ④ < ⑤ < ⑦ < ③ < ① < ② 7.把相同质量的葡萄糖和甘油分别溶于 100g 水中 ,所得溶液的沸点 、凝固点 、蒸气压 和渗透压都不相同 。因为稀溶液的上述性质主要与在一定量溶剂中所含溶质的微粒数目 有关 ,而与溶质的本性无关 。葡萄糖 (C6H12O6)的分子量为 180 ,甘油 [C3H5(OH)3]的 分子量为 92 ,因而相同质量的葡萄糖和甘油所含的分子个数并不相同 ,甘油的分子个 数较多 ,当它们分别溶于 100g 水中 ,则甘油溶液的沸点较高 ,凝固点较低 ,蒸气压 较低 ,渗透压较大 。如果把相同物质的量的葡萄糖和甘油分别溶于 100g 水中 ,则所得 两种溶液中所含溶质微粒数相同 ,因此上述稀溶液依数性的数值也相同 。 8.稀溶液的沸点不一定比纯溶剂高 。对于难挥发或挥发性比纯溶剂低的溶质 ,其稀溶液的 沸点比纯溶剂的高 ;而对于挥发性比纯溶剂大的溶质 (例如在水中加入乙醇) 溶液的蒸 气压将比纯溶剂的高 ,此时溶液的沸点比纯溶剂低 。 9.可以用渗透压来说明其主要原因 。当土壤中溶液的浓度大于农作物细胞液浓度时 ,细胞 液中的水份将通过细胞膜向土壤渗透 ,则细胞达不到所需的水份 。因此 ,盐碱地中盐 的浓度较大时 ,农作物的细胞会失水 、甚至枯萎 。同样 ,施了太浓的肥料 ,农作物
中南大学07级有机化学实验试卷(含答案)

中南大学考试试卷2008 -- 2009学年下学期时间80分钟09年 5月20日有机化学实验课程 32 学时学分考试形式:闭卷专业年级:应化,制药07级总分100分,占总评成绩70%一、填空题(共10小题,每小题2分)1.减压过滤的优点有:(1) ;(2) ;(3)。
2.液体有机物干燥前,应将被干燥液体中的尽可能,不应见到有。
3.提勒管法测定熔点时,温度计的水银球部分应放在什么位置:。
熔点测定关键之一是加热速度,当热浴温度达到距熔点15℃时,应,使温度每分钟上升。
当接近熔点时,加热要,使温度每分钟上升4.简单分馏装置中分馏液体体积以不超过烧瓶容积的为宜。
当开始有馏液流出时,应控制流出液速度。
如果分馏速度太快,产品将下降。
分馏和蒸馏在原理上及装置上有哪些异同:。
两种沸点接近的液体组成的混合物能否用分馏提纯。
5.采用重结晶提纯样品,选择重结晶溶剂是根据原理进行,选择方法是在1-3 mL溶剂中加入 g样品,时完全溶解,时析出大量晶体,为良溶剂。
重结晶溶剂一般过量,若需要加活性炭进行脱色时,活性炭过量会有什么不良影响:。
6.分液漏斗主要应用在哪四个方面(1)(2)(3)(4)。
7.水蒸气蒸馏是用来分离和提纯或有机化合物的一种方法,被提纯物质必须具备三个条件是(1) ;(2) ;(3)。
8.薄层色谱应用在哪三个方面催化苯甲醛合成安息香中,加入苯甲醛后,反应混合物的pH值要保持9-10。
溶液pH 9.VB1值过低或过高有什么不好?10. 合成乙酰苯胺的实验是采用什么方法来提高产品产量的?(1):。
(2):。
二、选择题(共20分,每小题1分)1、蒸馏分离提纯液体有机化合物时,依据化合物的性质是()。
A、溶解度B、重度C、化学性质D、挥发度2、用分液漏斗萃取振荡时,漏斗的活塞部分应采取的位置是()。
A、向上倾斜;B、向下倾斜;C、保持水平位置;D、保持垂直位置3、蒸馏硝基苯(b.p. 210.8℃),应选用的冷凝管是()。
考研化学试题2007考研题十卷无机试卷

普化无机试卷(10)班级 姓名 分数一、选择题 ( 共13题 23分 )1. 2 分 (4523) 黄色HgO 低于573 K 加热时可以转化成红色HgO ,这是因为………………………( )(A) 加热改变了结构类型 (B) 加热使晶体出现了缺陷(C) 结构相同,仅仅由于晶粒大小不同 (D) 加热增强了Hg 2+ 对O 2-的极化作用2. 2 分 (1349) 下列化合物与水反应放出 HCl 的是………………………………………………… ( )(A) CCl 4 (B) NCl 3 (C) POCl 3 (D) Cl 2O 73. 2 分 (2098) 在下列物质中,具有顺磁性的有:(1) (NH 4)2Re 2Cl 8; (2) (NH 4)3Tc 2Cl 8; (3) 氧合血红蛋白; (4) 维生素B 12。
4. 2 分 (1515) 在下列反应中:① Cu 2+ + I -−→−② Cu 2+ + CN - −→− ③ Cu 2+ +-24MnO + H 2O −→− ④+22Hg + I - (适量) −→− ⑤+22Hg + NH 3·H 2O −→−金属离子氧化态发生变化的是………………………………………………………………( )(A) ①②③④ (B) ①②③⑤ (C) ①②④⑤ (D) ②③④⑤5. 2 分 (3677) 在下列溶液中,HCN 电离度最大的是………………………………………………( )(A) 0.1 mol ·dm -3 NaCN (B) 0.1 mol ·dm -3 KCl 与0.2 mol ·dm -3 NaCl 混合液(C) 0.2 mol ·dm -3 NaCl (D) 0.1 mol ·dm -3 NaCN 和0.1 mol ·dm -3 KCl 混合液6. 2 分 (3879) 对于一个确定的化学反应来说,下列说法中正确的是………………………………( )(A) mr G ∆越负,反应速率越快 (B) m r H ∆越负,反应速率越快 (C) 活化能越大,反应速率越快 (D) 活化能越小,反应速率越快7. 2 分 (0401) H 2(g) +21O 2(g)H 2O(l) 的Q p 与Q V 之差(kJ ·mol -1)是………………………( )(A) -3.7 (B) 3.7 (C) 1.2 (D) -1.28. 2 分 (0909) 原子轨道角度分布图中,从原点到曲面的距离表示…………………………………( )(A) ψ值的大小 (B) r 值的大小 (C) Y 值的大小 (D) 4πr 2d r 值的大小9. 2 分 (1766) 已知Y 2O 2S : Eu 3+是目前彩色电视中广泛应用的一种稀土荧光粉 ,它显示的颜色是…………………………………………………………………………………………… ( )(A) 绿色 (B) 红色 (C) 黄色 (D) 蓝色10. 2 分 (3936) 关于原子结构的叙述中:①所有原子核均由中子和质子构成;②原子处于基态时,次外层电子不一定是8个;③稀有气体元素,其基态原子最外层有8电子;④最外层电子数为2的原子一定是金属原子。
中南大学题库

第1章气体一、单选题1、某气体AB,在高温下建立下列平衡∶AB(g)==A(g)+B(g).若把1.00mol此气体在T=300K,P=101 kPa下放在某密闭容器中,加热到600K时,有25.0%解离。
此时体系的内部压力(kPa)为( )A. 253 B. 101 C.50.5 D.1262、一敞口烧瓶在7℃时盛满某种气体,欲使1/3 的气体逸出烧瓶,需加热到()A.100℃B.693 ℃C.420 ℃D.147 ℃3、实际气体和理想气体更接近的条件是( )A.高温高压 B. 低温高压 C. 高温低压 D. 低温低压4、A,B两种气体在容器中混合,容器体积为V,在温度T下测得压力为P,V A ,V B 分别为两气体的分体积,P A ,P B 为两气体的分压,下列算式中不正确的一个是( )A. PV A = n A RTB. P A V A =n A RTC. P A V= n A RVD. P A (V A+V B )= n A RT5、某容器中加入相同物质的量的NO和Cl2,在一定温度下发生反应:NO(g)+1/2Cl2NOCl(g)。
平衡时,各物种分压的结论肯定错误的是()A. P(NO)=P(Cl2) B. P(NO)=P(NOCl)C. P(NO)<P(Cl2) D. P(NO)>P(NOCl)6、The height of a column of liquid supported by atmospheric pressure is inversely proportional to the density of the liquid. Mercury has a density of 13.6 g/mL. How higha column of water (density = 1.00 g/mL) would be supported by an atmospheric pressure of0.876 atm? ( )A. 9.05×103 mmB. 1.03×104 mmC. 49.0 mmD. 11.9 mm7、If you purchase a balloon filled with helium and take it outside on a cold day, you will notice that it shrinks and becomes less buoyant. What gas law explains this observation? ( )A. Boyle'sB. Charles'sC. Avogadro'sD. Graham's8、A sample of gas occu pies 10.0 L at 50°C. Assuming that pressure is constant, what volume will the gas occupy at 100°C?( )A. 10.0 LB. 20.0 LD. 5.0 L9、What is the Charles's law constant (in L/K) for 200 mg of carbon dioxide at 600 mm pressure? ( )A. 4.73 10–4 L/KB. 5.64 10–3 L/KC. 42.0 L/KD. 2.11 103 L/K10、At a given temperature and pressure, which gas occupies the smallest volume per unit mass? ( )A O2B. ArC. CO2D. Xe11、At what temperature (in °C) will 25.0 g of carbon dioxide (at 1.00 atm) occupy. ( )A. 188°CB 461°CD. –270°C12、What is the molar mass of a gas that has a density of 3.11 g/L at 100°C and 1.50 atm pressure? ( )A. 0.152 g/molB. 95.2 g/molC. 17.0 g/molD. 63.5 g/mol13、What volume of N2gas would be produced by the decomposition of 35.0 g NaN3solid? (Assumethat the gas is produced at 1.00 atm pressure and 150°C.)( )A 28.0 LB. 9.95 LC. 18.7 LD. 56.1 L14、At what temperature would CO2 gas have the same average molecular speed as O2 gas has at 400 K? ( )A. 250 KB. 550 KC. 400 KD. 600K15、How much faster does nitrogen escape from the balloon than oxygen? ( )A. 1.07 times fasterB. 1.14 times fasterC. 0.875 times as fastD. 0.935 times as fast二、判断题(判断下列各项叙述是否正确,对,打“√”;错,打“×”。
(NEW)中南大学《910生物化学(含有机化学)》历年考研真题汇编

7 _________酶催化ATP生成cAMP,后者再经_________酶降解成 _________而失活。
8 酮体生成的直接原料是_________,其限速酶是_________。 9 大肠杆菌RNA聚合酶的全酶由_________组成,其核心酶的组 成为_________。 二、名词解释(32分): 鸟氨酸循环 G蛋白 竞争性抑制 冈崎片段 一碳单位 脂肪动员 糖异生 端粒和端粒酶 三、简答题:
分
5 讲述尿素循环及其调节。10分
6 讲述线粒体内NADH呼吸链与氧化磷酸化过程。15分
7 写出谷氨酸在体内 ① 氧化生成CO2和H2O; ② 生成糖; ③ 生成甘油三脂的主要历程,注明催化反应的关键酶。15分
2005年中南大学生物化学考研真 题
一、名词解释(20分): 结构域 酶化学修饰 乳酸循环 氧化磷酸化 旁分泌信号 二、简答题: 1 酶活性中心的结构特点是什么?5分 2 糖的有氧氧化分几个阶段?写出每个阶段的关键酶。5分 3 为什么酮体是肝内合成肝外用?5分 4 线粒体内生成乙酰-CoA是如何转移至线粒体外,用于脂肪的合
2003年中南大学生物化学考研真 题
1 红细胞内还原型谷胱甘肽的含量很高,从红细胞的代谢阐明这 一现象。10分
2 从血红蛋白及肌红蛋白的结构阐明它们的氧饱和曲线的特点。 10分
3 重酶促反应的机制解释酶促反应具有极高的效率。10分 4 机体如何调节丙酮酸脱氢酶复合物的活性。10分 5 简述氧化磷酸化的耦联机制。10分 6 何谓甲硫氨酸循环及它的主要功能。10分 7 简述TPK-Ras-MAPK途径。10分 8 生物转化的定义是什么?包括哪些步骤?10分 9 简述血浆脂蛋白的代谢及相互转变。20分
中南大学有机化学考试试卷答案
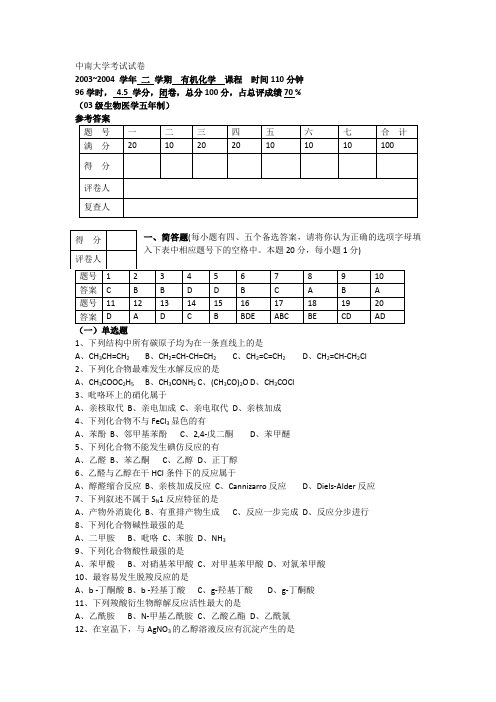
中南大学考试试卷2003~2004 学年二学期有机化学课程时间110分钟96学时,4.5 学分,闭卷,总分100分,占总评成绩70 %(03级生物医学五年制)(一)单选题1、下列结构中所有碳原子均为在一条直线上的是A、CH3CH=CH2B、CH2=CH-CH=CH2C、CH2=C=CH2D、CH2=CH-CH2Cl2、下列化合物最难发生水解反应的是A、CH3COOC2H5B、CH3CONH2C、(CH3CO)2OD、CH3COCl3、吡咯环上的硝化属于A、亲核取代B、亲电加成C、亲电取代D、亲核加成4、下列化合物不与FeCl3显色的有A、苯酚B、邻甲基苯酚C、2,4-戊二酮D、苯甲醚5、下列化合物不能发生碘仿反应的有A、乙醛B、苯乙酮C、乙醇D、正丁醇6、乙醛与乙醇在干HCl条件下的反应属于A、醇醛缩合反应B、亲核加成反应C、Cannizarro反应D、Diels-Alder反应7、下列叙述不属于S N1反应特征的是A、产物外消旋化B、有重排产物生成C、反应一步完成D、反应分步进行8、下列化合物碱性最强的是A、二甲胺B、吡咯C、苯胺D、NH39、下列化合物酸性最强的是A、苯甲酸B、对硝基苯甲酸C、对甲基苯甲酸D、对氯苯甲酸10、最容易发生脱羧反应的是A、b -丁酮酸B、b -羟基丁酸C、g-羟基丁酸D、g-丁酮酸11、下列羧酸衍生物醇解反应活性最大的是A、乙酰胺B、N-甲基乙酰胺C、乙酸乙酯D、乙酰氯12、在室温下,与AgNO3的乙醇溶液反应有沉淀产生的是A 、B 、C 、D 、13、下列化合物中没有芳香性的是A 、B 、C 、D 、14、下列化合物中,N 原子上的未共用电子对在sp 2杂化轨道上的是A 、B 、C 、D 、15、下列化合物中有变旋光现象的是A 、B 、C 、D 、(二)多选题(少选、选错、多选或不选不给分) 16、能发生碘仿反应的是A 、正丙醇B 、丙酮C 、丙醛D 、乙醇E 、异丙醇 17、下列化合物有旋光性的有A 、乳酸B 、亮氨酸C 、(2R,3R)酒石酸D 、(2R,3S)酒石酸E 、甘氨酸 18、下列哪些糖为非还原糖A 、葡萄糖B 、蔗糖C 、麦芽糖D 、果糖E 、糖原 19、能发生缩二脲反应的有A 、L-半胱氨酸B 、甘氨酰谷氨酸C 、蛋白质D 、多肽E 、尿素 20、下列哪些概念所指的化合物在立体化学中属于非对映体A 、差向异构体B 、内消旋体C 、外消旋体D 、端基异构体E 、互变异构体二、判断题(你认为正确的打“√”,错误的打“×”,本题10分,每小题1分)1、 不对称烯烃与氢溴酸加成时,若反应体系中有过氧化物则反马氏规则。
中南大学无机化学考研题库含答案

中南大学无机化学考研题库含答案无机化学是化学学科的一个重要分支,对于考研的同学来说,掌握好这门课程至关重要。
以下是为大家整理的中南大学无机化学考研题库及答案,希望能对大家的复习有所帮助。
一、选择题1、下列物质中,属于离子晶体的是()A 干冰B 金刚石C 氯化钠D 石墨答案:C解析:离子晶体是由阴、阳离子通过离子键结合而成的晶体。
氯化钠是典型的离子晶体,干冰是分子晶体,金刚石是原子晶体,石墨是混合型晶体。
2、下列分子中,中心原子采用 sp³杂化的是()A BeCl₂B BF₃C CH₄D CO₂答案:C解析:CH₄分子中,碳原子的价层电子对数为 4,采用 sp³杂化。
BeCl₂中 Be 原子采用 sp 杂化,BF₃中 B 原子采用 sp²杂化,CO₂中C 原子采用 sp 杂化。
3、下列物质中,具有顺磁性的是()A O₂B N₂C H₂D CO答案:A解析:O₂分子中有两个未成对电子,具有顺磁性。
N₂、H₂、CO 分子中电子均已成对,具有反磁性。
4、下列溶液中,凝固点降低最多的是()A 01 mol·L⁻¹的蔗糖溶液B 01 mol·L⁻¹的氯化钠溶液C 01 mol·L⁻¹的氯化钙溶液D 01 mol·L⁻¹的醋酸溶液答案:C解析:根据稀溶液的依数性,凝固点降低与溶质的粒子数有关。
氯化钙溶液中粒子数最多,因为氯化钙在溶液中完全电离出 3 个离子(1 个钙离子和 2 个氯离子),所以凝固点降低最多。
5、下列电极反应中,标准电极电势最大的是()A Ag⁺+ e⁻= AgB Cu²⁺+ 2e⁻= CuC Fe³⁺+ e⁻= Fe²⁺D Zn²⁺+ 2e⁻= Zn答案:A解析:标准电极电势越大,氧化态的氧化性越强。
在上述电极反应中,Ag⁺的氧化性最强,所以标准电极电势最大。
2007年中国科学院无机化学考研试题及答案

)
=F
−
(g)
= 2F(g)
= Na (g) + F (D) Na(g) = Na (g) + e
(B) NaF(s)
+ + −
−
(g)
15. 若两个液态组分混合形成理想溶液,则混合过程的…………………………………( (A) ΔV = 0 ΔH = 0 ΔS = 0 ΔG = 0 (B) ΔV > 0 ΔH < 0 ΔS < 0 ΔG > 0 (C) ΔH = 0 ΔV = 0 ΔS > 0 ΔG < 0 (D) ΔH > 0 ΔV < 0 ΔG< 0 ΔS > 0 16. 将下列四种气体按给定量混合均匀, 其中分压最小的是------------------------------( (B) 3.2 g CH4 (C) 2.8 g CO (D) 19.2 g O2 (A) 0.6 g H2 )
4−
5.
)
(B) [Cu(en)2] (D) [Co(CN)6]3−
2+
6. 已知:H3PO4 K1 = 7.1 × 10-3,K2 = 6.0 × 10-10,K3 = 4.4 × 10-13 Na2HPO4 和 Na3PO4 溶解在水中, 其物质的量浓度相同, 这溶液的[H+]应是…………… ( -3 -8 -10 -13 (A) 7.1 × 10 (B) 6.0 × 10 (C) 4.3 × 10 (D) 4.4 × 10 7. s, p, d, f 各轨道的简并轨道数依次为…………………………………………………( (A) 1, 2, 3, 4 (B) 1, 3, 5, 7 (C) 1, 2, 4, 6 (D) 2, 4, 6, 8 试判断下列说法,正确的是……………………………………………………………( 科目名称:无机化学 第 1 页 共6页
中南大学物化考试卷及答案 4套

ΔvapHm=ΔsubHm-ΔfusHm= 17 580 J·mol-1
-ΔvapHm/RT + B = -3116 K/T + 27.537
B = 22.922
所以液体 CO2 的蒸气压与温度的经验关系为:
ln(p/Pa) = -ΔvapHm/RT + 22.922 = -2115 K/T + 22.922
0, W
0, Δ
U
0 ,ΔH
0,
2. 1mol 25℃的液体苯在弹式量热计中完全燃烧,放热 3264KJ,则反应
Kp =(x NH3 p)2/(x H2 p)3(x N2 p)= 6.818×10-8 kPa2 解得 p = 1115 kPa
(2 分)
(1 分) (2 分)
(2 分)
(3 分)
6
中南大学考试试卷 02
一、填空题(每小题 3 分,共 45 分)
1. 273.15K,101.325KPa 下,固体冰融化为水,其过程的 Q
15. [答] (C)
二、填空题 ( 共 5 题 9 分 )
16. [答] Q=W=nRTln(V2/V1),n=2 mol
17. [答] 吉布斯自由能
18. [答] f = 3
19. [答] xB(g) > xB(总) > xB(l)
xB= 0.6 恒沸混合物
20. [答] T; T, p
三、计算题 ( 共 5 题 60 分 )
3. N2(g),O2(g) 体系中加入一种固体催化剂,可生成几种气态氮的氧化物,则体系的自由
度为
。
4.完全互溶的二组分溶液,在 xB= 0.6 处平衡蒸气压有最高值,那么组成 xB=0.4 的溶液在 气-液平衡时,xB(g),xB(l),xB(总)的大小顺序为________________ 。将 xB=0.4 的溶液进 行精镏,塔顶将得到 ___________ 。
中南大学无机化学考研题库(含答案)

习题1.完成并配平下列反应方程式。
(1)Cu2O+H2SO4(稀)→CuSO4+Cu+H2O(2)Cu2++2NaOH(浓)+2OH-→Na2[Cu(OH)4](3)2Cu2++4I-→2CuI(s)+I2(4)Cu+4CN-+H2O→Cu(CN)43-+OH-+1/2H2(5)Cu2++ 4CN-→[Cu(CN)2]-+(CN)2(6)CdCl2+KI(过量)→K2[CdI4](7)2Cu2++4OH-+C6H12O6→Cu2O+2H2O+C6H12O7(8)3CuS+ 8HNO3(浓)→3Cu(NO3)2 +2NO+ 3S↓+ 4H2O(9)Au+HNO3+4HCl→HAuCl4+NO2+2H2O(10)Zn2++NaOH(浓) +2H2O→ Na[Zn(OH)4]+H2↑(11)2Hg2++Sn2++6Cl-→Hg2Cl2+SnCl4(12)4Zn+10HNO3(极稀) →4Zn(NO3)2+NH4NO3+3H2O(13)AgBr+2Na2S2O3→Na3[Ag(S2O3)2]+ NaBr(14)2Ag(NH3)2++CH3CHO+3OH-→2Ag+HCOO-+4NH3+2H2O(15)Hg2Cl2+2NH3→HgNH2Cl↓+Hg↓+NH4Cl(16)3HgS+ 12HCl(浓)+2HNO3(浓) →3H2[HgCl4]+3S+2NO+4H2O(17)HAuCl4+FeSO4→(18)4Au+O2+8CN-+2H2O→4[Au(CN)2]-+4OH-2. 解释下列现象,并写出相关的反应方程式(1)加热CuCl2·H2O得不到CuCl2。
因为CuCl2·H2O受热分解时,在失去HCl的同时,生成了碱式盐:CuCl2·H2O=Cu(OH)2·CuCl2·+2HCl+2H2O(2)焊接金属时,常用浓ZnCl2溶液处理金属的表面。
FeO+2H[ZnCl2(OH)]=Fe[ZnCl2(OH)]2+H2O(3)有空气存在时,铜能溶于氨水。
中南大学无机化学试题及答案

2004-2005 年度第二学期 无机化学中段考试卷 A 答案
一、选择题 ( 共 15 题 30 分 ) 1. 7459 (C) 2. 4333 (D) 3. 4338 (D) 4. 1478 (D) 5. 7396 (C) 6. 1349 (C) 7. 1482 (D) 8. 7475 (D) 9. 7446 (D) 10. 7363 (C) 11. 1421 (A) 12. 4348 (B) 13. 7463 (D) 14. 4361 (D) 15. 1460 (B) 二、填空题 ( 共 12 题 30 分 ) 16. 5 分 (7452) NO,NO2,无,N2O4, 和 17. 5 分 (1410) NH3, HOCl H3,PO3,,HCl SbOCl, HCl BiOCl,HCl H 3,AsO3, ,HCl 18. 2 分 (4402) I2 + 5Cl2 + 12OH I2 + 5H2O2
四、问答题 ( 共 4 题 20 分 ) 31 5 分 (1364) 工业上怎样用氯化钾制备氯酸钾?写出有关反应方程式。
32. 5 分 (7427) 黑色化合物 A 不溶于水,但可溶于盐酸。稀释其盐酸溶液时,有白色沉淀 B 析出,酸化时,沉 淀溶解。在溶液中通 H2S 时,生成一种褐黑色沉淀 C,该沉淀可溶于 Na2S2 溶液生成化合物 D。试 判断各化合物: A为 ,B 为 ,C 为 ,D 为 。
= 2N (g) + 4HCl(g) + 5O (g) + 6H O
2 2 2
= -639 kJ·mol-1
用固体 NH4ClO4 和铝粉混合成固体推进剂。估算高氯酸铵和铝粉的质量比。 (相对原子质量:N 14,Cl 35.5,Al 27.0)
36、中南大学无机化学题库答案:问答题(1-3)

5.由于逆反应的平衡常数很大 K =1.5³106 ,逆反应进行十分完全 ,所以将 NO (g)和
Θ
O2 (g) 等体积混合后 , 几乎完全转化为棕色的 NO2 (g) 。 在开口的试管中有 NO 析出时 , 在试管口即可观察到棕色的 NO2 生成 。 6.理想气体状态方程
pV nRT 。使用时应注意如下几点 :
1 2 1 ③ 3,1,0,+ 2
① 3,1,1,+ ⑤ 3,1,-1,+
1 2 1 ④ 3,1,0,- 2
② 3,1,1,-
1 2
⑥ 3,1,-1,-
1 2
由于四个 3 p 电子必然有两个电子是成对的 ,另外两个电子应自旋平行 。因此硫的四
个 3 p 电子所有可能的各套量子数组合为 : ⑪ ①②③⑤ ⑫ ①②④⑥ ⑬ ①③④⑤ ⑭ ①③⑤⑥ ⑮ ②④⑤⑥ ⑯ ②③④⑥ 11.⑪ 1 s 2 2 s 2 2 p 63 s 2 3 p 6 3 d 10 4 s 2 4 p 2 ,Ge ,锗 ,第四周期 ,ⅣA 族 。 ⑫ 该元素原子最外层各价电子的核外运动状态如下表 : 最外层各价电子 4 s2 4 p2 ⑬ 此元素原子最外层 pχ n 4 4 4 l 0 0 1 m 0 0 +1 或-1、0 mS +1 / 2 -1 / 2 都是+1 / 2
Vi ni ,组分气体的体积分数与温度无关 。 V n
⑫ 变化 。因为恒温下 pi p总 压必然改变 。 ⑬ 不变 。因为体积变化时只是压力随之改变 ,而 ni 和 n总 不变 ,所以
ni n 由于 i 不变 ,所以压强变化时组分气体的分 n总 n总
ni 不变 。 n总
3
(二) 原子结构 1.氢原子只有一个电子,没有屏蔽效应 ,也无穿透效应 ,轨道能量只决定于主量子数 n 。 氯原子是多电子原子 ,存在屏蔽效应和穿透效应 ,造成同主层不同亚层的能级分裂 。 电子在 3 s 和 3 p 轨道上受到其它电子的屏蔽作用不同 ,它们的穿透能力也不同 ,造 成在不同亚层轨道上的能量不同 。所以在多电子原子中 ,轨道能量不仅与主量子数 n 有关 ,还与副量子数 l 有关 。 2. 将氢原子核外电子从基态激发到 2 s 或 2 p 轨道所需要的能量无差别 , 因为氢原子是单 电子原子 ,轨道能量只决定于主量子数 n ,所以 E2s=E2p 。但氦原子属于多电子原子 , 轨道能量不仅与主量子数 n 有关 ,还与副量子数 l 有关 ,E2s<E2p ,所以核外电子从基 态激发到 2 p 轨道所需要的能量要高一些 。 3.见下表 :
9、中南大学无机化学题库(选择题)(16-21)

(
)
41.下列化合物中,在水中溶解度最小的是 * A、NaF B、KF C、CaF2 D、BaF2
(
)
42.下列化合物中,溶解度最大的是 *** A、LiF B、NaClO4 C、KClO4 D、K2PtCl6
(
)
43.下列化合物中,具有顺磁性的是 ** A、Na2O2 B、SrO C、KO2
310
(
)
59.可以将钡离子和锶离子分离的一组试剂是*** A、H2S 和 HCl C、K2CrO4 和 HAc B、(NH4)2CO3 和 NH3·H2O D、(NH4)2C2O4 和 HAc
(
)
60.Ca 、Sr 、Ba 的草酸盐在水中的溶解度与其铬酸盐相比*** A、草酸盐溶解度逐渐增加,铬酸盐溶解度逐渐降低 B、草酸盐溶解度逐渐降低,铬酸盐溶解度逐渐增加 C、两者都是溶解度逐渐降低 D、两者都是溶解度逐渐增加 61.至今未发现能生成过氧化物的元素是* A、Be B、Ba C、Cs D、Li
Θ Θ
B、金属锂表面有氧化物保护膜 C、金属钠的熔点低于锂的熔点 D、NaOH 易溶于水,而 LiOH 较难溶于水 68.超氧化钠 NaO2 与水反应的产物是** A、NaOH ,H2 ,O2 C、NaOH ,H2O2 ,O2 B、NaOH ,O2 D、NaOH ,H2 ( ) ( )
69.碱土金属氢氧化物在水中的溶解度规律是* A、从 Be 到 Ba 依次递增 C、从 Be 到 Ba 基本不变 B、从 Be 到 Ba 依次递减 D、从 Be 到 Ba 变化无规律
(
)
(
)
62.下列氢氧化物中,碱性最强的是* A、LiOH B、Be (OH)2 C、Mg (OH)2 D、Ca (OH)2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中南大学2015年全国硕士研究生入学考试《无机化学》考试大纲
一考试性质
无机化学考试是为我校招收无机化学、有机化学、应用化学、分析化学和物理化学硕士研究生而设置的入学考试科目,其目的是科学地测试学生掌握大学本科阶段无机化学的基本知识和基本理论,以及运用其基本原理和实验手段来分析和解决无机化学领域问题的能力,以保证考生具有基本的无机化学理论和实验技能。
二考试目标
1 初步掌握元素周期律,化学动力学、化学热力学、近代物质结构、化学平衡以及基础电化学等基本原理。
2 利用无机化学原理去掌握有关无机化学中元素和化合物的基本知识,并具有对一般无机化学问题进行理论分析和计算的能力。
三考试形式和试卷结构
(1)试卷满分及考试时间:本试卷满分为150分,考试时间为180分钟。
(2)答题方式:答题方式为闭卷考试(可以使用数学计算器)。
四试卷题型结构
本课程考试题型包括选择题,填空题,推断题(简答题),计算题以及化学方程式的书写等内容,其分值为:
选择题(30~35分),填空题(20~25分),完成反应式(20~25分),计算题(25~35分),推断题(或简答题)(20~35分)。
五考试内容
5.1 无机化学中的化学原理,主要包括如下内容:
(1)掌握化学反应中的质量和能量关系;
(2)了解化学反应速率,熟悉影响化学反应及化学平衡的因素;
(3)了解酸碱理论,熟悉溶液中的单相与多相离子平衡,掌握弱酸、弱碱溶液中离子浓度、盐类水解和沉淀平衡的计算;
(4)熟悉氧化还原反应的基本原理,掌握电极电势、Nernst方程及其应用,了解电势图及其应用;
(5)了解配合物的化学键理论,掌握配合物的基本概念、稳定常数及其应用,熟悉配合物在水溶液中的稳定性。
5.2结构化学
(1)了解原子结构的近代概念,熟悉原子中电子的分布,掌握原子性质的周期性;
(2)了解价键理论、杂化轨道理论、分子轨道理论的基本概念,掌握离子键、共价键、分子间力和氢键的特点;
(3)了解晶体的特征、性质以及晶体结构与物理性质的关系。
5.3 元素化学,主要包括下面主要内容:
(1)了解氢、稀有气体及其化合物的性质;
(2)熟悉卤素及其单质的通性,掌握卤化氢、氢卤酸和卤化物的性质,了解氯的含氧酸及其盐、氰、氢氰酸及其盐的性质;
(3)熟悉氧族元素的通性,掌握过氧化氢、硫化氢、硫化物、硫的氧化物、含氧酸及其盐的性质,了解氧气、臭氧和水的净化;
(4)熟悉氮族元素的通性,掌握氮的氧化物、含氧酸及其盐的性质,了解氮气、氨、铵盐以及磷的化合物的性质;
(5)了解硅、硼及其重要化合物的性质,熟悉氧化铝、氢氧化铝及铝盐的性质,掌握碳及其重要化合物的性质;
(6)熟悉碱金属、碱土金属的通性,掌握其正常氧化物、氢氧化物与盐类的性质,了解其低氧化物、过氧化物和超氧化物的性质;
(7)熟悉过渡元素的通性,了解过渡元素的基本性质,掌握铁、铬、锰、钴、镍、锌、铜及其重要化合物的性质;
(8)熟悉镧系、锕系元素的通性。
5.4 实验部分
(1)基本操作和技能:无机化学实验中的基本操作和技能。
(2)测定实验:了解一些常数(如气体常数)和化学数据(如解离常数)的测定方法,初步掌握正确操作、记录和处理实验数据的能力。
(3)元素及其化合物的性质实验:通过元素及化合物的性质实验、个别离子和混合离子(三种)的检出实验,掌握常见元素及其化合物酸碱性、溶解性、氧化还原性、水解及配位性等性质,培养正确观察、分析和归纳的能力。
(4)无机化合物的制备及综合、设计性实验;通过无机制备实验,学习无机物的制备、分离和提纯技术和方法,培养学生独立设计实验方案、选择仪器和药品进行实验的初步能力。
六主要参考教材
(1)《无机化学》,黄可龙等主编,科学出版社,2007;
(2)《无机化学》(上、下册,第三版)武汉大学、吉林大学编,高教出版社,1994;(3)《无机化学学习指导》,王一凡、古映莹主编,科学出版社,2009;。
