有机化学之亲核取代反应40页PPT
有机化学中的亲核取代反应

有机化学中的亲核取代反应亲核取代反应是有机化学中一类重要的化学反应,其中亲核试剂攻击一个电子不足的原子中心,将其取代。
本文将介绍亲核取代反应的基本概念、机理和应用。
一、概述亲核取代反应是有机化学反应中最为常见的类型之一。
它涉及到一个亲核试剂与一个电子不足的原子中心反应,亲核试剂中的亲核基团取代掉原子中心上的离去基团。
这种反应过程中,亲核试剂的亲核性质起到了至关重要的作用。
二、机理亲核取代反应的机理可分为两种类型:S_N1和S_N2反应。
在S_N1反应中,亲核试剂首先与原子中心发生解离,形成一个离子中间体。
然后,亲核试剂中的亲核基团攻击中间体,并取代离去基团。
而在S_N2反应中,亲核试剂与原子中心同时反应,亲核基团直接取代离去基团。
三、常见亲核取代反应1. 氢化反应:氢化反应是有机化学领域中最常见的亲核取代反应之一。
在氢化反应中,亲核试剂通常是氢气(H2),它与不饱和化合物发生反应,将双键或三键还原成单键。
2. 烷基化反应:烷基化反应是向有机化合物中引入烷基基团的亲核取代反应。
常用的烷基化试剂包括Grignard试剂和有机锂试剂等。
3. 羧酸衍生物的酯化反应:酯化反应是一种常见的有机合成反应,用来制备酯类化合物。
在这个反应中,烷基或芳基醇与羧酸发生反应,形成酯化物和水。
4. 氧代硫醚合成反应:氧代硫醚合成反应通常用于制备含氧硫醚化合物。
在该反应中,亲核试剂通常是醇类化合物,与硫醇发生反应,生成氧代硫醚化合物。
亲核取代反应在有机化学合成中具有广泛的应用。
它可以用于合成新的化合物、改变化合物的性质,以及构建有机分子的碳-碳或碳-其他原子键。
通过合理选择亲核试剂和适当的反应条件,亲核取代反应可以高效、选择性地进行,是有机合成中不可或缺的重要工具。
总结亲核取代反应是有机化学中常见的化学反应类型。
本文简要介绍了亲核取代反应的概念、机理和常见类型,并强调了其在有机合成中的重要性和应用。
熟悉亲核取代反应有助于我们更好地理解有机化学反应的基本原理,为有机合成的设计和实施提供了理论参考。
第四章 亲核取代反应PPT课件

电荷增加 电荷减少 电荷分散 电荷分散
增加溶剂 极性后速 率变化
速率加快 速率减慢 速率减慢 速率减慢
编辑版pppt
19
常用溶剂的极性可以它们的介电常数来表示. 表2 常用质子性和非质子性溶剂的介电常数ε
质子性溶剂
ε
非质子性溶
ε
剂
水 甲醇 乙醇 1-丙醇 2-丙醇
醋酸 甲酸 氢氟酸 甲酰胺 氢氰酸
绝过大渡部态分的S电N荷1反比应反是应由物中有性所分增子加离。解溶成剂带极电性荷增的加离,子使,过 渡态的能量降低,从而降低反应的活化能,使反应加速。
δ+ δ-
R-L
[R…L]
R++L-
例如叔卤代烷的溶剂解反应随溶剂极性增加而加速。
SN1反应:
(CH3)3C-Br + Sol-OH
(CH3)3C-O-Sol + HBr
15
试剂的亲核性与碱性大小一致的有下列情况:
(1)试剂中亲核原子相同时(如O),其亲核性与碱 性顺序都是:
RO- > HO- > ArO- > RCOO- > ROH > H2O 带负电荷试剂的亲核性比其共轭酸大,碱性也强。
ArO-小于HO- ,是因为芳环与氧共轭,电子平均化 使 负 电 荷 分 散 的 结 果 。 RCOO - 小 于 ArO - 是 因 为 C=O吸电子的缘故。
+
编辑版pppt
9
如果能用个别的路易斯结构式来表示,其碳正
离子的价电子层有六个电子,与三个原子或原
子团键连,如+CH3,R3C+等称为经典碳正离 子。相反地,如果不能用个别的路易斯结构式
来表示,这类碳正离子具有一个或多个碳原子
卤代烃—亲核取代反应(有机化学课件)

卤代烃在有机合成的多种用途
灭火器
制冷剂
管材
薄膜
墙板地板
日用品
目录CONTENT来自01亲核取代反应
02
亲核取代反应实例
01
亲核取代反应
亲核取代反应 1.卤代烷结构分析
导入动画
结论:卤代烃的取代是一个亲核取代的过程。
亲核取代反应 2. 定义 亲核取代反应(SN):
有机化合物分子中的原子或原子团被亲核试剂取代的反应。
2. 被烷氧基取代
卤代烷与醇钠作用,卤原子被烷氧基取代而生成醚类化合物。
+ R X
△ R'ONa
+ ROR'
NaX
Williamson 醚合成法
伯卤代烷 > 仲卤代烷 > 叔卤代烷
亲核取代反应实例
3. 被氰基取代
卤代烷与氰化钠或氰化钾在乙醇溶液中共热回流,卤原子被氰基(—CN)取代,
得到腈。
乙醇
+ RX
亲核取代反应实例
6. 卤化物的互换
氯代烷或溴代烷的丙酮溶液与碘化钠共热,可生成氯化钠和溴化钠沉淀。
丙酮
+ RCl NaI
丙酮
+ RBr NaI
+ RI
NaCl
+ RI
NaBr
卤代烷的 定性鉴定
伯卤代烷>仲卤代烷>叔卤代烷
小结
100% 80% 60% 40% 20%
R-X
NaOH
ROH 醇类
R’ONa ROR’ 醚类
NaCN
+ RCN
NaX
乙醇
+ CH 3CH 2CH 2Cl
NaCN
亲核取代反应讲解

亲核取代反应讲解
亲核取代反应是有机化学常见的一种反应。
在这种反应中,一个亲核试剂汇合一个有机反应物,并且代替了原有的基团。
在这个反应中,亲核试剂成为了新的基团。
这种反应是在有机化学中广泛运用的,非常有用。
它可以用于构建长链分子,连接分子,以及进行化学变换,制造新化合物。
现在,让我们跟着下面的步骤学习一下如何进行亲核取代反应。
1. 首先,你需要准备好亲核试剂。
亲核试剂可以是任何一种有活性的物质,其分子中含有一个亲核中心,例如氨基、羟基、硫代锰酸根、氰根、卤素根等。
在这个过程中,亲核试剂将代替原有的基团。
2. 准备好需要反应的有机化合物。
选定有机化合物,将其与亲核试剂混合,具体反应条件需要根据不同化合物的特性进行调整。
3. 进行反应。
在进行反应时,通常需要一定的触发条件。
例如,需要加热、催化、加压等。
这些条件可以影响反应速率和产率。
4. 产物的分离与纯化。
完成反应后,需要对产物进行分离和纯化。
这可以通过各种方法进行,例如渗透色谱、薄层色谱、皮尔斯等方法。
通过以上步骤,亲核取代反应就完成了。
这个反应可以进行多次,生成不同的产物,依据不同的具体反应条件,可以得到不同的产物类型。
总之,亲核取代反应是有机化学中非常常见的一种反应。
通过学会这个反应,可以制造许多新型材料和化合物。
即使在化学实验室或制造工厂等工作中,软硬件机器人也可以准确地掌握这个技术,帮助实验者进行研究和开发不同的产物。
《亲核取代反应》PPT课件

2021/4/25
7
2. 亲核取代反应机理
2021/4/25
8
2.1 亲核取代反应的几种形式
(1)中性底物 + 中性亲核试剂 (neutral substrate + neutral nucleophile)
RX + Y:
+
RY +
X:-
2021/4/25
9
例如下列反应:
CH3 C6H5 C Cl + CH3CH2OH
2CH
3
2021/4/25
10
2.中性底物 + 负离子亲核体 (neutral substrate + anionic nucleophile)
RX + Y:
RY + X:-
2021/4/25
11
象这类型反应有:
CH3CHCH2CN
NaI acetone
CH3CHCH2CN
Br
I
CH2OTs
LiBr acet one
N3(1)
(-) N3
CH3
C
C6H5
H2/Pt (2)
H
H
CH3 (-) H2N C C6H5
H
SH (3)
(-) HS
CH3
C
C6H5
CH3I (4)3C)2HS C C6H5
H
N3- (+) C6H5
(5)
CH3 C N3 H
1,3,5 为SN2反应,构型翻转了。 1,2两3,,54种,为6途不SN经涉2反得及应到手,的性构产C的型物反翻是应转一,了对无。对构映型体变化 2,4,6 不涉及手性C的反应,无构型变化 两种途经得到的产物是一对对映体
有机化学概论课件第八章 亲核取代反应
NNOO((2211))NNaa 22 CCOO33 ,, HH22 OO ,, 110000℃ ℃
NNOO22
((22))
NNOO22 CCll
HH22 OO,, HH++ ℃ ℃
NNOO22 OOHH
NNOO22
NNOO22
(1) NNaa 22 CCOO33 ,, HH22 OO
Hale Waihona Puke (2)HH22 OO,, HH++
(1)被 -OH 取代
SO3Na
ONa
OH
NaOH( l )
~ 300 ℃
H2 O,H+
注:共熔、芳环上无-NO2,-X
(2)CN-,NH3,RNH2。
SO3Na
OCNa
NaCN
~ 300 ℃
O
O
SO3K
NH3
NH2
heat, pressure
O
O
(2) 势能图 P254 (3) 特征:v , 构型(外消旋化),重排。
C C C CC
C Br
+ OH
CC C C CC
OH
2.3 分子内亲核取代反应 邻基效应
CH3CH2
Cl
OHH2O , Δ
CH3CH2
OH
R-X
R`ONa
R-O-R`
ROH
CH2 OH
CH2 Cl
O H- ,H2O, Δ
或Ca(OH)2, Δ
C2 H5 S
C2 H5 S
CH2 CH2 -H + + OH2
CH2 CH2 OH
Br
CH3 -OH
CC
CH3 H
亲核取代反应课件

亲核取代反应通常涉及碳-卤素键的断裂和碳-碳键的形成,反应过程中通常伴 随着电子重排。
反应机理
第一步
亲核试剂(Nu)进攻卤代烃的碳原子,形成一个 中间体(碳正离子)。
第二步
碳正离子与亲核试剂发生反应,生成取代产物和 卤素离子。
第三步
产物从溶剂中释放出来。
反应类型
单分子亲核取代反应(SN1)
01
共轭效应
在共轭体系中,由于π电子的离域作用,使得电子云分布更加均匀,从而影响反 应活性。在亲核取代反应中,共轭效应通常通过影响反应中间体的稳定性来影响 反应速率。
空间效应
分子间的相互作用
分子间的相互作用如氢键、π-π相互作用等可以影响反应活 性。例如,在某些亲核取代反应中,分子间的氢键可以增强 反应中间体的稳定性,从而提高反应速率。
细胞信号转导
在细胞信号转导过程中, 有些信号分子通过亲核取 代反应来发挥作用。
代谢过程
生物体内许多代谢过程涉 及到亲核取代反应,如糖 代谢、脂肪酸代谢等。
Байду номын сангаас
在药物合成中的应用
药物合成中的取代反应
在药物合成中,许多步骤涉及到亲核 取代反应,如氨基的保护与脱保护、 醇的氧化等。
药物分子的修饰
通过亲核取代反应可以实现对药物分 子的修饰,以提高药物的疗效和降低 副作用。
过程。
06
亲核取代反应的发展趋势与展望
新反应类型的发现与开发
新的亲核取代反应
随着科学技术的不断发展,研究者们发现了许多新的亲核取代反应类型,如碳-氢键的亲核取代、光诱导的亲核 取代等。这些新反应类型的发现为有机合成提供了更多的可能性。
反应机理研究
为了更好地控制和利用亲核取代反应,研究者们深入研究了这些反应的机理。通过了解反应机理,可以预测反应 条件下的产物,优化反应条件,提高反应效率。
卤代烃—亲核取代反应机理(有机化学课件)

υ=k [(CH3)3CBr]
导入动画
磺化反应 2. SN1历程的特点
反应分两步进行 在反应中有活性中间体—碳正离子生成,有可能发生重排反应 为1级反应ν=k[R-X]
磺化反应 练一练
写出2,2-二甲基-3-溴丁烷的水解历程
03
双分子亲核取代 反应(SN2)
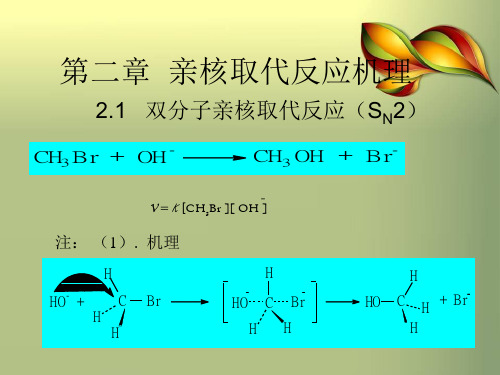
双分子亲核取代反应(SN2) 1. 溴甲烷的水解历程
CH3Br + OH-
CH3OH
= k[CH3Br][OH-]
υ=k [CH3Br][OH-]
+ Br-
双分子亲核取代反应(SN2)
1. 溴甲烷的水解历程
C—O 键部
分形成
过渡态
Cr HO
亲核试剂从远离Br 的一边进攻底物
Br fastHO
中心碳构型转化
双分子亲核取代反应(SN2) 2. SN2历程的特点
反应一步完成,属于协同反应 v=k[CH3X][OH-],为二级反应 构型转化(Valden inversion)
小结
100% 80 % 60 % 40 % 20 %
卤代烃亲核 取代机理
导入
卤代烃不仅在有机合成中有广泛的应 用,而且在有机化学理论研究方面也 占有重要的地位。
01
亲核取代反应
目录
CONTENT
02
单分子亲核取 代反应( SN1 )
03
双分子亲核取 代反应(SN2)
01
亲核取代反应
亲核取代反应
02
单分子亲核取 代反应(SN1)
单分子亲核取代反应(SN1) 1. 叔丁基溴的水解历程
最新【理学】亲核取代反应模版课件幻灯片课件

O C6H13
对甲苯磺酸-2-辛酯
Ingold和 Hughes等进一步明确指出,SN2反应中亲核试剂是从离 去基的背后进攻,底物构型是反转的。
为什么是从离去基的背后进攻?根据分子规道理论的解释,亲 核试剂是电子给体,在亲核进攻时要把电子给予底物中与离去 基团相连的碳原子,而C-X键的成键轨道已用于与X成键,已有 一对电子,亲核试剂的电子无法进入成键轨道,因此只能去进 攻在空间上处于离去基反面那一瓣的σ反键轨道,随着Nu的进 入和离去基的逐渐离去,中心碳原子上的另外三个键逐渐反转, 到能量最高的过渡态,Nu、 中心碳原子C和离去基X在一条直线 上,随后就是构型反转:
OB CH2 CD3 -BH O2S
CH3 SO2
O CH O2 O CHCD3
O2S
CD3
CD3
CD3
把甲基用D同位素标记,并且把等量的标记和未标记的反应物
放在一起反应,得到4种异构体的等量混合物(都是25%),由于
后两种是只有分子间反应才能得到的,所以推测这些产物都是
SN1 + SN2混合机理
在亲核取代反应中,含伯烷基的化合物一般为SN2机理,含叔烷 基的化合物一般为SNl机理,仲烷基化合物的反应机理还难以有 比较明确的说法。 一种观点认为SN2和SN1是两种极限情况,它们之间的区域是离 子对机理,但另一种意见认为没有中间区域,取代反应可能是 一部分为SN2机理,另一部分为SN1机理。
碳正离子的存在。
A cO
A cO
H
hv
A cO
2CO A cM eC N -H 2OA cO
C H
2
碳正离子为平面结构或近于平面结构。桥头碳原子不能形成平 面结构,因此,桥头上的SN1反应不能或极难进行。 1-氯莰烷 (1-chlorocamphane)在80%乙醇溶液中与30%KOH一起回流21h 也不能起反应。
《有机化学反应类型》亲核取代机制

《有机化学反应类型》亲核取代机制有机化学反应类型——亲核取代机制在有机化学的广袤领域中,亲核取代反应是一类极其重要的反应类型。
它就像是有机化学反应这个大舞台上的一位常客,频繁地登场,演绎着分子结构的变化与转化。
亲核取代反应,简单来说,就是一个亲核试剂取代了一个原子或基团的过程。
为了更好地理解这一反应,我们先来明确几个关键的概念。
亲核试剂,顾名思义,是具有亲核性的试剂。
它通常是一些带有孤对电子的分子或负离子,比如氢氧根离子(OH⁻)、氨(NH₃)、氰离子(CN⁻)等。
这些亲核试剂“虎视眈眈”地盯着有机分子中的某个位置,准备发动“进攻”。
而被取代的原子或基团呢,通常被称为离去基团。
常见的离去基团有卤素(如氯、溴、碘)、磺酸酯基等。
它们在反应中“功成身退”,为亲核试剂腾出位置。
亲核取代反应可以分为两种主要的机制:单分子亲核取代(SN1)和双分子亲核取代(SN2)。
先来说说 SN1 反应。
在 SN1 反应中,反应的第一步是离去基团自行离去,形成一个碳正离子中间体。
这个碳正离子就像是反应中的“关键人物”,它的稳定性决定了整个反应的速率。
一般来说,碳正离子越稳定,反应就越容易进行。
比如,三级碳正离子比二级碳正离子稳定,二级碳正离子又比一级碳正离子稳定。
当碳正离子形成后,亲核试剂迅速与之结合,完成反应。
由于第一步是反应的决速步,只涉及到一个分子的变化,所以被称为单分子亲核取代反应。
SN1 反应的速率通常只取决于形成碳正离子这一步的速率,与亲核试剂的浓度无关。
这就好比是一场接力赛,第一棒跑得快慢决定了整个比赛的结果,而第二棒的速度再快,也无法改变第一棒的成绩。
再来看 SN2 反应。
在 SN2 反应中,亲核试剂从离去基团的背面“悄悄接近”,然后与碳原子形成一个过渡态,同时离去基团“黯然离去”。
整个过程就像是一场“协同作战”,亲核试剂和离去基团的“进出”是同时进行的。
SN2 反应的速率与亲核试剂的浓度以及底物的浓度都有关系,因为亲核试剂和底物都参与了反应的决速步。
最新第四章亲核取代反应概要1教学讲义ppt课件

H
(I)
(II)
碳正离子(I)比(II)稳定(p-π共轭效应),较纯粹的SN1反应。
二.双分子亲核取代反应历程(SN2)
1.有关实验和事实 ①动力学测定:
-
C H3 Br+O H
C H3 O H+Br-
v=k[CH3Br][OH-] 由此称为双分子反应
②立体化学变化测定:构型翻转(瓦尔登Walden转化)
CH3COOH 保持构型
在双环烯烃(V),(VI)和(VII)中较低 级(碳数少)同系物的五元环比较高级同系 物的五员环折叠程度更大,π键与展开的正 电荷间的距离缩短,有利于背面参与作用。
X
X
X
( V) k相对: 1
( VI ) 5×102
( VII ) 2.5×106
3.苯基参与
于是有后面的离子对机理的提出。
H
H
Ph C BrCH3OHCH3OCPh+ 73%消 旋 化 产 物
CH3
HBr
CH3
27% 构 型 转 化
三. 离子对-溶剂化历程
洛杉矶加利福尼亚大学的S.Weinstein离子对机理:
反应底物在溶剂作用下断键形成正、负离子,但静电 吸引使它们形成紧密离子对,以SN2为主;
的正电荷得到分散。故体系能量降低,碳正离子较为稳 定,因而C-X键容易断裂。
H2C CH CH2
烯
丙
基 型
+
正
离
子
CH2
苄
基
+
H
型 正
CH
离 子
SN2反应过渡态中的p-π共轭
Nu -
N u δ-
H HC C H
亲核取代PPT课件

(C-Br)也没有完全断裂,即在反应过程中,旧键的断裂和新键
的形成是同时进行的,其过渡态只是转变过程中的活化状
态,不是中间体,故反应是一步完成的。
SN2的能量曲线:
HH
HO
Br 过 渡 态
H
E
CH 3 Br + OH
CH 3 OH + Br 反应进展
H OR
R
在质子型溶剂中:亲核 试剂与溶剂形成氢键, 由此降低了试剂的亲核 性,不利于反应进行。
在质子型溶剂中:试剂的亲核性强度顺序为:
SH- > CN- > I- > OH- >N3- > Br- > CH3CO2- > Cl > F- > H2O
SN 2反应常在极性非质子型溶剂中进行。
极性非质子型溶剂 (Polar Aprotic Solvents)不 能与 Nu:形成氢键,不能使亲核试剂溶剂化,使裸 露的负离子作为亲核试剂,具有较高的反应活性。
当取代基具有+I、
超共轭效应、+C效 应,SN 1反应速率增 大, 反应活性增大。
~10 10
当中心碳原子与杂原子直接相连时(R-ZCH2-L), SN 1反应速率明显增大:
C2H5OCH2Cl SN 1反应 109
速率
C-C-C-C-Cl 1.0
C2H5O-CH2CH2Cl 0.2
当杂原子与中心碳原子相连时,所形成的 正碳离子,因共轭效应而被稳定。
A. 当进攻原子为同一原子时,亲核性强度与碱性一致:
RO- > HO- >> RCO2- > ROH > H2O CH3O- > PhO- > CH3CO2- > NO2-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SN2 反应的影响因素
3) Nucleophile (亲核试剂 )
The nucleophile can be neutral or negatively charged as long as it has an unshared pair of electrons. So it is also a Lewis base(路易斯碱).
CH3Br + HO-
CH3O H+ Br-
progress of the reaction
SN2 反应的影响因素
1) Substrate(底物) —— Steric Effects
SN2 反应的影响因素
1) Substrate(底物) —— Steric Effects
H
C H
H
Br
H3C
C H
steriochemistry two stereoisomers
R-OH + HX
80% EtOH + HOreaction order k /10-5mol-1 L s-1
----
2nd-order
4.75 170
2140
inversion of configuration
预示两种不同的机理
两种不同的亲核取代反应机理 — SN1 和 SN2
H
Br
H3C
H3C C H
Br
H3C
H3C C H3C
Br
SN2反应活性: methyl > 10 > 20 > 30
SN2 反应的影响因素
2) The leaving Group(离去基团)
离去基团的离去倾向越大,SN2 反应活性越高。 离去基团的碱性越弱,则离去倾向越大。 Relative reactive(反应活性):
Basicity (碱性)—— how well the base shares electrons with a proton.
Nucleophilicity ( 亲 核 性 ) —— how readily the nucleophile is able to attack an atom (e. g. carbon) other than a proton.
原因:质子性溶剂使亲核 试剂阴离子溶剂化,即发 生离子-偶极相互作用, 亲核性降低。碱性越强, 亲核性降低越大。
In protic solvents, the weaker the basicity of nucleophile, the stronger the nucleophilicity.
一步反应,动力学表现为二级反应 亲核试剂是从离去基团的背面进攻
—— 因此发生构型的转化
SN2 反应的机理
SN2反应中过渡态结构:
sp2杂化
新键已部分形成
旧键已部分断裂
反应势能变化图如右: 凡能影响过渡态稳定性
的因素都将影响反应的 活性和选择性
Free energy
HH
#
HO Br
CH3
Ea
Nu - CH3 + B-r
OH- CH3O-
I-
CN- HS-
1 500 Less reactive
700 1,000 16,000 25,000 100,000 125 More reactive
SN2 反应的影响因素
3) Nucleophile (亲核试剂 ) 关于亲核试剂的亲核性强弱顺序尚无完善的 解释,不过一般有如下的规律:
双分子亲核取代反应(SN2)
-
N u+ CX
+
CNu +X -
单分子亲核取代反应(SN1)
-
CX
+
C+ + X-
C+ + Nu
C Nu
SN1 和 SN2 反应的影响因素
N u+ CX
CNu +X -
底物 RX(以卤代烃和磺酸酯为代表) 离去基团 X 亲核试剂 :Nu or :Nu 溶剂
SN2 反应的机理
——在质子性溶剂中, 同一族元素的原子 随周期数的增加亲 核性增加 (碱性降 低)。
原因:原子可极化性
和溶剂化效应
——在非质子溶剂中 顺序刚好相反
原子半径越大,可极化性越大,易成键。
SN2 反应的影响因素
4) The Solvent (溶剂)
Protic solvents (质子性溶剂) — 含有 -OH 或 -NH — 不利于SN2 反应
SN2 反应的影响因素
4) The Solvent (溶剂)
Aprotic polar solvents(非质子极性溶剂) — 极性很强,但不含有-OH 或 -NH
acetonitrile(CH3CN), dimethylformamide[HCON(CH3)2, DMF] dimethyl sulfoxide [(CH3)2SO, DMSO], hexamethylphosphoramide {[(CH3)2N]3PO, HMPA}
本章重点内容
1、 Mechanism 、 Stereochemistry SN1 和 SN2 反应的机理、影响 因素和立体化学 2\ Factors Affecting the Rate of SN1 Reactions and SN2 reactions
2、SN1 与 SN2 反应的竞争问题
3、SN1 和 SN2 反应在合成上的应用 (1)官能团的相互转化;(2)C - C 键的形成
SN2 反应的影响因素
3) Nucleophile (亲核试剂 )
亲核试剂的亲核性越强,反应活性越高。 亲核性强弱常受到底物、溶剂甚至是浓度的影响。 因此,比较亲核试剂的强弱应该确定一个标准,最
好在相同的底物和相同的反应条件下比较:
Nu =
Байду номын сангаасrelative reactivity
Nu- + CH3 - Br 2HO CH3CO2- NH3 Cl-
亲核取代反应
Nucleophilic Substitution Reaction
实验事实
R-X + H2O
kinetic
80% EtOH reaction order k /10-5s-1
(CH3)3C-X
(CH3)2CH-X CH3CH2-X CH3-X
1st-order
1010 0.24 0.14 0.35
——亲核性强弱顺序与碱性基本相同 ——同一周期元素原子随原子序数增加亲核性减弱
-CH3 > -NH2 > HO- > F-; ——带负电荷基团的亲核性强于中性基团
HO- > H2O; CH3O- > CH3OH; -NH2 > NH3;
SN2 反应的影响因素
3) Nucleophile (亲核试剂 )
