15药典中培养基
霉菌与酵母菌计数方法(2015版药典)

霉菌与酵母菌计数方法1试验菌液得制备与使用(以白色念珠菌为示例)白色念珠菌(0)代↓传代培养↓实验菌液得制备:沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养基,培养温度20~25℃,培养时间2~3天↓计数培养基适用性检查:胰酪大豆胨琼脂培养基,培养温度30~35℃,培养时间不超过5天,接种量不大于100cfu↓计数方法适用性试验:胰酪大豆胨琼脂培养基(MPN法不适用),培养温度30~35℃,培养时间不超过5天,接种量不大于100cfu 注:当需用玫瑰红钠琼脂培养基测定霉菌与酵母菌总数时,应进行培养基适用性检查,检查方法同沙氏葡萄糖琼脂培养基1.1菌种试验用菌株得传代次数不得超过5代(从菌种保藏中心获得得干燥菌种为第0代),并采用适宜得菌种保藏技术进行保存,以保证试验菌株得生物学特性。
1。
2菌液制备(按表1规定程序培养各试验菌株)取白色念珠菌得新鲜培养物↓用pH7、0无菌氯化钠—蛋白胨缓冲液或0、9%无菌氯化钠溶液制成适宜浓度得菌悬液取黑曲霉得新鲜培养物↓加入3~5ml含0.05%聚山梨酯80得pH7.0无菌氯化钠—蛋白胨缓冲液或0、9%无菌氯化钠溶液,将孢子洗脱↓采用适宜得方法吸出孢子悬液至无菌试管内↓用含0。
05%聚山梨酯80得pH7.0无菌氯化钠—蛋白胨缓冲液或0。
9%无菌氯化钠溶液制成适宜浓度得黑曲霉孢子悬液菌液制备后若在室温下放置,应在2小时内使用;若保存在2~8℃,可在24小时内使用、稳定得黑曲霉孢子悬液可保存在2~8℃,在验证过得贮存期内使用、1。
3阴性对照为确认试验条件就是否符合要求,应进行阴性对照试验,阴性对照试验应无菌生长。
如阴性对照有菌生长,应进行偏差调查、2、培养基适用性检查按表1规定,接种不大于100cfu得菌液至沙氏葡萄糖琼脂培养基平板↓置表1规定条件下培养↓每一试验菌株平行制备2管或2个平皿↓同时,用相应得对照培养基替代被检培养基进行上述试验↓被检固体培养基上得菌落平均数与对照培养基上得菌落平均数得比值应在0。
2015版中国药典微生物检查方法及培养基变更参照

2015版中国药典微生物检查方法及培养基变更参照1.无菌检查法1.1变更内容1.1.1无菌检查方面,使用胰酪胨大豆肉汤(胰酪胨大豆液体培养基/大豆酪蛋白肉汤培养基)取代改良马丁培养基与硫乙醇酸盐流体培养基配合进行细菌和真菌的全面微生物检测。
1.1.2菌液制备环节,使用胰酪胨大豆肉汤、胰酪胨大豆琼脂取代营养肉汤、营养琼脂进行金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌和大肠埃希氏菌的菌液制备。
1.1.3菌液制备环节,使用沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基取代改良马丁培养基、改良马丁琼脂进行白色念珠菌和黑曲霉菌液的制备,同时对沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂的配方进行了变更。
1.1.4适用性试验中,胰酪胨大豆肉汤使用枯草芽孢杆菌、白色念珠菌和黑曲霉进行灵敏度检查;硫乙醇酸盐流体培养基使用金黄色葡萄球菌、大肠埃希氏菌、生孢梭菌、铜绿假单胞菌进行灵敏度检查。
1.2培养基信息2010版2015版无菌检查/菌液制备——硫乙醇酸盐流体培养基无菌检查/菌液制备——改良马丁培养基菌液制备——改良马丁琼脂培养基菌液制备——营养肉汤菌液制备——营养琼脂无菌检查——0.5%葡萄糖肉汤培养基供试品制备——0.1%蛋白胨水培养基无菌检查/菌液制备——硫乙醇酸盐流体培养基无菌检查/菌液制备——胰酪胨大豆肉汤菌液制备——胰酪胨大豆琼脂菌液制备——沙氏葡萄糖琼脂菌液制备——沙氏葡萄糖肉汤无菌检查——0.5%葡萄糖肉汤培养基供试品制备——0.1%蛋白胨水培养基供试品制备——pH7.0氯化钠—蛋白胨缓冲液1.3参考文件(国家药典委员会—中国药典2015版附录征求意见稿—1101无菌检查法)http://w w /cms/new scenter/new s/000603.html2.非无菌产品微生物限度检查2.1变更内容2.1.1供试品制备环节,除了pH7.0氯化钠—蛋白胨缓冲液、pH6.8磷酸盐缓冲液、pH7.6磷酸盐缓冲液外,添加了pH7.2磷酸盐缓冲液和胰酪胨大豆肉汤。
抑菌效力检查法-2015中国药典

抑菌效力检查法-2015中国药典录入时间:2014-9-16 9:44:02 来源:国家药典委员会抑菌剂是指抑制微生物生长的化学物质,有时也称防腐剂。
抑菌效力检查法系用于测定灭菌及非灭菌制剂的抑菌活性,以评价最终产品的抑菌效力,同时也可用于指导生产企业在研发阶段制剂中抑菌剂浓度的确定。
如果药物本身不具有充分的抗菌效力,那么应根据制剂特性(如水溶性制剂)添加适宜的抑菌剂,以防止制剂在正常贮藏或使用过程中可能发生的微生物污染和繁殖使药物变质而对使用者造成危害,尤其是多剂量包装的制剂。
在药品生产过程中,抑菌剂不能用于替代药品生产的GMP 管理,不能作为非无菌制剂降低微生物污染的唯一途径,也不能作为控制多剂量包装制剂灭菌前的生物负载的手段。
所有抑菌剂都具有一定的毒性,制剂中抑菌剂的量应为最低有效量。
同时,为保证用药安全,成品制剂中的抑菌剂有效浓度应低于对人体有害的浓度。
抑菌剂的抗菌效力在贮存过程中有可能因药物的成分或包装容器等因素影响而变化,因此,应验证成品制剂中的抑菌剂效力在效期内不因贮藏条件而降低.本试验方法和抑菌剂抑菌效力判断标准用于包装未启开的成品制剂培养基培养基的制备胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基?? 照无菌检查法(通则1101)制备。
培养基的适用性检查抑菌效力测定用培养基应进行培养基的适用性检查,包括成品培养基、由脱水培养基或按处方配制的培养基均应检查。
菌种试验所用的菌株传代次数不得超过5 代(从菌种保藏中心获得的冷冻干燥菌种为第0代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
培养基适用性检查的菌种及新鲜菌体培养见表1。
菌液制备取表1 大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的新鲜培养物用pH7.0 无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液。
取表2 黑曲霉的新鲜培养物加入3~5ml 含0.05%(ml/ml)聚山梨酯80 的pH7.0 无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,将孢子洗脱。
药典三部(2015版)-通则-3301支原体检查法

3301 支原体检查法主细胞库、工作细胞库、病毒种子批、对照细胞以及临床治疗用细胞进行支原体检查时,应同时进行培养法和指示细胞培养法(DNA染色法)。
病毒类疫苗的病毒收获液、原液采用培养法检查支原体,必要时,亦可采用指示细胞培养法筛选培养基。
也可采用经国家药品检定机构认可的其他方法。
第一法培养法推荐培养基及其处方⑴支原体液体培养基支原体肉汤培养基猪胃消化液500ml 氯化钠 2.5g牛肉浸液(1︰2)500ml 葡萄糖 5.0g酵母浸粉 5.0g 酚红0.02gpH值7.6±0.2。
于121℃灭菌15分钟精氨酸支原体肉汤培养基猪胃消化液500ml 葡萄糖 1.0g牛肉浸液(1︰2)500ml L-精氨酸 2.0g酵母浸粉 5.0g 酚红0.02g氯化钠 2.5gpH值7.1±0.2。
于121℃灭菌15分钟⑵支原体半流体培养基按⑴项处方配制,培养基中不加酚红,加入琼脂2.5~3.0g。
⑶支原体琼脂培养基按⑴项处方配制,培养基中不加酚红,加入琼脂13.0~15.0g。
除上述推荐培养基外,亦可使用可支持支原体生长的其他培养基,但灵敏度必须符合要求。
培养基灵敏度检查(变色单位试验法)⑴菌种肺炎支原体(ATCC 15531株)、口腔支原体(ATCC 23714株),由国家药品检定机构分发。
⑵操作将菌种接于适宜的支原体培养基中,经36℃±1℃培养至培养基变色,盲传两代后,将培养物接种至待检培养基中,做10倍系列稀释,肺炎支原体稀释至10-7~10-9,接种在支原体肉汤培养基内;口腔支原体稀释至10-3~10-5,接种在精氨酸支原体肉汤培养基内。
每个稀释度接种3支试管,置36℃±1℃培养7~14天,观察培养基变色结果。
⑶结果判定以接种后培养基管数的2/3以上呈现变色的最高稀释度为该培养基的灵敏度。
液体培养基的灵敏度:肺炎支原体(ATCC 15531株)应达到10-8,口腔支原体(ATCC 23714株)应达到10-4。
2015年版中国药典 通则1105 非无菌产品微生物限度检査:微生物计数法

养 温 度 3 0 〜 3 5 C , 3 5 X :, 培 养 时 间 不 超 过
培 养 时 间 1 8 〜 24 3 天 , 接 种 量 不 大 于
小时
100c£u
计数方法适用性试验
需氧菌总数计数
霉菌和酵母菌 总数计数
胰酪大豆胨琼脂培养 基或胰酪大豆胨液体培 养 基 (M P N 法 ), 培 养 温 度 30〜 35°C, 培 养 时 间 不 超 过 3 天 ,接 种 量 不 大 于 lOOcfu
苗种及苗液制备 苗 种 试 验 用 菌 株 的 传 代 次 数 不 得 超 过 5 代 (从 菌 种 保 藏中心获得的干 燥 菌 种 为 第 0 代 ),并 采 用 适 宜 的 菌 种 保 藏 技 术进行保存,以 保 证 试 验 菌 株 的 生 物 学 特 性 。计 数 培 养 基 适用性检查和计数方法适用性试验用菌株见表1。 菌液 制 备 按 表 1 规 定 程 序 培 养 各 试 验 菌 株 。取 金 黄 色 葡萄球菌、铜 绿 假 单 胞 菌 、枯 草 芽 孢 杆 菌 、 白色 念珠菌 的新 鲜培养物,用 P H 7 .0 无 菌 氣 化 钠 -蛋 白 胨 缓 冲 液 或 0 .9 % 无菌 氣化 钠 溶 液 制 成 适 宜 浓 度 的 菌 悬 液 ;取 黑 曲 霉 的 新 鲜 培 养 物 加 人 3〜5 m l含 0. 05% ( m l/m l) 聚 山 梨 酯 8 0 的 p H 7_0无 菌 氯 化 钠 -蛋 白胨 缓 冲 液 或 0 .9 % 无 菌 氣 化 钠 溶 液 ,将 孢 子 洗 脱 。 然后,采 用 适 宜 的 方 法 吸 出 孢 子 悬 液 至 无 菌 试 管 内 ,用 含 0. 05%(m l/m l)聚 山 梨 酯 8 0 的 pH7. 0 无菌氣化钠-蛋白胨缓冲 液 或 0. 9%无 菌 氣 化 钠 溶 液 制 成 适 宜 浓 度 的 黑 曲 霉 孢 子 悬 液 。 菌 液 制 备 后 若 在 室 温 下 放 置 ,应 在 2 小 时 内 使 用 ;若保 存 在 2〜8 * C ,可 在 2 4 小 时 内 使 用 。黑 曲 霉 孢 子 悬 液 可 保 存 在 2〜8 ° C , 在 验 证 过 的 贮 存 期 内 使 用 。 阴性对照 为 确 认 试 验 条 件 是 否 符 合 要 求 ,应 进 行 阴 性 对 照 试 验 , 阴 性对照 试 验应 无菌 生 长。如 阴 性 对 照 有 菌 生 长 ,应进 行偏 差调查。 培养基适用性检査 微生物计数用的成品培养基、由脱水培养基或按处方配 制的培养基均应进行培养基适用性检查。 按 表 1 规 定 ,接 种 不 大 于 lOO cfu的 菌 液 至 胰 酪 大 豆 胨 液体培养基管或胰酪大豆胨琼脂培养基平板或沙氏葡萄糖琼
2015版中国药典微生物限度

性试验:菌种及菌液制备、培养基适用性检查 、计数方法适用性试验。 1.4 供试品检查:检验量、供试品检查 1.5 结果判断 1.6 稀释液、冲洗液及培养基
1.1 总则:
• 微生物计数法系用于能在有氧条件下生长的嗜温 细菌和真菌的计数。
• 当本法用于检查非无菌制剂及其原、辅料等是否 符合规定的微生物限度标准时,应按规定进行检 验,包括样品的取样量和结果的判断等。除另有 规定外,本法不适用于活菌制剂的检查。
30~35 ℃ 不超过3天
20~25 ℃ 不超过5天
每一试验菌株平行制备2 管或2 个平皿;接种量50~100cfu ; 同时,用相应的对照培养基替代被检培养基进行上述试验。 结果判定:
若被检培养基上的菌落平均数不小于对照培养基上的菌落 平均数的70 %,且菌落形态大小与对照培养基上的菌 落一致,判该培养基的适用性检查符合规定。
3. MPN 法
– 取规定量供试品,按方法适用性试验确认的 方法进行供试液制备和供试品接种,所有试 验管在30~35℃培养3~5 天,如果需要确 认是否有微生物生长,按方法适应性试验确 定的方法进行。记录每一稀释级微生物生长 的管数,从表3查对每1g 或1ml 供试品中需 氧菌总数的最可能数。
1.5结果判断
菌数报告规则
– 需氧菌总数测定宜选取平均菌落数小于 300cfu 的稀释级、霉菌和酵母菌总数测定宜 选取平均菌落数小于100cfu 的稀释级,作为 菌数报告(取两位有效数字)的依据。取最 高的平均菌落数,计算1g、1ml 或10 cm² 供 试品中所含的微生物数。
– 如各稀释级的平皿均无菌落生长,或仅最低 稀释级的平板有菌落生长,但平均菌落数小 于1 时,以﹤1 乘以最低稀释倍数的值报告菌 数。
2015版中国药典培养基变更参照pdf

2015 版中国药典微生物检查方法及培养基变更参照无菌检查法1.1 变更内容1.1.1 无菌检查方面,使用胰酪胨大豆肉汤(胰酪胨大豆液体培养基/大豆酪蛋白肉汤培养基)取代改良马丁培养基与硫乙醇酸盐流体培养基配合进行细菌和真菌的全面微生物检测。
1.1.2菌液制备环节,使用胰酪胨大豆肉汤、胰酪胨大豆琼脂取代营养肉汤、营养琼脂进行金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌和大肠埃希氏菌的菌液制备。
1.1.3菌液制备环节,使用沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基取代改良马丁培养基、改良马丁琼脂进行白色念珠菌和黑曲霉菌液的制备,同时对沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂的配方进行了变更。
1.1.4适用性试验中,胰酪胨大豆肉汤使用枯草芽孢杆菌、白色念珠菌和黑曲霉进行灵敏度检查;硫乙醇酸盐流体培养基使用金黄色葡萄球菌、大肠埃希氏菌、生孢梭菌、铜绿假单胞菌进行灵敏度检查。
1.2 培养基信息2. 非无菌产品微生物限度检查2.1 变更内容2.1.1供试品制备环节,除了pH7.0氯化钠—蛋白胨缓冲液、pH6.8磷酸盐缓冲液、pH7.6磷酸盐缓冲液外,添加了pH7.2磷酸盐缓冲液和胰酪胨大豆肉汤。
2.1.2菌液制备环节,使用胰酪胨大豆肉汤、胰酪胨大豆琼脂取代营养肉汤、营养琼脂进行金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、乙型副伤寒沙门氏菌和大肠埃希氏菌的菌液制备;使用沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂培养基取代改良马丁培养基、改良马丁琼脂进行白色念珠菌和黑曲霉菌液的制备,同时对沙氏葡萄糖液体培养基、沙氏葡萄糖琼脂的配方进行了变更;使用梭菌增菌培养基取代硫乙醇酸盐流体培养基进行生孢梭菌菌液的制备。
2.1.3微生物计数环节,使用胰酪胨大豆琼脂取代营养琼脂进行需氧菌计数;增加需氧菌的MPN 法计数,该方法使用胰酪胨大豆肉汤;使用沙氏葡萄糖琼脂取代玫瑰红钠琼脂进行霉菌和酵母菌总数测定,同时增加玫瑰红钠琼脂、沙氏葡萄糖琼脂(含抗生素)两种选择性培养基于对因沙氏葡萄糖琼脂上生长的细菌使霉菌和酵母菌的计数结果不符合微生物限度要求情况下的霉菌和酵母菌计数;取消了使用酵母浸出粉胨葡萄糖琼脂培养基(YPD)对酵母菌进行计数的试验环节。
2015年版药典微生物修订内容

科
增订了原敷料、中药提取物及饮片的微生物限
度标准。
兴
修订内容
依
1 、菌数计数结果以10n表示;
科
2、 以需氧菌总数取代细菌数。以耐胆盐革 兰
阴性菌取代大肠菌群。
依科制药
分类及其标准
1、制剂通则、品种项下要求无菌的制剂及标示无菌
新 依
的制剂和原辅料应符合无菌检查法规定 2、 用于手术、烧伤或严重创伤的局部给药制剂 应符合无菌检查法规定
新
依
科
2015版药典微生物修订内容
兴
依 科
一综合车间(二车间)
2015.10
依科制药
微生物计数法主要内容
新 2010版
依
科
细菌数—
兴 营养琼脂培养基
依
科
霉菌和酵母菌数 — 玫瑰红钠琼脂培养基
2015版
1、 细菌数修订为 需氧菌总数。 2、 霉菌和酵母菌数修订为 霉菌和酵母菌总数。 3、 需氧菌总数: 是指胰酪大豆胨琼脂培养基 上生长的 总菌落数(包括真菌菌落 数) 。 4、 霉菌和酵母菌总数: 是指沙氏葡萄糖琼脂培养基上 生长的总菌落数(包括细菌菌落数) 。 若为因 沙 氏葡萄糖琼脂培养基上生长的细菌使霉菌和酵母 菌的计数结果不符合微生物限度要求,可使用含 有抗生素的(如氯霉素、庆大霉素)的沙氏葡萄 琼脂培养基或其它选择性培养基(如玫瑰红钠琼 脂培养基)进行霉菌和酵母菌总数测定。
依
霉菌及酵母菌总数 沙氏葡萄糖琼脂( SDA)
科
依科制药
新 修订后
依
耐胆盐的革兰氏阴性菌、大肠埃希菌、沙门菌、
科
铜绿假单胞菌、金黄色葡萄球菌、梭菌、白色
念珠菌
兴
修订前
2015版中国药典微生物限度

1.4.2供试品检查
• 供试液制备
– ⑶油脂类供试品
• 取供试品,加入无菌十四烷酸异丙酯使溶 解,或与最少量并能使供试品乳化的无菌 聚山梨酯 80或其他无抑菌性的无菌表面 活性剂充分混匀。表面活性剂的温度一般 不超过 40℃(特殊情况下,最多不超过 45℃),小心混合,若需要可在水浴中进 行,然后加入预热的稀释液使成 1∶10供 试液,保温,混合,并在最短时间内形成 乳状液。必要时,用稀释液或含上述表面 活性剂的稀释液进一步 10倍系列稀释。
– 培养和计数 培养条件和计数方法同平皿计数 法,每张滤膜上的菌落数应不超过100cfu。
• 菌数报告规则
– 以相当于 1g、1ml 或10cm2 供试品的菌落数 报告菌数;若滤膜上无菌落生长,以﹤1 报 告菌数(每张滤膜过滤1g、1ml 或10cm2 供 试品),或﹤1 乘以最低稀释倍数的值报告菌 数。
1.4.2供试品检查
• 供试液制备
– ⑷需用特殊方法制备供试液的供试品
• 膜剂供试品 • 肠溶及结肠溶制剂供试品 • 气雾剂、喷雾剂供试品 • 贴膏剂供试品
1.4.2供试品检查
1. 平皿法
– 平皿法包括倾注法和涂布法。 – 除另有规定外,取规定量供试品,按方法适用性
试验确认的方法进行供试液制备和菌数测定,每 稀释级每种培养基至少制备2个平皿。 – 培养和计数 除另有规定外,胰酪大豆胨琼脂培养 基平板在30~35℃培养3~5天,沙氏葡萄糖琼脂 培养基平板在20~25℃培养5 ~7天, 观察菌落 生长情况,点计平板上生长的所有菌落数,必要时 可适当延长培养时间至7 天进行菌落计数并报告 。菌落蔓延生长成片的平皿不宜计数。点计菌落 数后,计算各稀释级供试液的平均菌落数,按菌 数报告规则报告菌数。 – 若同稀释级两个平皿的菌落数平均值不小于15, 则两个平皿的菌落数不能相差1 倍或以上。
_中国药典_2015年版沙门菌检查用培养基的质量探讨_钱文静

Drug Standards of China 2014,Vol. 15 No. 1
中国药品标准 2014 年第 15 卷第 1 期 21
表 1 不同企业生产的培养基与实验室自配培养基主要理化属性比对结果
培养基 TSB
理化属性
性状 颜色
pH( 7. 3 ± 0. 2)
RV
性状
颜色
pH( 5. 2 ± 0. 2)
关键词: 沙门菌检查; 培养基; 质量研究
中图分类号: R921. 2
文献标识码: A
文章编号: 1009 - 3656( 2014) - 1 - 19 - 5
Discussion on Quality of Culture Mediums For Salmonella Examination in Chinese Pharmacopoeia 2015 Edition
胰酪大豆胨肉汤( TSB) 培养基 [碧迪医疗器械 有限公司( 简称 BD) ,青岛高科园海博生物技术有 限公司( 简称海博) ,北京三药科技开发公司( 简称 三药) ,北京陆桥技术有限公司( 简称陆桥) ]; RV 沙 门菌增菌肉汤培养基[ BD,海博,实验室自行配制 ( 简称自配) ]; 木糖赖氨酸脱氧胆酸盐琼脂( XLD) [BD,海博,陆桥,自配]; 三糖铁琼脂培养基 ( TSI) [海博,三药,陆桥,自配]; 赖氨酸脱羧酶试验培养 基[陆桥,海博,青岛日水生物技术有限公司( 简称 日水) ,自配]; 氨基酸对照培养基[海博,日水,自 配]; 氰化钾培养基[陆桥,海博,日水,自配]; 氰化
2 检验方法 2. 1 菌液制备
菌液制备均按 2010 年版《中国药典》附录菌液 制备[2]要求在临用前制备成每 1 mL 含菌落数不大 于 100 cfu 的菌悬液。 2. 2 培养基的配制
药典培养基

11C42
肠道菌增菌液体培养基
Enterobacteria Enrichment Broth Medium
用于耐胆盐革兰阴性菌的增菌培养
11C02
紫红胆盐葡萄糖琼脂培养基
Violet Red Bile Glucose Agar
用于耐胆盐革兰阴性菌的分离培养
用于万古霉素效价测定
11E13
抗生素检定IX
Antibiotic MediumIX
用于白色念珠菌悬液抗生素效价测定
11E14
多黏菌素B用培养基
Polymyxin B Medium
用于多粘菌素B效价测定
11E15
制霉素检定培养基
Nystatin Medium
用于制霉素效价测定
11E16
麦迪/麦白霉素检定培养基
11C21
精氨酸支原体肉汤基础培养基
Mycoplasma(Ma)Broth Medium Base
用于培养支原体
11C22
肺炎支原体肉汤基础培养基
Mycoplasma(Mp)Broth Medium Base
用于分离肺炎支原体
11C23
支原体琼脂基础培养基
Mycoplasma Agar Medium Base
Medecamycin Medium
用于麦迪(白)霉素效价测定
11E17
阿奇霉素检定培养基
用于阿奇霉素效价测定
11F01
生芽孢琼脂斜面培养基
Porulation Medium
用于快速生芽孢
产品号
产品名称
产品说明及用途
11A09
支原体半流体培养基
Mycoplasma Semi-Fluid Base
2015年版中国药典微生物限度检查法

1.1 总则:
• 环境: – 微生物计数试验环境应符合微生物限度检查的要 求。(在不低于GMP 现行版要求的D 级洁净环境 、局部洁净度不低于B 级的单向流空气区域内进 行)【10版:在环境洁净度10000级下的局部洁净 度100级的单向流空气区域内】。 – 检验全过程必须严格遵守无菌操作,防止再污染 ,防止污染的措施不得影响供试品中微生物的检 出。 – 单向流空气区域、工作台面及环境应定期进行监 测。
菌数报告规则
– 需氧菌总数测定宜选取平均菌落数小于 300cfu 的稀释级、霉菌和酵母菌总数测定宜 选取平均菌落数小于100cfu 的稀释级,作为 菌数报告(取两位有效数字)的依据。取最 高的平均菌落数,计算1g、1ml 或10 cm² 供 试品中所含的微生物数。 – 如各稀释级的平皿均无菌落生长,或仅最低 稀释级的平板有菌落生长,但平均菌落数小 于1 时,以﹤1 乘以最低稀释倍数的值报告菌 数。
1.4.2供试品检查
• 供试液制备 – ⑴ 水溶性供试品
• 取供试品,用 pH7.0 无菌氯化钠-蛋白胨 缓冲液,或pH7.2 磷酸盐缓冲液,或胰酪 大豆胨液体培养基溶解或稀释制成 1:10 供试液。若需要,调节供试液 pH 值至 6 ~8。必要时,用同一稀释液将供试液进 一步 10倍系列稀释。水溶性液体制剂也 可用混合的供试品原液作为供试液。
1.3.1菌液制备及使用
试验菌株 试验菌液的制备
金黄色葡萄球菌 〔CMCC(B) 26 003)〕
铜绿假单胞菌 〔CMCC(B)10 104〕 枯草芽孢杆菌 〔CMCC(B) 63 501〕 白色念珠菌 〔CMCC(F) 98 001〕
胰酪大豆胨琼脂培养基或胰酪大豆胨液体培 养基 【10版:营养肉汤或营养琼脂培养基】 30~35℃,18~24小时
2015版药典培养基

紫红胆盐葡萄糖琼脂培养基 颗粒 Violet Red Bile Glucose Agar
麦康凯液体培养基 MaConkey Broth
麦康凯液体培养基 颗粒 MaConkey Broth
麦康凯琼脂培养基 MaConkey Agar
HB4114-19 HBKP4114-19 HB0126-4 HBKP0126-4 HB0116-4 HBKP0116-4 HB8313-5 HBKP8313-5 HB6238-10 HBKP6238-10 HB4198-11 HBKP4198-11 HB4105-6 HBKP4105-6 HB4088-62 HB4128-22 HBKP4128-22
沙氏琼脂培养基(SDA) Sabouraud Agar
大豆酪蛋白琼脂(TSA)培养基平板(9cm) TSA
营养琼脂平板 9cm TSA
沙氏琼脂平板(9cm) Sabouraud Agar
含青霉素酶 TSA 平板(9cm) Tryptose Soya Agar
TSA 表面接触皿(65mm) TSA
TSA 表面接触皿(7.5cm) TSA
规格 250g 250g 1kg 250g 1kg 250g 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包 10 个/包
价格(元) 产品说明及用途
120
用于医药工业洁净室(区)沉降菌的测试 150
HBPP5190-100
硫乙醇酸盐流体培养基
HBPP5191-100 HBPP5222-500 HBPP5222-250
中国药典2015版无菌检查方法适用性试验(直接接种法)
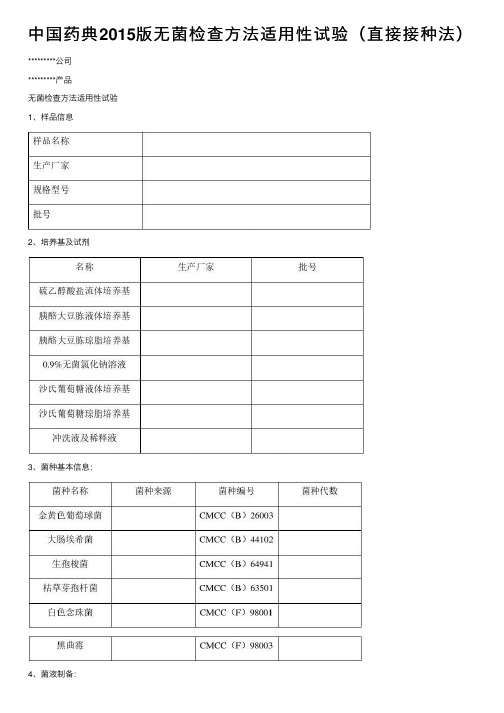
中国药典2015版⽆菌检查⽅法适⽤性试验(直接接种法)*********公司*********产品⽆菌检查⽅法适⽤性试验1、样品信息2、培养基及试剂3、菌种基本信息:4、菌液制备:2.1接种⾦黄⾊葡萄球菌、⼤肠埃希菌、枯草芽孢杆菌的新鲜培养物⾄胰酪⼤⾖胨培养基中或胰酪⼤⾖胨脂培养基上,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.2接种⽣孢梭菌的新鲜培养物⾄硫⼄醇酸盐流体培养基中,30~35℃培养18~24⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌悬液。
2.3接种⽩⾊念珠菌的新鲜培养物⾄沙⽒葡萄糖液体培养基或沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养24~48⼩时,培养物⽤0.9%⽆菌氯化钠溶液制成每1ml 含菌数⼩于100cfu的菌悬液。
2.4接种⿊曲霉菌的新鲜培养物接种⾄沙⽒葡萄糖琼脂斜⾯培养基上,20~25℃培养5~7天,加⼊3~5ml含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液,将孢⼦洗脱。
然后,采⽤适宜的⽅法吸出孢⼦悬液⾄⽆菌试管内,⽤含0.05%(ml/ml)聚⼭梨酯80的0.9%⽆菌氯化钠溶液制成每1ml含菌数⼩于100cfu的菌孢⼦悬液。
6、⽆菌检查直接接种法⽅法适⽤性试验6.1供试品制备:描述供试品制备过程(主要为每个样品的取样部位及⽤量)。
6.2试验组:取装量为 ml硫⼄醇酸盐流体培养基,接种规定的供试品量(同6.1),并接种⼩于100cfu的⾦黄⾊葡萄球菌;⼤肠埃希菌、⽣孢梭菌、枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉按照上述步骤操作,其中⼤肠埃希菌、⽣孢梭菌加⼊硫⼄醇酸盐流体培养基,枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉加⼊胰酪⼤⾖胨液体培养基。
6.3对照组:取装量为 ml硫⼄醇酸盐流体培养基3管,分别接种⼩于100cfu的⾦黄⾊葡萄球菌、⼤肠埃希菌、⽣孢梭菌;取相同装量的胰酪⼤⾖胨培养基3管,分别接种⼩于100cfu枯草芽孢杆菌、⽩⾊念珠菌、⿊曲霉。
15版药典与10版药典微生物区别

15版药典与10版药典微生物区别一、微生物计数法1、计数方法(1)平皿法(15版包含平皿法、涂布法)(2)薄膜过滤法(3)MPN法(最可能数法)新增2、计数培养基适用性检查(1)菌种及菌液的制备15版药典新增PH7.0无菌氯化钠-蛋白胨缓冲液可以作为稀释液,0.9℅无菌氯化钠同样可以使用。
金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌增菌由营养肉汤培养基或营养琼脂培养基改为胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基。
白色念珠菌增菌由改良马丁培养基或改良马丁琼脂培养基改为沙氏葡萄糖琼脂培养基或沙氏葡萄糖液体培养基,培养温度由23~28℃改为20~25℃。
黑曲霉增菌由改良马丁琼脂斜面培养基改为沙氏葡萄糖琼脂培养基或马铃薯葡萄糖琼脂培养基,培养温度由23~28℃改为20~25℃。
(2)培养基适用性检查10年药典判断依据:被检培养基上的菌落平均数不小于对照培养基上的菌落平均数的70℅,且菌落形态大小与对照培养基上的菌落一致。
15年药典判断依据:被检固体培养基上的菌落平均数与对照培养基上的菌落平均数的比值应在0.5~2范围内,且菌落形态大小与对照培养基上的菌落一致;被检液体培养基管与对照培养基管比较,试验菌应生长良好。
3、供试品计数方法适用性试验(1)供试液的制备10年药典制备方法特点:稀释液为PH7.0无菌氯化钠蛋白胨缓冲液分类:液体供试品,固体、半固体或黏稠性供试品,需用特殊方法制备供试液的供试品(非水溶性供试品、膜剂供试品、肠溶及结肠溶制剂供试品、气雾剂喷雾剂供试品、贴膏剂供试品、具抑菌活性的供试品)。
15年药典制备方法特点:稀释液为PH7.0无菌氯化钠蛋白胨缓冲液,或PH7.25磷酸盐缓冲液,或胰酪大豆胨液体培养基分类:水溶性供试品,水不溶性非油脂类供试品,油脂类供试品,需用特殊方法制备供试液的供试品(膜剂供试品、肠溶及结肠溶制剂供试品、气雾剂喷雾剂供试品、贴膏剂供试品)(2)抗菌活性的去除或灭活15年药典方法比10年药典少了离心沉淀法4、供试品检查(1)检验量10年药典:一般应随机抽取不少于检验用量(两个以上最小包装单位)的3倍量供试品。
2015药典培养基

2015药典培养基2015版药典培养基2015年10月27日发布1.1 无菌检查法产品号产品名称产品说明及用途11A 01硫乙醇酸盐流体培养基ThioglycollateMedium用于药品、生物制品等的无菌检查,用于需氧菌和厌氧菌的培养11A 02硫乙醇酸盐培养基(不含琼脂)ThioglycollateMedium(without Agar)用于生物制品中混浊制品的无菌试验,检查需氧菌和厌氧菌112PH7.0氯化钠-蛋可作为供试品稀释液18 白胨缓冲液SodiumChloride-PeptoneBuffer11601 沙氏葡萄糖琼脂培养基(含氯霉素) Sabouraud GlucoseAgar(containingChloramphenicol)用于测定霉菌和酵母菌总数11001 胰酪大豆胨琼脂培养基(TSA )-平板特供 用于药品无菌检查及一般细菌培养等其他用途 1.2 微生物限度检查1.3 抑菌剂效力检查产品号产品名称产品说明及用途11 10 4胰酪胨大豆肉汤培养基(TSB)Tryptone SoyBrothMedium用于真菌,需氧菌无菌检查及用途11 33 2胰酪胨大豆琼脂培养基(TSA)Tryptone SoyAgar Medium用于药品、生物制品中需氧菌菌的培养等其他用途11 21 6沙氏葡萄糖液体培养基(SDB)Sabouraud用于霉菌和酵母菌的培养Glucose Liquid Medium11 32 5沙氏葡萄糖琼脂培养基(SDA)SabouraudGlucose AgarMedium用于测定霉菌和酵母菌总数1.4 纯化水检验产品号产品名称产品说明及用途11A 16R2A琼脂R2A Agar用于纯化水中菌落总数的测定1.5抗生素检定培养基产品号产品名称产品说明及用途11E 01MH肉汤培养基MH BrothMedium用于抗生素敏感试验11E 02MH琼脂培养基Mueller HintonAgar Medium用于抗生素敏感试验11E 03抗生素检定I(PH6.5 - 6.6)AntibioticMedium I用于苯唑青霉素等抗生素检定11E 04抗生素检定I(PH7.8 - 8.0)AntibioticMedium I用于链霉素等抗生素检定11E 05抗生素检定II(PH6.5 - 6.6)AntibioticMedium II用于四环素等抗生素效价测定11E 06抗生素检定II(PH7.8 - 8.0)AntibioticMedium II用于林可霉素等抗生素效价测定11E 07抗生素检定IIIAntibioticMedium III用于藤黄八叠球菌菌悬液制备11E 08抗生素检定IVAntibioticMedium IV用于两性霉素效价测定11E 09抗生素检定VAntibioticMedium V用于培养啤酒酵母菌菌种11E 10抗生素检定VIAntibioticMedium VI用于多粘菌素效价测定11E 11抗生素检定VIIAntibioticMedium VII用于头孢噻肟钠效价测定11E 12抗生素检定VIIIAntibioticMedium VIII用于万古霉素效价测定11E抗生素检定IX用于白色念珠菌悬液13AntibioticMedium IX抗生素效价测定11E 14多黏菌素B用培养基Polymyxin BMedium用于多粘菌素B效价测定11E 15制霉素检定培养基Nystatin Medium用于制霉素效价测定11E 16麦迪/麦白霉素检定培养基MedecamycinMedium用于麦迪(白)霉素效价测定11E 17阿奇霉素检定培养基用于阿奇霉素效价测定11F 01生芽孢琼脂斜面培养基PorulationMedium用于快速生芽孢1.6 支原体检查。
2015版药典培养基适用性验证
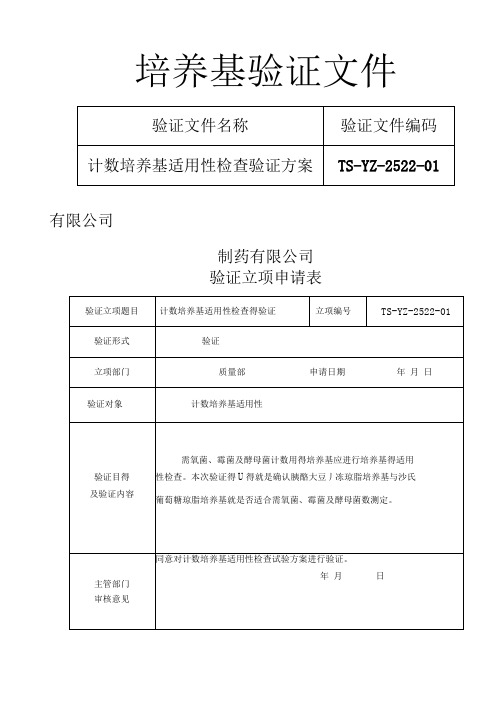
培养基验证文件有限公司制药有限公司验证立项申请表验证方案得审批验证方案目录1、概述2、验证目得3、验证范围4、验证项目小组成员及职责5、验证合格标准6、试验材料7、菌液制备8、适用性检查9、验证记录10、验证结论及综合评价计数培养基适用性检查得验证方案1、验证目得:需氧菌、霉菌及酵母菌计数用得培养基应进行培养基得适用性检查。
本次验证得LI得就是确认胰酪大豆丿冻琼脂培养基与沙氏葡萄糖琼脂培养基就是否适合需氧菌、霉菌及酵母菌总数测定。
2、参照标准:《中国药典》2015年版四部1105非无菌产品微生物限度检查法。
3、验证项山胰酪大豆丿冻琼脂培养基与沙氏葡萄糖琼脂培养基得适用性检查。
4、验证小组人员及职责:5、合格标准:被检固体培养基上得菌落平均数与对照培养基上得菌落平均数得比值应在0、5〜2范围内,且菌落形态大小与对照培养基上得菌落一致。
6、试验材料:6、1、被验证产品:胰酪大豆陈琼脂培养基、沙氏葡萄糖琼脂培养基。
6、2、仪器设备:621、YXQ-LS-100G型立式压力蒸汽灭菌器622、GHT-00双人净化工作台623、BSC-110011A2-X 生物安全柜624、MJ-250I型霉菌培养箱(20〜25°C)625、LRH-250 生化培养箱(30〜35°C)626、电热恒温干燥箱6.2.7微波炉、、验证用培养基、、验证用菌株:(第代)、菌液制备按6、4规定程序培养各试验菌株。
取金黃色葡萄球菌、铜绿假单胞菌、枯草芽砲杆菌、口色念珠菌得新鲜培养物,用pH7、0无菌氯化钠-蛋口腺缓冲液制成约为50~100cfu / ml得菌悬液;取黑曲霉得新鲜培养物加入3〜5ml含0、05%(ml/ml)聚山梨酯80得pH7、0无菌氯化钠-蛋口陈缓冲液,将砲子洗脱。
然后,采用适宜得方法吸出砲子悬液至无菌试管内,用含0、05%(ml/m 1)聚山梨酯80得pH7、0无菌氯化钠-蛋白月东缓冲液制成约为50~100cfii / ml得黑曲霉泡子悬液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
名称规格价格(元)产品说明及用途pH 7.2磷酸盐缓冲液
Phosphate Buffer pH
7.2 250g 85.00
用于检测大肠菌群、大
肠杆菌时样品的稀释
硫乙醇酸盐流体培养基
(FT)Thioglycollate
Medium 250g 115.00
用于培养好氧菌、厌氧
菌及无菌试验
0.1%蛋白胨水稀释剂
0.1%Peptone Broth 100g 30.00
用于制备药品样品的稀
释液或冲洗液
0.5%葡萄糖肉汤培养基
0.5%Dextrose Broth
Medium 250g 70.00
用于硫酸链霉素等抗生
素的无菌检验
胰酪大豆胨琼脂培养基
(TSA)
Tryptone Soy Agar
Medium 250g 120.00
用于药品、生物制品中
需氧菌和真菌的培养等
其他用途
胰酪大豆胨液体培养基
(TSB)
Tryptone Soy Broth
Medium 250g 100.00
用于真菌,需氧菌无菌
检查及其他用途
沙氏葡萄糖琼脂培养基
(SDA) 250g
85.00
用于霉菌、酵母菌分离
培养
Sabouraud Dextrose
Aga
沙氏葡萄糖液体培养基
(SDB)
Sabouraud Dextrose
Broth 250g 80.00
用于霉菌、酵母菌培养。
pH7.0氯化钠蛋白胨缓
冲液
pH7.0 NaCl Peptone
Broth 250g 75.00
用于药品、生物制品的
样品稀释
玫瑰红钠琼脂培养基
Rose Bengal Agar
Medium
250g 100.00 用于霉菌、酵母菌计数
马铃薯葡萄糖琼脂
(PDA)
Potato Dextrose Agar
250g 115.00 用于霉菌和酵母菌计数三糖铁琼脂(TSI)
Triple Sugar Iron
Agar 250g 80.00
用于肠杆菌科细菌的生
化反应筛选
肠道菌增菌液体培养基
(EE)
Enterobacteria
250g 180.00 用于肠道菌增菌培养
Enrichment Broth
紫红胆盐葡萄糖琼脂培
养基
Violet Red Bile
Glucose Agar
250g 100.00 用于肠杆菌计数麦康凯琼脂培养基
(MacC)MacConkey Agar Medium 250g 90.00
用于肠道杆菌的分离培
养
麦康凯液体培养基
MacConkey Broth
250g 85.00 用于大肠杆菌检验RV沙门菌增菌液体培养
基
RV Salmonella Enrichment Medium 250g 120.00
用于沙门氏菌增菌培养
用
木糖赖氨酸脱氧胆盐(XLD)琼脂Xylose
Lysine Desoxycholate
Agar 100g 160.00
用于志贺氏菌和沙门氏
菌的选择性分离培养
溴化十六烷基三甲铵琼
脂培养基Cetrimide Agar 250G
90.00
用于绿脓假单胞菌的选
择和分离培养
甘露醇氯化钠琼脂培养
基
Mannitol Salt Agar 250g100.00
用于金黄色葡萄球菌的
选择性分离培养
梭菌增菌培养基
Reinforced Medium for
Clostridia
200g 170.00 用于梭菌增菌培养
R2A琼脂R2A Agar 250G
250.00
用于水中细菌总数的检
测。
