胶体
胶体

紧密层
0热力学电势差:
固体表面与溶液本体间的电势差
x
双 电 层 的 Stern 模 型
当溶胶相对静止时,整个溶胶体系是电中性的,但 当分散相粒子和液体介质相对运动时,就会产生电位差, 这种电位差叫电动电势。 胶粒是带电的,由于静电引力使反粒子在表面周围,
又由于分子热运动,使反粒子在表面附近呈扩散分布。
离表面近的一层——紧密层(内层),厚度(约几
1869年,发现了Tyndall效应,可区别溶胶及溶液;
1903年,德国科学家Zsigmondy发明了超显微镜, 肯定溶胶的一个根本问题—体系的多相性,从而明确了 胶体化学是界面化学。
1907年,德国化学家Ostwald创办《胶体化学和工
业杂志》—胶体化学正式成为一门独立的学科。 1941年,前苏联的德查金(Derjaguin B V)和朗道 (Landau L D)以及1948年荷兰的维韦(Werwey E J W)和 奥佛比克(Overbeek J T G)胶体稳定性的DLWO理论。从 70年代起,对高分子稳定胶体的研究逐渐成为热点,其中
φ0
+ + + + + + + + + + + +
δ
φ0
+ + + + + + + + + + + + +
-
A B x -
平板双电层模型
扩散双电层模型
质 点 表面+ + + + + + + + + +
胶体

四、胶体的性质
胶体的性质1、 丁达尔现象
当一束强光透过胶体时,可以看到一条光 亮的通路,这种现象叫做丁达尔现象。
胶体的性质2: 布朗运动
在超显微镜下观察胶体溶液可以看到胶体颗粒 不断地作无规则的运动。
普遍存在 的现象
胶体的性质3、 渗析
利用溶液与胶体的 这一区别,把混有 离子或分子杂质的 胶体装入半透膜袋, 并且浸入溶剂中, 使离子或分子从胶 体中分离出去,这 样的操作叫做渗析
水 水
水
分散质直径
溶液
1nm > d 1nm < d <100nm 100nm < d
分散系
胶体 浊液
二、胶体的定义
分散质微粒的直径大小在1nm—100nm 之间的分散系叫胶体
( 10-9m~10-7m) 生活中常见的胶体:墨汁,淀粉溶液,豆浆,血 液,空气
三、胶体的制备
制备原理:使分散质粒子大小在1nm ~ 100nm 之间 (1)高分子形成的溶液,如: 蛋白质溶液,淀粉溶液 (2)物理分散法,如 墨汁,炭素墨水 (3)化学方法(结合法),如: Fe(OH)3胶体,AL(OH)3胶体,AgI胶体
胶体的应用
血液透析
豆腐的制作
指甲花与明矾捣碎
自来水的净化
四、胶体的分类
根据分散质 微粒的构成
粒子胶体:Fe(OH)3胶体、AgI胶体 分子胶体:淀粉溶液、蛋白质溶液
气溶胶:烟、云、雾
据分散剂 状态分类 液溶胶:AgI胶体、Fe(OH)3胶体 固溶胶:有色玻璃、烟水晶
不同分散系的比较
分散系 溶液 <1nm 悬浊液 >100nm 乳浊液 >100nm 很多分子集 合体 胶体 1nm— 100nm
常见胶体举例

常见胶体举例
(最新版)
目录
1.引言
2.常见胶体举例
2.1 空气
2.2 海洋
2.3 土壤
2.4 生物体
3.结论
正文
【引言】
胶体是一种特殊的物质形态,由两种或两种以上的物质组成,其中一种物质呈胶状分散于另一种物质中。
在我们生活中,胶体无处不在,下面我们来看看一些常见的胶体例子。
【常见胶体举例】
2.1 空气
空气是一种典型的胶体,由氮气、氧气和少量的其他气体组成。
在空气中,氮气和氧气以胶状分散于空气中,使我们能够呼吸到新鲜的空气。
2.2 海洋
海洋中的海水也是一种胶体,主要由水和溶解其中的盐类组成。
此外,海洋中还存在着大量的生物,这些生物和海水共同构成了一个庞大的生态系统。
2.3 土壤
土壤是陆地上最重要的胶体,由固体颗粒、水分和空气组成。
土壤中的固体颗粒包括了各种矿物质和有机物质,它们是植物生长的基础。
2.4 生物体
生物体也是一种特殊的胶体,由细胞和细胞间质组成。
细胞是生物体的基本单位,通过细胞间质的连接,形成各种组织和器官,构成完整的生物体。
【结论】
胶体在我们生活中无处不在,从空气到海洋,从土壤到生物体,都存在着各种形态的胶体。
胶体
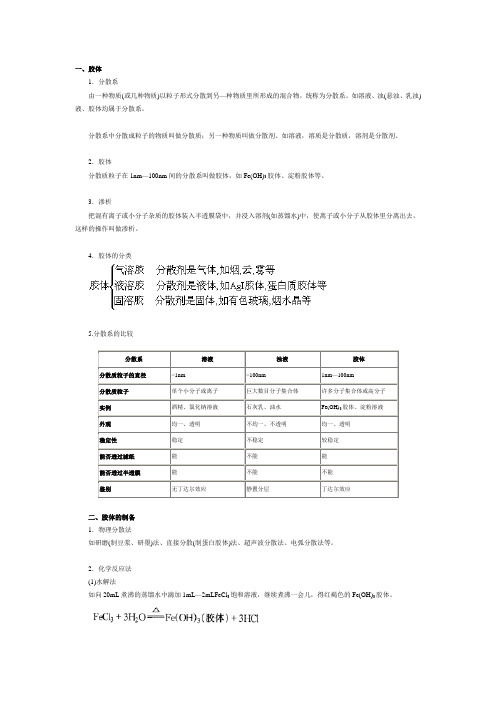
一、胶体1.分散系由一种物质(或几种物质)以粒子形式分散到另—种物质里所形成的混合物,统称为分散系。
如溶液、浊(悬浊、乳浊)液、胶体均属于分散系。
分散系中分散成粒子的物质叫做分散质;另一种物质叫做分散剂。
如溶液,溶质是分散质,溶剂是分散剂。
2.胶体分散质粒子在1nm—100nm间的分散系叫做胶体,如Fe(OH)3胶体、淀粉胶体等。
3.渗析把混有离子或小分子杂质的胶体装入半透膜袋中,并浸入溶剂(如蒸馏水)中,使离子或小分子从胶体里分离出去,这样的操作叫做渗析。
4.胶体的分类5.分散系的比较二、胶体的制备1.物理分散法如研磨(制豆浆、研墨)法、直接分散(制蛋白胶体)法、超声波分散法、电弧分散法等。
2.化学反应法(1)水解法如向20mL煮沸的蒸馏水中滴加1mL—2mLFeCl3饱和溶液,继续煮沸一会儿,得红褐色的Fe(OH)3胶体。
(2)复分解法①向盛有10mL 0.01mol/LKI的试管中,滴加8—10滴0.01mol/LAgNO3溶液,边滴边振荡,得浅黄色AgI胶体。
AgNO3十KI=AgI(胶体)十KNO3②在一支大试管里装入5mL—10mL1mol/LHCl,加入1mL水玻璃,然后用力振荡即可制得硅酸溶胶。
Na2SiO3十2HCl十H2O=2NaCl十H4SiO4(胶体)除上述重要胶体的制备外,还有:①肥皂水(胶体):它是由C17H35COONa水解而成的。
②淀粉溶液(胶体):可溶性淀粉溶于热水制得。
③蛋白质溶液(胶体):鸡蛋白溶于水制得。
三、胶体的提纯——渗析法将胶体放入半透膜袋中,再将此袋放入蒸馏水中,由于胶粒直径大于半透膜的微孔,不能透过半透膜,而小分子或离子可以透过半透膜,使杂质分子或离子进入水中而除去。
如果一次渗析达不到纯度要求,可以把蒸馏水更换后重新进行渗析,直至达到要求为止。
半透膜的材料:蛋壳内膜,动物的肠衣、膀胱等。
1.渗析与渗透的区别渗析:分子、离子通过半透膜,而胶体粒子不能通过半透膜的过程。
高一化学必修一知识点:化学胶体

高一化学必修一知识点:化学胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
2、胶体的分类:①.根据分散质微粒组成的状况分类:如:胶体胶粒是由许多等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
又如:淀粉属高分子化合物,其单个分子的直径在1nm~100nm 范围之内,这样的胶体叫分子胶体。
②.根据分散剂的状态划分:如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、溶胶、溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
3、胶体的制备A.物理方法①机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小②溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水、聚乙烯熔于某有机溶剂等。
B.化学方法①水解促进法:FeCl3+3H2O(沸)=(胶体)+3HCl②复分解反应法:KI+AgNO3=AgI(胶体)+KNO3Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl思考:若上述两种反应物的量均为大量,则可观察到什么现象?如何表达对应的两个反应方程式?提示:KI+AgNO3=AgI↓+KNO3(黄色↓)Na2SiO3+2HCl=H2SiO3↓+2NaCl(白色↓)4、胶体的性质:①丁达尔效应——丁达尔效应是粒子对光散射作用的结果,是一种物理现象。
丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”。
当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而以溶液和浊液无丁达尔现象,所以丁达尔效应常用于鉴别胶体和其他分散系。
②布朗运动——在胶体中,由于胶粒在各个方向所受的力不能相互平衡而产生的无规则的运动,称为布朗运动。
胶体

1、定义:由一种或几种物质分散Leabharlann 另一种物质中得到的体系,即分散系。
分散质 分散剂
溶液
分散质微粒直径 < 1nm
2、分类:
胶体
1nm<分散质微粒直径 < 100nm
浊液
分散质微粒直径 > 100nm
悬浊液 乳浊液
胶体
1、定义:分散质微粒直径介于1nm-100nm之间的分散系,即胶体。
2、分类
聚沉
聚沉
小结: 三种分散系的比较
分散系
分散质粒 子的直径
溶液
<1nm
均一、透明 分子、离子
胶体
1nm~100nm
较均一 透明 粒子/高分子
浊液
>100nm
不均一 不透明 大量粒子
外观
分散质微粒 能否透过滤纸 能否透过 半透膜
能
能
不能
能
稳定
不能
较稳定
不能
不稳定
稳定性
⑶聚沉:
使分散质聚集成较大的微粒,在重力作用下形成沉淀析出。
能使胶体聚沉的方法:
1、加入电解质(中和)
2、加入带相反电荷的胶体 3、加热 4、搅拌
6.胶体的用途:
电泳 (1)静电除尘 聚沉 (2)硝酸铵肥效较差 聚沉 (3)明矾净水 (4)FeCl3溶液用于伤口止血 (5)黄河入海口形成三角洲 聚沉 (6)微波手术刀止血
气溶胶 液溶胶 固溶胶
云、烟、雾
豆浆、牛奶、墨水、肥皂水 果冻、有色玻璃、豆腐
按分散剂状态
粒子胶体 按胶粒组成 分子胶体
Fe(OH)3胶体、AgI胶体 淀粉溶液
3、胶体的制备:
物理法:分子胶体,可直接溶解,如淀粉溶液。 化学法: 粒子胶体
胶体

胶体溶液中,逐滴加入HCL 在Fe(OH)3胶体溶液中,逐滴加入 稀溶液,会出现一系列变化。 稀溶液,会出现一系列变化。 (1)先出现红褐色沉淀,原因是 先出现红褐色沉淀, 先出现红褐色沉淀 HCL为电解质,可使 为电解质, 为电解质 可使Fe(OH)3溶胶发生聚沉 _____________________________ (2)随后沉淀溶解,溶液呈黄色,写 随后沉淀溶解, 随后沉淀溶解 溶液呈黄色, 出此反应的离子方程式 Fe(OH)3十3H+=Fe3+十3H2O _____________________________。
4.电泳电镀 利用电泳将油漆、乳胶、 电泳电镀:利用电泳将油漆 乳胶、 电泳电镀 利用电泳将油漆、 橡胶等粒子均匀地沉积在镀件上。 橡胶等粒子均匀地沉积在镀件上。 5.医学上利用血清的纸上电泳进行某些 医学上利用血清的纸上电泳进行某些 医学上 疾病的诊断。 疾病的诊断。
胶体为什么能够稳定存在? 胶体为什么能够稳定存在?
二.胶体的性质
4. 胶体的聚沉:使胶体粒 子聚集成 较大的颗粒,形成沉淀,从分散剂里 较大的颗粒,形成沉淀, 析出的过程。 析出的过程。
1.分析MgSO 溶液加入Fe(OH) 胶体中后,发生凝聚的原因。 1.分析MgSO4溶液加入Fe(OH)3胶体中后,发生凝聚的原因。 分析 已知NaCl NaCl使 胶体凝聚的效果不如等浓度的MgSO 2.已知NaCl使Fe(OH)3胶体凝聚的效果不如等浓度的MgSO4? 卤水点豆腐”是把CaSO 3.“卤水点豆腐”是把CaSO4(或MgCl2)加入豆浆中发生凝聚 制得豆腐。但如用Na 等盐效果却不如前者, 制得豆腐。但如用Na2SO4、 K2SO4等盐效果却不如前者, 说明豆浆胶体带什么电? 说明豆浆胶体带什么电?
胶体的性质及其应用

胶体具有介稳性的原因
主要是因为胶体粒子表面积大,可以通 过吸附而带电荷。同种胶体粒子的电性相 同,在通常情况下,它们之间的相互排斥 阻碍了胶体粒子变大,使它们不容易聚集。 胶体粒子所作的布朗运动也使得它们不容 易聚集成质量较大的颗粒而沉降下来。
3、胶体的电泳:在外加电场的作用下,胶 粒定向地向阴极或阳极运动。 原因:胶粒吸附离子而带同种电荷。 带正电:金属氧化物、金属氢氧化物胶体 如Fe2O3 、 Al(OH)3胶体等 带负电:非金属氧化物、金属硫化物胶体 如H2SiO3(SiO2) 、 Sb2S3胶体等 应用:⑴ 静电除尘 ⑵ 精制粘土 ⑶ 血清电泳用于诊断疾病
3、已知土壤胶体粒子带负电,在土壤里施用含 氮量相等的下列肥料,肥效较差的是 ( C ) A.(NH4)2SO4 B.NH4HCO3 C.NH4NO3 D.NH4Cl 4、下列事实与胶体知识有关的是 ( D) ①用卤水点豆腐 ②工厂烟窗用电极除尘 ③河 海交接处易沉积形成沙洲 ④向25ml沸腾的蒸馏 水中加入5-6滴饱和FeCl3溶液所得液体. A.①②③ B.②③④ C.①③④ D.全部都是
凝胶的形成: 胶体在聚沉的过程中由于某种原因使分散 剂一起聚沉成的一种不流动的胶冻状物质。 如:豆腐脑、果冻等
三、胶体的制备方法 1、分散法:大→小 ⑴ 、研磨法:把固体磨成直径大小为1nm~ 100nm之间的微粒,再分散到适当 的分散剂中, 并加入稳定剂。
如:工业制石墨胶体、有色玻璃、碳素墨水、 涂料、颜料、炸药、塑料、橡胶等。 ⑵ 、胶溶法 2 、凝聚法:小→大 AgNO3 + KI = AgI(胶体) + KNO3 注意:⑴溶液浓度足够稀(0.001mol/L)。 ⑵有一种反应物必须过量。 四、胶体的精制—渗析
胶体

(2)解离作用: 胶核表面分子的解离使胶粒带电。
如:硅胶胶粒(x SiO2 ﹒y H2O)带负电
H 2 SiO 3 HSiO 3 HSiO 3 SiO 3 2+ + H+ H+
3.4.3
一、溶胶的结构
溶胶的结构及稳定 性
胶团结构的表示方法如下:
• AgI正溶胶的胶团结构
3.4.3
一、溶胶的结构
溶胶的结构及稳定 性
二、高分子化合物溶液
高分子化合物在适当的溶剂中能强烈的溶剂化,形 成很厚的溶剂化膜而溶解,碰撞时不易结合成大分子而 沉淀,构成了均匀、稳定的分散系,称为高分子化合物 溶液。高分子化合物溶液的本质是真溶液,丁达尔现象 不明显。
特点:稳定性大、粘度大
17
高分子化合物溶液和溶胶的性质
性质
分散相颗粒特 征 通透性 扩散速度 分散相组成 均一性 稳定性 粘度 外加电解质离 子的影响
3.4.3
溶胶的结构及稳定 性
2. 异电溶胶的相互聚沉
• 将两种带相反电荷的溶胶互相混和,带异电的胶粒会相互 吸引、中和而聚沉。 加入明矾 KAl(SO4)2· 12H2 O 水解后生成Al(OH)3正溶胶
如:水的净化
水中带负电荷的悬浮粒子 相互作用形成絮状物后聚沉
3.4.3
溶胶的结构及稳定 性
温度越高,布朗运动越剧烈
3.4.2
溶胶的基本特征
2. 扩散与沉降(宏观)
在重力场中,胶粒受重力作用而下沉,这 一现象称为沉降。
胶粒由于布朗运动会从密度大的区域向
密度小的区域迁移,这种现象称为扩散。 沉降速率等于扩散速率,溶胶系统处于沉 降扩散平衡。形成浓度梯度。
3.4.2
胶体的概念

胶体的概念
胶体是一种自然界中极为普遍的物质,它是一种混合物,可以存在固态,液态,气态的三种形态。
科学家将胶体的特性和各种混合物分为离子性胶体、非离子性胶体、聚合物胶体和多分子胶体四种类型。
离子性胶体是一种物理效应引起的物质,是由离子和离子形成的混合物。
离子性胶体主要由离子加入水中而形成,离子可以是金属离子,酸离子,碱离子等,它们在水中出现,通常会产生一种粘性的现象,这就是胶体的特性。
非离子性胶体是由非离子物质构成的胶体,它们的凝结特性比离子性胶体要弱得多,但它们的应用也十分广泛,如硅烷的溶液就是很有用的非离子性胶体。
聚合物胶体是一种利用有机物聚合形成的混合物,对于它们的聚合及稳定,有多种因素可以影响,如温度,pH值,电离等。
聚合物胶体一般由有机物聚合而成,可以有多种不同的特性,有极佳的稳定性和流变性,它们的应用非常广泛,主要用于制作粉体、糊状物,以及各种饮料和食品。
多分子胶体是一种杂质系统,它是一种复合体,由多种不同的分子组成,它们可以互相作用,在多分子胶体系统中发挥重要作用,比如可以控制胶体的形状,强度,稳定性和流变性,能使胶体具有良好的物性性质,并有较强的抗外界环境影响能力。
在现代社会,胶体的应用越来越广泛,它们可以用于食品工业,医药行业,油漆涂料工业,纺织工业,建筑工业,化妆品行业等行业,
在日常生活中也有广泛的应用,比如磨牙用的牙膏,沐浴用的沐浴乳,彩妆的面膜等。
胶体是一种自然物质,具有很多独特的性质,它们的应用也有着极大的潜力和发展前景,以上是对胶体的简单介绍,仅供参考。
化学 胶体

扩散层
{ [Fe(OH)3]m· nFeO+· (n-x)Cl-}x+· xCl胶核 吸附离子 反离子
胶团
第五章 胶体
胶粒 吸附层
第二节
溶胶
扩散层
{ [AgI]m· nAg+· (n-x)NO3-}x+· xNO3胶核 吸附离子 反离子 胶团
练习:书写AgI溶胶胶团式
第五章 胶体
三、溶胶的稳定与聚沉
第五章 胶体
第二节 溶胶
讨论 CaCl2 、MgSO4 、Na3PO4等三种电解质对 由等体积0.080mol· L-1的KI溶液和 0.10mol· L-1的AgNO3溶液混合所得溶胶的 聚沉能力相同吗?
2- PO 3Cl SO…….? 反离子 4 4
第五章 胶体
第二节 溶胶
临界聚沉浓度(mmol· L-1 ):
均相
1~ 100nm
缔合 胶体 乳状液 悬浮液
非 均 相
> 100nm
粗粒 分散系
第五章 胶体
第一节 分散系概述
二、胶体分散系 分散相粒子大小在1~100nm 溶胶 高分子溶液 缔合胶体
第五章 胶体
第一节 分散系概述
溶胶:由许多数目巨大的粒子(原子、分子或小 离子)形成的聚集体分散于液体中形成的分散体 系,是高度分散的非均相系统,属热力学不稳定 体系。 多相性 热力学不稳定
d>>λ d<<λ
反 射
透 射
d接近于λ
乳光
强度的 散射- Tyndall
分散系分类及特征
分散相粒子大小 (直径) <1nm 分子(离子) 分散系 真溶液 性质
1 nm =10-9 m
分散相
胶体高考知识点总结

胶体高考知识点总结胶体是我们高中化学课程中的重要一环。
胶体是指由两种或两种以上的物质组成的均匀体系,其中一个物质被分散相(胶体颗粒)分散在另一种物质中的连续相(溶剂)中。
在本文中,我们将重点总结胶体的基本概念、性质、分类、制备和应用等知识点。
一、基本概念1. 分散相和连续相胶体是由两种或两种以上的物质组成的,其中一个物质以颗粒形式分散在另一种物质中。
分散相指的是被分散的颗粒,连续相指的是颗粒所处的介质或溶剂。
2. 胶体颗粒胶体的分散相是由胶体颗粒组成的。
胶体颗粒呈现小、均匀、不可见于肉眼的特点,其粒径一般在1纳米到1微米之间。
3. 胶体稳定性胶体的稳定性是指胶体颗粒保持在溶液中不聚集或沉降的能力。
稳定性主要受到胶体颗粒的表面电荷、吸附层和环境因素的影响。
二、性质1. 光学性质胶体溶液呈现乳白色或半透明状态。
当胶体颗粒尺寸与可见光波长相近时,可散射光线,使溶液呈现乳白色。
2. 过滤性胶体溶液可以通过纸膜过滤,但无法通过常规滤膜。
这是因为胶体颗粒尺寸较小,无法被常规滤膜所阻截。
3. 扩散性胶体溶液具有扩散性,即胶体颗粒可以在溶液中自由扩散,但扩散速度较慢。
三、分类1. 溶胶溶胶是指分散相为固体的胶体体系。
常见的溶胶有胶体金、二氧化硅溶胶等。
2. 凝胶凝胶是指分散相为液体的胶体体系,呈现凝胶状。
凝胶在形成时,分散相之间形成了网状结构,使其呈现固体的性质。
3. 乳胶乳胶是指分散相为液滴的胶体体系。
最典型的乳胶就是牛奶,其中脂肪球是分散相。
4. 泡沫泡沫是指分散相为气体的胶体体系。
泡沫由一个或多个液滴所组成,如肥皂泡。
四、制备1. 机械制备法机械制备法是通过机械作用将固体或液体分散到溶剂中,形成胶体溶液。
常见的机械制备方法有研磨法、乳化法等。
2. 化学制备法化学制备法是通过化学反应将溶质转化为胶体颗粒分散在溶剂中,形成胶体溶液。
常见的化学制备方法有沉淀法、共沉淀法等。
五、应用1. 医药领域胶体在医药领域有广泛的应用,如胶体药物输液、纳米载药系统等。
什么是胶体

什么是胶体胶体是一种物质,由两种或更多种不相溶物质组成,在其中一种物质中分散着微小的、均匀分散的颗粒,称为分散相,而另一种物质中充当分散相的介质称为分散体。
胶体的名称源于希腊语中的“gelos”,意为胶状物质。
胶体的特点是分散相的颗粒尺寸通常在1到1000纳米之间,介于溶液和悬浮液之间。
这些微粒在溶剂中分散稳定,不会立即沉降或聚集,形成一个持续均匀的系统。
胶体是由两种不相溶物质组成的体系,由分散相和分散体组成。
分散相是指颗粒在溶剂中形成的微小粒子,可以是固体、液体或气体。
而分散体是指包裹在分散相周围形成颗粒的物质,可以是液体、固体或气体。
胶体的形成是由于分散体对分散相的作用力和表面能的影响。
分散体可以通过电荷、吸附、溶解度、表面活性剂等方式与分散相相互作用,使得分散相保持分散状态。
在胶体中,分散相的颗粒通常较小,使得它们不会由于重力沉降而分离,而分散体则能够保持颗粒的分散状态。
胶体在自然界中广泛存在,如乳液、乳胶、胶体溶液等。
在生活中,我们经常接触到的一些胶体物质包括牛奶、蛋白质、墨水、泡沫、凝胶等。
胶体不仅存在于自然界中,也有许多应用领域,如制药、食品、涂料、油漆、化妆品、纸张等。
胶体具有一些独特的性质,如光学性质、电导性质、粘性质、流变性质等。
这些性质对于胶体在科学研究和实际应用中具有重要意义。
胶体科学研究着重于探索胶体的结构、性质和相互作用,以及对所涉及的物理、化学和生物学现象的解释和理解。
总结起来,胶体是一种由分散相和分散体组成的体系,在其中分散相的微粒均匀稳定地分散于分散体中。
胶体具有许多独特的性质和广泛的应用领域,对于我们的生活和工业过程具有重要的作用。
胶体

原因二胶体粒子在不停地做布朗运动,与重力作用相同时便形成沉降平衡的状态。
结构根据Fajans规则(能与晶体的组成离子形成不溶物的离子将优先被吸附.优先吸附具有相同成分的离子),胶体粒子是胶团,它又包括胶粒与扩散层,而胶粒又包括胶核与吸附层。
3净水原理化学解释胶体粒子的直径一般在1nm——100nm之间,它决定了胶体粒子具有巨大的表面积,吸附力很强,能在水中吸附悬浮固体或色素形成沉淀,从而使水净化,这就是胶体净水的原理。
能在水中自然形成浓度较大的胶体,并且对水质无明显副作用的物质有KAl(SO4)2·12H2O(明矾)、FeCl3·6H2O等(注:长期饮用明矾净化的水有引发老年痴呆症等疾病的风险),这样的物质被称为净水剂,其形成胶体的化学原理是使其发生水解反应:FeCl3 + 3H2O===△===Fe(OH)3(胶体)+3HCl注:Fe(OH)3胶体呈红褐色,在自来水净化中常用,另外也可用来净化被重金属污染的水源,高效廉价。
2Al3++ 6H2O===(可逆号)===2Al(OH)3(胶体)+6H+凝胶编辑又称冻胶。
溶胶或溶液中的胶体粒子或高分子在一定条件下互相连接,形成空间网状结构,结构空隙中充满了作为分散介质的液体(在干凝胶中也可以是气体,干凝胶也成为气凝胶),这样一种特殊的分散体系称作凝胶。
没有流动性。
内部常含有大量液体。
例如血凝胶、琼脂的含水量都可达99%以上。
可分为弹性凝胶和脆性凝胶。
弹性凝胶失去分散介质后,体积显著缩小,而当重新吸收分散介质时,体积又重新膨胀,例如明胶等。
脆性凝胶失去或重新吸收分散介质时,形状和体积都不改变,例如硅胶等。
由溶液或溶胶形成凝胶的过程称为胶凝作用(gelation)。
水凝胶(Hydrogel)是以水为分散介质的凝胶。
具有网状交联结构的水溶性高分子中引入一部分疏水基团和亲水残基,亲水残基与水分子结合,将水分子连接在网状内部,而疏水残基遇水膨胀的交联聚合物。
胶体定义

定义分散质粒子直径在1nm—100nm之间的分散系;胶体是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系,这是一种高度分散的多相不均匀体系。
编辑本段分类1、按分散剂的不同可分为气溶胶,固溶胶,液溶胶;2、按分散质的不同可分为粒子胶体、分子胶体;编辑本段实例1、烟,云,雾是气溶胶,烟水晶,有色玻璃是固溶胶,蛋白溶液,淀粉溶液是液溶胶;2、淀粉胶体,蛋白质胶体是分子胶体,土壤是粒子胶体;四、胶体的性质:能发生丁达尔现象,聚沉,产生电泳,可以渗析,等性质五、胶体的应用:1、农业生产:土壤的保肥作用.土壤里许多物质如粘土,腐殖质等常以胶体形式存在.2、医疗卫生:血液透析,血清纸上电泳,利用电泳分离各种氨基酸和蛋白质.133、日常生活:制豆腐原理(胶体的聚沉)和豆浆牛奶,粥,明矾净水.4、自然地理:江河人海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉.5、工业生产:制有色玻璃(固溶胶),冶金工业利用电泳原理选矿,原油脱水等.编辑本段胶体的应用胶体在自然界尤其是生物界普遍存在,应用也很广泛。
在金属、陶瓷、聚合物等材料中加入固态胶体粒子,不仅可以改进材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,还可以改进材料的光学性质。
有色玻璃就是由某些胶态金属氧化物分散于玻璃中制成的。
医学上越来越多地利用高度分散的胶体来检验或治疗疾病,如胶态磁流体治癌术是将磁性物质制成胶体粒子,作为药物的载体,在磁场作用下将药物送到病灶,从而提高疗效。
国防工业中有些火药、炸药须制成胶体。
一些纳米材料的制备,冶金工业中的选矿,是有原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体。
编辑本段具体介绍为了回答什么是胶体这一问题,我们做如下实验:将一把泥土放到水中,大粒的泥沙很快下沉,浑浊的细小土粒因受重力的影响最后也沉降于容器底部,而土中的盐类则溶解成真溶液.但是,混杂在真溶液中还有一些极为微小的土壤粒子,它们既不下沉,也不溶解,人们把这些即使在显微镜下也观察不到的微小颗粒称为胶体颗粒,含有胶体颗粒的体系称为胶体体系.胶体化学,狭义的说,就是研究这些微小颗粒分散体系的科学.通常规定胶体颗粒的大小为1~100nm(按胶体颗粒的直径计).小于1nm的几颗粒为分子或离子分散体系,大于100nm的为粗分散体系.既然胶体体系的重要特征之一是以分散相粒子的大小为依据的,显然,只要不同聚集态分散相的颗粒大小在1~100nm之间,则在不同状态的分散介质中均可形成胶体体系.例如,除了分散相与分散介质都是气体而不能形成胶体体系外,其余的8种分散体系均可形成胶体体系.习惯上,把分散介质为液体的胶体体系称为液溶胶,如介质为水的称为水溶胶;介质为固态时,称为固溶胶.由此可见,胶体体系是多种多样的.溶胶是物质存在的一种特殊状态,而不是一种特殊物质,不是物质的本性.任何一种物质在一定条件下可以晶体的形态存在,而在另一种条件下却可以胶体的形态存在.例如,氯化钠是典型的晶体,它在水中溶解成为真溶液,若用适当的方法使其分散于苯或醚中,则形成胶体溶液.同样,硫磺分散在乙醇中为真溶液,若分散在水中则为硫磺水溶胶.由于胶体体系首先是以分散相颗粒有一定的大小为其特征的,故胶粒本身与分散介质之间必有一明显的物理分界面.这意味着胶体体系必然是两相或多相的不均匀分散体系.另外,有一大类物质(纤维素、蛋白质、橡胶以及许多合成高聚物)在适当的溶剂中溶解虽可形成真溶液,但它们的分子量很大(常在1万或几十万以上,故称为高分子物质),因此表现出的许多性质(如溶液的依数性、黏度、电导等)与低分子真溶液有所不同,而在某些方面(如分子大小)却有类似于溶胶的性质,所以在历史上高分子溶液一直被纳入胶体化学进行讨论。
胶体的概念

胶体的概念胶体是一个比较特殊的物理现象,它混合了液体和固体的特性,常常会出现在许多不同的材料系统中。
作为一个粒子集合体,胶体因其特殊的性质而备受关注,因为它们可以在不同的理论模型系统中被用来描述不同的物理现象。
这些描述不仅仅是物理学家在研究各种物理现象时用到的,还可以被应用到工业界,比如涂料、纺织品、食品、医药、建筑等行业。
胶体的概念与它们在多种物理现象中的表现形式有着密切的关系,它们的本质就是粒子团。
这类聚合物中包括液滴、微滴、气囊、油膜等,具有不同的结构特征。
液滴是一种独特的胶体结构,它们具有极小的体积,其表面能够吸附其他物质,导致胶体的特殊物理性质变化。
胶体的性质取决于不同的胶体组分,包括分子大小、形状和构形,以及水的构成和电荷量等方面。
这些不同的构成成分会影响胶体的结构,从而也影响它们的物理性质。
比如说,水的构成会影响胶体的稠度,水的电荷量会影响胶体的电荷属性,而胶体分子尺寸和形状则会影响胶体的流变性质。
此外,胶体性质还和外界因素有关,比如温度、 pH值、释度等。
在一定范围内,随着温度的增加,抗粘度会降低,但超过一定温度后抗粘度又会再次升高;随着稀释度的增加,胶体的粘度也会降低;随着pH值的变化,胶体的流动性也会有明显的变化。
因此,控制外界条件可以调整胶体的性质以满足不同的需求。
胶体是一种多维度的现象,它不仅具有许多特殊的物理性质,而且还受到外部条件的影响,很难把它归纳在一种单一的理论模型中。
迄今为止,学者们已经利用动力学理论和热力学理论来研究胶体所具有的特性,但由于胶体的复杂性,这种研究仍然存在局限性。
因此,胶体的研究需要以多个视角和跨学科理论的方法,来进一步深入和拓展。
总而言之,胶体是一种复杂而特殊的物理现象,它涉及许多不同的材料、物理性质、理论模型和应用领域,为研究人员提供了更多的元素和技术可以探索。
在不断深入研究的过程中,相信胶体的实际应用价值也会变得更加明显,为各行各业带来更多的便利和进步。
胶体

胶体一、定义及分类1、胶体;分散质粒子直径在1nm—100nm之间的分散系;2、按照分散剂状态不同分为:气溶胶:烟,云,雾液溶胶:蛋白溶液,淀粉溶液固溶胶:烟水晶,有色玻璃、水晶二、胶体的性质1、丁达尔现象2,聚沉,3、电泳,4、渗析,5、吸附6、布朗运动三、胶体的制备1、物理法:如研磨(制豆浆,研墨),直接分散(制蛋白质胶体)2、水解法:如向煮沸的蒸馏水滴加FeCl3饱和溶液,得红褐色Fe(OH)3胶体(此法适用于制金属氢氧化物胶体)3.复分解+剧烈震荡法注意:1.不可过度加热,否则胶体发生聚沉,生成Fe(OH)3沉淀2.不可用自来水,自来水中有电解质会使胶体发生聚沉,应用蒸馏水4.FeCl3不能过量,过量的也能使胶体发生聚沉5.书写制备胶体的化学方程式时,生成的胶体不加沉淀符号“↓”6.为了制得浓度较大的胶体,要用FeCl3的饱和溶液,一般不用稀溶液。
7.不能用玻璃棒搅拌,否则会使胶体颗粒碰撞成大颗粒形成沉淀。
四、胶体的鉴别①有丁达尔效应②有电泳现象五:胶体的提纯1、电泳2、渗析(透析)六、应用1.医疗卫生:血液透析,血清纸上电泳利用电泳分离各种氨基酸和蛋白质.2.日常生活:吸尘器、制豆腐原理(胶体的聚沉)和豆浆牛奶,粥明矾净水. 能在水中自然形成浓度较大的胶体,并且对水质无明显副作用的物质有KAl(SO4)2·12H2O(明矾)、FeCl3·6H2O等,这样的物质被称为净水剂,其形成胶体的化学原理是使其发生水解反应:Fe3+ + 3H2O==(有加热符号)Fe(OH)3(胶体)+3H+ Fe(OH)3红褐色Al3+ + 3H2O==(可逆号)Al(OH)3(胶体)+3H+3.自然地理:江河人海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉.4.工业生产:制有色玻璃(固溶胶),冶金工业利用电泳原理选矿原油脱水等.。
七、胶体的电性(1)正电: 一般来说,金属氢氧化物、金属氧化物的胶体粒子带正电荷,如Fe(OH)3 , Al(OH)3 , Cr(OH)3 , H2TiO3 , Fe2O3 , ZrO2 , Th2O3(2)负电: 非金属氧化物,非金属硫化物,金属硫化物的胶体粒子带负电荷,如As2S3 , Sb2S3 , As2O3 , H2SiO3 , Au , Ag , Pt。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、胶体的制备
实验:沸水中滴加饱和氯化铁溶液
D
FeCl 3+ 3H2O Fe(OH)3(胶体) + 3HCl
渗析:使离子、分子从胶体中分离出去 (净化胶体)
胶体与溶液的分离、提纯: ---渗析 ⑴原理:胶粒直径较大不能透过半透膜 ⑵定义:把混有离子或分子杂质的胶体装入半透 膜袋,并浸入溶剂中,使离子或分子从 胶体里分离出去,这样的操作叫做渗析。
> 10 0n m
胶体
水
氢氧化铁
大分子或 1- 100nm 均一稳定 分子离子 的集合体
澄 清 透 明 分 子 、 <1nm 均一稳定 离子
溶液
水
硝酸钾
一、胶体
胶体:分散质微粒直径在1~100nm之 间的分散系。
胶体的分类:
按照分散剂的状态不同可分为 液溶胶 分散剂为液体 气溶胶 分散剂为气体(云、雾、烟) 固溶胶 分散剂为固体(有色玻璃、烟水晶)
• 胶体微粒(胶粒)具有吸附能力,
能吸附溶液中的离子使胶粒带电。
例如:氢氧化物、金属氧化物胶粒
易吸附阳离子——带正电; 硅酸、
硫化物、非金属氧泳
原因:带电的胶体微粒在电场作用下 发生了定向移动。
4、胶体的凝聚
原因:当破坏胶体微粒原来带有相同电 荷的特点时,就会使它从不容易 凝聚的状态变成聚集状态而沉淀 胶体凝聚的方法: ⑴加电解质溶液 (2)加带相反电荷的胶体 (3)加热
胶 体
分散系:由一种(或几种)物质的微粒
分散于另一种物质里形成的混
合物。
分散质:分散系中分散成微粒的物质。 分散剂:分散系中微粒分散在其中的物质。
分散系
悬浊液
分散剂
水
分散质
沙子
特征
浑浊,静 置后分层
分散质微 分散质微 粒 粒直径
固体 小颗粒 > 100nm
乳浊液
水
油
浑 浊 , 静 小液滴 置后分层
四、胶体的应用
* 豆腐的制作 * 盐碱地保肥能力差
* 三角洲的形成
思考题:
在氢氧化铁胶体中逐滴加入稀硫酸, 会产生什么现象?
布朗运动
1、微观解释
2、微粒路径
布朗运动
微粒路径
注 ⑴胶体提纯时要多次渗析。 意
⑵通过验证溶剂中是否有含有杂质离子或分子 检验胶体是否提纯完全。
---过滤
胶体与悬浊液的分离
渗析示意图
三、胶体的重要性质
1、丁达尔现象
原因:胶体粒子较大(1~100nm),对 光具有 散射作用,光在胶体的通路中出现 一条明亮的光带。
2、布朗运动
原因:胶体微粒受分散剂分子不停的、无 规则的撞击,形成不停的、无秩序的 运动。
