乙二胺四乙酸二钠盐标准滴定液
5 EDTA-2Na滴定液标配操作规程

乙二胺四乙酸二钠滴定液配标操作规程一、目的:建立乙二胺四乙酸二钠滴定液的配标操作规程,规定了乙二胺四乙酸二钠滴定液的配制、标定操作内容、方法与要求。
二、范围:适用于乙二胺四乙酸二钠滴定液(0.05mol/L)的配制和标定操作三、编定依据:《中国药典》2010年版二部附录、《中国药品检验标准操作规程》2010年版四、职责:质量保证部质保室及质量检测中心对实施本规程负责五、内容:1.仪器与用具高温炉、电子天平、瓷坩埚、锥形瓶(250m1)、研钵、量筒(1000m1)、酸式滴定管(50.0m1)、取样勺、称量瓶、具塞玻璃瓶(2000m1)2.试药与试液2.1乙二胺四乙酸二钠(AR)2.2氧化锌(基准试剂)2.3 0.025%甲基红的乙醇溶液、铬黑T指示剂2.4 氨-氯化铵缓冲液(pH10.0)2.5稀盐酸2.6氨试液3.配制3.1分子式:C10H14N2Na2O8·2H2O 分子量:372.243.2欲配浓度:18.61g →1000ml。
3.3操作:乙二胺四乙酸二钠滴定液(0.05mol/L) 取乙二胺四乙酸二钠19g,加适量的水使溶解成1000ml,摇匀。
4.标定与复标4.1原理ZnO + 2HCl→ ZnCl2+ H2O←Zn 2+ + HIn 2-→ZnIn - + H +←Na 2Y 2-+Zn 2+ →ZnY 2- +2Na +←Na 2Y 2-+ ZnIn - → ZnY 2- + Na 2In - ←(紫色) (纯蓝色)4.2操作方法 4.2.1乙二胺四乙酸二钠滴定液(0.05mol/L):取于约800℃灼烧至恒重的基准氧化锌0.12g ,精密称定,加稀盐酸3ml 使溶解,加水25ml ,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml 与氨-氯化铵缓冲液(pH10.0)10ml ,再加铬黑T 指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正,每1ml 乙二胺四乙酸二钠滴定液(0.05mol/L )相当于4.069mg 的氧化锌。
乙二胺四乙酸二钠标准滴定溶液
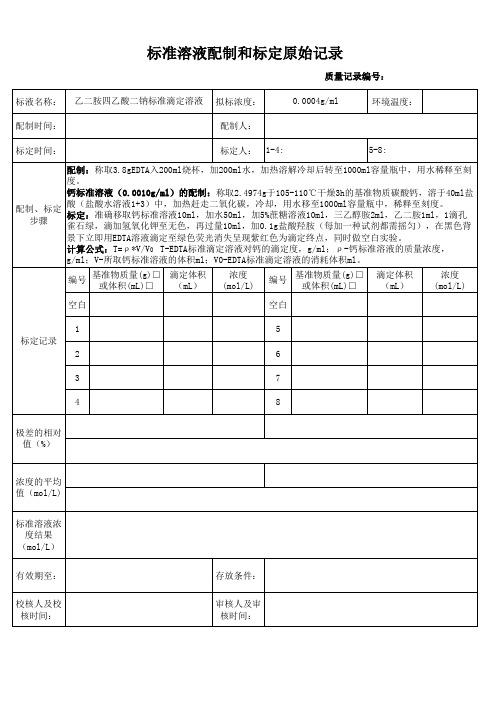
浓度的平均 值(mol/L) 标准溶液浓 度结果 (mol/L) 有效期至: 校核人及校 核时间: 存放条件: 审核人及审 核时间:
标准溶液配制和标定原始记录
质量记录编号: 标液名称: 配制时间: 标定时间: 乙二胺四乙酸二钠标准滴定溶液 拟标浓度: 配制人: 标定人: 1-4: 5-8: 0.0004g/ml 环境温度:
配制:称取3.8gEDTA入200ml烧杯,加200ml水,加热溶解冷却后转至1000ml容量瓶中,用水稀释至刻 度。 钙标准溶液(0.0010g/ml)的配制:称取2.4974g于105-110℃干燥3h的基准物质碳酸钙,溶于40ml盐 酸(盐酸水溶液1+3)中,加热赶走二氧化碳,冷却,用水移至1000ml容量瓶中,稀释至刻度。 配制、标定 标定:准确移取钙标准溶液10ml,加水50ml,加5%蔗糖溶液10ml,三乙醇胺2ml,乙二胺1ml,1滴孔 步骤 雀石绿,滴加氢氧化钾至无色,再过量10ml,加0.1g盐酸羟胺(每加一种试剂都需摇匀),在黑色背 景下立即用EDTA溶液滴定至绿色荧光消失呈现紫红色为滴定终点,同时做空白实验。 计算公式:T=ρ *V/V0 T-EDTA标准滴定溶液对钙的滴定度,g/ml;ρ -钙标准溶液的质量浓度, g/ml;V-所取钙标准溶液的体积ml;V0-EDTA标准滴定溶液的消耗体积ml。 编号 空白 1 标定记录 2 3 4 极差的相对 值(%) 6 7 8 基准物质量(g)□ 滴定体积 或体积(mL)□ (mL) 浓度 (mol/L) 编号 空白 5 基准物质量(g)□ 或体积(mL)□ 滴定体积 (mL) 浓度 (mol/L)
乙二胺四乙酸二钠滴定液的配制及标定作业指导书

EDTA-2Na滴定液的配制及标定作业指导书1.目的正确配制/标定EDTA-2Na标准滴定液。
2.适用范围适用于公司实验室用EDTA-2Na滴定溶液的配制及标定操作指导。
3.职责3.1品控员负责试验室滴定溶液的配制。
3.2品控工程师负责对配制结果的审核。
3.3品控经理对本文件的有效性负责。
4.定义无5.程序5.1 原理ZnO+2HCl→ ZnCl2+ H2OZnCl2+Na2H2Y+2NH4OH→ Na2ZnY + 2NH4Cl +2H2OCaCO3+ 2HCl→ CaCl2+CO2+H2OCaCl2+ Na2H2Y +2NaOH→Na2CaY+2NaCl+2H2O式中Y=((COOCCH2)2NCH2CH2N(CH2COO)2)4-5.2 仪器分析天平(0.1mg)、 1000ml容量瓶、250ml容量瓶、1000 ml试剂瓶、250ml 锥形瓶、500ml锥形瓶、500ml烧杯、100ml烧杯。
5.3 试剂EDTA-2Na、铬黑T指示剂、工作基准试剂氧化锌(ZnO)、工作基准试剂碳酸钙(CaCO3)、甲基红指示剂、氨-氯化铵缓冲液(pH≈10)、氨水溶液(10%)、盐酸溶液(20%)、钙指示剂。
5.4配制5.4.1 0.05mol/L EDTA-2Na滴定液:称取20.0 g EDTA-2Na ,加1000 mL 水,加热溶解,冷却,摇匀。
5.4.2 0.02mol/L EDTA-2Na滴定液:称取 8.0 g EDTA-2Na ,加1000 mL 水,加热溶解,冷却,摇匀。
5.4.3 0.01 mol/L EDTA-2Na 滴定液: 在分析天平上称取 3.723±0.004 g EDTA-2Na 溶于500ml RO 水中,转移至1000 ml 容量瓶中,稀释至刻度,摇匀。
5.4.4 0.002 mol/L EDTA-2Na 滴定液: 吸取200 ml已标定准确浓度的0.01 mol/L EDTA-2Na滴定液至1000ml容量瓶中,稀释至刻度,摇匀。
EDTA标准溶液的配制和标定

EDTA标准溶液的配制和标定(2010-02-25 16:56:19)转载▼标签:杂谈实验原理2.1 乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,常温下其溶解度为0.2g·L-1,在分析中不适用,通常使用其二钠盐配制标准溶液。
乙二胺四乙酸二钠盐的溶解度为120g·L-1,可配成0.3mol·L-1以上的溶液,其水溶液pH=4.8,通常采用间接法配制标准溶液。
标定EDTA溶液常用的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Hg、Ni、Pb。
等。
通常选用其中与被测组分相同的物质作基准物,这样滴定条件较一致。
EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量,则宜用CaCO3为基准物。
首先可加HCl溶液与之作用,其反应如下:CaCO3+2HCl═CaCl2+H2O+CO2↑然后把溶液转移到容量瓶中并稀释,制成钙标准溶液。
吸取一定量钙标准溶液,调节酸度至pH≥12,用钙指示剂作指示剂以EDTA滴定至溶液从酒红色变为纯蓝色,即为终点,其变色原理如下:钙指示剂(常以H2Ind表示)在溶液中按下式电离:H3Ind═2H++HInd2-在pH≥12溶液中,HInd2-与Ca2+离子形成比较稳定的络离子,反应如下:HInd2-+Ca2+═CaInd-+H+纯蓝色酒红色所以在钙标准溶液中加入钙指示剂,溶液呈酒红色,当用EDTA溶液滴定时,由于EDTA 与Ca2+离子形成CaInd-络离子更稳定的络离子,因此在滴定终点附近,CaInd-络离子不断转化为较稳定的CaY2-络离子,而钙指示剂则被游离了出来,其反应可表示如下:CaInd-+H2Y2-═CaY2-+ HInd2-+H2O由于CaY2-离子无色,所以到达终点时溶液由酒红色变成纯蓝色。
用此法测定钙,若Mg2+离子共存(在调节溶液酸度为pH≥12时,Mg2+离子将形成Mg(OH)2沉淀),此共存的少量Mg2+离子不仅不干扰钙的测定,而且会使终点比Ca2+离子单独存在时更敏锐。
EDTA溶液的配制与标定

8-1 EDTA 溶液的配制与标定实验8-1 EDTA 溶液的配制与标定一、仪器与试剂酸式滴定管、锥形瓶、烧杯、移液管、分析天平20%盐酸、10%氨水、氨—氯化铵缓冲液(PH=10)、铬黑T 混合指示剂,乙二胺四乙酸二钠,基准ZnO 二、EDTA 标准溶液的配制乙二胺四乙酸简称EDTA ,难溶于水,通常用乙二胺四乙酸二钠盐(Na 2H 2Y·H 2O )进行配制。
称取40g 的乙二胺四乙酸二钠,加热溶于1000ml 水中,冷却,摇匀。
三、基本原理乙二胺四乙酸二钠标准溶液主要采用间接法制备,国标规定以氧化锌基准试剂标定。
标定以氨—氯化铵缓冲液控制PH=10,采用铬黑T (EBT )做指示剂:22Zn HIn ZnIn H +--++→+当滴加EDTA 时,溶液中游离的Zn 2+首先与EDTA 阴离子进行配位反应:2222Zn H Y ZnY 2H +--++→+溶液仍为ZnIn -酒红色,到达计量点时,稍过量的EDTA 便夺取ZnIn -中的Zn 2+,释放出指示剂呈兰色,为滴定终点。
2222ZnIn H Y ZnY HIn H ----++→++(酒红色) (兰色)四、标定步骤称取0.25g 于800℃灼烧至恒重的基准氧化锌,称准至0.0001g 。
用少量水湿润,加2mL20%的盐酸溶液使样品溶解,加10mL 水,用10%氨水溶液中和至PH7~8(出现白色浑浊),加10mL氨—氯化铵缓冲液(PH=10)及少量铬黑T指示剂(固体),溶液呈酒红色。
用配制好的乙二胺四乙酸二钠[c(EDTA)=0.1mol/L]滴定至溶液经紫色变为纯蓝色。
同时作空白试验。
五、数据记录六、计算乙二胺四乙酸二钠标准溶液浓度按下式计算c(EDTA)=m/(V1-V2)×0.08138式中:c(EDTA)——乙二胺四乙酸二钠标准溶液之物质的量的浓度,mol/L;m——氧化锌之质量,g;V1——乙二胺四乙酸二钠溶液之用量,mL;V2——空白试验用乙二胺四酸二钠之用量,mL;0.08138——与1.00mL乙二胺四乙酸二钠标准溶液[C(EDTA)=1.000mol/L]相当的以克表示的氧化锌的质量。
EDTA标准溶液的配制与标定

EDTA标准溶液的配制与标定一、实验目的1.学习EDTA标准溶液的配制及标定方法。
2.掌握络合滴定的原理,了解络合滴定的特点。
二、实验原理乙二胺四乙酸(简称EDTA,常用H4Y表示)难溶于水,在常温下其溶解度为0.2g/L(约0.0007mol . L-1),在分析中通常使用其二钠盐配制标准溶液。
乙二胺四乙酸二钠盐的溶解度为120g. L-1,可配成浓度为0.3mol . L-1的溶液,其水溶液pH≈4.8,通常采用间接法配制标准溶液。
标定EDTA溶液常采用的基准物有Zn、ZnO、CaCO3、Bi、Cu、MgSO4·7H2O、Ni、Pb等。
通常选用其中与被测物组分性质相近的物质作基准物,这样滴定条件较一致,可减小误差。
标定EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量,则适用CaCO3为基准物,首先可加HCI溶液,其反应如下:CaCO3 + 2HCl= CaCl2+ CO2↑+ H2O然后把溶液转移到容量瓶中并稀释,制成钙标准溶液。
吸取一定量钙标准溶液,调节酸度至pH≥12,用钙指示剂,以EDTA溶液滴定至溶液由酒红色变纯蓝色,即为终点。
其变色原理如下:钙指示剂(常以H3Ind表示),在水溶液中按下式解离:H3Ind=2H+ + HInd2-在pH≥12的溶液中HInd2-离子与Ca2+离子形成比较稳定的配离子,其反应如下:HInd2- + Ca2+ = CaHInd- + H+EDTA溶液若用于测定Pb2+、Bi+离子,则宜以ZnO或金属锌为基准物,以二甲酚橙为指示剂。
在pH≈5~ 6的溶液中,二甲酚橙指示剂本身显黄色,与Zn2+ 离子的配合物呈紫红色。
EDTA与Zn2+离子形成更稳定的配合物,因此用EDTA溶液滴定至近终点时,二甲酚橙被游离了出来,溶液由紫红色变为黄色。
在本实验中,以锌粉为基准物,进行EDTA溶液的标定。
三、实验仪器与药品乙二胺四乙酸二钠盐、锌片(纯度为99.99%)、200g/L六亚甲基四胺溶液、二甲酚橙指示剂、盐酸(1:1)、分析天平、电炉、酸式滴定管、25ml移液管、250ml容量瓶、常用玻璃仪器若干四、实验内容与步骤1.EDTA标准溶液的配制:用电子天平称取1.9g乙二胺四乙酸二钠盐于250ml烧杯中,加100ml蒸馏水溶解,随后将烧杯放置于电炉上,边加热边搅拌,待溶液冷却至室温后,将溶液引流至细口瓶,用量筒量取500ml蒸馏水并倒入部分蒸馏水洗涤烧杯,洗涤的溶液和量筒中剩余的蒸馏水全部转移至细口瓶中。
乙二胺四乙酸二钠标准滴定溶液的配制与标定方法

乙二胺四乙酸二钠标准滴定溶液的配制与标定方法
(C(1/2EDTA)= 0.1 mol/l
1.主题内容与适用范围
本标准编写了EDTA标准滴定溶液的量浓度为0.1 mol/l时的配制和标定方法。
本标准适用于EDTA标准滴定溶液的量浓度为0.1 mol/l时的配制和标定。
2.配制
2.1称取93 g乙二胺四乙酸二钠,溶于5000 ml离子交换水中。
2.21:1的盐酸溶液:10 ml浓盐酸注入10 ml离子交换水中。
2.3氨-氯化铵缓冲溶液的配制:称取20 g氯化铵,溶于500 ml水中,加100 ml
分析纯浓氨水稀释至1000 ml。
3.标定
3.1标定原理
M2+ + H2Y2- = MY2- +2H+
3.2标定方法
基准锌粒先用1:1盐酸洗涤,然后用离子交换水洗去盐酸,再用丙酮冲洗后,于110 o C下烘数分钟,冷却后精确称取3.2690 g锌粒于干燥的烧杯中,加20 ml 浓盐酸溶解后移入1000 ml容量瓶中,以离子交换水稀至刻度。
用移液管准确移取20 ml锌基准液于250 ml三角瓶中,加10 ml氨缓冲液(pH = 10)再加少许
固体铬黑T指示剂,摇匀,用乙二胺四乙酸二钠溶液滴定至溶液由紫色变纯蓝
色为终点。
3.3标定结果的计算
C(EDTA)= V×C V1
式中:
V为锌基准溶液的用量,ml;
V1为乙二胺四乙酸二钠溶液的用量,ml;
C为锌基准溶液的量浓度,mol/l。
4.注意事项
平行试验间的相对误差不得大于±0.3%。
EDTA标准溶液(0.05molL)的配制与标定

实验EDTA标准溶液(0.05mol/L)的配制与标定一、实验目的掌握EDTA标准溶液配制和标定的方法。
二、实验原理EDTA标准溶液常用乙二胺四乙酸的二钠盐(EDTA·2Na·2H2O=372.24)配制。
EDTA·2Na·2H2O是白色结晶粉末,可以制成基准物质,但一般不直接用EDTA配制标准溶液,而是先配制成大致浓度的溶液,然后以ZnO或Zn为基准物标定其浓度。
滴定在pH≈10的条件下进行,以铬黑T为指示剂,溶液由紫红色变为纯蓝色时即为终点。
滴定过程中的反应为:Zn2+ + HIn2-ZnIn- + H+Zn2+ + H2Y2-ZnY2- + 2H+终点时:ZnIn- + H2Y2- ZnY2- + HIn2- + H+(紫红色)(纯蓝色)三、仪器与试剂仪器:分析天平,台秤,50mL碱式滴定管,250mL锥形瓶,20mL移液管,100mL烧杯,10mL量筒,洗耳球,表面皿;试剂:NH3·H2O-NH4Cl缓冲溶液(pH=10.0),6mol·L-1HCl,1:1氨水,纯锌粒,EDTA-Na2(AR) ,铬黑T指示剂。
四、实验步骤1.EDTA标准溶液(0.05mol·L-1)的配制取EDTA·2Na·2H2O约9.5g,加蒸馏水500mL使溶解,摇匀,贮存在硬质玻璃瓶或聚乙烯塑料瓶中。
2.EDTA标准溶液(0.05mol·L-1)的标定以Zn粒为基准物质,用分析天平准确称取纯锌粒0.75~1.00g(准确至0.1mg),置于100mL烧杯中,加6mol·L-l HCl溶液5mL,盖好表面皿,使锌粒完全溶解。
用蒸馏水冲洗表面皿和烧杯内壁,然后将溶液移入250mL容量瓶中,再冲洗表面皿和烧杯内壁数次,冲洗液全部并入容量瓶中,最后加水稀释至刻度,摇匀。
准确移取20mL此溶液,置于锥形瓶中,逐滴加入1:1氨水至开始出现Zn(OH)2白色沉淀,再加NH 3·H 2O-NH 4Cl 缓冲溶液10mL ,加水稀释至约100mL ,加少许铬黑T ,用待标定的EDTA 标准溶液滴定至溶液由红色变为蓝色即为终点。
理化分析中常用滴定液的配制、标定和贮藏方法汇总!

理化分析中常用滴定液的配制、标定和贮藏方法汇总!乙二胺四乙酸二钠滴定液(0.05mol/L) C10H14N2Na2O82H2O=372.24 18.61g1000mL 【配制】取乙二胺四乙酸二钠19g,加适量的水使溶解成1000mL,摇匀。
【标定】取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3mL使溶解,加水25mL,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25mL与氨-氯化铵缓冲液(pH10.0)10mL,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1mL乙二胺四乙酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。
依据本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
【贮藏】置玻璃塞瓶中,避开与橡皮塞、橡皮管等接触。
四苯硼钠滴定液(0.02mol/L) (C6H5)4BNa=342.22 6.845g1000mL 【配制】取四苯硼钠7.0g,加水50ml振摇使溶解,加入新配制的氢氧化铝凝胶(取三氯化铝1.0g,溶于25mL水中,在不断搅拌下缓缓滴加氢氧化钠试液至pH8~9),加氯化钠16.6g,充分搅匀,加水250mL,振摇15分钟,静置10分钟,滤过,滤液中滴加氢氧化钠试液至pH8~9,再加水稀释至1000mL,摇匀。
【标定】精密量取本液10mL,加醋酸-醋酸钠缓冲液(pH3.7)10mL与溴酚蓝指示液0.5mL,用烃铵盐滴定液(0.01mol/L)滴定至蓝色,并将滴定的结果用空白试验校正。
依据烃铵盐滴定液(0.01mol/L)的消耗量,算出本液的浓度,即得。
本液临用前应标定浓度。
如需用四苯硼钠滴定液(0.01mol/L)时,可取四苯硼钠滴定液(0.02mol/L)在临用前加水稀释制成。
必要时标定浓度。
【贮藏】置棕色玻瓶中,密闭保存。
亚硝酸钠滴定液(0.1mol/L) NaNO2=69.00 6.900g1000mL【配制】取亚硝酸钠7.2g,加无水碳酸钠(Na2CO3) 0.10g,加水适量使溶解成1000mL,摇匀。
SOP-QC标-001-00乙二胺四乙酸二钠滴定液配制与标定操作规程

乙二胺四醋酸二钠滴定液(0.05mol/L)配制与标定操作规程目的:建立乙二胺四醋酸二钠滴定液配制与标定的操作规程。
范围:本法规定了乙二胺四醋酸二钠滴定液(0.05mol/L)配制标定的方法和操作要求;适用于本公司实验用乙二胺四醋酸二钠滴定液(0.05mol/L)的配制、标定与复标。
职责:质检员、QC经理、质量总监对本规程实施负责。
依据:中国药典2015年版四部误差要求:规程:1 试剂、指示剂:1.1 乙二胺四醋酸二钠(AR)1.2 稀盐酸:取盐酸234ml,加水稀释至1000ml,即得。
1.3 0.025%甲基红的乙醇溶液:取甲基红0.025g,加乙醇适量使溶解成100ml,摇匀,即得。
1.4 氨试液:取浓氨溶液400ml,加水使成1000ml,即得。
1.5 氨—氯化铵缓冲液(PH10.0):取氯化铵5.4g,加水20ml溶解后,加浓氨溶液35ml,再加水稀释至100ml,即得。
1.6 铬黑T指示剂:取铬黑T0.1g,加氯化钠10g,研磨均匀,即得。
2基准试剂:2.1 基准氧化锌3仪器与用具3.1 三角烧瓶(200ml)3.2 滴定管(50ml)4 操作步骤:4.1 C10H14N2Na2O8·2H2O=372.24 18.61g→1000ml4.2 配制取乙二胺四乙酸二钠19g,加适量的水使溶解成1000ml,摇匀。
4.3 标定取于约800℃灼烧至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色。
加水25ml 与氨—氯化铵缓冲液(PH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定的结果用空白试验校正。
每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg的氧化锌。
根椐本液的消耗量与氧化锌的取用量,算出本液的浓度,即得。
4.4 计算公式:MF= ×0.05(Vi-Vo) × 4.069式中: M:基准氧化锌的称取量(mg);Vi:滴定所耗胺四乙酸二钠滴定液的体积(ml);Vo:空白试验所耗乙二胺四乙酸二钠滴定液的体积(ml)。
EDTA标准滴定溶液

EDTA标准滴定溶液化学名称:乙二胺四乙酸,简称EDTA,表示式H4Y,结构式为:—COCH2╲H+H+╱CHCOO-N-CH2-CH2-NHOOCH2╱╲CH2COOHEDTA在水中的溶解度很小,通常使用的是乙二胺四乙酸二钠盐,仍简称为EDTA,表示式为Na2H2Y,通常用H2Y2-表示。
日常工作用的乙二胺四乙酸二钠盐含二分子结晶水,简式为:Na2H2Y.2H2O,分子质量为:372.24,可与大多数金属离子形成易溶于水的络合物。
一、制备滴定溶液的任务和过程:目的:确定适合于滴定分析用的标准滴定溶液的准确浓度。
原理:EDTA标准滴定溶液是以络合反应为基础的滴定分析仪器:①电子天平,滴定架,漏斗,滤纸(快速定量)②玻璃仪器:烧杯(500 mL 、400mL 、300mL),广口瓶(20L)量筒(1000mL)三角烧瓶(500mL)洗瓶(500mL)滴定管(50mL),移液管(25mL),药品:乙二胺四乙酸二钠盐(优级纯),Caco3(基准试剂),,CMP混合指示剂,溶液的保存:EDTA溶液贮存于玻璃容器中,能慢慢地与玻璃中的Ca²+生成CaY,使EDTA浓度降低,若贮存于聚乙烯之类的容器中,浓度很少改变。
仪器使用情况:①称量天平,首先要做清洁工作,天平台上和天平上的灰尘要擦净,再将天平内和秤盘(表面皿)用软毛刷扫干净,检查没有灰尘了,校正天平后再进行称量。
②玻璃仪器进行清洗(参考~~~标准),一般情况用洗涤剂洗刷即可。
简单检验方法:将清洗的玻璃仪器倒置时,水流出后,水在玻璃仪器上形成一层均匀的薄膜,不挂水珠或水纹,证明玻璃仪器洗干净。
(使用前用装有一级水的洗瓶冲洗3次待用)二、EDTA标准滴定溶液的配制:⒈清洁校正天平后,在天平上垫一张干净滤纸进行称量,称取5.6gEDTA(乙二胺四乙酸二钠盐).⒉将称好的EDTA(乙二胺四乙酸二钠盐)从滤纸倾倒入清洗干净的玻璃烧杯中(烧杯要用一级水冲洗三次)。
EDTA标准滴定试验

水泥或石灰稳定材料中水泥或石灰剂量测定方法
一、溶液配制:
1、乙二胺四乙酸二钠(EDTA二钠)标准溶液:取37.23gEDTA 二钠(分析纯),用40-50℃的无CO2蒸馏水全部溶解,定溶至1000ml。
2、氯化铵溶液:取500g氯化铵+4500ml蒸馏水,充分振荡,使氯化铵完全溶解。
3、氢氧化钠溶液:取18g氢氧化钠(粒)+2ml三乙醇铵(分析纯)+1000ml蒸馏水,使其全部溶解。
二、试验步骤:
1、取湿料300g放入盛样器,倒入600ml氯化铵溶液,用搅拌棒搅拌3分钟,放置沉淀4分钟,用移液管吸取上层(液面上1-2cm)悬浮液10ml放入锥形瓶内。
2、用量筒量取50ml氢氧化钠溶液倒入锥形瓶内,然后加入钙红指示剂(质量约为0.2g),摇匀,溶液呈玫瑰红色。
3、记录滴定管中EDTA二钠标准溶液的体积V1(以ml计,读至0.1ml),然后用EDTA二钠标准溶液滴定,边滴定边摇匀,并仔细观察溶液的颜色;在溶液颜色变为紫色时,放慢滴定速度,并摇匀;直到纯蓝色为终点,并记录滴定管中的EDTA二钠标准溶液体积V2(以ml计,读至0.1ml)。
计算V1-V2,即为EDTA二钠标准溶液的消耗量。
乙二胺四乙酸二钠盐标准溶液的标定的探讨

X i o n g Z h e n g y u Q i u Y a l i n F a n L u ( C h o n g q i n g Y o n g c h u a n I n s t i t u d e f o r F o o d a n d D r u g C o n t r o 1 )
Ac i d Di s o d i u m S a l t S t a n d a r d Aq u a s
Zh a o Z h ua n g z h i Ya n Ha i y u a n De n g Zh o up e ng Z ha o Yi
赵壮 志 , 等: 乙二 胺 四 乙酸 二 钠 盐 标 准 溶 液 的标 定 的探 讨
一 2 1一
萎 薹 ■函锄圜
鍪 薹 萋 囊 囊 萎 囊 萎 萎 萎 霎 萋 薹 垂 薹 萎 垂 囊
乙 二 胺 四 乙 酸 二 钠 盐 标 准 溶 液 的 标 定 的 探 讨
Ab s t r a c t : At p r e s e n t ,t h e c a l i b r a t i o n o f t h e n a t i o n a l s t a nd a r d GB /T 6 01 —2 0 0 2 Et h y l e n e d i a — mi n e t e t r a a c e t i c a c i d d i s o di u m i s me a s u r e d wi t h z i n c c hl o r i d e. Th e e n d p o i n t o f t h i s me t h o d i s n o t c l e a r i n t h e p r a c t i c a l a p p l i c a t i o n,i t i s d i ic f u l t t o c a l i b r a t e t he t i t r a t i o n s o l u t i o n c o r r e c t l y,a n d t h e r e s u l t i s n o t e a s y t o p a r a l l e 1 .I n t h i s p a p e r,t h e a u t h o r p ut f o r wa r d t h e u s e o f r e f e r e n c e c a l c i u m c a r b o n a t e t o c a l i b r a t e Et h y l e n e d i a mi n e t e t r a a c e t i c a c i d d i s o di u m.Af t e r a n u mb e r o f e x p e r i me n t s , t h i s me t h o d c o u l d a c c u r a t e l y c a l i b r a t e t h e c o n c e n t r a t i o n o f Et h y l e n e d i a mi n e t e t r a a c e t i c a c i d d i s o d i —
滴定液的基本分类

滴定液的基本分类
滴定液的基本分类主要基于其成分和用途。
具体来说,滴定液主要有以下几种类型:
1. 盐酸滴定液:根据用途和浓度的不同,盐酸滴定液可以分为不同的类型。
一般来说,它们可以分为以下几类:
浓度为/L的盐酸滴定液:主要用于化学分析中的酸度滴定,例如氧化还原反应的滴定、中和反应的滴定等。
浓度为/L的盐酸滴定液:主要用于化学实验室中的一般酸度滴定或中和反应。
浓度为1mol/L的盐酸滴定液:通常用于化学实验室中需要高浓度滴定的实验。
2. 乙二胺四醋酸二钠滴定液(/L)、乙醇制氢氧化钾滴定液(/L)、四苯硼钠滴定液(/L)、甲醇钠滴定液(/L)、亚硝酸钠滴定液(/L)等:这些滴定液都用于不同的化学分析实验,如酸度滴定、氧化还原反应滴定等。
3. 草酸滴定液(/L)、氢氧化四丁基铵滴定液(/L)、氢氧化钠滴定液(1mol/L、/L或/L)、重铬酸钾滴定液(/L)、烃铵盐滴定液(/L)、高氯酸滴定液(/L)和高锰酸钾滴定液(/L)等:这些滴定液同样用于不同的化学分析实验,如酸度滴定、氧化还原反应滴定等。
以上信息仅供参考,如有需要,建议咨询专业化学人士。
同时请注意,使用这些化学物质时务必遵守安全操作规程,避免造成对身体的伤害。
配制和标定edta标准溶液浓度时要注意的问题

配制和标定edta标准溶液浓度时要注意的问题edta是乙二胺四乙酸二钠盐的英文缩写,它是一种白色结晶粉末,无臭、无毒、吸湿性小、易溶于水,室温下饱和溶液的浓度约为0.3mol/l。
经过多次的实践证明,配制和标定edta标准溶液时要注意以下几个问题,否则会影响标定edta 标准溶液浓度的准确度。
1、操作中用到的蒸馏水要合格。
即蒸馏水里面不能含有金属离子杂质,否则会影响标定的准确性,有的还会影响终点的观察,如al3+、fe3+等离子会封闭指示剂而有可能看不到滴定终点。
2.操作中使用的所有玻璃仪器应使用合格的蒸馏水清洗。
如果因为不干净而带入杂质,会影响校准结果的准确性。
3.操作中使用的容量仪器,如滴定管、容量瓶、移液管等,应进行校准。
在操作过程中也应进行温度校正。
4、基准物质如zno要在800±50℃的高温炉中灼烧至恒重。
基准物质的溶解要先用少量蒸馏水润湿,以防粉末溅出,再逐滴加盐酸溶液至完全溶解后转移到容量瓶中。
zno溶解可以用电炉加热助溶解,盖上表面皿。
注意控制加热温度,不要使之沸腾,以防zno液溅出,而影响标定的准确度。
5、基准物质溶液的转移要完全,洗涤烧杯≥3次以保证洗涤干净,定容操作要准确和规范,在离刻度线1cm左右要停留2min左右,改用滴管加水至刻度线后摇匀。
6.手术中使用的辅助溶液的浓度应该相对准确。
如果差异较大,有时会影响校准终点的正确判断。
7.滴定管和移液管应彻底润湿和清洗,滴定管应准确估计。
8、移入锥形瓶中的基准物质溶液要先用洗瓶把瓶口粘的溶液冲下,再加其它试剂。
指示剂做一个加一个,这样平行性好,标定出的edta标准溶液的准确度高。
9.滴定终点的确定:标准溶液的配制和标定对分析人员的操作技能、细致性和耐心要求较高,要求分析人员操作规范、熟练,能够正确确定滴定终点。
总之,在配制和标定edta标准溶液中,要特别注意所用蒸馏水的质量、容量仪器的准确性、操作的规范性和熟练性,尽可能把影响edta标准溶液标定的因素都考虑进去,这样标定出的edta标准溶液浓度的准确度是在国家标准允许的误差范围内的。
《分析化学》课件——任务五 EDTA标准溶液的配制与标定

• 乙二胺四乙酸难溶于水,实际工作中通常用它的二钠盐 (Na2H2Y·2H2O)配制标准溶液。乙二胺四乙酸二钠盐(也简称EDTA) 是白色微晶粉末,易溶于水,经提纯后可作基准物质直接配制标 准滴定溶液,但提纯方法较复杂。配制溶液时,由于蒸馏水的质 量不高也会引入杂质,因此实验室中使用的标准滴定溶液一般采 用间接法配制。
3.标定方法
• 在pH=4~12时Zn2+均能与EDTA定量配 位,多采用如下方法:
• ①在pH=10的NH3-NH4Cl缓冲溶液中, 以铬黑T为指示剂,直接标定。
• ②在pH=5的六亚甲基四胺缓冲溶液中, 以二甲酚橙为指示剂,直接标定。
2.标定的条件
• 为了使测定结果具有较高的准确度,标定的条件与测定的条件应尽可能相同。在可能 的情况下,最好选用被测元素的纯金属或化合物为基准物质。这是因为不同的金属离 子EDTA反应完全的程度不同,允许的酸度不同,因而对结果的影响也不同。如Al3+与 EDTA的反应,在过量EDTA存在下控制酸度并加热,配位率也只能达到99%左右,因 此要准确测定Al3+含量最好采用纯铝或含铝标样标定EDTA溶液,使误差抵消。又如, 由实验用水中引入的杂质(如Ca2+、Pb2+)在不同条件下有不同影响,在碱性中滴定时两 者均会与EDTA配位,在酸性溶液中只有Pb2+与EDTA配位,在强酸溶液中则两者均不 与EDTA配位。因此,若在相同酸度下标定和测定,这种影响就可以被抵消。
实验目的:EDTA标准滴定溶液的配制
一、EDTA标 准滴定溶液
的配制
二、EDTA标 准滴定溶液
的标定
一、EDTA标准滴定溶 液的配制
1.配制方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙二胺四乙酸二钠盐标准滴定液
乙二胺四乙酸二钠盐标准滴定液
1.1.配制
按表12的规定称取乙二胺四乙酸二钠盐,加1000ml水,加热溶解,冷却,摇均。
表 12
乙二胺四乙酸二钠盐标准滴定液的浓度 C(EDTA)/mol/L 乙二胺四乙酸二钠盐的质量m/g
0.1 40
0.05 20
0.02 8
1.2.标定
1.2.1.
乙二胺四乙酸二钠盐标准滴定液的浓度 C(EDTA)=0.1mol/L C (EDTA)=0.05mol/L
按表13的规定称取于800℃±50℃的高温烘灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加2毫升盐酸溶液(20%)溶解,加100毫升水。
用氨水溶液(10%)调节溶液PH至7~8,加10毫升胺氯化铵缓冲溶液甲(PH≈10)及铬黑T指示液(5g/L)用配制好的乙二胺四乙酸二钠盐溶液滴定至溶液由紫色变为纯蓝色。
同时做空白试验。
表 13
乙二胺四乙酸二钠盐标准滴定液的浓度 C(EDTA)/mol/L 工作基准试剂氧化锌的质量m/g
0.1 0.3
0.05 0.15
乙二胺四乙酸二钠盐标准滴定液的浓度C(EDTA),数值以摩尔每升(mol/L)表示,按式(18)计算:
(18)
式中:
m-----氧化锌的质量的准确数值,单位为克(g);
V1---乙二胺四乙酸二钠盐溶液的体积的数值,单位是毫升(mL);
V2---空白试验乙二胺四乙酸二钠盐溶液的体积的数值,单位是毫升(mL);
M--- 氧化锌的摩尔质量的数值,单位为克没摩尔(g/mol)[M (ZnO)=81.39]。
1.2.2.
乙二胺四乙酸二钠盐标准滴定液的浓度 C(EDTA)=0.02mol/L 称取42g于800℃±50℃的高温烘灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加3毫升盐酸溶液(20%)溶解,移入250毫升容量瓶中,稀释至刻度。
摇均。
取35.00~40.00毫升,加70毫升水,用氨水溶液(10%)调节溶液PH至7~8,加10毫升胺氯化铵缓冲溶液甲(PH≈10)及5滴铬黑T指示液(5g/L),用配制好的乙二胺四乙酸二钠盐溶液滴定至溶液由紫色变为纯蓝色。
同时做空白试
验。
乙二胺四乙酸二钠盐标准滴定液的浓度C(EDTA),数值以摩尔每升(mol/L)表示,按式(19)计算:
(19)
式中:
m-----氧化锌的质量的准确数值,单位为克(g);
V1---氧化锌溶液的体积的准确数值,单位是毫升(mL);
V2---乙二胺四乙酸二钠盐溶液的体积的数值,单位是毫升(mL);
V3---空白试验乙二胺四乙酸二钠盐溶液的体积的数值,单位是毫升(mL);
M--- 氧化锌的摩尔质量的数值,单位为克没摩尔(g/mol)[M(ZnO)=81.39]。
秋雨工作室朱玺瑜
2011年10月28日。
