第10章 酶的作用机制和酶的调节 生物化学课件(王镜岩版)
《生物化学》酶的作用机制和酶的调节

side view
胃蛋白酶原
在pH5.0以下断裂 切去44个氨基酸片断
胃蛋白酶
溶菌酶
必需基团
酶的活性中心往往只是包括酶蛋白的几个氨基酸残 基,而对于活性中心以外的氨基酸残基,并非是可有可无 的,有些氨基酸残基也是酶表现催化活性所必需的,称为 必需基团。因此酶的活性中心属于必需基团的一部分,必 需基团还包括其它一些对酶活性必需的氨基酸残基。
(五)金属离子催化
1、需要金属的酶分类 (1)金属酶 含紧密结合的金属离子,多属于过渡金 属离子如,Fe2+、Fe3+、Cu2+、Zn2+、 Mn2+或Co3+。 (2)金属-激活酶 含松散结合的金属离子,通常为碱和碱 土金属离子,如Na+、K+、Mg2+或Ca2+。
(五)金属离子催化
2、金属离子以三种主要途径参加催化过程: (1)通过结合底物为反应定向 (2)通过可逆的改变金属离子的氧化态调 节氧化还原反应 (3)通过静电稳定或屏蔽负电荷
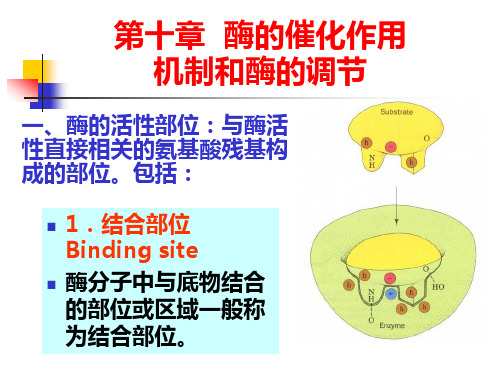
(一)酶活性部位的特点
1、活性部位在酶分子的总体中只占相当小的部分。 2、酶的活性部位是一个三维实体。 3、酶的活性部位并不是和底物的形状正好互补的,而 是在酶和底物结合的过程中,底物分子或酶分子, 有 时是二者构象同时发生变化后才互补的。 (诱导 契合学说)。 4、酶的活性部位位于酶分子表面的一个裂缝内,底物 分子结合到裂缝内并发生催化作用。 5、底物通过次级键较弱的的力结合到酶上。 6、酶活性部位具有柔性或可运动性。
广义酸基团 (质子供体) 广义碱基团(质子受体)
(四)共价催化(covalent catalysis)
共价催化又称亲核催化或亲电子催化,在催化时, 亲核催化剂或亲电子催化剂能分别放出电子或汲 取电子并作用于底物的缺电子中心或负电中心,迅 速形成不稳定的共价中间复合物,降低反应活化能, 使反应加速。
王镜岩高级生物化学 酶的作用机制和酶的调节
H2N
补:酶的调节部位 Regulatory site
某些酶分子中存在着一些可以与其他分子发生 某种程度的结合的部位,从而引起酶分子空间 构象的变化,对酶起激活或抑制作用。
酶催化作用的本质
酶催化作用的本质是酶的活性中心与底 物分子通过短程非共价力(如氢键,离子 键和疏水键等)的作用,形成E-S反应中 间物。 其结果使底物的价键状态发生形变或极 化,起到激活底物分子和降低过渡态活 化能作用。
肠激酶
-
-胰凝乳蛋白酶活性 最高,但不稳定 -胰凝乳蛋白酶稳定, 活性只有的40%
胃蛋白酶的激活
思考
机体为会么先产生酶原后再经过剪切加 工形成活性酶,为会么不直接产生活性 酶,其生理意义何在?
(三)可逆的共价修饰
1、共价调节酶:可被共价修饰而改变酶活 性。 2、可逆的共价修饰:通过其它酶对其多肽 链上某些基团进行可逆的共价修饰,使酶 处于活性与非活性的互变状态,从而调节 酶活性。 3、例如:蛋白激酶通过蛋白磷酸化和去磷 酸化来失现酶活性与非活性的互变。
非常 保守
胰凝乳蛋白酶上的催化基团
(胰凝乳蛋白酶)
胰凝 乳蛋 白酶 催化 反应 的详 细机 制
三、酶活性的调节控制
(一)别构调控 1、别构调节:酶分子的非催化部位与某些 化合物可逆地非共价结合后发生构象的改 变,进而改变酶活性状态的作用。 2、别构酶:具有上述这种调节作用的酶。 3、效应物:能使酶分子发生别构作用的物 质。可分为正效应物(别构激活剂)和负 效应物(别构抑制剂)。 *ATCase, 3-磷酸甘油醛脱氢酶
习题
* 关于别构酶,正确的表达是 A、它们一般是寡聚酶 B、它们一般是单体酶 C、当效应剂与别构酶非共价结合后,引起别构效应。 D、当效应剂与别构酶共价结合后,引起别构效应。 E、别构酶的动力学性质符合米氏方程式。 F、别构酶的动力学性质不符合米氏方程式。 下列哪一个酶的催化活性需要金属离子? A、溶菌酶 B、羧肽酶 C、胰凝乳蛋白酶 D、胰蛋白酶 胰蛋白酶属单体酶。 别构酶动力学曲线的特点都是呈S形曲线。 酶活性中心是亲水的介电区域。 溶菌酶的实现催化功能需金属离子Mg2+参与。 4、 简述酶活性调控的几种机制。 同工酶有何生理意义?
第10章酶的作用机制和酶的调节

第10章酶的作用机制和酶的调节第10章酶的作用机制和酶的调节教学目的:掌握酶的活性部位结构与功能、酶活性的别构调节、酶原激活,了解酶高效性原因教学重点:酶活性部位的结构与功能及酶的活性的别构调节教学难点:酶活性的别构调节教学方法:多媒体教学内容:一、酶的活性部位及确定方法(一)酶活性部位概念及特点1、酶的活性中心(活性部位):指酶分子中的表面有一个必需基团比较集中、并构成一定空间结构的微小区域。
酶活性中心的基团,按其功能可分为结合基团和催化基团。
活性中心的基团都是维持酶活性的必需基团,2、酶活性部位的共同点:(1)酶活性部位仅占酶体积的很小一部分,通常只占整个酶分子体积的1~2%,酶分子是大分子物质,由很多氨基酸构成,而活性部位仅由几个氨基酸残基组成催化部位一般由2~3个氨基酸残基组成。
结合部位氨基酸残基数目,不同的酶有所不同。
可能是一个,也可能是多个。
(2)酶的活性部位具有三维结构,构成酶活性中心的基团,可位于同一条肽链上,也可位于不同的肽链上,在一级结构上可能相距甚远,但在空间结构上位置必须相互靠近;酶的空间结构受物理或化学因素影响时,酶的活性部位可能会遭破坏,酶会失活。
(3)活性中心的结合基团与底物专一性结合,这需要活性部位的基团精确排列。
活性部位具有一定的柔韧性,活性部位的结构并不是与底物的结构正好互补。
在酶与底物结合过程中,酶活性中心的构象在底物的诱导下可发生形变,然后嵌合互补形成中间产物,而底物在酶活性中心的诱导下也可发生形变,变的易与酶结合,有时是两者的构象同时发生变化后才互补契合(诱导契合学说)。
(4)酶活性部位位于酶分子表面的一个裂缝内,底物分子或底物分子的一部分结合到裂缝中,裂缝内的非极性基团较多,形成一个疏水环境,提高与底物的结合能力,也有极性的氨基酸残基,以便与底物结合并催化底物发生反应。
(5)底物通过较弱的次级键与酶结合。
组成酶活性中心的氨基酸残基,常见的有:组氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、半胱氨酸和酪氨酸3、研究酶活性部位的方法(1)共价修饰(2)亲和标记法(3)切除法(4)X射线晶体结构分析法二、酶促反应机制(一)基元催化的分子机制:酶的催化作用包括若干基元催化。
酶的作用机制和酶活性的调节.ppt

O
O
HH
HH33CC
CC OO
OO CC
OO--
+O
O H HH NH
OC HH C HH H
几种常见酶的结构与功能
蛋白酶
• 蛋白酶是催化肽键水解的一类酶的总称。尽管肽键的水解在能量学上 是十分有利的,但如果没有蛋白酶的催化,一个肽键在中性pH和25℃ 条件下大概需要300年~600年的时间才能完成水解。
四面体中间物因肽氧负离子与Ser195以及Gly193之间形成的氢键而得 到稳定,这些相互作用的净效应导致活化能的降低。
肽键断裂,离开基团(原来肽键的氨基一侧作为第一产物)从His57 咪唑环上得到一个质子。原来肽键的羧基一侧通过氢键以及与Ser195形成 的共价键仍然与酶结合。
水进入活性中心,质子化His57使之成为酸。而释放出来的OH-亲核 进攻留下来的多肽羰基碳,于是第二个四面体形的过渡态中间物形成了 。
广义的酸碱催化
溶菌酶Glu35的广义酸催化溶菌酶Biblioteka Glu 35被疏水氨基酸残基所环绕
核糖核酸酶A的广义酸碱催化
静电催化
• 活性中心电荷的分布可用来稳定酶促反应的过 渡态,酶使用自身带电基团去中和一个反应过 渡态形成时产生的相反电荷而进行的催化称为 静电催化。
• 有时,酶通过与底物的静电作用将底物引入到 活性中心。
乳酸脱氢酶催化的酶促反应
What is an isozyme?
(1) Isozymes are physically distinct forms of the same enzyme.
(2) Isozymes may differ from each other by differences in their amino acid sequences or by the presence of different posttranslational modifications in each isozyme.
王镜岩-生物化学I-第9章 酶促反应动力学—第10章 酶的作用机制和酶的调节

V 反 应 初 速 度
V=
V[S] Km + [S]
0
底 物 浓 度 [S]
反应初速度随底物浓度变化曲线
最 大 反 应 速 率
V
V
b.当[S]很大时 V=V[S]/[S]=V
0 级反应
V/2
a.当[S]很小时 V=V[S]/Km 一级反应
0 Km (米氏常数) [S]
混合级
米氏曲线
Km=?
V=
V[S] Km + [S]
②可以判断酶的专一性和天然底物
Km值最小的底物——最适底物/天然底物
1/Km近似表示酶对底物的亲和力: 1/Km越大、亲和力越大
k2>>k3时
Km= k2 + k3 k1
Km≈k2(分离能力)/k1(亲合能力)
E+S k1 k2 ES k3 P+E
Km越小,亲和力越强。
[S]很小时,反应速度就能达到很大。
若 V=V/2
• Km = [S]
V V [S] 1 = 2 Km + [S]
Km + [S] = 2[S]
2、动力学参数的意义
(1)米氏常数Km的意义
V Vmax Vmax/2
Vmax 2
Km
[S]
Vmax[S] = Km + [S]
Km=[S]
∴Km值等于酶促反应速度为最大反应速度一半 时的底物浓度,单位是mol/L。
依据: 能否用透析、超滤等物理方法 除去抑制剂,使酶复活。
1、不可逆抑制作用 :
不 可 逆 抑 制
抑制剂与酶必需基团以牢固的共价键相连 很多为剧毒物质
重金属、有机磷、有机汞、有机砷、
酶的作用机制和调节王镜岩生物化学全

2、 活性部位只有几个氨基酸残基所构成。活性部
位体积只占整个酶分子体积的1%~2%。催化部 位一般只由2~3个氨基酸残基组成。
3、 活性部位是一个三维实体。 活性部位的氨基酸残基在一级结 构可能相距甚远,甚至位于不同 的肽链上,通过肽链的盘绕、折 叠而在空间结构上相互靠近。可 以说没有酶的空间结构,也就没 有酶的活性部位。
Asp102,Ser195, His57
4、 活性部位是会发生形变的,不是和
底物的形状正好互补,而是通过诱导契合结合 。
底物
靠近
定向 酶
诱导
互补性结 构变化
契合
• 5、 活性部位是位于酶分子表面的 一个裂缝内。裂缝内是相当疏水的区域
,非极性基团较多,但在裂缝内也含有 某些极性的氨基酸残基,以便与底物发 生催化作用。
表明,催化能力只局限在酶分子的一定 区域,只有少数特异的氨基酸残基参与 底物结合及催化作用。这些特异的氨基 酸残基比较集中的区域,叫酶的活性部位
结合部位:负责与底物的结合,决定酶的专一性
催化部位:负责催化底物键的断裂形成新键, 决定酶的催化能力。
酶的活性中心与必需基团
1 概念
必需基团:
与酶分子活性有关的基团,若经化 学修饰(如氧化、还原、酰基化、
增加了底物的有效浓度)
•定向效应是指反应物的反应 基团之间或酶的催化基团与底 物的反应基团之间的正确取位 。
二、底物的形变和诱导契合
• 当酶遇到其专一性底 物时,酶中某些基团 或离子可以使底物分 子内敏感键的某些基 团的电子云密度增高 或降低,使敏感键的 一端更加敏感,底物 分子发生形变,底物 比较接近它的过渡态 ,降低了反应活化能 ,使反应易于发生。
烷基化等)使其改变,则酶分子中直接与底物结合,并和 催化作用直接有关的区域
生物化学第10章 酶的作用机理和酶的调节

别够调节可发生在底物-底物、调节物-底物、调节物-调节 物之间,可以是正协同也可以是负协同。
2.别构酶的动力学
别构酶的[S]对V0的动力学曲线不是双曲线,而是S形曲线(正协 同)或表观双曲线(负协同),二者均不符合米氏方程。
定向效应: 底物会诱导酶分子构象改变,使酶活性中心的相 关基团和底物的反应基团正确定向排列,使反应基团之间 的分子轨道以正确方向严格定位,使酶促反应易于进行。
2. 底物的形变(distortion)与诱导契合
当酶遇到其底物时,酶中某些基团或离子可以使底物分子 内敏感键中的某些基团的电子云密度增高或降低,产生“电子 张力”,使敏感键的一端更加敏感,底物分子发生形变,底物 比较接近它的过渡态,降低了反应活化能,使反应易于发生。
[S] (10-4molL-1)
(NAG)2 (NAG)3 (NAG)4 (NAG)5 (NAG)6 (NAG)8
相对水解率
0 1 8 4000 30000 30000
××
ABCDEF
NAG-NAM-NAG-NAM-NAG-NAM
××
NAG-NAG-NAG
NAG-NAG-NAG-NAG NAG-NAG-NAG-NAG-NAG NAG-NAM-NAG-NAM-NAG-NAM
酶与底物给合时构象变化的示意图
3.多元催化和协同效应
在酶催化反应中,几个基元催化反应配合在一起起作用, 如:胰凝乳蛋白酶是通过Asp102, His57,Ser195组成电荷中继网 催化肽键水解,包括亲核和酸碱共同催化共同作用。
4. 活性部位微环境的影响
10 酶的作用机制和酶的调节11-9-1

一、酶的活性部位
概述 (一)酶活性部位的特点 (二)研究酶活性部位的方法
概述
酶分子表现催化活性的关键部位是酶的活性中心 (active center)或活性部位(active site),是 指酶分子中与底物结合并起催化反应的空间部位。 活性部位由2部分组成: ①结合部位:与底物结合的部位,它决定酶的专一性。 ②催化部位:催化底物转化为产物的部位,它决定酶反
肠激酶
胰 缬天天天天赖异缬甘
蛋
白
酶
原
的
激 活
缬天天天天赖
过
程
组
46 丝
S
183
S
S S 胰蛋白酶原 活性中心
缬 异甘组
丝
SS
S S
胰蛋白酶
胰蛋白酶原的激活过程
胰凝乳蛋白酶原激活
胰凝乳蛋白酶原是245个氨基酸组成的一 条多肽链。在激活过程中,从多肽链中 切去2个二肽(14-15,147-148),形成 3个肽段,通过二硫键连接。
二、酶催化反应的独特性质
5、酶除了有进行催化反应所必需的活性部位以外,还有其 他一些特性,使反应更有利的进行。通过以下4点完成:
①在活性部位存在1个以上催化基团,能进行协同催化; ②存在结合部位,与底物具有互补识别功能; ③多底物时,存在多个结合部位; ④酶与底物结合使底物分子中的键产生张力,有利于形 成ES复合物。
溶菌酶 (lysozyme) :
从 P397图10-13可见, NAG和NAM多聚糖链(虚线条)横穿溶菌酶分子。
见P397图10-13
溶菌酶和底物的 复合物
溶菌酶
P396 图10-10
水解N-乙酰氨基葡萄糖(NAG)和N-乙酰氨基葡糖乳酸(NAM)之间的糖苷键
酶的作用机制和酶的调节ppt课件

主 要 是
Ser
Thr
Ca2+ 依赖性 蛋白激酶〔PKC)
六、同工酶〔isoenzyme〕
〔一〕定义: 催化一样的化学反响,但其
蛋白质分子构造、理化性质和免 疫性能等方面都存在明显差别的 一组酶。
〔二〕酶原的激活
酶原(zymogen):酶的无活性的前体
酶原的激活:由无活性的酶原转变为有活 性的酶的过程。
酶原激活的意义:在特定的环境和条件下 发扬作用;防止细胞本身消化;有的酶原可 以视为酶的储存方式。
酶原激活的机理:
酶原 在特定条件下
一个或几个特定的肽键断裂,水解 掉一个或几个短肽
CTP反馈抑制ATCase
O HN
O
COON
H
ATP 别构激活剂 CTP 别构抑制剂
NH2
N
CTP(嘧啶生物合成的终端产物)
O
O
O
O
N
O- P O O-
PO O-
P O H2C O
-
OOH OH
调理亚基 催化亚基
② 3-磷酸甘油醛脱氢酶 具有负协同效应的别构酶代表
〔2〕别构酶的动力学
S形曲线〔正协同〕 表观双曲线〔负协同效应〕
——与酶的催化活性直接相关的化学基团 常见:His咪唑基、Ser-OH、
Gluγ-COOH、Cys-SH、Asp-OH 位于活性中心
必需基团 活性中心以外, 稳定分子构象
非必需基团
活性中心以外 的必需基团
结合基团
底物 催化基团 活性中心
〔二〕 酶活性部位的特点
第10章_酶的作用机制和酶的调节.

活性部位微环境的影响
酶分子表面有一个裂缝,活性部位就 位于疏水环境的裂缝中。 在非极性环境中的介电常数较在水介 质的介电常数低。 在非极性环境中两个带电基团之间的 静电作用比在极性环境中显著增高
胰凝乳蛋白酶
四、酶催化反应机制的实例
溶菌酶(2)
溶菌酶(3)
溶菌酶催化作用
溶菌酶(4)
丝氨酸蛋白酶(7)
催化三联体 底物(一种多肽)
活性部位 疏水口袋
胰凝乳蛋白酶
酶-底物复合物
胰凝乳蛋白酶反应的详细机制
丝氨酸蛋白酶(8)
②
Ser195-OH的O与肽键的羰基C共价结合,H结合于His57的N上
胰凝乳蛋白酶反应的详细机制
丝氨酸蛋白酶(9)
产物1
③
His提供H给肽键的N形成-NH2,肽键断裂,释放第一个产物
研究酶活性部位的方法(1)
1 酶分子侧链基团的化学修饰法 (1)非特异性共价修饰 (2)特异性共价修饰 (3)亲和标记法 2 动力学参数测定法 3 X射线晶体结构分析法
4 定点诱变法
研究酶活性部位的方法(2)
酶分子侧链基团的化学修饰法
用带标记的化合物与酶的活性部位氨基酸残基侧链基团共价结合,然后 水解该酶,分离出带有标签的肽段,即可分析出活性部位的氨基酸残基。
二、酶催化反应的独特性质
(1)酶反应可以分为两类,一类反应仅仅涉及到电子的转移, 另一类反应涉及到电子和质子两者或其他基团的转移 (2)酶的催化作用是由氨基酸侧链上的功能基团和辅酶为媒介的
(3)酶催化反应的最适pH范围通常狭小 (4)与底物相比较,酶分子很大,而活性部位通常只比底物稍大一些 (5)酶除了具有进行催化反应所必需的活性基团外,还有别的特性
生物化学 第10章 酶作用机制和酶调节-精品文档

3、X射线晶体结构分析法
二、影响酶催化效率的有关因素
ห้องสมุดไป่ตู้
底物和酶的邻近效应与定向效应 底物的形变和诱导契合 酸碱催化 共价催化 金属离子催化 多元催化和协同效应 活性部位微环境的影响
(一)底物和酶的邻近效应与定向效应
邻近效应:在酶促反应中,由于酶和底物分子之间的 亲和性,底物分子向酶的活性中心靠近,最终结合到 酶的活性中心,使底物在酶活性中心的有效浓度大大 增加的效应。 定向效应:当专一性底物向酶活性中心靠近时,会诱 导酶分子构象发生改变,使酶活性中心的相关基团和 底物的反应基团正确定向排列,同时使反应基团之间 的分子轨道以正确方向严格定位,使酶促反应易于进 行。
Chapter10 酶的作用机制和酶的调节
一、酶的活性部位
(一)酶活性部位的特点 在酶蛋白中只有少数特异的氨基酸残基参与底物结合及催化作用, 这些特异的氨基酸残基比较集中的区域,即与酶活力直接相关的区域 称为酶的活性部位或活性中心(通常将酶的结合部位和催化部位总称 为酶的活性部位或活性中心)。
(二)研究酶活性部位(活性中心)的方法
2. 掌握别构酶、同工酶的概念 3. 了解酶工程的含义及酶的应用
ATP
ADP
Thr Ser -OH
蛋白激酶
Thr Ser -O-PO32-
Tyr
蛋白磷酸酶 酶蛋白
Pi H2O
Tyr
酶蛋白
酶的磷酸化与脱磷酸化
四、同工酶
•
同工酶(isoenzyme)是指催化相同的化学反应,
而酶蛋白的分子结构、理化性质乃至免疫学
性质不同的一组酶。
同工酶主要由于基因倍增(duplication)和 趋异(divergence)所致。
生物化学__酶的作用机制和酶的调节

2006-1-7
羧 肽 酶 结 合 底 物 前 后 构 象 变 化
2006-1-7
Glu270
Zn
Tyr248 Arg145
Zn
底物
(三)酸碱催化
酶分子的一些功能基团起瞬时质子供体或质子受体的作用。
氨甲酰磷酸
ATCase
天冬氨酸
+-
ATP
氨甲酰天冬氨酸 UMP UTP
CTP
2006-1-7
E.coli的ATCase的亚基排列
c:催化亚基(catalytic subunit) r:调节亚基( regulative subunit)
ATCase
c3r3)
半 分 子 ( 的 结 构
2006-1-7
2006-1-7
邻近效应与定向效应对反应速度的影响: ①使底物浓度在活性中心附近很高 ②酶对底物分子的电子轨道具有导向作用 ③酶使分子间反应转变成分子内反应 ④邻近效应和定向效应对底物起固定作用
2006-1-7
(二)底物的形变和诱导契合
酶中某些基团可使底物分子的敏感键中某些基团的电子云密度变化,产生电 子张力,降低了底物的活化能。
Glu
级联系统调控糖原 分解示意图
肾上腺素或 胰高血糖素
肾上腺素或 胰高血糖素
(极微量)
(5)酶具有复杂的折叠结构。
1、腺苷酸环化酶
2006-1-7
2006-1-7
接触残基:R1、R2、R6、R8、R9、 R163
辅助残基:R3、R4、R5、R164、R165
结构残基:R10、R162、R169
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Chapter10 酶的作用机制和酶的调节
一、酶的活性部位
(一)酶活性部位的特点 在酶蛋白中只有少数特异的氨基酸残基参与底物结合及催化作用,
这些特异的氨基酸残基比较集中的区域,即与酶活力直接相关的区域 称为酶的活性部位或活性中心(通常将酶的结合部位和催化部位总称 为酶的活性部位或活性中心)。
(二)研究酶活性部位(活性中心
Chapter10 酶的作用机制和酶的调节
二、酶活力的测定 3)酶的比活力:是指每毫克酶蛋白所含有的酶活力单位
数,它是酶制剂纯度的一个指标。 4)酶的收率:指纯化过程中酶活性的收率。 5)纯化倍数:指提纯后与提纯前酶比活力的比值。
Chapter10 酶的作用机制和酶的调节
四、寡聚酶、同工酶及诱导酶(428页)
(一)寡聚酶 酶蛋白由二个以上的亚基组成,有四级结构。大部分别构酶是寡聚酶。
(二)同工酶 催化同一种化学反应,但其酶蛋白本身的分子结构和组成却有所不同
的一组酶。如 哺乳动物5种乳酸脱氢同工酶(LDH) (三)诱导酶与结构酶
结构酶是指细胞中天然存在的酶,它的含量较为稳定,受外界的影响 很小。
诱导酶是指当细胞中加入特定诱导物后诱导产生的酶,它的含量在诱 导物存在下显著增高,这种诱导物往往是该酶底物的类似物或底物本身。
Chapter10 酶的作用机制和酶的调节
二、酶活力的测定 1)酶活力:又称为酶活性,一般把酶催化一定化学反
应的能力称为酶活力,通常以在一定条件下酶所催化 的化学反应速度来表示。 因此酶活力可用单位时间内单位体积中底物的减少量 或产物的增加量表示,单位为mol/min等
2)酶活力单位:一般用活力单位U(Unit)表示,许多酶 活力单位都是以最佳条件或某一固定条件下每分钟催化 生成一微摩尔产物所需要的酶量为一个酶活力单位。
