基因反义核酸对食管鳞癌细胞系
食管鳞状细胞癌中ctDNA甲基化标记物的筛选及其诊断价值研究

食管鳞状细胞癌中ctDNA甲基化标记物的筛选及其诊断价值研究食管鳞状细胞癌中ctDNA甲基化标记物的筛选及其诊断价值研究引言:食管鳞状细胞癌(Esophageal Squamous Cell Carcinoma,ESCC)是一种常见的恶性肿瘤,常见于亚洲地区,其发病率和死亡率居世界前列。
目前,早期诊断和治疗仍面临挑战。
随着分子生物学和肿瘤遗传学的快速发展,无创性检测技术正在成为研究的热点。
而环绕DNA的多种化学修饰改变,如甲基化,是基因组稳定性和表观遗传调控的重要因素。
本研究旨在筛选食管鳞状细胞癌中ctDNA的甲基化标记物,并评估其在诊断中的价值。
方法:从已确诊的食管鳞状细胞癌患者中收集100例血浆样本和100例癌组织样本,同时收集100例健康人的血浆样本作为对照组。
采用甲基化特异性PCR(MSP)对候选标记物进行筛选。
通过体外模型对筛选出的标记物进行功能验证,包括增殖、迁移性和侵袭性实验。
此外,还对临床样本中的ctDNA进行检测,并与组织样本的PCR结果进行比对,评估其在食管鳞状细胞癌的诊断中的准确性。
结果:经过初步筛选,我们发现某些基因的甲基化程度在食管鳞状细胞癌患者中明显增加。
经过功能验证,这些标记物与肿瘤的增殖、迁移性和侵袭性相关。
此外,通过对血浆中的ctDNA进行检测,我们观察到这些标记物在食管鳞状细胞癌患者中的频率明显升高,与组织样本的PCR结果一致,并且具有较高的敏感性和特异性。
讨论:本研究表明食管鳞状细胞癌中特定的甲基化标记物在血浆ctDNA中明显升高,具有较高的诊断价值。
与传统的组织样本检测相比,血浆ctDNA检测无创,并能提供即时的结果,有望成为食管鳞状细胞癌早期诊断的潜在方法。
此外,这些标记物的功能验证结果也为进一步研究其作为治疗靶点的潜力提供了支持。
结论:本研究通过筛选食管鳞状细胞癌中ctDNA的甲基化标记物,证明其在诊断中的价值,并为进一步研究提供了基础。
尽管仍需更大规模的研究验证和临床应用探索,但血浆ctDNA作为无创性检测方法在食管鳞状细胞癌早期诊断中具有潜在的应用前景。
食管鳞状细胞癌中FBXO32基因表达及其临床意义

食管鳞状细胞癌中FBXO32基因表达及其临床意义张明慧;郭炜;董稚明;郭艳丽;韩立杰;崔蕾【摘要】目的观察食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中FBXO32基因的表达,探讨该基因在ESCC发生、发展中的作用.方法分别应用RT-PCR及免疫组织/细胞化学法检测食管癌细胞和ESCC组织中FBXO32 mRNA及蛋白表达,观察DNA去甲基化剂5-氮杂-2′-脱氧胞苷(5-aza-2′-deoxycitydine,5-aza-dC)对食管癌细胞系(TE1、TE13、T.TN、Yes-2)FBXO32基因表达的影响.结果 TE13、T.TN、Yes-2细胞株中均未检测到FBXO32 mRNA及蛋白表达,在去甲基化剂作用后,4株食管癌细胞株中FBXO32基因表达均上调.FBXO32 mRNA在ESCC和癌旁正常组织中的表达量分别为0.24±0.15和0.49±0.21,ESCC组织中FBXO32 mRNA表达量明显低于癌旁正常组织(P<0.05),且与患者的淋巴结转移及肿瘤组织的分化程度密切相关.51例ESCC 组织中,12例FBXO32基因蛋白表达,阳性率为23.5%,明显低于正常食管黏膜组织(70.5%,P<0.01),且FBXO32与患者的淋巴结转移密切相关.结论 FBXO32基因在ESCC中的异常低表达与ESCC的发生、发展密切相关,且甲基化可能是其表达沉默的机制之一.【期刊名称】《临床与实验病理学杂志》【年(卷),期】2013(029)006【总页数】5页(P632-636)【关键词】食管肿瘤;鳞状细胞癌;FBXO32【作者】张明慧;郭炜;董稚明;郭艳丽;韩立杰;崔蕾【作者单位】河北医科大学第四医院河北省肿瘤研究所病理研究室,石家庄,050011;河北医科大学第四医院河北省肿瘤研究所病理研究室,石家庄,050011;河北医科大学第四医院河北省肿瘤研究所病理研究室,石家庄,050011;河北医科大学第四医院河北省肿瘤研究所病理研究室,石家庄,050011;河北省沧州市中心医院放疗科,沧州,061001;河北医科大学第四医院河北省肿瘤研究所病理研究室,石家庄,050011【正文语种】中文【中图分类】R735.1肌肉萎缩相关基因1(FBXO32又名atrogin-1、MAFbx)属于F-box蛋白家族,构成泛素蛋白连接酶复合体 4个亚单位的其中一员[1,2]。
鳞癌的病理实验报告

鳞癌的病理实验报告
《鳞癌的病理实验报告》
鳞癌是一种常见的恶性肿瘤,通常发生在皮肤、口腔、食道、肺部等部位。
为
了更深入地了解鳞癌的病理特征,我们进行了一项实验研究,以期能够为鳞癌
的诊断和治疗提供更准确的依据。
在实验中,我们收集了一批患有鳞癌的组织样本,并进行了病理学分析。
首先,我们对组织样本进行了常规的组织学染色,观察到了典型的鳞癌组织结构。
细
胞核增大、异型性增加、角化现象减少等特征都在染色图像中清晰可见。
接着,我们利用免疫组织化学技术对组织样本进行了进一步的分析。
结果显示,鳞癌组织中的肿瘤细胞呈现出强烈的细胞角蛋白阳性表达,这与鳞癌的组织学
特征相吻合。
同时,我们还观察到了一些肿瘤相关标志物的异常表达,如p53、Ki-67等,这些结果也为鳞癌的诊断和预后评估提供了重要的参考。
除此之外,我们还对鳞癌组织样本进行了基因检测和蛋白质组学分析。
通过比
较鳞癌组织与正常组织的基因表达谱和蛋白质组成,我们发现了一系列与鳞癌
发生发展相关的潜在标志物,这为鳞癌的分子机制研究和靶向治疗提供了新的
线索。
综合以上实验结果,我们对鳞癌的病理特征有了更深入的认识,这将有助于提
高鳞癌的早期诊断率和治疗效果。
我们相信,通过持续的研究和探索,我们能
够更好地理解鳞癌的发病机制,为患者的健康带来更多的希望和可能。
【国家自然科学基金】_反义基因治疗_基金支持热词逐年推荐_【万方软件创新助手】_20140731
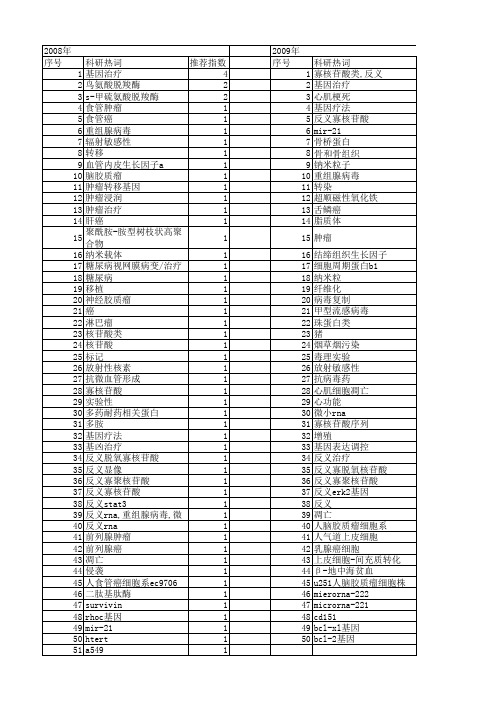
科研热词 基因治疗 膀胱肿瘤 胆道狭窄 胆结石 慢性增生性胆管炎 微小rna-21 复发 鸟氨酸脱羧酶 骨肉瘤 重组腺病毒 载体 转染 胆管炎 肝癌细胞 肝内胆管结石 端粒 神经胶质瘤 斑马鱼 抑癌基因 心肌细胞凋亡 心肌梗死 外胚层 增殖 反义技术 反义寡核苷酸类 反义基因治疗 反义rna 内胚层 侵袭 人端粒酶逆转录酶 中胚层 zili u251人脑胶质瘤细胞株 rna干扰 rna pcna mir-21 ing1 dna cdc2蛋白激酶 cd151
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50
科研热词 寡核苷酸类,反义 基因治疗 心肌梗死 基因疗法 反义寡核苷酸 mir-21 骨桥蛋白 钠米粒子 重组腺病毒 转染 超顺磁性氧化铁 舌鳞癌 脂质体 肿瘤 结缔组织生长因子 细胞周期蛋白b1 纳米粒 纤维化 病毒复制 甲型流感病毒 珠蛋白类 猪 烟草烟污染 毒理实验 放射敏感性 抗病毒药 心肌细胞凋亡 心功能 微小rna 寡核苷酸序列 增殖 基因表达调控 反义治疗 反义寡脱氧核苷酸 反义寡聚核苷酸 反义erk2基因 反义 凋亡 人脑胶质瘤细胞系 人气道上皮细胞 乳腺癌细胞 上皮细胞-间充质转化 β -地中海贫血 u251人脑胶质瘤细胞株 mierorna-222 microrna-221 cd151 bcl-xl基因 bcl-2基因
推荐指数 3 2 2 2 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
1-肿瘤学题库及答案汇总(完整版)

I7中山大学肿瘤学硕士复试试题一. 名词解释1.直接致癌物:这类化学物质进入体内后能与体内细胞互相作用,不需要经过代谢就能诱导正常细胞癌变的化学物质。
2.间接致癌物:这类化学物质进入人体后需要经体内微粒体混合功能氧化酶活化,变成化学性质活泼的形式方具有致癌作用的化学致癌物。
3.转移(metastasis):肿瘤细胞脱离原发瘤,沿淋巴管,血管,体腔到达与原发瘤不相连的部位,并继续生长,形成与原发瘤同样类型的肿瘤。
4.信号传导(singal transduction):细胞外因子通过与受体(膜受体或核受体)结合,所引发细胞内的一系列生物化学反应,直至细胞生理反应所需基因的转录表达开始的过程。
5.动脉栓塞治疗(transcatheter arterial chemoembolization):经导管将化疗药物和栓塞剂通过肿瘤供血动脉注入肿瘤组织中,化疗药物可以以较长时间较高浓度停留于肿瘤组织中,在杀伤肿瘤细胞的同时栓塞肿瘤血管可促使肿瘤细胞坏死,并且可降低体循环的药物浓度,减轻全身化疗毒性作用,达到更好的治疗效果。
6.肿瘤多学科综合治疗(multidisciplinary synthetic therapy):根据病人的身心状况,肿瘤的具体部位、病理类型、侵犯范围和发展趋势,结合细胞分子生物学的改变,有计划、合理地应用现有的多学科各种有效治疗手段,以最适当的经济费用取得最好的治疗效果,同时最大限度地改善病人的生活质量。
7.抑癌基因(tumor suppressor gene, recessive oncogene, antioncogene, tumorsusceptibility gene):通过纯和缺失或失活而引起恶性转化的基因。
8.反义核酸技术:一种能够有效调节细胞中基因表达的手段,其基本原理是根据核酸碱基互补配对的规律设计出能与靶基因特定区域结合的DNA或RNA,从而影响靶基因的表达,抑制其功能。
pai-1过表达促进食管鳞癌细胞的侵袭和迁移

Hereditas (Beijing) 2020年3月, 42(3): 287―295 收稿日期: 2019-12-31; 修回日期: 2020-02-12基金项目:国家自然科学基金项目(编号:81520108023),中国医学科学院医学与健康科技创新工程项目(编号:2019-I2M-1-003,2016-I2M-3-007),北京市科技新星项目(编号:Z171100001117017)资助[Supported by the National Natural Science Foundation of China (No. 81520108023), CAMS Innovation Fund for Medical Sciences (Nos. 2019-I2M-1-003, 2016-I2M-3-007), Beijing Nova Program (No.Z171100001117017)]作者简介: 王迪,硕士研究生,专业方向:肿瘤遗传学。
E-mail: 156********@ 通讯作者:郝佳洁,博士,副研究员,研究方向:肿瘤遗传学。
E-mail: hjj8173@王明荣,博士,研究员,研究方向:肿瘤遗传学。
E-mail: wangmr2015@DOI: 10.16288/j.yczz.19-334网络出版时间: 2020/2/28 11:15:42URI: /kcms/detail/11.1913.r.20200227.0958.002.html研究报告PAI-1过表达促进食管鳞癌细胞的侵袭和迁移王迪,杨荔艳,刘奏,余竟,张敏杰,张钰,蔡岩,徐昕,郝佳洁, 王明荣国家癌症中心/国家肿瘤临床医学研究中心, 中国医学科学院北京协和医学院肿瘤医院肿瘤精准医学研究中心, 分子肿瘤学国家重点实验室,北京 100021摘要: 食管癌是常见的恶性肿瘤之一。
由SERPINE1基因编码的纤溶酶原激活物抑制因子 1 (plasminogenactivator inhibitor-1, PAI-1)已被报道在多种类型癌症患者的肿瘤组织中存在高表达并参与癌症进展。
食道鳞癌实验报告结果

一、实验背景食道鳞癌是常见的恶性肿瘤之一,其发病率和死亡率在全球范围内呈上升趋势。
为了深入探讨食道鳞癌的生物学特性,本研究采用细胞培养、流式细胞术、免疫组化等技术,对食道鳞癌细胞的增殖、凋亡、迁移和侵袭等特性进行系统研究。
二、实验材料与方法1. 实验材料:人食道鳞癌细胞系(HNE1)、人正常食管上皮细胞(GES-1)、DMEM 培养基、胎牛血清、PI染液、Annexin V-FITC凋亡检测试剂盒、Matrigel侵袭基质等。
2. 实验方法:(1)细胞培养:将HNE1和GES-1细胞分别接种于培养瓶中,置于37℃、5%CO2的培养箱中培养。
(2)细胞增殖实验:采用CCK-8法检测细胞增殖情况。
(3)细胞凋亡实验:采用Annexin V-FITC/PI双染法检测细胞凋亡情况。
(4)细胞迁移实验:采用Transwell小室法检测细胞迁移能力。
(5)细胞侵袭实验:采用Transwell小室法检测细胞侵袭能力。
(6)免疫组化:采用SP法检测细胞中E-cadherin、N-cadherin、Vimentin等蛋白的表达。
三、实验结果1. 细胞增殖:与GES-1细胞相比,HNE1细胞增殖速度明显加快,呈剂量依赖性。
2. 细胞凋亡:Annexin V-FITC/PI双染法检测结果显示,HNE1细胞凋亡率低于GES-1细胞。
3. 细胞迁移:Transwell小室法检测结果显示,HNE1细胞迁移能力显著高于GES-1细胞。
4. 细胞侵袭:Transwell小室法检测结果显示,HNE1细胞侵袭能力显著高于GES-1细胞。
5. 免疫组化:免疫组化结果显示,HNE1细胞中E-cadherin表达降低,N-cadherin和Vimentin表达升高。
四、讨论与分析本研究通过细胞培养、流式细胞术、免疫组化等技术,对食道鳞癌细胞的生物学特性进行了系统研究。
结果表明,与正常食管上皮细胞相比,食道鳞癌细胞具有以下特点:1. 细胞增殖能力增强:食道鳞癌细胞在体外培养过程中,增殖速度明显加快,呈剂量依赖性。
食管癌早期诊断的研究进展

食管癌早期诊断的研究进展作者:朱小娟高社干王立东时振国朱珊珊来源:《中国保健营养·中旬刊》2013年第06期【摘要】我国食管癌的发病率和死亡率居世界第一。
早期诊断是提高食管癌疗效和改善预后的关键因素,采用内镜、X线钡餐造影、CT、MRI等影像学检查与分子生物学肿瘤标志物相结合,为食管癌的早期诊断提供了充分依据。
【关键词】食管肿瘤;早期诊断;研究进展【中图分类号】R735 【文献标识码】A 【文章编号】1004-7484(2013)06-0089-01近年来,食管癌的病死率仍居高不下。
究其原因,主要是临床发现的食管癌患者多为中晚期,其5年生存率低于10%,而早期食管癌综合治疗5年生存率高达90%~100%。
因此,提高食管癌患者生存率关键在于早期诊断。
现对食管癌近年早期诊断的研究进展综述如下。
1 内镜检查目前,内镜检查已逐步成为食管癌筛查的首选方法,尤其是各种新内镜技术被应用于临床,显著提高了早期食管癌的诊断水平。
1.1 色素内镜(chromoendoscopy,CHE)色素内镜指在常规内镜的基础上喷洒色素溶液于食管黏膜上,病变组织与色素溶液发生化学反应而易于观察,可发现大量的癌前病变及微小癌、原位癌,其方法快速、损伤小、简单易行。
虽然色素内镜的应用显著提高了早期食管癌的检出率,但作为一种新的诊断方法,仍存在一些问题。
例如,色素注入方式会影响染色的效果;对染色图像的辨认也缺乏统一的标准。
Connor等[1]认为,应在大量实践的基础上制定操作规程及统一诊断标准。
当前诊断早期食管癌的最佳方法为在染色内镜基础上行针对性组织病理学活检。
1.2 超声内镜(EUS)超声内镜是将内镜与超声完美结合的新技术。
它可判断消化道管壁的层次结构、周围组织的关系及有无周围脏器侵犯及相关淋巴结情况,能够鉴别食管良恶性病变、判断其浸润程度。
EUS已成为早期食管癌治疗前的必选检查方法,帮助准确评估病变的部位,选择治疗方法[2]。
自噬基因Beclin-1与凋亡基因Bax、Bcl-2在食管鳞癌中的表达及意义

采用免疫组化 食管
s P法检测 4 5例食管鳞癌组织 中 B cn1B x和 B l el 一、a i c- 2的表达水平 , 分析其与临床病理 因素的关系。结果 并
1% 甲醛 固定 , 0 石蜡 包 埋 , m 厚 度连 续 切 片并 裱 4
于A E P S打底 的玻片上。Bcnl Bx Bl e i—、 a、 c2蛋 白 l - 检 测采用 免疫 组化 S P法 , 鼠抗人 B c n1多克 隆抗 el 一 i
选 择 20 0 7年 7—1 0月在 四川大 学
2 1 B ci.、 a . el 1 B x和 B l n c 2蛋 白 的表 达 -
B c n1 el 一 i
华西医院进行食管鳞癌手术切除的标本 4 例 , 5 术前 均未接受任何治疗 。其 中男 3 8例 、 7例 , 女 年龄 3 8~ 7 岁( 6 8 > t 0岁 2 、 6 2 例 )肿瘤位于胸 中段 0例 < 0岁 5 ; 3 例、 3 下段 9 上段 3 有淋巴结转移 2 例 , 例、 例; l 无淋 巴转移 2 例 ; 4 按照 UC 19 IC97年标准分期 ,,2例, Tl T l 例 ,3 O例,4 0例;T M分期I 1 23 T l T1 pN 期 2例,a Ⅱ 期 1 , ) l , 期 1 例 。随机 选择上述患者 0例 I 期 2例 Ⅲ Ⅱ 1
山东 医药 2 1 00年第 5 0卷第 4 5期
・
临床 研 究 ・
自噬基 因 B c n1 el 一 与凋 亡基 因 B x B l i a、c2 一 在 食 管鳞 癌 中的表达及 意义
宋海侠 , 陈永顺 , 王立帅 , 毛 琴 , 晓月 , 伏 卢 铀 ( 四川 大学华 西 医院, 都 6 0 4 ) 成 10 1
食管鳞癌中mTORp70S6K信号通路的作用及其阻断策略

食管鳞癌中mTOR/p70S6K信号通路的作用及其阻断策略侯桂琴【摘要】:雷帕霉素靶蛋白(target of rapamycin,mTOR)信号通路在肿瘤发生发展中起重要作用,因而也越来越受到人们的关注。
mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇3-激酶相关激酶(PIKK)家族。
在哺乳动物中,mTOR下游有两个主要的靶分子,一个是核糖体S6激酶(S6K),另一个是真核翻译起始因子(eIF4E)结合蛋白1(4E-BP1)。
mTOR的激活导致了S6K和4E-BP1的磷酸化,磷酸化的4E-BP1可以从帽-依赖性翻译起始因子 eIF4E上释放出来,最终增强了与细胞生长有关的基因的翻译。
这两个过程也可能与其他的mTOR靶点一起增强了核糖体的生物合成及一些特殊mRNA的选择性翻译。
许多研究证明,mTOR被认为是肿瘤治疗中重要且有前景的治疗靶点,其抑制剂目前正在进行临床及临床前研究,试用于多种癌症如肾细胞癌、结肠癌、乳腺癌、前列腺癌及小细胞肺癌等。
食管鳞癌是世界上最常见的恶性肿瘤之一,尤其在我国河南省林州市(林县),食管鳞癌的发生率及死亡率均很高。
但是,mTOR及其信号通路的激活状态在食管鳞癌中尚未见报道,这促使我们研究mTOR/p70S6K信号通路在食管鳞癌发生发展中的作用,为治疗食管鳞癌寻找新的靶点。
在本研究中,我们检测了食管鳞癌细胞系EC9706和Eca109中mTOR及其主要下游因子的激活状态,并检测了雷帕霉素和抗mTOR的小干扰RNA(siRNA agains t mTOR,以下简称mTOR-siRNA)对通路中各因子mRNA及蛋白表达的影响以及对细胞增殖、细胞周期及凋亡的影响。
而且,还观察了雷帕霉素和mTOR-siRNA对裸鼠移植瘤生长的抑制作用。
结果显示,mTOR/p70S6K信号通路在食管鳞癌中是异常激活的,并且癌细胞的分化程度越低,激活状态越高;另外,还证实雷帕霉素能特异性抑制mTOR/p70S6K信号通路并诱导细胞凋亡,而mTO R-siRNA不仅能抑制信号通路,还能提高细胞对雷帕霉素和顺铂的敏感性。
PTEN基因与肿瘤相关性的研究进展

PTEN基因与肿瘤相关性的研究进展抑癌基因PTEN具有双重特异性磷酸酶活性,在多个系统的肿瘤中表达减低或缺失。
基因突变、杂合性缺失、启动子甲基化等可致其表达减低,进而通过相关的信号转导通路影响肿瘤的细胞周期、侵袭和转移。
乳腺、甲状腺、妇科以及消化系统等肿瘤中PTEN基因表达减低或缺失与肿瘤的恶性程度有关,导致其表达减低或缺失的机制以及信号转导通路的作用不尽相同。
本文就PTEN基因与不同肿瘤相关性的研究进展作一综述。
[Abstract] The tumor suppressor PTEN gene possesses a dual specific phosphatase activity,and its expression is decreased or absent in many tumors. The abnormality of PTEN,including mutation,loss of heterozygosity and methylation of promoter,can cause its expression to decrease,and then affect the cell cycle,invasion and metastasis of tumors through related signal transduction pathways. The reduction or deletion of PTEN gene expression in tumors such as breast,thyroid,gynecology,digestive system is associated with the malignancy of the tumors in different systems,and the related mechanisms and signal transduction pathways that lead to the abnormality of PTEN are various in different tumors. This article reviews the recent research progress on the correlation between PTEN gene and different tumors.[Key words] PTEN gene; Tumor; Research progress腫瘤是目前严重威胁人类健康的疾病,其发生发展涉及原癌基因激活和/或抑癌基因失活的一系列生物学过程。
食管鳞癌组织中Slug、Vimentin、E-cadherin与血管生成拟态的表达及意义

食管鳞癌组织中Slug、Vimentin、E-cadherin与血管生成拟态的表达及意义周芳芳;陈冰【摘要】目的观察食管鳞癌(human esophageal squamous cell carcinoma,ESCC)组织中上皮间质转化(epithelial mesenchymal transitions,EMT)相关蛋白锌指转录因子snail2(Slug)、E-钙黏附蛋白(E-cadherin)和波形蛋白(Vimentin)与血管生成拟态(vasculogenic mimicry,VM)的表达,并探讨其临床意义.方法收集120例ESCC组织采用CD34/PAS套染检测VM情况;免疫组化法检测Slug、血管内皮钙黏蛋白(vascular endothelial cadherin,VE-cadherin)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和Vimentin,E-cadherin表达.结果在120例ESCC中Slug的阳性表达与ESCC患者年龄、性别无关(P>0.05),但与分化程度、淋巴结转移、临床分期、脉管癌栓形成等有关(P <0.05);Slug,Vimentin在有VM组阳性表达率明显高于无VM组(P<0.05),且均与VM表达呈正相关(r=0.473、0.396);E-cadherin在有VM组阳性表达率明显低于无VM组(P<0.05),与VM表达呈负相关(r=-0.191);VE-cadherin,VEGF在Slug阳性组的阳性表达率明显高于Slug阴性组(P<0.05),两者均与Slug表达呈正相关(r=0.405,0.445).结论 Slug调控的上皮间质转化可能参与了食管鳞癌中血管生成拟态形成过程,另外Slug的高表达可能提示ESCC患者的不良预后.【期刊名称】《山西医科大学学报》【年(卷),期】2017(048)002【总页数】5页(P144-148)【关键词】Slug;波形蛋白;E-钙黏蛋白;血管生成拟态;上皮间质转化;食管鳞癌【作者】周芳芳;陈冰【作者单位】皖南医学院病理学教研室,芜湖241000;皖南医学院病理学教研室,芜湖241000【正文语种】中文【中图分类】R735.1血管生成拟态(vasculogenic mimicry,VM)是一种不依赖于内皮细胞的肿瘤新生血管,是近年来肿瘤血管的研究热点,其在缺氧环境下由HIF-1α[1]诱导VEGF[2]、VE-cadherin[3]等分子的经典信号通路的相关机制已经成熟,但有研究发现,COX-2[4]、TFPI-2[5]、小分子核酸[6]、Mig-7[7]等均参与了血管生成拟态的形成,证实了血管生成拟态的形成机制可能是非常复杂的多信号调控的多条通路的过程;另外在研究血管生成拟态形成过程中发现肿瘤细胞是通过自身变形和细胞外基质重塑构成血管样结构,因此推测肿瘤细胞可能是通过EMT过程来实现肿瘤细胞的变形从而形成VM,Slug是锌指蛋白家族中成员之一,参与调控多种恶性肿瘤的EMT过程。
食管癌相关基因甲基化研究进展

临床与实验病理学杂志J Clin Exp Pathol 2009 Dec;25(6)
食管癌相关基因甲基化研究进展
·综
述·
王巍伟,李锋
关键词:食管肿瘤;癌基因;抑癌基因;甲基化
中图分类号:R 735.1
文献标识码:A
文章编号:1001—7399(2009)06-0656—05
人类肿瘤的发生是一个多步骤、多阶段、多基因改变与 表基因改变的复杂过程,主要涉及癌基因激活和抑癌基因失 活,最后引起基因表达异常。近年来研究表明,基因表达改 变主要通过两大机制:一是遗传学机制(genetic mechanism), 即由DNA核苷酸序列改变引起,包括突变、缺失、染色体重 排等,产生结构异常的基因产物;再就是表观遗传学机制 (epigenetic mechanism),即没有DNA序列变化、可遗传的基 因表达(活性)的改变,DNA甲基化是其主要形式。近年来, DNA甲基化成为肿瘤研究领域一大热点,其可调控细胞增 殖、凋亡、分化,且其水平与肿瘤的生物学特性密切相关。
3食管癌相关基因甲基化研究进展
童1抑癌基因甲基化与食管癌DNA甲基化是基因表达调
万方数据
临床与实验病理学杂志J Clin Exp Pathol 2009 Dec;25(6)
·657-
图1 MALDI-TOF-MS法示意图
Байду номын сангаас
控的一种方式,抑痛基因启动子区高甲基化可以使其表达受 抑,这与肿瘤的发生发展密切相关,其中食管癌也不例外。 3.1.1 p16基因p16基因定位于人类第9号染色体 (9p21),其表达产物p16蛋白是细胞周期调节蛋白,直接参 与细胞增殖的负调节。张帆等…检测30例食管鳞状细胞癌 p16/INK4基因甲基化状况及其表达提示甲幕化不是引起 p16失表达的主要原因。Abbaszadegan等¨o研究伊朗东北部 一组散发食管癌患者p16基因的甲基化率为73.3%,在食管 癌高风险家系中甲基化率为64.3%,并认为其是食管癌高风 险家系中有价值的早期诊断标志。宋长山等一。检测75例食 管癌组织、癌旁组织和切缘组织p16基因启动子区甲基化状 态及其蛋白表达,提示p16基因甲基化在食管癌发生发展中 起着重要作用。食管鳞癌的分期和淋巴结转移与p16基因甲 基化之间有密切关系。 3.1.2 RASSFIA基因 Ras相关区家族1A(RAS association domain family 1A gene,RASSFl A)是2000年从人类染色体 3p21.3上克隆出来的新型候选抑癌基因。Wong等”叫的研 究表明ESCC中RASSFIA甲基化具有流行病学/种族差异, 并提示不同的发病机制导致了中国食管癌的发生。丁士刚 等”“研究发现原发性食管鳞癌存在RASSFlA启动子超甲
lncRNA SBF2-AS1低表达提高食管鳞癌的放射敏感度

㊀㊀基金项目:国家自然科学基金资助项目(8170101890);蚌埠医学院创新基金资助项目(Byycx1941)作者单位:225400㊀蚌埠医学院附属泰兴市人民医院肿瘤放疗科通讯作者:刘阳晨,电子信箱:liuyctx@lncRNA SBF2-AS1低表达提高食管鳞癌的放射敏感度查文娟㊀李晓敏㊀铁小伟㊀陈㊀瑞㊀李㊀皓㊀刘阳晨摘㊀要㊀目的㊀探究长链非编码RNA SBF2-AS 沉默后对食管鳞癌细胞放射敏感度的影响㊂方法㊀用实时荧光定量PCR (qRT -PCR)检测TE -13和HET -1A 细胞中SBF2-AS1的表达水平㊂将TE -13细胞分为si -NC 组㊁si -SBF2-AS1组㊁IR +si -NC 组㊁IR +si -SBF2-AS1组㊂四甲基偶氮唑蓝(MTT)和EDU(胸腺嘧啶核苷酸类似物)检测各组细胞增殖㊂流式细胞术检测各组细胞凋亡㊂蛋白质印记(Western blot)法检测各组细胞中E2F1蛋白的变化㊂结果㊀TE -13细胞中SBF2-AS1的表达水平明显高于HET -1A(P <0.05)㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组细胞存活分数呈剂量依赖性显著下降(P <0.05)㊂与si -NC 组比较,IR +si -NC 组㊁si -SBF2-AS1组和IR +si -SBF2-AS1组在48h 和72h 的A 值显著降低(P <0.05)㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组48h 和72h 的A 值显著降低(P <0.05)㊂与si -SBF2-AS1组比较,IR +si -SBF2-AS1组48h 和72h 的A 值显著降低(P <0.05)㊂与si -NC 组比较,IR +si -NC 组㊁si -SBF2-AS1组和IR +si -SBF2-AS1组增殖率显著降低(P <0.05)㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组增殖率显著降低(P <0.05)㊂与si -SBF2-AS1组比较,IR +si -SBF2-AS1组增殖率显著降低(P <0.05)㊂与si -NC 组比较,IR +si -NC 组㊁si -SBF2-AS1组和IR +si -SBF2-AS1组的细胞凋亡率显著升高(P <0.05)㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组的细胞凋亡率显著升高(P <0.05)㊂与si -SBF2-AS1组比较,IR +si -SBF2-AS1组的细胞凋亡率显著升高(P <0.05)㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组E2F1蛋白的表达量显著下降(P <0.05)㊂结论㊀敲除SBF2-AS1可以通过抑制TE -13细胞增殖,促进其凋亡,来增强其对放射治疗的敏感度,为提高食管鳞癌放射治疗疗效提供一个新的靶点㊂关键词㊀食管鳞癌㊀LncRNA SBF2-AS1㊀放射敏感度中图分类号㊀R735.1㊀㊀㊀㊀文献标识码㊀A㊀㊀㊀㊀DOI ㊀10.11969/j.issn.1673-548X.2021.03.012Low Expression of LncRNASBF2-AS1Increases Radiosensitivity in Esophageal Squamous Cell Carcinoma.㊀Zha Wenjuan ,Li Xiaomin ,Tie Xiaowei ,et al.Department of Oncology and Radiotherapy ,Taixing Peopleᶄs Hospital Affiliated to Bengbu Medical College ,Jiangsu 225400,ChinaAbstract ㊀Objective ㊀To investigate the biological role of SBF2-AS1in promoting radiotherapy resistance of esophageal squamous cell carcinoma.Methods ㊀Detection of SBF2-AS1expression in TE -13and HET -1A cells by real -time fluorescence quantitative PCR (qRT -PCR)was performed.TE -13cells were divided into si -NC group,si -SBF2-AS1group,IR +si -NC group and IR +si -SBF2-AS1group.Cell proliferation was detected by MTT and EDU.The apoptosis of each group was detected by flow cytometry,and the change of E2F1protein in each group was detected by westernblot.Results ㊀The expression level of SBF2-AS1in TE -13cells was significantly higher than that in HET -1A group(P <0.05).Compared with IR +si -NC group,the cell survival fraction of IR +si -SBF2-AS1group decreased significantly in a dose -dependent manner(P <0.05).Compared with si -NC group,the A values of IR +si -NC group,si -SBF2-AS1group and IR +si -SBF2-AS1group were significantly lower at 48h and 72h(P <0.05).Com-pared with IR +si -NC group,the A values of IR +si -SBF2-AS1group at 48h and 72h were significantly lower(P <0.05).Compared with si -SBF2-AS1group,the A values of IR +si -SBF2-AS1group at 48h and 72h were significantly lower(P <0.05).The prolifer-ation rate of IR +si -NC group,si -SBF2-AS1group and IR +si -SBF2-AS1cell group was significantly lower than that of si -NC group(P <0.05),that of IR +si -SBF2-AS1group was significantly lower than that of IR +si -NC group(P <0.05),and that of IR +si -SBF2-AS1group was significantly lower than that of si -SBF2-AS1group(P <0.05).Compared with si -NC group,the apoptosis rate of IR +si -NC group,si -SBF2-AS1group and IR +si -SBF2-AS1group was significantly higher(P <0.05),that of IR +si -SBF2-AS1group was significantly higher than that of IR +si -NC group(P <0.05),and that of IR +si -SBF2-AS1group was signifi-cantly higher than that of si -SBF2-AS1group(P <0.05).Compared with IR +si -NC group,the expression of E2F1protein in IR +㊃94㊃si-SBF2-AS1group decreased significantly(P<0.05).Couclusion㊀Knockout of SBF2-AS1can enhance the sensitivity of TE-13 cells to radiotherapy by inhibiting proliferation and promoting apoptosis,which provides a new target for improving the efficacy of radiother-apy for esophageal squamous cell carcinoma.Key words㊀Esophageal squamous cell carcinoma;LncRNA;SBF2-AS1;Radiosensitivity㊀㊀食管癌是一种恶性程度很高的肿瘤,在东亚地区高发[1]㊂而中国的食管癌发生率居高不下,约占所有食管癌病例的一半[2]㊂鳞癌和腺癌是食管癌的两种主要组织学类型,且全球一半以上的食管鳞癌发生在中国[3,4]㊂而在中国食管癌的发生率位居第6位,病死率位居第5位[5]㊂中国的食管癌患者主要以食管鳞癌为主,食管腺癌较少㊂虽然食管癌的治疗方法多种,但由于早期诊断困难,被发现时已到中晚期导致患者预后很差,5年总体生存率不足20%[6]㊂放射治疗是食管鳞癌主要的治疗方法之一,但是由于存在放疗抵抗,影响了放射治疗的疗效,导致许多食管癌患者放疗失败㊂但越来越多的研究证实了一种长链非编码RNA(lncRNA)可能是导致恶性肿瘤产生放疗抵抗的原因㊂lncRNA MALAT1在放疗耐受的结直肠癌细胞中高表达,并且可以增加细胞活力,MALAT1主要作为ceRNA吸附miR-101-3P来增强结直肠癌细胞的放疗抵抗,导致结直肠癌细胞对放射治疗不敏感,或许这是许多结直肠癌患者放疗失败的一个可能原因[7]㊂lncRNA HOTAIR与乳腺癌细胞的放疗敏感度呈负相关,且进一步的研究发现HOTAIR通过与miR-449b-5p结合使得HSPA1A的表达上调,导致乳腺癌细胞放疗耐受性的产生[8]㊂lncRNA MINCR也被发现为是导致鼻咽癌放疗抵抗的一个潜在基因, MINCR通过海绵化miR-223,增加ZEB1和激活AKT/PI3K轴来降低鼻咽癌细胞的放射敏感度[9]㊂同样地也有许多调控食管鳞癌放疗敏感度的lncRNA 被发现㊂LINC00473可以调节microRNA-497-5p 和细胞分裂周期25A降低食管鳞癌的放疗敏感度[10]㊂lncTUG1通过降低miR-144-3p水平和调节MET/EGFR/AKT轴来增强ESCC的放射抵抗[11]㊂SBF2-AS1已被报道可以作为促癌因子在多种肿瘤中发挥作用,但是SBF2-AS1是否是食管鳞癌放疗抵抗的潜在的分子尚未被报道㊂材料与方法1.材料:人食管鳞癌细胞TE-13购自中国科学院上海生命科学研究院细胞资源中心;RPMI1640培养基和胎牛血清购自美国Gibco公司;无血清冻存液和10%聚丙烯酰胺凝胶预混液(10%SDS PAGE)购自苏州新赛美科技公司;TRIzol试剂和lipofectamin-eRNAiMAX购自美国赛默飞公司,E2F1抗体和actin 抗体购自美国CST公司,q-PCR试剂盒和反转录试剂盒购自南京诺唯赞生物科技有限公司,胸腺嘧啶核苷酸类似物(thymine nucleotide analogue,EDU)试剂盒购自广州锐博公司,四甲基偶氮唑蓝(methyl thia-zol tetrazolium,MTT)试剂盒和蛋白marker购自碧云天生物技术公司㊂2.细胞培养与转染:复苏食管鳞癌细胞系TE-13和正常细胞HET-1A,用含10%胎牛血清的RP-MI1640培养基培养并放在37ħ㊁5%CO2的培养箱中孵育㊂待细胞长至80%~90%用预冷PBS洗2遍,用胰酶进行消化,待细胞变圆将细胞吹打下来离心,将其分装在2个培养瓶中㊂取对数生长期的细胞铺板于6孔板中,24h后按照LipofectamineRNAiMAX说明将si-SBF2-AS1和si-NC转染进TE-13细胞中分为si-SBF2-AS1组和si-NC组,转染48h后进行后续实验㊂3.RT-PCR检测:RT-PCR检测SBF2-AS1的表达水平:用TRIzol试剂按照说明书提取细胞中的总RNA,并检测浓度和纯度;用反转录试剂盒将RNA 反转录成cDNA,荧光定量PCR进行RT-PCR㊂以GAPDH为SBF2-AS1的内参基因,SBF2-AS1的相对表达量用2-ΔΔCt计算㊂反应条件:95ħ,预变性5min(1个循坏),95ħ10s,60ħ30s(40个循坏);相应的引物序列:SBF2-AS1上游引物:5ᶄ-CACGAC-CCAGAAGGAGTCTAC-3ᶄ,下游引物:5ᶄ-CCCGG-TACCTTCCTGTCATA-3ᶄ;GAPDH上游引物:5ᶄ-GGAGCGAGATCCCTCCAAAAT-3ᶄ,下游引物:5ᶄ-GGCTGTTGTCATACTTCTCATGG-3ᶄ㊂4.MTT法检测:si-SBF2-AS1和si-NC转染进TE-13细胞然后分别用0Gy和4Gy的X线照射后将细胞分为si-NC组㊁si-SBF2-AS1组㊁IR+ si-NC组和IR+si-SBF2-AS1组,收集细胞以每孔5000个铺到96孔板中,每组设置5个复孔,培养24㊁48㊁72和96h后分别在每个孔中加入100μl MTT 溶液适当混匀,在37ħ培养箱中孵育4h;每孔加入㊃05㊃100μl Formazan溶液适当混匀,在培养箱中孵育3h,最后在570nm波长处测吸光度㊂实验:si-SBF2-AS1和si-NC转染进TE-13细胞然后分别用0Gy和4Gy的X线照射后将细胞分为si-NC组㊁si-SBF2-AS1组㊁IR+si-NC组和IR+si-SBF2-AS1组,以每孔1ˑ105个细胞铺进免疫荧光薄底96孔板中,每组设置3个复孔㊂每个孔中加入100μl50nmol/L Edu培养基孵育2h,弃培养基,PBS清洗细胞2次,每次5min㊂然后加入50μl的细胞固定液室温孵育30min,弃固定液,接着加入50μl2mg/ml甘氨酸,脱色摇床孵育5min,弃甘氨酸㊂再加入100μlPBS脱色摇床清洗5min,使用100μl渗透剂脱色摇床孵育10min,然后加入100μl 的1ˑApoll®染色反应液进行染色,避光室温脱色摇床孵育30min,弃反应液㊂接着加入100μl渗透剂清洗2遍,最后每孔加入100μl1ˑHoechst33342反应液进行DNA染色,避光室温孵育30min,加PBS清洗2次;最后用荧光显微镜放大100倍进行图像获取㊂6.流式细胞术:取对数生长期的TE-13细胞消化下来铺进6孔板,将si-SBF2-AS1和si-NC转染进TE-13细胞然后分别用0Gy和4Gy的X线照射后将细胞分为si-NC组㊁si-SBF2-AS1组㊁IR+ si-NC组和IR+si-SBF2-AS1组,每组设置3个复孔㊂收集细胞(约1ˑ106个),用预冷PBS清洗2次之后弃去PBS,在每管中加入100μl的binding buffer,轻轻吹打混匀;1000r/min离心5min,避光条件下每管加入0.5ml PI染色,重悬细胞,室温避光孵育15min后进行流式检测㊂7.Western blot法:取对数生长期的TE-13细胞消化下来铺进6孔板,将si-SBF2-AS1和si-NC 转染进TE-13细胞然后4Gy的X线照射后将细胞分IR+si-NC组和IR+si-SBF2-AS1组㊂待细胞长至70%~80%时用预冷PBS清洗2次,在每个孔中加入含有1μl cocktail的RIPA裂解液,并放在冰上裂解20min,之后将细胞刮下来,12000ˑg4ħ离心15min㊂取上清,按上清液的量加入5ˑSDS使其稀释成1ˑSDS,95ħ煮5min,用BCA蛋白测浓度㊂取40μg的蛋白用配好10%聚丙烯酰胺凝胶预混液电泳,转膜后用2%脱脂奶粉室温孵育2h,一抗4ħ摇床孵育过夜㊂TBST摇床清洗3次,每次5min,二抗室温孵育1h,TBST清洗3次,每次5min,采用ECL化学发光试剂盒显影㊂8.统计学方法:用Graphpad prism8.0统计学软件对实验数据进行分析㊂计量资料以均数ʃ标准差(xʃs)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义㊂结㊀㊀果1.SBF2-AS1在食管鳞癌细胞和食管正常上皮细胞中的表达水平:用RT-PCR检测人食管鳞癌细胞TE-13和人正常食管上皮细胞HET-1A中SBF2-AS1的表达㊂TE-13细胞中SBF2-AS1的表达(5.508ʃ0.283)明显高于HET-1A组(1.000ʃ0.344),差异有统计学意义(t=4.710,P=0.009),详见图1㊂图1㊀qRT-PCR检测SBF2-AS1在TE-13和HET-1A中的表达2.TE-13细胞存活:用si-SBF2-AS1和si-NC转染TE-13细胞,并用0Gy㊁2Gy㊁4Gy㊁6Gy和8Gy照射,结果显示,与si-NC组(100%ʃ0.00%㊁83.00%ʃ4.00%㊁69.00%ʃ7.00%㊁58.00%ʃ3.00%㊁36.00%ʃ6.00%)比较,si-SBF2-AS1组(100.00%ʃ0.00%㊁55.00%ʃ1.00%㊁26.00%ʃ5.00%㊁10.00%ʃ3.00%㊁4.00%ʃ4.00%)的细胞存活分数显著降低,差异有统计学意义(t=2.497,P=0.047),详见图2㊂图2㊀不同放射剂量下TE-13细胞的存活曲线㊃15㊃㊀㊀3.TE -13的A 值:与si -NC 组比较,IR +si -NC 组㊁si -SBF2-AS1组和IR +si -SBF2-AS1组在48h 和72h 的A 值显著降低㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组48h 和72h 的A 值显著降低㊂与si -SBF2-AS1组比较,IR +si -SBF2-AS1组48h 和72h 的A 值显著降低,差异有统计学意义,详见表1㊂表1㊀MTT 检测各组细胞的活力(x ʃs )组别0h 24h 48h 72h si -NC 组0.24ʃ0.000.39ʃ0.060.56ʃ0.020.78ʃ0.03IR +si -NC 组0.24ʃ0.000.52ʃ0.030.74ʃ0.05∗0.98ʃ0.04∗si -SBF2-AS1组0.24ʃ0.000.38ʃ0.030.63ʃ0.05∗0.83ʃ0.03∗IR +si -SBF2-AS1组0.24ʃ0.000.33ʃ0.070.43ʃ0.07∗#Δ0.58ʃ0.02∗#ΔF 1.97613.86429.632P0.0860.0080.002㊀㊀与si -NC 组比较,∗P <0.05;与IR +si -NC 组比较,#P <0.05;与si -SBF2-AS1组比较,ΔP <0.05㊀㊀4.TE -13细胞的增殖能力:与si -NC 组比较,IR +si -NC 组㊁si -SBF2-AS1组和IR +si -SBF2-AS1组增殖率显著降低㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组增殖率显著降低㊂与si -SBF2-AS1组比较,IR +si -SBF2-AS1组增殖率显著降低,差异有统计学意义,详见图3和表2㊂图3㊀EDU 检测各组细胞增殖水平A.si -NC 组;B.IR +si -NC 组;C.si -SBF2-AS1组;D.IR +si -SBF2-AS1组表2㊀干扰SBF2-AS1的表达联合放疗对TE -13细胞增殖率的影响(x ʃs )组别增殖率(%)si -NC 组77.00ʃ7.00IR +si -NC 组47.00ʃ4.00∗si -SBF2-AS1组51.00ʃ1.00∗IR +si -SBF2-AS1组23.00ʃ3.00∗#Δ㊀㊀F =97.75,P =0.000;与si -NC 组比较,∗P <0.05;与IR +si -NC 组比较,#P <0.05;与si -SBF2-AS1组比较,ΔP <0.05㊀㊀5.TE -13细胞凋亡:与si -NC 组比较,IR +si -NC 组㊁si -SBF2-AS1组和IR +si -SBF2-AS1组的细胞凋亡率显著升高㊂与IR +si -NC 组比较,IR +si -SBF2-AS1组的细胞凋亡率显著升高㊂与si -SBF2-AS1组比较,IR +si -SBF2-AS1组的细胞凋亡率显著升高,差异有统计学意义,详见图4和表3㊂6.干扰SBF2-AS1的表达联合放疗抑制E2F1蛋白的表达:与IR +si -NC 组(80.000ʃ3.215)比较,IR +si -SBF2-AS1组(45.000ʃ3.215)E2F1蛋白的表达量显著下降,差异有统计学意义(t =7.699,P =0.002),详见图5㊂讨㊀㊀论虽然现在食管鳞癌的治疗方法有很多种,放疗也是食管鳞癌治疗的主要手段之一,特别是对于胸中上段的食管鳞癌来说㊂新辅助放疗和术后辅助放疗都是食管鳞癌治疗的标准方法,尽管放射疗法及各种新型化疗药物的临床应用提高了治疗效果,但患者的生存率仍然较低,其中放疗抵抗被认为是导致食管鳞癌治疗失败的原因之一㊂因此寻找影响食管鳞癌放疗疗效的基因可能为以后提高放疗疗效奠定基础㊂lncRNA 是一种具有200多个核苷酸的非编码RNA,lncRNA 可以从表观遗传学㊁转录和转录后的角度调节生物体的生理功能㊂它们参与细胞增殖㊁分化㊁染㊃25㊃图4㊀流式细胞术检测各组细胞凋亡水平A.si -NC 组;B.IR +si -NC 组;C.si -SBF2-AS1组;D.IR +si -SBF2-AS1组表3㊀干扰SBF2-AS1的表达联合放疗对TE -13细胞凋亡的影响(x ʃs )组别凋亡率(%)si -NC 组7.59ʃ1.56IR +si -NC 组18.00ʃ1.34∗si -SBF2-AS1组15.31ʃ1.31∗IR +si -SBF2-AS1组27.10ʃ3.17∗#ΔF 214P0.000㊀㊀与si -NC 组比较,∗P <0.05;与IR +si -NC 组比较,#P <0.05;与si -SBF2-AS1组比较,ΔP <0.05图5㊀干扰SBF2-AS1的表达联合放疗对E2F1蛋白的影响色体重塑㊁表观遗传调控㊁转录和转录后调控等多种生物学过程[12,13]㊂根据其特征和功能,它们可以在多种肿瘤中起着促癌或抑癌因子的作用㊂随着ln-cRNA 研究的深入,它们也被发现可以调控化疗或者放疗的敏感度,这一发现为食管鳞癌的临床诊断和治疗提供了新的思路㊂lncRNA SBF2-AS1已被发现不仅在多种肿瘤中上调,而且对放疗也有影响㊂Yu 等[14]研究发现SBF2-AS1可以通过micoRNA -302a /MBNL3来增强非小细胞肺癌的辐射抗性㊂本研究结果显示,SBF2-AS1在食管鳞癌放疗抵抗细胞株中高表达㊂E2F1是一种转录因子,一般参与调节了细胞周期的进程㊂且有许多研究发现E2F1可以促进多种肿瘤生长如膀胱癌㊁垂体瘤和喉癌[15~17]㊂也有研究发现E2F1会影响恶性肿瘤放射治疗㊂研究发现TFAM 下调使E2F1下降导致G 1期阻滞进而抑制肿瘤细胞的增殖最后导致肿瘤细胞的放射敏感度提高[18]㊂microRNA -16-5p 通过调节细胞周期蛋白D1/E1-pRB -E2F1通路增强前列腺癌细胞的放射敏感度[19]㊂本研究发现E2F1在食管㊃35㊃鳞癌放疗抵抗细胞株中高表达㊂本研究结果显示SBF2-AS1可以使E2F1表达升高,SBF2-AS1可以促进食管鳞癌放疗抵抗细胞增殖,并且促进食管鳞癌放疗抵抗细胞中E2F1蛋白和mRNA的表达,由此可推断SBF2-AS1是通过促进E2F1表达来提高食管鳞癌细胞的放疗抵抗的,但关于SBF2-AS1调控E2F1的机制还应进行深入研究㊂参考文献1㊀Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistis 2018:GLO BOCN estimates of incidence and mortality worldwide for 36cancersin185countries[J].CA Cancer J Clin,2018,68(6): 394-4242㊀Malhotra GK,Yanala U,Ravipati A,et al.Lobal trends in esophage-al cancer[J].J Surg Oncol,2017,115(5):564-5793㊀Hussain S,Thakur N,Salam I,et al.Association of cyclinD1gene polymorphisms with risk of esophageal squamouscell carcinoma in Kashmir Valley:a high risk area[J].Mol Carcinog,2011,50: 487-4984㊀Zhang YW.Epidemiology of esophageal cancer[J].World J Gastro-enterol,2013,19(34):5598-56065㊀陈万青,李贺,孙可欣,等.2014年中国恶性肿瘤发病和死亡分析[J].中华肿瘤杂志,2018,1:5-136㊀中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜专业委员会.中国早期食管癌筛查及内镜诊治专家共识意见精简版(2014年,北京)[J].中华消化杂志,2015,35(5):294-2997㊀Guo J,Ding Y,Yang H,et al.Aberrant expression of lncRNA MAL-AT1modulates radioresistance incolorectal cancer in vitro via miR-101-3p sponging[J].Exp Mol Pathol,2020,115(undefined): 104448-1044748㊀Zhang S,Wang B,Xiao H,et al.LncRNA HOTAIR enhances breast cancer radioresistance through facilitating HSPA1A expression via se-questering miR-449b-5p[J].Thorac Cancer,2020,11(7): 1801-18169㊀Zhong QM,Chen YF,Chen ZL.LncRNA MINCR regulates irradia-tion resistance in nasopharyngeal carcinoma cells via the microRNA-223/ZEB1axis[J].CellCycle,2020,19(1):53-6610㊀Liu WH,Qiao HY,Xu J,et al.LINC00473contribut es to the ra-dioresistance of esophageal squamous cell carcinoma by regulating mi-croRNA-497-5p and cell divis ioncycle25A[J].Int J Mol Med, 2020,46(2):571-58211㊀Wang P,Yang Z,Ye T,et al.lncTUG1/miR-144-3p affect the radiosensitivity of esophageal squamouscell carcinoma by competitively regulating c-MET[J].J Exp Clin Cancer Res,2020,39(1):7-18 12㊀Tian T,Gong Z,Wang M,et al.Identifcation of long non-coding RNA signatures in triple-negativebreast cancer[J].Cancer Cell Int, 2018,17(18):10-1913㊀Quinn JJ,Chang HY.Unique features of long non-coding RNA bio-genesis and function[J].Nat Rev Genet,2016,17(1):47-62 14㊀Yu Z,Wang G,Zhang C,et al.LncRNA SBF2-AS1affects the ra-diosensitivity of non-small cell lungcancervia modulating micro RNA-302a/MBNL3axis[J].Cell Cycle,2020,19(3):300-316 15㊀Xu J,Hua X,Yang R,et al.XIAP Interaction with E2F1and Sp1 via itsBIR2and BIR3domains specific activated MMP2to promote bladder cancer invasion[J].Oncogenesis,2019,8(12):71-79 16㊀García-Martínez A,López-MuñozB,Fajardo C,et al.E2F1in-creased mRNA and miR-17-5p expression isCorrelated to invasive-ness and proliferationof pituitary neuroendocrine tumours[J].Diag-nostics(Basel),2020,10(4):227-24017㊀Li P,Lin XJ,Yang Y,et al.Reciprocal regulationof miR-1205and E2F1modulates progression of laryngealsquamous cell carcinoma[J]. Cell Death Dis,2019,10(12):916-92818㊀Jiang X,Wang J.Down-regulationof TFAM increases the sensitivi-tyof tumour cells to radiation via p53/TIGAR signalling pathway[J]. J Cell Mol Med,2019,23(7):4545-455819㊀Wang Fang,Mao Aihong,Tang Jinzhou,et al.microRNA-16-5p enhances radiosensitivity through modulating Cyclin D1/E1-pRb-E2F1pathway in prostate cancer cells[J].J Cell Physiol,2019,234 (8):13182-13190(收稿日期:2020-11-01)(修回日期:2021-01-06)(上接第13页)24㊀Wongwananuruk T,Panichyawat N,Indhavivadhana S,et al.Accu-racy of anti-Mullerian hormone and total follicles count to diagnose polycystic ovary syndrome in reproductive women[J].Taiwan J Obstet Gynecol,2018,57(4):499-50625㊀Mahajan N,Kaur J.Establishing an anti-Mullerian hormone cutoff for diagnosis of polycystic ovarian syndrome in women of reproductive age-Bearing Indian ethnicity using the automated anti-Mullerian hormone assay[J].J Hum Reprod Sci,2019,12(2):104-113 26㊀Casadei L,Fanisio F,Sorge RP,et al.The diagnosis of PCOS in young infertile women according to different diagnostic criteria:the role of serum anti-Mullerian hormone[J].Arch Gynecol Obstet, 2018,298(1):207-21527㊀Sova H,Unkila-Kallio L,Tiitinen A,et al.Hormone profiling,in-cluding anti-Mullerian hormone(AMH),for the diagnosis of poly-cystic ovary syndrome(PCOS)and characterization of PCOS pheno-types[J].Gynecol Endocrinol,2019,35(7):595-60028㊀Bleil ME,Gregorich SE,Adler NE,et al.Race/ethnic disparities in reproductive age:an examination of ovarian reserve estimates across four race/ethnic groups of healthy,regularly cycling women[J].Fer-til Steril,2014,101(1):199-20729㊀陈倩,傅亚富.抗苗勒管激素在多囊卵巢综合征中的临床应用[J].中国卫生检验杂志,2018,28(2):212-214(收稿日期:2020-09-28)(修回日期:2020-10-12)㊃45㊃。
金刚纂中木脂素对食管鳞癌细胞的抑制作用

Journal of China Pharmaceutical University2022,53(1):93-98学报金刚纂中木脂素对食管鳞癌细胞的抑制作用戚微岩1,夏春磊1,安柔锦1,高新梅1,李东平1,徐寒梅1,2*(1中国药科大学江苏省合成多肽药物发现与评价中心,南京211198;2中国药科大学天然药物活性组分与药效国家重点实验室,南京211198)摘要金刚纂(Euphorbia neriifolia L.)是大戟科植物,采用硅胶柱色谱以及制备HPLC等多种色谱技术,从金刚纂地上部分中分离出5个已知的木脂素成分,并对这5种木脂素的潜在抗肿瘤活性进行体外研究,其中化合物2对食管鳞癌细胞,特别是KYSE-410和KYSE-450细胞,表现出增殖抑制和细胞毒性。
机制研究进一步证明化合物2可通过激活caspase-3/9及下调Bcl-2/Bax蛋白表达比例,诱导癌细胞发生显著凋亡。
实验结果显示,化合物2在体外对食管鳞癌细胞,尤其是KYSE-410细胞具有显著抑制作用,表明化合物2具有良好的抗肿瘤活性,应对其进行深入研究。
关键词金刚纂;木脂素;抗肿瘤活性;细胞凋亡中图分类号R931.6;R965文献标志码A文章编号1000-5048(2022)01-0093-06doi:10.11665/j.issn.1000-5048.20220114引用本文戚微岩,夏春磊,安柔锦,等.金刚纂中木脂素对食管鳞癌细胞的抑制作用[J].中国药科大学学报,2022,53(1):93–98.Cite this article as:QI Weiyan,XIA Chunlei,AN Roujin,et al.Suppressive effect of lignans from Euphorbia neriifolia L.on esophageal squa⁃mous cancer cell[J].J China Pharm Univ,2022,53(1):93–98.Suppressive effect of lignans from Euphorbia neriifolia L.on esophageal squamous cancer cellQI Weiyan1,XIA Chunlei1,AN Roujin1,Gao Xinmei1,LI Dongping1,XU Hanmei1,2*1The Engineering Research Center of Synthetic Polypeptide Drug Discovery and Evaluation of Jiangsu Province,China Pharmaceutical University,Nanjing211198;2State Key Laboratory of Natural Medicines,China Pharmaceutical University,Nanjing 211198,ChinaAbstract Eubhorbia neriifolia L.is a plant of Euphorbia family.Five known lignans were isolated from the aerial parts of E.neriifolia L.by silica gel for column chromatography and preparative high-performance liquid chromatography(HPLC).Their potential antitumor activities were evaluated in pound2exhibited proliferation inhibition and cytotoxicity against esophageal squamous cancer cells,especially KYSE-410and KYSE-450cells.Further analyses showed that compound2could significantly induce apoptosis through the activation of caspase3/9and down-regulation of the Bcl-2/Bax protein ratio.These results suggested that compound2had a significant inhibitory effect on the esophageal squamous cancer cells,especially KYSE-410, which deserves further research as a potential antitumor agent.Key words Euphorbia neriifolia L.;lignans;antitumor activity;cell apoptosisThis study was supported by the Natural Science Foundation of Jiangsu Province(No.BK20180569)大戟科植物包含约2000个种属,广泛分布在热带和温带地区[1]。
基于基因芯片技术探讨安罗替尼靶向治疗食管鳞状上皮细胞癌的作用机制研究

基于基因芯片技术探讨安罗替尼靶向治疗食管鳞状上皮细胞癌的作用机制研究摘要:目的基于基因芯片技术探讨安罗替尼靶向治疗食管鳞状上皮细胞癌的作用机制研究。
方法从细胞层面、实体肿瘤层面对安罗替尼治疗食管癌进行探索,qRT-PCR和Western blotting分析,以解决安罗替尼影响TE-1细胞的转录组的变化及其在肿瘤异种移植模型中表现出抗癌活性。
结果在体内,安洛替尼降低了肿瘤大小、肿瘤重量以及肿瘤重量与体重的比率,与5-FU+DDP相比,体重减轻更少。
在体外,以50%生长抑制浓度9.454μM的剂量依赖性方式抑制/M期阻滞TE-1细胞;增TE-1细胞生长24小时,在早期和晚期诱导凋亡,在G2强P21、Bax和p-AKT的表达,同时降低细胞周期蛋白B1、CDK1和Bcl-2的表达。
/ M期细胞凋亡并阻结论安罗替尼可以在体内外抑制TE-1细胞的生长,诱导G2滞细胞周期,通过改变caspase-3,Bcl-2,Fos和ZNRF3的表达而降低其表达。
关键词:安罗替尼;食管鳞状上皮细胞癌;细胞周期;细胞凋亡;项目基金:本文系2019年度海南省重点研发计划项目(社会发展方向)的研究成果,项目名称为“基于基因芯片技术探讨安罗替尼靶向治疗食管鳞状上皮细胞癌的作用机制研究”,项目编号:ZDYF2019174。
食管癌(EC)的特点是具有较高的发病率和死亡率[1],在诊断的恶性肿瘤中排名第八。
它由两种主要的组织学亚型组成,腺癌(AC)和鳞状细胞癌(SCC)以及主要的亚型SCC。
即使在外科手术,术前化学疗法和放射疗法方面取得了巨大进步,其生存率仍然很低,其5年生存率在15%至20%之间,中位生存期为1.5年[2]。
安洛替尼是一种新批准的多激酶抑制剂,在中国将三线治疗作为晚期非小细胞肺癌(NSCLC)的治疗药物[3]。
它作用于血管内皮生长因子受体(VEGFR)1至VEGFR 3,成纤维细胞生长因子受体(FGFR)1至FGFR 4,血小板源性生长因子受体(PDGFR)和干细胞因子受体(c-kit),以预防新生血管生成和肿瘤进展[4]。
核酸药物在癌症治疗中的应用

核酸药物在癌症治疗中的应用近年来随着医疗技术不断进步,核酸药物作为一种新型的生物制剂,正在成为癌症治疗中的新宠。
与传统的化疗药物相比,核酸药物不仅能够对肿瘤实现更为精准的靶向作用,同时还具备更低的毒副作用和更高的治疗效果。
本文将详细介绍核酸药物在癌症治疗中的运用情况和未来发展趋势。
一、核酸药物的分类和作用机制核酸药物主要包括三种类型:siRNA、miRNA和抗合成酶DNA(antisense oligonucleotides)。
siRNA和miRNA主要用于基因沉默和靶向治疗,而抗合成酶DNA主要用于遏制细胞的DNA或RNA的转录作用。
核酸药物作用机制主要包括基因沉默和基因表达调控。
基因沉默是指通过siRNA和miRNA等技术,抑制目标基因的转录和翻译过程,从而达到抑制肿瘤增殖的目的。
基因表达调控是指通过抗合成酶DNA技术,在细胞内靶向抑制DNA 或RNA的合成,从而遏制肿瘤细胞的生长和分裂。
二、核酸药物的应用情况目前,核酸药物在癌症治疗中的应用已经相当广泛。
以下几种癌症是目前核酸药物应用的主要领域。
1、肝癌肝癌是世界范围内发病率最高的癌症之一。
siRNA和miRNA已经被应用于肝癌的治疗中。
通过基因沉默和靶向治疗,这些核酸药物能够精准地抑制肝癌细胞的增殖和转移,从而大大提高了肝癌患者的生存率。
2、乳腺癌乳腺癌是女性最常见的恶性肿瘤之一。
在乳腺癌治疗中,抗合成酶DNA是最常用的核酸药物。
通过靶向抑制乳腺癌细胞的DNA或RNA的合成,这些药物能够有效遏制癌瘤的生长和转移,并减少毒副作用。
3、胃肠癌胃肠癌是消化系统中最常见的肿瘤之一。
siRNA和miRNA已经在胃肠癌治疗中得到广泛应用。
通过基因沉默和靶向治疗,这些药物能够精准地抑制胃肠癌细胞的增殖和转移,从而提高了其治疗效果。
三、核酸药物的发展趋势尽管核酸药物在癌症治疗中的应用已经有了长足的进展,但是其研究还存在很多挑战和问题。
以下是该领域的未来发展趋势:1、技术不断升级随着生物技术的不断进步,核酸药物的研究和开发也在不断升级。
CHFR、CDKN2 A甲基化在食管鳞癌KYSE150、KYSE180细胞系放射抵抗中的作用

CHFR、CDKN2 A甲基化在食管鳞癌KYSE150、KYSE180细胞系放射抵抗中的作用梅新宇;程民;王亮;解明然;吴显宁【期刊名称】《中国老年学杂志》【年(卷),期】2018(038)016【摘要】目的探讨抑癌基因CHFR、CDKN2A甲基化在食管鳞癌放射抵抗中的作用.方法食管鳞癌细胞系KYSE150、KYSE180经辐照处理后形成稳定的放射抵抗细胞克隆KYSE150-8 Gy,KYSE180-8 Gy,对原始细胞系和放射抵抗细胞系抑癌基因CHFR、CDKN2A进行DNA提取、甲基化处理及焦磷酸测序,再对样本mRNA 进行提取并采用实时聚合酶链反应(RT-PCR)检测其表达.并配对比较细胞系增殖能力.结果 KYSE150、KYSE180及KYSE150-8 Gy、KYSE180-8 Gy细胞系均有CHFR及CDKN2A基因DNA甲基化现象,且放射抵抗细胞系DNA甲基化程度高于原始细胞系,相应基因表达低于原始细胞系,且放射抵抗细胞系增殖能力显著高于原始细胞系.结论 CHFR、CDKN2A基因高甲基化导致肿瘤抑制功能的丧失,使食管鳞癌细胞DNA修复能力和抗凋亡能力显著加强,并因此抗拒了放射线的灭活,同时增强了肿瘤的增殖能力.【总页数】3页(P4011-4013)【作者】梅新宇;程民;王亮;解明然;吴显宁【作者单位】中国科学技术大学附属第一医院安徽省立医院胸外科,安徽合肥230001;安徽省老年医学研究所;安徽省老年医学研究所;中国科学技术大学附属第一医院安徽省立医院胸外科,安徽合肥 230001;中国科学技术大学附属第一医院安徽省立医院胸外科,安徽合肥 230001【正文语种】中文【中图分类】R735.5【相关文献】1.氯离子通道蛋白1调控放射抵抗食管鳞癌细胞放射敏感性的机制 [J], 张静平;陈鑫;惠蓓娜;孟君琦;张晓智2.肝癌细胞系中SLIT2、DAPK、RIZ1、CHFR、EDNRB、3-OST-2基因甲基化状态 [J], 李培坤;耿小平;朱立新;李晓明;刘付宝;赵红川3.5-氮杂-2'-脱氧胞苷对胃癌AGS细胞CHFR基因去甲基化作用及意义 [J], 邱庆安;吕云福;陈一明;林友刚;伍海鹰;刘宁4.异丙酚通过miR-218抑制人食管鳞癌细胞系KYSE150的侵袭和迁移 [J], 高虹; 金慧; 刘春芝; 杨静远5.miR-132在食管癌细胞系KYSE150中对靶基因FOXA1的调控作用 [J], 李书军;陈彦亮;江中太;牛颂歌;吕宝雷;吴文新因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水 平 的 表 达 差 异 有 > 倍 以 上 $ "/$%& 是 从 人 心 脏
...’\H’\\H\H\%@a 和 下 游 引 物 Fa%\’HHHH.\. H’HHH’\\HH%@a 扩 增 "/$%* 开 放 阅 读 框 全 长 +,-. ! 并克隆于 ;Y,DQ%’ 载体上 $ 测序后用 !"# $ 和 $%&I % 进行酶切 ! 琼脂糖凝胶电泳分离纯化 $
将 纯 化 后 的 "/$%* 全 长 +,-. 和 用 合 适 限 制 酶 消 化 ( 纯 化 后 的 ;+,-.@CD c 4_+%b61 )d *)Z7e62<3J:7 * 载 体 进 行 连 接 $ 得 到 反 义 真 核 表 达 载 体 "/$%f c
+,-. 文 库 中 得 到 的 12345267 的 同 源 物 ! 是 12345267
!(**%&;($<%$/% =( # >? @+$AB+ C%, # :D5495D0E:033E F+G #:D5715D0E:313E HAI+#, # <+),J<K=&#$L")+8%<)8/$
收 稿 日 期 ! 0113A12A70 修 回 日 期 ! 0113A1DA07
0 表 达 上 调 促 进 CH70 细 胞 过 度 生 长 和 增 殖 # 并 参 与 食 管 鳞 癌 的 转 移 %
!"/
细胞转染 采用 /6;3K:+25467:’Y &WWW )Z7e62<3J:7 * 转 染 试
剂 ! 按照具体说明进行操作 $ ’NO& 细胞接种于 > 孔 板上 ! 待细胞生长到 VWX?>WX 密度时进行转染 $ 在
O 48 无血清培养 基 中 混 合 VCW &J "/$%& 真 核 表 达
基因超家族的一员
%)?@ &
$ "/$%* 蛋白在人体组织中广
%*&
泛分布 ! 其中在骨骼肌和心脏中的表达水平较高 $
"/$%* 基 因 定 位 于 A;B@CD ! 由 DE 个 外 显 子 和 A 个
内 含 子 组 成 ! 长 约 @ *FE G; ! 编 码 长 约 DCF 9G 的
4=-. ! 指 导 有 @F> 个 氨 基 酸 组 成 的 多 肽 链 的 合
成
%*!@ &
;+g-.@CO c 4_+%b61 )d * 克 隆 ! 摇 菌 ! 测 序 ! 检 查 插 入
片段是否正确 $
$ "/$%* 蛋白由 @ 个主要的结构域组成 ’-% 端
%*&
!% 螺旋区 ( 由 !% 螺旋和 "% 折叠交替组成的结构域
和 H% 端结构域 $ 目前尚无 "/$%* 参与肿瘤发生的相关报道 $ 本 研 究 验 证 了 "/$%* 在 食 管 鳞 癌 组 织 中 高 表 达 的 结 果 ! 并 以 "/$%* 开 放 阅 读 框 )3;:7 <:5I67J K<54: !
应 用 +,-. 微 阵 列 从 食 管 鳞 癌 配 对 组 织 中 得 到一批在食管鳞癌中差异表达的基因! 其中包括
以 > 月龄女性胎儿的食管上皮组织总 =-. 逆 转录的 +,-. 为模板 !以上游引物 Fa%\\H\\’’\\\
"/$%0 "12345267%869: ;<32:67 * ! "/$%* #$ 它在 4=-.
质粒和 &F &8 /6;3K:+25467:’Y &WWW 转染试剂 $ 培养
L=M * 全长 +,-. 构建的真核表达质粒转染食管 鳞
癌细胞系 ’NO* ! 以进一步研究它对食管鳞癌细胞 系生长特性的影响 $
&V h 后 ! 加入含血清的培养基继续培养 $ 利用终浓
度为 &WW &J c 48 的 \VOQ 进 行 筛 选 ! 挑 取 单 克 隆 进 行 =’%$H= 鉴定 $
. "# 2 A’BB7?7+:’2<<C 7D>?7EE7A ,7+7 *F:2’+7A B?*; 7E*>42,72< EG82;*8E H7<< H2?H’+*;2
! I9JJ "
7D>?7EE7A ’+ I9JJ :’EE87EL M4’E E:8AC N2E :* H*+B’?; *K7?(7D>?7EE’*+ *B 9&@(. ’+ I9JJ :’EE87E # :* H*+E:?8H: 78=2?C*:’H 7D>?7EE’*+ ><2E;’A *B 9&@(. # 78 清 华 大 学 自 动 化 系
通 讯 作 者 !李 衍 达
A7H?72E7A 7D>?7EE’*+ *B 9&@(. ’+ MI-. H7<<E #
2+A >?*<’B7?2:’*+ # 2+A H7<< 2A47E’K7 2F’<’:CL BQIB7H!MQI ! 3>(?7,8<2:’*+ *B 9&@(. ,7+7 ;’,4: H*+:?’F8:7 :* 4C>7?>?*<’B7?2:’*+ *B MI-. H7<<E # ;7:2E:2E’E *B I9JJL F’RSGEJ! ! I7E*>42,72< +7*><2E;E $ 9:*;2:’+(<’=7 >?*:7’+ . ! 9&@(. "$ J7<< :?2+EB7H:’*+
生物信息学教育部重点实验室" 北 京 4999:3
2+A ’+K7E:’,2:7 :47 ?*<7 *B 8>(?7,8<2:’*+ *B 9&@(. ’+ ’+’:’2:’*+ 2+A >?*,?7EE’*+ *B I9JJL O’&PQJ! ! 97;’(G82+:’:2:’K7 ?7K7?E7 :?2+EH?’>:’*+(>*<C;7?2E7 H42’+ ?72H:’*+ ! OM(@JO " N2E 8E7A :* A7:7H: 7D>?7EE’*+ *B 9&@(. ’+ I9JJ :’EE87EL 18<<(<7+,:4 *>7+(?72A’+, B?2;7 ! PO1 " *B 9&@(. N2E 2;><’B’7A B?*; H/$# *B +*?;2< 7E*>42,72< 7>’:47<’2 FC @JO # 2+A ’+E7?:7A ’+:* >H/$#QL- R ;CH("’E !S " :* H*+E:?8H: 2 78=2?C*:’H 7D>?7EE’*+ ><2E;’A *B 9&@(.L M47+ :47 ?7H*;F’+2+: N2E :?2+EB7H:7A ’+:* I9JJ H7<< <’+7 MI-.L @*E’:’K7 H7<< H<*+7E N7?7 E7<7H:7A FC E7;’(G82+:’:2:’K7 OM(@JOL 5MM 2EE2C # ><2:7 H<*+7 B*?;2:’*+ 2EE2C # B<*N HC:*;7:?C # 2+A 5M9 2EE2C N7?7 >7?B*?;7A :* ;72E8?7 :47 7BB7H: *B 9&@(. *+ MI-. H7<<EL E’!H7&! ! 9&@(. N2E *K7?(7D>?7EE7A ’+ I9JJ :’EE87EL 97+E7 R 2+:’E7+E7 78=2?C*:’H 7D>?7EE’*+ ><2E;’AE *B 9&@(. N7?7 #+:’E7+E7 :?2+EB7H:’*+ *B 9&@(. ,7+7 <7A :* 9 >42E7 2??7E: # 2+A E8>>?7EE7A H7<< ,?*N:4 2+A H*+E:?8H:7AL
关 键 词 ! 食 管 肿 瘤 $ P>QA0 $ 细 胞 转 染 中 图 分 类 号 ! SET287 文 献 标 识 码 !O 文 章 编 号 ! 799953DEX ! 0992 " 9059722592
!"#
张 立 勇 ! 等 ! "#$%& 基 因 反 义 核 酸 对 食 管 鳞 癌 细 胞 系 ’()* 生 长 和 增 殖 的 影 响
