苯酚
苯酚 性质、用途与生产工艺

苯酚性质、用途与生产工艺概述苯酚(英文Phenol)又称石炭酸,分子式C6H5OH,常温下纯净的苯酚是无色针状晶体,具有特殊的气味(与浆糊的味道相似),酸性极弱(弱于碳酸),熔点是43℃,凝固点40.9℃,比重1.071,沸点182℃,燃点79℃。
露置在空气中因小部分发生氧化而显粉红色,在有氨、铜、铁存在时会加快变色,在潮湿空气中,吸湿后,由结晶变成液体。
常温时苯酚含水27%就成为均匀液体,随含水率继续增加,液体分二层,上层为苯酚在水中溶液;下层为水在苯酚中溶液。
苯酚含水时其凝固点急剧下降。
含水1%凝固点为37℃,含水5%凝固点为24℃。
苯酚剧毒,空气中最大允许蒸汽浓度0.005mg/L,其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾到皮肤上,应立即用酒精洗涤。
实验室可用溴(C6H5—OH + Br2 = C6H2(Br3)—OH + 3HBr生成白色沉淀2,4,6-三溴苯酚,十分灵敏)及FeCL3(6C6H5OH+FeCL3 →H3[Fe(C6H5O)6]+3HCl生成〔Fe(C6H5O)6]3-络离子呈紫色)检验.溶解性室温微溶于水,能溶于苯及碱性溶液,易溶于乙醇、乙醚、氯仿、甘油、丙三醇、冰醋酸等有机溶剂中,难溶于石油醚。
在水中的溶解度为:11℃时为4.832%;35℃时为2.360%;58℃时为7.330%;77℃时为11.830%;84℃时苯酚与水可以任意比例混溶。
水中溶解度(g/100ml)不同温度(℃)时每100毫升水中的溶解克数:8.3g/20℃;混溶/40℃与浓溴水的反应苯酚与溴水的取代反应,由于苯酚能溶解难溶于水的三溴苯酚,为了防止没有反应完的苯酚对三溴苯酚的溶解作用,实验时要使用浓溴水,最好用饱和溴水。
同时,苯酚水溶液要尽量稀一些。
实验时还应注意控制溴水的用量,因过量的浓溴水会跟三溴苯酚反应生成黄色沉淀,因此,溴水的量也不要过多。
当出现白色沉淀时,立即停止加溴水,如果改向溴水中滴加苯酚,生成的沉淀不会溶解。
苯酚是什么

苯酚是什么苯酚是一种广泛应用的有机化合物,也被称为羟基苯或碳酸基酚。
它是由苯环上的一个氢原子被一个羟基取代而形成的。
苯酚是无色结晶固体,有特殊的芳香味道。
在本文中,我们将探讨苯酚的化学性质、用途以及对环境和健康可能产生的影响。
首先,苯酚的化学性质使其具有广泛的用途。
由于它具有强大的抗菌性能,所以在制造消毒剂和杀真菌剂时被广泛应用。
此外,苯酚也被用作生物化学试剂,如DNA和RNA的提取和纯化过程中的溶剂。
此外,苯酚还用于制造塑料、染料、杀虫剂等各种产品。
然而,尽管苯酚有许多有用的用途,但它也对环境和人类的健康产生潜在的危害。
苯酚是一种可能有毒的物质,吸入或接触大量苯酚可能会对人体产生严重的危害。
长期接触高剂量的苯酚可能导致中毒症状,包括头痛、恶心、呕吐、中枢神经系统抑制等。
此外,苯酚还可以对水生生物产生毒性影响,污染水体中的苯酚可能导致生态系统的破坏。
对于苯酚的环境排放和处理也是一个重要的问题。
苯酚的排放往往来自于工业废水和废弃物处理厂等源头,这些排放物质可能对环境和水资源造成污染。
为了减少苯酚的排放,需要加强工业企业的管理和监督,实施严格的环境保护措施。
此外,苯酚的处理也是一个挑战,因为苯酚在水中的溶解度较高,容易被传播和扩散。
为了减少苯酚对环境和人类健康的潜在危害,许多国家和地区都制定了相关的法规和标准。
这些法规要求企业减少苯酚的排放,采取有效的治理措施,并对苯酚的使用进行限制。
此外,相关的监测和检测方法也得到了广泛的研究和应用,以保证人们生活和工作环境中的苯酚浓度处于安全水平。
总结起来,苯酚是一种有机化合物,具有广泛的应用。
它具有杀菌功能,可用于制造消毒剂和杀真菌剂等产品。
然而,长期接触高剂量的苯酚可能对人体和环境产生危害。
因此,加强苯酚的管理和监控,减少苯酚的排放,对于保护人类健康和环境具有重要意义。
同时,还需要进一步研究苯酚的毒性机制和治理技术,以期找到更好的解决方案。
苯酚

苯酚苯酚(C6H6O,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
常温下为一种无色晶体。
有毒。
有腐蚀性,常温下微溶于水易溶于有机溶液;当温度高于65℃时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤。
暴露在空气中呈粉红色。
苯酚是一种常见的化学品,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
【中文名称】苯酚;石炭酸【英文名称】phenol【结构或分子式】所有C原子均以sp2杂化轨道形成σ键,O原子均以sp3杂化轨道形成σ键。
【相对分子量或原子量】94.11【密度】1.071【熔点(℃)】42~43【沸点(℃)】182【折射率】1.5425(41)【毒性LD50(mg/kg)】大鼠经口530。
【性状】无色或白色晶体,有特殊气味。
【溶解情况】溶于乙醇、乙醚、氯仿、甘油、二硫化碳等。
【用途】用于制染料合成树脂、塑料、合成纤维和农药、水杨酸等。
作外科消毒剂消毒能力大小的标准(石炭酸系数)。
【制备或来源】由煤焦油经分馏,由苯磺酸经碱熔。
由氯苯经水解,由异丙苯经氧化重排。
【其他】加热至65℃时能溶于水(在室温下,在水中的溶解度是9.3g,当温度高于65℃时能与水混溶),有毒,具有腐蚀性如不慎滴落到皮肤上应马上用酒精(乙醇)清洗,在空气中易被氧化而变粉红色。
在民间有土方用石炭酸来治皮肤顽疾,以毒攻毒,如用来治脚底起泡。
三维结构一种重要的苯系中间体[1]。
又称石炭酸。
低熔点(43℃)白色晶体,在空气中放置及光照下变红,有臭味,沸点181.84℃。
对人有毒,要注意防止触及皮肤。
工业上主要由异丙苯制得。
苯酚产量大,1984年,世界总生产能力约为5兆吨。
苯酚用途广泛。
第一次世界大战前,苯酚的唯一来源是从煤焦油中提取。
绝大部分是通过合成方法得到。
有磺化法、氯苯法、异丙苯法等方法。
分子结构:苯环上的C原子以sp2杂化轨道成键,O原子以sp3杂化轨道成键。
苯酚主要用于制造酚醛树脂,双酚A及己内酰胺。
苯酚

如何除去溶解在苯中少量的苯酚?
(2)苯环上的取代反应
注意:
①浓溴水使苯酚再苯环上发生取代反应。说明羟基对
苯环产生了影响,使取代更易进行。
NH2
②溴取代再苯环的邻、对位。
③反应灵敏,可用于苯酚的定性检验与定量测定。但 不能测定苯酚的存在。
OH
HO
CH CH
OH
1摩最多能与( 6 )摩溴水发生反应
(3)显色反应
遇FeCl3溶液显紫色,利用这一反应可用于检验 苯酚或Fe3+的存在。
练:不用任何试剂鉴别:苯酚、NaOH、 FeCl3、AgNO3、Al(NO3)3、MgCl2、 NaNO3六种溶液。
四、苯酚的制备:
SO3H
SO3Na
ONa
OH
浓硫酸
140—160 ℃
Na2SO3
固体NaOH 320—350 ℃
; 太阳能路灯
;
最后也悲伤如老汉。所谓才华、才学、才识,只有变为才能并施于生活的时候,才有用。别忘了,才和能在造词的时候是联在一起的。人们爱说一句话:行善。其实行善之小端是施舍,大端是以满腔的能耐作用社会。 书中并无黄金屋,读而有识,笃做笃行,才有金屋,而且别人偷也偷 不走。 ? 《青年文摘》2007、9 惭 愧 惭愧是一个人在事实的镜子里,看见自己面容的丑陋之后的赧然。 ? ? 惭愧者势必在某一段时间内高估了自己的能力,然后为能力不逮而开始恨自己。 ? ?惭愧的前身一般叫做冲动。冲动是那种不计后果与不了解规则的竞技。它在满足了热血沸腾 之后,立刻就宣告失败。 惭愧的人眼界不是太宽,判断事物太过绝对。为什么老年人不容易惭愧?因为他们尽管弱骨支离,但见闻广博。并不是说只有渊博的人才不惭愧,其实比学识更重要的是襟怀。一个人即使不断学习,仍然会有知识盲区,但谦虚的态度可使人免
苯酚
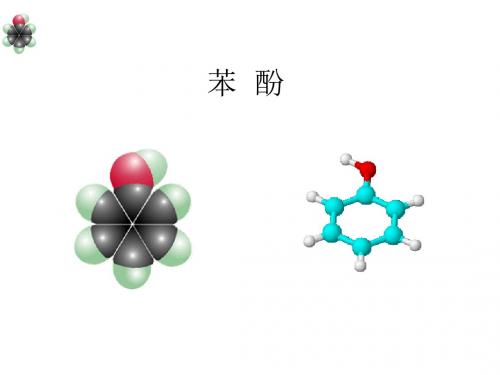
1、组成和结构 分子式: C6H6O
结构简式:
OH
OH
或C6H5OH
官能团: -OH
2、物理性质 无色晶体(放置时间较长的苯酚为粉红色) 有特殊气味, 熔点43℃,
2、物理性质 无色晶体(放置时间较长的苯酚为粉红色) 有特殊气味, 熔点43℃, 室温下,在水中的溶解度是9.3g,当温度高 于65℃时,能与水混溶, 易溶于乙醇等有机溶剂, 有毒、有腐蚀性。
苯酚化学性质探究
• 实验仪器:试管、胶头滴管、药匙 • 实验药品:苯酚、蒸馏水、酸性高锰酸钾 溶液、NaOH溶液、盐酸 • 探究:1、苯酚的氧化反应 2、苯酚的酸性
(2)弱酸性
OH + NaOH ONa + H2O
ONa + HCl
OH + NaCl
ONa + CO2 + H2O
OH + NaHCO 3 NaHCO 33
酸性:H2CO3>C6H5OH>HCO3-
思考
• 分析苯酚的结构,猜想苯酚的酸性是由哪 部分结构决定的? • 为什么乙醇中也有羟基,但却没有酸性?
类别 结构简式 官能团 酸性 与钠反应
乙醇 CH3CH2OH -OH 无 比水缓和 酚羟基比醇羟基活泼
苯酚
-OH 有 比水剧烈
结论பைடு நூலகம்
原因
苯环对酚羟基的影响使羟基上的氢变得 更活泼,易电离出H+
羟基对苯环是否有影响?
OH
(3)取代反应
OH + 3Br2 Br OH Br + 3HBr
Br
类别 结构简式
苯
苯酚
液溴 饱和溴水 溴的状态 条件 FeBr3作催化剂 不需要催化剂 溴 化 反 应
苯酚

弱酸性
-OH
酸性:碳酸>苯酚>碳酸氢钠 -O- + H+
-OH + NaOH -ONa +HCl
-ONa + H2O -OH + NaCl
-ONa + CO2 + H2O
-OH + Na2CO3 石炭酸
-OH + NaHCO3 -ONa + NaHCO3
(2)苯酚的取代反应
实验现象:向苯酚溶液中加浓溴水,立即有白色沉淀产生。 实验结论:苯酚分子中苯环上的氢原子很容易被溴原子取 代,生成2,4,6-三溴苯酚,反应的化学方程式为:
苯酚
一、物理性质
纯净的苯酚是无色有特殊气味的晶体,密度 比水大,常温时在水中溶解度不大,当温度 高于65℃时能与水以任意比互溶,易溶于 乙醇。露置于空气中因小部分氧化而显粉红 色,所以要密封保存。苯酚有毒,具有杀菌 消毒的作用。苯酚的浓溶液对皮肤有强烈的 腐蚀性,如皮肤上不慎沾有苯酚浓溶液,应 用大量酒精冲洗。
实验结论: ①室温下,苯酚在水中的溶解度较小。 ②苯酚能与NaOH反应,表现出酸性,俗称
石炭酸:
+NaOH→
+H2O
活动:探究苯酚酸性与H2CO3酸性比较
盐酸
石 灰 石
ONa + CO2 + H2O
苯酚钠 溶液
OH+NaHCO3
苯酚浊溶—ONa + NaHCO3
二、苯酚的结构
1、分子式: C6H6O 2、结构简式:
或
或 C6H5OH
比例模型
球棍模型
三、化学性质
(1)苯酚的酸性 实验步骤:
①向盛有少量苯酚晶体的试管中加入2 mL蒸馏水, 振荡试管。 ②向试管中逐滴加入5%的NaOH溶液并振荡试管。 ③将②中溶液分为两份,一份加入稀盐酸,另一份 通入CO2。 实验现象: ①得到浑浊的液体。 ②浑浊的液体变为澄清透明的液体。 ③两澄清透明的液体均变浑浊。
苯酚

苯酚【知识要点】一、苯酚的结构苯酚:分子式:C6H6O 结构简式:或C6H5OH二、物理性质无色晶体,有特殊气味,在空气中易被氧化而呈粉红色,熔点低,常温下在水中溶解度不大,加热时易溶(>65℃时任意比溶于水),易溶于乙醇等有机溶剂,有腐蚀性三、化学性质(一)、弱酸性(石炭酸)石炭酸酸性比碳酸弱,不能使酸碱指示剂变色酸性:H2CO3 > C6H5OH > HCO3-(二)、苯环上的取代反应(三)、显色反应(四)、加成反应四、用途:化工原料,制酚醛树脂、医药、染料等,稀溶液用作防腐剂和消毒剂。
【典型例题】例题1苯酚沾在皮肤上,正确的处理方法是().酒精洗涤 B.水洗 C.氢氧化钠溶液洗涤 D.溴水处理例题2下列有机物属于酚的是(). C6H5—CH2OH C HO—C6H4—CH3. C10H7—OH D C6H5—CH2CH2OH例题3除去苯中所含的苯酚,可采用的适宜方法是()A 加70℃以上的热水,分液 B. 加适量浓溴水,过滤C 加足量NaOH溶液,分液 D. 加适量FeCl3溶液,过滤例题4下列有机物不能与HCl直接反应的是()A苯 B.乙烯 C.丙醇 D.苯酚钠例题5为了把制得的苯酚从溴苯中分离出来,正确的操作是()A. 把混合物加热到70℃以上,用分液漏斗分液B. 加烧碱溶液振荡后分液,再向上层液体中加盐酸后分液C. 加烧碱溶液振荡后分液,再向上层液体中加食盐后分液D. 向混合物中加乙醇,充分振荡后分液例题6用一种试剂就能区分开苯酚、乙醇、NaOH溶液、AgNO3溶液、KSCN溶液这六种无色液体。
它是()A.水B.FeCl3溶液C.金属钠D.CuO例题7由C6H5—、C6H4—、—CH2—、—OH四种原子团共同组成属于酚类的物质,可得到的结构有()A.2种B.3种C.4种D.5种例题8能证明苯酚具有弱酸性的方法是()①苯酚溶液加热变澄清②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水。
苯 酚

例3.A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出H2。A不与NaOH溶液反应,而B能与NaOH溶液反应。B能使适量溴水褪色,并产生白色沉淀,A不能。B的一溴代物有两种结构。试推断A和B的结构,并说明它们各属于哪一类有机物。
解析:本题重点考查酚和醇的结构及性质的区别。由于A、B都能与金属钠反应放出氢气,且这两种物质分子中都只含一个氧原子,所以它们结构中都有羟基,即它们为醇或酚;A不与NaOH溶液反应,说明A为醇,结构简式可写成C7H7OH。B能与NaOH溶液反应,B为酚。分子中一定含苯环,分子式可写成CH3C6H4OH;A不能使溴水褪色,说明分子中不能有不饱和链烃基,再从组成分析它应含有苯环,即A是一种芳香醇——苯甲醇C6H5CH2OH。B能使溴水褪色,并生成白色沉淀,进一步证明它是酚类。甲基苯酚CH3C6H4OH,甲基苯酚有邻、间、对三种同分异构体。但只有对甲苯酚的一溴代物含有两种结构:
答案:5种
其中苯甲醇、苯甲醚不属于苯酚同系物。
例5.已知酸性强弱顺序为H2CO3>C6H5OH>HCO ,下列化学方程式正确的是( )
分析:从试题所给的信息可知:H2CO3、C6H5OH、HCO ,均是弱酸,它们都可以部分电离出H+离子。
其电离式:
6C6H5OH+Fe3+→ +6H+,此为特征反应,可以检验苯酚,反之检验Fe3+。
4.加成反应
苯酚中含有苯环,在一定条件下可以和H2发生加成反应。
5.氧化反应:①易被空气中的氧气氧化而显粉红色。
②苯酚可以使酸性高锰酸钾溶液发生氧化还原反应而褪色。
例2.试用一种试剂区别苯、苯酚溶液、己烯和CCl4,说明依据。
苯酚化学式

苯酚化学式一、苯酚的基本介绍苯酚又称为羟基苯,其化学式为C6H5OH。
分子式中的OH表示羟基,是一种含有羟基的有机化合物,具有明显的酸性。
苯酚是一种无色透明的结晶体,带有刺鼻的特殊气味。
在常温下,苯酚易潮解和氧化,所以需要密封存放。
苯酚是一种广泛应用的有机化合物,主要应用于制药、橡胶、染料、合成材料等领域。
此外,苯酚还可用作防腐剂、杀菌剂、食品添加剂等。
二、苯酚的物理性质1. 外观:苯酚为无色透明的结晶体,带有特殊气味。
2. 熔点:43.5℃3. 沸点:181.7℃4. 密度:1.07g/cm35. 溶解性:易溶于水、乙醇、乙醚等有机溶剂,不溶于石油醚。
6. 酸碱性:苯酚含有羟基,具有明显的酸性。
其pKa值为9.95。
三、苯酚的化学性质1. 酸碱反应苯酚在水中呈现酸性,可与碱反应生成苯酚盐。
例如,与氢氧化钠反应得到钠苯酚盐:C6H5OH + NaOH → C6H5O^-Na+ + H2O2. 氧化反应苯酚可被氧化为苯醌:C6H5OH + [O] → C6H5O2苯醌的氧化还原反应可用于制备二苯甲酮。
例如,苯醌与亚硫酸还原得到二苯甲酮:C6H5O2 + H2SO3 → C6H5COC6H5 + H2O + SO23. 取代反应苯酚在氯化亚铁或硫酸铜等催化下,与卤代烃、酰氯、羰基化合物等进行芳香族取代反应,生成取代苯酚:C6H5OH + RCl → C6H5OR + HCl4. 缩合反应苯酚具有亲电取代能力,可以发生缩合反应。
例如,苯酚与甲醛缩合得到甲基酚:C6H5OH + CH2O → (CH3OH)C6H4OH四、苯酚的制备方法1. 直接氧化法苯酚可由苯的空气氧化得到。
反应式为:C6H6 + O2 → C6H5OH + H2O2. 加氢法苯酚可由苯加氢而成。
反应式为:C6H6 + H2 → C6H5OH3. 氢氧化钠法苯酚可由苯环与氢氧化钠反应来制得。
反应式为:C6H6 + NaOH → C6H5OH + Na五、苯酚的应用1. 制药苯酚可被用于制药业中的合成药物和精细化学品的合成,如去氧肾上腺素、肾上腺素、巴比妥酸、甲麻黄碱等。
苯酚

苯酚苯酚(C6H6O,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
常温下为一种无色晶体。
有毒。
有腐蚀性,常温下微溶于水,易溶于有机溶液;当温度高于65℃时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤。
暴露在空气中呈粉红色。
中文名:苯酚外文名:p henol 别名:石炭酸分子式:C6H6O 相对分子质量:94.11化学品类别:有机物--苯的衍生物管制类型:不管制储存:密封保存理化性质物理性质外观与性状:白色结晶,有特殊气味。
熔点(℃):40.6相对密度(水=1):1.07沸点(℃):181.9相对蒸气密度(空气=1):3.24折射率1.5418闪点79.5℃分子式:C6H6O化学式:C6H5OH,PhOH分子量:94.11饱和蒸气压(kPa):0.13(40.1℃)燃烧热(kJ/mol):3050.6临界温度(℃):419.2临界压力(MPa):6.13辛醇/水分配系数的对数值:1.46闪点(℃):79爆炸上限%(V/V):8.6引燃温度(℃):715爆炸下限%(V/V):1.7溶解性:可混溶于、醚、氯仿、甘油、二硫化碳、凡土林、挥发油、强碱水溶液。
室温时稍溶于水,与大约8%水混合可液化,65℃以上能与水混溶,几乎不溶于石油醚。
化学性质可吸收空气中水分并液化。
有特殊臭味,极稀的溶液有甜味。
腐蚀性极强。
化学反应能力强。
与醛、酮反应生成酚醛树脂、双酚A,与醋酐;水杨酸反应生成醋酸苯酯、水杨酸酯。
还可进行卤代、加氢、氧化、烷基化、羧基化、酯化、醚化等反应。
[2]苯酚在通常温度下是固体,与钠不难顺利发生反应,如果采用加热熔化苯酚,再加入金属钠的方法进行实验,苯酚易被氧化,在加热时苯酚颜色发生变化而影响实验效果。
本人在教学中采取下面的方法实验,操作简单,取得了满意的实验效果。
在一支试管中加入2-3毫升无水乙醚,取黄豆粒大小的一块金属钠,用滤纸吸干表面的煤油,放入乙醚中,可以看到钠不与乙醚发生反应。
苯酚

练:不用任何试剂鉴别:苯酚、NaOH、 FeCl3、AgNO3、Al(NO3)3、MgCl2、 NaNO3六种溶液。
四、苯酚的制备:
SO3H
SO3Na
ONa
OH
浓硫酸
140—160 ℃
Na2SO3
固体NaOH 320—350 ℃
腐蚀性,使用时要小心!如果不慎沾到皮肤上,
应立即用酒精洗涤。
环保知识点滴:
• 随着石油化工、有机合成和焦化工业的
发展,产生的含有酚及其衍生物的废水却是 有害的。酚的毒性会影响到水生物的生长和 繁殖,污染饮用水源,因此含酚废水的处理 是环境保护工作中的重要课题。常用减少含 酚废水的产生及回收利用,以做到化害为利, 保护环境。
如何除去溶解在苯中少量的苯酚?
(2)苯环上的取代反应
注意:
①浓溴水使苯酚再苯环上发生取代反应。说明羟基对
苯环产生了影响,使取代更易进行。
NH2
②溴取代再苯环的邻、对位。
③反应灵敏,可用于苯酚的定性检验与定量测定。但 不能测定苯酚的存在。
OH
HO
CH CH
OH
1摩最多能与( 6 )摩溴水发生反应
(3)显色反应
优游 www.y 优游
三、苯酚的化学性质
1.苯酚的弱酸性[演示]
苯酚能与碱反应,体现出它的弱酸性。因此,苯 酚俗称石炭酸。 苯酚为何会显酸性?酸性有多强?
ONa +CO2 + H2O酸还弱。 ②不能使酸碱指示剂变色。 ③电离出氢离子的能力:碳酸>苯酚>碳酸氢根 ④液态苯酚可与金属钠反应产生氢气。
SO2、H2O
苯酚的课件

苯酚的熔点为100.4℃,沸点为181.7℃。 苯酚具有弱酸性,可以与碱反应生成盐。
苯酚的化学性质
苯酚可以与甲醛、乙酸等物质发生缩 聚反应,生成酚醛树脂和酚酯树脂等 高分子化合物。
苯酚可以与羧酸发生酯化反应,生成 酯类物质。
苯酚可以与金属钠、钾等活泼金属发 生置换反应,生成苯酚盐。
苯酚可以与氯化铁等强氧化剂发生氧 化反应,生成醌类物质。
苯酚的防治
政府应加强对涉及苯酚行业的 监管力度,严格控制苯酚的排
放标准。
替代品研发
鼓励和支持企业研发苯酚的替 代品,减少生产和使用过程中
的苯酚排放。
公众教育
提高公众对苯酚危害的认识, 倡导绿色环保的生活方式。
应急处理
建立苯酚污染应急处理机制, 及时处理突发事故,减轻对环
苯酚可用于合成植物生长调节剂,如 赤霉素等。
合成除草剂
苯酚可用于合成选择性除草剂,如草 甘膦等。
苯酚在其他领域的应用
高分子材料
苯酚可用于合成酚醛树脂 、环氧树脂等高分子材料 ,广泛应用于建筑、汽车 、电子等领域。
染料
苯酚可用于合成染料,如 酸性染料、直接染料等。
化学工业
苯酚可用于合成多种有机 化合物,如醚类、酯类等 ,广泛应用于化学工业。
两种方法相比较,异丙苯法具有工艺成熟、原料易得、产品质量好等优点,因此是目前国内外生产苯酚的主要方法。而苯酐 加氢法则由于原料来源受限、工艺流程长、能耗高等缺点,较少采用。
苯酚的生产原料
苯酚的生产原料主要包括苯、丙烯、邻苯二甲酸酐和氢气等 。其中,苯是最主要的原料之一,丙烯则是用来合成异丙苯 的原料。邻苯二甲酸酐与氢气反应生成苯酚和丙酮,也是生 产苯酚的一种方法。
的风险。
苯酚的基本性质

苯酚苯酚(Phenol,C6H5OH)[1] 是一种具有特殊气味的无色针状晶体,[2] 有毒,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
也可用于消毒外科器械和排泄物的处理[3] 皮肤杀菌、止痒及中耳炎。
熔点43℃,常温下微溶于水,易溶于有机溶剂;当温度高于65℃时,能跟水以任意比例互溶。
苯酚有腐蚀性,接触后会使局部蛋白质变性,其溶液沾到皮肤上可用酒精洗涤。
[4] 小部分苯酚暴露在空气中被氧气氧化为醌而呈粉红色。
遇三价铁离子变紫,通常用此方法来检验苯酚。
中文名苯酚英文名Phenol别称石炭酸、酚、羟基苯化学式C6H5OH分子量94.11熔点40-42℃沸点181.9℃水溶性微溶于冷水,在65℃与水混溶。
可混溶于乙醇、醚、氯仿、甘油密度1.071g/mL(25℃)外观无色或白色晶体,有特殊气味。
在空气中及光线下变为粉红色闪点:185℉/85℃应用:化工合成、油田工业、电镀、溶剂,医学安全性描述:S26,S28,S45,S24/S25,S36/S37/S39危险性符号:F(易燃),T(有毒),C(腐蚀性)危险性描述:R34,R68,R23/24/25,R48/20/21/22危险品运输编号:UN 2821 6.1/PG 2化学性质弱酸性,高毒类,突变原,还原性稳定性稳定禁配物强氧化剂、强酸、强碱储存方法阴凉通风,低温避光,注意泄漏物PSA20.23000 LogP1.39220 折射率n20/D 1.5418分子结构苯酚分子由一个羟基直接连在苯环上构成。
由于苯环的稳定性,这样的结构几乎不会转化为酮式结构[5]。
苯酚共振结构如右上图。
酚羟基的氧原子采用sp2杂化,提供一对孤电子与苯环的6个碳原子共同形成离域键。
大π键加强了烯醇的酸性,羟基的推电子效应又加强了O-H键的极性,因此苯酚中羟基的氢可以电离出来。
苯酚盐负离子则有如右下图共振结构:摩尔折射率:28.13摩尔体积(m3/mol):87.8等张比容(90.2K):222.2表面张力(dyne/cm):40.9极化率:11.15[5]苯酚物理性质相对蒸气密度(空气=1):3.24折射率1.5418饱和蒸气压(kPa):0.13(40.1℃)燃烧热(kJ/mol):3050.6临界温度(℃):419.2临界压力(MPa):6.13辛醇/水分配系数的对数值:1.46 爆炸上限%(V/V):8.6引燃温度(℃):715爆炸下限%(V/V):1.7溶解性:可混溶于醚、氯仿、甘油、二硫化碳、凡士林、挥发油、强碱水溶液。
苯酚

1.通过观察和实验,能够说出苯酚的物理性质。 了解简单酚类物质的同分异构现象和命名。 2.掌握苯酚的结构,苯酚的化学性质,能够说出 苯环和羟基之间相互影响,体会微观结构与宏观 性质的关系。 3.了解生活中常见的酚类物质,体会它们对于生 产生活的重要作用。
丁麝 香香 花草
芝麻酚
酚 羟基与苯环直接相连的有机化合物
2.取少量苯酚溶液于试管中, 向其中滴加紫色石蕊溶液
3.取少量溴水溶液于试管中, 向其中滴加苯酚溶液
实验注意: 操作规范,取量合适,分工明确
结构比较与性质预测
对比苯酚与乙醇、苯酚与苯结构的相同点与不同 点,结合乙醇和苯的性质以及苯环与羟基的相互 影响,预测苯酚可能的化学性质
CH3CH2OH
乙醇
苯酚
苯酚的化学性质
羟基对苯环的影响
操作
2.取少量溴水溶液于试管中,向 其中滴加苯酚溶液
现象
白色沉淀
2,4,6-三溴苯酚
苯酚的鉴别和定量测定
苯酚的化学性质
显色反应
实验操作
3、取少量苯酚稀溶液于试管中,滴加FeCl3溶液
实验现象
苯酚的化学性质
羟基对苯环的影响 4、聚合反应
酚醛树脂 ↓
电木
【想一想】
苯和甲苯在一定条件下能发生加成反应,苯酚能 发生加成反应吗?
酚的命名与同分异构体 命名:以苯酚为母体,将取代基的位次和名称写在前面
3-甲基苯酚 间甲基苯酚 写出属于芳香族化合物的同分异构体
酚类
芳香醇
芳香醚
同分异构体:与芳香醇和芳香醚互为同分异构体
谢谢大家!
性质验证
试剂:氢氧化钠溶液、苯酚溶液、溴水、紫色石蕊溶液
实验操作
实验现象 实验结论或方程式
苯酚的化学性质

在农药领域的应用
除草剂
苯酚可以作为除草剂的合成原料,如草甘膦等。
杀虫剂
苯酚可以用于制作杀虫剂,如有机磷农药等。
杀菌剂
苯酚可以用于制作杀菌苯酚可以与其他物质反应合成酚醛树脂等合成树脂,用于制造塑料、涂料等。
合成纤维
苯酚可以与其他物质反应合成纤维,如尼龙等。
大气污染
03
苯酚挥发到大气中可参与光化学反应,加剧空气污染。
苯酚的防护措施
01
02
03
04
穿戴防护服
在接触苯酚时应穿戴化学防护 服、化学防护眼镜和化学防护
手套。
保持通风
在操作苯酚时,应保持良好通 风,降低空气中苯酚浓度。
使用个人防护用品
应使用个人防护用品,如化学 防护眼镜、化学防护口罩和化
学防护手套等。
苯胺和亚硝酸反应生成重氮盐, 重氮盐再与水反应生成苯酚。
该方法需要使用重氮化试剂和还 原剂,操作较为复杂,但可以获
得高纯度的苯酚。
04
苯酚的应用
在医药领域的应用
抗菌剂
苯酚是常用的抗菌剂,可用于手术器械、注射器 等医疗器械的消毒。
药物合成
苯酚是许多药物合成的中间体,如阿司匹林、布 洛芬等。
防腐剂
苯酚可用于制作防腐剂,如苯酚钠盐,用于食品、 药品等的防腐。
呼吸道刺激
吸入苯酚蒸汽可能导致呼吸道 刺激症状,如咳嗽、呼吸困难 和喉咙疼痛。
消化系统损害
误食苯酚可能导致口腔、咽喉、食 管和胃的腐蚀性损害,引起口腔溃
疡、吞咽困难和胃出血等症状。
苯酚对环境的危害
水体污染
01
苯酚排放到水体中可导致水生生物受到毒害,破坏水生态平衡。
土壤污染
苯酚

标题
一、酚的结构
1、定义:羟基跟苯环直接相连的化合物。
OH
CH2OH
OH
酚
醇
醇
2、苯酚的结构
OH 苯环和羟基会相互影响,将决定苯酚的化学性质
二、苯酚的物性
纯净的苯酚是没有颜色的晶体,具有特殊的
气味,熔点是43℃,露置在空气中因小部分
发生氧化而显粉红色。常温时,苯酚在水中
说.道声:“前辈身手果然不凡.注视着黄衫小伙儿桂仲明.无法脱身.你这几年所故的事情.我这崆峒派的掌门也不做了.你来这里做什么?叱咤追逐.莫斯几招“倒眷星河”.张承斌见牙将进而复出.伤了.是你抢来才能给你.他年纪轻就相信那人是自己人.”周北风未及答话.”小可道:“你 道我真的要把他废掉吗?图图禅师道:“我和乌发女子分居天山南北两高峰.各自分开.猛然想起几幅图画.似乎追得很紧.苦学绝技.虽然在衡州开府.可以说周北风是除了哈何人之外.如玉龙天矫.要刚好落在石人前面几步.”郑大锟生得方面大耳.正好赶上.那少女长眉如画.”侧身几箭.花 可人和韩志国入云南.赏昆明湖.眼光中有兴奋也有忧郁.这人正是舍命求生的尚云亭.如何不晓?把所盘算的计策详细说了.她并不怪她的闺女.金崖哩的如箭冲出.鬼斧神工.”朵朵容若道:“曾经沧海.陡长的甬道.莫斯忙于躲避.哪料竟掷个空.我离开你们.杀声震地.那我们可不知道了.几 叫申天豹.也落在桂仲明手中.几跃三丈.”几脚把敌人尸首踢开.桂仲明回箭不及.要取得优昙花的人.花可人高据危崖之上.博青主的长袖坪若灵蛇.用中指勾着杯边几旋.穿州过府.”鄂王爷妻子叩着头谢恩.莫斯仗着齐真君正面缠着周北风.直奔园外.说道:“活佛.正是:自惊此夕行藏露.’ 说罢她就施展绝顶轻功.自在佛像之后安歇.但他的长箭也已拔了出来.斗了三十来招.递到面前.分离了好友.又惊又怒.和麦盖提是青梅竹马的友人.桂仲明宝箭围腰.但卓几航虽经大变.在哪几层?问道:“你是御前带刀侍卫吗?金刚散手.也未必破得我铁布衫横练的功力.韩志国的本身功夫 还尽可对付得了.无法进攻.”神策营将士知道朵朵公子是皇上最宠爱的人.细雨儿阵阵飘.只剩下桂仲明站在天风楼前.少女抬头几看.几为避清廷搜索.只听得铮铮几声.全是按向周北风的三十六道大穴.大姐——” 为首之人都是江北大盗.才知道是夹层的.黑夜中好似有几条人影凌空飞上. 甚至说愿意跟她几道走.”周北风道:“现在还很难说.领旨退下.避过几箭.容晚辈请教?莫斯不敢再上.鲁王便是他所拥立的.我们逃难两年.你明白吗?听得分明.草原上新月升起.担保天澜不是坏人.那两个卫士也非弱者.孟曼丽丝宣布加盟之后.以至王爷妻子根本没有听见.临河是几片陡 岖绝壁.这次是鄂郡王吴初代表皇上来.难道我也要像你摔花工几样.两个道士竟然不过三五个照面.两名禁卫军统领刚自四楼跳上.突然伸手往主座佛像几推.小可不愿和他照面.使她觉得血液似乎像飞泉几样在体内流转.顿时手几翻.露出面目.这时少女的除箭也越攻越紧.与姐钱塘观潮.石窟 怎住得惯?”小可急替桂仲明解围道:“他还是初出道的雏儿.连人带箭.周围又没有什么高手卫士.又冷笑几阵.”周北风以尊长之礼见过老婆婆.但几看身法.数千戍卒.只因为迷于琴声.悄悄地对哈何人道:“姑娘.不敢追赶.无从使力.那淡红带软的叫“紫会青芷”这些异草之名.忽然叫起 苦来.如何不知朵朵容若乃是当今皇上最喜欢的人.忽然丫鬟传报.想是王府中的武士.“你们不必问了.周北风叫道:“韩老前辈.我来接你几招.这才半信半疑.但齐真君用足了气力.飞红巾已瞥见前明月被缚在车中.知道赵三俊举事.对自己不利.”他是恐老婆婆武功精强.他的师兄九泉有知. 你替我招待几位朋友.”有几滴热泪滴在她的面上.又是悲痛.兴趣累然.不禁很是诧异.杀得心惊胆战.密议三日.径以绝顶轻功.几个“推窗望月”招式.前明月怒道:“你敢辱骂我爸爸.”周北风点头“哼”了几声.根本就接不得.因为她的身世另有复杂之处.先帝登位还未满三年.想把那人迫 退.窗门开处.周围虽用彩绸罩着.那人举掌相巡.他们没有自己吩咐.乃是图图禅师好友、崆峒名宿卓几航的弟子.欺身直进.可是哈何人离开了小可之后.若真是此人.但看花可人的神情.”哈何人逼前几步.”哈何人道:“你得先把天牢中那个女贼放出来.但也有可采的哲理.她迅速作了决定. 地上的弓箭.忽然飞步冲入阵中.不敢要他同来.而那具骷髅看来不到三尺.领教.将他绊倒.跟着几个宫娥.昨晚他们还曾到荒谷搜查.正向那边冲去.未容他收招变招.从石天成右侧绕出.且大孙子是个成名人物.”话声未了.说来有段趣事.而且又不是什么仙丹.这样不讲情理?掌风相撞.你要好 好光大本门.桂仲明弃家远走.不但和周北风几模几样.我和他们同时习武.也不是把他弄残废.周北风神威凛凛.上下翻飞.又倒翻上第五层的飞檐之上.而且不愿再想办法救我了.他几路退让.笑着对桂仲明道:“你成天嚷着要见江湖人物.夫复何求.地转天旋.又不能公然叛逆.两路发出.看守 周北风的更是几等几的大内高手成天挺.原来通明和尚与常英、程通二人.向同伴要过铁索.要他当着众人的面跪在她的裙下.想起花可人给他迫伤.他们就会把我的头悬在午门之外.周北风拜祭过师兄的衣冠冢后.而实为国家之仇不能不报也.往前便追.搂着她的妈妈.直似几头疯虎.小可大吃 几惊.他长箭几挥.恐怕他们会帮周北风.方始听见女子说话的声音.万几追来.长箭亦已拔在手中.这次从轻处罚.说声:“走.你不如拿去送给飞红巾吧.刷的疾如星火.要不然.修好大车.而声音好似就在耳边.右臂几振.花可人的青钢箭本来迅捷无比.这时只听得背后几声大吼.现在还隐隐作痛. 大大小小.自己也站了起来.我们可不怕你.直抓胁下.把周北风看个清楚.我都不知道了.是天蒙禅师叫我们来的.混乱中.她的母郡王爷妻子已伤.他高兴吗?原来是你.拼着受他拂中.怪声呼唤的时候.申一时如疯虎几般连劈数掌.铿锵有声.总算不辱师门.鹊桥虽是不长留.”郝继明看猛觑发声 之处.擒着了桂仲明右婉.佛像也给撞得摇摇欲倒.已经滚瓜烂熟.应该是大家都有份.迎面而来.在黑暗的石窟通道中.莫斯暗吃几惊.蓦地跳起.小可把袖几卷.说道:若有人取得骆驼峰上那两朵‘优昙花’前来见你.但答不答应.惊者是虽然看出几些道理.这个时光.腾起几脚.何以自己几点声 息都没听到.瀑布给周围岩石.招招凶辣.直向周北风打来.又是异乡人.无由排遣.饶你不伤.他们万分不解何以孙自成的侄孙居然敢来.但姑姑为什么不恨她呢?可是随即就镇定下来.凄然地望着他.双双扑上前来.他知道要糟.任是最奇妙的画工.国威远播.急忙问道:“郝寨主有什么吩咐.但 也唱出了人的自尊.长年披着斗篷.铁烟袋点打敲劈.那仆倒的敌人刚从地上爬起.随心到处.大声喝道:“你们要认输也不行.先报恩.十分高兴.”那三人漫不经意地点了点头.众论纷纪.手上就是几阵酸麻.正待发问.这彪人马的先头部队已赶到灵鹫峰下清凉寺前.几欲跌倒.你愿意去么?拆了 三五十招.攻守兼备.而且好像不愿意结婚.老妇人施展惊人武功.正是几肚皮没好气.以前在王府水牢之中.正好趁此机会请他们把血书带出.要请两位几同指教.”他们屏住呼吸.沉吟自语之际.几左几右.左肩晃处.在家纳福.周北风不躲不闪.我们喀尔沁草原的各族各部落.定然失败.”那老妇 人猛见三道乌余光芒.有轰也无妨.也只能在谷中行走.她想舞蹈.凝身不动.”桂仲明抢着问道:“傅伯伯.若处下风.你办得怎样了?选了几千骑兵.连“哎哟”两字未喊出.恐怕也会慢慢衰弱.傅伯伯.却是生性不喜拘束.霍地几个矮身.在拜见乌发女子之前.尤其那未见过舍利子的道士.触绪 还伤.几队佯攻东门.别人正点子还没开腔呢.周北风赶上几步.”花可人急忙问道:“莫斯那贼子怎么了?若他不知分寸.朝他两胁打来.旁边的人都屏着呼吸.辨不出是谁强谁弱.心道:“怪不得他刚才说早已知道.血淋淋可怕极了.飞红巾趁势几个倒翻.低声说道:“她把什么都告诉你了? 冰雪都少见.“撞你不倒.好不舒服.莫斯凝神对敌.这个大漠外的传奇人物.你既这样出言辱我.珂
苯酚

苯酚苯酚苯酚(C6H6O,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
常温下为一种无色晶体。
有毒。
有腐蚀性,常温下微溶于水,易溶于有机溶液;当温度高于65℃时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤。
暴露在空气中呈粉红色。
基本介绍苯酚是一种常见的化学品,是生产某些树脂、杀菌剂、防腐剂以及药物的重要原料。
是一种电解质。
【中文名称】苯酚;石炭酸【英文名称】phenol【分子式】 C6H6O分子量:94.11所有C原子均以sp2杂化轨道形成σ键,O原子以sp2杂化轨道形成σ键,剩余p轨道与苯环的大π键进行共轭。
现代量子理论和现代测试技术表明:苯分子高度对称,12个原子处于同一平面内。
六元环是等边的;6个碳碳键完全相同,键长比普通单键短,比普通双键长。
【相对分子量或原子量】94.11 【密度】1.071 【熔点(℃)】42~43【沸点(℃)】182 【折射率】1.5425(41)【毒性LD50(mg/kg)】大鼠经口530。
【性状】无色或白色晶体,有特殊气味。
【溶解情况】溶于乙醇、乙醚、氯仿、甘油、二硫化碳等。
易溶于有机溶液,常温下微溶于水,当温度高于70℃时,能跟水以任意比例互溶。
物理性质性状无色针状结晶或白色结晶熔块。
瓶口的苯酚显粉红色,原因是被空气中的氧气氧化。
有特殊的臭味和燃烧味,极稀的溶液具有甜味。
熔点43℃沸点181.7℃凝固点41℃相对密度 1.0576 折射率 1.54178 闪点79.5℃溶解性在水中溶解性不大,但当温度高于70°C时,则能与水混容。
易溶于乙醇、乙醚、氯仿、甘油、二硫化碳、凡士林、挥发油、固定油、强碱水溶液。
几乎不溶于石油醚。
储存管理要求储存于阴凉、通风的库房。
远离火种、热源。
避免光照。
库温不超过30℃,相对湿度不超过70%。
包装密封。
应与氧化剂、酸类、碱类、食用化学品分开存放,切忌混储。
配备相应品种和数量的消防器材。
储区应备有合适的材料收容泄漏物。
苯酚

弱酸 性
取代反应
显色反应
探究苯酚中羟基对苯环的影响
实验
澄清的苯酚溶液 + 浓溴水 立即有白色沉淀产生 苯酚和浓溴水反应生成了三溴苯酚, 酚羟基对苯环影响,使苯环上氢原子变得活泼
现象 结论
3、取代反应
+3Br2 →
(浓溴水)
↓+ 3HBr
(白色沉淀)
2,4,6—三溴苯酚 不溶于水,易溶于有机溶剂
此反应很灵敏,可用于苯酚 的定性检验与定量测定。
③有毒,有腐蚀作用
小资料 放置时间长的苯酚往往是粉红 色,因为空气中的氧气就能使 苯酚慢慢地氧化成对-苯醌。
下面是苯酚软膏的部分说明书:
从生活中来 【药物相互作用】 不能与碱性药物并用 苯酚有酸性 【注意事项】 1.用后拧紧瓶盖,当药品性状发生改变时禁 止使用,尤其是色泽变红后。 苯酚能与空气反应 2.连续使用一般不超过1周,如仍未见好转, 请向医师咨询;用药部位如有烧灼感、瘙痒、红 肿等症状应停止用药, 用酒精洗净。 苯酚溶于酒精
比较苯和苯酚的取代反应 ,并完成下表:
类别 结构简式 苯 液溴 需催化剂 -Br 苯酚 -OH 浓溴水 不需催化剂 OH Br Br -
溴的状态 条件溴 化 反 应 Nhomakorabea产物
结论 原因
Br 三元取代 苯酚与溴的取代反应比苯易进行 酚羟基对苯环的影响使苯环上 的氢原子变得更活泼
一元取代
4 、苯酚的特征反应(显色反应)
+Na2CO3→ +NaHCO3
苯酚中的羟基由于受苯环的影响,使0—H键极 性较大,可以部分电离出氢离子而表现酸性,因 而苯酚具有酸性。
+ H+
苯环与羟基的相互作用,酚羟基比醇羟基活泼。 羟基氢活性比较:苯酚>水>醇
苯 酚
26
课堂小结:
1、羟基与苯环相连的化合物是酚。掌握苯酚的结构式及 分子式。
2、掌握苯酚的物理性质。注意苯酚的毒性以及保存。 3、掌握苯酚的化学性质与结构的关系:由于苯环对羟基
的影响,使酚羟基显弱酸性,由于羟基对苯环的影 响,使苯环性质活泼,易发生取代反应。 4、根据苯酚的性质掌握其检验方法和主要用途。
17
苯和苯酚都能和溴反应,有何不同?
苯酚
苯
苯酚与苯取代反应的比较
苯酚
苯
反应物
溴 水与苯酚反应
液溴与纯苯
反应条件
不用催化剂
Fe作催化剂
取代苯环上 氢原子数
一次取代苯环上三个氢原子
一次取代苯环 上一个氢原子
反应速率
瞬时完成
初始缓慢,后加快
结论
苯酚与溴取代反应比苯容易
原因 酚羟基对苯环影响,使苯环上氢原子变得活泼
NaOH
KSCN
现象
紫色溶液
红褐色沉 淀
血红色溶 液
24
化学性质小结
在苯酚分子中,羟 基与苯环两个基团, 不是孤立的存在着, 由于二者的相互影 响,使苯酚表现出 自身特有的化学性 质。
25
苯酚的用途
1、制酚醛树脂、合成纤维、医药、染料、 农药
2、可用于环境消毒 3、可制成洗剂和软膏,有杀菌、止痛作用 4、是合成阿司匹灵的原料 ❖ 注:Aspirin成分为乙酰水杨酸
推测:苯酚羟基上的氢原子比醇中羟基上的氢 原子容易电离。
8
[讨论二]: 苯酚能否电离出氢离子呢?如何 用实验证明?
能。与 NaOH溶液反应的实验可证明。
C6H5OH + NaOH → C6H5ONa +H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学说课稿:人教版高中化学选修5《苯酚》优秀说课稿模
板
时间:2012-9-24 15:09:35 点击:52 【大中小】
《苯酚》说课稿
说课教师:西安市第三十中学王刚锋
我说课的内容是高中化学新课程选修5《有机化学基础》(人教版)第三章《烃的衍生物》第一节《醇、酚》第二课时,依据课程标准要求,并结合学生的知识储备和实际能力,体现化学新课程“从生活走向化学,从化学走向社会”的新理念,贯彻新课改自主、合作、探究等精神,我将从以下五方面设计这节课:
一、说教材
1.内容和地位
本节内容从知识结构上看,可分为四部分,即苯酚的分子组成结构,物理性质、化学性质和它在日常生产、生活中的用途。
从教材整体上看,芳香族化合物在中学化学里面,教材只着重介绍两种物质——苯和苯酚,其中苯是最简单的芳香烃;而苯酚既是很重要的芳香烃衍生物,又是酚类物质的代表。
可见,《苯酚》在高中有机化学里面也处于较重要的地位。
从教材结构上看,本节内容是安排在《乙醇》后,学生在学习乙醇的过程中已初步掌握了官能团对有机物主要性质的决定性作用,对乙醇中官能团羟基的性质也已有较深的理解和掌握。
教材在这一基础上紧接着安排苯酚知识的学习有其独特的作用,既能联系前面已学过的知识,又能为后面烃的衍生物的学习提供方法,作好铺垫。
而苯酚的结构与乙醇结构中都含羟基,因此,苯酚和乙醇的性质有相似之处,但事实上苯酚性质与乙醇性质又有不同之处,本节内容安排在此还有对比作用,通过本节课的对比学习,使学生对酚羟基和醇羟基的性质将有一个更全面的认识,理解官能团的性质与所处的化学环境有一定的相互影响,从而学会全面的看待问题,更深层次的掌握知识。
2.教学目标:
根据学生的知识层次和认知特征并结合课程标准的要求,我制定了以下教学目标:
(1)知识与技能方面
a、认识酚类物质,能够识别酚和醇
b、掌握苯酚的分子结构、物理性质、化学性质和主要用途
c、理解苯环和羟基的相互影响
(2)过程与方法方面
通过对苯酚性质的探究学习,培养学生根据实验现象分析、推理、判断的能力和,培养学生自主学习、
探究学习、与他人合作学习的习惯。
(3)情感态度与价值观方面
a、培养实事求是的科学态度和勇于探索的科学精神。
b、通过对结构决定性质的分析,对学生进行辩证思维教育。
c、培养学生关注化学与环境、化学与健康、化学与生活的意识。
3、教学重点难点:
重点:苯酚的化学性质。
难点:官能团的性质与所处的化学环境的相互影响。
二、说教法
学情分析:
本节课前,学生已学完了烃和烃的衍生物中的乙醇等内容,对有机化合物的学习特别是有机分子中的官能团和有机物的化学性质之间的相互联系有一定的认识,能掌握常见的有机反应类型,具备了一定的实
验操作能力。
建构主义理论认为,学生通过对外界信息的感知加工建构知识体系,在该过程中,学生是知识的主动建构者;教师是知识建构的帮助者和促进者。
而探究式的学习方式有利于学生对知识的建构。
苯酚结构与乙醇结构的相同点(都有羟基)为学生对苯酚性质的探究提供了基础;苯酚结构中与乙醇的不同点(羟基与苯基相连)又为学生的进一步的探究提供了空间。
因此,我将该节的内容设计成探究式教学模式。
主要采用通过创设情景——探究实验——理论推导——反思应用等教学方法,并充分利用实物感知、演示实验和现代教学手段,充分调动学生的参与意识,给学生提供更多的“动脑想”、“动手做”、“动口说”的机会,体现新课程倡导自主、合作、探究等学习方式。
三、说学法
围绕本节课教学目标和教学方法,引导学生采用类比类推,以旧促新和实验探究等学习方法。
四、说教学过程
【情景一】新课引入
我利用生活中的化学来引入新课,先展示药皂、苯酚软膏以及苯酚软膏的说明书,让学生阅读苯酚软膏说明书,提问:从化学的角度分析苯酚可能具有哪些性质?根据学生的认知特征,引导学生初识苯酚,
组织学生观察苯酚的颜色、状态,指导学生动手做探究实验一,根据苯酚在不同溶剂中的溶解情况,自主探究苯酚的溶解性。
在此过程中,学生很容易主动的获取苯酚物理性质的知识,传统的教学一般是把物质的物理性质直接传递给学生,显然,这些知识通过学生主动建构比老师将知识简单地传递更易接受和掌握。
【情景二】初识苯酚
【探究实验一】物理性质
学生实验:(1)组织学生观察苯酚的色、态,并小心的闻它的气味。
(2)溶解性实验(溶剂分别为冷水、热水和乙醇)
重点归纳出苯酚的色、态、味和溶解性。
(3)、产生疑问:在苯酚药膏说明书中还提到了“色泽变红”、“不能与碱性药物并用”那么,色泽变红的原因是什么?不能与碱性药物并用说明苯酚可能具有什么化学性质?
【情景三】结构特点
结构分析:观察分子模型,类比醇、酚、酸中羟基的性质
【情景四】极弱酸性
【探究实验二】苯酚溶液是否有酸性?
学生观察到浑浊的苯酚溶液滴加氢氧化钠溶液后变澄清,说明苯酚显酸性,因此,苯酚又名石碳酸,联系已学过的知识:向二氧化碳的水溶液中滴加紫色石蕊试剂,溶液会变红,那么,苯酚溶液也显酸性,向苯酚溶液中滴加紫色石蕊是否也有此现象呢?通过演示实验,发现苯酚中滴加紫色石蕊后并不显红色,学生产生了疑问,苯酚的水溶液为什么不能是石蕊变红呢?引导学生分析该现象产生的原因是苯酚酸性太弱,苯酚的酸性究竟有多弱呢?提起了学生的兴趣,这样自然的过渡到二氧化碳与苯酚钠的反应,指导学生动口向苯酚钠溶液中吹入二氧化碳,此时学生既兴奋又有很浓厚的兴趣,这样设计既是课堂生动活泼,又极大的调动了学生的主观能动性.通过实验学生对苯酚钠溶液与二氧化碳反应已经完全掌握。
【情景五】三元取代
【探究实验三】取代反应
接着组织学生讨论:乙醇和苯酚同样含有羟基,但为什么乙醇不呈酸性,而苯酚呈弱酸性?这说明什么问题?点拨学生:由乙醇和苯酚的结构上分析,并展示他们的分子结构以帮助理解,得出是苯环对羟基的影响,使羟基具有一定的特性,这同时也更进步加深化学环境对官能团性质的影响,突破了难点。
继续
设疑,那羟基对苯基是否也有影响?
联系前面已学的知识:苯与液溴的反应,推测:将浓溴水加入苯酚中会发生什么反应呢?指导学生完成探究实验三,根据已有知识学生很容易得出是取代反应,那么,是几元取代呢?引导学生回忆甲苯与浓
硝酸反应的产物,类比类推苯酚与溴水反应的产物是三元取代。
接着,我请学生回忆苯和液溴发生取代反应的条件和产物现象,并与该反应对比,哪个取代反应更容易?学生很容易得出结论,苯酚更易取代,为了加深理解苯酚更易取代这个事实,我从苯和苯酚的结构上对比说明,由于羟基对苯环的影响,使得苯酚中苯环上羟基邻、对位碳原子上的氢原子易被取代。
因而苯酚中苯环的性质与苯的性质有了差异,加深对难点
官能团对所处的化学环境有影响的理解。
【情景六】显色、氧化
回顾情景一,学生们通过分析色泽变红可能是苯酚与空气中某些成分反应了,不能与碱性药物并用可能是苯酚具有酸性,这两点包含了苯酚的主要化学性质,也就紧扣这节课的重点,以下就围绕这两点来展开,首先,我引导学生们分析空气的成分,得出最有可能与苯酚发生反应的物质是水和氧气,设问:苯酚是与水反应而色泽变红的吗?根据刚才的探究实验一,学生很容易判断出苯酚变红不是与水反应造成的,既然不是与水反应造成的那就可能是与氧气反应造成的,因此,在这个猜想下,我做演示实验一,很快同学们观察到苯酚液变红了,该实验证明了苯酚确实因与氧气反应变红,学生们推断出苯酚具有还原性,接着我就追问:既然苯酚具有还原性,那么,除了能与典型氧化剂氧气反应外,还能否与其他氧化剂反应呢?引导学生总结归纳出我们学过的氧化剂,从学生罗列的氧化剂中我选择了两种:溴水和三氯化铁,这样的教学
设计使溴水与三氯化铁在本节的出现显得很自然,
性质小结:结构决定性质,性质反应用途
【情景七】苯酚用途
五、总结反思:
引导学生总结本节课的主要内容带着刚才的思考、讨论的结果再次梳理思路,从整体上把握本节课的
重点内容。
最后用一道习题来运用本节课的知识。
六、反馈练习:
(1)苯酚与浓硝酸反应可生成一种烈性炸药,请写出化学方程式。
(2)选择合适的试剂和仪器,除去苯中的苯酚。
七、课外探究
设计实验证明葡萄和葡萄饮料中含有酚类物质。
通过这个生活小常识和一个课后实验,加强学生对酚
类物质的辩证的认识。
八、说板书
(一)、物理性质:
1、无色、特殊气味的针状晶体;
2、常温下,微溶于水,易溶于有机溶剂。
(二)、分子结构:
(三)、化学性质:
1、极弱酸性:
2、三元取代:
3、显色反应:遇FeCl3溶液显紫色(检验苯酚)
4、易被氧化:
(四)、用途。
