第二十章蛋白质和核酸
生物化学 第20章转录与加工

(三)链的延长
链的延长反应是RNA聚合酶核心酶催化下进行的。 链的延伸方向是5'-3',而核心酶沿模板链3'-5'方 向移动,这与RNA是在DNA指导下合成的结论是一致的。 同位素标记实验或用3‘-脱氧腺苷(冬虫夏草菌素) 作实验可以证实链的延伸方向是5'-3'。 当由起始向延伸阶段转变时,由于σ亚基的离去, 核心酶的构象发生变化,同DNA的结合力减弱,便于核 心酶沿模板运动,使模板链上的每个核苷酸具有同等 被转录的机会。 一条模板链上可以同时有多个RNA聚合酶结合,形 成羽毛状。
真核生物与5S rRNA的基因成串排列,中间被不 转录区分开。转录后的5S rRNA经过适当加工便参 与核糖体的装配。 某些真核生物的rRNA 具有自我加工的能力。 只有少数真核生物的rRNA基因含有内含子。 1982年,T.cech从四膜虫中分离到一种RNA具有酶 的作用。当这个pre—rRNA与鸟嘌呤核苷或鸟苷酸 (GMP、GDP、GTP)一起保温时(在蛋白质缺乏 下),它的一个413nt的内含子自我切除,并把它 的两侧的外显子连接起来,即这种pre-rRNA能自我 剪接。
启动子的核苷酸顺序很特别,富含A .T碱基对。靠近每 个转录的前导顺序。在转录起始位点的上游存在两段一致 顺序(consensus sequence)。
3’端
模板链
原核生物中转录起始区的共同序列
三
原核生物基因转录-RNA合成的过程
(一) 模版的识别与转录泡的形成 RNA聚合酶与DNA模板的结合RNA聚合酶先 同DNA非专一性结合。在σ因子的帮助下,聚合酶 很快地滑向转录的起始部位,找到启动子-35和 -10序列结合在启动子上。 该过程是不可逆的。DNA的两条链(模版链和编码 链)局部解开,同时形成一个解链区称为转录泡。
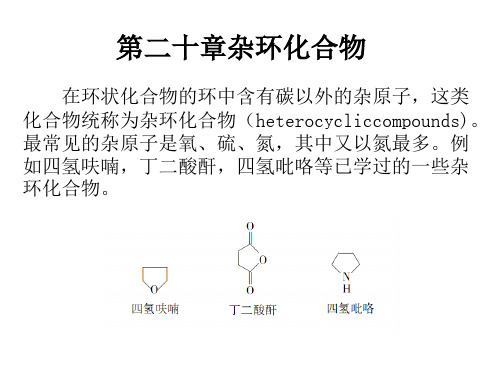
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
生化习题集-修改版

⽣化习题集-修改版⽬录第⼀章蛋⽩质的结构与功能 (2)第⼆章核酸的结构与功能 (16)第三章酶 (25)第四章糖代谢 (35)第五章脂类代谢 (48)第六章⽣物氧化 (61)第七章氨基酸代谢 (70)第⼋章核苷酸代谢 (79)第九章物质代谢的联系与调节 (85)第⼗章 DNA⽣物合成 ---- 复制 (92)第⼗⼀章 RNA的⽣物合成----转录 (102)第⼗⼆章蛋⽩质的⽣物合成---- 翻译 (109)第⼗三章基因表达调控 (118)第⼗四章基因重组与基因⼯程 (127)第⼗五章细胞信息转导 (135)第⼗六章肝的⽣物化学 (150)第⼗七章维⽣素与微量元素 (161)第⼗⼋章常⽤分⼦⽣物学技术的原理及其应⽤ (165)第⼗九章⽔和电解质代谢 (170)第⼆⼗章酸碱平衡 (174)第⼀章蛋⽩质的结构与功能⼀. 单项选择题1. 下列不含有⼿性碳原⼦的氨基酸是A. GlyB. ArgC. MetD. PheE. Val2. 那⼀类氨基酸在脱去氨基后与三羧酸循环关系最密切A. 碱性氨基酸B. 含硫氨基酸C. 分⽀氨基酸D. 酸性氨基酸E. 芳⾹族氨基酸3. ⼀个酸性氨基酸,其pHa1=2.19,pHR=4.25,pHa2=9.67,请问其等电点是A. 7.2B. 5.37C. 3.22D. 6.5E. 4.254. 下列蛋⽩质组分中,那⼀种在280nm具有最⼤的光吸收A. 酪氨酸的酚环B. 苯丙氨酸的苯环C. 半胱氨酸的巯基D. ⼆硫键E. ⾊氨酸的吲哚环5. 测定⼩肽氨基酸序列的最好办法是A. 2,4-⼆硝基氟苯法B. ⼆甲氨基萘磺酰氯法C. 氨肽酶法D. 苯异硫氰酸酯法E. 羧肽酶法6. 典型的α-螺旋含有⼏个氨基酸残基A. 3B. 2.6C. 3.6D. 4.0E. 4.47. 每分⼦⾎红蛋⽩所含铁离⼦数为A. 5B. 4C. 3D. 2E. 18. ⾎红蛋⽩的氧合曲线呈A. U形线B. 双曲线C. S形曲线D. 直线E. Z形线9. 蛋⽩质⼀级结构与功能关系的特点是A. 氨基酸组成不同的蛋⽩质,功能⼀定不同B. ⼀级结构相近的蛋⽩质,其功能类似可能性越⼤C. ⼀级结构中任何氨基酸的改变,其⽣物活性即消失D. 不同⽣物来源的同种蛋⽩质,其⼀级结构相同E. 以上都不对10. 在中性条件下,HbS与HbA相⽐,HbS的静电荷是A. 减少+2B. 增加+2C. 增加+1D. 减少+1E. 不变11. ⼀个蛋⽩质的相对分⼦量为11000,完全是α-螺旋构成的,其分⼦的长度是多少nmA. 11B. 110C. 30D. 15E. 110012. 下⾯不是空间构象病的是A. ⼈⽂状体脊髓变性病B. ⽼年痴呆症C. 亨丁顿舞蹈病D. 疯⽜病E. 禽流感13. ⾕胱⽢肽发挥功能时,是在什么样的结构层次上进⾏的A. ⼀级结构B. ⼆级结构E. 以上都不对14. 测得某⼀蛋⽩质样品的含氮量为0.40g,此样品约含蛋⽩质多少克A. 2.00gB. 2.50gC. 6.40gD. 3.00gE. 6.25g15. 在pH6.0的缓冲液中电泳,哪种氨基酸基本不动A. 精氨酸B. 丙氨酸C. ⾕氨酸D. 天冬氨酸E. 赖氨酸16. 天然蛋⽩质不存在的氨基酸是A. 半胱氨酸B. 脯氨酸C. 丝氨酸D. 蛋氨酸E. ⽠氨酸17. 多肽链中主链⾻架的组成是A. -NCCNNCCNNCCN-B. ―CHNOCHNOCHNO―C. ―CONHCONHCONH―D. ―CNOHCNOHCNOH―E. ―CNHOCCCNHOCC―18. 在20种基本氨基酸中,哪种氨基酸没有⼿性碳原⼦A. ⾕氨酸B. 半胱氨酸C. 赖氨酸D. 组氨酸E.⽢氨酸19. 下列哪种物质从组织提取液中沉淀蛋⽩质⽽不变性A. 硫酸D. 丙酮E. 1N盐酸20. 蛋⽩质变性后表现为A. 粘度下降B. 溶解度增加C. 不易被蛋⽩酶⽔解D. ⽣物学活性丧失E. 易被盐析出现沉淀21. 对蛋⽩质沉淀、变性和凝固的关系的叙述,哪项是正确的A. 变性的蛋⽩质⼀定要凝固B. 变性的蛋⽩质⼀定要沉淀C. 沉淀的蛋⽩质必然变性D. 凝固的蛋⽩质⼀定变性E. 沉淀的蛋⽩质⼀定凝固22. 蛋⽩质溶液的稳定因素是A. 蛋⽩质溶液有分⼦扩散现象B. 蛋⽩质溶液有“布朗运动”C. 蛋⽩质分⼦表⾯带有⽔化膜和同种电荷D. 蛋⽩质的粘度⼤E. 蛋⽩质分⼦带有电荷23. 镰⼑型贫⾎症患者,Hb中氨基酸的替换及位置是A. α-链第六位Val换成GluB. β-链第六位Val换成GluC.α-链第六位Glu换成ValD. β-链第六位Glu换成ValE. 以上都不对24. 下列蛋⽩质通过凝胶过滤层析柱时,最先被洗脱的是A.⽜β乳球蛋⽩(分⼦量35000)B. 肌红蛋⽩(分⼦量16900)C. ⽜胰岛素(分⼦量5700)D. ⾎清清蛋⽩(分⼦量68500)E. 超氧化物歧化酶(分⼦量32000)25.下列哪⼀种物质不属于⽣物活性肽C. 促肾上腺⽪质激素D. ⾎红素E. 胰岛素26.下列不属于结合蛋⽩质的是A.核蛋⽩B. 糖蛋⽩C. 脂蛋⽩D. 清蛋⽩E.⾊蛋⽩27. 可⽤于裂解多肽链中蛋氨酸羧基侧形成的肽键的试剂是A. 甲酸B. 羟胺C. 溴化氰D.β-巯基⼄醇E. 丹磺酰氯⼆. 多项选择题1. 下列氨基酸那些是蛋⽩质的组分A. HisB. TrpC. ⽠氨酸D. 胱氨酸2. 下列氨基酸中那些具有分⽀的碳氢侧链A. MetB. CysC. ValD. Leu3. 在⽣理pH值情况下,下列氨基酸中的那些氨基酸侧链带正电荷A. ArgB. GluC. LysD. Asp4.下列对于肽键的叙述正确的是A. 具有部分双键性质B. 具有部分单键性质C. ⽐双键键长长,⽐单键键长短D.⽐双键键长短,⽐单键键长长5. 对⾕胱⽢肽叙述正确的是A. 有⼀个γ-肽键B. 有⼀个功能性的基团-巯基C. 分别由⾕氨酸胱氨酸和⽢氨酸组成D. 对⽣物膜具有保护作⽤6. 下⾯那些是结合蛋⽩质A. ⾎红蛋⽩B. ⽜胰核糖核酸酶C. 肌红蛋⽩D. 胰岛素7. 下列那些蛋⽩质具有四级结构A. ⾎红蛋⽩B. ⽜胰核糖核酸酶C. 肌红蛋⽩D. 蛋⽩激酶A8. 含有卟啉环的蛋⽩质是A. ⾎红蛋⽩B. 过氧化氢酶C. 肌红蛋⽩D. 细胞⾊素9. 下列那些蛋⽩质含有铁离⼦A. ⾎红蛋⽩B. ⽜胰核糖核酸酶C. 肌红蛋⽩D. 胰岛素10. 蛋⽩质变性是由于A. 氢键断裂B. 肽键破坏C. 破坏⽔化层和中和电荷D. 亚基解聚11. 镰⼑型红细胞贫⾎症患者⾎红蛋⽩β-链上第六位的⾕氨酸被缬氨酸所取代后,将产⽣那些变化A.在pH7.0电泳时增加了异常⾎红蛋⽩向阳极移动的速度B.导致异常脱氧⾎红蛋⽩的聚合作⽤C.增加了异常⾎红蛋⽩的溶解度D.⼀级结构发⽣改变12. 下⾯有哪些蛋⽩质或酶能协助蛋⽩质正确折叠A. 分⼦伴侣B. ⽜胰核糖核酸酶C. 胰岛素D. 伴侣素13. 下列哪些肽分⼦⼀级组成极相近,⽽且属于寡肽A. 脑啡肽B.催产素C. 加压素D. 促肾上腺⽪质激素14. 下⾯对氨基酸与蛋⽩质之间的关系叙述正确的是A. 氨基酸具有的性质蛋⽩质也⼀定具有B. 有些氨基酸的性质蛋⽩质也具有C.有些蛋⽩质的性质氨基酸不具有D.两者之间的性质关系并不紧密15. 肽键平⾯中能够旋转的键有A. C=OB. C-NC. Cα-N D. Cα-C16. 对⾎红蛋⽩的结构特点叙述正确的是A. 具有4个亚基B. 是⼀种结合蛋⽩质C. 每个亚基都具有三级结构D. 亚基键主要靠次级键连接三. 填空题1. 组成蛋⽩质的碱性氨基酸有、和。
《基础应用化学》课件 第二十章-生物高分子

C6 Hα-2DOH-(-O)-吡喃果C1 H糖2OH
5H
OH 2
H4
3 OH
OH
H
α-D-(-)-呋喃果糖
HH
H
6
H
6
1
COHO2O
H1
OCHH2OH
5 5 OHHOHH2 CHHO 22
OHOHHH4OH4
3CO3OHHH3
COHH2O H 1
C6Hβ2-OαDHC-6D-H(--2HO(O-H)-)4吡-吡CO喃喃果OO果H糖H糖C1 H2OH
第二十章 生物高分子
目录
CONTENTS
1 糖类
2
氨基酸和蛋白质
PART 1
糖类
糖类
一、单糖
1、单糖的结构
(1)单糖的开链式结构
单糖分子中都含有手性碳原子,所以 都有立体异构体。例如五羟基己醛分 子中有四个手性碳原子,其立体异构 体总数应为 24 个,天然葡萄糖是其中 的一个,其构型如右图:
CHO H C OH HO C H H C OH H C OH
CH2OH
CO
HO
H
H
OH
H
OH
CH2OH
+ 托伦试剂(斐林试剂)COOHH NhomakorabeaOH
OH H
H OH
+ Ag↓(Cu2O↓)
H
OH
CH2OH
糖类
一、单糖
(2)氧化反应
2、单糖的性质
在不同条件下,醛糖可被氧化成不同产物,比如用硝酸氧化葡萄糖时,得到葡萄糖 二酸,而用溴水氧化葡萄糖则得到葡萄糖酸。反应式如下:
抗生素中的链霉素含有氨基糖的 组分。
糖类
二、二糖
中药药理学-第二十章-补虚药

22
增强下丘脑-垂体-肾上腺皮质轴功能
• 补气药人参、刺五加、黄芪、白术、甘草 ,补血药熟地黄、当归、何首乌,补阴药 玄参、生地黄、知母,补阳药巴戟天、仙 茅、淫羊藿、鹿茸、杜仲,以及生脉注射 液等均有增强肾上腺皮质功能的作用。
ANHUI AGRICULTURAL UNIVERSITY
23
增强下丘脑-垂体-性腺轴功能
ANHUI AGRICULTURAL UNIVERSITY
30
• 人参、党参、刺五加、当归、淫羊藿、 补骨脂。麦冬、女贞子、黄精、墨旱莲 等能扩张冠脉、增加冠脉血流量、改善 心肌血氧供应,提高心肌抗缺氧能力, 具有抗心肌缺血作用。
• 甘草、刺五加、淫羊藿、冬虫夏草、当 归、麦冬、生脉散、参附汤、炙甘草汤 具有抗心律失常作用。
ANHUI AGRICULTURAL UNIVERSITY
24
Байду номын сангаас
调节下丘脑-垂体-甲状腺轴功能
• 甲状腺激素具有调节物质代谢增加产热的作用。 阴虚证和阳虚证病人的血清T3和T4含量均显著低 于正常人,而阴虚证病人又明显低于阳虚证病人 。
• 紫河车、人参具有增强甲状腺轴功能的作用。 • 人参及补阳药附子肉桂合剂具调节甲状腺轴功能
• Cu、Zn、Fe、Li为人体必需微量元素, 非必需或有害微量元素是Ni、Pb,黄芪 、枸杞、人参、灵芝等Zn含量均较高;
ANHUI AGRICULTURAL UNIVERSITY
20
④调节环核苷酸水平
补虚药可通过影响cAM P和cGMP的含量 而对细胞的代谢和功能起着重要的作用, 提高组织中的cAMP浓度而增强细胞活力 ,如黄芪、党参、甘草灌胃给药可显著升 高小鼠血浆和牌组织中cAMP的含量。
生物化学重点名词英文缩写

生物化学英文缩写第一章蛋白质氨基酸分类1、非极性脂肪族氨基酸Gly 甘氨酸Ala 丙氨酸Val 缬氨酸Leu 亮氨酸Ile 异亮氨酸Pro 脯氨酸2、极性中性氨基酸Ser 丝氨酸Cys 半胱氨酸Met 蛋氨酸Asn 天冬酰胺Gln 谷氨酰胺Thr 苏氨酸3、芳香族氨基酸Phe 苯丙氨酸Trp 色氨酸Tyr 酪氨酸4、酸性氨基酸Asp 天冬氨酸Glu 谷氨酸5、碱性氨基酸Lys 赖氨酸Arg 精氨酸His 组氨酸Hb 血红蛋白Mb 肌红蛋白PrP 阮病毒蛋白PI 等电点CD 圆二色光谱NMR 核磁共振技术第二章核酸cAMP 环腺苷酸HGP 人类基因组计划hnRNA 不均一核RNAm7GpppN 7-甲基鸟嘌呤-三磷酸核苷CBP 帽结合蛋白PABP poly(A)结合蛋白ORF 开放阅读框DHU 双氢尿嘧啶ψ假尿嘧啶核苷m G,m A 甲基化嘌呤snmRNA 非mRNA小RNAsnRNA 核内小RNAsnoRNA 核仁小RNAscRNA 胞质小RNAsiRNA 小片段干扰RNA第三章酶NAD+尼克酰胺腺嘌呤二核苷酸,辅酶I NADP+尼克酰胺腺嘌呤二核苷酸磷酸,辅酶IIFMN 黄素单核苷酸FAD 黄素腺嘌呤核苷酸LDH 乳酸脱氢酶CK 肌酸激酶PCR 聚合酶链反应BAL 二巯基丙醇PAM 解磷定第四章糖代谢SGLT Na 依赖型葡萄糖转运体GLUT 依赖一类葡萄糖转运体G-6-P 6-磷酸葡萄糖PEK-1 6-磷酸果糖激酶-1PEP 磷酸烯醇式丙酮酸FBP-2 果糖二磷酸酶-2TAC 三羧酸循环(TCA循环) GSH 谷胱甘肽UDPG 尿苷二磷酸葡萄糖UDPGA尿苷二磷酸葡萄糖醛酸PKA 蛋白激酶A第五章脂类代谢FA 脂肪酸PG 前列腺素TX 血栓烷LTs 白三烯CM 乳糜微粒FFA 游离脂肪酸HSL 激素敏感性甘油三酯脂酶ACP 酰基载体蛋白VLDL 极低密度脂蛋白LDL 低密度脂蛋白IDL 中密度脂蛋白HDL 高密度脂蛋白SRS-A 过敏反应的慢反应物质5-HPETE 氢过氧化廿碳四烯酸PA 磷脂酸PIP2磷脂酰肌醇-4,5-二磷酸IP3三磷酸肌醇RCDP 康-亨综合症MV A 甲羟戊酸SCP 固醇载体蛋白CE 胆固醇酯LRP LDL受体相关蛋白HL 肝脂酶FC 游离胆固醇CERP 胆固醇流出调节蛋白LCAT 卵磷脂胆固醇脂肪酰转移酶第六章生物氧化Fe-S 铁硫中心CoQ 辅酶Q(泛醌)F P2黄素蛋白-2(人复合体2)Cyt 细胞色素OSCP 寡霉素敏感蛋白DNP 二硝基苯酚mtDNA 线粒体DNACP 磷酸肌酸ROS 反应活性氧类(自由基)SOD 超氧物歧化酶第七章氨基酸代谢GPT 谷丙转氨酶ALT 丙氨酸转氨酶GOT 谷草转氨酶AST 天冬氨酸转氨酶IMP 次黄嘌呤核苷酸CPS-I 氨基甲酰磷酸合成酶IAGA N-乙酰谷氨酸OCT 鸟氨酸氨基甲酰转移酶5-HT 5-羟色胺FH4四氢叶酸SAM S-腺苷甲硫氨酸NOS 一氧化氮合酶第八章核苷酸代谢HGPRT 次黄嘌呤-鸟嘌呤磷酸核糖转移酶PRPP 磷酸核糖焦磷酸6MP 6-巯基嘌呤MTX 甲氨蝶呤5-FU 5-氟尿嘧啶FUTP 三磷酸氟尿嘧啶核苷第九章物质代谢的联系与调节MS 中心性肥胖CCK 胆囊收缩素第十章DNA的生物合成E、coli 大肠杆菌dNTP 脱氢三磷酸核苷(N代表任一碱基) DNA-pol DNA聚合酶SSB 单链DNA结合蛋白HDP 螺旋反稳定蛋白RF 复制因子/释放因子PCNA 增殖细胞核抗原CDK 细胞周期蛋白依赖激酶hTR 人类端粒RNAhTP1人类端粒协同蛋白1hTRT 端粒酶逆转录酶TT 胸苷酸二聚体第十一章RNA的生物合成CTP 羧基末端结合域Inr 转录起始子TF 转录因子PIC 转录起始前复合物TPB TATA-结合蛋白CDK-9 周期蛋白依赖性激酶9CPSF 断裂与聚腺苷酸化特异性因子CStF 断裂激动因子PAP 多聚腺苷酸聚合酶PAB II 腺苷酸结合蛋白II 第十二章蛋白质的生物合成rp 多种核糖体蛋白质EF 延长因子fMet N-甲酰甲硫氨酸THFA N10-甲酰四氢叶酸RBS 核糖体结合位点PAB/PABP poly A结合蛋白TF 触发因子HSP 热休克蛋白PDI 蛋白质二硫键异构酶PPI 肽-脯氨酰顺反异构酶POMC 鸦片促黑皮质素原ACTH 促肾上腺皮质激素β-LT β酯酸释放激素α-MSH α-促黑激素CLIP 促肾上腺皮质激素样中叶肽SRP 信号肽识别颗粒IFN 干扰素第十三章基因表达调控AFP 编码甲胎蛋白CAP 分解物基因激活蛋白IPTG 异丙基硫代半乳糖苷TAF TA TA盒结合蛋白(TBP)相关因子UAS 上游激活序列EBP 增强子结合蛋白bZIP 碱性亮氨酸拉链bHLH 碱性螺旋-环-螺旋RNP 核糖体复合物TfR 运铁蛋白受体IRE 铁反应元件eIF 翻译起始因子RBP RNA结合蛋白RISC 沉默复合体dsRNA 双链RNA第十四章基因重组与基因工程IS 插入序列bp 碱基对YAC 人工染色体载体cDNA 逆转录DNA第十五章细胞信息传导PDE 磷酸二酯酶cGPK cGMP依赖性蛋白激酶(PKG)PLC 磷脂酰肌醇特异性磷脂酶CDAG 二酯酰甘油PIKs 磷脂酰肌醇激酶CaM 钙调蛋白PP 蛋白磷酸酶HRE 激素反应元件GPCR G蛋白偶联型受体PTK 酪氨酸激酶EGF 表皮生长因子IκB NF-κB抑制蛋白β-AR β-肾上腺素能受体XLA 人类X染色体连锁低γ丢蛋白血症第十六章血液的生物化学Gal 半乳糖APP 急性时相蛋白质GRP C-反应蛋白IL-1 白细胞介素-1APR 急性时相反应物MHb 高铁血红蛋白ALA δ-氨基-γ-酮戊酸UPG-I 尿卟啉原I同合酶CPG III 粪卟啉原IIIEPO 促红细胞生成素第十七章肝的生物化学GK 葡糖激酶MEOS 肝微粒体乙醇氧化系统UGT 葡糖醛酸基转移酶COMT 可溶性儿茶酚-O-甲基转移酶GST 谷胱甘肽-S-转移酶第二十章癌基因Rb基因视网膜母细胞瘤基因。
生化英文缩写

生化英文缩写生物化学英文缩写第一章蛋白质氨基酸分类1、非极性脂肪族氨基酸Gly 甘氨酸Ala 丙氨酸Val 缬氨酸Leu 亮氨酸Ile 异亮氨酸Pro 脯氨酸2、极性中性氨基酸Ser 丝氨酸Cys 半胱氨酸Met 蛋氨酸Asn 天冬酰胺Gln 谷氨酰胺Thr 苏氨酸3、芳香族氨基酸Phe 苯丙氨酸Trp 色氨酸Tyr 酪氨酸4、酸性氨基酸Asp 天冬氨酸Glu 谷氨酸5、碱性氨基酸Lys 赖氨酸Arg 精氨酸His 组氨酸Hb 血红蛋白Mb 肌红蛋白PrP 阮病毒蛋白PI 等电点CD 圆二色光谱NMR 核磁共振技术第二章核酸cAMP 环腺苷酸HGP 人类基因组计划hnRNA 不均一核RNAmGpppN 7-甲基鸟嘌呤-三磷酸核苷CBP 帽结合蛋白PABP poly(A)结合蛋白ORF 开放阅读框DHU 双氢尿嘧啶ψ假尿嘧啶核苷G,A 甲基化嘌呤snmRNA 非mRNA小RNA snRNA 核内小RNA snoRNA 核仁小RNAscRNA 胞质小RNAsiRNA 小片段干扰RNA第三章酶NAD 尼克酰胺腺嘌呤二核苷酸,辅酶I NADP 尼克酰胺腺嘌呤二核苷酸磷酸,辅酶II FMN 黄素单核苷酸FAD 黄素腺嘌呤核苷酸LDH 乳酸脱氢酶CK 肌酸激酶PCR 聚合酶链反应BAL 二巯基丙醇PAM 解磷定第四章糖代谢SGLT Na依赖型葡萄糖转运体GLUT 依赖一类葡萄糖转运体G-6-P 6-磷酸葡萄糖PEK-1 6-磷酸果糖激酶-1PEP 磷酸烯醇式丙酮酸FBP-2 果糖二磷酸酶-2TAC 三羧酸循环(TCA循环)GSH 谷胱甘肽UDPG 尿苷二磷酸葡萄糖UDPGA尿苷二磷酸葡萄糖醛酸PKA 蛋白激酶A第五章脂类代谢FA 脂肪酸PG 前列腺素TX 血栓烷LTs 白三烯CM 乳糜微粒FFA 游离脂肪酸HSL 激素敏感性甘油三酯脂酶ACP 酰基载体蛋白VLDL 极低密度脂蛋白LDL 低密度脂蛋白IDL 中密度脂蛋白HDL 高密度脂蛋白SRS-A 过敏反应的慢反应物质5-HPETE 氢过氧化廿碳四烯酸PA 磷脂酸PIP 磷脂酰肌醇-4,5-二磷酸IP 三磷酸肌醇RCDP 康-亨综合症MVA 甲羟戊酸SCP 固醇载体蛋白CE 胆固醇酯LRP LDL受体相关蛋白HL 肝脂酶FC 游离胆固醇CERP 胆固醇流出调节蛋白LCAT 卵磷脂胆固醇脂肪酰转移酶第六章生物氧化Fe-S 铁硫中心CoQ 辅酶Q(泛醌)F P 黄素蛋白-2(人复合体2)Cyt 细胞色素OSCP 寡霉素敏感蛋白DNP 二硝基苯酚mtDNA 线粒体DNACP 磷酸肌酸ROS 反应活性氧类(自由基)SOD 超氧物歧化酶第七章氨基酸代谢GPT 谷丙转氨酶ALT 丙氨酸转氨酶GOT 谷草转氨酶AST 天冬氨酸转氨酶IMP 次黄嘌呤核苷酸CPS-I 氨基甲酰磷酸合成酶IAGA N-乙酰谷氨酸OCT 鸟氨酸氨基甲酰转移酶5-HT 5-羟色胺FH 四氢叶酸SAM S-腺苷甲硫氨酸NOS 一氧化氮合酶第八章核苷酸代谢HGPRT 次黄嘌呤-鸟嘌呤磷酸核糖转移酶PRPP 磷酸核糖焦磷酸6MP 6-巯基嘌呤MTX 甲氨蝶呤5-FU 5-氟尿嘧啶FUTP 三磷酸氟尿嘧啶核苷第九章物质代谢的联系与调节MS 中心性肥胖CCK 胆囊收缩素第十章DNA的生物合成E.coli 大肠杆菌dNTP 脱氢三磷酸核苷(N代表任一碱基)DNA-pol DNA聚合酶SSB 单链DNA结合蛋白HDP 螺旋反稳定蛋白RF 复制因子/释放因子PCNA 增殖细胞核抗原CDK 细胞周期蛋白依赖激酶hTR 人类端粒RNAhTP 人类端粒协同蛋白1hTRT 端粒酶逆转录酶TT 胸苷酸二聚体第十一章RNA的生物合成CTP 羧基末端结合域Inr 转录起始子TF 转录因子PIC 转录起始前复合物TPB TATA-结合蛋白CDK-9 周期蛋白依赖性激酶9 CPSF 断裂和聚腺苷酸化特异性因子CStF 断裂激动因子PAP 多聚腺苷酸聚合酶PAB II 腺苷酸结合蛋白II第十二章蛋白质的生物合成rp 多种核糖体蛋白质EF 延长因子fMet N-甲酰甲硫氨酸THFA N-甲酰四氢叶酸RBS 核糖体结合位点PAB/PABP poly A结合蛋白TF 触发因子HSP 热休克蛋白PDI 蛋白质二硫键异构酶PPI 肽-脯氨酰顺反异构酶POMC 鸦片促黑皮质素原ACTH 促肾上腺皮质激素β-LT β酯酸释放激素α-MSH α-促黑激素CLIP 促肾上腺皮质激素样中叶肽SRP 信号肽识别颗粒IFN 干扰素第十三章基因表达调控AFP 编码甲胎蛋白CAP 分解物基因激活蛋白IPTG 异丙基硫代半乳糖苷TAF TATA盒结合蛋白(TBP)相关因子UAS 上游激活序列EBP 增强子结合蛋白bZIP 碱性亮氨酸拉链bHLH 碱性螺旋-环-螺旋RNP 核糖体复合物TfR 运铁蛋白受体IRE 铁反应元件eIF 翻译起始因子RBP RNA结合蛋白RISC 沉默复合体dsRNA 双链RNA第十四章基因重组与基因工程IS 插入序列bp 碱基对YAC 人工染色体载体cDNA 逆转录DNA第十五章细胞信息传导PDE 磷酸二酯酶cGPK cGMP依赖性蛋白激酶(PKG)PLC 磷脂酰肌醇特异性磷脂酶C DAG 二酯酰甘油PIKs 磷脂酰肌醇激酶CaM 钙调蛋白PP 蛋白磷酸酶HRE 激素反应元件GPCR G蛋白偶联型受体PTK 酪氨酸激酶EGF 表皮生长因子IκB NF-κB抑制蛋白β-AR β-肾上腺素能受体XLA 人类X染色体连锁低γ丢蛋白血症第十六章血液的生物化学Gal 半乳糖APP 急性时相蛋白质GRP C-反应蛋白IL-1 白细胞介素-1APR 急性时相反应物MHb 高铁血红蛋白ALA δ-氨基-γ-酮戊酸UPG-I 尿卟啉原I同合酶CPG III 粪卟啉原IIIEPO 促红细胞生成素第十七章肝的生物化学GK 葡糖激酶MEOS 肝微粒体乙醇氧化系统UGT 葡糖醛酸基转移酶COMT 可溶性儿茶酚-O-甲基转移酶GST 谷胱甘肽-S-转移酶第二十章癌基因Rb基因视网膜母细胞瘤基因。
生物化学简答题

⽣物化学简答题第⼆章蛋⽩质1、组成蛋⽩质的基本单位是什么?结构有何特点?氨基酸是组成蛋⽩质的基本单位。
结构特点:①组成蛋⽩质的氨基酸仅有20种,且均为α-氨基酸②除⽢氨酸外,其Cα均为不对称碳原⼦③组成蛋⽩质的氨基酸都是L-α-氨基酸2、氨基酸是如何分类的?按其侧链基团结构及其在⽔溶液中的性质可分为四类:①⾮极性疏⽔性氨基酸7种②极性中性氨基酸8种③酸性氨基酸2种④碱性氨基酸3种3、简述蛋⽩质的分⼦组成。
蛋⽩质是由氨基酸聚合⽽成的⾼分⼦化合物,氨基酸之间通过肽键相连。
肽键是由⼀个氨基酸的α-羧基和另⼀个氨基酸的α-氨基脱⽔缩合形成的酰胺键4、蛋⽩质变性的本质是什么?哪些因素可以引起蛋⽩质的变性?蛋⽩质特定空间结构的改变或破坏。
化学因素(酸、碱、有机溶剂、尿素、表⾯活性剂、⽣物碱试剂、重⾦属离⼦等)和物理因素(加热、紫外线、X射线、超声波、⾼压、振荡等)可引起蛋⽩质的变性5、简述蛋⽩质的理化性质。
①两性解离-酸碱性质②⾼分⼦性质③胶体性质④紫外吸收性质⑤呈⾊反应6、蛋⽩质中的氨基酸根据侧链基团结构及其在⽔溶液中的性质可分为哪⼏类?各举2-3例。
①⾮极性疏⽔性氨基酸7种:蛋氨酸,脯氨酸,缬氨酸②极性中性氨基酸8种:丝氨酸,酪氨酸,⾊氨酸③酸性氨基酸2种:天冬氨酸,⾕氨酸②碱性氨基酸3种:赖氨酸,精氨酸,组氨酸第三章核酸1.简述DNA双螺旋结构模型的要点。
①两股链是反向平⾏的互补双链,呈右⼿双螺旋结构②每个螺旋含10bp,螺距3.4nm,直径2.0nm。
每个碱基平⾯之间的距离为0.34nm,并形成⼤沟和⼩沟——为蛋⽩质与DNA相互作⽤的基础③脱氧核糖和磷酸构成链的⾻架,位于双螺旋外侧④碱基对位于双螺旋内侧,碱基平⾯与双螺旋的长轴垂直;两条链位于同⼀平⾯的碱基以氢键相连,满⾜碱基互补配对原则:A=T,G≡C⑤双螺旋的稳定:横向—氢键,纵向—碱基堆积⼒⑥DNA双螺旋的互补双链预⽰DNA 的复制是半保留复制2、从组成、结构和功能⽅⾯说明DNA和RNA的不同。
有机化学第二十章 蛋白质和核酸

第二十章 蛋白质和核酸1.写出下列化合物的结构式:(1)门冬酰门冬酷氨酸;(2)谷-半胱-甘三肽(习惯称谷胱甘肽)(Glutathiene,一种辅酶,生物还原剂); (3)运动徐缓素Arg-Pro-Gly-Phe-Pro-phe-Arg;(4)3’-腺苷酸; (5)尿芏-2’,3‘- 磷酸; 6)一个三聚核苷酸,其序列为腺-胞-鸟. (7)苯丙氨酰腺苷酸; 答案:(1)H 2NCH CCH 2COOH NHOCHCCH 2COOHONHCHCOOHCH 2OH(2)H 2N CHCCH 2CH 2COOHO NHCH2SHCONHCH 2COOHCNHCH 2CONHCHC O CH 2NHCC CH 2OHNC ONCHO H 2N 2)3NHCHNH 2NO C ONHCHC CH 2ONH CHCOOH CH 2CH 2NH CH 2NO(3)ONH(4)NNNN O HH O OH NH 2H HOPOOHOHO H HH HOHNNH OOOO P P OOOOOHOH(5)N NN N O H H O O NH 2H OHOH H H HN N ONH 2O OH P OP OOHOH O OOOOO N NN N O H H NHCHHNNN N O H HO OHH HONH 2OP O OHOOCHNH 2CH 2OHHO(6)(7)2.写下列化合物在标明 的pH 时的结构式:(1)缬氨酸在pH8时; (2)丝氨酸在pH1时; (3)赖氨酸在pH10时; (4)谷氨酸在pH3时; (5)色氨酸在pH12时; 答案:(1)CH3CH 3CHCOO NH 2(2)HOCH 2CHCOOHNH 3(3)H 2NCH 2CH 2CH 2CH 2CHOONH 2(4)2CH 2HONH 3O(5)N CH 2CHCOONH 2H3.举列说明下列名词的定义:(1)α-螺旋构型;(2)变性;(3)脂蛋白; (4)三级结构; (5)β-折叠型.答案:(1)α-螺旋构型:(α-helix )是蛋白质最常见,含量最丰富的二级结构。
高中化学蛋白质和核酸教案

高中化学蛋白质和核酸教案主题:蛋白质和核酸教学目标:1.了解蛋白质和核酸的基本结构和功能;2.掌握蛋白质和核酸的化学性质;3.了解蛋白质和核酸在生物体内的重要作用。
教学重点:1.蛋白质的组成、结构和功能;2.核酸的组成、结构和功能;3.蛋白质和核酸的化学性质。
教学内容:一、蛋白质1. 蛋白质的组成:氨基酸是蛋白质的组成单位,18种氨基酸构成了蛋白质。
2. 蛋白质的结构:主要由氨基基团、羧基团和侧链组成,具有四级结构:一级结构、二级结构、三级结构和四级结构。
3. 蛋白质的功能:酶、激素、抗体、血红蛋白等都是蛋白质的功能。
二、核酸1. 核酸的组成:由糖、磷酸和碱基组成,碱基分为嘌呤和嘧啶两类。
2. 核酸的结构:DNA和RNA是生物体内两种重要的核酸,都具有双螺旋结构。
3. 核酸的功能:DNA存储遗传信息,RNA参与蛋白质合成。
三、蛋白质和核酸的化学性质1. 蛋白质的水解:氨基酸在强酸或酶的作用下会发生水解反应。
2. 核酸的水解:核酸在酶的催化下会发生水解反应,形成核苷酸。
教学方法:1. 理论讲解结合实例分析;2. 组织学生进行小组讨论,共同解决问题;3. 实验操作,观察蛋白质和核酸的化学性质。
教学评价:1. 课堂互动问答;2. 学生小组展示;3. 实验操作数据分析。
教学反思:1. 讲解是否详细清晰;2. 学生理解及掌握程度;3. 实验操作是否达到预期效果。
教学延伸:1. 探讨蛋白质和核酸的应用领域;2. 深入了解蛋白质和核酸的新研究进展;3. 拓展学生科学素养,引导学生关注生命科学领域。
(以上为蛋白质和核酸的化学教案范本,可根据具体情况进行适当调整)。
第二十章疾病相关基因克隆

连锁分析是定位疾病未知基因的常用方法
根据基因在染色体上呈直线排列,不同基因相 互连锁成连锁群的原理,即应用被定位的基因 与同一染色体上另一基因或遗传标记相连锁的 特点进行定位
三 利用生物信息数据库
电子克隆(in silico cloning)
通过已获得的序列与数据库中核酸序列及蛋白 质序列进行同源性比较,或对数据库中不同物 种的序列比较分析,拼接,预测新的全长基因等, 进而通过实验证实,从组织细胞中克隆该基因
(一)从已知蛋白质功能和结构出发克隆 疾病基因
1 依据蛋白质的氨基酸序列信息鉴定克隆 疾病相关基因
如果疾病相关的蛋白质在体内表达丰富,可分 离纯化得到一定纯度的足量蛋白质,就可用质 谱或化学方法进行氨基酸序列分析,获得全部 或部分氨基酸序列信息.色体上的候选区域 绘制目的区域的物理图谱 疾病相关基因的确定
基因定位的基本方法
体细胞杂交法(somatic cell hybridization)
又称细胞融合(cell fusion) , 是通过融合细胞 的筛查定位基因. 将来源不同(人与鼠)的两种细胞融合成一个新 细胞,在融合过程中人类染色体逐渐丢失,最后 只剩一条或数条,即可定位基因.
一 不依赖染色体定位的疾病相关基因克隆 策略 二常用策略---定位克隆 三 生物信息数据库的利用
一 不依赖染色体定位的疾病相关基因克 隆策略
功能克隆(functional cloning)
在掌握或部分了解基因功能产物蛋白质的基础 上,鉴定蛋白质相关基因,进而克隆该基因 采用从蛋白质到DNA的研究路线
2 用蛋白质的特异性抗体鉴定疾病基因
获得少量低纯度的蛋白质
免疫动物获得特异性抗体
直接结合正翻译过程 中的新生肽链,获得同 中的新生肽链 获得同 时结合在核糖体上的 mRNA分子 最终克 分子,最终克 分子 隆未知基因 筛查可表达的cDNA文 文 筛查可表达的 库,筛选出可与该抗体 筛选出可与该抗体 反应的表达蛋白质的阳 性克隆,获得候选基因 性克隆 获得候选基因
高中生物 第一部分蛋白质、核酸的结构性质

目录
第一节 蛋白质元素组成及生理功能
第二节 蛋白质的基本结构单位──氨基酸 第三节 肽
第四节 蛋白质的分子结构 第五节 蛋白质的分子结构与功能的关系
第六节 蛋白质的重要性质 第七节 蛋白质分类(自学)
思考
蛋白质主要元素组成:C、H、O、N、S 及 P、Fe、 Cu、Zn、Mo、I、Se 等微量元素。•
2 两性解离性质 (pI) 3 紫外吸收 4 变性与复性;
核酸分子杂交 ,增色效应,减色效应,Tm 5 颜色反应
蛋白质:茚三酮反应;双缩脲反应:酚试剂反应 核酸: DNA 与二苯胺反应,
RNA与甲基间苯二酚反应
第二章 蛋白质化学
主要内容:介绍氨基酸的结构、分类、 性质及肽的概念,重点讨论蛋白质的结构、 性质以及结构和功能的相互关系。
一级结构
化学结构
二级结构
超二级结构和结构域 三级结构
空间构象
四级结构
蛋白质的一级结构
多肽链中氨基酸的排列顺序,包括二硫键的位置称为蛋白 质的一级结构(primary structure)。这是蛋白质最基本的结构, 它内寓着决定蛋白质高级结构和生物功能的信息。一级结构的 走向规定为N-端 C-端。
蛋白质结构与功能的关系实例:
同功能蛋白质结构的种属差异与保守性 蛋白质前体的激活 核糖核酸酶的变性与复性 血红蛋白变构和输送氧的功能 血红蛋白异常病变—镰刀型贫血病
核酸结构与功能的关系 核酸是遗传物质,其结构和功能的关系主要体现在遗传信息传递的
中心法则之中
五、蛋白质、核酸的化学性质
1 大分子特性 蛋白质的胶体性质和沉淀(盐析法,透析法) 核酸的沉降特性( 沉降系数 S)
动力学上更为合理 蛋白质(酶)活性部位常位于结构域之间,使其更具柔性.
生物化学教程

生物化学教程第1篇生物分子的结构和化学第1章生物分子导论一、生命物质的化学组成(一) 生命元素(二) 生物分子二、物分子的三维结构(一) 生物分子的大小(二) 立体异构与构型(三) 生物分子间相互作用的立体专一性(四) 构象与三维结构(五) 三维结构的分子模型三、生物结构中的非共价力(一) 静电相互作用(二) 氢键(三) 范德华力(四) 疏水相互作用熵效应四、水和生命(一) 水的结构和性质(二) 水是生命的介质五、细胞的分子组织层次六、生物分子的起源与进化(一) 化学进化的理论(二) 实验室中化学进化的演示(三) 原始生物分子第2章蛋白质的构件——氨基酸一、蛋白质的化学组成和分类二、蛋白质的水解三、a-氨基酸的一般结构四、氨基酸的分类(一) 常见的蛋白质氨基酸(二) 不常见的蛋白质氨基酸(三) 非蛋白质氨基酸五、氨基酸的酸碱性质(一) 氨基酸的解离(二) 氨基酸的等电点六、氨基酸的化学反应(一) a-羧基反应(二) a-氨基反应(三) 茚三酮反应(四) 侧链官能团的特异反应七、氨基酸的旋光性和光谱性质(一) 氨基酸的旋光性和立体化学(二) 氨基酸的光谱性质八、氨基酸混合物的分离和分析(一) 分配层析(二) 离子交换层析第3章蛋白质的通性、纯化和表征一、蛋白质的酸碱性质二、蛋白质的胶体性质与蛋白质的沉淀(一) 蛋白质胶体性质(二) 蛋白质沉淀三、蛋白质分离纯化的一般原则四、蛋白质的分离纯化方法(一) 透析和超过滤(二) 凝胶过滤(三) 盐溶和盐析(四) 有机溶剂分级分离法(五) 凝胶电泳和等电聚焦(六) 离子交换层析(七) 亲和层析(八) 高效液相层析五、蛋白质相对分子质量的测定(一) 凝胶过滤法测定相对分子质量(二) SDS-聚丙烯酰胺凝胶电泳法测定相对分子质量(三) 沉降速度法测定相对分子质量六、蛋白质的含量测定与纯度鉴定(一) 蛋白质含量测定(二) 蛋白质纯度鉴定第4章蛋白质的共价结构一、蛋白质的分子大小二、蛋白质结构的组织层次三、肽(一) 肽和肽键的结构(二) 肽的物理和化学性质(三) 天然存在的活性肽四、蛋白质测序的策略五、蛋白质测序的一些常用方法(一) 末端分析(二) 二硫键的断裂(三) 氨基酸组成的分析(四) 多肽链的部分裂解(五) 肽段氨基酸序列的测定(六) 肽段在原多肽链中的次序的确定(氨基酸全序列的重建)(七) 二硫键位置的确定六、根据基因的核苷酸序列推定多肽的氨基酸序列七、蛋白质一级结构的举例八、蛋白质序列数据库九、肽与蛋白质的化学合成:固相肽的合成第5章蛋白质的三维结构一、研究蛋白质构象的方法二、稳定蛋白质三维结构的力三、多肽主链折叠的空间限制(一) 肽平面与a-碳的二面角(φ和ψ)(二) 可允许的妒和砂值:拉氏图四、二级结构:多肽主链的局部规则构象(一) a螺旋(二) 卢片或卢折叠(三) 口转角五、纤维状蛋白质(一) a-角蛋白(二) 磷脂的生物合成六、类二十烷酸的生物合成七、胆固醇的代谢(一) 胆固醇代谢的特点(二) 胆固醇的生物合成八、脂蛋白的代谢第6章蛋白质的功能与进化一、蛋白质功能的多样性二、血红蛋白的结构(一) 血红素(二) 珠蛋白的三级结构(三) 与O2结合的机制(四) 血红蛋白的四级结构三、血红蛋白的功能:转运氧(一) 肌红蛋白是氧的贮库(二) 血红蛋白氧合的协同性和别构效应(三) 血红蛋白的两种构象状态:R态和T态(四) 血红蛋白协同性氧结合的定量分析(五) BPG调节Hb对O2的亲和力(六) H+和CO2调节Hb对O2的亲和力:Bohr效应四、血红蛋白分子病(一) 镰状细胞贫血病(二) a-和β-地中海贫血五、免疫球蛋白(一) 免疫系统(二) 免疫球蛋白的结构和类别(三) 基于抗体一抗原相互作用的生化分析方法六、氨基酸序列与生物学功能(一) 同源蛋白质的物种差异与生物进化(二) 同源蛋白质具有共同的进化起源第7章糖类和糖生物学一、引言(一) 糖类的生物学作用(二) 糖类的化学本质(三) 糖类的命名和分类二、单糖的结构和性质(一) 单糖的链状结构(二) 单糖的环状结构(三) 单糖的构象(四) 单糖的物理和化学性质三、重要的单糖和单糖衍生物(一) 单糖(二) 糖醇(三) 糖酸(四) 脱氧糖(五) 氨基糖四、寡糖(一) 寡糖的结构(二) 常见的二糖(三) 其他简单寡糖(四) 环糊精五、多糖(一) 贮存同多糖(二) 结构同多糖(三) 结构杂多糖六、糖缀合物(一) 糖蛋白(二) 寡糖链的生物学功能(三) 蛋白聚糖(四) 脂多糖七、寡糖结构的分析(一) 寡糖结构分析的策略(二) 用于寡糖结构分析的一些方法第8章脂质与生物膜一、三酰甘油和蜡(一) 脂肪酸(二) 酰基甘油(三) 蜡二、磷脂和鞘脂(一) 甘油磷脂的结构(二) 甘油磷脂的一般性质(三) 几种常见的甘油磷脂(四) 醚甘油磷脂(五) 鞘脂三、萜和类固醇(一) 萜(二) 类固醇(三) 胆固醇和其他固醇(四) 固醇衍生物四、血浆脂蛋白(一) 血浆脂蛋白的分类(二) 血浆脂蛋白的结构与功能五、膜的分子组成和超分子结构(一) 生物膜的分子组成(二) 脂双层的自装配(三) 膜组分的不对称分布(四) 生物膜的流动性(五) 生物膜的流动镶嵌模型六、脂质的提取与分析(一) 脂质的有机溶剂提取(二) 脂质的吸附层析分离(三) 混合脂肪酸的气液色谱分析(四) 脂质结构的测定第9章酶引论一、酶研究的简史二、酶是生物催化剂(一) 反应速率理论与活化能(二) 酶通过降低活化自由能提高反应速率(三) 酶还是偶联反应的介体(四) 酶作为生物催化剂的特点三、酶的化学本质(一) 酶的化学组成(二) 酶的四级缔合四、酶的命名和分类(一) 酶的命名(二) 酶的分类和编号五、酶的专一性(一) 酶对底物的专一性(二) 关于酶专一性的假说六、酶活力的测定(一) 酶活力、活力单位和比活力(二) 反应速率、初速率和酶活力测定七、非蛋白质生物催化剂——核酶(一) 核酶的发现(二) L19RNA是核酶(三) RNaseP的RNA组分是核酶(四) 锤头核酶八、酶分子工程(一) 固定化酶(二) 化学修饰酶(三) 抗体酶——人工模拟酶(四) 酶的蛋白质工程第10章酶动力学一、有关的化学动力学概念(一) 基元反应和化学计量方程(二) 化学反应的速率方程一(三) 反应分子数和反应级数(四) 一级、二级和零级反应的特征二、底物浓度对酶促反应速率的影响(一) 酶促反应动力学的基本公式-米-曼氏方程(二) 米一曼氏方程所确定的图形是一直角双曲线(三) 米一曼氏动力学参数的意义(四) 米一曼氏方程的线性化作图求Km和Vmax值三、多底物的酶促反应四、影响酶促反应速率的其他因素(一) pH对酶促反应的影响(二) 温度对酶促反应的影响(三) 激活剂对酶促反应的影响五、酶的抑制作用(一) 抑制作用的概念(二) 抑制作用的类型(三) 可逆抑制的动力学(四) 酶抑制剂应用举例第11章酶作用机制和酶活性调节一、酶的活性部位及其确定方法二、酶促反应机制(一) 基元催化的分子机制(二) 酶具有高催化能力的原因三、酶促反应机制的举例(一) 丝氨酸蛋白酶(二) 烯醇化酶四、酶活性的别构调节(一) 酶的别构效应和别构酶(二) 别构酶的动力学特点(三) 协同性配体结合的模型(四) 别构酶的举例五、酶活性的共价调节(一) 酶的可逆共价修饰(二) 酶原激活——不可逆共价调节六、同工酶第12章维生素与辅酶一、引言(一) 维生素的概念(二) 维生素的发现(三) 维生素-辅酶的关系二、水溶性维生素(一) 维生素B1(硫胺素) 和辅酶硫胺素焦磷酸(TPP)(二) 维生素B2(核黄素) 和黄素辅酶(FMN和FAD)(三) 维生素PP(烟酸和烟酰胺) 和烟酰胺辅酶(NAD和NADP)(四) 泛酸和辅酶A(五) 维生素B6和辅酶磷酸吡哆醛(六) 生物素和辅酶生物胞素(七) 叶酸和辅酶F(四氢叶酸)(八) 维生素B12(氰钴氨素) 和辅酶5-脱氧腺苷钴胺素(十) 维生素C(抗坏血酸)三、脂溶性维生素(一) 维生素A(视黄醇)(二) 维生素D(钙化醇)(三) 维生素E(生育酚)(四) 维生素K(萘醌)第13章核酸通论一、核酸的发现和研究简史(一) 核酸的发现(二) 核酸的早期研究(三) DNA双螺旋结构模型的建立(四) 生物技术的兴起(五) 人类基因组计划开辟了生命科学新纪元二、核酸的种类和分布(一) 脱氧核糖核酸(DNA)(二) 核糖核酸(RNA)三、核酸的生物功能(一) DNA是主要的遗传物质(二) RNA参与蛋白质的生物合成(三) RNA功能的多样性第14章核酸的结构一、核苷酸(一) 碱基(二) 核苷二、核酸的共价结构(一) 核酸中核苷酸的连接方式(二) DNA的一级结构(三) RNA的一级结构三、DNA的高级结构(一) DNA的双螺旋结构(二) DNA的三股螺旋和四股螺旋(三) DNA的超螺旋(四) DNA与蛋白质复合物的结构四、RNA的高级结构(一) tRNA的高级结构(二) rRNA的高级结构(三) 其他RNA的高级结构第2篇新陈代谢第15章核酸的物理化学性质和研究方法一、核酸的水解(一) 酸水解(二) 碱水解(三) 酶水解二、核酸的酸碱性质三、核酸的紫外吸收四、核酸的变性、复性及杂交(一) 变性(二) 复性(三) 核酸分子杂交五、核酸的分离和纯化(一) 核酸的超速离心(二) 核酸的凝胶电泳(三) 核酸的柱层析(四) DNA的提取和纯化(五) RNA的提取和纯化六、核酸序列的测定(一) DNA的酶法测序(二) DNA的化学法测序(三) RNA的测序(四) DNA序列分析的自动化七、核酸的化学合成八、DNA微阵技术(一) DNA芯片的类型(二) DNA芯片的制作(三) 核酸杂交的检测(四) DNA芯片的应用第16章激素一、引言(一) 激素的定义(二) 激素的分类(三) 人和脊椎动物的内分泌腺及其分泌的激素(四) 激素和其他化学信号的区别(五) 激素分泌的等级控制和反馈调节二、激素作用的机制(一) 类固醇激素和甲状腺激素的作用机制(二) 肽激素和肾上腺儿茶酚胺激素的作用机制三、人和脊椎动物激素举例(一) 胺(氨基酸衍生物) 激素(二) 肽和蛋白质激素(三) 类固醇(甾类) 激素(四) 类二十烷酸或类前列腺酸(脂肪酸衍生物)四、昆虫激素(一) 脑激素(二) 保幼激素(三) 蜕皮激素(四) 性信息素五、植物激素(一) 生长素(二) 细胞分裂素(三) 赤霉素(四) 脱落酸(五) 乙烯第17章新陈代谢总论一、新陈代谢概述二、新陈代谢中常见的有机反应机制(一) 基团转移反应(二) 氧化反应和还原反应(三) 消除、异构化及重排反应(四) 碳一碳键的形成与断裂反应三、新陈代谢的研究方法第18章生物能学一、有关热力学的一些基本概念(一) 体系的概念、性质和状态(二) 能的两种形式——热与功(三) 内能和焓的概念(四) 热力学的两个基本定律和熵的概念(五) 自由能的概念二、自由能变化、标准自由能变化及其与平衡常数的关系(一) 化学反应的标准自由能变化及其与平衡常数的关系(二) 能量学用于生物化学反应中一些规定的概括(三) 标准自由能变化的可加性(四) △Gθ,△G和平衡常数计算的举例三、高能磷酸化合物(一) 高能磷酸化合物的概念(二) ATP以基团转移形式提供能量四、其他高能化合物第19章六碳糖的分解和糖酵解作用一、糖酵解作用二、糖酵解第一阶段的5步反应(一) 葡萄糖磷酸化形成葡萄糖-6-磷酸(二) 葡萄糖-6-磷酸异构化形成果糖-6-磷酸(三) 果糖-6-磷酸形成果糖-1,6-二磷酸(四) 果糖-1,6-二磷酸转变为甘油醛-3-磷酸和二羟丙酮磷酸(五) 二羟丙酮磷酸转变为甘油醛-3-磷酸三、糖酵解第二阶段的5步反应(一) 甘油醛-3-磷酸形成1,3-二磷酸甘油酸(二) 1,3-二磷酸甘油酸转移高能磷酸基团形成ATP(三) 3-磷酸甘油酸转变为2一磷酸甘油酸(四) 2-磷酸甘油酸脱水形成磷酸烯醇式丙酮酸(五) 磷酸烯醇式丙酮酸转变为丙酮酸并产生一个ATP分子四、由葡萄糖转变为2分子丙酮酸的能量估算五、丙酮酸在无氧条件下的去路(一) 生成乳酸(二) 生成乙醇六、糖酵解作用的调节(一) 磷酸果糖激酶是关键酶(二) 果糖-2,6-二磷酸对糖酵解的调节作用(三) 已糖激酶和丙酮酸激酸对糖酵解的调节作用七、其他六碳糖的分解途径(一) 六碳糖进入细胞(二) 六碳糖进入糖酵解途径分解第20章柠檬酸循环一、丙酮酸进入柠檬酸循环的准备阶段——形成乙酰-CoA(乙酰-SCoA)(一) 丙酮酸脱羧反应(二) 乙酰基转移到CoA-SH分子上形成乙酰-CoA的反应(三) 还原型二氢硫辛酰转乙酰基酶氧化,形成氧化型的硫辛酰转乙酰基酶(四) 还原型E3的再氧化二、柠檬酸循环的全貌三、柠檬酸循环的各个反应步骤(一) 草酰乙酸与乙酰-CoA缩合形成柠檬酸(二) 柠檬酸异构化形成异柠檬酸(三) 异柠檬酸氧化形成a-酮戊二酸(四) a-酮戊二酸氧化脱羧形成琥珀酰-CoA(五) 琥珀酰-CoA转化为琥珀酸并使GDP磷酸化形成高能GTP(哺乳类) 或使ADP成为ATP(植物或细菌)(六) 琥珀酸脱氢形成延胡索酸(七) 延胡索酸水合形成L-苹果酸(八) 苹果酸氧化形成草酰乙酸四、柠檬酸循环的化学总结算五、柠檬酸循环的调节六、柠檬酸循环的双重作用七、乙醛酸途径第21章氧化磷酸化和光合磷酸化作用一、氧化磷酸化作用(一) 和电子传递相关的氧化还原电势(二) 用标准还原势计算自由能变化(三) 线粒体的电子传递链(四) 氧化磷酸化作用的机制(五) 氧化磷酸化的解偶联(六) 质子动力为主动转运提供能量(七) 电子传递和氧化磷酸化中的P/O比(八) 细胞溶胶内NADH的再氧化(九) 氧化磷酸化作用的调节二、光合磷酸化作用(photophosphorylation)(一) 光合作用(photosynthesis)(二) 叶绿体的结构(三) 叶绿体中捕获光的叶绿素和其他色素(四) 光合作用中的电子传递(五) 光合磷酸化作用(六) CO2的固定(暗反应)(七) 由Rubisco酶的加氧活性引起的光(合) 呼吸第22章戊糖磷酸途径一、戊糖磷酸途径的发现二、戊糖磷酸途径的主要反应三、戊糖磷酸途径反应速率的调控四、戊糖磷酸途径的生物学意义第23章葡糖异生和糖的其他代谢途径一、葡糖异生作用(一) 葡糖异生作用的途径(二) 葡糖异生途径总览(三) 由丙酮酸形成葡萄糖的能量消耗及意义(四) 葡糖异生作用的调节(五) 乳酸的再利用和可立氏循环二、糖的其他代谢途径三、葡萄糖出入动物细胞的特殊运载机构四、糖蛋白的生物合成五、糖蛋白糖链的分解代谢第24章糖原的分解与合成代谢一、糖原的分解代谢二、糖原的生物合成三、糖原代谢的调控(一) 糖原磷酸化酶的别构调节因素(二) 糖原合酶的调节因素(三) 激素对糖原代谢的调节四、糖原累积症第25章脂质的代谢一、脂肪酸的分解代谢(一) 三酰甘油的消化、吸收和转运(二) 脂肪酸的氧化分解二、脂肪酸的生物合成(一) 乙酰-CoA从线粒体到细胞溶胶的转运(二) 脂肪酸的合成步骤三、脂肪酸代谢的调节四、三酰甘油的生物合成五、磷脂的分解代谢与合成(一) 甘油磷脂的分解代谢第26章蛋白质降解和氨基酸的分解代谢一、蛋白质的降解(一) 蛋白质降解的特性(二) 蛋白质降解的反应机制(三) 机体对外源蛋白质的需要及其消化作用二、氨基酸的分解代谢(一) 氨基酸的转氨基作用(二) 葡萄糖-丙氨酸循环将氨运入肝脏(三) 谷氨酸脱氢酶催化的氧化脱氨基作用(四) 氨的命运三、尿素的形成——尿素循环(一) 尿素循环过程(二) 尿素循环的调节四、氨基酸碳骨架的分解代谢(一) 经丙酮酸形成乙酰-CoA(二) 部分碳骨架形成乙酰-CoA或乙酰乙酰-CoA(三) 形成a-酮戊二酸(四) 形成琥珀酰-CoA(五) 形成草酰乙酸的途径(六) 分支氨基酸脱氨基和脱羧基的特殊性(七) 生糖氨基酸和生酮氨基酸(八) 氨基酸与一碳单位(九) 氨基酸与生物活性物质(十) 氨基酸代谢缺陷症第27章氨基酸的生物合成和生物固氮一、生物固氮二、氨的同化作用——氨通过谷氨酸和谷氨酰胺掺人生物分子三、氨基酸的生物合成(一) 由a-酮戊二酸形成的氨基酸——谷氨酸、谷氨酰胺、脯氨酸、精氨酸、赖氨酸(二) 由草酰乙酸形成的氨基酸——天冬氨酸、天冬酰胺、甲硫氨酸、苏氨酸、赖氨酸(细菌、植物) 、异亮氨酸(三) 由丙酮酸形成的氨基酸——亮氨酸、异亮氨酸、缬氨酸、丙氨酸(四) 由甘油酸-3-磷酸形成的氨基酸——丝氨酸、甘氨酸、半胱氨酸(五) 以磷酸烯醇式丙酮酸和赤藓糖-4-磷酸为前体形成的氨基酸——色氨酸、苯丙氨酸、酸(六) 组氨酸的生物合成四、氨基酸生物合成的调节五、由氨基酸合成的其他特殊生物分子(一) 卟啉的生物合成(二) 谷胱甘肽的生物合成(三) 肌酸的生物合成(四) 氧化氮的生物合成第28章核酸的降解和核苷酸代谢一、核酸和核苷酸的分解代谢(一) 核酸的解聚作用(二) 核苷酸的降解(三) 嘌呤碱的分解(四) 嘧啶碱的分解二、核苷酸的生物合成(一) 嘌呤核糖核苷酸的合成(二) 嘧啶核糖核苷酸的合成(三) 脱氧核糖核苷酸的合成三、辅酶核苷酸的生物合成(一) 烟酰胺核苷酸的合成(二) 黄素核苷酸的合成(三) 辅酶A的合成第3篇遗传信息第29章遗传信息概论一、NA是遗传信息的携带分子(一) 细胞含有恒定量的DNA(二) DNA是细菌的转化因子(三) 病毒是游离的遗传因子(四) 基因是DNA的一段序列(五) DNA重组技术为基因组的研究提供了最有力的手段二、RNA使遗传信息得以表达(一) RNA参与蛋白质的合成(二) RNA进行信息加工(三) RNA干扰(四) RNA的表型效应(五) RNA对基因的解读三、遗传密码的破译四、遗传密码的基本特性(一) 密码的基本单位(二) 密码的简并性(三) 密码的变偶性(四) 密码的通用性(五) 密码的防错系统五、遗传物质的进化(一) 生物进化的热力学和动力学(二) 生命的起源和进化(三) 生物的进化:驱动力、多样性和适应性第30章 DNA的复制和修复一、DNA的复制(一) DNA的半保留复制(二) DNA的复制起点和复制方式(三) DNA聚合反应和有关的酶(四) DNA的半不连续复制(五) DNA复制的拓扑性质(六) DNA的复制过程与复制体变化(七) 真核生物DNA的复制二、DNA的损伤修复(一) 错配修复(二) 直接修复(三) 切除修复(四) 重组修复(五) 应急反应(SOS) 和易错修复三、DNA的突变(一) 突变的类型(二) 诱变剂的作用(三) 诱变剂和致癌剂的检测第31章DNA的重组一、同源重组(一) Holliday模型(二) 细菌的基因转移与重组(三) 重组有关的酶二、特异位点重组三、转座重组(一) 细菌的转座因子(二) 真核生物的转座因子第32章RNA的生物合成和加工一、DNA指导下RNA的合成(一) DNA指导的RNA聚合酶(二) 启动子和转录因子(三) 终止子和终止因子(四) 转录的调节控制(五) RNA生物合成的抑制剂二、RNA的转录后加工(一) 原核生物中RNA的加工(二) 真核生物中RNA的一般加工(三) RNA的剪接、编辑和再编码(四) RNA生物功能的多样性(五) RNA的降解三、在RNA指导下RNA和DNA的合成(一) RNA的复制(二) RNA的逆转录(三) 逆转座子的种类和作用机制第33章蛋白质的生物合成一、参与蛋白质生物合成的RNA和有关装置(一) 核糖体(二) 转移RNA和氨酰-tRNA合成酶(三) 信使RNA二、蛋白质生物合成的步骤(一) 氨酰-tRNA的合成(二) 多肽链合成的起始(三) 多肽链合成的延伸(四) 多肽链合成的终止(五) 多肽链的折叠与加工三、蛋白质合成的忠实性(一) 蛋白质合成的忠实性需要消耗能量(二) 合成酶的校对功能提高了忠实性(三) 核糖体对忠实性的影响四、蛋白质的运输和定位(一) 蛋白质的信号肽与跨膜运输(二) 糖基化在蛋白质定位中的重要作用(三) 线粒体和叶绿体蛋白质的定位(四) 核的运输和定位五、蛋白质生物合成的抑制物第34章细胞代谢与基因表达调控一、细胞代谢的调节网络(一) 代谢途径交叉形成网络(二) 分解代谢和合成代谢的单向性(三) ATP是通用的能量载体(四) NADPH以还原力形式携带能量(五) 代谢的基本要略在于形成ATP、还原力和构造单元以用于生物合成二、酶活性的调节(一) 酶促反应的前馈和反馈(二) 产能反应与需能反应的调节(三) 酶活性的特异激活剂和抑制剂(四) 蛋白酶解对酶活性的影响(五) 酶的共价修饰与连续激活三、细胞对代谢途径的分隔与控制(一) 细胞结构和酶的空间分布(二) 细胞膜结构对代谢的调节和控制作用四、细胞信号传递系统(一) 激素和递质受体的信号转导系统(二) 细胞增殖的调节(三) 门控离子通道和神经信号的传导五、基因表达的调节(一) 原核生物基因表达的调节(二) 真核生物基因表达的调节第35章基因工程及蛋白质工程一、DNA克隆的基本原理(一) DNA限制酶与片段连接(二) 分子克隆的载体与宿主(三) 外源基因导入宿主细胞二、基因的分离、合成和测序(一) 基因文库的构建(二) cDNA文库的构建(三) 克隆基因的分离与鉴定(四) 聚合酶链(式) 反应扩增基因(五) DNA的化学合成(六) 基因定位诱变(七) DNA序列的测定三、克隆基因的表达(一) 外源基因在原核细胞中的表达(二) 基因表达产物的分离和鉴定(三) 外源基因在真核细胞中的表达四、蛋白质工程(一) 蛋白质的分子设计和改造(二) 蛋白质的实验进化(三) 蛋白质工程的进展五、基因工程的应用与展望(一) 基因工程开辟了生物学研究的新纪元(二) 基因工程促进了生物技术产业的兴起(三) 基因工程研究的展望(二) 丝心蛋白(三) 胶原蛋白六、超二级结构和结构域(一) 超二级结构(二) 结构域七、球状蛋白质与三级结构(一) 球状蛋白质及其亚基的分类(二) 球状蛋白质三维结构的特征八、亚基缔合与四级结构(一) 有关四级结构的一些概念(二) 四级缔合在结构和功能上的优越性九、蛋白质的变性与折叠(一) 蛋白质变性与功能丢失-(二) 氨基酸序列规定蛋白质的三维结构(三) 多肽链是分步快速折叠的。
封面、目录、概要王镜岩《生物化学》第三版笔记(打印版)

封⾯、⽬录、概要王镜岩《⽣物化学》第三版笔记(打印版)⽣物化学笔记王镜岩等《⽣物化学》第三版适合以王镜岩《⽣物化学》第三版为考研指导教材的各⾼校的⽣物类考⽣备考⽬录第⼀章概述------------------------------01 第⼆章糖类------------------------------06 第三章脂类------------------------------14 第四章蛋⽩质(注1)-------------------------21 第五章酶类(注2)-------------------------36 第六章核酸(注3)--------------------------------------45 第七章维⽣素(注4)-------------------------52 第⼋章抗⽣素------------------------------55 第九章激素------------------------------58 第⼗章代谢总论------------------------------63 第⼗⼀章糖类代谢(注5)--------------------------------------65 第⼗⼆章⽣物氧化------------------------------73 第⼗三章脂类代谢(注6)--------------------------------------75 第⼗四章蛋⽩质代谢(注7)-----------------------------------80 第⼗五章核苷酸的降解和核苷酸代谢--------------86 第⼗六章 DNA的复制与修复(注8)---------------------------88 第⼗七章 RNA的合成与加⼯(注9)---------------------------93 第⼗⼋章蛋⽩质的合成与运转--------------------96 第⼗九章代谢调空------------------------------98第⼆⼗章⽣物膜(补充部分)---------------------102(1)对应⽣物化学课本上册第3、4、5、6、7章。
有机化学 第二十一章 氨基酸、蛋白质和核酸

氨基酸等电点可由相应氨基酸盐酸盐的pKa值求 出。如丙氨酸盐酸盐,可看作一个二元酸,具有两
个平衡常数K1和K2
用碱调节丙氨酸盐酸盐水溶液pH值,当加入 0.5mol碱时,平衡中氨基酸正离子4的浓度与偶极 离子5的相同,[4] =[5]此时溶液pH值等于pK1,实 际上此溶液中只有50%的偶极离子5。当加入1.5mol 碱时,溶液中氨基酸偶极离子5的浓度等于负离子6, [5]=[6]此时溶液的pH值等于pK2 ,溶液中也含50% 偶极离子5。所以使丙氨酸完全以偶极离子5存在时, pH值应为pK1和pK2的平均值,这个pH值即为丙氨酸 的等电点(pI),pI=(pK1 + pK2)/2。根据表21-2数据, 丙氨酸盐酸盐的pK1为2. 3、pK2为9. 7,可求出丙 氨酸等电点为6. 0:
三、氨基酸的来源与合成 氨基酸不仅是组成蛋白质的结构单元,而且它
们本身也是人体生长的重要营养物质,具有特殊的 生理作用,因此氨基酸的生产和应用早就得到人们 的重视。
生产氨基酸主要有以下四条途径: 1.蛋白质的水解
由蛋白质水解制备氨基酸是从1820年开始的, 这是一个最古老的方法。味精早期就是由小麦蛋白 质—面筋水解得到。胱氨酸、半咣氨酸是由头发水 解制得的。
天然氨基酸,除甘氨酸外, α碳原子都有手 性,且都是L构型。氨基酸的构型是与乳酸相比而 确定的(也就是从甘油醛导出来的)。例如,与L -乳酸相应的L -丙氨酸的构型是:
正像糖类化合物一样,氨基酸的构型习惯于用 D,L标记法。如果用R/S法标记,那么天然氨基酸大 多属于S构型。但也有R构型的,如L-半胱氨酸为R构 型。
胺与羧酸反应很容易形成铵盐,当氨基和羧基存在 于同一分子时,可在分子内发生质子迁移而形成内盐 (zwitterion):
第二十章 氨基酸 蛋白质 核酸

完全水解后,经分析氨基酸的组成为:丙、亮、赖、苯丙、脯、丝、 酪、缬。 端基分析:N-端 丙……………………亮 C-端。 胰蛋白酶催化水解:分离得到酪氨酸,一种三肽和一种四肽。 用 Edman 降解分别测定三肽、四肽的顺序,结果为:丙-脯-苯丙;赖丝-缬-亮。 由上述信息得知,八肽的顺序为:
丙 脯 苯丙 酪 赖 丝 缬 亮 三肽 糜蛋白酶 四肽
NH2NH2
C
O NH
C NH O
+
NH2 CH COOH CH2Ph
D,L-苯丙氨酸 合成法合成的氨基酸是外消旋体,拆分后才能得到 D-合 L-氨基酸。 氨基酸的化学合成 1850 年就已实现,但氨基酸的发酵法生产在一百年后的 1957 年才得以实现用糖类(淀粉)发酵生产谷氨酸。
第二节 多 肽
一、多肽的组成和命名 1. 肽和肽键 一分子氨基酸中的羧基与另一分子氨基酸分子的氨基脱水而形成的酰胺叫 做肽,其形成的酰胺键称为肽键。
位于左边的为 L 型。例如:
COOH H C R NH2 NH2
COOH C R H
D-氨基酸
L-氨基酸
天然氨基酸(出甘氨酸外)其他所有α-碳原子都是手性的,都有旋光性, 而且发现主要是 L 型的(也有 D 型的,但很少) 。 二、氨基酸的性质 1.氨基酸的酸-碱性——两性与等电点 氨基酸分子中的氨基是碱性的,而羧基是酸性的,因而氨基酸既能与酸反 应,也能与碱反应,是一个两性化合物。
R CH COOH NH2 OH H H OH
R CH COO NH2
R CH COO NH3
R CH COO H NH3
溶Байду номын сангаас pH> 等电点 pH<等电点
等电点 (pI)
蛋白质

谷胱甘肽(glutathione, GSH)
γ-肽键
还原型
氧化型
(1) 体内重要的还原剂 保护蛋白质和酶分子中的巯基免遭氧化, 使蛋白质处于活性状态。 (2) 谷胱甘肽的巯基作用 可以与致癌剂或药物等结合,从而阻断这 些化合物与DNA、RNA或蛋白质结合,保护机体免遭毒性损害。
第二节 蛋白质的分子结构
无规卷曲泛指那些不能被归入明确的二级结构 如折叠或螺旋的多肽区段。实际上这些区段大多数 既不是卷曲,也不是完全无规的。这些“无规卷曲” 也像其它二级结构那样是明确而稳定的结构,但是 它们受氨基酸残基侧链R基相互作用的影响很大。这 类有序的非重复性结构经常构成酶活性部位和其它
蛋白质特异的功能部位。
模体是具有特殊功能的超二级结构
(一)α-helix
① 多个肽平 面通过Cα的 旋转,相互之 间紧密盘曲成 稳固的右手螺 旋。
α-helix
② 主链螺旋 上升,每3.6个 氨基酸残基上 升一圈,螺距 0.54nm。肽平 面和螺旋长轴 平行。
α-helix
③ 相邻两圈螺旋之间 借肽键中羰基氧 (C=O)
和亚氨基氢(NH)形成许
多链内氢键,即每一个
氨基酸残基中的亚氨基
氢和前面相隔三个残基 的羰基氧之间形成氢键, 这是稳定α-螺旋的主要 化学键。
α-helix
④ 肽链中氨基酸残基侧链R基, 分布在螺旋外侧,其形状、大小 及电荷均会影响α-螺旋的形成。
(二)β-pleated sheet
①是肽链相当伸展的结构,肽平面之间折叠成锯齿状,相邻肽 平面间呈110°角。 ②依靠两条肽链或一条肽链内的两段肽链间的羰基氧与亚氨基 氢形成氢键,使构象稳定。也就是说,氢键是稳定β-折叠的主 要化学键。
蛋白质存在于所有的生物细胞中.

用Edman降解法提供逐次减少一个残基的肽链 灵敏度提高,能连续测定。 多肽顺序自动分析仪 样品最低用量可在5pmol
(5)与荧光胺的反应 •α- NH2的反应 •氨基酸定量 (6)与5,5’-双硫基-双(2-硝基苯甲酸)反应 •-SH的反应 •测定细胞游离- SH的含量 (7)其他反应 •成盐、成酯、成肽、脱羧反应
1.蛋白质是生物体内必不可少的重要成分 蛋白质占干重 人体中(中年人) 人体 45% 水55% 细菌 50%~80% 蛋白质19% 真菌 14%~52% 脂肪19% 酵母菌 14%~50% 糖类<1% 白地菌50% 无机盐7% 2.蛋白质是一种生物功能的主要体现者 (1)酶的催化作用 (2)调节作用(多肽类激素) (3)运输功能 (4)运动功能 (5)免疫保护作用(干扰素) (6)接受、传递信息的受体 (7)毒蛋白
(3) 与2,4-二硝基氟苯(DNFB)反应
反应特点 A.为α- NH2的反应 B.氨基酸α- NH2的一个H原子可被烃基取代(卤代烃) C.在弱碱性条件下,与DNFB发生芳环取代,生成二硝基苯氨基酸 应用:鉴定多肽或蛋白质的N-末端氨基酸 A.虽然多肽侧链上的ε- NH2、酚羟基也能与DNFB反应,但其生成物,容易与 α- DNP氨基酸区分和分离
COOH H3N
+
C R
H
-H pK1 ' +H
+
+
COO H3N
+
-
C R
H
-H pK2 ' +H
+
+
COO H2N C R
-
H
PH
1 正离子
7 0 两性离子 等电点PI
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
赖氨酸(Lys)
返回
2 氨基酸的构型
组成蛋白质的氨基酸除甘氨酸外,α-碳原子都是手性的。 氨基酸的构型常用D/L法标记,但与糖D/L标记法不完全
一样。
CHO HO H CH2OH
L-甘油醛
COOH H2 N H CH3
L-丙氨酸
HN
COOH H
L-脯氨酸
在苏氨酸和异亮氨酸分子中还有第二个手性碳原子,它 们的构型分别为:
中性氨基酸
氨基羧基 数目相等 氨基数目 多于羧基
碱性氨基酸
酸性氨基酸
羧基数目 多于氨基
返回
H2NCCH2CHCOOH O NH2
门冬酰胺(Asn)
H2NCCH2CH2CHCOOH O NH2
谷氨酰胺(Gln)
按烃基的结构分为脂肪族氨基酸、芳香族氨基酸和杂环 氨基酸。 氨基酸的烃基不同和相互作用,在很大程度上影响 蛋白质的结构,特别是它的生理功能。
可以通过测定氨基酸的等电点来鉴别氨基酸。
课堂练习:
•下列氨基酸溶于水使之达到等电点应加酸还是加碱?
(1)赖氨酸
H2NCH2CH2CH2CH2CHCOOH NH2
等电点时pH>7,溶于水中使之达到等电点应当加碱 (2)甘氨酸 H2NCH2COOH 等电点时pH<7,溶于水中使之达到等电点应当加酸
(3)谷氨酸
α-氨基戊二酸 (谷氨酸)
NH2
β-氨基丙酸
返回
天然氨基酸常采用习惯名称,即按其来源或性质命名。
门冬氨酸最初是由天门冬的幼苗中发现的; 甘氨酸是因为具有甜味。
构成蛋白质的20种氨基酸,有一套通用的符号,这些 符号象元素符号一样,是国际通用的。
8种人体必需氨基酸:
CH3 (CH3)2CHCHCOOH NH2 (CH3)2CHCH2CHCOOH NH2 CH3CH2CHCHCOOH NH2
缬氨酸(Val)
OH CH3CHCHCOOH NH2
亮氨酸(Leu)
CH3SCH2CH2CHCOOH NH2
异亮氨酸(Ile)
C6H5CH2CHCOOH NH2
苏氨酸(Thr)
CH2CHCOOH
N
蛋氨酸(Met)
苯丙氨酸(Phe)
H2NCH2CH2CH2CH2CHCOOH NH2
NH2
色氨酸(Trp)
是通过相互作用,以内盐(偶极离子)形式存在的。 在溶液中存在下列平衡:
R
CH NH3+
COOH
OH - H+
R
CH NH3+
COO
-
OH - H+
R
CH NH2
COO
-
(3) 等电点 在不同pH值的溶液中,氨基酸能以正离子、负离子和两 性离子三种离子间形成动态平衡。 适当调节溶液的pH值,使得氨基酸的羧基与氨基的离子 化程度相等。 此时所带的正负电荷数相同,净电荷为零呈电中性。 这个等电状态的pH值,称为该氨基酸的等电点,用pI表示。 在等电点时,氨基酸几乎全部以两性离子形式存在,有 极少量的严格相等的正离子和负离子。
在自然界中存在的氨基酸目前知道的有400多种,但在 生物体内组成蛋白质的氨基酸只有20种。
组成蛋白质的氨基酸都是α-氨基酸,只是基团R不同。
R
CH NH2
COOH
这些氨基酸有的只有一个氨基和一个羧基,有的含有 第二个氨基(碱性基团)或第二个羧基(酸性基团) 。
根 据 氨 基 和 羧 基 的 相 对 数 目
在等电点时,氨基酸几乎全部以两性离子形式存在。 溶液的pH<pI时,氨基酸以正离子形式存在;
溶液的pH>pI时,氨基酸以负离子形式存在。
处于等电点的氨基酸溶解度最小。 分子结构不同的氨基酸,等电点各不相同。 中性氨基酸:pI=6.2~6.8; 酸性氨基酸:pI=2.8~3.2;
碱性氨基酸:pI=7.6~10.8。
(1) α-氨基酸的物理性质 熔点:α-氨基酸都是高熔点固体,多数在熔化时分解。 因此,α-氨基酸的熔点不能作为鉴定的可靠物理常数。 甘氨酸:262℃(分解);酪氨酸:310℃(分解) 。
(2) 酸碱性 氨基酸既能和酸反应生成铵盐,也能和碱反应生成羧酸 盐,是两性化合物。
氨基酸分子中的羧基和氨基不是以游离状态存在的,而
HOOCCH2CH2CHCOOH NH2
等电点时pH<7,溶于水中使之达到等电点应当加酸
返回
(4) 氨基的反应 蛋白质中的20种α-氨基酸除脯氨酸外,都能与亚硝酸反 应,放出氮气生成α-羟基酸。
氨基酸的命名
• 氨基酸的系统命名法是以羧酸为母体,氨基为取代基 来命名的。 但α -氨基酸通常按其来源或性质所得的 俗名来称呼。
H2NCH2COOH NH2CH2CH2CH2CH2CHCOOH NH2
α-氨基乙酸 (甘氨酸)
HOOCCH2CH2CHCOOH
α,ε-二氨基己酸 (赖氨酸)
NH2CH2CH2COOH
产品介绍:三聚氰胺是一种重要的有机 化工中间产品,主要用来制作三聚氰胺 树脂,具有优良的耐水性、耐热性、耐 电弧性、优良阻燃性。用途:可用于装 饰板的制作,用于氨基塑料、粘合剂、 涂料、币纸增强剂、纺织助剂等。 摄入人体后由于胃酸的作用三聚氰胺和三聚氰酸相互解离并被分别 通过小肠吸收进入血液循环并最终进入肾脏。在肾细胞中两者再次 结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭。由于三 聚氰胺结石微溶于水,对于成年人,由于经常喝水使得结石不容易 形成。但对于哺乳期的婴儿,由于喝水很少并且相比成年人肾脏狭 小,造成更容易形成结石。这也是2008年中国婴幼儿奶粉污染事件 中受害者基本为婴儿而很少见到其他年龄阶段的儿童或成人的原因 之一。中国卫生部对于该污染事件的指导治疗方案中,对于三聚氰 胺造成的轻度结石,推荐使用大量饮水的方法来消除,也是基于这 个原理。
COOH H2N H OH H CH3
L-苏氨酸 (2S,3R)
COOH H2N H H H3C CH2CH3
L-异亮氨酸 (2S,3R)
根据离羧基最近的手性碳原子的构型判定:氨基在左侧 的为L型,氨基在右侧的为D型。
由于组成蛋白质的氨基酸都是L型的,因此习惯上仍
使用D/L法。
3 氨基酸的性质
第十五章、氨基酸、多肽、蛋白质
蛋白质是重要的生物大分子,在生物体中含量较大,种类
繁多,生物体的各种生物功能就是依靠蛋白质来完成的。 蛋白质的基本结构单位是20种α-氨基酸。 多肽是多个α-氨基酸分子通过酰胺键(肽键)连接而生成的 化合物,蛋白质则是分子量很大的多肽。
1 氨基酸的结构、分类和命名
