2010年全国高中学生化学竞赛决赛(冬令营)理论试题与实验试题
2010年高中化学冬令营决赛两道试题赏析

考题点评青春,一旦和它紧紧地握手,就能获得开拓新途径的动力,拥有创造性人生的灵性.2010年高中化学冬令营决赛两道试题赏析江苏 乔加亮 陈 凯高中化学冬令营中的有机化学试题历来比初赛难度大.2010年全国高中化学竞赛冬令营试题仍然以科技前沿为背景,考查有机合成与推断.这类题目不仅要求考生要掌握全面的有机物质结构与性质知识,还需具备很强的知识迁移和综合解决问题能力.下面就以两题为例,详细地对有机试题进行分析.!第7题∀2005年诺贝尔化学奖授予在烯烃复分解反应研究方面做出卓越贡献的Chauv in 、Grubbs 和Schro ck 3位化学家.烯烃复分解反应已被广泛应用于有机合成和化学工业,特别是药物和塑料的研发.最近,这一反应在天然产物(+) A ng elm ar in 的全合成中得到应用.(+) Angelmarin 是中草药独活中的有效成分之一.1971年Fr ank 小组报道了它的关键中间体E 的合成(见合成路线1).最近,Coster 小组用廉价易得的烯丙基溴代替Frank 方法中较贵的3 甲基 1 乙炔,合成中间体G,再经烯烃复分解反应得到D,继而通过对应选择性环氧化等4步得到光学纯的(+) Ang elmarin (见合成路线2).(+) A ng elm arin合成路线1:合成路线2:(1)画出B 、C 、F 的结构式.(2)试为合成路线1中第2、3步反应和合成路线中的第2步反应提出合理的从C 到E 转化(即第4步反应)提出合理的反应条件和试剂.(3)试解释合成路线2中从D 到E 转化(即第4步反应)的历程(用反应式表示).(4)在合成路线2的第2步反应(从F 到G 的转化)中还观察到了1种副反应,它是G 的同分异构体,试画出这个副产物的结构式.(5)3 甲基 3 氯 1 乙炔是合成路线1中使用的原料之一,用乙炔和必要的有机或无机试剂,用不超过三步反应的合成路线合成该化合物,写出反应式.合成路线的第1步中的反应物有酚羟基,因此具有弱酸性,碳酸钠与A 发生中和反应会生成酚钠,由于酚钠是1种盐,有较好的水溶性;而3 甲基 3 氯 1 丁烯是有机物,故在没有其他有机溶剂的情况下,酚钠与3 甲基 3 氯 1 丁烯之间会有明显的界限,几乎不会发生反应.加入丙酮后,3 甲基 3 氯 1 丁烯会溶解到丙酮中,因为A 作为有机盐在丙酮中也会有一定的溶解度,这样2种反应物充分就会混合,为接下来的反应创造条件.因为A 是1种盐,可在水溶液中完全电离成氧负离子和钠离子,氧负离子具有很强的亲核性,会攻击3 甲基 3 氯 1 丁烯中发生极化的碳卤键一端的碳原子,发生亲核取代反应生成B;B 在Lindlar 催化剂的催化下部分氢化生成C;C 在加热时断裂碳氧键生成氧负离子和稳定的三级碳正离子,前者水化成酚羟基,后者是一种良好的亲电试剂,羟基是邻对位定位基,因为对位已被取代,所以亲电试剂攻击羟基的邻位碳,其中1个碳原子是2个氧的邻位,因活性较强被进攻,进攻后生成D;在超氧化试剂下,D 中的双键被氧化而成环氧化物;同时D 中含有酚羟基具有酸性,故可与61好学而不勤问非真好学者.碳酸钠发生中和反应生成具有亲核性的氧负离子,氧负离子又进攻极化的碳氧键中的碳原子发生亲核加成反应,其中生成的氧负离子水解成醇即得E.合成路线2提供了另一种合成方案,其中反应的第1步同路线1中的第1步反应机理相同:A 与3 溴丙烯会发生亲核取代反应,生成F,第2步的反应机理与路线1中的第4步一样,即F 在加热的情况醚键断裂,其中生成的氧负离子水解成羟基;生成的碳正离子进攻羟基的2个邻位,G 为主要产物.第3步是在Grubbs 催化剂发生的烯烃复分解反应得到F.至于用乙烯和其他原料合成3 甲基 3 氯 1 丁烯,采用的合成思想是官能团的互换.即用羟基替代卤素原子.互换的原因是因为卤代烃的合成较难,替代后得到的醇的合成则很常见.醇的最常见的合成方法就是亲核加成法:包括格氏试剂合成法即格氏试剂与酮的反应或碳负离子与酮反应.观察3 甲基 3 羟基 1 丁烯的结构,可知2个三键碳原子都来自于乙炔负离子或格氏试剂;剩余的部分则是相应的酮提供.答案 (1)(2)合成路线1第1步反应:H 2/Lindlar 催化剂,第3步反应:加热,合成路线2第2步反应:加热;(3)(4)、(5)见背面.!第8题∀20世纪70年代我国科学家从民间治疗疟疾草药黄花蒿中分离出一种含有过氧桥结构的半萜内酯化合物,称为青蒿素,它是我国自主研发并在国际上注册的药物,也是目前世界上最有效的抗疟疾药物之一.我国著名有机合成化学家、中国科学院院士周维善教授在青蒿素的全合成方面做出了开创性的工作.他领导的合作小组于1983年完成了青蒿素的首次全面合成.该研究组所采用的合成路线如下:(Bn=苄基;LDA =[(CH 3)2CH ]2NLi (二异丙基氨基锂);p TsOH =对甲苯磺酸)62考题点评形成天才的决定因素应该是勤奋.(1)青蒿素分子中共有几个手性碳原子?写出内酯环上的C 2,C 3,C 4和C 5的构型(用R /S 表示).(2)用系统命名法起始原料香茅醛和中间体A (用R /S 表示其构型).(3)画出中间体B 、F 和G 的立体异构式(用楔形线表示).(4)中间体C 在高位阻强碱LDA 存在下与3 三甲基硅基 3 丁烯 2 酮进行M ichael 加成反应,除得到中间体D 外,还产生1种副产物,它是D 的1种同分异构体.画出该产物的立体结构式(用楔形线表示).(5)写出由中间体D 到中间体E 转化的机制(用反应式表示).第1步是烯烃作为亲核试剂的亲核加成反应,由于烃基的推电子诱导效应,碳碳双键发生极化,电子云偏向三号碳,使其带负电荷具有亲核性,进攻羰基碳,碳氧双键打开生成氧负离子,碳碳双键间的1对电子转移到三号碳和羰基碳间,甲基中碳氢键转移到一号和二号碳之间,解离成氢离子,氢离子与氧负离子结合成羟基,即得化合物A.第2步是烃基的反马氏加成:氢原子加到含氢量少的碳原子上;第3步:氢化钠是很强的碱,夺取羟基中的氢生成氧负离子,氧负离子作为亲核试剂与苄基氯发生亲核反应,同时Jones 试剂会将羟基氧化为羰基生成C;从C 到D 是典型的亲核加成反应;从D 到E,在氢氧化钡的作用下,D 脱去了1个 #H 形成碳负离子,碳负离子进攻羰基,碳氧键断裂成氧负离子,水解成羟基,在乙二酸的作用下,发生消除反应,脱去1个水分子生成E;E 在NaBH 4的还原下,得F;F 在Jones 试剂的氧化下,羟基变为羰基,生成G;G 在CH 3M gBr 的作用下发生亲核加成反应,即带部分负电荷的甲基进攻极化的带负电荷的羰基碳,碳氧键断裂,成键电子完全偏向氧,生成氧负离子,氧负离子水解为羟基.得到的产物在p TsOH 的作用脱去与羰基相邻的碳原子上的氢和羟基,形成稳定的共轭结构,即H;对于手性碳的概念,是指一个碳原子连接不同的4个基团.青蒿素中有7个这样的碳原子,手性碳原子的构型可用R 、S 标定.答案 (1)7个手性碳;2R,3S,4R,5S(2)香茅醛:(R) 3,7二甲基 6 辛烯醛中间体A:(1R,2S,5R ) 5 甲基 2 (1 甲基乙烯基)环己醇或(1R,2S,5R) 5 甲基 2 (2 丙烯基)环己醇(3)(4)(5)这两道试题虽然知识点考查角度不尽相同,但它们都是以合成新物质为知识背景,以科技新成果为载体体现有机化学合成思维;而且仍然着眼于基础知识,例如亲核反应和亲电反应都是有机化学竞赛要求中的基础反应机制.(作者单位:南京晓庄学院生物化工与环境工程学院)63。
全国高中化学竞赛决赛(冬令营)理论试题及解答

2000年全国高中学生化学竞赛(决赛)理论试题2000.1.11.杭州● 竞赛时间4小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定地方(方框内),不得用铅笔填写,写在其他地方的应答一律无效。
使用指定的草稿纸。
不得持有任何其他纸张。
● 把营号写在所有试卷(包括草稿纸)右上角处,不写姓名和所属学校,否则按废卷论。
● 允许使用非编程计算器、直尺、橡皮等文具,但不得带文具盒进入考场。
1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLi Be B C N O FNa Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co NiCu Zn G a G e As Se BrRb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn Ïà ¶Ô Ô- ×Ó ÖÊ Á¿第1题A 的单质和B 的单质在常温下激烈反应,得到化合物X 。
10年全国高中学生化学竞赛(初赛)试题与试题分析.(10份)

全国高中学生化学竞赛(初赛)试题汇编试题与试题分析●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
1997年全国高中学生化学竞赛(初赛) 试题分析第一题(10分)次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物A。
经鉴定:反应后的溶液是磷酸和硫酸的混合物;X射线衍射证实A是一种六方晶体,结构类同于纤维锌矿(ZnS), 组成稳定;A的主要化学性质如下:1。
温度超过60℃,分解成金属铜和一种气体;2。
在氯气中着火;3。
与盐酸应放出气体。
回答如下问题:(1)写出A的化学式。
(2)写出A的生成反应方程式。
(3)写出A与氯气反应的化学方程式。
(4)写出A与盐酸反应的化学方程式。
[解题思路]整个试题围绕着A是什么物质。
可以把有关的信息用如下的图形来综合:4(+H2A+H2SO4+H3PO4是红棕色难溶物MX型的组成,即1:1型化合物Cu和一种气体,可见A中有Cu与盐酸反应放出气体,这种气体不可能是A中的Cu一定是A中的另一组成产生的,可假设X+HCl产生的气体,可假设M=Cu首先可以把A写成MX。
其中的M是铜是无疑的,因A经加热分解可以得到铜(M=Cu)。
X是什么?这是本题的难点。
先根据MX具有ZnS的结构,是M:X=1:1的组成,A只可能是CuS,CuP,CuO和CuH等等,显然,只有CuH才是与其他信息对应的,若是CuS或CuO,生成反应中就找不到被强还原剂(NaH2PO2)还原的元素,若是CuP,与铜和磷的化合价矛盾(按化合价,应是Cu3P或者Cu3P2,均不是ZnS的组成),所以A是CuH。
高中化学 竞赛决赛(冬令营)理论试题

促敦市安顿阳光实验学校高中学生化学竞赛决赛(冬令营)理论试题H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95压力pφ=1bar(巴)=100000Pa(帕斯卡) R=8.314 J·K-1·mol-1第1题(8分)1990年代初发现了碳纳米管,它们是管径仅几纳米的微管,其结构相当于石墨结构层卷曲连接而成。
近年,人们合成了化合物E的纳米管,其结构与碳纳米管十分相似。
气体A与气体B相遇立即生成一种白色的晶体C。
已知在同温同压下,气体A的密度约为气体B的密度的4倍;气体B易溶于水,向其浓水溶液通入CO2可生成白色晶体D;晶体D的热稳性不高,在室温下缓慢分解,放出CO2、水蒸气和B;晶体C在高温下分解生成具有润滑性的白色晶体E1;E1在高温高压下可转变为一种硬度很高的晶体E2。
E1和E2是化合物E的两种不同结晶形态,分别与碳的两种常见同素异形体的晶体结构相似,都是型固体材料;E可与单质氟反,主要产物之一是A。
(1)写出A、B、C、D、E的化学式。
(2)写出A与B反的化学反方程式,按酸碱理论的观点,这是一种什么类型的反?A、B、C各属于哪一类物质?(3)分别说明E1和E2的晶体结构特征、化学键特征和它们的可能用途。
(4)化合物A与C6H5NH2在苯中回流,可生成它们的1︰1加合物;将这种加合物加热到280℃,生成一种环状化合物(其中每摩尔加合物失去2摩尔HF);这种环状化合物是一种非极性物质。
写出它的分子式和结构式。
第2题(8分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)之间的能量差ΔE(=E c-E v)称为带隙,图中的e-为电子、h+为空穴。
2010年全国高中学生化学竞赛试题及参考答案

中国化学会第24届全国高中学生化学竞赛(省级赛区)试卷气体常数R=8.31447 J K-1 mol-1 法拉第常数F=96485 C mol-1 阿佛加德罗常数N A=6.022142×1023 mol-1第1题 (15分)1-12009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk轰击48Ca靶合成的,总共得到6个117号元素的原子,其中1个原子经p次α衰变得到270Db后发生裂变;5个原子则经q次α衰变得到281Rg后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。
1-2 写出下列结构的中心原子的杂化轨道类型:[(C6H5)IF5]-(C6H5)2Xe[I(C6H5)2]+1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用第2题 (5 分)最近我国有人报道,将0.1 mol L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2-)分别为0.345V和 -0.476 V,nFEӨ=RT ln K,EӨ表示反应的标准电动势,n为该反应得失电子数。
计算25o C下硫离子和铜离子反应得到铜的反应平衡第3题 (7 分) 早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。
它是迄今已知的除金刚石和氮化硼外最硬的固体。
1930年确定了它的理想化学式。
左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。
第4题 (8分)O—O键长112 pm 121 pm 128 pm 149 pm化学式2[Co2O2(NH3)10]4+,其O—O的键长为147 pm;B的化学式为Co(bzacen)PyO2,其O—O的键长为126 pm,Py是吡啶(C5H5N),bzacen是四齿配体[C6H5−C(O-)=CH−C(CH3)=NCH2−]2。
冬令营理论试题二

2010年全国高中学生化学竞赛(决赛)理论模拟试题第一题:(16分)将准确称量的等质量物质A和B置于充满氩气的容器中,很好的混合。
将容器密闭(p=760mm Hg,t=18℃)并加热。
反应停止后,容器内的压力等于2000mm Hg(t=27℃),而反应的唯一固体产物是一种单质X。
在空气中加热A的氧化物导致如下的质量损失(相对于起始质量):A.试确定图式中提到的所有物质。
B.试写出所有反应的方程式。
C.如果容器的体积等于1.000L ,确定物质A的称样质量。
D.简要地写出X的化学性质。
E.如可能的话,命名以B为基本成分的天然矿物。
第二题、(12分) 推测结构1. 一个化合物,分子式C5H8O2, 红外光吸收特征峰如下:3100 cm-1(弱), 2960 cm-1(弱), 1740 cm-1(强), 1650 cm-1(弱), 1230 cm-1(强)。
1H NMR谱化学位移:δ2.06 (3H, 单峰), 4.57 (2H, 双峰), 5-6.5 (3H, 多峰)。
写出该化合物的结构。
2. 化合物A (C7H15N),当用MeI处理时得到水溶性的盐B(C8H18NI)。
B与AgOH悬浮液加热得到C(C8H17N)。
C再经MeI处理,然后与AgOH悬浮液加热产生(CH3)3N和D (C6H10)。
D吸收两分子氢得到E(C6H14)。
E的NMR谱表明有一个多重峰和一个双峰,其相对强度为1:6。
推测A-E的结构(不必写推导过程)。
第三题、(16分)血红蛋白分子的Fe-heme的π电子可以看作是在二维正方形势箱中运动的自由电子体系,势箱的长度为L。
1.试画出最低的十七个轨道的相对顺序的能级图;2.确定含有26个π电子基态分子的最高占有分子轨道;3.该分子是顺磁性还是反磁性的?4.若该二维势箱的长度为1nm,试问能够使体系激发的最长波长是多少?第四题、(16分) 回答下列问题1. (CH3)2SO是两可配体,分别说明该配体与Fe(Ⅲ)和Hg(Ⅱ)的配位方式,并说明如何从实验来证明你的结论。
第20届全国高中化学竞赛决赛(冬令营)理论试题与答案

中国化学会第 20 届全国高中学生化学竞赛(决赛)理论试题参考答案及评分细则第 1 题(14 分)1-1 当g G m< 0时,反应可正向进行,由此解得T1>1186K, T2>1500 K,T3>1761K,故只有反应①在 1500K 以下可自动正向进行。
(计算2分,结果1分,共3分)Ti O2+ 2Cl2= Ti Cl4+2CO(1 分)1-2(方程式未配平不得分 )1-3 VOCl 3与 TiCl 4沸点相近(1分)Cu+ VOCl 3= VOCl 2+CuCl(1 分)1-4 TiCl 4 +2Mg=Ti+2MgCl 2(1分)1-5(1)Mg C O=Mg O + C O(1分)32Mg O + Cl+ C=Mg Cl+ C O(1分)22(2)阴极反应:Mg 2+-= Mg( 0.5 分)+2e阳极反应:--( 0.5 分)2Cl = Cl 2+2e电解反应: MgCl 2= Mg +Cl 2(1 分)1( 0.5分)(3)r H m = ∑v B f H m = 596.32 kJ molr S m =∑v B S m = 77.30+268.20-231.02=114.48(J·K-1·mol-1)( 0.5分)r G m = r H m —T r S m =596.32—1023×114.48×10-3=479.21(kJ·mol-1)(1 分)E = –r G m/ZF=–479210/(2×96500)= -2.48(V)E理 =2.48V(1分)第2 题2-12-2 ( 1) ZnS + 2H 2SO4=ZnSO 4+SO2+S+2H 2OCuS + 2H 2 SO4=CuSO4+SO2+S+2H 2O 加水的目的是浸取反应生成的可溶性硫酸盐。
(2) As2S3 +3Na 2S=2Na3AsS3SnS2 +Na 2S=NaSnS3加入氢氧化钠的目的是防止硫化钠水解2-3(1)S2O42-+Fe2O3+2H+=2SO32-+2Fe2++H2O (2) Na4[FeA 2]第 3 题(10 分)3-1[(3++ H O[(] )2++F e H) ]2= F e O H H O 2O6 2O5+ H 33-2(3 分)(1 分)(1 分)(0.5 分)(1 分)(1 分)(2 分)(1 分)H4 + O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)H O2[F e O H(H]) 2 +=(H2O)4 F e F e( H 2 O )4+ 2 H O(12分)2O5OHH 2 O H H 2 O H 2OH H 2 OH 2 O O.....OF e F e F e F eH 2 O O.....OH 2 O H 2OH 2 OH 2 O H H3-3Al 2O3+6HCl+9H 2O=2[Al(H 2O)6]Cl 3 [Al(H2O)6]Cl 3= [Al(OH) 2(H2O)4]Cl+2HCl[Al(OH) 2(H2 O)4]Cl+NH 3 H·2O=Al(OH) 3+NH 4Cl+4H 2O (nm-4m)Al(OH) 3+(6m-nm)[Al(OH) 2(H 2O)4]Cl=[Al 2(OH) n Cl 6-n] m+(24m-4nm)H2O 3-4第 4 题(22 分)4-1n NaBH 4 +4n CH 3CH2OH =[NaB(OC 2H5 )4] n +4n H 2↑(分子式错误,方程式未配平不得分;未写n 不扣分)4-2 A 属于混合晶体4-3[NaB(OC 2H 5)4]n 的一维结构示意图及一维点阵如下:m +O H 2O H 2(2分)(1 分)(1 分)(1 分)(1 分)(2分)4-4 Na 的配位数为4, B 原子采取SP3杂化(2分)。
第20届全国高中化学竞赛决赛(冬令营)理论试题及答案.pdf

变色为终点,消耗 HCI 标准溶液 22.78mL。
步骤二:称取纯的有机弱酸(H2B)样品 0.1963g。将样品定量溶解在 50.00mL 纯水中,选择
甲基橙为指示剂进行滴定。当加入新标定的 0.0950mol/L 氢氧化钠标准溶液 9.21mL 时,发
现该法不当,遂停止滴定,用酸度计测定了停止滴定时溶液的 pH=2.87。已知 H2B 的 pKal=2.86,
构式。
(3 分)
第 3 题(10 分)
无机高分子絮凝刑具有效能高、价格低廉的优点,广泛用于给水排水、工业废水及城市污水
处理。
3-1 大多数金属离子都能生成多核水解产物。铁盐溶于水后生成水合铁(Ⅲ)离子,当溶液 pH
升高时发生水解,首先生成黄色的水解产物[FeOH(H2O5)]2+,写出水解反应方程式。 (1 分)
(2 分)
1-4 精制后的 TiCl4 用金属镁还原可得海绵钛,写出化学反应方程式。
(1 分)
1-5 菱镁矿(主要成分为 MgCO3)煅烧分解后与焦炭混合在氯化器中加热到 1373 K,通入氯
气生成 MgCl2。在 1023 K 电解熔融 MgCl2 得到金属镁。
(1)写出用菱镁矿煅烧及氯化制取 MgCl2 的化学反应方程式。
(2) 写出 B 中氨基酸的结构式式并命名。
(3) 写出 C 中糖分子的费歇尔投影式,并给出该糖的名称。
O OO
HO
HO
OH
C
OH
(2 分) (2 分) (2 分)
第 8 题(15 分) 8-1 化合物 A(C10H12O3)具有旋光性,能溶于 NaHCO3 水溶液,并可起碘仿反应。将 A 加热
的化合物 B,B 无旋光性,也能溶于 NaHCO3 水溶液。B 经臭氧化,并在 Zn 粉和醋酸存在下 分解得化合物 C 和 D,C 可进行碘仿反应。D 加强热放出 CO2,并得化合物 E(C7H6O),E 可进行银镜反应,试写出 A、B、C、D、E 的结构式。(10 分)
第20届全国高中化学竞赛决赛(冬令营)理论试题及答案

中国化学会第20届全国高中学生化学竞赛(决赛)理论试题2007年1月17日● 本竞赛试题共8题,总分120分,竞赛时间4小时。
迟到超过30分钟者不得进入考场,考试开始后1小时内不得离开考场。
解答完毕,将试卷和答卷及草稿纸折好,背面朝上放于桌面,撤离考场。
● 试卷和答卷已分别装订成册,不得拆散,所有解答必须写在答卷的指定位置,写于其他 位置无效.● 选手营号写在答卷每页左边指定位置,不得写所属地区,学校名称和姓名,否则按废卷 论。
● 使用黑色墨水钢笔或圆珠笔答题,不得使用铅笔(包括作图)。
使用提供的草稿纸.不得携带任何其他纸张进入考场。
● 允许使用非编程计算器及直尺,橡皮、涂改液等文具,不得将文具盒以及手机、小灵通、BP 机等通讯工具带入考场,一经发现将严肃处理。
原予量: H 1.008 B 10.81 C 2.01 N 14.01 O 16.00第1题 (14分)钛及其合金具有密度小、强度高、耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。
我国四川省有大型钒钛磁铁矿。
从由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:钛铁铁海面钛l-1 钛铁矿的主要成分为FeTiO 3。
控制电炉熔炼温度(<1500K),用碳还原出铁,而钛则进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。
已知:FeTiO 3C TiO 2TiC Fe COFeTiO 3FeTiO3+=++++++C C43==Fe CO 3Ti ++Fe 3CO①②③G m r J .mol-1===G m r J .mol -1G mr J .mol -1190900-161T 750000--500T913800519T通过计算判断在电炉熔炼中主要发生以上哪个反应? (3分) 1-2 写出在1073—1273K 下氯化反应的化学方程式。
(1分)1-3 氯化得到的TiCl 4中含有的VOCl 3必须用高效精馏的方法除去,为什么? 实际生产中常在409 K 下用Cu 还原VOCl 3,反应物的摩尔比为1:l ,生成氯化亚铜和难溶于TiCl 4的还原物,写出还原反应方程式。
全国高中生化学竞赛经典套题(6)

2)对比以上方法,哪个更好,为什么?
参考答案(1006)
第 1 题(8 分) 1、4Na2SO3=3Na2SO4+Na2S(3 分)
6] 可由FeSO4与 KCN 直接在溶液中制备,Fe +4K +6CN =K 4Fe(CN) 6 , 2、K4[Fe(CN) (1 分)
3+ 6]却不能由Fe2(SO4)3和 KCN 直接在水溶液中制备,因为Fe 能将CN 氧化而有 但K3[Fe(CN)
第 5 题(10 分)
3晶体。用 X 射线衍射 把等物质的量的NH4Cl和HgCl2在密封管中一起加热时,生成NH4HgCl
法 测 得 该 晶 体 的 晶 胞 为 长 方 体 : a=b=419pm , c=794pm ; 用 比 重 瓶 法 测 得 它 的 密 度 ρ =3.87g/cm 。已知NH 4 (视为球形离子)占据晶胞的顶角,并尽可能远离Hg ;每个NH 4 被 8
B
H
C(各 1.5 分)
A 不稳定,因为其π电子数为 4,不符合 4n+2 规则。 B 不稳定,因为其 C-C-C 键角为 60 度,远小于理论值 109.5 度,环中存在张力。 (各 1 分) C 中两端的两个 C 原子是s p 杂化,中间两个 C 原子是 sp 杂化,成键为:
H C H π C π C π C H H
个Cl 围绕,距离为 335pm(与NH4Cl晶体中离子中间距一样) ;Cl 与Cl 尽可能远离。试根据 3
+
2+
+
以上条件回答下列问题:
3”单元; 1、计算晶胞中含有几个“NH4HgCl
2、画出晶胞的结构示意图;
3、晶体中Cl 的空间环境是否相同?说明理由;
2000年全国高中学生化学竞赛决赛(冬令营)理论试题与实验试题及参考答案

2000.1.11 杭州碘酸钙的制备及含量测定注意事项:●实验时间为5.0小时,请仔细阅读试题内容,合理安排时间,完成全部内容。
每超过5分钟要扣1分,最长不超过20分钟。
●若制备失败可向监考教师索取原料重做,但要扣5分;若产品不够纯度测定所需量,可向监考教师索取分析样品,但要扣16.5分。
●需监考教师签字的,考生务必主动配合,未当场签字者无效。
伪造数据者,以零分计。
●完成全部实验内容后,将产品、实验报告(包括试题)交给监考教师,并清洗所用仪器和整理桌面,经监考教师签字后方可离开考场。
●废弃物应放入指定容器内。
●实验过程请注意安全。
一、实验内容1.产品的合成:碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应生成碘酸钙。
2.产品的分析:用间接碘量法测定。
3.完成实验报告。
二、主要仪器、试剂及材料1.主要仪器圆底烧瓶100mL 1只球形冷凝管(带磨口塞)1支磁力搅拌器1台电接点温度计(导电表)1支电子继电器1台电加热器(300W)1只结晶皿(水浴缸)1只温度计(100℃) 1支漏斗、吸滤瓶、表面皿各1只布氏漏斗和抽滤瓶(带橡皮塞)1只滴定管夹1只烧杯600ml、500ml 1只量筒100ml 1只150ml 2只10ml 2只100ml 1只玻管(直管、弯管)各1支碘量瓶250ml 3只移液管(胖肚)50ml 1支橡皮管25ml 1支碱式滴定管50ml 1支塑料洗瓶、木夹各1只容量瓶250ml 2只滴管2支洗耳球、角匙、镊子各1只玻棒2支铁架台、铁圈、铁夹3付●公用仪器电子天平(最大称量100克,±0.0001克)电炉(800W)电子天平(最大称量100克,±0.01克)循环水式真空泵2.试剂及材料碘化学纯(CP) 1 mol·L-1 氯化钙溶液氯酸钾化学纯(CP)1∶1 高氯酸溶液碘化钾分析纯(AR)碘酸钾标准溶液30%氢氧化钾溶液0.1 mol·L-1硫代硫酸钠标准溶液0.5mol·L-1 氢氧化钠溶液0.5% 淀粉溶液6 mol·L-1盐酸无水乙醇化学纯(CP)1 mol·L-1硫酸pH试纸(1-14)滤纸、称量纸、碎冰3.主要原料和产品的某些性质3.1几种盐的溶解度(克/100克水)碘酸钙无水盐389.88 一水合物407.90 六水合物497.90硫代硫酸钠158.10 碘酸钾170.80 碘253.80 氯酸钾122.55三、操作步骤1.制备碘酸钙在100mL圆底烧瓶中依次加入2.20克碘、2.00克氯酸钾(均由教师定量供给)和45mL 水,放入搅拌磁子,然后把烧瓶置入水浴缸内,用铁夹固定,开动搅拌器,使氯酸钾溶解,滴加6mol·L-1盐酸8滴(pH~1),装上冷凝管,通冷却水,冷凝管顶部塞上带玻璃管塞子,用橡皮管把反应产生的气体导向盛有约100mL氢氧化钠溶液的大烧杯内吸收。
2010中国化学会第24届全国高中学生化学竞赛(省级赛区)

中国化学会第24届全国高中学生化学竞赛(省级赛区)试卷、答案及评分标准(2010年9月15日)题号 1 2 3 4 5 6 7 8 9 10 11 总分 满分 155781181361179100评分通则1.凡要求计算或推导的,必须示出计算或推导过程。
没有计算或推导过程,即使结果正确也不得分。
2.有效数字错误,扣0.5分,但每一大题只扣1次。
3.单位不写或表达错误,扣0.5分,但每一大题只扣1次。
4.只要求1个答案、而给出多个答案,其中有错误的,不得分。
5.方程式(不是反应式!)不配平不得分。
6.用铅笔解答(包括作图)无效。
7.使用涂改液涂改的解答无效。
8.不包括在标准答案的0.5分的题,可由省、市、自治区评分组讨论决定是否给分。
9.答案中红色字为标准答案,而蓝字体(加下划线)为注释语不属于答案。
气体常数R =8.31447 J K -1 mol -1 法拉第常数F =96485 C mol -1 阿佛加德罗常数N A =6.022142×1023 mol -1Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir P tAu Hg Tl Pb Bi Po At Ac-Lr HLi Be BC N O FNa Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu - 6.949.0122.924.339.140.085.487.62 132.137.[223] [226] 44.947.850.952.054.955.858.963.558.665.310.826.969.712.028.072.6114.8 204.118.7 207.112.4 200.107.197.106.195.102.192.101.190.98.9186.95.9183.92.9180.91.2178.88.914.016.019.030.974.92 121.209.32.078.9127.6 [210] [210] [210 ]126.79.935.4 4.0020.139.983.8131.[222] He Ne Ar Kr Xe Rn元素周期表Rf DbSgBh Hs Mt La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
全国高中化学竞赛决赛(冬令营)理论试题及解答

2000年全国高中学生化学竞赛(决赛)理论试题2000.1.11.杭州● 竞赛时间4小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定地方(方框内),不得用铅笔填写,写在其他地方的应答一律无效。
使用指定的草稿纸。
不得持有任何其他纸张。
● 把营号写在所有试卷(包括草稿纸)右上角处,不写姓名和所属学校,否则按废卷论。
● 允许使用非编程计算器、直尺、橡皮等文具,但不得带文具盒进入考场。
1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLi Be B C N O FNa Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co NiCu Zn G a G e As Se BrRb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn Ïà ¶Ô Ô- ×Ó ÖÊ Á¿第1题A 的单质和B 的单质在常温下激烈反应,得到化合物X 。
全国高中学生化学竞赛决赛(冬令营)理论试题及答案

2004年全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号( A 〜H )填人相应标题(① 一⑧)后的括号中(单选),并按要求填空。
表1字母所代表的物质AB C D E F G H +NO 2NON 2O 3N 2H 4 NH 3N 2O 4 H 2N 2O 2 NH 2OH◎()不是平面分子,其衍生物用作高能燃料。
笑()存在两种异构体,其中一种异构体的结构为。
3()具有线型结构,Lewis 结构式中每个键的键级为2.0。
)是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
@()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
炉()是顺磁性分子。
)水溶液会分解生成N 2O ,反应式为。
第二题(6分)图1是元素的厶f G m /F 一 Z 图,它是以元素的不同氧化态Z 与对应物BrO/ CIO/已0图 I ijG.nVF-Z上图中各物种的厶 f G m"'/F 的数值如表 2所示。
表2各物质的厶f G m /F种的△ f G m"/F 在热力学标准态pH =0 或 pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势 2 A 或2 B , A 、 B 分别表示 pH=0 (实线)和pH = 14 (虚线)。
OHr : (-Q.79)HQZr •54HC1OHBrO Hl5 61ZQ 吗.0氐0 r 轴 2.0 k tier—種性介减 --- 醯性介M1 e A " 3 e B " 3e A "422•由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于 还是小于其含氧酸盐的氧化性。
3•溴在自然界中主要存在于海水中,每吨海水约含0.14 kg 溴。
B 「2的沸点为58.78 C;溴在水中的溶解度 3.58 g/100 g H 20 ( 20 C )。
全国高中学生化学竞赛决赛(冬令营)理论试题与实验试题及参考答案

竞赛:碘酸钙的制备及含量测定注意事项:●实验时间为5.0小时,请仔细阅读试题内容,合理安排时间,完成全部内容。
每超过5分钟要扣1分,最长不超过20分钟。
●若制备失败可向监考教师索取原料重做,但要扣5分;若产品不够纯度测定所需量,可向监考教师索取分析样品,但要扣16.5分。
●需监考教师签字的,考生务必主动配合,未当场签字者无效。
伪造数据者,以零分计。
●完成全部实验内容后,将产品、实验报告(包括试题)交给监考教师,并清洗所用仪器和整理桌面,经监考教师签字后方可离开考场。
●废弃物应放入指定容器内。
●实验过程请注意安全。
一、实验内容1.产品的合成:碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应生成碘酸钙。
2.产品的分析:用间接碘量法测定。
3.完成实验报告。
二、主要仪器、试剂及材料1.主要仪器圆底烧瓶100mL 1只球形冷凝管(带磨口塞)1支磁力搅拌器1台电接点温度计(导电表)1支电子继电器1台电加热器(300W)1只结晶皿(水浴缸)1只温度计(100℃) 1支漏斗、吸滤瓶、表面皿各1只布氏漏斗和抽滤瓶(带橡皮塞)1只滴定管夹1只烧杯600ml、500ml 1只量筒100ml 1只150ml 2只10ml 2只100ml 1只玻管(直管、弯管)各1支碘量瓶250ml 3只移液管(胖肚)50ml 1支橡皮管25ml 1支碱式滴定管50ml 1支塑料洗瓶、木夹各1只容量瓶250ml 2只滴管2支洗耳球、角匙、镊子各1只玻棒2支铁架台、铁圈、铁夹3付●公用仪器电子天平(最大称量100克,±0.0001克)电炉(800W)电子天平(最大称量100克,±0.01克)循环水式真空泵2.试剂及材料碘化学纯(CP) 1 mol·L-1 氯化钙溶液氯酸钾化学纯(CP)1∶1 高氯酸溶液碘化钾分析纯(AR)碘酸钾标准溶液30%氢氧化钾溶液0.1 mol·L-1硫代硫酸钠标准溶液0.5mol·L-1 氢氧化钠溶液0.5% 淀粉溶液6 mol·L-1盐酸无水乙醇化学纯(CP)1 mol·L-1硫酸pH试纸(1-14)滤纸、称量纸、碎冰3.主要原料和产品的某些性质3.1几种盐的溶解度(克/100克水)碘酸钙无水盐389.88 一水合物407.90 六水合物497.90硫代硫酸钠158.10 碘酸钾170.80 碘253.80 氯酸钾122.55三、操作步骤1.制备碘酸钙在100mL圆底烧瓶中依次加入2.20克碘、2.00克氯酸钾(均由教师定量供给)和45mL 水,放入搅拌磁子,然后把烧瓶置入水浴缸内,用铁夹固定,开动搅拌器,使氯酸钾溶解,滴加6mol·L-1盐酸8滴(pH~1),装上冷凝管,通冷却水,冷凝管顶部塞上带玻璃管塞子,用橡皮管把反应产生的气体导向盛有约100mL氢氧化钠溶液的大烧杯内吸收。
全国高中生化学竞赛经典套题(4)

全国⾼中⽣化学竞赛经典套题(4)2010年全国化学竞赛初赛模拟试卷(4)(时间:3⼩时满分:100分)第1题(8分)试解释下列现象:⽬的是什么?简述其原理。
.在52中――的键⾓为°。
写出的杂化态并说明――有⼤键⾓的理由。
Z第2题(4分)H2和F2在暗处混合就爆炸,⽽有关资料记载了下⾯两个反应⽅程式:(1)2Li+H 2700~800o 2LiH (2)2Li+F 22LiF对于(1)可以理解,H 2键能⼤,(2)反应式条件是资料有误,还是另有原因?提出你的看第3题(6分)⾦溶胶是⼀种优异的纳⽶组装材料,是纳⽶材料研究中使⽤得最多、研究最⼴泛的对象。
制备⾦溶胶的⽅法有柠檬酸钠法、硼氢化钠法、EDTA 法等。
若⽤柠檬酸(三)钠与NaAuCl 4作⽤得到Au 。
请回答下列问题:1、写出由柠檬酸钠与NaAuCl 4作⽤制⾦溶胶的反应⽅程式;HOOCCH2(OH)(COOH)CH 2COOH3、Enustun 等⼈⽤阴阳离⼦树脂除去⾦溶胶中的阴阳离⼦。
然后将这种⾦溶胶分成三份:⼀份中不加任何物质,2天后⾦溶胶产⽣聚集;第⼆份中加⼊10-3mol/L NaClO4溶液,两周后产⽣聚集;第三份中加⼊10-5mol/L 的柠檬酸钠⼀直未产⽣聚集。
根据实验结果,你认为该第4题(7分)Polyazides 家族化合物是⼀种⾼能密度的材料,Tetraazidomethane 是其中⼀员,美国化学会的Chemical&Engineering News 在2006年报道了通过理论计算得到了Tetraazidomethane 结构。
虽然这种⼆元化合物(只含2种元素)的⾼度不稳定性可能排除了它在真实世界的有⼒发展,但它可以控制分解得到有趣的不同氮化物。
该物质的⼀种制备⽅法可由含锑盐A 与⼀种钠盐B 在⼀定条件下发⽣复分解反应制得:盐A 的阳离⼦为正三⾓形,含氮质量分数约为91.30%;阴离⼦为SbCl 6-。
精选试题-第高中化学竞赛试题届全国高中化学竞赛决赛(冬令营)理论试题及答案
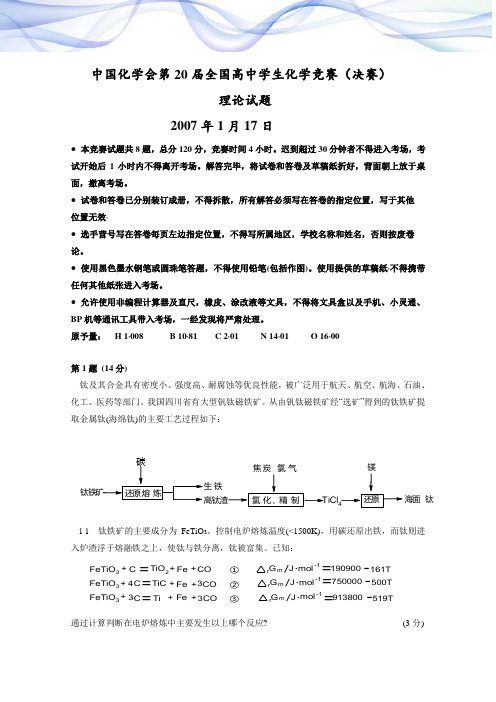
中国化学会第20届全国高中学生化学竞赛(决赛)理论试题2007年1月17日● 本竞赛试题共8题,总分120分,竞赛时间4小时。
迟到超过30分钟者不得进入考场,考试开始后1小时内不得离开考场。
解答完毕,将试卷和答卷及草稿纸折好,背面朝上放于桌面,撤离考场。
● 试卷和答卷已分别装订成册,不得拆散,所有解答必须写在答卷的指定位置,写于其他位置无效*● 选手营号写在答卷每页左边指定位置,不得写所属地区,学校名称和姓名,否则按废卷论。
● 使用黑色墨水钢笔或圆珠笔答题,不得使用铅笔(包括作图)。
使用提供的草稿纸*不得携带任何其他纸张进入考场。
● 允许使用非编程计算器及直尺,橡皮、涂改液等文具,不得将文具盒以及手机、小灵通、BP机等通讯工具带入考场,一经发现将严肃处理。
原予量:H 1*008B 10*81C 2*01 N 14*01 O 16*00第1题(14分)钛及其合金具有密度小、强度高、耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。
我国四川省有大型钒钛磁铁矿。
从由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:钛铁矿还原熔炼生铁高钛渣氯化、精制焦炭氯气还原镁海面钛TiCl4碳l-1 钛铁矿的主要成分为FeTiO3。
控制电炉熔炼温度(<1500K),用碳还原出铁,而钛则进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。
已知:FeTiO3C TiO2TiCFe COFeTiO3 FeTiO3+=++++++CC43==Fe CO3Ti++Fe3CO①②③G mrJ.mol-1===G mrJ.mol-1G mrJ.mol-1190900-161T750000--500T913800519T通过计算判断在电炉熔炼中主要发生以上哪个反应? (3分)1-2 写出在1073—1273K 下氯化反应的化学方程式。
(1分) 1-3 氯化得到的TiCl 4中含有的VOCl 3必须用高效精馏的方法除去,为什么? 实际生产中常在409 K 下用Cu 还原VOCl 3,反应物的摩尔比为1:l ,生成氯化亚铜和难溶于TiCl 4的还原物,写出还原反应方程式。
