第一章 化学电源基础-2
化学电源课件

循环寿命
循环寿命:化学电源在多次充放电过程中能够保持性能和容量的时间长度。 循环寿命取决于电池的材料、结构和制造工艺,以及使用条件和环境因素。
长循环寿命的电池能够延长使用寿命,减少更换次数和维护成本。
内阻
01
02
03
内阻:化学电源内部所具有的 电阻,包括欧姆电阻和极化电 阻。
内阻的大小直接影响电池的充 放电性能和效率,内阻越大, 充放电效率越低。
目前,燃料电池广泛应用于汽车、航 天、船舶和发电站等领域。
燃料电池由燃料(如氢气、甲醇等) 、氧化剂(如氧气、空气等)和电极 (正负极)组成。
燃料电池的优点包括高效率、低污染 和低噪音等。
太阳能电池
太阳能电池是一种利用太阳能光子的 能量转换成电能的装置。
目前,太阳能电池广泛应用于光伏发 电站、太阳能热水器和太阳能灯等领 域。
降低内阻有助于提高电池的充 放电性能和效率,减少能量损 失。
自放电率
01
自放电率:化学电源在 不使用情况下,其存储 的能量自行损失的速度
。
02
自放电率取决于电池的 材料、结构和制造工艺 ,以及环境温度和湿度
等因素。
03
自放电率越低,电池的 长期存储性能越好,能 够保持更长时间的可用
容量。
04
化学电源的发展趋势
电动汽车的普及
随着环保意识的提高和技术的进步,电动汽车的市场份额将持续增长。化学电源作为电 动汽车的核心技术,将发挥关键作用,为电动汽车的长距离行驶和快速充电提供支持。
电池技术的改进
未来,电动汽车的续航里程和充电速度将通过改进电池技术得到提升。新型化学电源的 开发将满足更严格的性能要求,如更高的能量密度、更快的充电速度和更长的使用寿命
化学电源课件

化学电源课件化学电源课件化学电源是一种能够将化学能转化为电能的装置,广泛应用于现代社会的各个领域。
它不仅为我们的生活提供了便利,还在工业生产、科学研究等方面发挥着重要的作用。
本文将从化学电源的原理、种类以及应用等方面进行探讨。
一、化学电源的原理化学电源的原理是基于化学反应中的电化学过程。
在化学反应中,原子或分子之间的电子转移会产生电荷,从而形成电流。
化学电源利用这种电化学反应的原理,将化学能转化为电能。
化学电源通常由两个半电池组成,即负极和正极。
负极是一个氧化剂,它能够吸收电子,而正极则是一个还原剂,它能够释放电子。
当两个半电池通过导电材料相连时,电子从负极流向正极,形成电流。
同时,离子也会在电解质中传递,维持电荷平衡,完成电化学反应。
二、化学电源的种类1. 干电池干电池是最常见的一种化学电源,它由一个锌负极、一个碳正极和一个电解质组成。
锌负极与电解质之间的反应产生电子,而电解质与碳正极之间的反应则促使电子流动。
干电池具有体积小、重量轻、使用方便等优点,广泛应用于日常生活中的电子设备。
2. 燃料电池燃料电池是一种利用氢气或氢气源与氧气反应产生电能的化学电源。
燃料电池具有高效能、无污染、噪音低等优点,被广泛应用于交通工具、航天器等领域。
其中,最为常见的燃料电池是质子交换膜燃料电池,它利用质子交换膜将氢气和氧气分隔开,通过电化学反应产生电流。
3. 锂电池锂电池是一种利用锂离子在正负极之间来回迁移产生电能的化学电源。
锂电池具有高能量密度、长寿命等优点,被广泛应用于移动通信设备、电动车辆等领域。
目前,锂离子电池是最为常见的一种锂电池,它具有较高的电压和较低的自放电率。
三、化学电源的应用化学电源在现代社会的各个领域都有广泛的应用。
在日常生活中,我们使用的手机、笔记本电脑、手表等电子设备都离不开化学电源。
干电池和锂电池是最常见的电子设备电源,它们为我们提供了方便的移动能源。
在工业生产中,化学电源也发挥着重要的作用。
1 化学电源课件基础

电
化 学 电 源 由 五 电 个 部 分 组
电极 电
极 电
极 电 极 极 电
成
IEC原电池命名体系示例 原电池命名体系示例
命名 CR2025 单体电池数 1 体系代码 C 形状 R 直径/mm 直径 20 高/mm 2.5 举例 一只直径20mm, , 一只直径 高度2.5mm,电 高度 , 化学体系代码为 C(锂/二氧化锰) 二氧化锰) ( 二氧化锰 的单体电池
1)第一类电极 1)第一类电极
第一类金属电极: 第一类金属电极: 由金属浸在含 有该金属离子的溶液中构成, 有该金属离子的溶液中构成,如 /Zn、 /Cu等 Zn2+/Zn、Cu2+/Cu等 第一类非金属电极: 若是非金属, 第一类非金属电极: 若是非金属, 则由非金属浸入该非金属负离子的 /Se: 溶液中构成, 溶液中构成,如Se2-/Se:
化学电源的标准
电池的标准化始于1912年 电池的标准化始于1912年。 目前国际电工委员会(IEC)专门负责电力、电子和相关技术领 目前国际电工委员会(IEC)专门负责电力、 域标准化工作的组织。 域标准化工作的组织。 国际标准化组织(ISO)则专门负责电子领域以外的国际标准。 国际标准化组织(ISO)则专门负责电子领域以外的国际标准。
铅酸蓄电池为例来说明化学电源的工作原理 以铅酸蓄电池为例来说明化学电源的工作原理
电池放电时,负极和正极上分别发生氧化反应和还原反应。 电池放电时,负极和正极上分别发生氧化反应和还原反应。 负极(阳极): ):Pb+ 负极(阳极): +HSO4- → PbSO4+H++2e正极(阴极): ):PbO2+3H++HSO4-+2e- → PbSO4+2H2O 正极(阴极): 电池充电时,负极和正极上分别发生还原反应和氧化反应。 电池充电时,负极和正极上分别发生还原反应和氧化反应。 负极(阴极): ):PbSO4+H++2e- → Pb+HSO4负极(阴极): + 正极(阳极): ):PbSO4+2H2O → PbO2+3H++HSO4-+2e正极(阳极): 该电池在充放电时总的反应可表示为: 该电池在充放电时总的反应可表示为:
《高二化学化学电源》课件

误差分析
对实验数据进行误差分析,评估 实验结果的可靠性和准确性。
实验结果与讨论
结果呈现
以表格、图表等形式呈现实验结果,使数据可视 化,便于分析和理解。
结果讨论
根据实验结果进行讨论,分析可能影响实验结果 的因素,提出可能的改进措施。
结论总结
总结实验结论,指出实验的局限性和未来改进的 方向,为后续研究和实际应用提供参考。
的电源。
能源存储
家庭和工业领域的能源 存储系统,用于平衡电 网负载和提高能源利用
效率。
军事领域
用于军事设备的电源, 如导弹、雷达等。
CHAPTER 02
化学电源的基本原理
电极与电解液
电极材料
电极是化学电源的关键组成部分,通 常由金属或导电聚合物制成。电极的 主要功能是参与氧化还原反应并传输 电子。
《高二化学化学电源》 ppt课件
CONTENTS 目录
• 化学电源简介 • 化学电源的基本原理 • 常见化学电源 • 化学电源的发展趋势与挑战 • 实验与探究 • 问题与思考
CHAPTER 01
化学电源简介
定义与特点
定义
化学电源是一种将化学能直接转 化为电能的装置,也称为电池。
特点
化学电源具有高能量密度、长寿 命、无污染等优点,广泛应用于 日常生活、工业生产、军事等领 域。
CHAPTER 06
问题与思考
化学电源的效率问题
总结词
化学电源的效率问题主要涉及到电能转换的效率和能量损失。
详细描述
化学电源的效率主要受到电极反应动力学、反应物质的传递、以及热力学过程的影响。电极反应的速率和反应物 质的传递速度决定了电流的密度,而热力学过程则决定了电池的电压。提高化学电源的效率需要从这些方面入手 ,例如优化电极材料、改善反应物质的传递等。
《化学电源》PPT课件

ppt课件
5
化学电源已有200多年的发展历史:
1836年,英国化学家和气象学家丹尼尔(1790-1845) 对“伏特电堆”进行了改良,他使用稀硫酸作电解液, 解决了电池极化问题,制造出第一个不极化、能保持平 稳电流、并可反复充电的锌-铜电池,又称“丹尼尔电 池”。
从1859年普兰特 (Plant‘e)试制成功化成式铅蓄电池以后, 化学电源便进入了萌芽状态。
锌-银电池 Zn| KOH | Ag2O 锂电池
ppt课件
11
(2)蓄电池 (二次电池)
电池工作时,在两极上进行的反应均为可逆 反应。因此可用充电的方法使两极活性物质恢复 到初始状态,从而获得再生放电的能力。这种充 电和放电能够反复多次,循环使用。常见的蓄电 池有:
铅酸蓄电池 Pb|H2SO4|PbO2 镉-镍蓄电池 Cd|KOH|NiOOH
(1)原电池 (一次电池)
电池经过连续放电或间歇放电后,不能用充电 的方法使两极的活性物质恢复到初始状态,即反 应是不可逆的,因此两极上的活性物质只能利用 一次。
原电池的特点是小型、携带方便,但放电电流 不大。一般用于仪器及各种飞子器件。广泛应用 的原电池有:
锌-锰干电池 Zn|NH4Cl,ZnCl2| MnO2, 锌-汞电池 Zn| KOH |HgO
综上所述,化学电源的发展是和社会的进步、 科学技术的发展分不开的,同时化学电源的发展 反过来又推动了科学技术和生产的发展。
ppt课件
9
二、 化学电源的分类
化学电源的分类有不同的方法: 1.按活性物质的保存方式分类
(1)活性物质保持在电极上 (i)非再生型一次电池 (ii)再生型二次电池 (蓄电池)
铁-镍蓄电池 Fe|KOH|NiOOH
高一化学化学电源ppt课件2024新版

06
实验:制作简易原电池与电解池
实验目的和原理
实验目的
通过制作简易原电池和电解池,了解化学电源的基本原理和工作过程,加深对 原电池和电解池的理解和掌握。
实验原理
原电池是将化学能转化为电能的装置,其基本原理是氧化还原反应。电解池是 将电能转化为化学能的装置,其基本原理是电解反应。通过制作简易原电池和 电解池,可以直观地观察和理解这两个过程。
废弃物处理
废弃的化学电源如处理不当,会对土壤和水体造 成污染,其中的重金属和有害物质还可能通过食 物链危害人类健康。
温室气体排放
化学电源在使用和废弃处理过程中会产生温室气 体,如二氧化碳、甲烷等,加剧全球气候变化。
绿色化学电源的发展与应用
锂离子电池
01
具有高能量密度、长循环寿命、无记忆效应等优点,广泛应用
分类
根据电池的性质和使用方式,可 分为原电池、蓄电池、燃料电池 等。
化学电源的发展历程
01
02
03
伏打电堆
1800年,意大利物理学家 伏打制成了世界上第一个 电池——伏打电堆,奠定 了化学电源的基础。
丹尼尔电池
1836年,英国科学家丹尼 尔发明了第一个实用电池 ——丹尼尔电池,开创了 化学电源的应用历史。
单质。
阴极反应
阴极发生还原反应,通常是阳离 子得到电子生成相应的金属或氢
气。
总反应
阳极反应和阴极反应的总和即为 电解池的总反应。
电解池的种类和特点
01
02
03
04
水溶液电解池
电解质为水溶液,电极反应在 水中进行。如电解水制氢气和
氧气。
熔融盐电解池
电解质为熔融盐,电极反应在 熔融盐中进行。如铝的冶炼。
化学电源课件
电池的优缺点
1 优点
便携、使用方便、没有噪音和污染。
2 缺点
有限的寿命、不可充电、对环境有一定的影响。
电池的正确使用和维护方法
避免过度放电
适时更换电池,避免电池过度放电而损坏。
定期清洁接点
保持电池和设备接点的清洁,确保电流传导良 好。
储存在干燥处
避免电池受潮和受热,影响电池寿命和性能。
正确处理废旧电池
铅酸电池
常见于汽车、摩托车和太阳能储能系统。
燃料电池
被用于电动汽车和航空航天等高能耗领域。
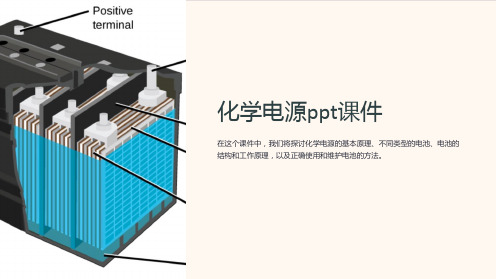
电池的结构和工作原理
1
负极
2
接受电子,通常由金属制成,如锌。
3
电子流动
4
正反应导致电子在电解液和正负极之间 流动,产生电能。
正极
提供电子的供应,通常由金属氧化物制 成。
电解液
导电介质,承载离子在正负极之间的移 动。
根据当地规定进行废电池的回收和处理。
电池的环保问题和解决方案
1
废旧电池回收
加强废旧电池的回收和处理,减少对环境的污染。
2
发展可再充电电池
推广使用可再充电电池,减少一次性电池的消耗。
3
研发环保替代品
不断研发新型化学电源,提高电池的使用寿命和环保性能。
碱性电池
常见于遥控器和闹铃等低功率设备。
铅酸电池
主要用于汽车和UPS电源系统等高功率应用。
锂离子电池
广泛应用于便携式电子设备,如手机和笔记本 电脑。
燃料电池
利用氢气等燃料产生电能,用于电动车和航天 器等领域。
常见的电池类型和用途
碱性电池
用于数码产品、玩具和手持小型设备。
锂离子电池
化学电源 第一章 化学电源基本知识

(1)原电池(一次电池):这种电池中的活性物质消
2018年8月9日星期四 15
耗后,即失去了工作能力,也就是说这种电池只能使用一 次。例如:Zn—MnO2,Mg—AgCl等电池。 (2)蓄电池(二次电池) 该电池中的活性物质消耗后,可进行充电使其恢复, 电池得到再生,使电池能够反复使用。例如铅酸蓄电池, OH—Ni电池,Ag—Zn电池等。 2. 按电解质的性质可将电池分为以下三类:
2018年8月9日星期四 3
二十世纪四、五十年代以后电池发展更加迅速 60 年代:“双子星座”和“阿波罗”飞船应用培根 H2-O2 燃料电池 70 年代:中东战争 能源危机 燃料电池、钠硫电池 、锂-硫化铁电池得到广泛发展 80 年代:贮氢材料的突破 氢镍电池 90 年代:嵌入化合物 锂离子电池
2018年8月9日星期四
2018年8月9日星期四 18
1.电池的电动势及开路电压
电池在开路时,即没有电位通过的情况下,正负极的平 衡电位之差,就是该电池的电动势。它的大小取决于电池的 本性及电解质的性质与活度,而与电池的几何结构等无关。 即: 平 平
E
假设电池的正负极反应为:
正极:aA ne cC 负极:bB ne dD
2018年8月9日星期四 19
则:
G RT a c a d E=E ln a b 平 平 nF nF a a
A B
0 0 ( G ) ( G ) G 正 负 正平 负平 E =- nF nF 0
c
d
由此可以明确地看出,若正极的电位越正,负极的电 位越负,电池的电动势也就越高。 从元素的标准电位序来看,在元素周期表左上边的元素 (IA,IIA族)具有较负的电位,右上边的元素(VIA,VIIA族) 具有较正的电位。由这些元素组成的电池可以得到较高的电 动势。 20 2018年8月9日星期四
2024年化学电源课件

化学电源课件一、引言化学电源作为一种能量转换和储存的装置,在现代社会中发挥着至关重要的作用。
随着科学技术的不断发展,化学电源的种类和应用领域也在不断拓展。
本课件旨在介绍化学电源的基本原理、主要类型、工作原理及其在各个领域的应用,以帮助读者更好地了解化学电源的重要性和发展前景。
二、化学电源的基本原理化学电源是利用化学反应将化学能转化为电能的装置。
在化学电源中,正极和负极之间通过电解质进行离子传递,从而产生电流。
化学电源的基本原理可以概括为两个主要过程:氧化还原反应和离子传递。
氧化还原反应是化学电源中最重要的反应之一。
在电池的正极,发生氧化反应,即正极材料失去电子,形成正离子;而在负极,发生还原反应,即负极材料获得电子,形成负离子。
这两个反应共同驱动电子从负极流向正极,形成电流。
离子传递是化学电源中的另一个重要过程。
在电池的电解质中,正离子和负离子通过电解质的传导作用,从正极向负极移动,以维持电荷平衡。
这种离子的传递过程使得电子能够在电池中形成一个闭合的回路,从而产生持续的电流。
三、化学电源的主要类型1.原电池:原电池是一种将化学能直接转化为电能的电源,如干电池、碱性电池等。
原电池通常是一次性使用的,其内部化学反应是不可逆的。
2.二次电池:二次电池是一种可以反复充放电的电源,如铅酸电池、锂离子电池等。
二次电池的内部化学反应是可逆的,可以通过充电过程将电能转化为化学能,通过放电过程将化学能转化为电能。
3.燃料电池:燃料电池是一种将燃料和氧气通过化学反应转化为电能的电源,如氢燃料电池、甲醇燃料电池等。
燃料电池具有高能量密度和低污染排放的优点,被广泛应用于电动汽车和便携式电源等领域。
4.太阳能电池:太阳能电池是一种将太阳光能转化为电能的电源,如硅太阳能电池、薄膜太阳能电池等。
太阳能电池具有清洁、可再生的特点,被广泛应用于太阳能发电和光伏建筑一体化等领域。
四、化学电源的工作原理化学电源的工作原理主要基于氧化还原反应和离子传递。
第1章 第2节 第2课时 化学电源

第2课时化学电源一、选择题:每小题只有一个选项符合题意。
1.电子表和电子计算器的电源通常用微型银—锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+H2O+Zn===Zn(OH)2+2Ag。
下列说法正确的是() A.Ag2O是正极,Zn是负极B.Zn是正极,Ag2O是负极C.工作时,电池负极区溶液pH增大D.工作时,电子由Ag2O极经外电路流向Zn极答案A解析根据总反应式可知,金属锌失去电子发生氧化反应,做该电池的负极,氧化银得到电子发生还原反应,做该电池的正极,A项正确、B项错误;负极区锌离子与氢氧根离子结合,溶液中氢氧根离子浓度减小,则其pH减小,C项错误;该电池工作时,电子由锌极经外电路流向氧化银极,D项错误。
【考点】一次电池和二次电池【题点】一次电池2.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O===ZnO+2MnOOH。
下列说法中错误的是()A.电池工作时,锌失去电子B.电池正极的电极反应式为:2MnO2+2H2O+2e-===2MnOOH+2OH-C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.2 mol电子,锌的质量减少6.5 g答案C解析由电池总反应式可知,锌为负极,电子从负极流出经外电路流向正极;外电路中每通过0.2 mol电子,参加反应的锌理论上为0.1 mol,即质量减少6.5 g。
【考点】一次电池和二次电池【题点】一次电池(锌锰干电池)3.Mg—AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg===Mg2++2Ag+2Cl-,有关该电池的说法正确的是()A.Mg为电池的正极B.负极反应为AgCl+e-===Ag+Cl-C.不能被KCl溶液激活D.可用于海上应急照明供电答案D解析由电池反应方程式看出,Mg是还原剂,AgCl是氧化剂,故金属Mg做负极,故A项错误;金属Mg做负极,其电极反应式为:Mg-2e-===Mg2+,故B项错误;因为该电池能被海水激活,故KCl溶液也可以激活该电池,故C项错误;电池是一种能被海水激活的一次性贮备电池,电池工作时将化学能转化为电能,电能的产生可用于海上应急照明供电,故D 项正确。
化学电源基础

生活中的电池
锌锰电池(Zn-MnO2) 镉镍电池(Cd-NiOOH) 铅酸电池(Pb-acid) 金属氢化物-镍电池(MH-NiOOH) 氢镍电池(H2-NiOOH) 锌镍电池(Zn-NiOOH) 锌-氧化银电池 锂电池 锂离子电池 金属-空气电池 燃料电池 Fuel Cell
3
其他电池
• Zn(Cd)-HgO电池: • 聚合物电池 • 钠硫电池:1.78~2.08V。比能量高,~ 300℃,电力调峰 • 热电池:储存寿命长、激活时间短, 400~600oC • 锌溴电池 • 液流电池:大规模储能 • 其他新型电池
( E S )P T nF
mV/ ℃
E QR T S nFT ( ) P T • 温度系数:铅酸电池+0.3 mV/ ℃ ,镉镍电池-0.5 mV/ ℃
40
5.2 电池的开路电压 open circuit voltage
• 电池的开路电压是两极间所联接的外线路处于开路 时,两极间的电极电势之差 • 如果电池的正、负极都处于热力学平衡状态,那么 开路电压就应等于电动势 • 开路电压总小于电动势, 锌-空气电池的电动势1.646V, 实际的开路电压为1.4~ 1.5 V • 开路电压与电动势区别: 平衡电极电势①与外界没 有电子交换;②电极上氧化还应和还原反应是可逆 的,反应速率相等
电解质的作用:
正负极间传递电荷,溶液导电; 正极:2NiOOH+2H2O+2e-→Ni(OH)2+2OH负极:Cd+2OH-→Cd(OH)2+2e-
离子导电,可 减少用量
参加电极反应。 •正极:PbO2+3H++HSO4-+2e-→PbSO4+2H2O 负极:Pb+HSO4-→PbSO4+H++2e-
1-2-2化学电源 by wyf

+3 1.某种锂电池的总反应为Li + MnO2 =LiMnO2,下列说法 正确的是( B ) A. Li是正极,电极反应为 Li -e- = Li+ B. Li是负极,电极反应为 Li - e- = Li+ C. Li是负极,电极反应为 MnO2 + e- = MnO2– D. Li是负极,电极反应为 Li -2e-= Li2+
【练习】燃料电池是燃料(例如CO、H2、CH4等)跟氧气或空气反 应,将此反应的化学能转化为电能的装置,电解质通常是KOH溶 液。则下列关于甲烷燃料电池的说法正确的是( A )。 A.负极反应式为:CH4+10OH--8e-= CO32-+7H2O B.负极反应式为:O2+2H2O+4e-===4OH- C.随着反应进行,电解质溶液碱性不变 碱性减弱 D.该电池的总反应与甲烷燃烧的反应方程式相同,反应式为 CH4+2O2===CO2+2H2O
4.随着生活水平的不断提高,废电池必须集中处理的问 题被提到议事日程上来,首要原因是(D ) A.利用电池外壳的金属材料 B.回收其中的石墨电极 C.不使电池中渗出的电解液腐蚀其他物品 D.防止电池中的汞、镉、铅等重金属离子污染水或土壤
5.(双选)下图为氢氧燃料电池工作原理示意图,按此图 提示,下列叙述不正确的是( AD ) A.b电极的电极反应为:4OH–-4e-===2H2O+O2↑ B.a电极是负极 C.氢氧燃料电池是一种具有应用前景的绿色电源 D.氢氧燃料电池是一种只能将氧化剂和燃料全部储藏在电 池内的发电装置
课前篇素养初探
(2)碱性锌锰电池。
①组成——正极: MnO2 。负极: Zn 。电解质: KOH 。
②工作原理:负极反应为 Zn+2OH--2e- ZnO+H2O
化学电源 课件

干电池
碱性电池
蓄电池
锂离子电池
燃料电池
一、一次电池
1、普通锌锰干电池
活性物质为NH4Cl和淀粉糊作电 解质,还填有MnO2 和炭黑。
锌筒 石墨棒
NH4Cl、ZnCl2 和 H2O等糊状物
MnO2和C
负 极:Zn - 2e-= Zn2+ 正 极:2NH4+ + 2e-+2MnO2= Mn2O3+ 2NH3↑+ H2O 总反应:Zn + 2NH4+ + 2MnO2=Zn2++ Mn2O3+ 2NH3↑+ H2O
2、甲烷燃料电池 (电解质溶液:KOH) CH4 +2O2+2OH- == CO32- + 2H2O
正极:2O2 + 4H2O + 8e- == 8OH负极:CH4+10 OH-–8e- == CO32-+7H2O
3、甲醇燃料电池(电解质溶液:KOH) 2CH3OH+4OH-+3O2===2CO32-+6H2O
②充电过程: 2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4
阴极: PbSO4 (s) +2e- =Pb(s) + SO42- 还原反应 阳极: 2PbSO4 (s)+2H2O -2e- = PbO2(s) + H++ SO42- 氧化反应
铅蓄电池的充放电过程:
放电
Pb(s)+PbO2(s)+2H2SO4
充电
2PbSO4(s)+2H2O(l)
2、镉镍电池
化学电源1章2015b

4.离子在进行电极反应的过程在,电子必须通过外电路
化学电源的电极电势
放电 充电
化学能→电能 化学能←电能
无负载 ABCD 放电 当正负极与负载接通时,出现 1 外线路有电子通过,电流 方向由正极流向负极。 2 正极上进行还原反应,产 生阴极极化,电势↘ 3 负极上进行氧化反应,产 生阳极极化,电势↗ 4电解质中的电流方向负极流 向正极 A′B′C′D′
– 工作电压
电池工作时两端的电压
– 放电制度 人为规定的放电条件称为放电制度 (放电电流、放电温度、放电的终止电压、 放电方式) – 放电曲线 用绘图的方式表示出电压随时间的变化曲线
【工作电压】 又称负载电压,放电电压,端电压,是指电流流过外电路时,电 池两极间的电压。 由于必须克服电极极化和欧姆内阻,工作电压总是低于开路电压, 必定低于电动势。
【初始工作电压和终止工作电压】 放电开始的瞬间(几秒)测得的电压 电压下降到不宜再继续放电的最低工作电压
【电池的放电曲线】
• 电池的内阻:
– 电流通过电池内部时受到的阻力,也叫全内阻。
– 包括两部分: 电池的欧姆内阻 电极的极化所相当的内阻,也叫极化内阻
欧姆内阻和电化学反应中电极极化引起的内 阻。
0
a b RT a aB 0 0 E ( ) ln A f nF a e a E F
-MnO2
G 0 278.4KJ / mol
G 0 278.4 E 1.44V nF 2 * 96.5
(2)如果反应的最终产物不是ZnO和Mn2O3,而是ZnMn2O4
正极反应 负极反应 总反应
第一章 化学电源的基本概念
•
– – – –
主要内容:
化学电源的组成和工作原理 化学电源的分类 化学电源的主要性能 电极的组成、结构和成型方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
1.4.1 电压
(2)额定电压
也称标称电压,指某电池开路电压的最低值(保证值),或者说是在规 定条件下电池工作的标准电压。
(3)工作电压 指电池接通负荷后在放电过程中显示的电压,又称负荷(载)电压或放 电电压。在电池放电初始的电压称为初始电压。 由于电流通过电池回路时使电极产生电极极化和欧姆极化,这时的工作 电压总是低于电动势。即:
另查表可知:
(PbO
2 /PbSO4 )
1.685V
20
- (PbSO4 /Pb)
0.355V
1.4.4 电池的能量和比能量
因此:
E 2.04V
+ -
从而,642.6克 反应பைடு நூலகம்在理论上所能产生的电能为:
W理 = 53.6×2.04 = Q理· E =109.3 Wh
6
A 电池的电压随时间变化的曲线
正极极化曲线 负极极化曲线
1.4.2 电池的内阻
电池的内阻:电流通过电池内部时受到的阻力称为电池内阻,包括欧姆 内阻(RW)和极化内阻(Rf)两部分。
R内 =R W +R f
(1)欧姆内阻:主要是由电极材料、电解液、隔膜的电阻及各部分零件的 接触电阻组成。欧姆电阻遵守欧姆定律。 (2)极化电阻:指化学电源的正极与负极在电化学反应进行时由于极化所 引起的内阻。它包括由于电化学极化和浓差极化所引起的电阻之和。极化 内阻与活性物质的本性、电极的结构、电池的制造工艺有关,尤其是与电 池的工作条件密切相关,放电电流和温度对其影响很大。 (3)比内阻:单位容量电池的内阻
V放 IR
, 分别为电流通过正,负极时的电极电势,I 为电池的工作电流,R
3
为电池内阻。
1.4.1 电压
影响工作电压的因素: (1)放电时间 一般放电时间长,电压低 (2)放电流密度 (3)放电深度 一般放电流密度大,电压低 一般放电深度低,电压低
若在指定负载和温度下 放电时,把电池的电压随时 间的变化作图,就可以得到 电池的放电曲线。
12
温度对锌-氧化汞电池容量的影响
1.4.3 电池的容量
由右图可知,随电流密度的提高, 电池的容量下降。这是由于当电流 密度上升时,导致电极极化增加, 消耗在欧姆内阻上的能量也增加, 使电池的容量下降,活性物质的利 用率降低。
铅酸电池的容量与放电电流密度的关系
活性物质的利用率取决于电池的结构、制造工艺和放电制度。采用薄型 电极和多孔电极,以及减少电池内阻,均可提高活性物质的利用率,从而提 高电池实际输出的容量,降低电池成本
m
MQ nF
其中,m 为电极上发生反应的物质的质量,g;M 为反应物的摩尔质量, gmol-1;Q 为通过的电量,Ah;n 是在电极反应式中的电子计量系数;F 为 法拉第常熟(约 96500 Cmol-1 或 26.8 Ahmol-1)
8
1.4.3 电池的容量
以上法拉第定律也可写为:
C0 Fn
19
1.4.4 电池的能量和比能量
下面以铅酸电池为例说明理论比能量的计算:
电池的总反应:
Pb PbO2 2H 2 SO4 2PbSO4 2H 2O
参加反应的总物质:
M=207.2(Pb)+239.2(PbO2)+2×98.08(H2SO4) = 642.6 g 该反应能产生两个法拉第的电量,如果 642.6克反应物质都能全部反应, 则就能产生 2×26.8=53.6Ah 的电量。
C C质 = ( Ah Kg 1 ) G C C体 = ( Ah L1 ) V
其中,C 为电池的容量;G 和 V 分别表示电池的质量和体积。
14
1.4.3 电池的容量
电池的实际容量主要与电池的正、负极活性物质的数量及利用率有关, 而活性物质利用率主要受放电制度、电极结构(包括电极高宽比例、厚度 、孔隙率以及导电栅网的形式)和制造工艺等因素影响。 (1)放电制度:电池放电时所规定的各种条件,主要包括放电形式、放电 速率(电流)、终止电压和温度等。
第一章 化学电源基础
& 1.1 化学电源概述 & 1.2 化学电源的组成 & 1.3 化学电源的工作原理 & 1.4 化学电源的性能
1
1.4.1 电压
(1)开路电压
电池的开路电压是指在开路状态下(几乎没有电流通过时),电池两极 之间的电势差 电池开路电 压与电动势 是否一致? 开
V =
13.5/20=67.5%
1.4.3 电池的容量
活性物质利用率的高低与以下因素有关: (1)与其本身的活性物质有关,自身的活性高,利用率就高 (2)与放电机制有关,(即与放电电流密度有关) (3)与电池的结构有关 (4)与放电深度有关
由左图可看出,温度降低,电池的容量 下降,这是由于当温度下降时造成了: 1. 反应物扩散困难; 2. 电解液内阻增大,电极易钝化。
当衡量电池的电压特性时,常用平均工作电压来表示:
V平
V
1
n
i
N
5
Ni 测定电压的次数
1.4.1 电压
分别表示正、负极的过电位,则电池的工作 我们知道,若用 、 电压也可表示为:
V E电动势 IR
对原电池的电压-电流特性与电极极化曲线,欧姆电压降的关系可用 下图表示:
R'内 =
R内 C
7
式中,R 内 为电池电阻,W;C 为电池容量,A· h
1.4.3 电池的容量
电池的容量是指电池放电时所能给出的电量(AH)。电池的容量通常 分为: 1. 理论容量:假设活性物质全部参加电池的成流反应所能提供的电量,可 依据活性物质的质量按照法拉第定律计算求得。 法拉第定律:电流通过电解质溶液时,在电极上发生化学反应的物质的量与 通过的电量成正比;当以相同电流通过一些列含有不同电解质溶液的串联电 解池时,在各电极上发生化学变化的基本单元物质的量相等。
不同的电池类型及不同的放电条件,对电池的容量和寿命的要求也不同 ,因为规定电池放电的终止电压也不同。一般来说,在低温或大电流(高 倍率)放电时,终止电压可规定得低些。 为什么低温大 电流放电时, 终止电压较低?
几种常用电池放电时的终止电压
17
1.4.4 电池的能量和比能量
电池的能量:指电池在一定的放电制度下,电池所能输出的电能,通常 用 W· h 表示。电池的能量分为理论能量和实际能量。 (1)理论能量:假设电池在放电过程中始终处于平衡状态,其放电电压保 持电动势(E)的数值,而且活性物质的利用率为100%,即放电容量为理论 容量,则在此条件下电池所输出的能量,即
电池的开路电压取决于电池正负极材料的本性、电解质和温度条件等, 而与电池的几何结构与尺寸大小无关。 电池的开路电压一般要用高内阻电压表来测量。如果电压表的内阻不大 ,譬如说只有 1000WV-1 ,即表示电压表上若有1V 的读数,就有约 1mA 的电流通过被测量的电池,对于微小型电池来说,足以引起电极的极化, 因此在实验测量中通常可以观察到电压表上的读数在逐渐下降,得不到正 确的结果。
(a)放电形式:
恒流放电:放电过程中保持放电电流为定值 恒阻放电:放电过程中保持负载电阻为定值 连续放电:在规定的放电条件下,连续放电至终止电压 间歇放电:在规定的放电条件下,放电若干时间后,中断一定的时间, 而后再继续放电,如此反复进行多次,直到所规定的终止电压为止
15
1.4.3 电池的容量
(2)放电电流:指电池放电时的电流大小。通常用放电率表示,放电率是 指电池放电时的速率,常用时率和倍率表示。 时率:也称小时率,以放电时间(h)表示的放电速率,即以一定的放 电电流放完额定容量所需的时间,常用 C/n 表示,其中 C 为额定容量, n 放电电流。
m 1 m M K M K Fn
其中,C0 是电池理论容量;K 称为电化当量, gA-1h-1 ,是指通过 1Ah 电量时 电极上析出或溶解物质的量,或是获得 1Ah 电量所需活性物质的质量。其倒数 (单位为 ,Ahg-1 )指每克物质理论上给出的电量,也称为电化当量。 (1)电化当量越小,理论容量越大 (2)分子量越小、电极反应中化合价变化越大的活性物质,电化当量越小
设质量比能量为X,则
642.6:109.3=1000:X X=170.2 W· h· kg-1
21
1.4.4 电池的能量和比能量
一些电池的理论比能量和实际比能量
电池
铅酸 Cd–Ni Fe–Ni
电池反应
Pb PbO2 2 H 2 SO4 2 PbSO4 2 H 2 O
电动势 (V)
2.104
倍率:指电池在规定的时间内放出其额定容量时所输出的电流值。其在 数值上等于额定容量的倍数。例如,2倍率放电,则表示放电电流的数值是 额定容量数值的2倍。
按照国际规定,放电率在 1/5C 以下的称为低倍率;1/5C ~ 1C 称为中倍率; 1C ~ 22C 则称为高倍率。
16
1.4.3 电池的容量
(3)终止电压:电池放电时,电压下降到不宜再继续放电的最低工作电压
理论比 实际比 能量
175.5 214.3 272.4
能量
10~50 15~40 10~25
(Wh/Kg) (Wh/Kg)
Cd 2 NiOOH 2 H 2 O 2 Ni (OH ) 2 Cd (OH ) 2 1.326(E0)
Fe 2 NiOOH 2 H 2 O 2 Ni (OH ) 2 Fe(OH ) 2
10
即理论上得到1Ah的电量,就需要消耗1.22克的锌或消耗1克锌就可得到0.82 Ah 的电量。
1.4.3 电池的容量
2. 实际容量:指在一定的放电条件下电池实际放出的电量,等于放电电流 与放电时间的乘积。
