第一章化学热力学基础参考答案
大学化学课后习题参考答案

第1章 化学热力学参考答案:(一)选择题1.A 2.A 3.C 4.B 5.D 6.C 7.C 8.C 9. A 10. C 11. A 12.C (二)填空题1.40;2.等温、等容、不做非体积功,等温、等压,不做非体积功; 3.>,<,=,> 4.增大、不变 5.不变 6.3.990 kJ·mol -1(三)判断题1. ×2. ×3. ×4. ×5. √6. ×7. ×8. ×9. × 10. × (四)计算题1.解:(g)O N (l)H 2N 4242+O(l)4H (g)3N 22+(l)H N 42摩尔燃烧热为2.解:)mol ·(kJ 28.254166.963.502)84.285(401f B r --=-⨯--⨯+=∆=∆∑HH ν)mol ·(kJ 14.627211r-Θ-=∆=H Q pK1077.3109.9824.37333mr r ⨯=⨯--=∆∆=-S T 转)mol ·(kJ 78.34357.86)15.137(36.3941f B r --=---=∆=∆∑G ν)K ·mol ·(J 9.9865.21056.1975.191216.21311B r ---=--⨯+==∆∑νNO(g )CO(g )+(g)N 21(g)CO 22+)mol ·(kJ 24.37325.90)52.110(5.3931f B r --=----=∆=∆∑H ν此反应的 是较大的负值,且)(,)(-∆-∆S H 型反应,从热力学上看,在 T 转的温度以内反应都可自发进行。
3.解:外压kPa 50e =p ,11p nRT V =,22p nRTV =,2e p p = 系统所做功:定温变化,0=∆U0=+=∆W Q U ,所以Q =1 247.1(J ) 定温过程pV =常数 ∆(pV )=0 所以 0)(=∆+∆=∆pV U H 4.解:查表知CaO(s) + SO 3(g) = CaSO 4(s)求得同理求得 因为 所以根据经验推断可知,反应可以自发进行。
第一章化学热力学习题参考答案
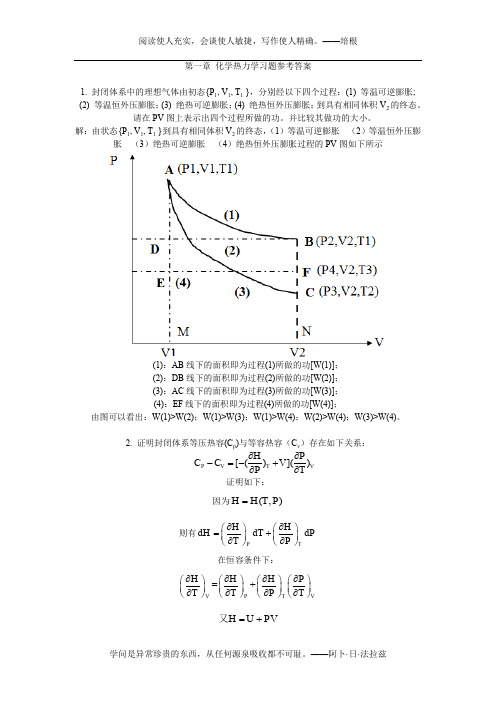
第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀;(2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)];(2):DB 线下的面积即为过程(2)所做的功[W(2)];(3):AC 线下的面积即为过程(3)所做的功[W(3)];(4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫ ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ =V P V T V H P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P P P T P C V S dT dP T T ∂∆=+-∂⎰⎰ 解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T H CpdT dp p ∂=+∂ dH TdS Vdp =+又()()T T H S T V p p∂∂=+∂∂则 (2) ()()T P S V p T ∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P V dH C dT T V dp T ∂=+-+∂ 积分得:2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S S dS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S V dS dT dP T T ∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S H T T T T∂∂==∂∂ 将(6)式代入(5)式得:[()](7)P P C V dS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C V S dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下: Q 2卡诺循环经如下过程(理想气体)1、等温可逆膨胀22U 0T Q W ∆=+=,2222121ln V T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V W PdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313ln VT V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=-220,,Q Q U W =∆=,214213411Q V V nRT V W PdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则 12144323,V V V V V V V V ==则有即或:根据绝热可逆过程方程PV =常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221ln ln =ln V V nRT nRT V V Q Q W V Q Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
物理化学 答案 第一章_习题解答

-
知此气体的 Cp,m=29.10 J·K 1,求过程的ΔU、ΔH、Q 和 W 。 解: (1)等容
ΔU = n ⋅ Cv ,m (T2 − T1 ) = 1 × (29.1 − 8.314) × 75 = 1559 J ΔH = n ⋅ C p ,m (T2 − T1 ) = 1 × 29.1 × 75 = 2183 J
η = −Wr / Q1 = (T1 − T2 ) / T1 = (500 − 300) / 600 = 40%
第二个卡诺热机效率
η ′ = −Wr / Q1′ = (T1 − T2′) / T1 = (500 − 250) / 600 = 50%
∵
η =η′
∴两个热机的效率不相同
(2)第一个热机吸收的热量: Q1 =
γ =1.4,试求 Cv,m。若该气体的摩尔热容近似为常数,试求在等容条件下加热该气体至 t2=
80℃所需的热。 解:∵ γ =
C p,m Cv , m
=
Cv , m + R Cv , m
= 1.4
∴ Cv, m =
R
γ
=
8.314 = 20.79 J ⋅ K -1 ⋅ mol-1 0.4
Qv = n ⋅ Cv ,m ⋅ ΔT = =
4
3 3 ⎧ ⎧ ⎪V1 = 5dm ⎪V2 = 6dm Q (可 ) = 0 ⎯⎯⎯⎯ → ⎨ ⎨ ⎪T1 = 298.15 K ⎪T2 = 278.15 K ⎩ ⎩
由理想气体绝热可逆过程方程式可知
T2 / T1 = (V1 / V2 ) Cv ,m =
R / Cv , m
物理化学(第一章)作业及答案

每次物理化学作业及答案§1.1 热力学基本概念第一周(1) 练习1“任何系统无体积变化的过程就一定不对环境作功。
”这话对吗?为什么?答:不对,应该是无体积变化的过程,系统就一定不对环境作体积功。
系统和环境之间交换能量的方式,除体积功外,还有非体积功,如电功,表面功等.2“凡是系统的温度下降就一定放热给环境,而温度不变时则系统既不吸热也不放热。
”这结论正确吗?举例说明之。
答:不正确。
系统的温度下降,内能降低,可以不放热给环境.例如: (13页例1-4) 绝热容器中的理想气体的膨胀过程,温度下降释放的能量,没有传给环境,而转换为对外做的体积功.而温度不变时则系统既不吸热也不放热。
不对, 等温等压相变过程,温度不变,但需要吸热(或放热), 如一个大气压下,373.15K 下,水变成同温同压的水蒸汽的汽化过程,温度不变,但需要吸热。
3在一绝热容器中盛有水,其中浸有电热丝,通电加热。
将不同对象看作系统,则上述加热过程的Q或W大于、小于还是等于零?⑴以电热丝为系统Q<0; W>0;⑵以水为系统; Q>0;W=0;⑶以容器内所有物质为系统Q=0; W>0;⑷将容器内物质以及电源和其它一切有影响的物质看作整个系统。
Q=0;W=0.4在等压的条件下,将1mol理想气体加热使其温度升高1K,试证明所作功的数值为R。
证明:∵等压过程则P1=P2=P e∴W=-p(V2-V1)=-p[ nR(T+1)/p- nRT/p]= -p×(nR/p)= -R51mol理想气体,初态体积为25dm3,温度为373.2K,试计算分别通过下列四个不同过程,等温膨胀到终态体积100dm3时,系统对环境作的体积功。
(1)向真空膨胀。
(2)可逆膨胀。
(3)先在外压等于体积50dm3时气体的平衡压力下,使气体膨胀到50dm3,然后再在外压等于体积为100dm3时气体的平衡压力下使气体膨胀到终态。
(4)在外压等于气体终态压力下进行膨胀。
第 1章 化学热力学基础习题解答(一)

根据反应 ,该反应的标准摩尔焓就是CH3COOH(l)的标准摩尔燃烧焓[变],而
7.关于热力学第二定律,下列说法不正确的是(D)
A .第二类永动机是不可能制造出来的
B.把热从低温物体传到高温物体,不引起其他变化是不可能的
C.一切实际过程都是热力学不可逆过程
2.热力学能是系统的状态函数,若某一系统从一始态出发经一循环过程又回到始态,则系统热力学能的增量是(A)
A.ΔU=0B.ΔU>0C.ΔU<0
U2=U1,U2—U1=0
3.对于封闭系统来说,当过程的始终态确定后,下列各项中(A)无确定值。
A. QB. Q+WC.W (当Q=0时)D.Q (当W=0时)
2. 的应用条件是恒容;W/=0;封闭系统。
3.已知反应
(i)
(ii)
则反应(iii) 的 为206.2kJ﹒mol-1。
反应(iii)=反应(ii)—反应(i)
4.已知298.15K时C2H4(g)、 及 的标准摩尔燃烧焓[变] (298.15K)分别为-1411 ,-1560 及-285.8 ,则 反应的标准摩尔焓[变] 为-136.8 kJ﹒mol-1。
第1章化学热力学基础(一)
一、选择题(均为单选题,将正确选项填在各题后的括号内)
1.系统的下列各组物理量中都是状态函数的是(C)
A.T,P,V,QB.m,Vm,Cp,ΔVC.T,P,V, nD.T,P,U,W
原因:A中T,P,V是,Q不是,是过程量;B中Vm,Cp是,m不是,ΔV是状态函数的
变化,D中T,P,U是,W不是
的燃烧反应就是 的生成反应
4.反应 的标准摩尔焓[变] (T)即是 的标准摩尔生成焓[变] (T)。(×)
物理化学《化学热力学基础》习题及答案

物理化学《化学热力学基础》习题及答案1-2 选择题1、273K ,θp 时,冰融化为水的过程中,下列关系是正确的有(B )A.0<WB.p Q H =∆C.0<∆HD.0<∆U2、体系接受环境做功为160J ,热力学能增加了200J ,则体系(A )A.吸收热量40JB.吸收热量360JC.放出热量40JD.放出热量360J3、在一绝热箱内,一电阻丝浸入水中,通以电流。
若以水和电阻丝为体系,其余为环境,则(C )A.0,0,0>∆=>U W QB.0,0,0>∆==U W QC.0,0,0>∆>=U W QD.0,0,0<∆=<U W Q4、任一体系经一循环过程回到始态,则不一定为零的是(D )A.G ∆B.S ∆C.U ∆D.Q5、对一理想气体,下列关系式不正确的是(A )A.0=⎪⎭⎫ ⎝⎛∂∂p T UB.0=⎪⎭⎫ ⎝⎛∂∂T V H C.0=⎪⎪⎭⎫ ⎝⎛∂∂T p H D.0=⎪⎪⎭⎫ ⎝⎛∂∂T p U 6、当热力学第一定律写成pdV Q dU -=δ时,它适用于(C )A.理想气体的可逆过程B.封闭体系的任一过程C.封闭体系只做体积功过程D.封闭体系的定压过程7、在一绝热刚壁体系内,发生一化学反应,温度从21T T →,压力由21p p →,则(D )A.0,0,0>∆>>U W QB.0,0,0<∆<=U W QC.0,0,0>∆>=U W QD.0,0,0=∆==U W Q 8、理想气体定温定压混合过程中,下列体系的性质不正确的是(C )A.0>∆SB.0=∆HC.0=∆GD.0=∆U9、任意的可逆循环过程,体系的熵变(A )A.一定为零B.一定大于零C.一定为负D.是温度的函数10、一封闭体系从B A →变化时,经历可逆R 和不可逆IR 途径,则(B )A.IR R Q Q =B.T Q dS IRδ> C.IR R W W = D.TQ T Q IR R =11、理想气体自由膨胀过程中(D )A.0,0,0,0=∆>∆>=H U Q WB.0,0,0,0>∆>∆=>H U Q WC.0,0,0,0=∆=∆><H U Q WD.0,0,0,0=∆=∆==H U Q W12、2H 和2O 在绝热定容的体系中生成水,则(D )A.0,0,0=∆>∆=孤S H QB.0,0,0>∆=>U W QC.0,0,0>∆>∆>孤S U QD.0,0,0>∆==孤S W Q13、理想气体可逆定温压缩过程中,错误的有(A )A.0=∆体SB.0=∆UC.0<QD.0=∆H14、当理想气体反抗一定外压做绝热膨胀时,则(D )A.焓总是不变的B.热力学能总是不变的C.焓总是增加的D.热力学能总是减小的15、环境的熵变等于(B 、C ) A.环体T Q δ B.环体T Q δ- C.环环T Q δ D.环环T Q δ-16、在孤立体系中进行的变化,其U ∆和H ∆的值一定是(D )A.0,0<∆>∆H UB.0,0=∆=∆H UC.0,0<∆<∆H UD.不能确定H U ∆=∆,017、某体系经过不可逆循环后,错误的答案是(A )A.0=QB.0=∆SC.0=∆UD.0=∆H18、C 6H 6(l)在刚性绝热容器中燃烧,则(D )A.0,0,0=<∆=∆Q H UB.0,0,0=>∆=∆W H UC.0,0,0==∆≠∆Q H UD.0,0,0=≠∆=∆W H U19 、下列化学势是偏摩尔量的是( B ) A.Zn V T B n F ,,⎪⎭⎫ ⎝⎛∂∂ B.Z n p T B n G ,,⎪⎭⎫ ⎝⎛∂∂ C.Z n V S B n U ,,⎪⎭⎫ ⎝⎛∂∂ D.Z n p S B n H ,,⎪⎭⎫ ⎝⎛∂∂ 20、在℃10-,θp ,1mol 过冷的水结成冰时,下述表示正确的是( C )A.00,0,0>∆>∆>∆<∆孤环体,S S S GB.00,0,0<∆<∆<∆>∆孤环体,S S S GC.00,0,0>∆>∆<∆<∆孤环体,S S S GD.00,0,0<∆<∆>∆>∆孤环体,S S S G21、下述化学势的公式中,不正确的是( D ) A.B B Z n p T n Gμ=⎪⎪⎭⎫ ⎝⎛∂∂,, B.m B pS T ,-=⎪⎭⎫ ⎝⎛∂∂μ C.m B TV p ,=⎪⎪⎭⎫ ⎝⎛∂∂μ D.Z n p T B n U ,,⎪⎪⎭⎫ ⎝⎛∂∂ 22、在373.15K ,101.325Pa ,)(2l O H μ与)(2g O H μ的关系是( B )A.)()(22g O H l O H μμ>B.)()(22g O H l O H μμ=C.)()(22g O H l O H μμ<D.无法确定23、制作膨胀功的封闭体系,pT G ⎪⎭⎫ ⎝⎛∂∂的值( B ) A.大于零 B.小于零 C.等于零 D.无法确定24、某一过程0=∆G ,应满足的条件是( D )A.任意的可逆过程B.定温定压且只做体积中的过程C.定温定容且只做体积功的可逆过程D.定温定压且只做体积功的可逆过程25、1mol 理想气体经一定温可逆膨胀过程,则( A )A.F G ∆=∆B.F G ∆>∆C.F G ∆<∆D.无法确定26、纯液体在正常相变点凝固,则下列量减少的是( A )A.SB.GC.蒸汽压D.凝固热27、右图中哪一点是稀溶液溶质的标准态的点( B )A.a 点B.b 点C.c 点D.d 点28、在θp 下,当过冷水蒸气凝结为同温度的水,在该过程中正、负号无法确定的是( D )A.G ∆B.S ∆C.H ∆D.U ∆29、实际气体的化学势表达式为θθμμp f RT T ln)(+=,其中标准态 化学势为( A )A.逸度θp f =的实际气体的化学势B.压力θp p =的实际气体的化学势C.压力θp p =的理想气体的化学势D.逸度θp f =的理想气体的化学势30、理想气体的不可逆循环,G ∆( B )A.0<B.0=C.0>D.无法确定31、在βα,两相中含A 、B 两种物质,当达平衡时,正确的是( B )A.ααμμB A =B.ααμμA A =C.βαμμB A =D.ββμμB A =32、多组分体系中,物质B 的化学势随压力的变化率,即)(,B Z B Z n T p ≠⎪⎪⎭⎫ ⎝⎛∂∂μ的值( A ) A.0> B.0< C.0= D.无法确定33、℃10-、标准压力下,1mol 过冷水蒸汽凝集成冰,则体系、环境及总的熵变为( B )A.0,0,0<∆<∆<∆univ sur sys S S SB.0,0,0>∆>∆<∆univ sur sys S S SC.0,0,0>∆>∆>∆univ sur sys S S SD.0,0,0<∆>∆<∆univ sur sys S S S34、p-V 图上,1mol 单原子理想气体,由状态A 变到状态B ,错误的是( B )A.Q U =∆B.Q H =∆C.0<∆SD.0<∆U35、体系经不可逆过程,下列物理量一定大于零的是( C )A.U ∆B.H ∆C.总S ∆D.G ∆36、一个很大的恒温箱放着一段电阻丝,短时通电后,电阻丝的熵变( D )A.0>B.0<C.0=D.无法确定37、热力学的基本方程Vdp SdT dG +-=可使用与下列哪一过程( B )A.298K ,标准压力的水蒸发的过程B.理想气体向真空膨胀C.电解水制备氢气D.合成氨反应未达平衡38、温度为T 时,纯液体A 的饱和蒸汽压为*A p ,化学势为*A μ,在1θp 时,凝固点为0f T ,向A 溶液中加入少量溶质形成稀溶液,该溶质是不挥发的,则A p 、A μ、f T 的关系是( D )A.f f A A A A T T p p <<<0,**,μμB.f f A A A A T T p p <<>0,**,μμC.f f A A A A T T p p ><>0,**,μμD.f f A A A A T T p p >>>0,**,μμ39下列性质不符合理想溶液通性的是: ( D )A. ∆mix V =0B. ∆mix S >0C. ∆mix G <0D. ∆mix G >040、从A 态到B 态经不可逆过程ΔS 体是: ( D )A.大于零B.小于零C.等于零D.无法确定41、常压下-10℃过冷水变成-10℃的冰,在此过程中,体系的ΔG 与ΔH 如何变化: ( D )A. ΔG<0,ΔH>0B. ΔG>0,ΔH>0C. ΔG=0,ΔH=0D. ΔG<0,ΔH<042、某绝热封闭体系在接受了环境所做的功之后,其温度:( A )A.一定升高B.一定降低C.一定不变D.不一定改变43、对于纯物质的标准态的规定,下列说法中不正确的是: (C)A. 气体的标准态就是温度为T ,压力为100kPa 下具有理想气体性质的纯气体状态。
第1章化学热力学基础习题解答二

第 1章 化学热力学基础(二)一、选择题(均为单选题,将正确选项填在各题后的括号内)8. 1 mol 理想气体,从同一始态出发经过绝热可逆压缩和绝热不可逆压缩到系统压力相同的终态,终态的熵分别为S 1和S 2,则两者关系为( B )A. S 1 = S 2B. S 1 < S 2C. S 1 >S 2D. S 1 ≥ S 2 始终态相同时,不可逆过程的熵变大于可逆过程9. 根据熵增加原理知,若从ΔS >0判定过程一定是自发过程,那么该系统一定是( C )A. 封闭系统B. 绝热系统C. 隔离系统D. 敞开系统10. 关于偏摩尔量,下列叙述正确的是( C ) A. 偏摩尔量是状态函数,其值与物质的数量有关 B. 在多组分多相系统中不存在偏摩尔量 C. 系统的强度性质没有偏摩尔量 D. 偏摩尔量的值只能大于或等于零11. 对封闭的单组分均相系统且'0W =时,()T G p∂∂的量值为( B )。
A. <0B. >0C. = 0D. 前述三种情况无法判断 根据p 69公式(1-128)(),0,T G V V p∂=>∂所以()0,T G p∂>∂12. 下面哪一个关系式是不正确的?( D ) A. ()p GS T∂=-∂ B. ()T G V p ∂=∂C. 2()V A T U T T ∂⎡⎤=-⎢⎥∂⎣⎦ D. ()pG T H T T ∂⎡⎤=-⎢⎥∂⎣⎦ 正确的应该是2()pG T H T T ∂⎡⎤=-⎢⎥∂⎣⎦ 二、填空题(在以下各小题中画有” ”处填上答案)5. 热力学第二定律的经典表述之一为___不可能将热从低温物体转移到高温物体而不留下其他变化 ,数学表达式为 __ Q dS Tδ≥,“>”不可逆,“=”可逆 。
答克劳修斯说与开尔文说都算对,但要求“之一”答第一种说法即克劳修斯说更妥当一些。
P 486. 在隔离系统中进行的可逆过程S ∆___=0__;进行的不可逆过程S ∆__>0_。
物理化学各章复习题 附答案

第一章化学热力学基础1.4 练习题1.4.1 判断题1.可逆的化学反应就是可逆过程。
2.Q和W不是体系的性质,与过程有关,所以Q + W也由过程决定。
3.焓的定义式H = U + pV是在定压条件下推导出来的,所以只有定压过程才有焓变。
4.焓的增加量DH等于该过程中体系从环境吸收的热量。
5.一个绝热过程Q = 0,但体系的DT不一定为零。
6.对于一定量的理想气体,温度一定,热力学能和焓也随之确定。
7.某理想气体从始态经定温和定容两过程达终态,这两过程的Q、W、DU及DH是相等的。
8.任何物质的熵值是不可能为负值和零的。
9.功可以全部转化为热,但热不能全部转化为功。
10.不可逆过程的熵变是不可求的。
11.某一过程的热效应与温度相除,可以得到该过程的熵变。
12.在孤立体系中,一自发过程由A→B,但体系永远回不到原来状态。
13.绝热过程Q = 0,即,所以d S = 0。
14.可以用一过程的熵变与热温熵的大小关系判断其自发性。
15.绝热过程Q = 0,而由于DH = Q,因而DH等于零。
16.按Clausius不等式,热是不可能从低温热源传给高温热源的。
17.在一绝热体系中,水向真空蒸发为水蒸气 (以水和水蒸气为体系),该过程W>0,DU>0。
18.体系经过一不可逆循环过程,其DS体>0。
19.对于气态物质,C p-C V = n R。
20.在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时Q= 0,所以DS=0。
1.4.2 选择题1.273K, p q时,冰融化为水的过程中,下列关系式正确的有 .A.W<0 B. DH = Q P C. DH<0 D. DU<02.体系接受环境作功为160J,热力学能增加了200J,则体系 .A.吸收热量40J B.吸收热量360JC.放出热量40J D.放出热量360J3.在一绝热箱内,一电阻丝浸入水中,通以电流。
若以水和电阻丝为体系,其余为环境,则 .A.Q> 0,W = 0,DU > 0 B.Q =0,W = 0,DU > 0C.Q = 0,W> 0,DU > 0 D.Q< 0,W = 0,DU < 04.任一体系经一循环过程回到始态,则不一定为零的是 .A.DG B.DS C.DU D.Q5.对一理想气体,下列哪个关系式不正确 .A. B.C. D.6.当热力学第一定律写成d U = δQ–p d V时,它适用于 .A.理想气体的可逆过程 B.封闭体系的任一过程C.封闭体系只做体积功过程 D.封闭体系的定压过程7.在一绝热钢壁体系内,发生一化学反应,温度从T1→T2,压力由p1→p2,则 .A.Q>0,W>0,DU > 0 B.Q = 0,W<0,DU <0C.Q = 0,W>0,DU >0 D.Q = 0,W = 0,DU = 08.理想气体混合过程中,下列体系的性质,不正确的是 .A.DS>0 B.DH =0 C.DG = 0 D. DU = 09.任意的可逆循环过程,体系的熵变 .A.一定为零 B.一定大于零 C.一定为负 D.是温度的函数10.一封闭体系,从A→B变化时,经历可逆(R)和不可逆(IR)途径,则 .A.Q R = Q IR B. C.W R = W IR D.11.理想气体自由膨胀过程中 .A.W = 0,Q>0,DU>0,DH=0 B.W>0,Q=0,DU>0,DH>0C.W<0,Q>0,DU=0,DH=0 D.W = 0,Q=0,DU=0,DH=012.H2和O2在绝热定容的体系中生成水,则 .A.Q=0,DH>0,DS孤 = 0 B.Q>0,W = 0,DU>0C.Q>0,DU>0,DS孤>0 D. Q=0,W = 0,DS孤>013.理想气体可逆定温压缩过程中,错误的有 .A. DS体= 0 B. DU=0 C.Q<0 D. DH=014.当理想气体反抗一定的外压做绝热膨胀时,则 .A. 焓总是不变的 B.热力学能总是不变的C.焓总是增加的 D.热力学能总是减小的15.环境的熵变等于 .A. B. C. D.1.4.3 填空题1.理想气体的定温可逆膨胀体系做的功最,定温可逆压缩过程环境做的功最。
第一章化学热力学习题参考答案
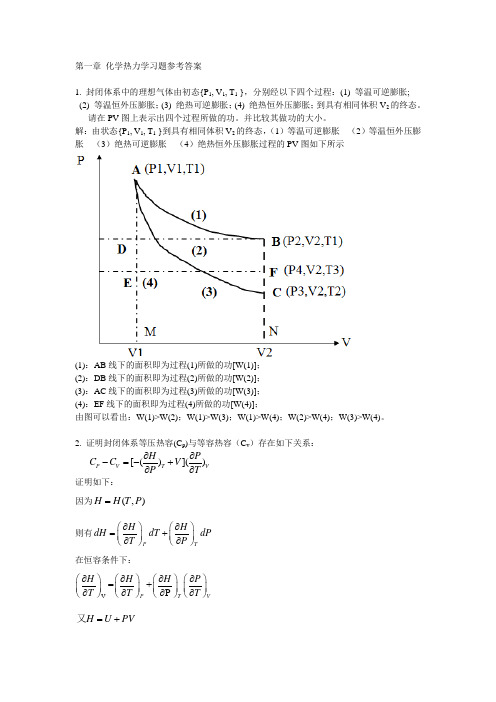
第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀; (2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)]; (2):DB 线下的面积即为过程(2)所做的功[W(2)]; (3):AC 线下的面积即为过程(3)所做的功[W(3)]; (4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭=V P VT VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫--⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P PP T P C V S dT dP T T∂∆=+-∂⎰⎰解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T HCpdT dp p∂=+∂ dH TdS Vdp =+又()()T T H ST V p p∂∂=+∂∂则 (2) ()()T P S Vp T∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P VdH C dT T V dp T∂=+-+∂ 积分得:2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S SdS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S VdS dT dP T T∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S HT T T T∂∂==∂∂将(6)式代入(5)式得:[()](7)P P C VdS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C VS dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下:Q 2卡诺循环经如下过程(理想气体) 1、等温可逆膨胀22U 0T Q W ∆=+=,2222121lnV T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V WPdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313lnV T V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=- 220,,Q Q U W =∆=,214213411Q V V nRT V WPdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则12144323,V V V VV V V V ==则有即或:根据绝热可逆过程方程PV γ=常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221lnln =ln V VnRT nRT V V Q Q W VQ Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
第01章--热力学基本定律--习题及答案

第一章 热力学基本定律习题及答案§ 1. 1 (P10)1.“任何系统无体积变化的过程就一定不做功。
”这句话对吗?为什么?解:不对。
体系和环境之间以功的形式交换的能量有多种,除体积功之外还有非体积功,如电功、表面功等。
2. “凡是系统的温度下降就一定放热给环境,而温度不变时则系统既不吸热也不放热。
”这结论正确吗?举例说明。
答:“凡是系统的温度下降就一定放热给环境”不对:体系温度下降可使内能降低而不放热,但能量可以多种方式和环境交换,除传热以外,还可对外做功,例如,绝热容器中理想气体的膨胀过程,温度下降释放的能量,没有传给环境,而是转换为对外做的体积功。
“温度不变时则系统既不吸热也不放热”也不对:等温等压相变过程,温度不变,但需要吸热(或放热), 如P Ө、373.15K 下,水变成同温同压的水蒸气的汽化过程,温度不变,但需要吸热。
3. 在一绝热容器中,其中浸有电热丝,通电加热。
将不同对象看作系统,则上述加热过程的Q 或W 大于、小于还是等于零?(讲解时配以图示) 解:(1)以电热丝为系统:Q<0,W>0(2)以水为系统:Q>0,W=0(忽略水的体积变化) (3)以容器内所有物质为系统:Q=0,W>0(4)以容器内物质及一切有影响部分为系统:Q=0,W=0(视为孤立系统)4. 在等压的条件下,将1mol 理想气体加热使其温度升高1K ,试证明所做功的数值为R 。
解:理想气体等压过程:W = p(V -V ) = pV -PV = RT -RT = R(T -T ) = R5. 1mol 理想气体,初态体积为25dm , 温度为373.2K ,试计算分别通过下列四个不同过程,等温膨胀到终态体积100dm 时,系统对环境作的体积功。
(1)向真空膨胀。
(2)可逆膨胀。
(3)先在外压等于体积50 dm 时气体的平衡压力下,使气体膨胀到50 dm ,然后再在外压等于体积为100dm 时气体的平衡压力下,使气体膨胀到终态。
第一章 化学热力学基础

第一章 化学热力学基础1.计算下列体系热力学能的变化(ΔU )(1) 体系吸收了60kJ 的热,并对环境做了40kJ 的功。
(2) 体系放出了50kJ 的热和环境对体系做了70kJ 的功。
解:(1)Q = +60kJ W = -40kJ;ΔU = Q + W = +(60) + (-40) = +20KJ (2) Q = -50KJ W = +70KJΔU = Q + W = (-50) + 70 = +20KJ2.298K 时,在恒容量热计中测得1.00mol C 6H 6 (1)完全燃烧生成H 2O (1)和CO 2 (g )时,放热3263.9KJ 。
计算恒压下1.00mol C 6H 6 (1)完全燃烧时的反应热效应。
解:C 6H 6完全燃烧时的反应式:C 6H 6(l)+7.5O 2(g)=3H 2O (l)+6CO 2(g) 实验是在恒容条件下, 即 Q V=-3263.9KJ Δn=6-7.5= -1.5据Q p = Q V +ΔnRT = -3263.9 + (-1.5) × 8.314 × 298 × 10 -3 = -3267.6(KJ·mol -1) 3.在弹式量热计里燃烧氮化铌反应为: NbN (s) + 45O 2 (g) =21Nb 2O 5 (s) + 21N 2 (g)在298下测得热力学能的变化为-712.97KJ.mol -1,求此反应的焓变。
解:在弹式量热计里测量恒容反应热:Q V =ΔU = -712.97KJ·mol -1 Δn==21 - 45 = -43据Q p = Q V +ΔnRTQ p = H r ∆ = -712.97+(-43) × 8.314 × 298 × 10 –3 = -714.83(KJ·mol -1)4.已知反应: A + B = C + DΘ∆1H r = -40.0 KJ·mol -1 C + D = E Θ∆2H r = +60.0 KJ·mol -1试计算下列反应的Θ∆H r :(1)C + D = A + B (2)2C + 2D = 2A + 2B (3)A + B = E解:(1)Θ∆H r =-Θ∆1H r = +40.0 KJ·mol -1 (2) Θ∆H r =2(-Θ∆1H r )= +80.0 KJ·mol -1(3) Θ∆H r = Θ∆1H r + Θ∆2H r = (-40.0) + ( +60.0) = +20.0 (KJ·mol -1)5.已知下列热化学方程式:(1)Fe 2O 3 (s) + 3CO(g) = 2Fe(s) +3CO 2(g) Θ∆1H r =-27.6 KJ·mol -1 (2)3 Fe 2O 3 (s) + CO(g) = 2Fe 3O 4(s) +CO 2(g) Θ∆2H r =-58.58 KJ·mol -1(3) Fe 3O 4 (s) + CO(g) = 3FeO(s) +CO 2(g) Θ∆3H r =+38.07 KJ·mol -1不查表计算下列反应的Θ∆H r : FeO (s) +CO (g) = Fe (s) +CO 2 (g) 解:[(1)×3-(2)-(3)×2]/6 为下式: FeO (s) +CO (g) = Fe (s) +CO 2 (g)Θ∆H r =[3Θ∆1H r -Θ∆2H r -2Θ∆3H r ]/6 =[3×(-27.6)-(-58.58)-2×(+38.07)]/6 = -16.73(KJ·mol -1) 6.已知: (1)Cu 2O (s)+21O 2 (g)=2CuO (s) Θ∆1H r =-143.7 KJ·mol -1; (2)CuO (s)+Cu (s)=Cu 2O (s) Θ∆2H r =-11.5 KJ·mol -1计算CuO (s)的标准生成热(Θ∆m f H )解:(1) + (2) 式得: CuO (s) +21O 2 (g) = CuO (s) 故标准生成热:Θ∆m f H = Θ∆1H r +Θ∆2H r = (-143.7)+( -11.5) =-155.2(KJ·mol -1)7. 已知:(1)MnO 2 (s) =MnO (s) +21O 2 (g) Θ∆1H r =+134.8 KJ·mol -1; (2)Mn (s)+ MnO 2 (s) = 2MnO (s) Θ∆2H r =-250.1KJ·mol -1计算MnO 2 (s)的Θ∆m f H 值。
《工科大学化学》物理化学部分课后习题参考答案(可编辑)

《工科大学化学》物理化学部分课后习题参考答案第 1 章化学热力学基本定律与函数第第第 1 1 1 章章章化学热力学基本定律与函数化学热力学基本定律与函数化学热力学基本定律与函数习题?1.1mol 双原子理想气体在 300 K、101 kPa 下,经恒外压恒温压缩至平衡态,并从此状态下QU WH恒容升温至 370 K、压强为 1 010 kPa。
求整个过程的、、及。
(答案:△U 1455 J,△H 2037 J,W17727 J,Q -16272 J)UH解: 第一步:恒外压恒温压缩至平衡态, 0, 03 3V 8.314×300/101×10 24.695dm ,13 3此平衡态的体积就是末态的体积 V , V 8.314×370/1010×10 3.046dm2 2-3此平衡态的压强 P’8.314×300/3.046×10 818.84kPa3 -3W-P’V -V -818.92×10 ×3.046-24.695×10 17727 J17.727 kJ2 1-QW17.727 kJ Q-17.727 kJ第一步: 因恒容 W0UQ C T -T 20.79×370-3001455.3 J1.455 kJv v,m 2 1H20.79+R×702037.3 J2.037 kJ整个过程:W17.727 kJ;Q -17.727+1.455 -16.27 kJ;UH1.455 kJ ;2.037 kJ。
UH2.设有 0.1 kg N ,温度为 273.15 K,压强为 101325 Pa,分别进行下列过程,求、、2QW及。
?1 恒容加热至压强为 151987.5 Pa;2 恒压膨胀至原体积的 2 倍;3 恒温可逆膨胀至原体积的 2倍;4 绝热可逆膨胀至原体积的2倍。
?4 4(答案: ①△U Q 1.01×10 J,△H 1.42×10 J,W 0;V②△H QP 28.4 kJ,△U 20.20 kJ,W -8.11 kJ;③ Q 5622 J ,W -5622 J,△H △U 0 J;④ Q 0,W △U -4911 J,△H - 6875 J)解: 将 N 气视为双原子理想气体,则2-1 -1C 29.10 J?mol ?K ;p,m-1 -1C 20.79 J?mol ?Kv,m1 W0, 末态温度 T 1.5T 1.5×273.15 K2 14U∴ Qvn CvT2-T1 100/28×20.79×1.5×273.15-273.151.01×10 J4Hn C T -T 100/28×29.10×1.5×273.15-273.151.42×10 Jp 2 12 末态温度 T 2T 2×273.15K2 1HQ n CpT -T 100/28×29.10×2×273.15-273.15 28388 J28.4 kJp 2 1Un CvT2-T1 100/28×20.79×273.15 20201 J20.20 kJVW -P -101325×100/28×8.314×273.15/101325 -8110J -8.11kJUH3 理想气体恒温, 0,W -Q -100/28×8.314×273.15×ln2 -5622 J -5.62 kJ0.4 0.4T V T V1 12 24 运用理想气体绝热过程方程:0.4 0.4T 1/2 ×T 1/2 ×273.15 207 K2 1Q0UTW n Cv,m 100/28×20.79×207-273.15 -4911 J - 4.911 kJH 100/28×29.10×207-273.15-6875 J -6.875 kJ-13.在 373.15 K、101325 Pa 下,1 mol 水缓慢蒸发。
第一章化学热力学习题参考答案

第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀; (2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)]; (2):DB 线下的面积即为过程(2)所做的功[W(2)]; (3):AC 线下的面积即为过程(3)所做的功[W(3)]; (4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭=V P VT VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫--⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P PP T P C V S dT dP T T∂∆=+-∂⎰⎰解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T HCpdT dp p∂=+∂ dH TdS Vdp =+又()()T T H ST V p p∂∂=+∂∂则 (2) ()()T P S Vp T∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P VdH C dT T V dp T∂=+-+∂ 积分得:2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S SdS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S VdS dT dP T T∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S HT T T T∂∂==∂∂将(6)式代入(5)式得:[()](7)P P C VdS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C VS dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下:Q 2卡诺循环经如下过程(理想气体) 1、等温可逆膨胀22U 0T Q W ∆=+=,2222121lnV T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V WPdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313lnV T V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=- 220,,Q Q U W =∆=,214213411Q V V nRT V WPdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则12144323,V V V VV V V V ==则有即或:根据绝热可逆过程方程PV γ=常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221lnln =ln V VnRT nRT V V Q Q W VQ Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
物理化学《化学热力学基础》习题及答案

物理化学《化学热力学基础》习题及答案 1-2 选择题1、273K ,θp 时,冰融化为水的过程中,下列关系是正确的有(B )A.0<WB.p Q H =∆C.0<∆HD.0<∆U2、体系接受环境做功为160J ,热力学能增加了200J ,则体系(A )A.吸收热量40JB.吸收热量360JC.放出热量40JD.放出热量360J3、在一绝热箱内,一电阻丝浸入水中,通以电流。
若以水和电阻丝为体系,其余为环境,则(C )A.0,0,0>∆=>U W QB.0,0,0>∆==U W QC.0,0,0>∆>=U W QD.0,0,0<∆=<U W Q4、任一体系经一循环过程回到始态,则不一定为零的是(D )A.G ∆B.S ∆C.U ∆D.Q5、对一理想气体,下列关系式不正确的是(A )A.0=⎪⎭⎫ ⎝⎛∂∂p T UB.0=⎪⎭⎫ ⎝⎛∂∂T V H C.0=⎪⎪⎭⎫ ⎝⎛∂∂T p H D.0=⎪⎪⎭⎫ ⎝⎛∂∂T p U 6、当热力学第一定律写成pdV Q dU -=δ时,它适用于(C )A.理想气体的可逆过程B.封闭体系的任一过程C.封闭体系只做体积功过程D.封闭体系的定压过程7、在一绝热刚壁体系内,发生一化学反应,温度从21T T →,压力由21p p →,则(D )A.0,0,0>∆>>U W QB.0,0,0<∆<=U W QC.0,0,0>∆>=U W QD.0,0,0=∆==U W Q 8、理想气体定温定压混合过程中,下列体系的性质不正确的是(C )A.0>∆SB.0=∆HC.0=∆GD.0=∆U9、任意的可逆循环过程,体系的熵变(A )A.一定为零B.一定大于零C.一定为负D.是温度的函数10、一封闭体系从B A →变化时,经历可逆R 和不可逆IR 途径,则(B )A.IR R Q Q =B.T Q dS IRδ> C.IR R W W = D.TQ T Q IR R =11、理想气体自由膨胀过程中(D )A.0,0,0,0=∆>∆>=H U Q WB.0,0,0,0>∆>∆=>H U Q WC.0,0,0,0=∆=∆><H U Q WD.0,0,0,0=∆=∆==H U Q W12、2H 和2O 在绝热定容的体系中生成水,则(D )A.0,0,0=∆>∆=孤S H QB.0,0,0>∆=>U W QC.0,0,0>∆>∆>孤S U QD.0,0,0>∆==孤S W Q13、理想气体可逆定温压缩过程中,错误的有(A )A.0=∆体SB.0=∆UC.0<QD.0=∆H14、当理想气体反抗一定外压做绝热膨胀时,则(D )A.焓总是不变的B.热力学能总是不变的C.焓总是增加的D.热力学能总是减小的15、环境的熵变等于(B 、C ) A.环体T Q δ B.环体T Q δ- C.环环T Q δ D.环环T Q δ-16、在孤立体系中进行的变化,其U ∆和H ∆的值一定是(D )A.0,0<∆>∆H UB.0,0=∆=∆H UC.0,0<∆<∆H UD.不能确定H U ∆=∆,017、某体系经过不可逆循环后,错误的答案是(A )A.0=QB.0=∆SC.0=∆UD.0=∆H18、C 6H 6(l)在刚性绝热容器中燃烧,则(D )A.0,0,0=<∆=∆Q H UB.0,0,0=>∆=∆W H UC.0,0,0==∆≠∆Q H UD.0,0,0=≠∆=∆W H U19 、下列化学势是偏摩尔量的是( B ) A.Zn V T B n F ,,⎪⎭⎫ ⎝⎛∂∂ B.Z n p T B n G ,,⎪⎭⎫ ⎝⎛∂∂ C.Z n V S B n U ,,⎪⎭⎫ ⎝⎛∂∂ D.Z n p S B n H ,,⎪⎭⎫ ⎝⎛∂∂ 20、在℃10-,θp ,1mol 过冷的水结成冰时,下述表示正确的是( C )A.00,0,0>∆>∆>∆<∆孤环体,S S S GB.00,0,0<∆<∆<∆>∆孤环体,S S S GC.00,0,0>∆>∆<∆<∆孤环体,S S S GD.00,0,0<∆<∆>∆>∆孤环体,S S S G21、下述化学势的公式中,不正确的是( D ) A.B B Z n p T n Gμ=⎪⎪⎭⎫ ⎝⎛∂∂,, B.m B pS T ,-=⎪⎭⎫ ⎝⎛∂∂μ C.m B TV p ,=⎪⎪⎭⎫ ⎝⎛∂∂μ D.Z n p T B n U ,,⎪⎪⎭⎫ ⎝⎛∂∂ 22、在373.15K ,101.325Pa ,)(2l O H μ与)(2g O H μ的关系是( B )A.)()(22g O H l O H μμ>B.)()(22g O H l O H μμ=C.)()(22g O H l O H μμ<D.无法确定23、制作膨胀功的封闭体系,pT G ⎪⎭⎫ ⎝⎛∂∂的值( B ) A.大于零 B.小于零 C.等于零 D.无法确定24、某一过程0=∆G ,应满足的条件是( D )A.任意的可逆过程B.定温定压且只做体积中的过程C.定温定容且只做体积功的可逆过程D.定温定压且只做体积功的可逆过程25、1mol 理想气体经一定温可逆膨胀过程,则( A )A.F G ∆=∆B.F G ∆>∆C.F G ∆<∆D.无法确定26、纯液体在正常相变点凝固,则下列量减少的是( A )A.SB.GC.蒸汽压D.凝固热27、右图中哪一点是稀溶液溶质的标准态的点( B )A.a 点B.b 点C.c 点D.d 点28、在θp 下,当过冷水蒸气凝结为同温度的水,在该过程中正、负号无法确定的是( D )A.G ∆B.S ∆C.H ∆D.U ∆29、实际气体的化学势表达式为θθμμp f RT T ln)(+=,其中标准态 化学势为( A )A.逸度θp f =的实际气体的化学势B.压力θp p =的实际气体的化学势C.压力θp p =的理想气体的化学势D.逸度θp f =的理想气体的化学势30、理想气体的不可逆循环,G ∆( B )A.0<B.0=C.0>D.无法确定31、在βα,两相中含A 、B 两种物质,当达平衡时,正确的是( B )A.ααμμB A =B.ααμμA A =C.βαμμB A =D.ββμμB A =32、多组分体系中,物质B 的化学势随压力的变化率,即)(,B Z B Z n T p ≠⎪⎪⎭⎫ ⎝⎛∂∂μ的值( A ) A.0> B.0< C.0= D.无法确定33、℃10-、标准压力下,1mol 过冷水蒸汽凝集成冰,则体系、环境及总的熵变为( B )A.0,0,0<∆<∆<∆univ sur sys S S SB.0,0,0>∆>∆<∆univ sur sys S S SC.0,0,0>∆>∆>∆univ sur sys S S SD.0,0,0<∆>∆<∆univ sur sys S S S34、p-V 图上,1mol 单原子理想气体,由状态A 变到状态B ,。
普通化学第一章检测题及答案

普通化学第一章(化学热力学基础)模拟试题1.填空题(1)物理量Q(热量)、T(热力学温度)、V(系统体积)、W(功),其中属于状态函数的是;与过程有关的量是。
(2)QV = △U 的应用条件是;;。
(3)在封闭体系中,公式△H = QP的适用条件是。
(4)已知CO2(g)的△fHmθ(298.15K)= -394 kJ/mol,CO2(g)= C(石墨)+O2(g)反应的△fHm(298.15K)为kJ/mol(5)已知反应C(石墨)+ O2(g)= CO2(g),△rHmθ(298.15 K)=-394 kJ·mol和C(金刚石)+O2(g)= CO2 (g),△rHmθ(298.15 K)= -396 kJ·mol问金刚石的△fHmθ(298.15 K)= kJ/mol。
(6)纯物质完美晶体,在时熵值为零。
(7)液态苯气化为气态苯的过程△rS 值,气体在催化剂上吸附过程△rS值。
(8)某放热反应的 B v>0,则在升高温度(p不变)时化学平衡的移动方向为;在增大压力(T不变)时平衡移动方向;加入隋性气体(T,p 不变)时平衡移动方向是。
(9)两个体积相同、温度相等的球形容器中,装有同一种气体,当连接两容器的活塞打开时,△S值。
(10)理想气体的吉布斯函数(G )在向真空膨胀时。
(11)在恒温恒压下,化学反应的△rHm -T△rSm > 0,则反应。
(12)熵减小的反应在低温下可自动进行,此反应的△rHm 。
(13)在等温等压条件下,某反应的Kθ=1,则△rGmθ的值为。
(14)在等温下,若化学平衡发生移动,其平衡常数。
(15)温度T时,在抽空的容器中发生下面的分解反应:NH4HS(s) NH3(g) +H2S(g),测得此平衡体系的总压力为p,则平衡常数Kθ的表达式为。
(16)在恒温恒压下,化学反应的△rHm= T△rSm,则化学反应。
2.选择题(1)内能是体系的状态函数,若某一体系从一始态出发经过一循环过程又回到始态,则体系内能的增量是()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章2.计算下行反应的标准反应焓变△r Hθm:解:①2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)△f Hθm(kJ•mol-1) 0 -824.2 -1675.7 0 △r Hθm=△f Hθm(Al2O3,s)+2△f Hθm(Fe,s)-2△f Hθm(Al,s)- △f Hθm(Fe2O3 ,s)= -1675.7 + 2×0 - 2×0 - (-824.2)= - 851.5 (kJ•mol-1)②C2H2 (g) + H2(g) → C2H4(g)△f Hθm(kJ•mol-1) 226.73 0 52.26△r Hθm = △f Hθm(C2H4 ,g) - △f Hθm(C2H2,g) - △f Hθm(H2,g)= 52.26 - 226.73 - 0= -174.47 (kJ•mol-1)3. 由下列化学方程式计算液体过氧化氢在298 K时的△f Hθm(H2O2,l):① H2 (g) + 1/2O2 (g) = H2O (g) △r Hθm = - 214.82 kJ•mol-1② 2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1③ 2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1④ 2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1⑤ H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1解:方法1:根据盖斯定律有:[(方程①-方程②+方程③-方程⑤)×2-方程④]÷2可得以下方程⑥H2(g)+O2(g)=H2O2(l) △r Hθm△r Hθm=[(△r Hθ1-△r Hθ2+△r Hθ3-△r Hθ5) ×2-△r Hθ4] ÷2={[-214.82-(-926.92)+(-1070.6)-51.46] ×2-(-498.34)} ÷2=[(-409.96)×2+498.34] ÷2=(-321.58) ÷2= -160.79(kJ•mol-1)△f Hθm(H2O2 ,l)= △r Hθm= -160.79 kJ•mol-1方法2:(1)由①可知H2O的△f Hθm(H2O,g)= - 214.82 kJ•mol-1(2)根据④计算O的△f Hθm(O,g)2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1△r Hθm = △f Hθm(O2 ,g)- 2△f Hθm(O,g)= 0 - 2△f Hθm(O,g)= - 498.34 kJ•mol-1△f Hθm(O,g)= 249.17 kJ•mol-1(3) 根据②求算△f Hθm(H,g)2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1△f Hθm(kJ•mol-1) 249.17 - 214.82△r Hθm = △f Hθm(H2O,g) - 2△f Hθm(H,g) -△f Hθm(O,g)= - 214.82 - 2△f Hθm(H,g)- 249.17= - 926.92△f Hθm(H,g)= 231.465 kJ•mol-1(4) 根据③求算△f Hθm(H2O2 ,g)2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1△f Hθm(kJ•mol-1) 231.465 249.17△r Hθm = △f Hθm(H2O2 ,g) - 2△f Hθm(H,g) -2△f Hθm(O,g)=△f Hθm(H2O2 ,g) -2×231.465 - 2×249.17= - 1070.6△f Hθm(H2O2 ,g)= - 109.33 kJ•mol-1(5) 根据⑤求算△f Hθm(H2O2 ,l)H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1△f Hθm(kJ•mol-1) -109.33△r Hθm = △f Hθm(H2O2 ,g) - △f Hθm(H2O2 ,l)= -109.33 - △f Hθm(H2O2 ,l)= 51.46△f Hθm(H2O2 ,l)= -160.79 kJ•mol-14. 在373 K,101.3 kPa下,2.0 mol H2和1.0 mol O2反应,生成2.0 mol的水蒸气,总共放热484 kJ的热量,求该反应的△r H m和△U。
解:2H2(g)+ O2(g) = 2H2O(g)(1) 定压下Q p = △r H m =- 484 kJ即△r H m= - 484kJ•mol-1(2) △U = Q P– P△V= Q P -△nRT= - 484 – (2 – 2 – 1) ×8.314×10-3 ×373= - 480.90 kJ5. 用弹式量热计测得下列反应C7H16 (l) + 11O2 (g) → 7CO2 (g) + 8H2O (l)在298K时Q v = - 4804 kJ•mol-1,试求反应的等压热效应Q p。
解:Q p = Q v + △nRT= - 4804 +(7-11)×8.314×10-3 ×298= - 4813.91 kJ6. 已知298 K时:① C6H4(OH)2 (aq) →C6H4O2 (aq) + H2 (g), △r Hθm, 1= 177.4 kJ•mol-1② O2 (g) + H2 (g) → H2O2 (aq), △r Hθm, 2 = - 191.2 kJ•mol-1③ 1/2O2 (g) + H2 (g) → H2O (g), △r Hθm, 3 = - 241.8 kJ•mol-1④ H2O (g) → H2O (l), △r Hθm, 4 = - 44.0 kJ•mol-1试计算下面反应的△r Hθm:C6H4(OH)2 (aq) + H2O2(aq) → C6H4O2 (aq) + 2 H2O (l)解:C6H4(OH)2 (aq) + H2O2(aq) → C6H4O2 (aq) + 2 H2O (l) (5)∵反应5= 反应1 -反应2 + 2×(反应3 + 反应4)∴△r Hθm,5 = △r Hθm, 1 - △r Hθm, 2 + 2×(△r Hθm, 3 + △r Hθm, 4)= 177.4 -(- 191.2)+ 2×(- 241.8 - 44.0 )= - 203 kJ•mol-18.已知298 K标态下:△f Hθm(O,g) = 249.1 kJ•mol-1 , △f Hθm(N,g) = 472.7 kJ•m ol-1 , O(g) + N(g) → NO(g) △rHθm = - 631.8 kJ•mol-1,求反应1/2N2(g)+ 1/2O2(g) = NO(g) 的△Hθ298K = ?解:设计盖斯循环,△Hθ298K =△Hθ1+△Hθ2+△Hθ3=△f Hθm(N,g)+ △f Hθm(O,g)+ △rHθm(NO,g)=472.7+249.1-631.8=90.0(kJ/mol)9.选择正确答案的序号填入括号内。
答案(1)D. 110.5, 解:∵反应③=反应①-反应②∴△Hθ3=△Hθ1-△Hθ2 =-393.5+283=110.5(2)C、-270.1, 解:由反应①求算△Hθf(HBr),△Hθ1 =2△Hθf(HBr,g) – (△Hθf(H2,g))+ △Hθ(Br2,l)=2△Hθf(HBr,g)- 0 -0 = -72.4 (kJ•mol-1)△Hθf(HBr,g) = -72.4./2 = -36.2(kJ•mol-1)由反应②求算△Hθf(NH3),△Hθ2==2△Hθf(NH3,g) – (3△Hθf(H2,g))+ △Hθ(N2,g)=2△Hθf(NH3,g)- 3×0 -0 = -92.4 (kJ•mol-1)△Hθf(NH3,g) = -92.4./2 = -46.2(kJ•mol-1)由反应③求算△Hθf(NH4Br,s),△Hθ3 = △Hθf(NH4Br,s) – [△Hθf(NH3,g) + △Hθf(HBr,g)]=△Hθf(NH4Br,s)– [ -36.2 -46.2]= -187.7△Hθf(NH4Br,s) = -187.7+(-82.4)= -270.1(kJ•mol-1)(3)B、2C(石墨)+3H2(g)=C2H6(g) ∵根据Q P = Q v+△nRT 有:Q P - Q v =△nRT ,当|△n|越大,则Q P与Q v的差值也就越大。
依题意:反应A的|△n| = |1-1/2|=1/2反应B的|△n| = |1-3|= 2反应C的|△n| = |1-1|=0反应D的|△n| = |1-1/2-3/2|=1∴选B、2C(石墨)+3H2(g)=C2H6(g)(4)选D 、-5.994.解:依题意:H2O(s)=H2O(l)的△H=+333J.g-1则有:H2O(l)=H2O(s)的△H=-333J.g-118g的水转化为同温度的冰,其焓变为:△H = -333J.g-1×18g-1 = - 5994J= - 5.994kJ(5)C、-286.解:由反应可得:△r Hθm=2.△Hθf(H2O,l)-[2△Hθf(H2,g) + △Hθ(O2,g)]= 2.△Hθf(H2O,l)-[2×0+0]= - 572△Hθf(H2O,l) = - 572/2=-286(kJ.mol-1)(6)B、-89.6.解:依题意有:KClO3(s) = KCl(s) + 3/2O2(g)的△Hθ1 = -44.8kJ则:反应2KClO3(s) = 2KCl(s) + 3O2(g)的△Hθ2为:△Hθ2 = 2△Hθ1 = 2×(-44.8)= - 89.6(kJ)(7) B、b-a.解:反应(1)-反应(2)得反应(3):MnO2(s)=Mn(s)+O2(g) △Hθ3 - ----(3)△Hθ3 = △Hθ1- △Hθ2 =a-b△Hθ3 = △Hθf(Mn,s)+ △Hθf(O2,g) - △Hθf(MnO2,s)=a-b解得:△Hθf(MnO2,s =b-a 选B、b-a(8)A、△Hθf(CO2,g)= △Hθ解:由反应可得:△Hθ=△Hθf(CO2,g)-[ △Hθf(C石墨,s) +△Hθf(O2,g)]=△Hθf(CO2,g)-[0 +0]△Hθ=△Hθf(CO2,g)10. 不查表、比较下列物质的Sθm的大小。
