环氧乙烷残留量检测办法学验证
环氧乙烷残留量检验
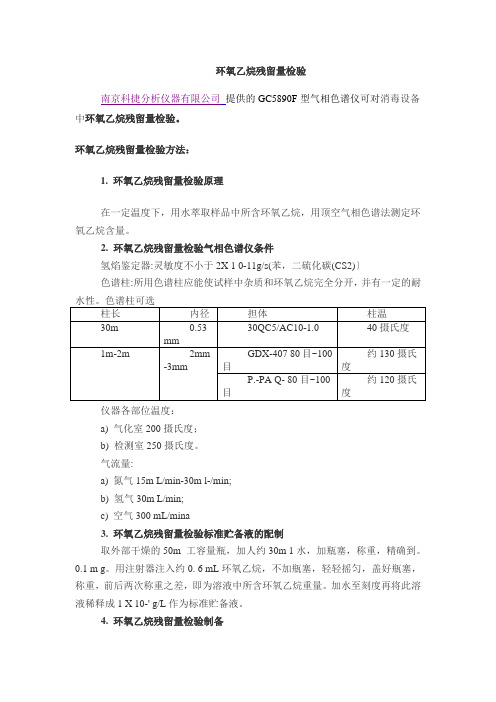
环氧乙烷残留量检验南京科捷分析仪器有限公司提供的GC5890F型气相色谱仪可对消毒设备中环氧乙烷残留量检验。
环氧乙烷残留量检验方法:1. 环氧乙烷残留量检验原理在一定温度下,用水萃取样品中所含环氧乙烷,用顶空气相色谱法测定环氧乙烷含量。
2. 环氧乙烷残留量检验气相色谱仪条件氢焰鉴定器:灵敏度不小于2X 1 0-11g/s(苯,二硫化碳(CS2)〕色谱柱:所用色谱柱应能使试样中杂质和环氧乙烷完全分开,并有一定的耐仪器各部位温度:a) 气化室200摄氏度;b) 检测室250摄氏度。
气流量:a) 氮气15m L/min-30m l-/min;b) 氢气30m L/min;c) 空气300 mL/mina3. 环氧乙烷残留量检验标准贮备液的配制取外部干燥的50m 工容量瓶,加人约30m 1水,加瓶塞,称重,精确到。
0.1 m g。
用注射器注入约0. 6 mL环氧乙烷,不加瓶塞,轻轻摇匀,盖好瓶塞,称重,前后两次称重之差,即为溶液中所含环氧乙烷重量。
加水至刻度再将此溶液稀释成1 X 10-' g/L作为标准贮备液。
4. 环氧乙烷残留量检验制备4.1 试验样制备应在取样后立即进行,否则应将供试样品封于由聚四氟乙烯密封的金属容器中保存。
4.2 将样品截为5 mm长碎块,取2. 0 g放人萃取容器中,加10 mL水,顶端空间40 mL,容器内压力为常压,在恒温水浴60 C士1'C中放置20 min.。
5. 环氧乙烷残留量检验步骤5 .1 用贮备液配制1X10-3g/L—1X102g/L六个系列浓度的标准溶液。
各取10mL按4 .2方法处理。
用玻璃注射器依次从平衡后的标准样和试样中迅速取1mL上部气体,注人进样器.记录环氧乙烷的峰高(或面积)。
注1: 在一个分析中尽量一人操作,并使用同一只1m L玻璃注射器注2: 注射器预先恒温到样品相同温度注3: 每次注意环氧乙烷保留时间的变化,以防进样汽化垫漏气注4: 每个样品(包括标样)在尽可能短的时间内分析三次,三次分析中必须有两次结果相差不大于5%,否则此样品应重新进行分析。
环氧乙烷残留量检验方法

环氧乙烷残留量检验方法环氧乙烷是一种无色、易挥发的化学物质,常用于消毒、灭菌和杀虫等领域。
然而,环氧乙烷可能对人体健康造成不利影响,因此对其残留量进行检验是非常重要的。
本文将介绍几种常用的环氧乙烷残留量检验方法。
1.气相色谱法气相色谱法是一种常用的环氧乙烷残留量检测方法。
该方法的原理是通过将样品气化后,使用气相色谱仪进行分离和检测。
首先,将样品加热至适当温度,使环氧乙烷挥发;然后,将挥发的环氧乙烷通过色谱柱分离,最后通过检测器进行检测。
这种方法检测灵敏度高,但需要专用的仪器和设备。
2.液相色谱法液相色谱法是另一种常用的环氧乙烷残留量检验方法。
该方法的原理是通过将样品溶解在适当的溶剂中,然后使用液相色谱仪进行分离和检测。
首先,将样品与溶剂混合,然后通过色谱柱将混合物中的环氧乙烷与其他成分分离,最后通过检测器进行检测。
与气相色谱法相比,液相色谱法更加适用于高浓度环氧乙烷残留的检测。
3.气相色谱质谱联用法气相色谱质谱联用法(GC-MS)是一种更为精确和灵敏的环氧乙烷残留量检验方法。
该方法将气相色谱和质谱联用,通过色谱柱分离目标化合物,并使用质谱仪进行识别和定量。
这种方法具有较高的灵敏度和分辨率,能够准确检测和定量环氧乙烷的残留量。
4.气体分析仪法气体分析仪法是一种简单且易于操作的环氧乙烷残留量检测方法。
首先,将样品加热至一定温度,使环氧乙烷挥发;然后,使用气体分析仪对挥发出的气体进行分析,确定其中是否存在环氧乙烷。
这种方法操作简便、快速且成本低,适用于快速筛查样品中的环氧乙烷残留。
在进行环氧乙烷残留量检验时1.选择合适的检测方法,根据需要的灵敏度、分辨率和样品类型等因素进行选择。
2.样品的制备要注意避免环氧乙烷的二次污染,使用适当的溶剂和容器。
3.检测仪器的校准和质量控制要做好,确保检测结果的准确性和可靠性。
4.根据国家相关标准和法规,确定合理的残留量限值,并评估检测结果是否符合要求。
综上所述,环氧乙烷残留量检验方法多种多样,可以根据实际需要选择适合的方法进行检验。
006环氧乙烷残留量试验操作检验规程

006环氧乙烷残留量试验操作检验规程一、试验目的本试验规程的目的是为了确定环氧乙烷残留量的含量,为产品质量的控制提供准确的数据依据。
二、试验仪器与试剂1.仪器:比色计、乙烷气源、恒温水浴槽;2. 试剂:乙烷标液(浓度为5000ppm)、甲醇、苯胺、氢氧化钠。
三、试验操作步骤1.准备工作(1)确保比色计工作良好,校准仪器。
(2)准备试样,将待测物品取样10g,精确称量,并记录对应的样品编号。
(3)准备好标准品,将乙烷标液配制成浓度为500ppm的标准溶液。
2.试样处理(1)将样品置于恒温水浴槽中保持温度为50℃,放置10分钟。
(2)取出样品后,将其加入50mL锥形瓶中,加入5mL的甲醇和2g 的氢氧化钠,摇匀并密封,静置30分钟。
(3)倒掉水浴槽中的水,用清水彻底冲洗干净,确保无残留物。
3.样品测定(1)将摇匀的样品离心后,取出上清液留待用。
(2)准备对照液,取甲醇5mL,苯胺3mL加入到10mL锥形瓶中,摇匀。
(3)将样品和对照液同时吸入比色计量筒,分别加入20mL的标准溶液,摇匀后静置2分钟。
(4)使用比色计按照说明书的要求进行测定,测定吸光度并记录结果。
注:可以根据需要调整样品和对照液的比例,但必须保持标准溶液的量。
4.结果计算样品的残留量(ppm)= (样品吸光度-对照液吸光度)*标准溶液浓度*样品稀释倍数五、结果判定根据产品的质量标准要求,判定样品的残留量是否符合要求。
如果超过了规定的范围,则判定为不合格。
六、试验注意事项1.在试验过程中,操作人员需佩戴防护眼镜和手套,严禁直接接触试剂和样品。
2.比色计需要经常进行校准,以确保测量的准确性。
3.在操作中严格控制试样的温度和时间,确保取得可靠的结果。
4.所有试验操作应按照相关安全规程进行,遵守实验室安全操作规范。
以上是006环氧乙烷残留量(比色法)试验操作检验规程,供参考使用。
具体实验操作应根据实际情况进行调整和改进。
环氧乙烷残留量(比色法)试验操作检验规程

环氧乙烷残留量(比色法)试验操作检验规程1 目的本实验检测经环氧乙烷(EO)消毒灭菌后的一次性医疗器械产品在一定时间后其EO的残留量,判定该产品是否符合其企业标准或相关标准。
为了确保实验数据的准确、可靠,制定本管理操作规程。
2 范围本规定适用比色法测定EO量的实验操作。
3 量比色法原理环氧乙烷在酸性条件下水解成乙二醇,乙二醇经高碘酸氧化成甲醛,甲醛与品红-亚硫酸试液反应产生紫红色化合物,通过比色分析可求得环氧乙烷含量。
4 样本检测基本过程5. 各步操作规程:5. 1试剂配制:(以下用水均为实验用水)1) 0.lmol/L盐酸:移取9mL用水定容至1000mL;2) 0.5%高碘酸:称取高碘酸0.5g溶解于水,定容至1 OOmL;3) 1%硫代硫酸钠溶液:称取硫代硫酸钠1g溶解于水,定容至100mL;4) 10%亚硫酸钠溶液: 称取无水亚硫酸钠10.0g溶解于水,定容至100mL;5) 品红-亚硫酸溶液:称取品红O.lg, 120mL热水溶解,冷却后加入10%亚硫酸钠溶液20mL.盐酸2mL置于暗处.溶液应为无色,若发现有微红色,应重新配置。
6)乙二醇贮备液的制备:a)取50mL容量瓶加入约30mL水精确称重W1, 加入0.5mL分析纯乙二醇,精确称重W2。
两次称重之差得到所加入的乙二醇质量W, 加水至刻度,混匀。
b)乙二醇浓度计算:c=(W/50)×1000 ;7)乙二醇标准液制备:将乙二醇贮备液1:1000稀释;5.2环氧乙烷标准曲线制备:1)取六支纳氏比色管每支加入2.0ml. 0.1 mol/L的盐酸,分别加入乙二醇0mL、0.5mL、1.OmL、1.5mL、2.OmL、2.5mL;每支比色管再加入0.5%高碘酸0.4mL,室温放置1h;2)在纳氏比色管中滴加硫代硫酸幼至出现的黄色好消失为:各管中加入0.2mL品红——亚硫酸;用水稀释至10.0mL,室温放置1h;3) 560nm测定吸度值,以空白液作参比;4) 制环氧乙烷标准曲线。
环氧乙烷残留量检测方法学验证

环氧乙烷残留量检测方法学验证.目录一、目的二、背景三、范围四、组织与职责五、内容六、附件药品生产质量管理文件一、目的用气相色谱GC-2010A型气相色谱仪(含顶空器)进行环氧乙烷残留量的检测方法学的研究,证明其适用于塑料瓶环氧乙烷残留量的检测。
二、背景环氧乙烷在医疗器械及卫生用品的消毒方面应用广泛。
在药品包装材料生产领域,口服药用塑料瓶在内包装后也进行环氧乙烷灭菌。
环氧乙烷穿透性强,消毒后因被消毒材料对其吸附能力不同,其完全消散时间也不同。
残留的环氧乙烷对人体有一定的毒性,因此需要对灭菌后的塑料瓶进行环氧乙烷残留的检测。
气相色谱法是采用气体为流动相流经装有填充剂的色谱柱进行分离测定的色谱方法。
物质经气化后被载气带入色谱柱进行分离,各组分先后进入检测器,用数据处理系统记录色谱信号。
现采用顶空法来检测环氧乙烷残留。
样品在顶空器内先将环氧乙烷气化,气化后的环氧乙烷再进入气相色谱中。
顶空法的另外一个优点就是能提高检测的灵敏度。
根据《医疗器械生物学评价第7部分:环氧乙烷灭菌残留量》(ISO10993-7:2008),2/个,重量约为2.8g/个,塑料瓶约环氧乙烷残留量接受标准为<10ug/cm2。
20cm故环氧乙烷残留接受标准为小于72ug/g,为了提高使用安全性故将接受标准制定为小于10ug/g参考文献《顶空毛细管柱气相色谱法测定口服药用塑料瓶中环氧乙烷残留量》(王丹丹,浙江省食品药品检验所)中方法:检测条件为:(1)顶空器条件:炉温(OVEN TEMP):70℃样品检测时间(SAMPL INTERV):10min阀温(MANIF TEMP):80℃管道温度(TUBE TEMP):80℃平衡时间(INCUB TIME):20min(2)气相条件:色谱柱HP-INNOWAX 柱长30m,直径0.320mm,膜厚0.25μm 进样口温度:200℃柱温:70℃检测器温度:250℃三、范围本验证方案适用于GC-2010A型气相色谱仪(含顶空器)检测药用滴眼剂塑料瓶(免洗)环氧乙烷残留量的方法学验证。
环氧乙烷残留量检测方法学验证

目录一、目的二、背景三、范围四、组织与职责五、内容六、附件药品生产质量管理文件一、目的用气相色谱GC-2010A型气相色谱仪(含顶空器)进行环氧乙烷残留量的检测方法学的研究,证明其适用于塑料瓶环氧乙烷残留量的检测。
二、背景环氧乙烷在医疗器械及卫生用品的消毒方面应用广泛。
在药品包装材料生产领域,口服药用塑料瓶在内包装后也进行环氧乙烷灭菌。
环氧乙烷穿透性强,消毒后因被消毒材料对其吸附能力不同,其完全消散时间也不同。
残留的环氧乙烷对人体有一定的毒性,因此需要对灭菌后的塑料瓶进行环氧乙烷残留的检测。
气相色谱法是采用气体为流动相流经装有填充剂的色谱柱进行分离测定的色谱方法。
物质经气化后被载气带入色谱柱进行分离,各组分先后进入检测器,用数据处理系统记录色谱信号。
现采用顶空法来检测环氧乙烷残留。
样品在顶空器内先将环氧乙烷气化,气化后的环氧乙烷再进入气相色谱中。
顶空法的另外一个优点就是能提高检测的灵敏度。
根据《医疗器械生物学评价第7部分:环氧乙烷灭菌残留量》(ISO 10993-7:2008),环氧乙烷残留量接受标准为<10ug/cm2。
塑料瓶约20cm2/个,重量约为2.8g/个,故环氧乙烷残留接受标准为小于72ug/g,为了提高使用安全性故将接受标准制定为小于10ug/g 参考文献《顶空毛细管柱气相色谱法测定口服药用塑料瓶中环氧乙烷残留量》(王丹丹,浙江省食品药品检验所)中方法:检测条件为:(1)顶空器条件:炉温(OVEN TEMP):70℃样品检测时间(SAMPL INTERV):10min 阀温(MANIF TEMP):80℃管道温度(TUBE TEMP):80℃平衡时间(INCUB TIME):20min(2)气相条件:色谱柱HP-INNOWAX 柱长30m,直径0.320mm,膜厚0.25μm进样口温度:200℃柱温:70℃检测器温度:250℃三、范围本验证方案适用于GC-2010A型气相色谱仪(含顶空器)检测药用滴眼剂塑料瓶(免洗)环氧乙烷残留量的方法学验证。
环氧乙烷残留量检验方法(气相色谱法)

附件1环氧乙烷残留量检验方法(气相色谱法)采用气相色谱法检测环氧乙烷残留量,制备供试液时有两种基本的样品浸提方法:模拟使用浸提法和极限浸提法。
模拟使用浸提法是采用使浸提尽量模拟产品使用的方法。
这一模拟过程使测量的环氧乙烷残留量相当于患者使用该器械的实际环氧乙烷摄入量。
极限浸提法是指再次浸提测得的环氧乙烷的量小于首次浸提测得值的10%,或浸提到测得的累积残留量无明显增加。
供试液制备时宜在取样后制备浸提液,否则应将供试样品封于由聚四氟乙烯密封的金属容器中保存。
引用GB/T14233.1-2008中环氧乙烷残留量气相色谱法测定方法时,若未规定浸提方法,则均按照极限浸提方法进行。
1.供试液制备1.1极限浸提法取产品上与人体接触的环氧乙烷相对残留含量最高的部件两份,平行做两个试验组进行试验。
将样品截为5mm长碎块(或Iomm2片状物),取1Og放入20m1萃取容器中,精密加入5m1水。
密封,60℃+1℃温度下平衡40min o1∙2模拟使用浸提法采用模拟使用浸提法时,应在产品标准中根据产品的具体使用情况,规定在最严格的预期使用条件下的浸提方法和采集方法。
并尽量采用以下条件:a)浸提介质:用水作为浸提介质;b)浸提温度:整个或部分与人体接触的器械在37℃(人体温度)浸提,不直接与人体接触的器械在25℃(室温)浸提。
C)浸提时间:当确定浸提时间时,应考虑在推荐或预期使用最为严格的时间条件下进行。
但不短于Ih od)浸提表面:器械与药液或血液接触的表面。
2.环氧乙烷标准贮备液配制取外部干燥的50m1容量瓶加入约30m1水加瓶塞,精确称重。
用注射器注入约0.6m1有证环氧乙烷标准物质,不加瓶塞,轻轻摇匀,盖好瓶塞,称重,前后两次称重之差,即为溶液中所含环氧乙烷重量。
加水至刻度制成约含环氧乙烷IOmgZm1的溶液,作为标准贮备液。
也可采用市售有证环氧乙烷标准物质,用水逐级稀释制备系列标准溶液。
3.绘制标准曲线用贮备液配制1μg∕m1~10μg∕m1六个系列浓度的标准溶液。
环氧乙烷残留方法适用性验证方案-气相色谱软件3Q验证

密级内部公开文件编号QJYZ-7.5-02-005-2020环氧乙烷残留量检测方法适用性验证方案版本/变更B/0页数1/10********护器材(天津)有限公司环氧乙烷残留量检测方法适用性验证方案编制:岗位:理化工程师签字:日期:审核:岗位:质量主管签字:日期:批准:岗位:质量经理签字:日期:环氧乙烷残留量检测方法适用性验证方案页数2/ 101.目的:用GC-2010 pro 型气相色谱仪(含HS-20型顶空进样器)进行环氧乙烷残留量的检测方法学研究,证明其适用于口罩产品环氧乙烷残留量的检测。
2. 范围适用于GC-2010 pro 型气相色谱仪(含HS-20型顶空进样器)检测口罩产品中环氧乙烷残留量的方法学验证。
3.验证小组3.1验证团队组成验证小组姓名部门/岗位签名组长质量部/质量总监组员体系部/体系经理组员质量部/质量经理组员质量部/工程师组员质量部/检验员3.2验证团队职责小组组长:负责批准验证方案和报告。
小组成员:●质量部理化工程师负责制定验证方案和形成报告,负责组织、协调各部门和资源,保证验证的顺利进行。
确保验证中的仪器、仪表、设备等在校验期限内使用。
●体系部体系主管负责审核验证方案和报告,负责跟进验证实施情况。
●质量部质量主管负责组织人员配合验证方案的实施,并确保验证工作的实施4 确认程序4.1确认依据:●GB/T 16886.7-2015 医疗器械生物学评价第7部分环氧乙烷灭菌残留量●《中国药典》2020版四部●NTSOP-8.2-03-030 《气相色谱仪操作指导书》环氧乙烷残留量检测方法适用性验证方案页数3/ 10●GB 18279.1-2015《医疗保健产品灭菌环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》●GBT 14233.1-2008 《医用输液、输血、注射器具检验方法第1部分:化学分析方法》●YYT 0969-2017 《一次性使用医用口罩中华人民共和国药典二部》(2015版)●《高纯度氢气发生器HG-4000 操作说明书》●《GC-2010 Pro 气相色谱仪简单操作说明书》●《AR-4000 无油空气压缩机操作说明书》●《HS-20 顶空进样器操作说明书》4.2确认仪器检测条件4.2.1 HS-20 顶空进样器检测条件为:恒温炉温度:60℃样品流路温度:150℃传输线温度:150℃样品瓶恒温时间:40min样品瓶加压时间:2.00min加压平衡时间:0.10min导入时间:0.50min导入平衡时间:0.10min进样时间:1.00min进样针冲洗时间:5.00minGC循环时间:6.00min4.2.2GC-2010 Pro 气相色谱仪检测条件:色谱柱CB-WAX 柱长30m,直径0.32mm,膜厚1.0μm柱温:60℃平衡时间:3.0min环氧乙烷残留量检测方法适用性验证方案页数4/ 10进样模式:分流分流比:10.0检测器温度:200℃控制模式:线速压力:42.5kPa总流量:13.2mL/min色谱柱流量:1.2mL/min线速:23.0cm/sec采样率: 320msec结束时间: 5min延迟时间: 0.00min尾吹流量: 30.0mL/min氢气流量: 40.0mL/min空气流量: 400.0mL/minAPC2压力: 50.0kPa5 验证计划本次验证包括预确认、安装确认、运行确认和性能确认四个部分,基于产品和检测需要预确认应在安装确认前完成。
产品环氧乙烷残留气相检测方法学验证方案

产品环氧乙烷残留气相检测方法学验证方目录1. 目的 (2)2. 适用范围 (2)3. 参考文件 (2)4. 名词解释 (2)5. 接受标准 (2)6. 职责及人员要求 (3)7. 抽样计划 (3)8. 设备和试剂信息 (3)9. 试验方法 (4)10. 文件控制 (10)11. 不合格情况处理 (10)12. 过程控制和监视 (10)13. 再验证 (10)14. 附件 (10)1.目的用SP-3500系列气相色谱仪(含DK-3001A顶空进样器)进行环氧乙烷残留量的检测方法学研究,证明使用的检测参数测定环氧乙烷残留量的有效性和准确性。
2.适用范围适用于气相色谱仪(SP-3500系列)测试我司用EO灭菌的产品。
3.参考文件《医用输液、输血、注射器具检验方法第一部分:化学分析方法》(GB/T 14233.1-2008)《医疗器械生物学评价第7部分:环氧乙烷残留量》(ISO 10993-7-2008)《医疗器械生物学评价第7部分:环氧乙烷灭菌残留量》(GB∕T 16886.7-2015)《中华人民共和国药典》(2020年版四部)4.名词解释4.1 SPL:分流/不分流毛细管进样装置。
4.2 FID:氢火焰离子检测器。
4.3 信噪比:指电子系统中信号与噪声的比例。
4.4 线性范围:是指利用一种方法取得精密度、准确度均符合要求的试验结果,而且成线性的供试物浓度的变化范围。
4.5 重复性:是用本方法在正常和正确操作情况下,由同一操作人员,在同一实验室内,使用同一仪器,并在短期内,对相同试样所做多个单次测试结果。
4.6 回收率:是指往待测样品中加入一定量的已知标准溶液,进行一系列处理后,得到的工作曲线和标准曲线比。
4.7方法检测限:指某一分析方法在给定的可靠程度内可以从样品检测待见物质的最小浓度或最小量。
所谓检测是指定性检测,即断定样品中确定存在有浓度高于空白的待定物质。
4.8 定量限:是指样品中被定量测定的最低值,其检测结果应具有一定的准确度。
(完整版)环氧乙烷残留量检测方法学验证

目录一、目的二、背景三、范围四、组织与职责五、内容六、一、目的用气相色谱GC-2010A型气相色谱仪(含顶空器)进行环氧乙烷残留量的检测方法学的研究,证明其适用于塑料瓶环氧乙烷残留量的检测。
二、背景环氧乙烷在医疗器械及卫生用品的消毒方面应用广泛。
在药品包装材料生产领域,口服药用塑料瓶在内包装后也进行环氧乙烷灭菌。
环氧乙烷穿透性强,消毒后因被消毒材料对其吸附能力不同,其完全消散时间也不同。
残留的环氧乙烷对人体有一定的毒性,因此需要对灭菌后的塑料瓶进行环氧乙烷残留的检测。
物质经气现采用),环氧浙江(1(2柱温:70℃检测器温度:250℃三、范围本验证方案适用于GC-2010A型气相色谱仪(含顶空器)检测药用滴眼剂塑料瓶(免洗)环氧乙烷残留量的方法学验证。
四、组织及职责五、内容1 系统适应性试验色谱系统的适应性试验包括理论板数(n)和拖尾因子(T)。
1)、色谱柱的理论板数(n):用于评价色谱柱的分离效果。
在检测中的测定物质为环氧乙烷,其理论板数不得小于4000。
2)、拖尾系数(T):用于评价色谱峰的对称性。
为保证分离效果和测量精度,环氧乙烷峰的拖尾系数应不得大于1.5。
对照品溶液的制备取100ml容量瓶,加入约20ml的纯化水,后取环氧乙烷标准品1ml加入到20ml的纯化水中溶、2专属性化水+3检测限4线性、1.25ug/ml5 准确度5ml回回收率(%)= 通过峰面积计算环氧乙烷标准品溶液实际浓度(以3次的平均值计)×100% 环氧乙烷标准品溶液的理论浓度6 精密度1)重复性取5ml环氧乙烷标准品溶液2.5ug/ml置于顶空瓶中,重复进样6个,计算RSD,RSD应小于3%。
2)中间精密度取5ml环氧乙烷标准品溶液2.5ug/ml,置于顶空专用瓶中,按上述方法测定环氧乙烷浓度,由不同人员,不同时间共计完成3次检测,每次检测制备3个样品作为平行,并计算RSD。
7 耐用性考察关键参数随机变动因素对结果的影响,如,顶空条件中炉温±3℃,气相色谱条件中柱温±3℃。
环氧乙烷残留量检测

支持性文件编号:
环氧乙烷(EO)残留量检测方法
1.试验目的
检测一次性医疗器材经环氧乙烷消毒后环氧乙烷的残留量,判定是否符合国家标准规定。
2.试验原理
环氧乙烷在酸性条件下水解成乙二醇,乙二醇经高碘酸氧化生成甲醛,甲醛与品红-亚硫酸试液反应产生紫红色化合物,通过比色分析可求得环氧乙烷的含量。
6.试验步骤
6.1取5支纳氏比色管,分别加入0.1mol/L盐酸ml,再精确加入ml、ml、ml、
ml、ml乙二醇标准溶液,再另取一支纳氏比色管,精确加入0.1mol/L盐酸溶液ml作为空白对照。
6.2分别在上述各管中加入高碘酸溶液ml,摇匀,放置1h。然后分别滴加硫代硫酸钠溶液至出现的黄色恰好消失。再分别加入品红-亚硫酸试液ml,用蒸馏水稀释成ml,摇匀,35℃~37℃条件下放置1h,测量560nm波长处的吸光度,空白液做参比溶液,绘制吸光度-体积标准曲线。
3.试验仪器及试剂
移液管,容量瓶(50ml,100ml,1000ml),量筒,烧杯,分析天平,滴管,分光光度计,纳氏比色管
0.1mol/L盐酸溶液,5g/碘酸溶液,10g/L硫代硫酸钠,100g/L亚硫酸钠溶液,品红-亚硫酸试液,乙二醇标准储备液,蒸馏水
4.试剂的配制
0.1mol/L盐酸溶液:取ml盐酸稀释至ml
乙二醇标准储备液:取一个外部干燥、清洁的ml容量瓶,加水约ml,精确称重。精确量取ml乙二醇,迅速加入瓶中,摇匀后,精确称重。两次称重之差即为溶液中所含乙二醇的重量,加水稀释至刻度,混匀。乙二醇的浓度为:
5.供试液制备
供试液的制备采用极限浸提法,取整个样品或样品上有代表性的部位,截为mm长的碎块,称取1.0g置于烧杯中,加入0.1mol/L盐酸溶液ml,室温放置1h,作为供试液。
环氧乙烷残留量的测定

结果计算 ——相对含量
六、结果计算 计算样品中环氧乙烷相对含量: CEO=1.775VC1×103 式中:CEO --------单位产品中环氧乙烷相对含量,μg/L V --------标准曲线上找出的供试液相应的体积,mL C1 --------乙二醇标准溶液浓度,g/L
结果计算 ——(容器类)绝对含量
8 结果计算 环氧乙烷残留量用绝对含量或相对
结果计算 ——绝对含量
六、结果计算 环氧乙烷残留量用绝对含量或相对含量表示: WEO=1.775VC1m 式中:WEO --------单位产品中环氧乙烷绝对含量,mg V --------标准曲线上找出的供试液相应的体积,mL C1 ---------乙二醇标准溶液浓度,g/L m --------单位产品的质量,g
溶液配制
三、溶液配制 • 0.1mol/L盐酸:取9mL盐酸稀释至1000mL。 • 高碘酸溶液(5g/L):称取高碘酸0.5g,溶于水,稀释至100mL。 • 硫代硫酸钠溶液(10g/L):称取硫代硫酸钠1.0g,溶于水,稀 释至100mL。 • 亚硫酸钠溶液(100g/L):称取10.0g无水亚硫酸钠,溶于水, 稀释至100mL。 • 品红-亚硫酸试液:称取0.1g碱性品红,加入120mL热水溶解, 冷却后加入10%亚硫酸钠溶液20mL、盐酸2mL,置于暗处。试 液应无色,若发现有微红色,应重新配置。
气相色谱法
• 3.3 根据不同浓度的标准溶液对应的峰高
(或面积) ,绘制峰高(或面积) -浓度 标准曲线。
• 3.4 取样品适量,配制成样品试样,同法测
定峰高(或面积) ,以测得的峰高(或面积) 从标准曲线上查得相应的标准溶液的浓度。
• 3.5 根据公式,计算出环氧乙烷残留量。
环氧乙烷残留方法适用性验证方案-气相色谱软件3Q验证

密级内部公开文件编号QJYZ-7.5-02-005-2020环氧乙烷残留量检测方法适用性验证方案版本/变更B/0页数1/10********护器材(天津)有限公司环氧乙烷残留量检测方法适用性验证方案编制:岗位:理化工程师签字:日期:审核:岗位:质量主管签字:日期:批准:岗位:质量经理签字:日期:环氧乙烷残留量检测方法适用性验证方案页数2/ 101.目的:用GC-2010 pro 型气相色谱仪(含HS-20型顶空进样器)进行环氧乙烷残留量的检测方法学研究,证明其适用于口罩产品环氧乙烷残留量的检测。
2. 范围适用于GC-2010 pro 型气相色谱仪(含HS-20型顶空进样器)检测口罩产品中环氧乙烷残留量的方法学验证。
3.验证小组3.1验证团队组成验证小组姓名部门/岗位签名组长质量部/质量总监组员体系部/体系经理组员质量部/质量经理组员质量部/工程师组员质量部/检验员3.2验证团队职责小组组长:负责批准验证方案和报告。
小组成员:●质量部理化工程师负责制定验证方案和形成报告,负责组织、协调各部门和资源,保证验证的顺利进行。
确保验证中的仪器、仪表、设备等在校验期限内使用。
●体系部体系主管负责审核验证方案和报告,负责跟进验证实施情况。
●质量部质量主管负责组织人员配合验证方案的实施,并确保验证工作的实施4 确认程序4.1确认依据:●GB/T 16886.7-2015 医疗器械生物学评价第7部分环氧乙烷灭菌残留量●《中国药典》2020版四部●NTSOP-8.2-03-030 《气相色谱仪操作指导书》环氧乙烷残留量检测方法适用性验证方案页数3/ 10●GB 18279.1-2015《医疗保健产品灭菌环氧乙烷第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求》●GBT 14233.1-2008 《医用输液、输血、注射器具检验方法第1部分:化学分析方法》●YYT 0969-2017 《一次性使用医用口罩中华人民共和国药典二部》(2015版)●《高纯度氢气发生器HG-4000 操作说明书》●《GC-2010 Pro 气相色谱仪简单操作说明书》●《AR-4000 无油空气压缩机操作说明书》●《HS-20 顶空进样器操作说明书》4.2确认仪器检测条件4.2.1 HS-20 顶空进样器检测条件为:恒温炉温度:60℃样品流路温度:150℃传输线温度:150℃样品瓶恒温时间:40min样品瓶加压时间:2.00min加压平衡时间:0.10min导入时间:0.50min导入平衡时间:0.10min进样时间:1.00min进样针冲洗时间:5.00minGC循环时间:6.00min4.2.2GC-2010 Pro 气相色谱仪检测条件:色谱柱CB-WAX 柱长30m,直径0.32mm,膜厚1.0μm柱温:60℃平衡时间:3.0min环氧乙烷残留量检测方法适用性验证方案页数4/ 10进样模式:分流分流比:10.0检测器温度:200℃控制模式:线速压力:42.5kPa总流量:13.2mL/min色谱柱流量:1.2mL/min线速:23.0cm/sec采样率: 320msec结束时间: 5min延迟时间: 0.00min尾吹流量: 30.0mL/min氢气流量: 40.0mL/min空气流量: 400.0mL/minAPC2压力: 50.0kPa5 验证计划本次验证包括预确认、安装确认、运行确认和性能确认四个部分,基于产品和检测需要预确认应在安装确认前完成。
环氧乙烷残留验证

环氧乙烷灭菌残留量检测验证1.目的对成品环氧乙烷灭菌残留量进行测定验证,确保产品质量。
2.适用范围本公司成品出厂前的环氧乙烷残留量检验。
3.无菌物品存放要求室内温度用空调机调节,保持室温在18~28℃,湿度45%~65%。
无菌物品储存的环境形成一个相对的独立区域,严格控制人员流动。
物品置于阴凉干燥、通风良好的物架上;物架应离地面大于10cm、离墙大于5cm、离顶大于50cm。
4.验证内容产品环氧乙烷灭菌24小时后每隔24小时检测一次,直至≤10 ug/g判断合格后。
4.1利用环氧乙烷在酸性条件下水解成乙二醇,乙二醇经高碘酸氧化生成甲醛,甲醛与品红-亚硫酸试液反应产生紫红色化合物,通过比色分析可求得环氧乙烷含量的原理来检测产品环氧乙烷的残留量。
4.2溶液配制a) 0.1mol/L盐酸:取9mL盐酸稀释至1000ml。
b) 0.5%高碘酸溶液:称取高碘酸0.5g,稀释至100ml。
c) 硫代硫酸钠溶液:称取硫代硫酸钠1g,稀释至100ml。
d) 10%亚硫酸钠试液:称取10.0g无水亚硫酸钠,溶解后稀释至100Ml。
e) 品红-亚硫酸试液:称取0.1g品红,加入120ml热水溶解,冷却后加入10%亚硫酸钠溶液20ml,盐酸2mL置于暗处。
试液应无色,若发现有微红色,应重新配制。
f)乙二醇标准贮备液:取一外部干燥、清洁的50mL容量瓶,加水约30mL,精确称重。
移取0.5mL乙二醇,迅速加入瓶中,摇匀,精确称重。
两次称重之差即为溶液中所含的重量,加水至刻度,混匀,按式计算其浓度:c=W×1000 50式中:c——乙二醇标准贮备液浓度,g/L;W——溶液中乙二醇重量,g。
乙二醇标准溶液(浓度c1= c×10-3 ):精确移取标准贮备液1.0Ml ,用水稀释至1000Ml。
4.3 试液制备4.3.1试液制备应在取样后立即进行,否则应将试样密封于容器中保存备用。
4.3.2将试样截取5mm长碎块,称取2.0g置于容器中,加0.1mol/L盐酸10Ml,室温放置1h。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精心整理目录
一、目的
二、背景
三、
范围
组织与职责
五、内容
六、附件
四、
精心整理
一、目的
用气相色谱GC-2010A 型气相色谱仪(含顶空器)进行环氧乙烷残留量的检测方法学的研究,
证明其适用于塑料瓶环氧乙烷残留量的检测。
背景
环氧乙烷在医疗器械及卫生用品的消毒方面应用广泛。
在药品包装材料生产领域,口服药用塑
料瓶在内包装后也进行环氧乙烷灭菌。
环氧乙烷穿透性强,消毒后因被消毒材料对其吸附能力不同,
其完全消散时间也不同。
残留的环氧乙烷对人体有一定的毒性,因此需要对灭菌后的塑料瓶进行环
氧乙烷残留的检测。
气相色谱法是采用气体为流动相流经装有填充剂的色谱柱进行分离测定的色谱方法。
物质经气化后被载气带入色谱柱进行分离,各组分先后进入检测器,用数据处理系统记录色谱信号。
现采用顶空法来检测环氧乙烷残留。
样品在顶空器内先将环氧乙烷气化,气化后的环氧乙烷再进入气相色
谱中。
顶空法的另外一个优点就是能提高检测的灵敏度。
根据《医疗器械生物学评价第7 部分:环氧乙烷灭菌残留量》(ISO10993-7:2008),环氧乙烷残留量接受标准为<10ug/cm2。
塑料瓶约20cm2/个,重量约为2.8g/个,故环氧乙烷残留接受标准为小于72ug/g,为了提高使用安全性故将接受标准制定为小于10ug/g
参考文献《顶空毛细管柱气相色谱法测定口服药用塑料瓶中环氧乙烷残留量》王丹丹,浙江
省食品药品检验所)中方法:
检测条件为:
1)顶空器条件:炉温(OVENTEM)P:70℃样品检测时间(SAMPLINTER)V:
10min
阀温( MANIFTEM)P:
80℃
管道温度(TUBETEM)P:
80℃
平衡时间(INCUBTIME):
20min
2)气相条件:色谱柱HP-INNOWA柱X长30m,直径0.320mm,膜厚0.25
μm
进样口温度:200℃
柱温:70℃
检测器温度:250℃
三、范围
本验证方案适用于GC-2010A 型气相色谱仪(含顶空器)检测药用滴眼剂塑料瓶(免洗)环氧乙
烷残留量的方法学验证。
四、组织及职责
五、内容
1系统适应性试验
色谱系统的适应性试验包括理论板数(n)和拖尾因子(T)。
1)、色谱柱的理论板数(n):用于评价色谱柱的分离效果。
在检测中的测定物质为环氧乙烷,其理论板数
不得小于4000。
2)、拖尾系数(T):用于评价色谱峰的对称性。
为保证分离效果和测量精度,环氧乙烷峰的拖
尾系数应不得大于1.5。
对照品溶液的制备
取100ml容量瓶,加入约20ml 的纯化水,后取环氧乙烷标准品1ml 加入到20ml 的纯化水中溶解,加纯化水至100ml 充分溶解并用纯化水将标准品稀释到10ug/ml、5ug/ml、2.5ug/ml、1.25ug/ml、0.62ug/ml、
0.31ug/ml、0.16ug/ml、0.08ug/ml。
2专属性
在上述的色谱条件下,分别进样5ml 纯化水、环氧乙烷标准品、环氧乙烷标准品+塑料瓶、纯
化水+塑料瓶。
其图谱在环氧乙烷峰附近不应有杂峰的干扰影响。
3检测限
取环氧乙烷标准品溶液10ug/ml 连续对倍稀释后取5ml 置于顶空瓶中进行环氧乙烷残留量检
测,直到其峰型不可辨别,此时环氧乙烷浓度为该方法的检测限。
4 线性
将环氧乙烷标准品溶液对倍稀释成的系列浓度的标准溶液5 个,10ug/ml、5ug/ml、2.5ug/ml、1.25ug/ml、
0.62ug/ml,分别取5ml 置于顶空瓶中,按气相色谱法测定。
以峰面积为横坐标,对照品浓度为纵坐
标,绘制标准曲线,并求曲线相关系数R,R 应大于0.99。
5准确度
取一整个塑料瓶,剪碎后置于顶空专用瓶中,共准备9个,其中3个分别加入5ml 高浓度环氧乙烷标准品溶液5ug/ml,3 个分别加入5ml 中浓度环氧乙烷标准品溶液2.5ug/ml,3 个分别加入5ml 低浓度环氧乙烷标准品溶液1.25ug/ml,按上述方法测定环氧乙烷浓度,计算加样回收率。
回收率
应满足80%~120%之间。
通过峰面积计算环氧乙烷标准品溶液实际浓度(以 3 次的平均值计)
回收率(%)= × 100%
环氧乙烷标准品溶液的理论浓度
6精密度
1)重复性
取5ml 环氧乙烷标准品溶液2.5ug/ml 置于顶空瓶中,重复进样6 个,计算RSD,RSD 应小于3%。
2)中间精密度
取5ml 环氧乙烷标准品溶液2.5ug/ml ,置于顶空专用瓶中,按上述方法测定环氧乙烷浓度,由不同人员,不同时间共计完成3次检测,每次检测制备3 个样品作为平行,并计算RSD。
7耐用性
考察关键参数随机变动因素对结果的影响,如,顶空条件中炉温± 3℃,气相色谱条件中柱温± 3℃取5ml 环氧乙烷标准品溶液2.5ug/ml ,置于顶空专用瓶中按上述各个条件测定环氧乙烷浓度。
六、附件
1、使用仪器:
3、系统适应性试验:
操作人:复核人:日期:日期:
4、专属性
溶液配制:
操作人:复核人:日期:日期:
5、检测限
溶液配制:
操作人:复核人:
日期:日期:
6、线性
溶液配制:
以峰面积为横坐标,浓度为纵坐标曲线,并求曲线相关系数R
方程为:相关系数R 为:
操作人:复核人:
日期:日期:
7、准确度溶液配制:标准曲线:
以峰面积为横坐标,浓度为纵坐标曲线,并求曲线相关系数R
标准曲线为:相关系数R:
操作人:复核人:
日期:日期:
精心整理
准确度(回收率):
计算过程:
操作人:复核人:
日期:日期:
8、精密度
8.1重复性
操作人:复核人:日期:日期:
8.2中间精密度
精心整理
日期:日期:9、耐用性
日期:日期:。
