临床试验信息登记表医疗器械
临床试验相关仪器设备检查记录表
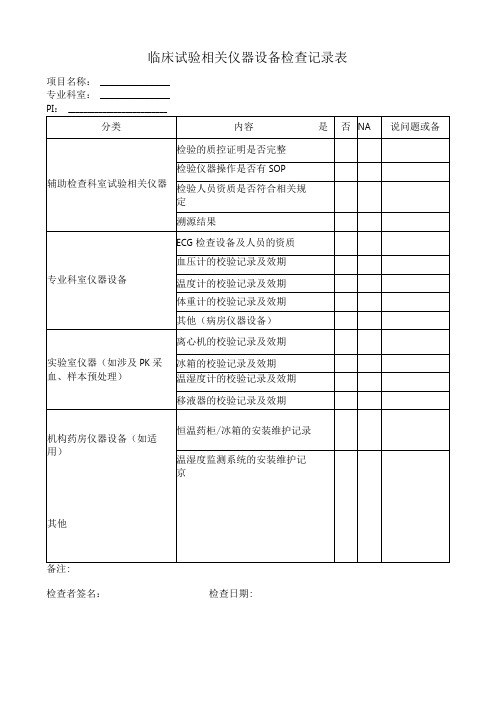
离心机的校验记录及效期
冰箱的校验记录及效期
温湿度计的校验记录及效期
移液器的校验记录及效期
机构药房仪器设备(如适用)
恒温药柜/冰箱的安装维护记录
温湿度监测系统的安装维护记京
其他
备注:
检查者签名:检查日期:
临床试验相关仪器设备检查记录表
项目名称:
专业科室:
PI:
分类
内容
是
否
NA说问题ຫໍສະໝຸດ 备辅助检查科室试验相关仪器
检验的质控证明是否完整
检验仪器操作是否有SOP
检验人员资质是否符合相关规定
溯源结果
专业科室仪器设备
ECG检查设备及人员的资质
血压计的校验记录及效期
温度计的校验记录及效期
体重计的校验记录及效期
其他(病房仪器设备)
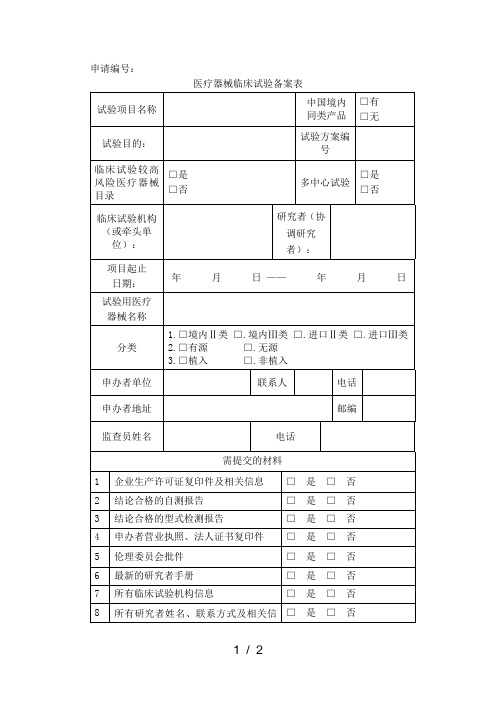
医疗器械临床试验备案表
医疗器械临床试验备案表
试验项目名称
中国境内同类产品
□有
□无
试验目的:
试验方案编号
临床试验较高风险医疗器械目录
□是
□否
多中心试验
□是
□否
临床试验机构(起止
日期:
年月日——年月日
试验用医疗
器械名称
分类
1.□境内Ⅱ类 □.境内Ⅲ类 □.进口Ⅱ类 □.进口Ⅲ类 2.□有源 □.无源 3.□植入 □.非植入
□ 是 □ 否
8
所有研究者姓名、联系方式及相关信息
□ 是 □ 否
9
监查员姓名、联系方式及相关信息
□ 是 □ 否
10
项目概要说明
□ 是 □ 否
11
SFDA批件(适用时)
□ 是 □ 否
12
申办者保证所提供资料真实性的声明
□ 是 □ 否
申请人签名:
年 月 日
备案号:
经办人签名:
年 月 日
申办者单位
联系人
电话
申办者地址
邮编
监查员姓名
电话
需提交的材料
1
企业生产许可证复印件及相关信息
□ 是 □ 否
2
结论合格的自测报告
□ 是 □ 否
3
结论合格的型式检测报告
□ 是 □ 否
4
申办者营业执照、法人证书复印件
□ 是 □ 否
5
伦理委员会批件
□ 是 □ 否
6
最新的研究者手册
□ 是 □ 否
7
所有临床试验机构信息
药物临床试验项目信息登记表

是否有更新/更新内容/更新日期
知情同意书版本号/版本日期
是否有更新/更新内容/更新日期
手册,eCRF等版本号/版本日期
是否有更新/更新内容/更新日期
盲态/是否揭盲
试验设计例数
本专业承担合同例数
首次伦理批准时间
启动时间
首例筛选时间
筛选/入组/完成/脱落剔除
最后一例出组时间
严重不良事件
药物临床试验项目信息登记表
填表日期:年月日
临床试验项目编号
临床试验项目名称
试验药物中文名称/试验器械名称
进口试验药物英文名称
注册分类
临床研究分期
是否涉及遗传办递交
剂型
规格
研制单位
申办者
CRO
新药临床研员/电话
是否组长单位
是否国际多中心
组长单位/大P1
进展情况
合同费用交付情况
医疗器械临床试验病例报告表样表说明模板

医疗器械临床试验病例报告表样表医疗器械临床试验病例报告表
试验项目名称
受试者病例号:□□□□□
试验用医疗器械编号:□□□
临床试验机构(或编号):□□
临床试验方案编号和日期(修改编号和日期若有)试验开始日期年月日
跟踪结束日期年月日
记录人签名:
填表说明
1.请用钢笔或签字笔填写,字迹应清晰,易于辨认。
2.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容及修改原因,由研究者签名并注明日期。
不得用任何方式(橡皮、涂改液等)涂抹原记录。
一、受试者病历简况
1、入组日期年月日
2、受试者姓名
3、出生日期年月
4、性别□1.男□2.女
5、临床诊断
6、接受的诊断/治疗方式(既往用药和/或手术)
7、入组前基础症状
8、入组时实验室检查
二、符合纳入/排除标准
三、诊断/治疗情况记录
四、一般情况观察记录
五、不良事件记录表
六、试验结论
七、声明
此病例报告表中的信息记录真实、准确,符合试验方案的要求,特此声明。
研究者签名:
年月日
监查与检查记录粘贴处
奥咨达小编提醒你,
快捷医疗器械注-册、zi询、各国ren-证、体系、临-床试验等一条龙高质量服务,服-务超过2600家企业,技术过硬,成功率高。
报jia?快来问问奥咨达客fu吧!。
临床试验信息登记表(医疗器械)

CRA:姓名/联系电话/邮箱
CRC:姓名/联系电话/邮箱
PI:姓名/联系电话/邮箱
Sub-I:姓名/联系电话/邮箱
(若启动前监查员与启动时监查员不是同一人,请分别提供联系方式及简历。)
监查计划
次/月;天/次
申办方或受委托的CRO代表签字/日期
主要研究者签字/日期
临床试验信息登记表(医疗器械)
专业名称
主要研究者
Sub-I
申办方
CRO
试验名称
方案编号
申办方信息
角色
公司名称
公司类型
注册地点
是否为北京生物医药产业跨越发展工程(北京G20)入选企业
注册申请人
申办方
生产商
CRO
中心实验室
SMO
(如已确定)
人类遗传资源批件
□需要□不需要
项目基本信息
审批形式
□备案□临床试验批件
□第二住院部
□第三住院部
□男科中心
□药理所
□Ⅰ期临床试验研究室
受试者来源
□门诊患者
□住院患者
□住院患者+门诊随访
□健康人
试验用器械基本信息
医疗器械
中文名
医疗器械
英文名
医疗器械
代号
医疗器械
商品名
目标人群
□创新医疗器械□应急审批程序医疗器械□其他
联络信息及监查计划
联络信息
申办方项目经理:姓名/联系电话/邮箱
批件号/日期
国产或进口
□国产□进口
境外已上市
□是□否
管理分类
□一类□二类□三类
研究中心
数量
组长单位
医疗器械临床试验项目基本情况登记表

第1页 / 共1页
医疗器械临床试验项目基本情况登记表
项目名称:
注册分类:□第二类医疗器械
□第三类医疗器械【需CFDA 批件□否□是,批件号:】仪器名称:
型号:
方案总例数:
拟承接例数:
承接科室:主要研究者:联系电话:
入组截至日期:试验观察周期:随访次数:
检查费用:□申办者提供□受试者自费□其他检查费用约:元/例
受试者补贴:□元/例□无备注:
初拟观察费:元/例是否聘请CRC □是□否
申办者:联系人:
注册地址:联系方式:
CRO: 监查员:
注册地址:联系方式:
其他参加单位及联系方式:
其他:
涉及外资单位需人类遗传办批件□是□否。
医疗器械临床试验登记表
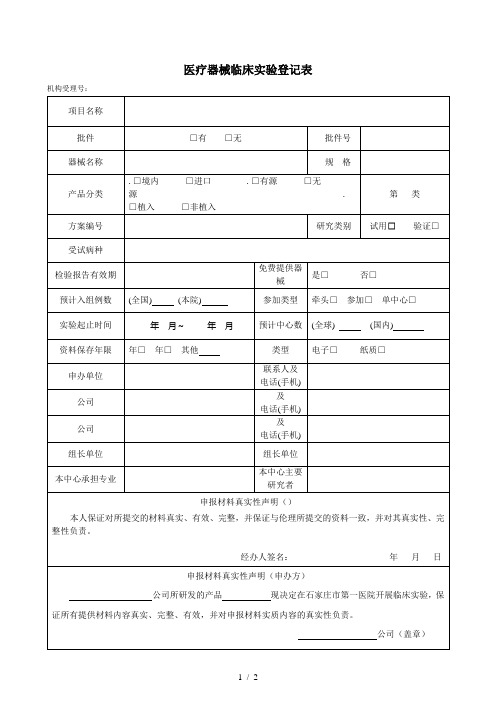
公司(盖章)
研究团队成员:
姓名
职称
项目分工
是否获得证书
签名
联系电话
主要研究者声明
本人自觉接受国家有关法律和法规的约束,对该项目的所有临床研究资料及相关内容保密,保护受试者权益及隐私,并郑重承诺与该项目无任何利益冲突。
资料保存年限
年□年□其他
类型
电子□纸质□
申办单位
联系人及
电话(手机)
公司
及
电话(手机)
公司
及
电话(手机)
组长单位
组长单位
本中心承担专业
本中心主要研究者
申报材料真实性声明()
本人保证对所提交的材料真实、有效、完整,并保证与伦理所提交的资料一致,并对其真实性、完整性负责。
经办人签名:年月日
申报材料真实性声明(申办方)
本人已审阅所有临床实验资料,认为本科室的人员配备、病源量和设备条件满足该项目实验要求,团队成员有充分的时间、并保证在约定时间内入组完成实验。本人同意并确认上述人员参加该临床实验。
主要研究者签字:年月日
(此由机构填写)
机构意见:经形式审查资料合格。
审查人签字:年月日
注:.团队成员中必须授权有项目质控训。
.机构登记表正反面打印。
.所有选择项目的“□”内用“×”标注
医疗器械临床实验登记表
机构受理号:
项目名称
批件
□有□无
批件号
器械名称
规格
产品分类
.□境内□进口.□有源□无源.□植入□非植入
第类
方案编号
医疗器械临床试验申请表医疗器械临床试验申请表

递交人签名及日期:
机构办接收人签名及日期:
机构办主任初审意见:
盖红章
15
医疗器械及对照品临床试验须知/使用说明书(如有)
盖红章
16
试验医疗渊械标签文本
盖红章
17
试验医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明
盖红章
18
16.1申办者营业执照
盖红章
16.2CRO(如有)营业执照及申办者对CRO的授权委托书
盖红章
16.3申办者/CRO对CRA的委托书
8
8.1知情同意书(版本号/日期)
盖红章
8.2其他提供给受试者的书面材料
盖红章
9
受试者保险的相关文件(若有)
ห้องสมุดไป่ตู้盖红章
IO
研究者手册(版本号/日期)
盖红章
11
病例报告表文本(版本号/日期)
盖红章
12
招募受试者和向其宣传的程序性文件(若有)
盖红章
13
基于产品技术要求的产品检验报告
盖红章
14
临床前研究相关资料
试验设计总例数:例本机构拟承担例数:例
预期试验期限:
试验用医疗器械是否免费:口否□是检查是否免费:□是口否口NA
受试者补助:口否,口是(口交通补助口采血补偿口其它)
数据处理人员:口委托专业医学统计人员统计口由经过统计培训的研究者统计数据统计单位:
申办者:
申办者PM姓名/电话/邮箱:
CRO:
CROPM姓名/电话/邮箱:
3.3研究者简历
4
研究者经济利益声明
5
5.1国家药品监督管理总局批件(被列入需进行临床试验审批的第三类医疗器械目录的渊械提供)(盖章)
医疗器械(体外诊断试剂)临床试验申请表

□其他
剂型
规格
批号
有效期
试验用数量
是否赠送
□是□否
是否进口注册
□是,进口许可证批号:□否
临床分期
□Ⅰ期□Ⅱ期□Ⅲ期□Ⅳ期□生物等效性
研究所需病例数
试验组例
对照组例
我院承担病例数
试验设计
□开放□单盲□双盲□双盲双模拟
□平行设计□交叉设计
□对照□非对照
□随机□非随机
□优效性□非劣性□等效性
8.组长单位伦理委员会批件(如适用)□有效□无效
9.其他
签名:
年月日
四、专ห้องสมุดไป่ตู้负责人审阅意见:
根据申办者申请,已审阅所有临床试验前相关资料,同意在本专业进行临床试验。在临床试验全过程中,我将严格执行国家食品药品监督管理局颁发的“药物临床试验质量管理规范”,客观、真实提供试验数据,充分保障受试者合法权益,并按GCP要求保存试验资料。按时完成临床试验任务。
医疗器械(体外诊断试剂)临床试验申请表
一、医疗器械(体外诊断试剂)临床试验概况
临床试验名称
申办者/CRO
监查员
联系电话
本机构参加形式
□独立□负责□参加
若为参加单位,请填写组长单位:
承担专业
专业负责人
主要研究者
试验类型
□药品中文名英文名商品名
□器械中文名英文名商品名
新药类别/分类
□化药类□中药、天然药物类
□医疗器械(诊断试剂)质量检查报告
□临床试验方案
□知情同意书包括患者须知
□研究小组成员名单
□病例报告表
□(组长单位)伦理委员会批件
□病人日记和其他向受试者提供的书面材料
临床试验器械使用记录表

临床试验器械使用记录表是一种用于记录临床试验中使用的器械的表格。
该表格通常包括以下内容:
器械名称:记录使用的器械的名称、型号和规格等信息。
生产厂家:记录器械的生产厂家或供应商信息。
使用数量:记录在临床试验中使用的器械数量。
使用日期:记录器械使用的日期。
受试者编号:记录受试者的唯一标识号。
管理员签字:由负责管理器械的人员签字确认。
受试者签字:由受试者或其监护人签字确认。
使用记录:详细记录器械的使用情况,包括使用时间、使用方式、使用效果等。
异常情况记录:记录在器械使用过程中出现的异常情况,如器械损坏、故障等。
器械回收/归还情况:记录器械的回收/归还情况,包括回收/归还日期、数量等信息。
临床试验器械使用记录表的作用是确保临床试验中使用的器械得到规范管理,保证试验结果的准确性和可靠性。
通过记录器械的使用情况,可以避免因器械问题导致的误差和偏差,提高试验的质量和可信度。
同时,该表格也有助于对临床试验数据进行追溯和审查,确保试验过程的合规性和合法性。
医疗器械临床试验申请表模板
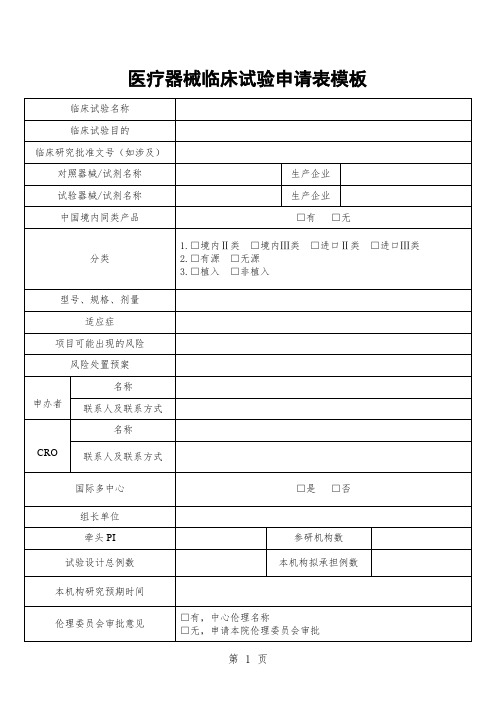
联系人及联系方式
CRO
名称
联系人及联系方式
国际多中心
□是 □否
组长单位
牵头PI
参承担例数
本机构研究预期时间
伦理委员会审批意见
□有,中心伦理名称
□无,申请本院伦理委员会审批
该研究方案是否被其他机构拒绝/否决/暂停/终止过?
□是,原因:
□否
报送资料列表
□注册产品标准或国家、行业标准
医疗器械临床试验申请表模板
临床试验名称
临床试验目的
临床研究批准文号(如涉及)
对照器械/试剂名称
生产企业
试验器械/试剂名称
生产企业
中国境内同类产品
□有 □无
分类
1.□境内Ⅱ类 □境内Ⅲ类 □进口Ⅱ类 □进口Ⅲ类
2.□有源 □无源
3.□植入 □非植入
型号、规格、剂量
适应症
项目可能出现的风险
风险处置预案
申办者
□国家药品监督管理部门批件(如有)
□申办者资质证明文件
□CRO资质证明文件
□产品自测报告
□结论合格的产品型式检验报告
□临床试验方案摘要
□临床试验方案草案
□研究者手册
□人类遗传资源审批/备案事项确认表
其他:
拟申请专业
申请人签名: 日期:
临床试验机构回执:
□ 受理,机构受理号:
□ 不予受理,原因:
机构受理人签名: 日期:
临床试验立项前信息表【模板】

请填写下列内容
试验名称*
试验用器械/试剂名称*
适应证*
分类*
境内有无同类产品:□有□无
境内:
□Ⅱ类□需要进行CFDA临床试验审批的Ⅲ类
□不需进行CFDA临床试验审批的Ⅲ类
境外:
□Ⅱ类□需要进行CFDA临床试验审批的Ⅲ类
□不需进行CFDA临床试验审批的Ⅲ类
本中心
*
组长单位*
组长单位
主要研究者*
计划入组例数
每例研究经费
试验计划
起止日期
年月日----年月日
申办者*
CRO公司
(如适用)*
项目联系人*
职务*
联系电话*
邮箱*
下列内容由机构办公室填写
专业是否承接过同类医疗器械的临床试验:□是□否
专业正在开展项或已完成项同类医疗器械的临床试验
回复意见
经办人
日期
试验编号
立项日期
【备注】:(1)请附试验方案摘要。
(2)标“*”项为必填项,请填写完整。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专业名称
主要研究者
Sub-I
申办方
CRO
试验名称
方案编号
申办方信息
角色
公司名称
公司类型
注册地点
是否为北京生物医药产业跨越发展工程(北京G20)入选企业
注册申请人
申办方
生产商
CRO
中心实验室
SMO
(如已确定)
人类遗传资源批件
□需要□不需要
项目基本信息
审批形式
□备案□临床试验批件
□第二住院部
□第三住院部
□男科中心
□药理所
□Ⅰ期临床试验研究室
受试者来源
□门诊患者
□住院患者
□住院患者+门诊随访
□健康人
试验用器械基本信息
医疗器械
中文名
医疗器械
英文名
医疗器械
代号
医疗器械
商品名
目标人群
□创新医疗器械□应急审批程序医疗器械□其他
联络信息及监查计划
联络信息
申办方项目经理:姓名/联系电话/邮箱
CRO项目经理:姓名/联系电话/邮箱
CRA:姓名/联系电话/邮箱
CRC:姓名/联系电话/邮箱
PI:姓名/联系电话/邮箱
Sub-I:姓名/联系电话/邮箱
(若启动前监查员与启动时监查员不是同一人,请分别提供联系方式及简历。)
监查计划
次/月;天/次
申办方或受委托的CRO代表签字/日期
主要研究者签字/日期
批件号/日期
国产或进口
□国产□进口
境外已上市
□是□否
管理分类
□一类□二类□三类
研究中心
数量
组长单位
组长单位
主要研究者
计划入组例数
全球例;中国区例;本中例。
试验方法
□随机□非随机□其他
□开放□单盲□双盲□其他
□阳性对照□安慰剂对照□单臂□其他
试验周期
期中分析
□无□有,节点为
项目开展地点
□门诊□急诊
□第一住院部
