除去粗盐中的可溶性杂质
粗盐提纯(除去其中可溶性杂质)

MgCl2 除去Na2SO4 MgCl2
Na2SO4
BaCl2
除去CaCl2、 BaCl2
NaCl MgCl2 Na2CO3
除去MgCl2
(3)过量 NaOH、过滤
NaCl
(5) 加热蒸发 除去HCl
NaCl HCl
(4)过量
HCl
NaCl
除去Na2CO3、 NaOH
NaOH
Na2CO3
NaCl CaCl2 MgCl2 Na2SO4
3.如果不过滤会造成什么结果? 如果不过滤,那么 Mg(OH)2、 CaCO3、 BaCO3和HCl反应,生成了MgCl2、 CaCl2、 BaCl2。
NaCl NaOH Na2CO3
化学实验
(4)过 量HCl
除去过量Na2CO3、
NaOH
NaCl HCl
Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑ HCl + NaOH ==== NaCl +H2O
化学除杂
除杂原则: *不增(尽量不引入新杂质) *不减(尽量不减少所需物质) *易分(容易分离——生成完全不溶物或气体) *复原(把杂质变成所需物质)
注意:除杂试剂要适当过量;过量试剂要除尽; 设计所加试剂的先后顺序!
化学实验
NaCl CaCl2
NaCl
(1)过量
(2)过量
BaCl2
CaCl2 Na2CO3
代替NaOH,理由是____________
5. 某KNO3溶液中含杂质KCl、K2SO4和 Ca(NO3)2,现欲除去杂质,得到纯净的 KNO3溶液,则加入试剂的正确顺序是
( CD )
A.Ba(NO3)2、K2CO3、AgNO3、HNO3 B.K2CO3、Ba(NO3)2、AgNO3、HNO3 C.Ba(NO3)2、AgNO3、K2CO3、HNO3 D.AgNO3、Ba(NO3)2、K2CO3、HNO3
化学实验基本方法除去粗盐中的可溶性杂质

实验原理
01
02
03
04
05
粗盐中含有泥沙等不溶性 杂质以及可溶性杂质,如 氯化镁、氯化钙等。
不溶性杂质可以通过溶解 、过滤的方法除去。
可溶性杂质可以通过加入 试剂转化为沉淀或气体而 除去,如加入氢氧化钠溶 液可以除去氯化镁,加入 碳酸钠溶液可以除去氯化 钙。
用于溶解粗盐和进行沉淀反应。
漏斗和滤纸
用于过滤不溶性杂质和沉淀物。
铁架台和铁圈
用于支撑漏斗进行过滤操作。
pH试纸或pH计
用于检测溶液的pH值,确保杂质 被完全去除。
酒精灯和石棉网
用于加热溶液,促进沉淀的生成 和溶解。
玻璃棒
用于搅拌溶液和引流操作。
03
实验步骤与方法
粗盐溶解与过滤
溶解
将粗盐逐渐加入盛有蒸馏水的烧 杯中,边加边用玻璃棒搅拌,直 加到粗盐不再溶解为止。
结晶
利用余热将溶液蒸干,得到纯净的食盐晶体。
04
实验结果与数据分析
粗盐中可溶性杂质含量测定
测定方法
通过化学分析方法,如滴定法、比色法等,对粗盐 中的可溶性杂质进行含量测定。
测定结果
根据实验数据,得出粗盐中可溶性杂质的含量,通 常以质量百分比表示。
结果分析
将测定结果与标准值或理论值进行比较,分析粗盐 中可溶性杂质的种类和含量是否符合要求。
能够准确称量和配制所需药品 ,并控制药品的用量和浓度。
能够独立完成实验,并对实验 过程中出现的问题进行及时分 析和解决。
拓展应用:其他可溶性杂质的去除方法
01
沉淀法
通过加入适当的沉淀剂,使杂质形成不溶性的沉淀物而分离出来。例如,
专题四 粗盐中难溶性杂质、可溶性杂质的去除

(1)称量:称量粗盐应用托盘天平,按“左物右码”的原则,粗盐和砝码 下应垫质量相同的称量纸。 (2)溶解:将粗盐加入烧杯中,再用量筒量取一定量的水,倒入烧杯中。 用___玻_璃__棒_____不断搅拌,直至粗盐不再溶解为止。 (3)过滤:将烧杯中的液体沿玻璃棒倒入过滤器进行过滤,若滤液仍浑 浊,应___重__新_过__滤_____。 【特别提醒】过滤后滤液仍然浑浊的原因:①滤纸破损;②过滤时液面高于 滤纸边缘;③承接滤液的烧杯不干净。
(5)他们用提纯得到的精盐配制了100 g 10%的氯化钠溶液。经检测溶质质 量分数偏小,其原因可能有____①_②__③____(填序号)。
①氯化钠固体仍然不纯 ②称量精盐时砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
(6)进行过滤操作时,出现过滤后的溶液仍然浑浊,则可能的原因是 ________滤__纸_破__损__;__过__滤_时__液__面__高__于_滤__纸__边__缘__(写两条);为得到澄清的溶 液,应_____重_新__过__滤___。
(5)在第⑦步操作之前,滤液中除了含有NaCl,还含有过量的Na2CO3和NaOH, 所以向滤液中滴加足量盐酸的目的是除去过量的Na2CO3和NaOH。 (6)第⑧步操作是蒸发结晶,蒸发时,玻璃棒要不断搅拌,防止因局部温 度过高造成液滴飞溅。
回顾目标:
• 1.记住粗盐提纯的步骤、仪器及注意事项; • 2.通过复习粗盐中的可溶性杂质的去除,会选择除杂试剂、理解
除杂顺序、知道除杂试剂的作用、会分析滤渣的成分; • 3.通过复习,能熟练书写相关化学方程式。
_2_H_C_l_+__N_a_2_C_O_3_=_=_=_=_2_N_aC_l_+__H_2_O_+__C_O_2_↑__ _H_C_l_+__N_a_O_H_=_=_=_=_N_a_C_l_+__H_2O_
中考化学第二轮专题复习课件:专题十五粗盐中可溶性杂质的去除(共29页)

3. 为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣 小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流 程进行实验探究。
(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是__玻__璃__棒__。 (2)写出一个加入Na2CO3溶液时所产生反应的化学方程式。 Na2CO3+CaCl2=== CaCO3↓+2NaCl
(3)步骤⑤是向饱和溶液中通入足量的气体,反应最终得到碳酸氢钠(在 该溶液中难溶)和一种氮肥,写出该反应的化学方程式。 NaCl+NH3+CO2+H2O=== NaHCO3↓+ NH4Cl
(1)写出X溶液中溶质的化学式。 Ba(OH)2
(2)请设计实验证明溶液B中含有NaOH(简要写出实验步骤和现象)。 答:取少量溶液B于试管中,加入过量的CaCl2或BaCl2等溶液,静置, 取上层清液滴加酚酞溶液,若溶液变红,则说明含有NaOH。 (3)最后制得氯化钠的质量大于粗盐中 氯化钠的质量,写出一个可使氯化钠 质量增加的化学方程式。 Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
11. 从海水中得到的粗盐中往往含有可溶性杂质(主要含有Na2SO4、 MgCl2、CaCl2)和不溶性杂质(泥沙等),某化学兴趣小组的同学设计 了如下实验方案来提纯NaCl。
(1)蒸发NaCl溶液时,当蒸发皿中 _出__现__较__多__固__体_时,停止加热,利用 余热将其蒸干。 (2)操作①加入的试剂为过量的NaOH 溶液,写出②和③的操作内容。 答:操作②为加入过量的BaCl2溶液,操作③为加入过量的Na2CO3溶液。 (3)若加入稀盐酸时不慎过量,则对后续步骤是否有影响并说明理由。 答:没有影响,因为盐酸具有挥发性,过量的稀盐酸在后续蒸发结晶中 会被除去。
如何除去粗盐中含有的可溶性杂质氯化钙
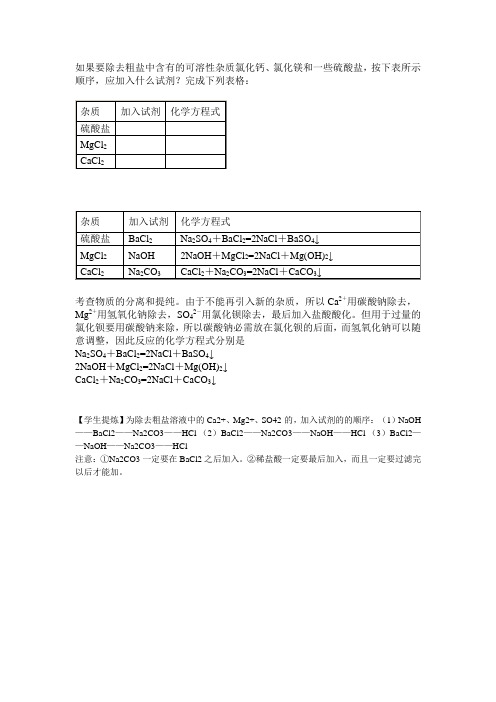
如果要除去粗盐中含有的可溶性杂质氯化钙、氯化镁和一些硫酸盐,按下表所示顺序,应加入什么试剂?完成下列表格:
考查物质的分离和提纯。
由于不能再引入新的杂质,所以Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。
但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此反应的化学方程式分别是
Na2SO4+BaCl2=2NaCl+BaSO4↓
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
CaCl2+Na2CO3=2NaCl+CaCO3↓
【学生提炼】为除去粗盐溶液中的Ca2+、Mg2+、SO42-的,加入试剂的的顺序:(1)NaOH ——BaCl2——Na2CO3——HCl (2)BaCl2——Na2CO3——NaOH——HCl (3)BaCl2——NaOH——Na2CO3——HCl
注意:①Na2CO3一定要在BaCl2之后加入。
②稀盐酸一定要最后加入,而且一定要过滤完以后才能加。
粗盐中可溶性杂质的去除方法

3、粗盐中CaCL 、MgC 2、N Q SO 杂质去除步骤1、 加入过量的NaOH 溶液。
【目的:除去 MgC 2。
】2、 加入过量的BaCl 2溶液。
【目的:除去NaSO 。
】3、 加入过量的NaCO 溶液。
【目的:除去 CaCb 与多余的 BaCb 。
】4、 过滤。
【目的:过滤出 Mg(OH 2、BaSOX CaCO BaCQ 】5、 加入过量稀盐酸。
【目的:除去多余的 NaOH 与多余的 NaCO 。
】6、蒸发结晶。
【要点】1、 加氢氧化钠与加氯化钡的顺序可以调换。
2、 加氯化钡与加碳酸钠的顺序不能颠倒。
3、 加盐酸前先过滤。
专项训练1、粗盐中含有MgCl2、CaCl 2等杂质,必须进行分离和提纯后才能用于工业生产和人们的 日常生活•粗盐提纯的部分流程如下图:请回答:(1) 步骤②加入过量的碳酸钠溶液的目的是反应的化学方程式为 _________________________________________ (2) 步骤④加入适量盐酸的目的是 __________________________ (3) 若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有2、通过海水提取的粗盐中含有 MgC 2、CaC b 、MgSO 以及泥沙等杂质。
以下是一种制备 精盐的实验方案(用于沉淀的试剂均过量)宦址 藩制T MG] 丫 屁OH,过谨4、请回答下列问题:加入违重 的盎顫________ 7(填化学式).下列说法不正确的是()A .氯化钠是由氯化钠分子构成的litSU样品 操作I过猱'5、 (1)步骤①中的BaCb 不能改成Ba(NO )2,其原因是什么(2) 进行步骤①后,如何判断 BaCl 2是否过量(3) 加入N Q CO 的目的是什么(4) 以上粗盐提纯的有关操作中需用到的主要仪器有哪些(5) 该实验方案还需完善,请写出具体的操作步骤。
_3、 粗盐中含有一定的杂质如 MgCl 2、CaCl 2和硫酸盐,现在想除掉这些杂质,请选择合适 的试剂除杂.(1) 除去Na 2SO 4,应加入 ,化学方程式(2) 除去MgCl 2,应加入 ,化学方程式(3)除去CaCl 2,应加入 ,化学方程式(4) 过滤,所得滤液中除了 NaCI 还含有 杂质,要除去这种杂质得到精致的NaCI 溶液应向滤液中加入至。
专题08 粗盐中可溶性杂质的去除(专练)中考化学二轮复习专项备考宝典(全国通用)(解析版)

粗盐中可溶性杂质的去除专题练习1.下图是去除粗盐中难溶性杂质的实验操作,其中正确的是A.取粗盐B.溶解C.过滤D.蒸发【答案】B【解析】A、取用药品瓶塞倒放,以免沾染杂质污染试剂,故图示操作错误;B、溶解使用玻璃棒搅拌,故图示操作正确;C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,故图示操作错误;D、正在加热的蒸发皿温度较高,为防止烫伤手,不能用手直接拿热的蒸发皿,应用坩埚钳夹取,故图示操作错误。
故选B。
2.为除去粗盐水中的MgCl2杂质,某同学设计的实验方案如下:在该粗盐水中加入过量的氢氧化钠溶液;充分反应后过滤,向滤液中加入适量盐酸。
(1)过滤操作中使用的玻璃仪器有烧杯、玻璃棒和______。
(2)写出加入NaOH溶液后所发生反应的化学方程式______。
(3)若将滤液在空气中敞口放置一段时间,则所得滤液中一定含有的溶质是______。
【答案】(1)漏斗(2)MgCl2+2NaOH=Mg(OH)2↓+2NaCl(3)NaCl、Na2CO3【解析】(1)过滤操作中使用的玻璃仪器有烧杯、玻璃棒和漏斗;(2)NaOH溶液与氯化镁反应生成氢氧化镁沉淀和氯化钠,所以加入NaOH溶液后所发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;(3)因为在该粗盐水中加入过量的氢氧化钠溶液,所以滤液中含有NaOH,NaOH能与空气中的二氧化碳反应生成碳酸钠、水,故所得滤液中一定含有的溶质是Na2CO3及生成的NaCl。
3.除去NaCl溶液中CaCl2、MgSO4杂质,得到NaCl晶体的操作有①加过量Ba(OH)2溶液:②加过量Na2CO3溶液:③过滤:④加适量稀盐酸:⑤蒸发结晶。
(1)操作③中用到的玻璃仪器有烧杯、漏斗和_______。
(2)写出加入Na2CO3溶液发生反应的化学方程式________。
(写一个化学方程式即可)试卷第2页,共14页(3)加适量稀盐酸的目的是________。
粗盐提纯(除去粗盐中的可溶性杂质) 教学设计

粗盐提纯(除去粗盐中的可溶性杂质)一、教学目标2-,并进一步知道如何选择试剂。
1.知道用什么试剂可以分别除去溶液中的Ca2+、Mg2+、SO42.知道除去可溶性杂质时,所加试剂一般要过量,过量的试剂也要在后续实验中除去。
3.在加入两种或两种以上的试剂除杂时,知道如何考虑试剂加入的先后顺序。
4.通过“除去粗盐中可溶性杂质实验方案”的讨论,知道除去混合物中杂质的一般思路是:明确所要除去的物质—→确定反应原理—→分析干扰物质—→排除干扰物质—→加入除杂试剂。
当有多种杂质时,要综合分析确定杂质除去的顺序、试剂加入的顺序、试剂的用量、试剂过量后的处理等问题。
5. 体会自主学习、探究学习、合作学习的乐趣。
二、教学对象分析学生的能力分析通过之前化学的学习,大部分学生已经知道在物质的除杂过程中不能引入新的杂质。
2-的检验的学习,大部分学生已经基本学会了如何根据溶解性表选择试通过上一节课CO3剂检验离子。
学生的认知方式分析经过新课的学习,学生知道了一些自主学习、探究学习、合作学习的方法,但如何在学习过程中进行自主学习、探究学习、合作学习,仍是一个有待解决的问题。
三、教材分析1.教材内容的联系这部分知识,既涉及元素化合物知识,又涉及实验技能型知识,我认为主要还是元素化合物知识为主。
由于刚刚学习了粗盐中的难溶性杂质可以用过滤这种物理的方法除去,不过得到的盐还是不纯,还含有可溶性杂质,这些可溶性杂质又该如何除去呢?可以说,无论书上有没有这个问题,其实都是教师和学生此时不得不考虑和面对的问题。
而且它是在学生经过初中化学的学习,已经有了物质的检验和提纯的基础知识(尽管很少)和刚刚学习了CO32-的检验和除去粗盐中的泥沙这两个实验之后进行的学习,因此学生已经大致知道如何选择试剂来检验物质和除杂,也知道杂质转化为沉淀之后要过滤除去。
而通过对这个问题的讨论,为学生全面地考虑物质除杂时试剂的选择、试剂的加入顺序以及实验操作的选择都是一次很好的锻炼。
粗盐提纯去除可溶性杂质

应用Powerpoint制作技巧 提高教学课件质量
软件简介
• Powerpoint是一款办公软件。它功能强大, 文字与图片、声音、录像、动画的排版变化灵 活,主要用于制作各种演示幻灯片,适用于演 讲、教学等场合。
例子导入
• 内容相同但制作方法不同的演示
普通制作型
课件制作型
提示:“结束放映”可返 回
当堂检测
1、知识回顾 (试剂选择要分清、过量原则要记清、滴加顺序要 摸清)。
2、根据所学知识完善思维导图。 3、书写《说明与检测》上册、下册,关于粗盐提 纯的习题并对比中考试题,找出相似性。 4、我的题库:设计关于粗盐提纯的中考题,自拟 试题,小组共享。
洗去心中杂念,用一颗纯洁的心奋力拼搏, 努力创造幸福完整的学习生活。---中考寄语
常用的还有柱状图表
6.课件的声音
• 声音文件的格式常规使用wav 推荐用mp3
• 声音的截取及格式转换推荐用解霸软件 • 可用音乐作为文稿背景音乐
例如:
7.课件的影片
• 影片的文件格式推荐用MPG或AVI • 影片的截取及格式转换推荐用解霸软件 • 把PPT课件和影片文件一起放进一个文件夹内 • 课件重点或难点可用影片辅助教学;在特殊场合
1、除杂本质——利用离子共存原理去除NaCl中的 Ca2+、Mg2+、SO42-等离子
2、易错点:(1)操作顺序混乱 (2)前后干扰考虑不全
需要熟知的不能共存的离子对
Ba2+
CO32- H+
SO42-
Ca2+
OH-
Cl- Ag+
Mg2+
试剂选择是核心,滴加顺序是关键。 所选试剂要过量,溶质成分须掂量。
粗盐中可溶性杂质的去除

粗盐中可溶性杂质的去除
粗盐中不但有可溶性杂质,还有氯化镁、氯化钙、硫酸钠等可溶性杂质,在医疗上常要用到纯度较高的氯化钠,这需要除去粗盐中的可溶性杂质,需要加入相应的化学试剂,进行一系列实验操作。
根据上述方案,回答下列问题:
(1)操作①中玻璃棒的作用是。
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、、。
(4)实验中加入“Na2CO3溶液”的目的是。
(5)利用提供的沉淀试剂,再写出一种添加试剂的操作顺序(填序号):。
解析:(1)溶解过程中玻璃棒的作用是加速粗盐的溶解;过滤操作中玻璃棒的作用是引流。
(2)把沉淀和液体分离的方法是过滤。
(3)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、酒精灯、蒸发皿。
(4)加入“Na2CO3溶液”的作用是沉淀出钡离子和钙离子。
(5)②③④三种试剂的加入可以除去相应的杂质离子,加过量氯化钡可除尽硫酸根离子,加过量氢氧化钠可除尽镁离子,加过量碳酸钠可除尽钙离子,过量的氢氧化钠与碳酸钠可加适量的盐酸除去,但过量的氯化钡无法用盐酸除去,可将碳酸钠的添加放在加氯化钡之后,这样既可除去钙离子,又能除去过量的氯化钡。
答案:(1)加速粗盐的溶解(2)过滤(3)酒精灯、蒸发皿(4)除去CaCl2和过量的BaCl2 (5)③②④或②④③
【方法提炼】
温馨提示:
①操作中加入过量药品的目的是将杂质除净。
②过量的碳酸钠溶液既可除去粗盐中的钙离子,也可除去过量的钡离子,因此,加入药品时,碳酸钠溶液须在氯化钡溶液之后添加。
③试剂加完后,过滤,滤液中加稀盐酸至溶液pH为7即可。
专题08 粗盐中可溶性杂质的去除(课件)-2023年中考化学二轮复习(全国通用)

中考链接
9.(2022·河南)食盐(主要成分是氯化钠)除可用作调味品外,还是一 种重要 化工原料。晾晒海水所得的粗盐中含有不溶性杂质(泥沙)和 可溶性杂质(CaCl2、MgCl2、Na2SO4)。下图是某化学小组在实验室对
(3)
粗盐样品进行除杂、提纯的过程。
①溶解、过滤、蒸发操作中都需要用到的一种玻璃仪器为_玻__璃__棒___(填 “烧杯”、“漏斗” 或“玻璃棒”)。
Na2CO3和NaOH
中考链接
7.为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴 趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按 以下流程进行实验探究。
(1)溶解,过滤、蒸发操作中都要用到的一种玻璃仪器是 玻璃棒 。 (2)写出一个加入Na2CO3溶液时所发生反应的化学方程式。
中考链接
考点二:试剂的作用
1.每种试剂的作用是什么?(重点考查Na2CO3、HCl) 除去......
2.上述过程中发生了__6___个__复__分__解__反应(类型)。 产生沉淀的反应有__4___个。
中考链接
考点三:试剂添加和操作顺序
1.先钡(BaCl2)后碳(Na2CO3) 两者顺序颠倒的后果: 过量的氯化钡无法除去
NaCl 溶液
蒸发 精 操作③ 盐
NaCl
NaOH
Na2CO3
Mg(OH) 2↓ BaSO4↓ CaCO3↓ BaCO3↓
中考链接
考点一:实验操作及仪器作用
1.操作①、②、③的名称是什么? ①溶解②过滤③蒸发 2.三个操作中都用到同一种玻璃仪器_玻__璃__棒__,该仪器在③中作用是?
不断搅拌,防止局部温度过高,造成液滴飞溅。
3.最终得到精盐中的氯化钠可能比原粗盐中含有的氯化钠要多,原因? 反应生成了氯化钠
专题粗盐中可溶性杂质的去除

环保领域
随着环保意识的提高,粗盐中可溶 性杂质的去除技术将在污水处理、 废弃物资源化利用等环保领域得到 更广泛的应用。
医药领域
粗盐中可溶性杂质的去除技术有望 在医药领域得到应用,例如在药物 制备过程中去除杂质,提高药物纯 度。
专题粗盐中可溶性杂质 的去除
目 录
• 粗盐中可溶性杂质概述 • 粗盐中可溶性杂质的来源 • 粗盐中可溶性杂质的去除方法 • 粗盐中可溶性杂质去除的实验研究 • 粗盐中可溶性杂质去除的实际应用 • 粗盐中可溶性杂质去除的未来展望
粗盐中可溶性杂质概
01
述
可溶性杂质的种类
氯化镁(MgCl2)
粗盐中常见的可溶性杂质,通常以离子形式 存在。
原理
利用离子交换剂的离子交换作用,将粗盐中的可溶性杂质离子与离子 交换剂中的可交换离子进行交换,从而达到去除杂质的目的。
应用
适用于去除粗盐中含量较低的杂质离子,如铁离子、铜离子等。
优点
去除效果好,不会引入新的杂质。
缺点
操作复杂,需要定期更换离子交换剂,成本较高。
膜分离法
利用半透膜的选择透过性,使不同大小的分子或离子 通过半透膜进行分离。在粗盐中可溶性杂质的去除中,
将粗盐溶解于蒸馏水中,用滤纸过滤 去除不溶性杂质,然后将溶液放入离 心机中分离可溶性杂质,最后用电子 天平称量分离出的可溶性杂质。
实验结果与分析
结果
实验分离出的可溶性杂质质量为 0.32g,占粗盐质量的1.2%。
分析
实验结果表明,粗盐中可溶性杂质的 质量分数较低,但这些杂质的存在会 影响粗盐的纯度和质量。因此,去除 粗盐中可溶性杂质是必要的。
粗盐的可溶性杂质的去除

溶液
Mg2+
NaOH
Ca2+
Na2CO3
溶液
溶液
BaSO4↓ Mg(OH)2↓ CaCO3↓
为了能完全除去杂质离子,加入的除杂试剂必须要过量
对于引入的新的杂质离子:
Ba2+
OH-
CO32BaCO3↓
HCl
2、分别利用什么反应除去杂质?
MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl
食 盐 水
NaCl MgCl2 CaCl2 Na2SO4 BaSO4↓
过量BaCl2
NaCl MgCl2 CaCl2 过量NaOH
BaSO4↓
Mg(OH)2↓
NaCl
BaCl2
CaCl2
BaCl2 NaOH
纯净NaCl固体
蒸 发 结 晶
BaSO4↓
Mg(OH)2↓ CaCO3↓ BaCO3↓ NaCl
CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl
Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl
Na2CO3+BaCl2 = BaCO3↓ + 2NaCl NaOH + HCl == NaCl + H2O Na2CO3+2HCl==2NaCl+ H2O + CO2↑
3、加入试剂的顺序
同时除去CaCl2和BaCl2。
最后加入盐酸除去CO32-、OH- 。
小结
(一)粗盐提纯
除去可溶性杂质(SO42- Ca2+ Mg2+ )的方法 (1)加入过量的氯化钡(除去硫酸根离子) (2)加入过量的碳酸钠(除去钡离子和钙离子) (3)加入过量的氢氧化钠(除去镁离子) (4)过滤(除去硫酸钡、碳酸钡、碳酸钙、氢氧 化镁沉淀) (5)向滤液中加入适量的稀盐酸(除去过量的碳 酸钠和氢氧化钠) (6)蒸发结晶
粗盐可溶杂质的除杂

3. 将过滤后的溶液倒入蒸发 皿中,用酒精灯加热,蒸发水 分,直至有大量晶体析出。
4. 用玻璃棒将晶体搅拌均匀 ,晾干后即可得到纯净的食盐
。
实验结果分析
• 通过实验,我们成功地除去了粗盐中的可溶性杂质,得到了较为纯净的食盐。在实验过程中,我们需要注意控制加热时间 和温度,避免食盐晶体因过热而分解。同时,在实验结束后,我们需要清洗并整理实验器材,保持实验室的整洁。
实验结果误差分析
1
在分析实验结果时,应考虑到各种可能影响实验 结果的因素,如试剂纯度、实验环境、操作误差 等。
2
对于实验结果的不确定度进行分析,可以采用统 计学方法计算标准偏差和置信区间等参数。
3
对于实验结果偏离预期的情况,应进行深入分析, 找出原因并采取相应措施,以提高实验结果的准 确性和可靠性。
粗盐可溶杂质的除杂
• 粗盐可溶杂质概述 • 粗盐可溶杂质的去除方法 • 粗盐可溶杂质去除的实验操作 • 粗盐可溶杂质去除的注意事项 • 粗盐可溶杂质去除的应用
目录
01
粗盐可溶杂质概述
粗盐可溶杂硫酸镁等,主 要来源于原盐中含有的杂 质。
氯化物
如氯化钙、氯化镁等,也 是常见的可溶性杂质。
实验操作规范
在进行粗盐可溶杂质去除实验前,应先熟悉实验原理、 操作步骤和注意事项。
在分离和纯化粗盐可溶杂质时,应按照实验步骤逐步进 行,不要省略或跳过任何步骤。
实验操作过程中要严格控制反应条件,如温度、pH值 和时间等,以保证实验结果的准确性和可靠性。
实验操作过程中应及时记录实验数据和现象,以便于分 析和总结实验结果。
化学沉淀法
总结词
通过向盐溶液中加入化学试剂,使可溶杂质转化为沉淀物,再将其分离的方法。
除去粗盐中的可溶性杂质课件

矿物混入
在粗盐的生产过程中,可 能会混入一些矿物,如石 灰石等,这些矿物会分解 成可溶性杂质。
02
粗盐中可溶性杂质去除的方法
沉淀法
沉淀法是一种通过向粗盐溶液中加入沉淀剂,使杂质离子转化为沉淀物,然后通 过过滤将沉淀物与溶液分离的方法。常用的沉淀剂包括氯化钡、碳酸钠、氢氧化 钙等。
沉淀法的优点是操作简单、成本低,适用于去除粗盐中含量较高的可溶性杂质。 但该方法可能会引入新的杂质,如钡离子、钙离子等。
离子交换法
离子交换法是一种通过离子交换剂与粗盐溶液中的可溶性 杂质离子进行交换,从而将杂质离子去除的方法。常用的 离子交换剂包括磺化煤、活性炭等。
离子交换法的优点是能够去除粗盐中含量较低的可溶性杂 质,且不会引入新的杂质。但该方法操作较复杂、成本较 高,且需要定期更换离子交换剂。
03
实验操作步骤
除去粗盐中的可溶性杂质课件
contents
目录
• 粗盐中可溶性杂质的种类和来源 • 粗盐中可溶性杂质去除的方法 • 实验操作步骤 • 实验注意事项 • 实验结果展示和讨论
01
粗盐中可溶性杂质的种类和来源
粗盐中可溶性杂质的种类
01
02
03
硫酸盐
如硫酸钠、硫酸钙等,由 于在粗盐的来源中,如海 水、盐湖等天然盐水中含 有一定量的硫酸盐。
对去除效果的影响。
实验原理探讨
02
结合实验结果,深入探讨粗盐中可溶性杂质的去除原理,帮助
学生理解实验过程和原理。
误差分析
03
分析实验过程中可能存在的误差来源,如试剂不纯、操作不规
范等,并提出减小误差的方法。
对实验的反思和改进建议
反思实验操作
回顾实验过程,反思实验操作中存在的问题和不足之处,并提出 改进措施。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ca2+
SO42Mg2+ Ba2+ SO42Na+ Ba2+
Ca2+
Mg2+
Cl-
Cl-
Na+
(2)除去Mg2+:加入过量NaOH溶液 MgCl2+NaOH=2NaCl+Mg(OH)2↓
OH-
Ca2+ Ba2+ ClBa2+ Mg2+ Na+ Mg2+ OH OHCl-
Ca2+ OHNa+
(3)除去Ca2+ 、Ba2+ :加入过量Na2CO3溶液 CaCl2+Na2CO3=2NaCl+CaCO3↓
BaCl2+Na2CO3=2NaCl+BaCO3↓
CO32-
Ca2+ Ba2+ Cl-
CO32-
OHNa+ Ba2+
CO32-
OHCa2+
CO32-
Cl-
Na+
除去OH- 、CO32- :加入适量的盐酸,将溶液 的pH调为7。 2HCl+Na2CO3=2NaCl+H2O+CO2↑ 2HCl+NaOH=2NaCl+H2O
可溶性杂质的除法: (1)原则:“除杂不加杂” (2)方法:加入化学试剂,让杂质离子转化为气体、沉淀 或水除去。 (3)步骤:①溶解②加入试剂③过滤④蒸发
除去食盐中的可溶性杂质
除去难溶性杂质后的食盐水中还含有SO42-、Ca2+、 Mg2+等杂质离子,如何除去这些可溶性杂质呢?我们可以 利用化学方法将它们一一除去。 (1)除去SO42-:加入过量BaCl2溶液 BaCl2+Na2SO4=2NaCl+BaSO4↓
H2O + CO2↑
Cl-
Na+
得到的精盐水,最后经蒸发结晶即得到较为纯净的氯化钠晶体。
