只有排在H前面的金属才能置换出酸里的氢 (20)
记化学价的口诀

记化学价的口诀一价氢、氯、钾、钠、银,二价氧、钡、钙、镁、锌,三铝、四硅、五价磷,二三铁、二四碳、二四六硫都齐全,铜汞二价最常见。
一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷常用元素化合价歌:一价氢、锂、钠、钾、银,二价氧、镁、钙、钡、锌,铜、汞一、二,铁二、三,碳、锡、铅在二、四寻,硫为负二和四、六,负三到五氮和磷,卤素负一、一、三、五、七,三价记住硼、铝、金。
一价钾钠氯氢银二价氧钙钡镁锌三铝四硅五氮磷二三铁,二四碳二四六硫都齐全铜汞二价最常见一价氢氯钾钠银二价氧钙钡镁锌二四六硫二四碳三铝四硅五氮磷铁有二三要分清莫忘单质都为零铜汞二价最常见正价负价要分清负一硝酸氢氧根负二硫酸碳酸根负三记住磷酸根正一价的是铵根化学方程式一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg + O2 点燃 2MgO2.铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43.铜在空气中受热:2Cu + O2 加热 2CuO4.铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35.氢气中空气中燃烧:2H2 + O2 点燃 2H2O6.红磷在空气中燃烧:4P + 5O2 点燃 2P2O57.硫粉在空气中燃烧: S + O2 点燃 SO2 8.碳在氧气中充分燃烧:C + O2 点燃 CO29.碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O二.几个分解反应:13.水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14.加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15.加热氯酸钾(有少量的二氧化锰):2KC lO3 ==== 2KCl + 3O2 ↑16.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17.碳酸不稳定而分解:H2CO3 === H2O + CO2↑18.高温煅烧石灰石:CaCO3高温CaO + CO2↑三.几个氧化还原反应:19.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 20.木炭还原氧化铜:C+ 2CuO高温2Cu + CO2↑21.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22.焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23.一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO224.一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225.一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)26.锌和稀硫酸反应:Zn + H2SO4 === ZnSO4 + H2↑27.铁和稀硫酸反应:Fe + H2SO4 === FeSO4 + H2↑28.镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑29.铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑30.锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑31.铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑32.镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑33.铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg (3)碱性氧化物 +酸 -------- 盐 + 水37.氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39.氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl (7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4 66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl 67.氢氧化钠与氯化镁:2N aOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl 68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.生石灰溶于水:CaO + H2O === Ca(OH)2 74.氧化钠溶于水:Na2O + H2O ==== 2NaOH76. 硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4·5H2O锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑21、铁和盐酸:Fe+2HCl=FeCl2+H2↑22、铁和稀硫酸:Fe+H2SO4= FeSO4+H2↑23、氢气还原氧化铜:H2+CuO=△=Cu+H2O24、木炭还原氧化铜:C+2CuO=高温=2Cu+CO2↑25、碳还原氧化铁:3C+2Fe2O3=高温=4Fe+3CO2↑26、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO427、铜和硝酸汞溶液:Cu+Hg (NO3)2=Hg+Cu(NO3)228、氢气还原氧化铁:3H2+Fe2O3=△=2Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2 (SO4)3+3H2↑30、钠和水反应:2Na+2H2O=2NaOH+H2↑(四)复分解反应31、大理石和稀盐酸(实验室制CO2):CaCO3+ 2HCl=CaCl2+H2O+CO2↑32、氢氧化钠和硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO433、碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑34、碳酸钾(草木灰)和盐酸:K2CO3+2HCl=2KCl+H2O+CO2↑35、盐酸和氢氧化钠(中和反应):HCl+NaOH=NaCl+H2O36、硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O37、硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl38、盐酸与硝酸银溶液:HCl+AgNO3=AgCl↓(白)+HNO339、氢氧化钠和氯化铁溶液:3NaOH+FeCl3=Fe(OH)3↓(红褐色)+3NaCl40、碳酸钡和稀硝酸:BaCO3+2HNO3=Ba(NO3)2+ CO2↑+H2O41、硫酸钠和氯化钡:Na2SO4+BaCl2=BaSO4↓+2NaCl42、氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+ NaNO343、碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH44、氢氧化铝和盐酸:Al(OH)3+3HCl=AlCl3 +3H2O45、硝酸铵和氢氧化钠:NH4NO3+NaOH=△=NaNO3+H2O+NH3↑46、氢氧化铁和硫酸:2Fe(OH)3+3H2SO4=Fe2 (SO4)347、盐酸除铁锈:Fe2O3+6HCl=2FeCl3+3H2O48、氧化铜和硫酸:CuO+H2SO4=CuSO4+H2O(五)其他:49、二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O50、二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+ H2O51、用氢氧化钠溶液吸收二氧化硫:SO2+2NaOH=Na2SO3+H2O52、一氧化碳还原氧化铜:CO+CuO=△=Cu+CO253、一氧化碳还原氧化铁(炼铁):3CO+Fe2O3=高温=2Fe+3CO254、甲烷在空气中燃烧:CH4+2O2=点燃=CO2+2H2O55、乙醇在空气中燃烧:C2H5OH+3O2=点燃=2CO2+3H2O56、甲醇在空气中燃烧:2CH3OH+3O2=点燃=2CO2+4H2OⅡ、金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au———————————————————————→金属活动性由强逐渐减弱小结:1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来二、溶液的酸碱度——pH石蕊试液红紫蓝—————————————————————————————酚酞试液无无红0 1 2 3 4 5 6 7 8 9 10 11 12 1314│└—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┘←————————————中性——————————————→六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃 2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O442. 铜在空气中受热:2Cu + O2 加热 2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑。
新浙教版初中科学化学方程式及其相关知识点总结完整

H2+ CuO Cu + H2O(置换反应)
现象:黑色粉末逐渐变成光亮的红色物质,同时试管口有水滴生成
相关知识点:(1)实验开始时,应先通入一段时间氢气,目的是赶走试管内的空气;
(2)实验结束后,应先拿走酒精灯,后撤走氢气导管,目的是防止新生成的铜与空气中的氧气结合,又生成氧化铜。
③置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应
④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应
2、氧化还原反应
氧化反应:物质得到氧的反应还原反应:物质失去氧的反应
氧化剂:提供氧的物质还原剂:夺取氧的物质(常见还原剂:H2、C、CO)
3、中和反应:酸与碱作用生成盐和水的反应
相关知识点:反应后的产物可用澄清的石灰水来进行检验。
8、硫在空气(或氧气)中燃烧
S + O2SO2(化合反应)
现象:在空气中是发出微弱的淡蓝色火焰,在氧气中是发出明亮的蓝紫色火焰。
相关知识点:该气体是导致酸雨的主要污染物。
9、 铁丝在氧气中燃烧
3Fe + 2O2Fe3O4(化合反应)
现象:剧烈燃烧,火星四射,生成一种黑色固体—四氧化三铁
11氢气在空气中燃烧
2H2+ O22H2O(化合反应)
现象:产生淡蓝色的火焰。
相关知识点:(1)氢气是一种常见的还原剂;(2)点燃前,一定要检验它的纯度。
12、实验室制取二氧化碳气体(或大理石和稀盐酸反应)
CaCO3+ 2HCl===CaCl2+ H2O + CO2↑(复分解反应)
现象:白色固体溶解,同时有大量气泡产生。
2H2O 2H2↑H2+ O2↑(分解反应)
2023年河南省郑州市名校联考化学九上期中综合测试试题含解析

2023年河南省郑州市名校联考化学九上期中综合测试试题注意事项1.考试结束后,请将本试卷和答题卡一并交回.2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置.3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符.4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案.作答非选择题,必须用05毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效.5.如需作图,须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗.一、单选题(本大题共15小题,共30分)1.小明设计实验探究铁、铜、银三种金属的活性顺序。
他设计了四个实验方案,分别选择的试剂是:①铜、银、硫酸亚铁溶液;②铁、银、硫酸铜溶液;③银、硫酸亚铁溶液、硫酸铜溶液;④铜、硫酸亚铁溶液、硝酸银溶液。
上述四个方案所选试剂正确的是()A.①②③B.①②③④C.②③D.②④2.如图是几种粒子的结构示意图,有关说法不正确...的是A.①和②属同种元素B.②属于稀有气体元素C.①和③化学性质相似D.④属于金属元素3.“沙枣子花开哎……香万里……”,这是宁夏花儿中的唱词。
这句唱词说明( ) A.沙枣花的分子质量很大B.沙枣花的分子分裂成原子C.沙枣花的分子体积很大D.沙枣花的分子在不断运动4.下列物质不属于空气污染物的( )A.二氧化碳B.可吸入颗粒物C.二氧化氮D.二氧化硫5.下列相关的解释或结论不正确的是A.自行车轮胎暴晒后炸裂——分子间间隔变大B.水通电分解——在化学变化中,分子可以再分C.木柴架空燃烧会更旺——木柴与氧气的接触面积变大D.把燃着的木条伸入集气瓶中,火焰熄灭——瓶中气体一定是CO26.以下是三种气体的密度(0℃,101kPa)和溶解性(标准状态),空气的密度是1.293 g/L。
实验室收集二氧化硫气体,可采用的方法是()。
金属活动性顺序表

)
随堂练习
A. ZnCl2 , HCl C. CuCl2 , HCl 有下列情况: (1)若反应后锌有剩余,则溶液中所含物质是 。 B. FeCl2 , CuCl2 D. ZnCl2 , FeCl2
1、向含有CuCl2,ZnCl2,HCl的溶液中撒入过量的铁粉,反应后溶液中一定有( )
2、在Cu(NO3)2和AgNO3混合溶液中,加入一定质量的锌粉,充分反应后。可能
(2)、排在氢前面的金属能与酸反应放出氢气,排在后面则不能;
(3)、排在前面的金属能把后面的金属从它们盐溶液中置换出来;
一、金属的位置越靠前,它的活动性越强
例1、你能从以下事实中体会到金属活动性的强弱吗?请解释:
(1)、镁条在空气中,点燃后,就剧烈燃烧;而铁丝却需要在纯氧中才能燃烧。
(2)、我们都知道人类利用铜器的历史要比利用铁器早的多,但是在许多博物馆里铜
D. 2Fe+3CuCl2=2FeCl3+3Cu
)
例题:将锌片投入下列盐溶液反应后,使溶液质量减轻的是( A. MgCl2 B. CuCl2 C. Hg (NO3)2 D. Al(NO3)3
如图所示:弹簧秤下悬挂一铁块,烧杯内为某液体。在以下 变化过程中,忽略液体和铁块体积的变化,请你判断。 (1)若液体液体为稀硫酸,随着反应的进行则弹簧秤示数 如何变化? (2)若液体为硫酸铜溶液,随着反应的进行则弹簧秤示数 如何变化?
基础习题
例:写出镁铝锌铁四种金属分别与稀盐酸和稀硫酸反应的化学反应 方程式。
金属
Mg Al Zn Fe
与稀盐酸反应
与稀硫酸反应
备注
Mg+2HCl=MgCl2+H2↑ 2Al+6HCl =2AlCl3+3H2↑ Zn+2HCl=ZnCl2+H2↑ Fe+2HCl=FeCl2+H2↑
初三化学下学期金属活动性顺序表的应用

1、金属跟 酸的反应 活泼金属+酸 盐+氢气
(1)在金属活动性顺序表中,排在氢前的金属 可置换出酸中的氢,排在氢后的金属不能置换出酸 中的氢。
;/naotanby 小儿脑瘫病因 新生儿脑瘫病因 脑瘫出现的原因
;
年纪的老人,还是刚刚学会写作文的小孩,他们的作业,大部分都沾染上了浓重的《读者》气息。这是一本刊物的成功,却也宣告了作为读者的失败。他们可以忍受日常生活的繁杂、琐碎,同时坚持不懈地制造有关幸福的谎言。更为可怕的是由此造成的错觉:他们的生活就是一向如此。 小市民的禅宗精神就是这样轻而易举地获得。以《读者》为代表的刊物在意识形态方面显示出来的力量,强大而隐秘,像尘埃一样无处不在,却拥有一副温情脉脉的面孔。 这种对苦难的净化,在想象力日益衰退和信念支离破碎的格局里,最终将演化出什么样的图景? 153、云 在低处飞 姐姐家在福建山区,那一年,她在家对面的半山腰上办了一个黑木茸种植园。在几万截朽木段里挖孔填菌,让它们自然生发。一年下来,姐姐培植的黑木茸,产量并不高,辛辛苦苦360天,保本都有点困难。 后来,姐姐请了一个林科所的专家来把脉,才知症结之所在。 原来,黑木茸培植基地处在半山腰上,这里经常飘浮着山云,湿气大,对黑木茸最初的生长不利。专家给姐姐提了个建议,云只在低处飞,只要把基地搬到山顶上去,问题就能得到解决。 姐姐在专家的指导下,把基地上移,当年就喜获丰收。人生何尝不是如此?云只在低处飞,它 遮住的只是在底层徘徊的人的去路。若要获得人生的晴空,路径只有一条,就是拼命地向上,向上! 154、头脑远比性感重要 没有索非亚?罗兰的艳光四射,也没有索菲?玛索的娇俏率性,6月13日,梅莉尔?斯特里普以亲切和智慧征服了国际电影节。 在世界影坛梅莉尔被誉 为是“一代只出一个的常青树”,她功成名就,却说自己最享受的是为人妻、为人母的幸福:“长期工作不回家我会发疯,不过长期在家不工作我也会发疯。”都说演员深入生活很重要,就在别人费力了解角色的时候,梅莉尔却住在远离名流富豪的普通人中间,静静地感知生活的点滴美 好。因为她知道:“明星不一定是好演员,好演员只要有点名气就一定是明星。” 在如云的好莱坞,梅莉尔算不上漂亮,也不富有,但她却以两次捧杯、13次提名的惊人成就屹立于奥斯卡之巅。梅莉尔演《克莱默夫妇》后,星光初现,前途无量。“有很多的诱惑摆在面前,是尽快 让自己赚一辈子也花不完的钱,还是让自己脚踏实地地成长为一个好演员,这需要良心,很庆幸我做出了正确的抉择。” 来之前,她刚刚成为奥斯卡终身成就奖最年轻的获得者。好莱坞的们争相模仿她的谈吐打扮,而她对成功的理解是:“第一是运气,它带来机会;第二是才气, 带你跨进门槛;第三最重要,是很多的人生经历感悟和对事业的执著热爱。”在她看来,身为女演员,“头脑远比性感重要,是头脑决定了你在这一行能走多远。” 155、失败缘于心 将一个铁笼子一分为二,把狗放进笼子的一边,一旦在笼子底上通电,狗就会受到电击的刺痛, 很快跳到笼子的另一边去,以躲避电击,而当另一边受到电击时,这些狗又会很轻松地跳回来,到没有通电的一边去。 然而,一批同样的狗,被放进笼中受到电击时,它们却不做任何跳跃和挣扎,只会浑身发抖,低声哀鸣。为什么这些狗会表现出这种任人宰割的惨像呢?原来,心 理学家曾把这些狗拴在一个铁柱上,时不时地用电刺激它们,狗受到电击后会挣扎、跳跃,但是无论它们怎样挣扎,都摆脱不了电击的折磨,经过几天数十次的电击和无效的挣扎后,这些狗都放弃了努力,再也不挣扎了。这时,再把这些狗放进铁笼中,对这种轻轻一跃就能摆脱的电击刺 痛,它们习惯了挫败,认"命"了。 在某些场合下,人是否也同样会像上述的狗一样自认"失败"的命运呢所谓失败,其实就是自己的一种感觉,是在通往目标的过程中,由于自己的行动多次受阻而产生的绝望感。在客观世界中,没有什么失败,失败仅仅存在于失败的人心中。 外 界的影响或许会暂时会把自己禁锢在失败的十字架上. 但是只要自己的心还没死,没服输。就怎么也不会被打倒. 即使这个过程是漫长的........ 156、守夜员的故事 John去应试某公司守夜员,因为没念过书,连自己的名字也不会写,而守夜员值勤时又必需填许多的窗体, 因此John在面试时便被回绝了。失望的john便去当捕鱼工人,存了一些钱后,他自己买一艘船自己捕鱼,赚了钱后便成立船公司,不只做鱼货事业,更做起海运事业,事业版图也扩到世界各角落。 一天John到银行办事,行员请他签名,他连名字都不会签,他说这事平常都由我太太,或会计小 姐处理,行员一脸惊叹的说: “你不识字就把事业做的那么大, 如果识字的话,那事业岂不是做的更大” john回答说:“如果我识字的话,现在应该是守夜员” 157、爱的水滴 有一天,一片竹林失火了,火越烧越大,越烧越烈。这时,一只小鸟飞到河边,弄湿了翅膀,然后回 到火场上空,将翅膀上的水滴下来,希望能熄灭大火。 他一次又一次地去取水灭火,天上的诸神看到后非常惊讶,他们问它:你为什么这么做?你要知道,这些小水滴是不可能扑灭这么大的火的,这根本就不可能。 小鸟回答说:竹林给了我许多,我非常爱它,我出生在这里, 这里是我的根,我的家,就算我不能扑灭大火,我也要不断地洒下爱的水滴,直到死去。 诸神明白了小鸟在做些什么,于是帮助它扑灭了大火。 在自己的家,自己的社区和自己的国家里,如果每个人都将自己的翅膀润湿,扑捏每天都可能燃起的心灵大火(贪婪、自私、愚昧、 残忍……),也许世界上的穷人就会少一些,陷入绝望和崩溃的人也会少一些,也许在昨天烧焦的草地上会再次盛开爱与和平的鲜花。 158、母亲给出的答案 有个孩子对一个问题一直想不通:为什么他的同桌想考第一一下子就考了第一,而自己想考第一却只考了全班第二十一 名? 回家后他问道:“妈妈我是不是比别人笨?我觉得我和他一样听老师的话,一样认真地做作业,可是,为什么我总比落后?”妈妈听了儿子的话,感觉到儿子开始有自尊心了,而这种自尊心正在被学校的排名伤害着。她望着儿子,没有回答,因为她不知道给怎样回答。 又 一次考试后,孩子考了第十七名,而他的同桌还是第一名。回家后,儿子又问了同样的问题。她真想说,人的智力确实有三六九等,考第一的人,脑子就是比一般的人灵。然而这样的回答,难道是孩子真想知道的答案吗?她庆幸自己没说出口。 应该怎样回答儿子的问题呢?有几次, 她真想重复那几句被上万个父母重复了上万次的话——你太贪玩了;你在学习上还不够勤奋;和别人比起来还不够努力……一次来搪塞儿子。然而,向象她儿子这样脑袋不够聪明,在班上成绩不甚突出的孩子,平时活得还不够辛苦吗?所以她没有那么做,她想为儿子的问题找到一个完美 的答案。 儿子小学毕业了,虽然他比过去更加刻苦,但依然没有赶上他的同桌,不过与过去相比,他的成绩一直在提高。为了对儿子的进步表示赞赏,她带他去看了一次大海。就是在这次旅行中,这位母亲回答了儿子的问题。 现在这位做儿子的再也不担心自己的名次了,也再 没有人追问他小学时成绩排第几名,因为他去年以全校第一名的成绩考入了清华。寒假归来时,母校请他给同学及家长们做一个报告。其中他讲了小时候的一段经历:“我和母亲坐在沙滩上,她指着前面对我说,你看那些在海边争食的鸟儿,当海浪打来的时候,小灰雀总能迅速地起飞, 它们拍打两三下翅膀就升入天空;而海鸥总显得非常笨拙,它们从沙滩飞入天空总要很长时间,然后,真正能飞跃大海横过大洋的还是它们。”这个报告使得很多母亲流下了眼泪,其中包括他自己的母亲。 159、阳光下的守望 我见过一个母亲,一个阳光下守望的母亲。母亲就 站在七月炙热的阳光下,翘首望着百米外的考场,神色凝重。母亲脸上早就冒出豆大的汗珠。汗水早就将她的衣衫浸染得像水洗一样,她的花白的头发凌乱地贴在前额上。母亲就这样半张着嘴,一动不动地盯着考场,站成一尊雕像。 树阴下说笑的家长停止了说笑,他们惊讶的望着 阳光下的母亲。有人劝母亲挪到树阴下,母亲神情肃然的脸上挤出比初冬的冰还薄的笑,小声嗫嚅道:“站在这里能清清楚楚地看到考场,能清清楚楚地看到孩子。”没人笑她痴,没人笑她傻,也没人再劝她。 烈日下守望的母亲舔了舔干裂的嘴唇,目光扫了扫不远处的茶摊,就又 目不转睛地盯着考场了。 不知过了多久,也许半个小时,也许一个小时,母亲像摊软泥一样瘫在了地上。众人一声惊呼后都围了上去,看千呼万唤后她仍昏迷不醒,便将她抬到学校大门口的医务室里。 听了心跳,量了血压,挂了吊针,母亲仍然紧闭着双眼。经验丰富的医生微 笑着告诉众人:“看我怎样弄醒她。” 医生附在母亲耳边,轻轻地说了句:“学生下考场了。” 母亲猛地从床上坐了起来,拔掉针头,下了病床:“我得赶快问问儿子考得怎么样。” 160、绿洲里的老先生 记得有一个故事说宋朝的苏东坡和佛印禅师在一起打坐,佛 印禅师问苏东坡:“我坐的姿态像什么?”苏东坡戏言:“你的坐相像一堆牛粪。”苏东坡反问佛印禅师:“我的坐相如何?”佛印说:“你坐得像一尊佛。”苏东坡很高兴,以为赢了佛印禅师,但是苏小妹告诉他:“禅师的心中是佛,看人都是佛;你心中是牛粪,看禅师的坐相就是牛 粪。” 另有一个故事。一个青年来到绿洲碰到一位老先生,年轻人便问:“这里如何?”老人家反问:“你的家乡如何?”年轻人回答:“遭透了!我很讨厌。”老人家就说:“那你快走,这里同你的家乡一样遭。”后来又来了另一个年轻人,他也问了同样的问题,老人家也同样 反问他:“你的家乡如何?”年轻人回答说:“我的家乡很好,我很想念家乡的人、花、事物......” 老人家便说:“这里也同样的好。”旁听者觉得诧异,问老人家为何前后答复不一致呢?老者说:“你要寻找什么,你就会找到什么!” 161、名气的价值 美国南北战争结束后, 太平洋人寿保险公司拟以3万美金的年俸,聘请曾任南部联军统帅的名将李将军为该公司董事长,但遭李将军拒绝,理由是他对人寿保险业务毫无心得。公司负责人当即告称:“阁下对人寿保险业务无心得无所谓,我们需要的是您的大名。” “好的,可见我的名气很有价值,
金属活动性顺序表专题复习(学生版)

金属活动性顺序表专题复习(学生版)金属活动性顺序表专题复习一、选择题1、以下化学方程式中,恰当的就是()a、cu+2agcl错误!未找到引用源。
2ag+cucl2b、zn+2agno3错误!未找到引用源。
2ag+zn(no3)2c、2na+cuso4错误!未找到提及源。
cu+na2so4d、2fe+3cucl2错误!未找到提及源。
2fecl3+3cu2、将锌片投入下列盐溶液中,充分反应后,使溶液质量减轻的是()a、mgcl2b、cucl2c、ag(no3)2d、kcl3、下列物质可以由相应的金属和酸发生置换反应而制得的是()a、fe2(so4)3b、cucl2c、agno3d、al2(so4)34、将一定质量的铁粉放进至足量的cu(no3)2和agno3混合溶液中,充份反应后过滤器,测得滤渣中只所含一种金属,则该金属就是()a、feb、cuc、ag5、向cucl2、zncl2、hcl的混合溶液中加入过量的fe粉,反应后的溶液中一定所含()a、zncl2、hclb、fecl2、cucl2c、cucl2、hcld、zncl2、fecl26、下列金属中,金属活动性最强的是()。
(a)zn(b)mg(c)fe(d)cu7、某工厂的废渣中夹杂少量的锌粉和氧化铜(其他的成分不跟酸反应),这些废为与废盐酸碰触时会构成污水,产生公害。
若向污水中抛进铁粉,且反应后使铁粉存有余下,则此时污水中一定所含的金属离子就是()a、fe2+、cu2+b、cu2+、h+c、zn2+、fe2+d、zn2+、h+8.x、y、z三种金属,只有z能与稀硫酸反应,当把y放入x的盐溶液时,y表面有x析出,则x、y、z三种金属的活动性顺序为()a.x>y>zb.z>x>yc.y>z>xd.z>y>x9.金(au)、银(ag)、铜(cu)曾长期做为货币金属展开流通,我国有著古老的金属货币历史和多样的货币文化。
判断金属活动性强弱的可能方法

判断金属活动性强弱的可能方法金属活动性顺序是学习化学必备的工具性知识,在中考中对金属活动顺序的考查是一个重点,在每年的中考试题中必定亮相。
所以,在化学学习中,要求学生必须牢记并理解、掌握其应用。
通过实验,人们归纳和总结出了常见金属的化学活动性顺序。
金属的化学活动性顺序在工农业生产和科学研究中有重要应用,我们可以通过以下一些方法进行判断。
思考:什么是置换反应?我们所学过的有关的置换反应有哪些呢?学习金属活动性顺序重在运用它解答有关金属与酸、金属与盐能否反应及怎样反应。
金属活动性顺序在实际应用中有以下三个方面的意义:(1)在金属活动性顺序表中,金属的位置越靠前,该金属在水溶液中就越容易失去电子变成离子,它的活动性就越强,反应速率就越快。
根据金属在金属活动性顺序表中的位置,可判断它的化学活动性。
(2)在金属活动性顺序中,排在氢前面的金属能置换出非氧化性酸(稀盐酸、稀硫酸,不能用浓硫酸、浓硝酸、稀硝酸,因为有较强的氧化性)里的氢,排在氢后面的金属不能置换出酸里的氢。
且金属的位置越靠前,反应越剧烈。
根据金属在金属活动性顺序表中的位置,可判断金属能否与酸发生置换反应产生氢气。
(3)在金属活动性顺序中,只有排在前面的金属才能把排在后面的金属从它们的盐溶液里置换出来。
其中金属钾钙钠的活动性太强,易与水发生剧烈反应,所以一般不能用来置换其它金属。
简而言之就是“前换后,盐必溶,钾钙钠,不能用”。
一、大多数金属都能与氧气反应,但反应的难易程度和剧烈程度不同。
如:2Mg+O2=2MgO;4Al+3O2 = 2Al2O3;3Fe+2O2Fe3O4;2Cu+ O22CuO,镁、铝、铁、铜等金属与氧气反应的难易程度和剧烈程度不同,金在高温时也不与氧气反应。
练习1.下表数据是在某温度下,金属镁和镍(Ni)分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:注:a和b均为与温度有关的常数,nm表示“纳米”请回答:Mg与Ni比较,哪一种更易氧化? 。
对金属活动性顺序的理解

对金属活动性顺序的理解在金属活动性顺序中,金属的位置越靠前,在水溶液中就越容易失去电子变成离子,它的金属活动性就越强;金属的位置越靠后,该金属的阳离子在水溶液中就越容易得到电子变成原子,它的金属活动性就越弱。
1、在金属活动性顺序中,排在氢前面的金属能置换出酸中的氢。
注意:(1)一般不使用非常活泼的金属(如钾、钙、钠)与酸反应制取氢气。
因为它们在常温下极易与水反应,置换出水中的氢,且反应非常剧烈。
(2)酸应采用非氧化性酸,如盐酸、稀硫酸等。
而不用浓硫酸或硝酸,因为它们的氧化性比较强,金属与之后反应生成水,不生成氢气。
(3)不用挥发性酸(如浓盐酸)制取氢气。
因为用挥发性酸制得的气体不纯。
(4)酸应用可溶性的酸,不溶性的酸(如硅酸)不能与金属发生置换。
(5)金属与酸反应生成的化合物必须溶于水,若生成的化合物不溶于水,则生成的化合物会附着在金属表面,阻碍与金属继续反应。
如制取氢气时不用铅与稀硫酸反应,是因为生成的硫酸铅微溶于水,阻碍反应继续进行。
2、排在前面的金属一般能够把排在后面的金属从它的化合物溶液里置换出来。
注意:(1)钾、钙、钠等活泼金属不能从化合物溶液里置换出金属。
当它们与化合物溶液接触时,先与溶液中的水反应生成相应的碱,碱再与化合物溶液反应。
如将钠放硫酸铜溶液中,发生反应的化学方程式为:2Na+2H2O====2NaOH+H2↑2NaOH+CuSO4====Cu(OH)2+Na2SO4(2)化合物必须可溶,因为金属与化合物的反应必须在溶液中进行,如:Fe+2AgCl====FeCl2+2Ag就是错误的。
(3)铁与化合物溶液反应时生成物中铁元素显+2价。
如:Fe+CuSO4====Cu+FeSO4金属活动性顺序典型题例题与练习一、根据金属活动性顺序直接判断金属的活动性强弱例1下列各组金属的活动性,符合由强到弱顺序排列的是( ).A.Zn、Al、Mg B.An、Fe、HgC.Cu、Fe、Zn D.Ag、Zn、Mg分析:根据金属活动性顺序,逐项分析得答案为B.二、根据化学反应判断金属的活动性强弱例2X、Y、Z三种金属的活动性,可用下列化学方程式说明:Z+Y(NO3)2===Z(NO3)2+Y;X+Y(NO3)2===X(NO3)2+Y;Z+H2SO4(稀)===ZSO4+H2↑===X跟稀H2SO4不发生反应.则三种金属的活动性由强到弱的顺序是________.分析:由金属活动性顺序表可知:Z排在H前面,X排在H后面;Z的活动性比Y强,X 的活动性比Y强,故金属活动性由强到弱的顺序应是Z>X>Y.练习:有甲、乙、丙三种金属,甲能从丙盐溶液中置换出丙,将乙、丙投入到稀硫酸中,丙溶解而乙不溶解,则这三种金属的活动性顺序是[ ]A.乙>甲>丙B.甲>丙>乙C.乙>丙>甲D.丙>乙>甲分析:按照题意可知,甲能从丙盐溶液中置换出丙,故甲比丙活泼;丙能与稀硫酸反应,丙应比氢活泼;乙不与稀硫酸反应,故乙比氢不活泼。
金属活动性顺序表

Ⅱ、金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au ———————————————————————→金属活动性由强逐渐减弱小结:1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来二、溶液的酸碱度——pH石蕊试液红紫蓝—————————————————————————————酚酞试液无无红酸性增强碱性增强pH试纸红黄蓝三、常见物质的颜色、气味等:红色:红P、Cu、Fe2O3红褐色:Fe(OH)3浅绿色:Fe2+盐的溶液黄色:S、Fe3+盐的溶液绿色:Cu2(OH)2CO3紫黑色:KMnO4晶体蓝色:Cu(OH)2、CuCO3、CuSO4•5H2O、Cu2+盐的溶液紫红色:KMnO4溶液黑色:C、Fe粉、CuO、MnO2、Fe3O4白色:BaSO4、AgCl、MgO、P2O5、CaO、NaOH、Ca(OH)2、CaCO3、KClO3、KCl、NaCl、BaCO3、CuSO4、Na2CO3等无色气体:空气、O2、H2、CO2、CO、CH4、N2、SO2刺激性气味气体:SO2、HCl、HNO3等无色透明:金刚石、干冰以及大部分酸、碱、盐的溶液和酒精、乙酸的溶液四、熟记一些物质的学名、俗名及对应的化学式Hg汞(水银)CO2二氧化碳(干冰)CO一氧化碳(煤气)CH4甲烷(沼气天然气)CaO氧化钙(生石灰)Ca(OH)2氢氧化钙(熟石灰、消石灰)CaCO3碳酸钙(石灰石、大理石)NaCl氯化钠(食盐)KMnO4高锰酸钾(灰锰氧)C2H5OH乙醇(酒精)CH3COOH乙酸(醋酸)NaOH氢氧化钠(烧碱、苛性钠)Na2CO3碳酸钠(纯碱、苏打)NaHCO3碳酸氢钠(小苏打)HCl氢氯酸(盐酸)CuSO4•5H2O五水硫酸铜(胆矾、蓝矾)(NH4)2SO4硫酸铵(硫铵)NH4HCO3碳酸氢铵(碳铵)Cu2(OH)2CO3碱式碳酸铜(铜绿)NH4NO3硝酸铵(硝铵)K2CO3碳酸钾(草木灰主要成分)五、化学反应类型1、化合反应:A+B→C2、分解反应:C→A+B3、置换反应:A+BC→B+AC4、复分解反应:AB+CD→AD+CB2、化学变化和物理变化的根本区别是:有没有新物质的生成。
高中化学 常见金属活动性顺序的应用

金属活动性规律1.排在前面的金属可以将排在后面的金属从它们的金属溶液中置换出来。
(若金属过于活泼,则会直接与水反应,并不会与水中的金属离子反应);2.理论上讲,金属活动性表中铁及排在其前的金属均可置换出纯水中的氢;3.若只考虑氢离子的氧化性,排在氢(H)前的金属才能和非氧化性酸反应,置换出氢;4.排在越后的金属越容易,也越先从它们的化合物中被置换出来;排在越前的金属越容易,也越先把其他化合物中的金属置换出来。
金属活动性顺序表的意义(1)金属的位置越靠前,它的活动性越强(2)位于氢前面的金属能置换出酸中的氢(强氧化酸除外)。
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来(K,Ca,Na除外)。
(4)很活泼的金属,如K、Ca、Na与盐溶液反应,先与溶液中的水反应生成碱,碱再与盐溶液反应,没有金属单质生成。
如:2Na+CuSO4+2H2O==Cu(OH)2↓+Na2SO4+H2↑(5)不能用金属活动性顺序去说明非水溶液中的置换反应,如氢气在加热条件下置换氧化铁中的铁:Fe2O3+3H22Fe+3H2O(二)金属活动性的应用:1.判断金属是否能与酸溶液或盐溶液发生反应;2.根据几种不同金属与酸溶液、盐溶液反应的现象,判断金属的活动顺序;3.根据不同金属与酸溶液反应的图像关系,判断生成氢气的速率、质量、金属活动性顺序并比较相对原子质量的大小;4.根据金属与盐溶液的反应,判断滤液、滤渣的成分。
金属活动性定义:金属活动性指金属单质在水溶液中失去电子生成金属阳离子的性质。
常见金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au金属原子与金属离子得失电子能力的比较金属活动性顺序表的应用(1)判断某些置换反应能否发生a.判断金属与酸能否反应:条件:①金属必须排在氢前面②酸一般指盐酸或稀硫酸b.判断金属与盐溶液能否反应:条件:①单质必须排在盐中金属的前面②盐必须可溶于水③金属不包含K、Ca、Na(2)根据金属与盐溶液的反应判断滤液、滤渣的成分。
苏教版化学方程式汇总

化学方程式及金属相关的特性一.物质与氧气的反应:(1)单质与氧气的反应:镁在空气中燃烧:2Mg + O2点燃 2MgO 2.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O 4氢气中空气中燃烧:2H2 + O2点燃 2H2O 6.红磷在空气中燃烧:4P + 5O2点燃2P2O 5碳在氧气中不充分燃烧:2C + O2点燃 2CO2(2)化合物与氧气的反应:一氧化碳在氧气中燃烧:2CO + O2点燃 2CO2二.几个分解反应:水在直流电的作用下分解:2H2O 通电 2H2↑+ O2↑加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO + H2O + CO2↑加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2+ O2↑碳酸不稳定而分解:H2CO3=== H2O + CO2↑18.高温煅烧石灰石:CaCO3高温 CaO+ CO2↑三.几个氧化还原反应:氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 20.木炭还原氧化铜:C+ 2CuO高温 2Cu + CO2↑焦炭还原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2↑焦炭还原四氧化三铁:2C+ Fe3O4高温 3Fe + 2CO2↑一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe + 3CO2一氧化碳还原四氧化三铁:4CO+ Fe3O4高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气(置换反应)锌和稀硫酸反应:Zn + H2SO4=== ZnSO4+ H2↑铁和稀硫酸反应:Fe + H2SO4=== FeSO4+ H2↑锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑铁和稀盐酸反应:Fe + 2HCl === FeCl2 + H2↑镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑铝和稀盐酸反应:2Al + 6HCl === 2AlCl3 + 3H2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4+ Cu锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4+ Cu(3)碱性氧化物 +酸 -------- 盐 + 水氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4=== Fe2(SO4)3+ 3H2O氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O氧化铜和稀硫酸反应:CuO + H2SO4==== CuSO4+ H2O氧化镁和稀硫酸反应:MgO + H2SO4==== MgSO4+ H2O(4)酸性氧化物 +碱 -------- 盐 + 水苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3+ H2O苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3+ H2O苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4+ H2O消石灰放在空气中变质:Ca(OH)2 + CO2==== CaCO3↓+ H2O消石灰吸收二氧化硫:Ca(OH)2 + SO2==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2+ 2H2O盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2+ 2H2O盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3+ 3H2O氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3+ 3H2O硫酸和烧碱反应:H2SO4+ 2NaOH ==== Na2SO4+ 2H2O硫酸和氢氧化钾反应:H2SO4+ 2KOH ==== K2SO4+ 2H2O硫酸和氢氧化铜反应:H2SO4+ Cu(OH)2==== CuSO4+ 2H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2+ H2O + CO2↑碳酸钠与稀盐酸反应: Na2CO3+ 2HCl === 2NaCl + H2O + CO2↑碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2+ H2O + CO2↑盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO3硫酸和碳酸钠反应:Na2CO3+ H2SO4=== Na2SO4+ H2O + CO2↑硫酸和氯化钡溶液反应:H2SO4+ BaCl2==== BaSO4↓+ 2HCl(7)碱 + 盐 -------- 另一种碱 + 另一种盐氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3=== CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3硫酸钠和氯化钡:Na2SO4+ BaCl2==== BaSO4↓ + 2NaCl五.其它反应:生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4+ 5H2O(四)复分解反应大理石和稀盐酸(实验室制CO2):CaCO3+ 2HCl=CaCl2+H2O+CO2↑氢氧化钠和硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4碳酸钠和盐酸(灭火器原理):Na2CO3+2HCl=2NaCl+H2O+CO2↑盐酸和氢氧化钠(中和反应):HCl+NaOH=NaCl+H2O硫酸和氢氧化钠溶液:H2SO4+2NaOH=Na2SO4+2H2O硫酸与氯化钡溶液:H2SO4+BaCl2=BaSO4↓+2HCl氢氧化钠和氯化铁溶液:3NaOH+FeCl3=Fe(OH)3↓(红褐色)+3NaCl碳酸钡和稀硝酸:BaCO3+2HNO3=Ba(NO3)2+ CO2↑+H2O氯化钠和硝酸银:NaCl+AgNO3=AgCl↓+ NaNO3碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH二氧化碳使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O二氧化碳通入氢氧化钠溶液:CO2+2NaOH=Na2CO3+ H2OⅡ、金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au———————————————————————→金属活动性由强逐渐减弱小结:1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来二、溶液的酸碱度——pH石蕊试液红紫蓝—————————————————————————————酚酞试液无无红0 1 2 3 4 5 6 7 8 9 10 11 12 1314│└—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┴—┘←————————————中性——————————————→六、金属(1)金属与氧气反应:铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)锌和稀硫酸Zn + H2SO4= ZnSO4+ H2↑铁和稀硫酸Fe + H2SO4= FeSO4+ H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4+ Cu七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水氧化铁和稀盐酸反应:Fe2O3+ 6HCl ==2FeCl3+ 3H2O氧化铁和稀硫酸反应:Fe2O3+ 3H2SO4== Fe2(SO4)3+ 3H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2+ 2H2O硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4+ 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2+ H2O + CO2↑2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3+ H2O消石灰吸收二氧化硫:Ca(OH)2 + SO2== CaSO3↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3== CaCO3↓+ 2NaOH3、盐的化学性质盐(溶液) + 金属单质------- 另一种金属 + 另一种盐铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4+ Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐碳酸钠与稀盐酸反应: Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑。
金属活动性顺序及其应用

初中化学:金属活动性顺序及其应用常见金属在溶液中的活动性顺序是“钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金”,具体如图所示.金属活动性顺序的应用主要有:1.表明了金属活动性强弱顺序(前强后弱).即在金属活动性顺序中,金属的位置越靠前,它在水溶液中就越容易失去电子变成离子,其活动性就越强;金属的位置越靠后,其阳离子在水溶液中就比较容易获得电子变成原子,其活动性就越弱.需要注意的是:金属的活动性就越强参加反应时,现象就越明显、越剧烈.2.可用来判断金属与酸能否发生置换反应(氢前置换氢).只有排在氢前面的金属,才能置换出酸中的氢,而排在氢后面的金属不能置换出酸中的氢.需要注意的是:(1)金属必须是排在金属活动性顺序中(H)前面的金属;(2)酸应是盐酸、稀硫酸(即不具有强氧化性的酸),不包括浓硫酸和硝酸;(3)单质铁与酸发生置换反应时生成亚铁盐;(4)K、Ca、Na除与酸反应外,还能与水在常温下发生置换反应(如2Na+2H2O =2NaOH+H2↑),其余金属则不能(这点初中阶段大体上了解即可).3.可用来判断金属与金属化合物溶液(即盐溶液)能否发生置换反应(前置后,盐可溶,K、Ca、Na不能够).排在金属活动性顺序中前面的金属一般能把排在后面的金属从其盐溶液里置换出来.需要注意的是:(1)在金属活动性顺序中只要排在前面的金属就能把排在后面的金属从其盐溶液中置换出来,而与H的位置无关.但K、Ca、Na等金属例外,由于它们过于活泼,不与溶液中的盐发生置换反应,而是先与溶液中的水发生置换反应(这点初中阶段大体上了解即可).如把钠放入硫酸铜溶液中虽然反应[2Na+2H2O=2NaOH+H2↑,CuSO4+2NaOH=Cu (OH)2↓+Na2SO4],最终没有单质铜生成.(2)铁与盐溶液发生置换反应时,生成二价亚铁盐.(3)用同种金属置换不同的盐溶液,盐中金属排在金属活动性顺序中较后的金属首先被置换出来.用不同的金属置换同种盐溶液,盐中金属先被排在金属活动性顺序中较前的金属置换出来.另外,若有一种金属和多种混合盐溶液反应,最先反应的是最不活泼的那个金属的盐溶液.例如,锌粒与氯化亚铁和硫酸铜和硝酸汞的混合溶液反应,最先反应的是硝酸汞,当硝酸汞被消耗完时,硫酸铜才与锌粒反应,同理,硫酸铜反应完后,锌才会和氯化亚铁反应.还有,当多种金属与一种盐溶液反应时,最活泼的金属先反应.例如,把打磨光亮的镁带、铝丝、铜丝一起放入硝酸银溶液中,镁被消耗完后,铝才和硝酸银反应,铝反应完后,铜跟硝酸银反应.另外,利用金属与酸或盐溶液之间的置换反应是否发生,通过具体的实验及其现象的分析,反过来可以反推金属的活动性顺序.具体的推断方法是这样的:1.利用金属与酸能否发生置换反应,来反推金属的活动性顺序.例如,把铁和铜分别放在稀盐酸中时,铁的表面上有气泡冒出,这说明铁位居金属活动性顺序中氢的前面;而铜的表面无明显的现象,这说明铜位居金属活动性顺序中氢的后面;由此可推得铁活泼性比铜的要强.2.利用金属与盐溶液能否发生置换反应,来反推金属的活动性顺序.例如,把铁钉放在硫酸铜溶液中,过一会儿,发现铁钉表面上出现了一层红色物质(即铜);由此可推得铁活泼性比铜的要强.【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对金属活动性顺序及其应用的理解或掌握情况;以及阅读、分析、推断、表达的能力和对知识的迁移能力等.并且,经常将其与“金属的性质及用途、常见金属的特性及其应用、合金与合金的性质、实验现象和结论(包括反应化学方程式)、其它的反应类型”等相关问题关联起来,进行综合考查.金属活动性顺序及其应用是历年来中考命题的热点;命题方式是根据金属活动性顺序及其应用来分析、推断、选择或解答有关金属的活动性强弱、某些置换反应是否发生、实验现象、实验结论(包括反应化学方程式)、金属的制备、金属的应用、生活中有关金属的实际问题,或者是反过来考查,或者是对所给的有关金属活动性顺序及其应用的表达进行判断,等等.题型有选择题、填空题、实验探究题.中考重点是考查学生阅读、分析和提炼所给的实验、问题情景或图表信息的能力,对金属活动性顺序及其应用、金属的性质及用途、常见金属的特性及其应用、合金与合金的性质等相关知识的理解或掌握情况,以及运用它们来解决实际问题的能力等.特别是,对我们身边生活中常用、常见金属及合金的有关知识的考查,是近几年中考的重中之重.【解题方法点拨】解答这类题目时,首先,要熟记和理解金属活动性顺序及其应用,以及与之相关的知识等;然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及从生活、电视、网络中了解到的有关金属及合金的信息,细致地阅读、分析题意等,联系着生活实际,细心地进行探究、推理,最后,按照题目的要求,认真地进行选择或解答即可.爱心提示:要想做好这方面的题目,除了学好教材中的有关金属活动性顺序及其应用等相关知识以外,还要做到以下两点:1.在平时的学习和生活中,注意留意、理解、搜集和熟记我们身边经常用到和见到的金属及合金的有关知识,以及最新的有关金属方面的科技前沿信息,等等.2.要特别注意灵活运用物质的性质与用途或变化规律之间的相互联系(即性质用途或变化规律),根据它们之间的联系来分析、推断和解答有关金属活动性顺序及其应用等相关问题,将会是事半功倍的.。
验证金属活动性顺序的方法

验证金属活动性顺序的方法
1、判断金属与酸能否发生置换反应(氢前置换氢)。
只有排在氢前面的金属,才能置换出酸中的氢,而排在氢后面的金属不能置换出酸中的氢。
通过这一反应可以把金属分为两类即氢前和氢后,能反应的一定比不反应的活泼。
注意的几点问题:
①排在金属活动性顺序中氢前面的金属才能与酸发生反应,看到有气泡产生。
②这里的酸应是盐酸、稀硫酸,不包括浓硫酸和硝酸。
③在置换反应中,单质铁与酸发生反应生成亚铁盐。
2、判断金属与金属化合物溶液(即盐溶液)能否发生置换反应:需要满足的条件是前面金属置换后面金属(钾钙钠除外),参加反应的必须是盐溶液,即盐可溶。
排在金属活动性顺序中前面的金属能把排在后面的金属从其盐溶液里置换出来。
扩展资料:
判断氢氧化物的热稳定性
金属性越强,其对应氢氧化物的热稳定性越强。
1、K→Na对应的氢氧化物不易分解。
2、Mg→Fe对应的氢氧化物加热可分解。
如:2Fe(OH)₃=Fe₂O₃+3H₂O
3、Sn→Cu对应的氢氧化物微热即分解。
如:Cu(OH)₂=CuO+H₂O
4、Hg→Ag对应的氢氧化物常温即易分解,如:2AgOH = Ag₂O+H₂O
5、Pt→Au一般无对应的氢氧化物。
高中金属活动顺序表应用大全(最新整理)

1金属活动顺序表的应用总结金属活动性顺序表是指金属在溶液或化学反应中的活泼程度,不是金属性的排序。
就是指金属的活跃程度而已,代表了金属的反应活性。
至于反应的难易程度就属于应用。
在金属活动顺序表中,一般位置越后的金属,金属性越弱,原子的还原性越弱;位置越前的金属,金属性越强,原子的还原性越强。
一般来说表中某金属可以把它后面的金属从它的盐溶液中置换出来。
注:金属性是指在化学反应中原子失去电子的能力。
失电子能力越强的原子其金属性就越强;失电子能力越弱的金属性也就越弱,而其非金属性就越强。
(初中)钾钙钠镁铝锌铁、锡铅(氢)铜、汞银铂金 : K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au (高中)钾钡钙钠镁铝锰锌、铬铁镍锡铅(氢)铜、汞银铂金 :K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au(总)Fr 、Cs 、 Rb 、 K 、 Ra 、Ba 、Sr 、 Ca 、 Na 、Li 、Ac 、 La 、 Ce 、 Pr 、Nd 、Pm 、Sm 、Eu 、 Gd 、Tb 、Y 、Mg 、Dy 、 Am 、Ho 、 Er 、Tm 、Yb 、 Lu 、(H)、 Sc 、 Pu 、Th 、Np 、Be 、 U 、 Hf 、Al 、Ti 、Zr 、V 、Mn 、 Nb 、 Zn 、 Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co 、 Ni 、 Mo 、 Sn 、Pb 、(D 2重氢)、 (H 2)、 Cu 、 Tc 、 Po 、 Hg 、Ag 、 Rh 、Pd 、Pt 、Au 钫、铯、铷、钾、镭、钡、锶、钙、钠、锂、锕、镧、铈、镨、钕、钷、 钐、铕、钆、铽、钇、镁、镝、镅、钬、铒、铥、镱、镥、(氢)、钪、钚、钍、镎、铍、铀、铪、铝、钛、锆、钒、锰、铌、锌、铬、镓、铁、镉、铟、铊、钴、 镍、钼、锡、铅、(氘分子)、(氢分子)、铜、锝、钋、汞、银、铑、钯、铂、金金属活动顺序表常有如下应用 :1、判断金属元素在自然界中的存在状态(1)K—Pb 在自然界中只有化合态。
2025年河北省邯郸市第十一中学初三下学期第一次模拟考化学试题含解析

2025年河北省邯郸市第十一中学初三下学期第一次模拟考化学试题注意事项1.考试结束后,请将本试卷和答题卡一并交回.2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置. 3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符.4.作答选择题,必须用2B 铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案.作答非选择题,必须用05毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效. 5.如需作图,须用2B 铅笔绘、写清楚,线条、符号等须加黑、加粗.一、单选题(本大题共10小题,共20分)1.有X 、Y 、Z 三种金属,只有Y 在自然界主要以单质形式存在,如果把X 放入Z 的硫酸盐溶液中,X 表面有Z 析出.据此判断这三种金属的活动性由强到弱的顺序为( ) A .Y 、X 、ZB .Z 、X 、YC .Y 、Z 、XD .X 、Z 、Y2.下列叙述,对应的方程式,所属基本类型都正确的是A .不能用铁制容器配制波尔多液:44=Fe+CuSO FeSO +Cu 置换反应B .酒精常用作燃料:25222C H OH+3O 2CO +3H O 点燃 氧化反应C .用小苏打治疗胃酸过多:2222Na CO +2HCl=2NaCl+H O+CO ↑ 复分解反应D .拉瓦锡研究空气成分:2HgOHg+O ∆↑ 分解反应3. “低碳经济,低碳生活”内涵之一是减少二氧化碳的排放,已成为社会发展和家庭生活的主流。
下列行为不符合“低碳”理念的是A .为提高生活水平,大量使用空调、电热水噐、电视机等电器B .发展太阳能、风能等新能源C .近距离出行时,用自行车替代机动车D .研制、推广使用以氢气、氧气提供动力的客车 4.下列实验能达到预期目的是A .除去氧化铜中的炭粉,可将混合物在足量的空气中灼烧B .除去铁粉中的少量镁粉,可加入稀硫酸充分反应后过滤C .为检验生石灰中是否含有熟石灰,可将其加水后滴加酚酞试液D .除去硝酸钠中的硫酸钠,可将混合物溶解、加适量氯化钡溶液、过滤、蒸发5.现有X 、Y 、Z 三种金属,将它们分别放入稀H 2SO 4中,只有X 无氢气放出。
初中要求掌握的时化学元素周期表中的前20号元素
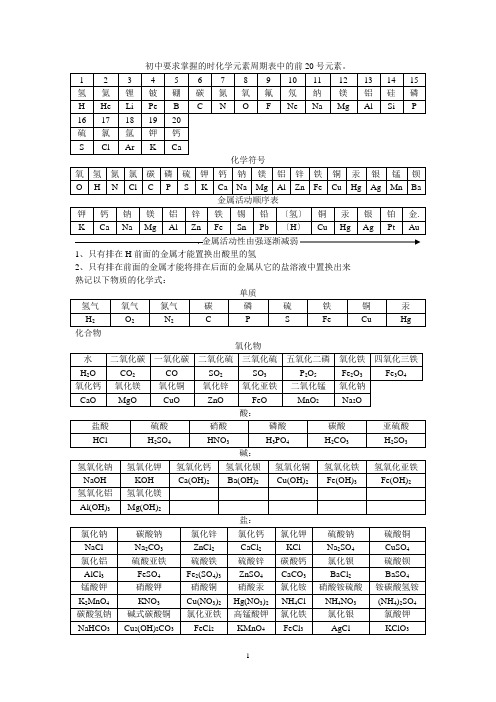
初中要求掌握的时化学元素周期表中的前20号元素。
. 金属活动性由强逐渐减弱1、只有排在H前面的金属才能置换出酸里的氢2、只有排在前面的金属才能将排在后面的金属从它的盐溶液中置换出来熟记以下物质的化学式:酸:〔5〕有机物:熟记以下化学方程式: 〔一〕化合反应1、木炭在氧气中燃烧: 2 22、硫在氧气中燃烧:S+O 2 SO 23、镁在空气中燃烧:2Mg+O2 2MgO4、铁在氧气中燃烧:3Fe+2O2Fe 3O 4 5、磷在氧气中燃烧:4P+5O 2 2P 2O 5 6、铜在空气中加热:2Cu+O 2 2CuO 7、氢气在氧气中燃烧:2H 22 2O 8、一氧化碳在空气中燃烧:2CO+O 2 2CO 2 9、碳不充分燃烧:2C+O 2〔不充分〕 CO 10、二氧化碳通过灼热的碳层:CO 2+C 2CO 11、二氧化碳与水反应:CO 2+H 2O=H 2CO 3 11'、氧化钠溶于水:Na 2O+H 2O=2NaOH 11''、生石灰和水化合:CaO+H 2O=Ca(OH)2 11'''、三氧化硫溶于水:SO 3+H 2O=H 2SO 4 〔二〕分解反应:12、氯酸钾与二氧化锰共热〔实验室制O 2):2KClO 3=(MnO 2 2KCl+3O 2↑ 13、加热高锰酸钾:2KMnO 4 K 2MnO 4+MnO 2+O 2↑ 14、加热碱式碳酸铜:Cu 2(OH)2CO 3 2CuO+H 2O+CO 2↑ 15、电解水:2H2O 2H 2↑+O 2↑点燃点燃点燃点燃点燃点燃点燃点燃高温通电16、碳酸不稳定分解:H2CO3=H2O+CO2↑17、高温煅烧石灰石:CaCO3CaO+CO2↑18、硫酸铜晶体受热失去结晶水:CuSO4·5H2OCuSO4+5H2O 18'、氢氧化铜受热分解:Cu(OH)2CuO+H2O〔三〕置换反应19、锌和稀硫酸反应〔实验室制H2〕:Zn+H2SO4=ZnSO4+H2↑20、锌和盐酸的反应:Zn+2HCl=ZnCl2+H2↑21、铁和盐酸:Fe+2HCl=FeCl2+H2↑22、铁和稀硫酸:Fe+H2SO4=FeSO4+H2↑23、氢气复原氧化铜:H2+CuO Cu+H2O24、木炭复原氧化铜:C+2CuO 2Cu+CO2↑25、碳复原氧化铁:3C+2Fe2O34Fe+3CO2↑26、铁和硫酸铜溶液:Fe+CuSO4=Cu+FeSO427、铜和硝酸汞溶液:Cu+Hg(NO3)2=Hg+Cu(NO3)228、氢气复原氧化铁:3H2+Fe2O32Fe+2H2O29、铝和稀硫酸:2Al+3H2SO4=Al2(SO4)3+3H2↑30、钠和水反应:2Na+2H2O=2NaOH+H2↑〔四〕复分解反应31、大理石和稀盐酸〔实验室制CO2〕:CaCO3+2HCl=CaCl2+H2O+CO2↑32、氢氧化钠和硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO433、碳酸钠和盐酸〔灭火器原理〕:Na2CO3+2HCl=2NaCl+H2O+CO2↑34、碳酸钾〔草木灰〕和盐酸:K2CO3+2HCl=2KCl+H2O+CO2↑高温高温高温35、盐酸和氢氧化钠〔中和反应〕:HCl+NaOH=NaCl+H 2O 36、硫酸和氢氧化钠溶液:H 2SO 4+2NaOH=Na 2SO 4+2H 2O 37、硫酸与氯化钡溶液:H 2SO 4+BaCl 2=BaSO 4↓+2HCl 38、盐酸与硝酸银溶液:HCl+AgNO 3=AgCl ↓〔白〕+HNO 339、氢氧化钠和氯化铁溶液:3NaOH+FeCl 3=Fe(OH)3↓〔红褐色〕+3NaCl 40、碳酸钡和稀硝酸:BaCO 3+2HNO 3=Ba(NO 3)2+CO 2↑+H 2O 41、硫酸钠和氯化钡:Na 2SO 4+BaCl 2=BaSO 4↓+2NaCl 42、氯化钠和硝酸银:NaCl+AgNO 3=AgCl ↓+NaNO 3 43、碳酸钠和石灰水:Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH 44、氢氧化铝和盐酸:Al(OH)3+3HCl=AlCl 3+3H 2O45、硝酸铵和氢氧化钠:NH 4NO 3+NaOH=△=NaNO 3+H 2O+NH 3↑ 46、氢氧化铁和硫酸:2Fe(OH)3+3H 2SO 4=Fe 2(SO 4)3 47、盐酸除铁锈:Fe 2O 3+6HCl=2FeCl 3+3H 2O48、氧化铜和硫酸:CuO+H 2SO 4=CuSO 4+H 2O 〔五〕其他:49、二氧化碳使澄清石灰水变浑浊:CO 2+Ca(OH)2=CaCO 3↓+H 2O 50、二氧化碳通入氢氧化钠溶液:CO 2+2NaOH=Na 2CO 3+H 2O 51、用氢氧化钠溶液吸收二氧化硫:SO 2+2NaOH=Na 2SO 3+H 2O 52、一氧化碳复原氧化铜:CO+CuO Cu+CO 253、一氧化碳复原氧化铁〔炼铁〕:3CO+Fe 2O 3 2Fe+3CO 2 54、甲烷在空气中燃烧:CH 4+2O 2 CO 2+2H 2O 55、乙醇在空气中燃烧:C 2H 5OH+3O 2 2CO 2+3H 2O 56、甲醇在空气中燃烧:2CH 3OH+3O 22CO 2+4H 2O 高温 点燃 点燃 点燃常见物质的颜色、气味等:红色:红P 、Cu 、Fe 2O 3 红褐色:Fe(OH)3 浅绿色:Fe 2+盐的溶液 黄色:S 、Fe 3+盐的溶液 绿色:Cu 2(OH)2CO 3 紫黑色:KMnO 4晶体 蓝色:Cu(OH)2、CuCO 3、CuSO 4·5H 2O 、Cu 2+盐的溶液 紫红色:KMnO 4溶液 黑色:C 、Fe 粉、CuO 、MnO 2、Fe 3O 4 白色:BaSO 4、AgCl 、MgO 、P 2O 5、CaO 、NaOH 、Ca(OH)2、CaCO 3、KClO 3、KCl 、NaCl 、BaCO 3、CuSO 4、Na 2CO 3等 无色气体:空气、O 2、H 2、CO 2、CO 、CH 4、N 2、SO 2 刺激性气味气体:SO 2、HCl 、HNO 3等 无色透明:金刚石、干冰以及大部分酸、碱、盐的溶液和酒精、乙酸的溶液熟记一些物质的学名、俗名及对应的化学式Hg 汞〔水银〕 CO 2二氧化碳〔干冰〕 CO 一氧化碳〔煤气〕 CH 4甲烷〔沼气天然气〕 CaO 氧化钙〔生石灰〕 Ca(OH)2氢氧化钙〔熟石灰、消石灰〕 CaCO 3碳酸钙〔石灰石、大理石〕 NaCl 氯化钠〔食盐〕 KMnO 4高锰酸钾〔灰锰氧〕 C 2H 5OH 乙醇〔酒精〕 CH 3COOH 乙酸〔醋酸〕 NaOH 氢氧化钠〔烧碱、苛性钠〕 Na 2CO 3碳酸钠〔纯碱、苏打〕 NaHCO 3碳酸氢钠〔小苏打〕 HCl 氢氯酸〔盐酸〕 CuSO 4·5H 2O 五水硫酸铜〔胆矾、蓝矾〕 (NH4)2SO4硫酸铵〔硫铵〕 NH 4HCO 3碳酸氢铵〔碳铵〕 Cu 2(OH)2CO 3碱式碳酸铜〔铜绿〕 NH 4NO 3硝酸铵〔硝铵〕 K 2CO 3碳酸钾〔草木灰主要成分〕化学反应类型1、化合反应:A+B →C2、分解反应:C →A+B3、置换反应:A+BC →B+AC4、复分解反应:AB+CD →AD+BC注: 表示沉淀表示气体 :表示反应条件是加热: 表示反应条件是点燃 :表示反应条件是高温:表示反应条件是通电点燃 高温 通电。
部分酸碱盐的溶解性记忆口诀

部分酸碱盐的溶解性记忆口诀部分酸碱盐的溶解性记忆口诀化学用语1. 电离方程式:H2SO4=2H++SO42-;NaOH=Na++OH-;AL2(SO4)3=2AL3++3SO42-2. 物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3·10H2O;氨水NH3·H2O。
金属活动性1. 金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H )Cu>Hg>Ag>Pt>Au2. 金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3. 金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
(马上点标题下蓝字"初中化学"关注可获取更多学习方法、干货!)酸、碱、盐的溶解性1. 常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2. 八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3. 四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4. 三个不存在的物质:氢氧化银、碳酸铝、碳酸铁复分解反应发生的条件反应有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1. 不溶性碱只能与酸性发生中和反应;2. 不溶性盐,只有碳酸盐能与酸反应;3. KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物。
