初中化学金属与酸反应的解题技巧复习PPT教学课件
合集下载
金属与酸反应专题 ppt课件

分析
相同质量、相同浓M度的g 盐+2酸H溶C液l——中——,产M生gC氢l2气+的H质2 量↑
关系是
73。
2
①酸足量, 金属 ②金属足量, 酸
完完全全反反应应;;相相同同质质量量的的金酸属,,产产生生相不同同质质量量的的氢氢气气((A=2lAZA>=ZFlnnelZM>+ng+M+622=H77gHH3C3F>CCl——ell——F————e————)2)FZAenlCCClll232+++3HH22H222↑↑↑
金属与酸反应
1、四个反应 2、两个问题
3、两种情况
⑴产氢速度 ⑵产氢多少
⑴酸足量 ⑵酸不足
①天平两端各放有盛有相等质量的足量的同种盐酸的烧杯,天 平平衡。现向两边各加入等质量的Fe、Zn,充分反应后,则天
平放金属 Zn 的一端偏重。
4、三种题型
②天平两端各放有盛有相等质量的同种盐酸的烧杯,天平平衡。
A.金属的活泼性N>M B.生成H2的质量相等 C.相对原子质量N>M D.消耗盐酸的质量一定相等
氢
气
M
质
量
N
0
反应时间
金属与酸反应
1、四个反应
Mg +2HCl———— MgCl2 + H2 ↑
24
2
2Al +6HCl———— 2AlCl3 +3H2 ↑
18
2
Fe +2HCl————FeCl2 + H2 ↑
⑴图像题
现向两边各加入等质量的过量的Fe、Zn,充分反应后,则天平
⑵天平题
的平衡情况是 天平平衡 。
演示文稿金属和酸反应专题复习课件

氢气要<0.195克,两者混合在一起才可能放出0.195克氢气!
由于,制氢本领(铝、镁、钠、铁、锌)所以选C!
第十一页,共23页。
• 小明同学用2.4 g不纯的镁粉与足量盐酸完
全反应,收集到H2的质量为0.205 g。已知 其中只含有另一种金属杂质。这种金属杂
质可能是下列物质中的 B
• A.铁
B.铝
_C_u__和_A__l _,滤液中除了水,一定还有_____A_l_C_l。3
分析:此题的突破点在于:先要根据“滤渣中有无气泡” 准 确判断出Al粉是否“过量”。
第二十二页,共23页。
题型五、判断反应前后溶液质量变化:
• 将锌片投入下列溶液中,反应一段时间后,
溶液质量减轻的是
()
A、硝酸银溶液
B、稀硫酸
第二十一页,共23页。
变形:
• 在CuCl2和MgCl2的混合溶液中加入一定量的Al粉,充分反
应后过滤,往滤渣中滴加适量稀盐酸, ⑴若滤渣中无气泡产生,则留在滤纸上的固体一定有
____C__u__,滤液中除了水,一定还有___M__g_C_l_2。和AlCl3 ⑵若滤渣中有气泡产生,则留在滤纸上的固体一定有
第十六页,共23页。
实验设计:
你能否设计实验证明Zn、Cu、Ag三种金属的活动性
顺序。(只写出试剂名称即可)
方案一:用Zn、Ag和CuSO4溶液 方案二:用Cu、Zn(NO3)2溶液和AgNO3溶液
第十七页,共23页。
• 某化学兴趣小组为测定Ag 、Fe、Cu 三种金
属的活动性顺序设四种方案,每种方案所用试
A.镁和铝 B.锌和镁 C.锌和铜 D.铜C和铁
【练习2】:在托盘天平的左右两盘上,各放一只盛有相同 浓度、相同质量的稀硫酸。天平平衡,在左杯中放入 m g铁粉,在右杯中放入m g锌粉,充分反应后,两杯中
中考复习化学反应的坐标图像问题(金属与酸反应专题)精品课件
能力提升 1.质量相等的镁、铝、锌、铁四种金属分别与足量的 硫酸溶液反应,产生氢气的质量与四种金属质量的关系
图像(如下图),正确的是 ( C )
产生氢气的能力由强到弱:Al>Mg>Fe>Zn; 与金属活动性无关。
2.将等质量的铝粉和铁粉分别与同体积、同浓度的
稀硫酸反应。反应情况如下图所示,有关叙述中可能
6.下列图像能正确反映对应变化关系的是( C )
A.用等质量、等浓度的双 氧水分别制取氧气
B.向等质量、等浓度的稀硫酸中分 别逐渐加入锌粉和铁粉
C.向等质量的锌粉和铁粉 中,分别加入相同质量分数 的稀盐酸
D.在一定量AgNO3和Zn(NO3)2的混 合溶液中加入铁粉
在一定量AgNO3和Zn(NO3)2的混合溶液中加入铁粉
课 一、解答反应图像问题应注意: 堂 (1)识标;(2)明点;(3)析线。 小 二、金属与酸的图像 结 1、横坐标为反应时间: : 类型一、等质量金属与足量酸反应,产生氢气的
质量与金属的相对原子质量大小成反比; 类型二、足量金属与等量酸反应,产生氢气的质 量相等。
2、横坐标为金属质量: 比较等质量的金属消耗的酸的质量谁多谁少;
是( B )
A.先偏左后偏右
B.先偏右后偏左
C.一直偏右
D.一直偏左
不能正确反映对应变化关系的是( )
B
A.分别向等质量的锌粉和铁粉中,加入足量且质 量分数相等的稀盐酸 B.向等质量的镁和锌中加入稀盐酸至过量 C.向生锈的铁钉中倒入稀盐酸 D.常温下,相同质量的锌和铁分别与足量的溶质 质量分数相同的稀硫酸反应
D.消耗硫酸的质量:甲>乙>丙
5.下列图象不能正确反映对应变化关系的是(B )
A.将颗粒大小相同质量相同的 铁和锌分别加入到足量的同质 量、同质量分数的稀盐酸中
金属与酸反应的图像专题 2(共19张PPT)

系为 镁=铁=,锌 和反应时间t的关系如右下图所示。
两份质量相等的锌分别与足量的稀盐酸和稀硫酸反应,产生氢气的质量关系为
。
两份质量相等的锌分别与足量的稀盐酸和稀硫酸反应,产生氢气
的质量关系为
。相等
极端假设: 相对原子质量:镁24铝27 铁56锌65
两种金属粉末混合物30g与足量的稀硫酸反应, 生成1g氢气。则这种混合物的可能组成是( ) A镁和铝 B铁和锌 C 铁和镁 D 铁和铝
最先被消耗完
②同一时间,产生氢气的质量: Mg > Al > Zn > Fe
当堂训练:15分钟
卷纸第三部分习题和下面两个题:
氢气的质量=
金属元素的化合价×金属的质量 金属的相对原子质量
金属的质量=
金属的相对原子质量×氢气的质量 金属元素的化合价
向上浮一些
B.
都生成2g氢气,镁、铝、铁、锌需要HCl的质量相等
2
生成0.1g氢气需要铝0.9g,需要镁1.2g。如果是镁铝
混合同样产生0.1g氢气,混合物的质量在0.9g和1.2g之间
2、将铁片放入下列溶液中,溶液的质量会减少的是
(
)D
A、HCl C、Na2 SO4
B、H2SO4 D、CuSO4
3、将铁片放入下列溶液中,铁片的质量会增加 的
是( ) C
A、稀H2SO4
金属与酸的反应常见题型
相对原的相对原子质量是M比N的 (填“大”或“小”)。
酸均因量不足而在反应中完全消耗,H守恒 活动性:Mg > Al > Zn > Fe
b
其他信息:活动性:Mg > Al > Zn > Fe 镁铝合金mg和足量的盐酸反应后,在标准状况下产生氢气的质量为0.
c
3-1-2金属与酸(碱)和水的反应 PPT56张

【提示】 铝无论与盐酸反应,还是与 NaOH 溶液反应,Al 与产生的 H2 的物质的量关系均为:2Al-3H2
2.铝与 NaOH 溶液的反应为氧化还原反应,该反应中何种 物质为氧化剂和还原剂?
【提示】 铝与 NaOH 溶液的反应的实质是铝先与水反应生成 Al(OH)3 和氢气,化学方程式为 2Al+6H2O===2Al(OH)3+3H2↑。 由于 Al(OH)3 呈现两性,与 NaOH 溶液反应生成偏铝酸钠。发生反 应的化学方程式为 Al(OH)3+NaOH===NaAlO2+2H2O,上述两个 反应叠加得到的方程式为:
答案 (1)D (2)①2Na+2H2O===2NaOH+H2↑ NaOH+NaHCO3===Na2CO3+H2O ②2Na+2H2O===2NaOH+H2↑ 3NaOH+FeCl3===Fe(OH)3↓+3NaCl
探究 2 铝与酸、强碱溶液的反应
1.铝与盐酸、NaOH 溶液反应的化学方程式中,Al 与 H2 的计量数有何规律?
2.钠与水反应实验现象的观察 应的实验现象观察(能力重难点)
3.掌握铁与水蒸气的反应原理 3.注意实验现象的讨论、培养观察
和分析问题的能力(方法重点)
课前自主研习
一、金属与水的反应
1.钠与水的反应
(1)实验探究:钠与水的化学反应。
实验操作
实验现象
结论或解释
①钠浮在水面上
①钠的密度比水小
②钠熔化成小球
步骤 6:师生互动完成【探究 2】。可利用【问题导思】中的 问题作为主线。
步骤 7:通过【例 2】和教材 P51“铝与 NaOH 溶液反应”讲 解研析,对【探究 2】“铝与酸、强碱反应”中反应特点进行总 结并掌握有关计算规律。
步骤 8:指导学生自主完成【巩固掌握 2】和【当堂自主纠 错】中 3~5 题。
2.铝与 NaOH 溶液的反应为氧化还原反应,该反应中何种 物质为氧化剂和还原剂?
【提示】 铝与 NaOH 溶液的反应的实质是铝先与水反应生成 Al(OH)3 和氢气,化学方程式为 2Al+6H2O===2Al(OH)3+3H2↑。 由于 Al(OH)3 呈现两性,与 NaOH 溶液反应生成偏铝酸钠。发生反 应的化学方程式为 Al(OH)3+NaOH===NaAlO2+2H2O,上述两个 反应叠加得到的方程式为:
答案 (1)D (2)①2Na+2H2O===2NaOH+H2↑ NaOH+NaHCO3===Na2CO3+H2O ②2Na+2H2O===2NaOH+H2↑ 3NaOH+FeCl3===Fe(OH)3↓+3NaCl
探究 2 铝与酸、强碱溶液的反应
1.铝与盐酸、NaOH 溶液反应的化学方程式中,Al 与 H2 的计量数有何规律?
2.钠与水反应实验现象的观察 应的实验现象观察(能力重难点)
3.掌握铁与水蒸气的反应原理 3.注意实验现象的讨论、培养观察
和分析问题的能力(方法重点)
课前自主研习
一、金属与水的反应
1.钠与水的反应
(1)实验探究:钠与水的化学反应。
实验操作
实验现象
结论或解释
①钠浮在水面上
①钠的密度比水小
②钠熔化成小球
步骤 6:师生互动完成【探究 2】。可利用【问题导思】中的 问题作为主线。
步骤 7:通过【例 2】和教材 P51“铝与 NaOH 溶液反应”讲 解研析,对【探究 2】“铝与酸、强碱反应”中反应特点进行总 结并掌握有关计算规律。
步骤 8:指导学生自主完成【巩固掌握 2】和【当堂自主纠 错】中 3~5 题。
金属与酸反应的图像问题 ppt课件
A. 产生H2的速率N>M B. 生成H2的质量M<N C. 相对原子质量较大的是N D. M、N两种金属中较活泼的是N
2021/3/30
20
5.将质量相等的A、B、C三种金属,同时分别 放入三份溶质质量分数相同且足量的稀盐酸中, 反应生成H2的质量与反应时间的关系如图所示, 根据图中所提供的信息,得出的结论正确的是
(A ) A. 放出的H2的质量是A>B>C B. 金属活动性顺序A>B>C C. 相对原子质量是A>B>C D. 反应速率最大的是A
2021/3/30
21
2、等质量的金属A、B与相同质量的稀硫酸 反应,在反应中A、B均显+2价,产生氢气的 质量随时间变化的情况如右图。则:
⑴金属A、B的活动性:A__>__B__ ⑵金属A、B的相对原子质量_A_>__B_。 ⑶对于曲线A表示的反应,物质稀__硫__酸___
/t 8
(2)向等质量的Mg、Al、Zn、Fe中分别滴加等浓度的 稀硫酸至过量,Mg产生的氢气质量的图像如图所示, 请在图中画出Al、Zn、Fe的图像。
Al
Zn
Fe
Mg +H2SO4=MgSO4 +H2↑ 2Al+3H2SO4=Al2(SO4 )3+3H2↑ Fe20+21/3H/320SO4=FeSO4 +H2↑ Zn +H2SO4=ZnSO4 +H2↑9
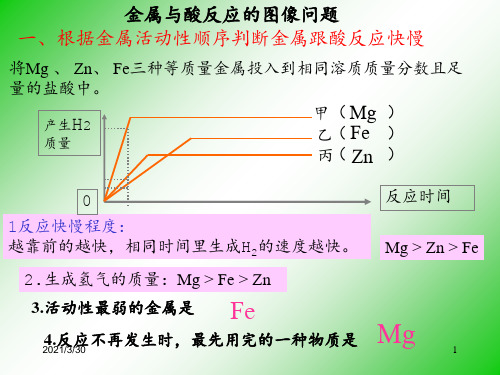
金属与酸反应的图像问题 一、根据金属活动性顺序判断金属跟酸反应快慢
将Mg 、 Zn、 Fe三种等质量金属投入到相同溶质质量分数且足 量的盐酸中。
产生H2
质量
甲( Mg ) 乙( Fe ) 丙( Zn )
0 1反应快慢程度: 越靠前的越快,相同时间里生成H2的速度越快。
2021/3/30
20
5.将质量相等的A、B、C三种金属,同时分别 放入三份溶质质量分数相同且足量的稀盐酸中, 反应生成H2的质量与反应时间的关系如图所示, 根据图中所提供的信息,得出的结论正确的是
(A ) A. 放出的H2的质量是A>B>C B. 金属活动性顺序A>B>C C. 相对原子质量是A>B>C D. 反应速率最大的是A
2021/3/30
21
2、等质量的金属A、B与相同质量的稀硫酸 反应,在反应中A、B均显+2价,产生氢气的 质量随时间变化的情况如右图。则:
⑴金属A、B的活动性:A__>__B__ ⑵金属A、B的相对原子质量_A_>__B_。 ⑶对于曲线A表示的反应,物质稀__硫__酸___
/t 8
(2)向等质量的Mg、Al、Zn、Fe中分别滴加等浓度的 稀硫酸至过量,Mg产生的氢气质量的图像如图所示, 请在图中画出Al、Zn、Fe的图像。
Al
Zn
Fe
Mg +H2SO4=MgSO4 +H2↑ 2Al+3H2SO4=Al2(SO4 )3+3H2↑ Fe20+21/3H/320SO4=FeSO4 +H2↑ Zn +H2SO4=ZnSO4 +H2↑9
金属与酸反应的图像问题 一、根据金属活动性顺序判断金属跟酸反应快慢
将Mg 、 Zn、 Fe三种等质量金属投入到相同溶质质量分数且足 量的盐酸中。
产生H2
质量
甲( Mg ) 乙( Fe ) 丙( Zn )
0 1反应快慢程度: 越靠前的越快,相同时间里生成H2的速度越快。
初中化学金属与酸反应的解题技巧复习精品PPT课件

偶尔来给自己一点喘息的余地和放松的空间吧,只为回归纯粹。 于是,我选择了一个周五的傍晚,住进了“花筑”民宿,来到了位于迪士尼周边2km的小镇。
算是给自己放一个小假,只为圆一场童话梦。 穿梭回到童年,就为简单、不知所谓的快乐一番。
我选择了一家名叫“花筑“的客栈,热情友善体贴的老板会在上海地铁11号线的终点站迪士尼和客栈之间,往返接送你的整个行程。
在《通往财富自由之路》中,笑来先生有一段对财富的精彩描述:人类真正认识市场的好处不过两三百年,而真正研究经济的运作规律迄今也不过300年,而人类对投资理财的探索,只不过200多年才开始的,对于概率和复利这样认知和应用也不到100年左右。根本称不上经验丰富。
一个短暂快乐的周末小假期,给予我的时光让我充分认识到: 我不会再装模作样地拥有很多朋友,而是要回到了真实独立的自我之中,以真正的我开始了独自的生活。 虽然有时我也会因为寂寞而难以忍受空虚的折磨,但我宁愿以这样的方式来维护自己的自尊,也不愿以耻辱为代价去换取那种表面的朋友。
正所谓,真正的生命不是你活了多少日子,而是你记住了多少日子。
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
• 问题2:有一种由两种金属组成的合金 3.0克,与足量酸反应放出氢气0.1克, 则两种金属可能是:
• A: Al 、Mg
B: Al 、Zn
• C: Zn 、Fe
D: Zn、 K
• 结论:投入的铝和镁的质量比为 m : n = 33 : 32
2020/1/1
Al > Mg > Ca > Na > Fe > Zn > K
算是给自己放一个小假,只为圆一场童话梦。 穿梭回到童年,就为简单、不知所谓的快乐一番。
我选择了一家名叫“花筑“的客栈,热情友善体贴的老板会在上海地铁11号线的终点站迪士尼和客栈之间,往返接送你的整个行程。
在《通往财富自由之路》中,笑来先生有一段对财富的精彩描述:人类真正认识市场的好处不过两三百年,而真正研究经济的运作规律迄今也不过300年,而人类对投资理财的探索,只不过200多年才开始的,对于概率和复利这样认知和应用也不到100年左右。根本称不上经验丰富。
一个短暂快乐的周末小假期,给予我的时光让我充分认识到: 我不会再装模作样地拥有很多朋友,而是要回到了真实独立的自我之中,以真正的我开始了独自的生活。 虽然有时我也会因为寂寞而难以忍受空虚的折磨,但我宁愿以这样的方式来维护自己的自尊,也不愿以耻辱为代价去换取那种表面的朋友。
正所谓,真正的生命不是你活了多少日子,而是你记住了多少日子。
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
• 问题2:有一种由两种金属组成的合金 3.0克,与足量酸反应放出氢气0.1克, 则两种金属可能是:
• A: Al 、Mg
B: Al 、Zn
• C: Zn 、Fe
D: Zn、 K
• 结论:投入的铝和镁的质量比为 m : n = 33 : 32
2020/1/1
Al > Mg > Ca > Na > Fe > Zn > K
金属与酸和水的反应ppt课件

20
(3). 钠和铁与水反应的启示
以上学习了两种不同的金属与水的反 应,从条件和产物都不相同,最本质的 原因还是金属的活动性不同。其实我们 也可以根据金属与水、酸反应的情况来 反过来推测金属的活动性。
21
思考:观察此图,你有何看法?
God Save me!!
盐酸
呵呵,挺 舒服,我 不怕…
22
活泼金属与水反应
注意:钠与水、酸反应的实质是与H+的反应, 酸里面的H+浓度大,所以钠与酸反应更快。
12
铁与水能不能反应?
13
铁不能与冷、热水反应,(可以在水, 氧气的条件下被腐蚀生锈,主要成分是 三氧化二铁)但能否在高温下与水蒸气 反应?
《铁与水蒸气反应》
14
请设计一个简单的实验装置,验证 铁粉与水蒸气反应与否?
25
3 化学兴趣小组利用如图装置进行“铁与水反应”的实 验,并检验产物的性质,请回答下列问题:
(1)A 装置的作用是__________________,B 中反应的化 学方程式为____________________________________。 (2)D 的作用是___________________________________。
3Fe+4H2O(g)===Fe3O4+4H2
注意:此反应生成的是Fe3O4
水是以气态(g)形式参加反应 条件是加热 高温 氢气不加气体符号
19
(2). 问题与思考-----水也能成炸药
英国一家炼铁厂的熔铁炉底部产生了 裂缝,顿时炽热的铁水从裂口夺路而出。 当温度高达摄氏一千多度的铁水碰上炉 旁一条小水沟的时候,刹那间“轰”的 一声震天动地的巨响,整个车间被掀掉 了,水为什么会产生这么大的相当于 TNT炸药的威力呢?
(3). 钠和铁与水反应的启示
以上学习了两种不同的金属与水的反 应,从条件和产物都不相同,最本质的 原因还是金属的活动性不同。其实我们 也可以根据金属与水、酸反应的情况来 反过来推测金属的活动性。
21
思考:观察此图,你有何看法?
God Save me!!
盐酸
呵呵,挺 舒服,我 不怕…
22
活泼金属与水反应
注意:钠与水、酸反应的实质是与H+的反应, 酸里面的H+浓度大,所以钠与酸反应更快。
12
铁与水能不能反应?
13
铁不能与冷、热水反应,(可以在水, 氧气的条件下被腐蚀生锈,主要成分是 三氧化二铁)但能否在高温下与水蒸气 反应?
《铁与水蒸气反应》
14
请设计一个简单的实验装置,验证 铁粉与水蒸气反应与否?
25
3 化学兴趣小组利用如图装置进行“铁与水反应”的实 验,并检验产物的性质,请回答下列问题:
(1)A 装置的作用是__________________,B 中反应的化 学方程式为____________________________________。 (2)D 的作用是___________________________________。
3Fe+4H2O(g)===Fe3O4+4H2
注意:此反应生成的是Fe3O4
水是以气态(g)形式参加反应 条件是加热 高温 氢气不加气体符号
19
(2). 问题与思考-----水也能成炸药
英国一家炼铁厂的熔铁炉底部产生了 裂缝,顿时炽热的铁水从裂口夺路而出。 当温度高达摄氏一千多度的铁水碰上炉 旁一条小水沟的时候,刹那间“轰”的 一声震天动地的巨响,整个车间被掀掉 了,水为什么会产生这么大的相当于 TNT炸药的威力呢?
中考专题复习金属与酸反应的专题PPT精品课件

物的质量为( B)
A.13.6g
B.13.4g
C.12g D.11g
7、今有56g镁、铁、锌的混合物跟足量的稀硫酸,
反应后得到的混合溶液,经蒸发后得到200g无水硫
酸盐,则反应产生的H2的质量是
()B
8、两金属A和B的相对分子原子质量之比为8:9, 等质量的A和B分别与足量的稀盐酸反应,生成的氢 气质量之比为3:4.则两金属的化合价之比为
2、方程式书写
四种金属与两种酸反应的化学方程式
Mg + H2SO4 = MgSO4 + H2↑ 2Al +3 H2SO4 = Al2(SO4)3 +3 H2↑ Zn + H2SO4 = ZnSO4 + H2↑ Fe + H2SO4 = FeSO4 + H2↑
Mg+ 2HCl =MgCl2 + H2↑ 2Al + 6HCl ==2AlCl3 + 3 H2↑ Zn + 2HCl =ZnCl2 + H2↑
10克镁,右边烧杯中同时加入10克铝,反应结 束后天平是否平衡? 。 不平衡 开始反应后天平向 右边偏转,反应完毕天平 向 左偏边转。
练习
1、在已经调节平衡的天平左右两个托盘上各 放上一个大小相同的烧杯,再向两个烧杯中各 加入质量相同的含H2SO49.8克的稀硫酸,然后 向左、右两边的烧杯中各加入铁、鋅,充分反 应后天平仍然平衡的是( )B
1、
God Save me!!
为什 么受 伤的 总是 我!
盐酸
我得意的 笑,又得 意的笑…
金属与盐酸的反应
无所谓, 我无所谓…
金
稀盐酸(稀硫酸)
属
现象
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
问题2:有一块不纯的铁,已知它含有 铜、钙、铝、镁中的一种或几种金属 杂质,56g这样的金属与足量的稀硫酸 充分反应后,生成2g氢气,则此铁块 中一定含有的金属杂质为____。
结论:这种铁块中一定含有的金属杂质是
铜。 2020/12/11
6
探究问题(二)
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24 g
40g
46g 56 g 65g 78g
问题1:天平两边分别放着盛有等量足 量的稀硫酸的烧杯,天平平衡,向天 平两边分别加入等质量的铝和铁,天 平将偏向哪一边?
结论:天平将偏向加铁的一边
化学课堂教学设计
金属与酸反应类型题的解题技巧
2020/12/11
1
教学目标:
知识目标:1、概括金属与酸反应量的关系的规律。
2、熟练地应用规律解决实际问题
能力目标:1、通过金属与酸反应规律的概括、总结、应用,
培
养大家分析综合能力及发现问题、解决问题的能
力。
2、通过金属与酸反应量的关系的规律的拓展,培养
A: 3gAl 、3gFe B: 7gZn、 7gFe
C: 5gMg 、5gAl D: 2gMg、 2gAl
E: 2.3gNa、2.4gMg
结论:使天平仍然平衡的是B、C、E。
2020/12/11
11
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24g 40g 46g 56g 65g 78g
问题6:将Cu和Al的合金和等质量的 Mg,分别投入两边有等量足量的稀硫 酸的小烧杯中,完全反应后天平仍然 平衡,则合金中Cu和Al的质量比为_ _。
结论:合金中Cu和Al的质量比为1 : 3。
2020/12/11
12
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
D: Zn、 K
结论:B、C有可能
2020/12/11
8
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
问题3:天平两边分别放着盛有等量足量 的稀盐酸的烧杯,向两边分别投入一
定量的铝和镁,充分反应后天平仍然
平衡,则投入的铝和镁的质量比是_ ____。
2020/12/11
3
探究问题(一)
1、请同学们迅速写出铝、镁、 铁、锌与稀硫酸反应的化学 方程式,指出各物质间量的 关系。
2、以小组为单位讨论在上述 反应中各物质间量的关系如 何?存在哪些规律?
2020/12/11
4
2020/12/11
Mg + H2SO4 = MgSO4 + H2↑
结论:一定有剩余的金属是Al、Fe、Mg, 剩余最多的是Al,可能没有剩余的是Zn。
2020/12/11
10
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24g 40g 46g 56g 65g 78g
问题5:天平两边分别放着盛有100克 9.8%的稀硫酸和100克7.3%的稀盐酸 的小烧杯,分别投入下列物质,反应 后天平仍然平衡的是
2
2
2
2
2
2
2
18
24
40
46 56 65 78
以铝为例
2 18
的含义是18克铝与足量的酸反应放
出氢气的质量是2克,即
2 18
*18=2克,那么X克
铝生成氢气的质量就是
2Hale Waihona Puke 18*X。由于生成的氢气中的氢元素是从酸中置换出来的,所以可推断
要生成2克氢气需要硫酸的质量是98克,盐酸
是73克。
2020/12/11
结论:投入的铝和镁的质量比为
m : n = 33 : 32
2020/12/11
9
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
问题4:有四支盛有等质量、等质量分 数的稀硫酸的小烧杯,分别向其中投 入等质量的Al、Fe、Zn、Mg,充分反 应后,天平仍然平衡,则一定有剩余 的金属是__,剩余最多的是___, 可能没有剩余的是____。
15
问题1:在托盘天平的两盘上各放一只
烧杯,分别盛有等质量足量的稀盐酸,
天平平衡,向左边烧杯加入Ng镁粉, 向右边烧杯加入Ng铝和氧化铝的混合
物,充分反应,若天平仍然平衡,则
混合物中铝元素和氧元素的质量比为
____。
结2论020/1:2/11 铝元素和氧元素的质量比为15:2
14
Al > Mg > Ca > Na > Fe > Zn > K
2020/12/11
7
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
问题2:有一种由两种金属组成的合金 3.0克,与足量酸反应放出氢气0.1克, 则两种金属可能是:
A: Al 、Mg
B: Al 、Zn
C: Zn 、Fe
24 98
2
Fe + H2SO4 = FeSO4 + H2↑
56 98
2
Zn + H2SO4 = ZnSO4 + H2↑
65 98
2
2Al +3H2SO4= Al2(SO4)3+3H2↑
54 294
6
18 98
2
5
等质量金属与足量酸反应置换出氢气的能力:
Al > Mg > Ca > Na > Fe > Zn > K
大家创新思维能力和灵活运用所学知识的能力。
情感、态度、价值观:通过讨论、探究,培养大家乐学、好
学的精神,引导大家体味知识形成过程中的快乐。
2020/12/11
2
例题1
现有一种由两种金属组成的 合金3.0克,使其与足量酸反 应,共放出0.1氢气克,则这 两种金属可能是( )
A:Al、Mg B:Al、Zn C:Zn、Fe D:Zn、K
问题7:5.6克不纯的Fe,与足量酸反应 生成0.22克氢气,则Fe粉中可能混有:
A:Zn B:Cu C:Mg D:K
结论: Fe粉中可能混有选项C。
2020/12/11
13
知识的拓展与迁移
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24g 40g 46g 56g 65g 78g
问题2:有一块不纯的铁,已知它含有 铜、钙、铝、镁中的一种或几种金属 杂质,56g这样的金属与足量的稀硫酸 充分反应后,生成2g氢气,则此铁块 中一定含有的金属杂质为____。
结论:这种铁块中一定含有的金属杂质是
铜。 2020/12/11
6
探究问题(二)
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24 g
40g
46g 56 g 65g 78g
问题1:天平两边分别放着盛有等量足 量的稀硫酸的烧杯,天平平衡,向天 平两边分别加入等质量的铝和铁,天 平将偏向哪一边?
结论:天平将偏向加铁的一边
化学课堂教学设计
金属与酸反应类型题的解题技巧
2020/12/11
1
教学目标:
知识目标:1、概括金属与酸反应量的关系的规律。
2、熟练地应用规律解决实际问题
能力目标:1、通过金属与酸反应规律的概括、总结、应用,
培
养大家分析综合能力及发现问题、解决问题的能
力。
2、通过金属与酸反应量的关系的规律的拓展,培养
A: 3gAl 、3gFe B: 7gZn、 7gFe
C: 5gMg 、5gAl D: 2gMg、 2gAl
E: 2.3gNa、2.4gMg
结论:使天平仍然平衡的是B、C、E。
2020/12/11
11
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24g 40g 46g 56g 65g 78g
问题6:将Cu和Al的合金和等质量的 Mg,分别投入两边有等量足量的稀硫 酸的小烧杯中,完全反应后天平仍然 平衡,则合金中Cu和Al的质量比为_ _。
结论:合金中Cu和Al的质量比为1 : 3。
2020/12/11
12
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
D: Zn、 K
结论:B、C有可能
2020/12/11
8
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
问题3:天平两边分别放着盛有等量足量 的稀盐酸的烧杯,向两边分别投入一
定量的铝和镁,充分反应后天平仍然
平衡,则投入的铝和镁的质量比是_ ____。
2020/12/11
3
探究问题(一)
1、请同学们迅速写出铝、镁、 铁、锌与稀硫酸反应的化学 方程式,指出各物质间量的 关系。
2、以小组为单位讨论在上述 反应中各物质间量的关系如 何?存在哪些规律?
2020/12/11
4
2020/12/11
Mg + H2SO4 = MgSO4 + H2↑
结论:一定有剩余的金属是Al、Fe、Mg, 剩余最多的是Al,可能没有剩余的是Zn。
2020/12/11
10
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24g 40g 46g 56g 65g 78g
问题5:天平两边分别放着盛有100克 9.8%的稀硫酸和100克7.3%的稀盐酸 的小烧杯,分别投入下列物质,反应 后天平仍然平衡的是
2
2
2
2
2
2
2
18
24
40
46 56 65 78
以铝为例
2 18
的含义是18克铝与足量的酸反应放
出氢气的质量是2克,即
2 18
*18=2克,那么X克
铝生成氢气的质量就是
2Hale Waihona Puke 18*X。由于生成的氢气中的氢元素是从酸中置换出来的,所以可推断
要生成2克氢气需要硫酸的质量是98克,盐酸
是73克。
2020/12/11
结论:投入的铝和镁的质量比为
m : n = 33 : 32
2020/12/11
9
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
问题4:有四支盛有等质量、等质量分 数的稀硫酸的小烧杯,分别向其中投 入等质量的Al、Fe、Zn、Mg,充分反 应后,天平仍然平衡,则一定有剩余 的金属是__,剩余最多的是___, 可能没有剩余的是____。
15
问题1:在托盘天平的两盘上各放一只
烧杯,分别盛有等质量足量的稀盐酸,
天平平衡,向左边烧杯加入Ng镁粉, 向右边烧杯加入Ng铝和氧化铝的混合
物,充分反应,若天平仍然平衡,则
混合物中铝元素和氧元素的质量比为
____。
结2论020/1:2/11 铝元素和氧元素的质量比为15:2
14
Al > Mg > Ca > Na > Fe > Zn > K
2020/12/11
7
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需:18g 24g 40g 46g 56g 65g 78g
问题2:有一种由两种金属组成的合金 3.0克,与足量酸反应放出氢气0.1克, 则两种金属可能是:
A: Al 、Mg
B: Al 、Zn
C: Zn 、Fe
24 98
2
Fe + H2SO4 = FeSO4 + H2↑
56 98
2
Zn + H2SO4 = ZnSO4 + H2↑
65 98
2
2Al +3H2SO4= Al2(SO4)3+3H2↑
54 294
6
18 98
2
5
等质量金属与足量酸反应置换出氢气的能力:
Al > Mg > Ca > Na > Fe > Zn > K
大家创新思维能力和灵活运用所学知识的能力。
情感、态度、价值观:通过讨论、探究,培养大家乐学、好
学的精神,引导大家体味知识形成过程中的快乐。
2020/12/11
2
例题1
现有一种由两种金属组成的 合金3.0克,使其与足量酸反 应,共放出0.1氢气克,则这 两种金属可能是( )
A:Al、Mg B:Al、Zn C:Zn、Fe D:Zn、K
问题7:5.6克不纯的Fe,与足量酸反应 生成0.22克氢气,则Fe粉中可能混有:
A:Zn B:Cu C:Mg D:K
结论: Fe粉中可能混有选项C。
2020/12/11
13
知识的拓展与迁移
Al > Mg > Ca > Na > Fe > Zn > K
换2g氢气需: 18g 24g 40g 46g 56g 65g 78g
