离子共存的判断方法
初中科学中怎么判断离子是否能在一种溶液中大量共存

初中科学中怎么判断离子是否能在一种溶液中大量共存、求方法、或者详细点关于离子的资料、还有几种物质混合在一起、能否是透明不产生气体的、怎么判断、在选择题中出现比较广泛、例如A选项Nacl、Baso⒋NaOH、Fe2o3、举例子这是不是实际题目最佳答案离子共存之一一般注意以下几点:①在强酸性溶液中,不能大量存在弱酸根离子:如碳酸根(CO3 2-)、碳酸氢根(HCO3 -)、硫离子(S 2-)、硫氢根离子(HS-)、亚硫酸根离子(SO3 2-)、硅酸根离子(SiO3 2-)、偏铝酸根离子(AlO2-)、氟离子(F-)等,也不能有大量的氢氧根(OH-)。
②强碱性溶液中,不能大量存在弱碱金属离子。
如:镁离子(Mg2+)、亚铁离子(Fe2+)、铝离子(Al3+)、铜离子(Cu2+)及铵根离子(NH4+)等,也不能大量存在氢离子(H+)及酸式根离子:HCO3-、HSO3-、HS-、H2PO4-等。
③能发生氧化还原反应的离子也不能共存:如:Fe3+与I-,Cu2+与I-,H+Fe2+与NO3-,H+与SO32-,ClO-与S2-,ClO-与Fe2+,H+、I-与NO3-,H+、I-与SO32-或S2-等。
④能形成络离子的也不能共存:如:Fe3+与SCN -,Ag+与SO32-,Fe3+与C6H5O-等。
以上内容简化为:①强酸不存弱酸根②强碱不存弱碱金属③氧化还原定不存④成弱也不存离子共存之二所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。
(1)生成难溶物或微溶物:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等不能大量共存。
(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-、SO32-、OH-、HSO3-等不能大量共存。
(3)生成难电离的物质:如H+与CH3COO-(即醋酸根离子)、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱;H+与OH-生成水,这些离子不能大量共存。
离子共存的判断

离子共存的判断
离子共存是指在一定条件下存在含有多种离子的溶液中,这些离子不会相互反应而保持共存状态。
如果未能正确判断离子共存的存在,就可能导致实验数据的不准确或偏移,从而影响实验的准确性和可靠性。
判断离子共存的方法主要有以下几种:
1. 颜色反应法:该方法是针对金属离子的颜色反应进行判断的。
不同金属离子在溶液中会产生不同的颜色反应,通过对比颜色可以确定溶液中是否存在多种金属离子。
但是这种方法只适用于颜色反应比较显著的金属离子,对于颜色反应不明显或相似的金属离子判断不准确。
2. 沉淀反应法:该方法基于沉淀反应的原理进行判断,如果溶液中不同离子的溶解度积差异比较大,则会进行沉淀反应,并在溶液中形成沉淀。
通过观察溶液是否产生沉淀可以判断溶液中是否存在多种离子。
3. 电性质反应法:该方法是利用溶液中离子的电性质进行判断的。
如果在溶液中电导率明显增加,则说明存在多种离子共存。
通过电性质的变化可以判断不同离子在溶液中的存在情况。
4. 同时加入不同试剂法:该方法是利用同时加入多种试剂进行反应的原理进行判断的。
不同离子在溶液中与不同试剂反应的规律是不同的,同时加入多种试剂可以通过反应的规律来判断存在的离子种类。
5. 光学仪器检测法:该方法是利用光学仪器对溶液进行检测,通过对光学仪器的测量结果来判断不同离子的存在情况。
该方法相对其他方法准确性更高,但需要昂贵的光学仪器。
离子共存的判断方法乐乐课堂

离子共存的判断方法乐乐课堂离子共存是化学中一个重要的概念,指的是不同离子在溶液或晶体中共存的现象。
在化学实验和实际应用中,判断离子共存的方法非常重要。
在本文中,我们将介绍一些常用的离子共存的判断方法。
一、常用的离子共存判断方法1. 气味判断法:有些离子在溶液中会产生特殊的气味,通过嗅觉判断可以初步确定离子的共存情况。
例如,硫化氢(H2S)气体具有刺鼻的臭鸡蛋味,当我们嗅到这种味道时,就可以判断溶液中可能存在硫化氢离子(HS-)。
2. 颜色判断法:某些离子具有特殊的颜色,通过观察溶液的颜色变化可以判断离子的共存情况。
例如,铁离子(Fe3+)溶液呈现黄褐色,当我们观察到溶液呈现这种颜色时,就可以初步判断溶液中可能存在铁离子。
3. 沉淀判断法:离子在溶液中常常会发生沉淀反应,通过观察溶液中是否产生沉淀可以判断离子的共存情况。
例如,当我们向溶液中加入硫酸钡(BaSO4)时,如果溶液中出现白色沉淀,则可以判断溶液中可能存在硫酸根离子(SO42-)和钡离子(Ba2+)。
二、离子共存判断方法的应用判断溶液中离子的共存情况,我们可以确定溶液的组成,进而进行相应的化学分析和处理。
1. 水质分析:水中常常含有各种离子,如钙离子(Ca2+)、镁离子(Mg2+)、铁离子(Fe3+)等。
通过对水样进行离子共存判断,可以了解水质的优劣,并采取相应的净水措施。
2. 土壤分析:土壤中也含有各种离子,如氯离子(Cl-)、硝酸根离子(NO3-)等。
通过离子共存判断,可以了解土壤的肥力和污染情况,为农业生产提供科学依据。
3. 化学分析:离子共存判断方法在化学分析中也得到广泛应用。
通过判断溶液中离子的共存情况,可以确定化合物的成分和结构,为化学实验和工业生产提供指导。
三、离子共存判断方法的局限性离子共存判断方法虽然简单易行,但也存在一定的局限性。
有些离子在共存情况下会发生复杂的化学反应,导致判断结果不准确。
此外,一些离子的共存情况也受到溶液浓度和温度等因素的影响,需要在实验中进行进一步的控制和调节。
高中离子共存的判断方法

高中离子共存的判断方法
1. 颜色法:离子共存的溶液往往呈现特定的颜色,可以通过观察溶液的颜色来判断是否存在离子共存。
铜离子与铁离子共存时,溶液呈现深蓝色。
2. 沉淀法:某些离子共存的溶液在一定条件下会生成沉淀,通过观察是否生成沉淀可以判断是否存在离子共存。
氯离子与银离子共存时,加入硝酸银会生成白色沉淀。
3. 导电性法:离子溶液具有良好的导电性,而纯的非电解质溶液则不导电。
可以通过测量溶液的导电性来判断是否存在离子共存。
4. pH法:某些离子共存的溶液的pH值会发生变化,可以通过测量溶液的pH值来判断是否存在离子共存。
酸性溶液中氢离子与铁离子共存时,溶液呈现红色。
5. 气体析出法:某些离子共存的溶液在一定条件下会析出气体,可以通过观察是否有气体析出来判断是否存在离子共存。
盐酸与碳酸氢铵溶液共存时会析出二氧化碳气体。
6. 晶体形状法:某些离子共存的溶液在蒸发过程中会生成特定形状的晶体,可以通过观察晶体的形状来判断是否存在离子共存。
7. 比重法:某些离子共存的溶液在一定条件下会呈现比纯溶质的溶液更大或更小的比重,可以通过测量溶液的比重来判断是否存在离子共存。
8. 活化分析法:通过使用合适的活化试剂,可以使某些离子共存的溶液变为一种活化溶液,然后通过观察是否有化学反应发生来判断是否存在离子共存。
9. 光谱法:利用不同离子溶液在特定波长下的吸光或发射光谱特性,可以通过光谱分析方法来判断是否存在离子共存。
10. 摩尔比法:根据离子溶液中溶质的摩尔比例,可以通过计算溶液中每种离子的摩尔浓度来判断是否离子共存。
离子共存判断的四个原则
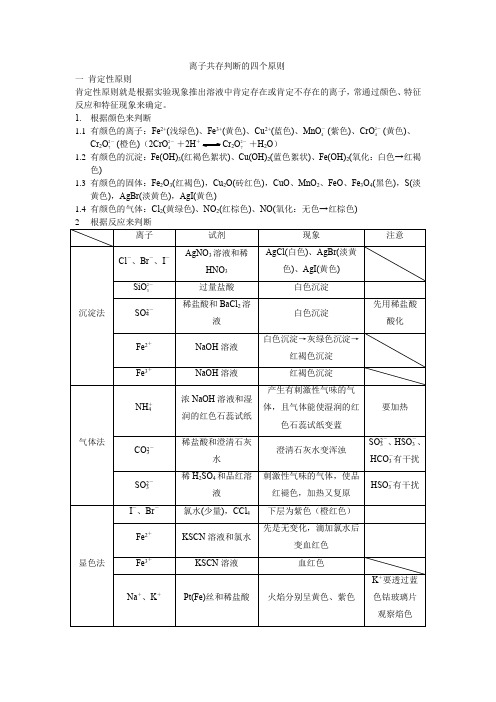
离子共存判断的四个原则一肯定性原则肯定性原则就是根据实验现象推出溶液中肯定存在或肯定不存在的离子,常通过颜色、特征反应和特征现象来确定。
1. 根据颜色来判断1.1有颜色的离子:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO-4(紫色)、CrO2-4(黄色)、Cr2O2-7(橙色)(2CrO2-4+2H+Cr2O2-7+H2O)1.2有颜色的沉淀:Fe(OH)3(红褐色絮状)、Cu(OH)2(蓝色絮状)、Fe(OH)2(氧化:白色→红褐色)1.3有颜色的固体:Fe2O3(红褐色),Cu2O(砖红色),CuO、MnO2、FeO、Fe3O4(黑色),S(淡黄色),AgBr(淡黄色),AgI(黄色)1.4有颜色的气体:Cl2(黄绿色)、NO2(红棕色)、NO(氧化:无色→红棕色)二互斥性原则互斥性原则是指在肯定某些离子的同时,结合离子共存规律(复分解反应、氧化还原反应的规律),否定一些离子的存在。
1根据溶液的酸碱性1.1强酸性溶液(非盐类水解)中不能共存:CH3COO-、F-、CO2-3/HCO-3、SO2-3/HSO-3、SiO2-3、ClO-、S2-(弱酸根)1.2强酸性溶液(非盐类水解)中不能共存:NH+4、Mg2+~Ag+、酸式根(HCO-3、HSO-3)溶液中隐含的酸碱性:①常温下,水电离产生的c(H+)= 1.0×10-12mol·L-1,则要注意溶液的pH可能为2或者12②与Al反应放出氢气的溶液,该溶液可能是酸性或强碱性③使酸碱指示剂变色,熟记常见指示剂变色范围:甲基橙:3.1~4.4(红、橙、黄)酚酞8.2~10.0(无色、粉、红)石蕊 5.0~8.2(红、紫、蓝)④常温下,c(H+)c(OH—)=10-a,若10-a>1则溶液呈酸性,若10-a<1则溶液呈碱性,当左右两边同乘以K w,c2(H+)=10-(a+14)2根据复分解反应不能大量共存K盐、Na盐和铵盐均可溶解;Fe2+、Fe3+、Cu2+、Mg2+与OH-、CO2-3、SO2-3、SiO2-3;Cl-只与Ag+不能共存;SO2-4只与Ba2+、Ag+、Ca2+不能大量共存;CO2-3、SO2-3只与K+、Na+、NH+4共存HCO-3、HSO-3不与会发生双水解的Fe2+、Fe3+、(Al3+)共存3三进出性原则进出性原则通常是在一些实验过程中应用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
高中化学之离子能否共存的原因与判断方法(重点,难点,常考点)

离子能否共存的原因与判断方法(重点,难点,常考点!!!)判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存。
下面就离子能否共存的原因与判断方法归纳如下:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+不能大量共存。
④弱酸的酸式阴离子与H+或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO4-、HPO42-等既不能与H+大量共存也不能与OH-大量共存。
(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:① Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;② Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③ NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。
中考化学离子共存的判断方法

中考化学离子共存的判断方法
多种离子能否共存于同一溶液中,归纳起来有四点:一色、二性、三特殊、四反应。
一色,即溶液颜色:
若限定溶液为无色溶液,则Cu2+、Fe3+、MnO4-、Co2+、Cr2O72-、CrO42-、Cr3+等有色离子不能存在。
二性,即溶液的酸性和碱性:
在强酸性溶液中,OH-及弱酸根离子(比如CO32-、SO32-、
S2-、CH3COO-等)均不能大量存在;
在强碱性溶液中,H+及弱碱阳离子(如NH4+、Al3+、Mg2+、Fe3+、等)均不能大量存在,多元弱酸的酸式酸根离子(如HCO3-、HSO3-、HS-、H2PO4-等)在强酸性和强碱性溶液中均不能大量存在。
三特殊,指三种特殊情况:
①AlO2-与HCO3-不能大量共存,发生反应的方程式为AlO2-+ HCO3-+H2O==Al(OH)3↓+CO32-;
②“NO3-+H+”组合具有强氧化性,能与S2-、Fe2+、I-等发生发应,而这种组合常常较为隐蔽,不易被察觉;
③NH4+与CH3COO-,Mg2+与HCO3-等组合中,虽然两种离子都能水解且相互促进,但总的水解程度仍很小,他们在溶
液中可以大量共存,但加热时不能大量共存。
四反应,指离子间能发生的四中类型的反应:
能相互反应的离子显然不能大量共存。
①复分解反应,如Ba2+和SO42- 、OH-和NH4+、H+和CH3COO-、
②氧化还原反应,如Fe3+与I-
③相互促进的水解反应,如Al3+和HCO3-、Al3+和AlO2-等。
④生成配合物的反应,如Fe3+和SCN-等。
判断离子是否共存的方法

判断离子是否共存的方法
标题,离子共存的判断方法。
离子共存是化学分析和研究中一个重要的课题。
离子的共存可
能会对化学反应、溶解度、沉淀和分析方法产生影响。
因此,准确
地判断离子是否共存对于化学研究和分析至关重要。
下面将介绍一
些常用的方法来判断离子是否共存。
1. 离子交换法,离子交换法是一种常用的方法,通过观察两种
离子在一定条件下的交换情况来判断它们是否共存。
这种方法适用
于离子交换树脂、离子交换膜等材料的研究。
2. 沉淀法,利用沉淀反应来判断离子是否共存。
当两种离子在
一定条件下形成沉淀时,可以判断它们是否共存。
例如,硫化物沉
淀法可以用来判断金属离子是否共存。
3. 分光光度法,分光光度法是一种通过测定溶液中的吸收或发
射光谱来判断离子是否共存的方法。
通过测定不同波长下的吸光度
或发射光强度,可以得到不同离子的浓度,从而判断它们是否共存。
4. 离子色谱法,离子色谱法是一种通过分离和测定离子的方法,可以用来判断离子是否共存。
通过色谱柱的分离作用,可以将不同
离子分离出来,然后通过检测器检测不同离子的浓度,从而判断它
们是否共存。
以上是一些常用的方法来判断离子是否共存,当然还有其他方法,如电化学方法、质谱法等。
在化学研究和实验中,选择合适的
方法来判断离子是否共存是非常重要的,可以为化学分析和研究提
供准确的数据和结果。
离子能否大量共存问题的分析与判断

离子能否大量共存问题的分析与判断判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存,否则就能大量共存。
下面讨论离子能否共存的原因与判断方法:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+ 与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+ 与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+ 大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+ 不能大量共存。
④弱酸的酸式阴离子与H+ 或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO4-、HPO42-等既不能与H+ 大量共存也不能与OH-大量共存。
(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+ 等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:① Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;② Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③ NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。
离子共存的判断方法初中

离子共存的判断方法初中嘿,同学们!今天咱来聊聊初中化学里特别重要的一个事儿——离子共存的判断方法。
咱先想想,在一个溶液里,各种离子就像一群小伙伴在一起玩耍。
那它们能不能愉快地玩耍,就得看它们之间是不是合得来啦!比如说,氢离子和氢氧根离子,那可就是一对冤家,碰到一起就会产生反应,生成水。
这就像两个脾气不对付的人,在一起就容易吵架,那就没法共存啦!再比如说,钙离子和碳酸根离子,它们碰到一起就会形成沉淀,也就是变成固体从溶液里跑出来啦。
这就好比是两个小伙伴,一旦碰到一起就会黏在一起,然后就没法在溶液里自由活动啦,自然也不能共存咯。
那怎么判断离子能不能共存呢?首先,咱得熟悉那些常见的会发生反应的离子对。
就像你得知道哪些人在一起容易闹别扭一样。
比如说,银离子和氯离子,钡离子和硫酸根离子等等。
这些都是容易产生反应的。
然后呢,看到一个溶液里的离子,咱就想想,它们之间会不会产生什么反应呀。
如果会,那肯定就不能共存啦。
这就好像你看到一群人,你得琢磨琢磨他们之间会不会有矛盾。
还有啊,有些离子在特定条件下才会发生反应。
比如说,氢离子和碳酸根离子,在常温下可能还能共存,但是如果溶液的酸碱度发生变化,它们可能就会反应啦。
这就好比有些人平时还好好的,但是在某些特定情况下就会爆发矛盾一样。
咱再说说那些能共存的离子。
它们就像是一群特别合得来的小伙伴,在一起怎么玩都没事。
比如说钠离子、钾离子、氯离子这些,它们一般都能和平共处,在溶液里快乐地游来游去。
判断离子共存可不能马虎哦!这就像是你交朋友一样,得仔细观察,认真判断。
要是不小心把会闹别扭的离子放在一起,那可就得出错啦!同学们,离子共存的判断方法其实并不难,只要咱多熟悉那些常见的离子反应,多做做练习题,很快就能掌握啦。
相信自己,一定能把这个知识点拿下!以后再遇到离子共存的问题,咱就能轻松搞定,就像解决一道简单的数学题一样容易。
加油吧!让我们在化学的世界里畅游,和那些离子们好好相处!。
离子能否大量共存问题的分析与判断

离子能否大量共存问题的分析与判断判断离子能否大量共存实际上就是判断离子之间能否反应,只要离子间相互反应,那么就不能大量共存,否则就能大量共存。
下面讨论离子能否共存的原因与判断方法:一、常见的离子不能大量共存的原因:(1)发生复分解反应生成难溶物、挥发性物质和难电离物质时不能大量共存。
如:①若阴阳离子能相互结合生成难溶物或微容物性盐,就不能大量共存。
如常见的Ba2+、Ca2+ 与CO32-、SO32-、SO42-、PO43-、SiO32-等;再如常见的Ag+ 与Cl-、Br-、I-、PO43-、CO32-、SO42-、S2-等。
②弱碱的阳离子不能与OH-大量共存。
如常见的Fe2+、Fe3+、Cu2+、NH4+、Ag+、Mg2+、Al3+、Zn2+等与OH-不能大量共存。
③弱酸根阴离子不能与H+ 大量共存。
如常见的CH3COO-、F-、CO32-、SO32-、S2-、PO43-等与H+ 不能大量共存。
④弱酸的酸式阴离子与H+ 或OH-均不能大量共存。
如常见的HCO3-、HSO3-、HS-、H2PO4-、HPO42-等既不能与H+ 大量共存也不能与OH-大量共存。
(2)若离子间能发生氧化还原反应,也不能大量共存。
如:①在酸性条件下,MnO4-具有较强的氧化性,与常见的Cl-、Br-、I-、S2-等能发生氧化还原反应,而不能大量共存;同样,NO3-在酸性条件下也具有较强的氧化性,与Br-、I-、S2-、Fe2+、SO32-等不能大量共存。
②在中性条件下,NO3-与I-、Fe2+ 等可以大量共存。
③无论是在酸性或碱性条件下,ClO-都具有氧化性,与常见的还原性离子如I-、Fe2+、S2-、SO32-等均不能大量共存。
(3)若阴、阳离子间发生“双水解”反应,有的促进反应进行,不能大量共存。
常见的能发生“双水解”反应离子归纳如下:①Al3+与HS-、S-、CO32-、HCO3-、AlO2-、SiO32-、ClO-等;②Fe3+与CO32-、HCO3-、AlO2-、ClO-等;③NH4+与AlO2-、SiO32-等;发生“双水解”反应时,由于水解彻底,可用“===”连接反应物和产物,水解生成的难容物或挥发性物质要加沉淀符号“↓”或气体反符号“↑”。
判断离子大量共存的四个要点

判断离子大量共存的四个要点1.一色(溶液的颜色)若题目要求是无色溶液,则Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫红色)、Cr3+(绿色)、CrO42-(黄色)、Cr2O72-(橙红色)等有色离子不能大量共存。
2.二性(溶液的碱性、酸性)若是酸性溶液,OH-、弱酸根离子(S2-、SO32-、S2O32-、CO32-、CH3COO-、ClO-、F-、AlO2-、SiO32-、PO43-、C6H5O-等)、弱酸的酸式酸根离子(HCO3-、HSO3-、HS-、H2PO4-、HPO42-等)不能大量共存。
若是碱性溶液,则H+、弱碱阳离子(Al3+、Cu2+、Fe2+、Fe3+、Mg2+、Ag+、Zn2+、NH4+等) 、弱酸的酸式酸根离子(HCO3-、HSO3-、HS-、H2PO4-、HPO42-等)不能大量共存。
3.三特殊离子的共存除普遍规律外,还有以下三种特殊情况:(1) AlO2-与HCO3-在水溶液中均因水解呈碱性,但AlO2-的水解能力太强,含有AlO2-的水溶液中c(OH-)较大,能直接与HCO3-作用生成Al(OH)3沉淀和CO32-,故AlO2-与HCO3-不能共存于同一溶液中。
(与其类似的还有AlO2-与HSO3-、HS-、H2PO4-、HPO42-等)(2)NO3-若不是在酸性溶液中,则能与某些还原性较强的离子(如S2-、I-、Fe2+等)共存,因为NO3-只有在酸性条件下才能表现出强氧化性。
又如MnO4-在碱性条件下能氧化SO32-、S2O32-、S2-、I-,但不能氧化Cl-、Br-;在酸性条件下,MnO4-的氧化性很强,常温下就能氧化Cl-、Br-。
(3)水解能力弱的弱碱阳离子与弱酸根离子(如Mg2+与HCO3-、HSO3-以及NH4+与CO32-、CH3COO-等),这些离子水解的程度很小,它们在溶液中能大量共存;如果加热促进水解就不能大量共存。
判断离子是否共存的几种情况

判断离子是否共存的几种情况:(1)发生复分解反应,离子不能大量共存。
①有气体产生如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存①具有较强还原性的离子不能与具有较强氧化性的离子大量共存如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
离子共存的判断方法

离子共存的判断方法-CAL-FENGHAI.-(YICAI)-Company One1离子共存的判定方法一.三审1.溶液有没有颜色Cu2+蓝色 Fe3+棕黄色 Fe2+浅绿色 MnO4-紫红色 Cr2O72-橙(红)色CrO42-(浅)黄色 Cr3+绿色Mn2+浅玫瑰色,稀溶液无色 Fe(H2O) 63+淡紫色 Co2+玫瑰色 Ni2+绿色MnO42-绿色 Fe(CN)64-黄绿色 Fe(CN)63-黄棕色2.溶液的酸碱性(注:H3O+等同于H+)OH-及弱酸根离子(如F-,CO32-,SO32-,S2-,CH3COO-)不能与H+大量共存H+及弱碱根离子(Mg2+,Al3+,Zn2+,Fe3+,Fe2+,Cu2+,Ag+,NH4+)不能与OH-大量共存酸式弱酸根离子(如HCO3-,HSO3-,HS-,HPO3-,H2PO4-)与H+或OH-均不能大量共存3.共存不共存注:生成气体:CO32-,HCO3-,SO32-,HSO3-,S2-,HS-与H+生成沉淀:SiO32-与H+Mg2+,Al3+,Zn2+,Fe3+,Fe2+,Cu2+,Ag+与OH-难溶或微溶性盐生成弱电解质:H+,酸式弱酸根与OH-,F-,CH3COO-,ClO-与H+NH4+与OH-二.看1.是否发生复分解反应(生成难溶、难电离、挥发性物质)2.是否发生氧化还原反应Fe3+与I-,S2-,SO32-(在H+环境下,可抑制Fe3+水解)NO3-(H+)与I-,S2-,SO32-,Br-,Fe2+MnO4-(H+)与I-,S2-,SO32-,Br-,Fe2+,Cl-S2-(H+)与SO32-ClO-与I-,S2-,SO32-,Br-,Fe2+歧化反应:2H++S2O32-=S↓+SO2↑+H2O(产生无色气体和淡黄色沉淀)注:①HS-视同S2-,HSO3-视同SO32-②ClO-与I-,S2-,SO32-,Br-,Fe2+Fe3+与I-,S2-,SO32-不需要在H+环境下助记:锰与氯氯、硝、锰与溴、亚铁铁、氯、硝、锰与碘、负二正四价硫硫负二与正四价(高锰酸根离子与氯离子次氯酸根离子,硝酸根离子,高锰酸根离子与溴离子,亚铁离子铁离子,次氯酸根离子,硝酸根离子,高锰酸根离子与碘离子,负二、正四价硫离子硫负二价与正四价)3.是否发生双水解反应Al3+与S2-,(HS-),CO32-,(HCO3-),AlO2-,SiO32-Fe3+与CO32-,(HCO3-),AlO2-,SiO32-NH4+与AlO2-,SiO32-(其它:AlO2-与Mg2+,Fe2+)注:[Al(OH)4]-相当于AlO2-+2H2O助记:硅酸根、偏铝酸根与铝铁铵碳酸根、碳酸氢根与铝铁硫离子、氢硫酸根只与铝(硅酸根离子,偏铝酸根离子与铝离子,铁离子,铵根离子碳酸根离子,碳酸氢根离子与铝离子,铁离子硫离子、氢硫酸根只与铝)4.是否发生络合反应Fe3+与SCN-,C6H5O-Ag+与NH3·H2O(NH4+, OH-)三.特例①AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-AlO2-+ HSO3-+H2O=Al(OH)3↓+SO32-②PO43-+H2PO4-=2HPO42-四.溶解性①碱K+,Na+,Ba2+,NH4+碱可溶,Ca(OH)2只微溶,其它碱均不溶②盐钾钠铵盐都可溶硝酸盐遇水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡、铅(CaSO4,Ag2SO4微溶)碳酸盐钾、钠、铵才可溶(MgCO3微溶)其它:①PO43-,HPO42-钾、钠、铵才可溶H2PO4-均可溶②硫化物(S2-)钾钠铵钙镁可溶亚硫酸盐(SO32-)钾钠铵可溶③AgCl↓白色AgBr↓淡黄色 AgI↓黄色 Ag2S↓黑色。
高中化学二轮复习离子反应--离子共存三步解题法与离子推断4项基本原则

二轮复习离子反应--离子共存三步解题法与离子推断4项基本原则1.离子大量共存的判断方法溶液中离子能否大量共存的判断准则:看离子在所给条件下能否反应。
其判断步骤:先看条件,后看反应。
(1)先看条件——题干条件①看准题干要求,需辨别的离子组是“大量共存”还是“不能大量共存”,是“可能”还是“一定”。
②看准附加条件,如溶液的颜色(若为无色溶液,则MnO 4-、Fe 3+、Cu 2+、Fe 2+等有色离子不能大量存在);溶液的酸碱性;特定离子或分子的存在等。
(2)后看反应——所给离子之间能否发生反应反应类型不能大量共存的离子复分解反应生成沉淀Ba 2+与CO 32-、SO 42-、SO 32-;SiO 32-与H +不能大量共存生成气体H +与CO 32-、HCO 3-、S 2-、SO 32-等不能大量共存生成弱电解质H +与OH -、ClO -、F -、CH 3COO -不能大量共存①澄清溶液不代表无色。
②含有大量Fe 3+的溶液,隐含是酸性溶液,并具有强氧化性。
③含有大量NO 3-的溶液,隐含酸性条件下具有强氧化性。
④含有大量AlO 2-的溶液,隐含是碱性溶液。
⑤能发生互相促进水解反应的离子也可能大量共存。
如:NH 4+与CH 3COO -、CO 32-,Mg 2+与HCO 3-等组合中,虽然存在相互促进水解情况,但水解程度较小,在溶液中仍然能大量共存。
2.化学实验与离子检验 (1)沉淀法在离子检验中的应用(3)显色法在离子检验中的应用-,Fe3++3SCN-===Fe(SCN)3Fe3+KSCN溶液红色Fe3++3SCN-===Fe(SCN)3Na+、K+Pt(Fe)丝和稀盐酸火焰分别呈黄色、紫色K+要透过蓝色钴玻璃观察焰色离子共存题目的3步解题流程离子推断中的4项基本原则题组一 离子能否大量共存的判断1.(2018·潮州模拟)常温下,下列各组离子在指定溶液中一定能大量共存的是() A .1.0 mol·L -1的KNO 3溶液:H +、Fe 2+、Cl -、SO 42-B .通入过量SO 2气体后的溶液:H +、Ca 2+、Fe 3+、NO 3-C .通入足量CO 2的溶液:H +、NH 4+、Al 3+、SO 42-D .与铝反应产生大量氢气的溶液:Na +、K +、CO 32-、NO 3-解析:选C A 项,1.0 mol·L -1的KNO 3溶液中,NO 3-、H +和Fe 2+会发生氧化还原反应,不能大量共存,错误;B 项,通入过量SO 2气体后的溶液中,SO 2能被离子组合(NO 3-、H +)和Fe 3+氧化,不能大量共存,错误;C 项,通入足量CO 2的溶液中,各离子之间不发生任何反应而能大量共存,正确;D 项,与铝反应产生大量H 2的溶液呈酸性或碱性,在酸性溶液中,H +和CO 32-反应不能大量共存,酸性溶液中存在NO 3-不能产生H 2,错误。
判断离子共存的四原则

判断离子共存的四原则离子共存知识是高考的热点,也是每年高考的必考内容。
离子能否共存其实就是看离子之间能否发生反应,能反应,则不能大量共存;否则,能大量共存。
在判断离子能否共存时,常用到以下四大原则: 1肯定性原则肯定性原则就是根据实验现象推出溶液中肯定存在或肯定不存在的离子。
此原则常根据一色、四反应、三特等来确定溶液中存在或不存在的离子。
(1)一色:无色溶液中不存在Fe2+、Fe3+、Cu2+、MnO4-、CrO42-、Cr2O72-等有色离子。
(2)四反应:发生以下四大反应,均不能共存。
①复分解反应离子间相互反应能生成难溶物、易挥发物质、难电离物质都不能大量共存。
I. 生成难溶物:如Ba2+、Ca2+等不能与SO42-、CO32-等大量共存;Ag+与Cl-、SO42-、CO32- 等不能大量共存。
为了确定哪些物质难溶,我们最好能记住溶解性口诀表:钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶;多数酸溶碱少溶、只有钾钠铵钡溶;几种微溶物要牢记、口诀中未有皆下沉。
II. 生成易挥发物质:如H+与CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等;OH-与NH4+。
III. 生成难电离物质:如H+与F-、ClO-、PO43-、CH3COO-等弱酸根离子。
②氧化还原反应常见的四种氧化性离子有:Fe3+、NO3-、MnO4-、ClO-,常见的六种还原性离子有:Fe2+、S2-、SO32-、I-、Br-、Cl-。
其中Fe3+ 能将S2-、SO32-、I-氧化而不能大量共存;NO3-在酸性条件下能将Fe2+、S2-、SO32-、I-、Br-氧化而不能大量共存;MnO4-、ClO- 在碱性或中性条件下能将S2-、SO32-、I- 等氧化而不能大量共存,在酸性条件下可以将上述六种还原性离子都氧化而不能大量共存。
除此之外,S2-与SO32-在碱性条件下可以共存,但酸性条件下则会发生氧化还原反应而不能大量共存。
判断离子共存的四要诀

判断离子共存的四要诀作者:桑姬萍来源:《理科考试研究·高中》2019年第05期摘要:几种离子能够在同一溶液中大量共存,表明这几种离子不可能发生任何反应,若能发生反应,则这种离子肯定不能大量共存.离子共存的判断,知识综合度高,要求学生熟知这些离子的特性及相互反应的规律,成为学生认知的一个难点,本文通过详解例题,总结出判断离子共存的四要决,即一色,二性(酸碱性),三特,四反应,来突破认知离子共存的难点[l].关键词:离子共存;四要诀;方法指导1 通过溶液的颜色判定离子熊否共存由于有些离子在溶液中有颜色,如Mn04-在溶液中呈紫色,Fe3+在溶液中呈黄色,Fe2+在溶液中呈浅绿色,Cu2+在溶液中呈蓝色,所以如果溶液限定无色,这些离子就不可能大量共存.但要注意,透明并不一定无色,还要注意题于条件是“澄清透明”还是“无色透明”[2].例1 无色透明的酸性溶液中,下列各组离子可以大量共存的是()或强酸性溶液中均不能大量存在.例3 常温下,各组离子在对应指定的溶液中一定能大量共存的是()A.Mg2+、Na+、N03-、HS03-在滴入酚酞显红色的溶液中B.H+、Fe2+、N03-、CI-在0.1 mol.L-1 Fe(N03)2溶液中C.K+、Na+、N03-、AlO2 在0.1 mol.L-1氨水中D.Ca2+、NH4+、Cl-、HC03-在由水電离出的c( H+)= 10-11mol.L-1的溶液中解析滴入酚酞呈显红色的溶液,必然呈碱性,HS03-、Mg2+肯定不能大量存在,A项错误;如果有H+大量存在,溶液必然呈酸性,在此条件下N03-具有强氧化性,可以氧化Fe2+,因此不能大量存在,B项不正确;K+、Na+、NO3、Al02-在呈呈弱碱性的氨水可以大量共存,C 项对;由水电离出的c(H+)= 10-11 mol.L-1可判断出水的电离受到抑制,溶液可能是碱性溶液,也可能是酸性溶液,但无论碱性还是酸性溶液,HC03-都不能大量存在,因此D错.选C.3 掌握三种特殊情况,判定离子能否共存第一种特殊情况是,HC03-与Mg2+,CH3COO -、CO3-与NH4+等组合中,存在两种离子的水解但水解程度很小,因而它们在溶液中仍然可以大量共存.第二种特殊情况是HC03-与AlO2不能在溶液中大量共存,因为AlO2+HC03-+ H20一AI(OH)3↓+CO3-.第三种特殊情况是,I一、HS -、Fez+、S2-等能与“CIO -’和“N03-+ H+’等发生氧化还原反应,因为“CIO -’和“N03- +H+'’等代表的是强氧化剂,所以它们不可能大量共存.例4 可能含有C03 -、S02-、N03-、Fe3+、NH4+、Mg2+、A13+、H+中的几种某溶液,①如果加入锌粒能产生无色无味的气体;②如果加入NaOH溶液能产生白色沉淀,并且随着加入NaOH的物质的量变化沉淀量发生如图1所示的变化,则正确的是:()A.只有Al3+、Mg2+、H+三种阳离子存在溶液中B.溶液中n( NH4+)=0. 2molc.溶液中可能存在S02 -和N03-,不含C02-D.n(H+):n(Al3+): n(Mg2+)=1:1:1解析根据题意,加入锌粒有无色无味的气体的产生,说明溶液显酸性必含H+,而C02 -不能大量存在于酸性环境中;“N03-+ H+’在酸性环境中起硝酸的作用,是强氧化剂,能氧化金属,反应后产生NO气体,无色有刺激性气味,因此不会大量存在;如果有Fe3+,加入NaOH 溶液,两者反应会出现红褐沉淀,说明无Fe3+.从图象可知:消耗的NaOH的物质的量在0. Imol以前,H+ +OH-= H.O,n(H+)=n(OH -)=0. 1mol.消耗的NaOH的物质的量从0.1mol 至0.5mol过程中:Mg2++ OH-= Mg (OH)2 ↓;Al3++ OH-=Al (OH)3↓;消耗的NaOH的物质的量从0.5mol至0.7mol过程中,沉淀物的质量没有发生变化,可知此时溶液中发生反应:NH4++ OH-= NH3.H20,n(NH4+)=n(OH-)=0. 2mol.消耗的NaOH的物质的量从0. 7mol至0.8mol过程中的反应:Al(OH)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子共存的判定方法
一.三审
1.溶液有没有颜色
Cu2+蓝色Fe3+棕黄色Fe2+浅绿色MnO4-紫红色Cr2O72-橙(红)色
CrO42-(浅)黄色Cr3+绿色
Mn2+浅玫瑰色,稀溶液无色Fe(H2O) 63+淡紫色Co2+玫瑰色Ni2+绿色
MnO42-绿色Fe(CN)64-黄绿色Fe(CN)63-黄棕色
2.溶液的酸碱性(注:H3O+等同于H+)
OH-及弱酸根离子(如F-,CO32-,SO32-,S2-,CH3COO-)不能与H+大量共存
H+及弱碱根离子(Mg2+,Al3+,Zn2+,Fe3+,Fe2+,Cu2+,Ag+,NH4+)不能与OH-大量共存
酸式弱酸根离子(如HCO3-,HSO3-,HS-,HPO3-,H2PO4-)与H+或OH-均不能大量共存3.共存不共存
注:生成气体:CO32-,HCO3-,SO32-,HSO3-,S2-,HS-与H+
生成沉淀:SiO32-与H+
Mg2+,Al3+,Zn2+,Fe3+,Fe2+,Cu2+,Ag+与OH-
难溶或微溶性盐
生成弱电解质:H+,酸式弱酸根与OH-,
F-,CH3COO-,ClO-与H+
NH4+与OH-
二.看
1.是否发生复分解反应(生成难溶、难电离、挥发性物质)
2.是否发生氧化还原反应
Fe3+与I-,S2-,SO32-(在H+环境下,可抑制Fe3+水解)
NO3-(H+)与I-,S2-,SO32-,Br-,Fe2+
MnO4-(H+)与I-,S2-,SO32-,Br-,Fe2+,Cl-
S2-(H+)与SO32-
ClO-与I-,S2-,SO32-,Br-,Fe2+
歧化反应:2H++S2O32-=S↓+SO2↑+H2O(产生无色气体和淡黄色沉淀)
注:①HS-视同S2-,HSO3-视同SO32-
②ClO-与I-,S2-,SO32-,Br-,Fe2+
Fe3+与I-,S2-,SO32-不需要在H+环境下
助记:锰与氯
氯、硝、锰与溴、亚铁
铁、氯、硝、锰与碘、负二正四价硫
硫负二与正四价
(高锰酸根离子与氯离子
次氯酸根离子,硝酸根离子,高锰酸根离子与溴离子,亚铁离子
铁离子,次氯酸根离子,硝酸根离子,高锰酸根离子与碘离子,负二、正四价硫离子
硫负二价与正四价)
3.是否发生双水解反应
Al3+与S2-,(HS-),CO32-,(HCO3-),AlO2-,SiO32-
Fe3+与CO32-,(HCO3-),AlO2-,SiO32-
NH4+与AlO2-,SiO32-
(其它:AlO2-与Mg2+,Fe2+)
注:[Al(OH)4]-相当于AlO2-+2H2O
助记:硅酸根、偏铝酸根与铝铁铵
碳酸根、碳酸氢根与铝铁
硫离子、氢硫酸根只与铝
(硅酸根离子,偏铝酸根离子与铝离子,铁离子,铵根离子
碳酸根离子,碳酸氢根离子与铝离子,铁离子
硫离子、氢硫酸根只与铝)
4.是否发生络合反应
Fe3+与SCN-,C6H5O-
Ag+与NH3·H2O(NH4+, OH-)
三.特例
①AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-
AlO2-+ HSO3-+H2O=Al(OH)3↓+SO32-
②PO43-+H2PO4-=2HPO42-
四.溶解性
①碱
K+,Na+,Ba2+,NH4+碱可溶,Ca(OH)2只微溶,其它碱均不溶
②盐
钾钠铵盐都可溶
硝酸盐遇水影无踪
氯化物不溶氯化银
硫酸盐不溶硫酸钡、铅(CaSO4,Ag2SO4微溶)
碳酸盐钾、钠、铵才可溶(MgCO3微溶)
其它:①PO43-,HPO42-钾、钠、铵才可溶
H2PO4-均可溶
②硫化物(S2-)钾钠铵钙镁可溶
亚硫酸盐(SO32-)钾钠铵可溶
③AgCl↓白色AgBr↓淡黄色AgI↓黄色Ag2S↓黑色。
