化学反应四种基本类型PPT课件 人教版
合集下载
化学反应四种基本类型PPT课件

C2H5OH+3O2 = 2CO2+3H2O
————————————;
点燃 点燃
CH4+2O2 = CO2+2H2O
—————————————
• 一、选择题
1.汽车的尾气中含有氮的氧化物,它们是空气污染物。汽车行驶时,由于电火花 的作用,汽缸里有一系列化学反应发生,其中有 N2+O2 放电 = 2NO;
新 课 标 要 求
1.化合反应:“多变一”型
( 1 )单质和氧气的反应:
如:Fe、Mg、Cu、Al、C、S、P、H2 ( 2 )一氧化碳和二氧化碳的转化: 高温 点燃 = C+CO 2CO 2 = 2CO+O 2CO CO CO2 _ _______ , CO——— 2 2 CO2 (3)氧化物和水的反应: 如:CO2+H2O=H2CO3,类似的反应还有SO2、 SO3;同学们可自己完成 Na2O+H2O=2NaOH,类似的还有K2O、CaO 可自己完成
=
③ Fe+H2SO4=FeSO4+H2 ↑
④ Zn+H ________________ 2SO4=ZnSO4+H2↑ (3)金属和盐的反应:(金属前置后,盐必溶,不用钾钙 钠) 4=ZnSO4+Cu ① Zn+CuSO ———————— ② Cu+2AgNO3=Cu(NO3)2+2Ag
4、复分解反应:“头尾结合型
2.分解反应:“一变多”型
(1)产生氧气的反应: △ ①2KMnO ____________ 4 =K2MnO4+MnO2+O2↑ MnO = 2KCl+3O2↑ ②2KClO ____________ 3 △ MnO ③ 2H ____________ 2O2 = 2H2O+O2↑ 通电 2H O ④ ____________ = 2H2↑+O2↑ 2
化学反应四种基本类型PPT课件

化学反应四种基本类型
能用金属活动性顺序表对有关的置 换反应进行简单的判断,并能解释 日常生活中的一些现象。
初步认识常见的:化合反 应、分解反应、置换反应、 复分解反应;并能根据化 学反应解释与日常生活相 关的一些现象;知道复分 解反应发生的条件。
了解人们如何利 用化学反改善和 提高自身的生活 质量。
(1)酸+碱=盐+水(又叫中和反应)
如:NaOH+HCl=NaCl+H2O
(2)酸+盐=新酸+新盐,
如: CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)碱+盐 = 新碱+新盐, 如: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)盐+盐 = 新盐+新盐, 如: NaCl+AgNO3=AgCl ↓ +NaNO3 (5)金属氧化物+酸=盐+水,
2.分解反应:“一变多”型
(1)产生氧气的反应: △ ①2KMnO ____________ 4 =K2MnO4+MnO2+O2↑ MnO = 2KCl+3O2↑ ②2KClO ____________ 3 △ MnO ③ 2H ____________ 2O2 = 2H2O+O2↑ 通电 2H O ④ ____________ = 2H2↑+O2↑ 2
三、简答题
9.下图是某同学设计的趣味实验装置,其气密性良好。
(1)若胶头滴管中的物质是 浓NaOH溶液,锥型瓶中充满 CO2,则挤压胶头滴管后能观 察到什么现象?并写出有关反 应的化学方程式。 U型管内液面左高右低。2NaOH+CO2=Na2CO3+H2O (2)若将胶头滴管中的物质滴入锥形瓶后,能明显观察到U 型管中红墨水的液面左低右高,甚至从右端溢出。请推测胶头 滴管和锥形瓶中的物质分别是什么?(答出两种组合即可) 产生气体:稀硫酸和锌;稀盐酸和碳酸钠;双氧水和二氧化锰 产生热量:浓硫酸和水;水和生石灰;水和氢氧化钠
能用金属活动性顺序表对有关的置 换反应进行简单的判断,并能解释 日常生活中的一些现象。
初步认识常见的:化合反 应、分解反应、置换反应、 复分解反应;并能根据化 学反应解释与日常生活相 关的一些现象;知道复分 解反应发生的条件。
了解人们如何利 用化学反改善和 提高自身的生活 质量。
(1)酸+碱=盐+水(又叫中和反应)
如:NaOH+HCl=NaCl+H2O
(2)酸+盐=新酸+新盐,
如: CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)碱+盐 = 新碱+新盐, 如: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)盐+盐 = 新盐+新盐, 如: NaCl+AgNO3=AgCl ↓ +NaNO3 (5)金属氧化物+酸=盐+水,
2.分解反应:“一变多”型
(1)产生氧气的反应: △ ①2KMnO ____________ 4 =K2MnO4+MnO2+O2↑ MnO = 2KCl+3O2↑ ②2KClO ____________ 3 △ MnO ③ 2H ____________ 2O2 = 2H2O+O2↑ 通电 2H O ④ ____________ = 2H2↑+O2↑ 2
三、简答题
9.下图是某同学设计的趣味实验装置,其气密性良好。
(1)若胶头滴管中的物质是 浓NaOH溶液,锥型瓶中充满 CO2,则挤压胶头滴管后能观 察到什么现象?并写出有关反 应的化学方程式。 U型管内液面左高右低。2NaOH+CO2=Na2CO3+H2O (2)若将胶头滴管中的物质滴入锥形瓶后,能明显观察到U 型管中红墨水的液面左低右高,甚至从右端溢出。请推测胶头 滴管和锥形瓶中的物质分别是什么?(答出两种组合即可) 产生气体:稀硫酸和锌;稀盐酸和碳酸钠;双氧水和二氧化锰 产生热量:浓硫酸和水;水和生石灰;水和氢氧化钠
化学反应四种基本类型ppt课件

= Fe +CuSO4 Cu+FeSO4
= Cu +2AgNO3 2Ag+Cu(NO3)2
定义:由两种化合物互相交换成分,生成另外一种 化合物的反应。
表达式:AB+CD→AD+CB
复
特点:双交换,价不变
分
发生条件:生成物中有沉淀或水或气体
解
判断复分解反应能否发生时:
反
应
要考虑生成物中有没有沉淀、气体和水
表达式:A+BC→B+AC
置
特点:一换一(或单换单)
换 依据:金属活动顺序表
反
应
较活泼金属+酸→盐+氢气
举例:
如:Z n H 2S4O Zn4 S H 2 O
金属+盐→新金属+新盐,
如H:2F C ue C ΔOCu 4 uS F HO 2O e4 SC O u
高温
C2CuO2CuCO 2
(“前换后”,“盐可溶”,“不用K、Ca、Na等”)
化学反应四种基本类型
定义:有两种或两种以上物质生成另一种物 质的反应。
表达式:A+B→AB
特点:多变一 化
合
某些金属+氧气→氧化物
反
某些非金属+氧气→氧化物
应
举例: CO2 C高温 2CO
2CO O2 点燃2CO2
CO2 H 2O H 2CO3
CaO H 2O Ca (OH )2
化合反应:(多变一)
注意:
要考虑反应物的可溶性
有些难溶物的物质也可以发生复分解反应 如:难溶性的碳酸盐可以与酸反应 难溶性的碱也可以与酸发生反应
复分解反应举例
四种基本反应类型
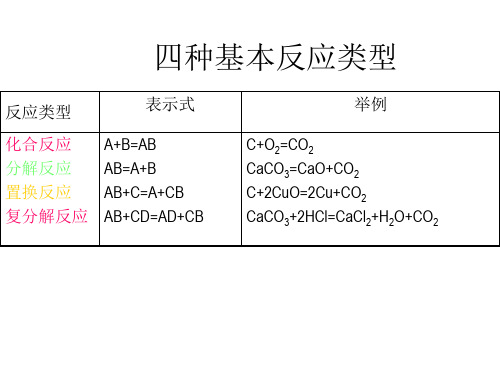
四种基本反应类型
反应类型 化合反应 分解反应 置换反应 复分解反应 表示式 A+B=AB AB=A+B AB+C=A+CB AB+CD=AD+CB 举例 C+O2=CO2 CaCO3=CaO+CO2 C+2CuO=2Cu+CO2 CaCO3+2HCl=CaCl2+H2O+CO2
氧化还原反应分析
化学反应
H2+CuO=Cu+H2O
氧化反应 还原反应
H2 H2O CO2 CO2 CuO CuO CuO Cu Cu Cu
Байду номын сангаас
基本反应类型
置换反应 置换反应
C+2CuO=2Cu+CO2 C CO+CuO=Cu+CO2 CO
讨论:
讨论及结论
(1)以上三个化学反应是否都属于某种基本反应类型? (2)由氢气还原氧化铜的实验分析,氧化反应和还原反应是单独 存在还是同时存在?(由有水珠生成及氧化铜变红的现象说明) (3)如果2NA+CL2=2NACL的反应也是氧化还原反应,是否符合 上述定义? 结论: 1。化学反应类型有多种分类方法,各有自己的适用范围。
2。初中学习的知识还有待于完善。
3。氧化反应和还原反应是同时发生的,称为氧化还原反应, 在实践所学的定义有一定的局限性
反应类型 化合反应 分解反应 置换反应 复分解反应 表示式 A+B=AB AB=A+B AB+C=A+CB AB+CD=AD+CB 举例 C+O2=CO2 CaCO3=CaO+CO2 C+2CuO=2Cu+CO2 CaCO3+2HCl=CaCl2+H2O+CO2
氧化还原反应分析
化学反应
H2+CuO=Cu+H2O
氧化反应 还原反应
H2 H2O CO2 CO2 CuO CuO CuO Cu Cu Cu
Байду номын сангаас
基本反应类型
置换反应 置换反应
C+2CuO=2Cu+CO2 C CO+CuO=Cu+CO2 CO
讨论:
讨论及结论
(1)以上三个化学反应是否都属于某种基本反应类型? (2)由氢气还原氧化铜的实验分析,氧化反应和还原反应是单独 存在还是同时存在?(由有水珠生成及氧化铜变红的现象说明) (3)如果2NA+CL2=2NACL的反应也是氧化还原反应,是否符合 上述定义? 结论: 1。化学反应类型有多种分类方法,各有自己的适用范围。
2。初中学习的知识还有待于完善。
3。氧化反应和还原反应是同时发生的,称为氧化还原反应, 在实践所学的定义有一定的局限性
初中化学反应四种基本类型

3、盐酸与氢氧化铝反应:
3HCl +Al(OH)3=ALCl3 +3H2O
8、硫酸钠与氯化钡反应:
Na2SO4 +BaCl2=BaSO4 ↓+2NaCl
4、盐酸与硝酸银反应:
HCl +AgNO3=AgCl↓+HNO3
9、硫酸铜与氢氧化铜反应:
CuSO4 +2KOH=Cu(OH)2↓+K2SO4
5、碳酸钙与盐酸反应:
2HCl +CaCO3=CaCl2+H2O+CO2 ↑
10、碳酸钠与氢氧化钙反应:
Na2CO3 +Ca(OH)2=2NaOH +CaCO3 ↓
二、理清关系: 化合与氧化,置换与氧化还原,复分 解与中和,各反应间关系:
氧 化 A 化 合
CH4 +2O2
氧 化 还 原
置 换
复 分 解
中 和
=CO +2H O
Fe2O3 +3CO
点燃
=2Fe+3CO
高温
2
CH4 +2O2
=CO +2H O
2 2
CO2 +Ca(OH)2
= CaCO3 ↓+H2O = Na2SO3+H2O
SO2 +2NaOH
中考热点
1.下列对基本反应的类型正确的是(
A.置换反应的产物中一定有单质 B.化合反应的反应物都是单质 C.复分解反应的产物都是化合物 D.分解反应的产物都是化合物
化学反应四种基本类型
定义:有两种或两种以上物质生成另一种物 质的反应。 表达式:A+B→AB 化 合 反 应 特点:多变一
化学反应的分类(正式)PPT课件

1.碱+(某些)非金属氧化物 →盐+H2O 不
FCe22HO53O+H6+HC3Ol =2 2点F燃eC2Cl3O+23+H32HO2O F3Ce2OO+3 +Fe32HO23S高O温4 =2Fe2+(S3OC4)O3 2+ 3H2O
2.酸+(某些)金属氧化物 →盐+ H2O
属 于 任 何
CFeO2O+ 3C+u6OH加C热l =C2uF+eCCl3O+2 3H2O 3FCe2OO+3 +Fe32HO23S高O温4 =2Fe2+(S3OC4)O3 2+ 3H2O
3.CO+金属氧化物 →金属+CO2
C2NHa4O+H2O+2C点O燃2 C=ONa2 2+C2OH32+OH2O
基 本 反 应 类
C2N2HaO5OHH++S3OO32=点N燃a22SCOO4 2++H32HO2O 4.化合物+O2→CO2+ H2O 型
含有相同反应物的化学反应
C+O2点燃 CO2
复
22HHCCll ++ CCaa((OOHH))22 ==CCaaCCll22 ++ 22HH22OO(2)酸+碱→盐 +水
分
HH22SSOO44 ++ 22NNaaOOHH ==NNaa22SSOO44++ 22HH22OO
解
HH22SSOO44 ++ CCaa((OOHH))22 == CCaaSSOO44++ 22HH22OO
初中化学_化学反应四种基本类型 PPT课件 图文

本节课你有哪些收获?
1.化学反应的基本类型:化合反应、分解反应、置换 反应、复分解反应(能够对典型反应分类)。
2.能根据化学反应解释与日常生活相关的一些现象。 3.能用金属活动性表对有关的置换反应进行简单的
判断。 4了解人们如何利用化学反应改善和提高生活质量。
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇 4、与肝胆人共事,无字句处读书。——周恩来 5、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 6、一切节省,归根到底都归结为时间的节省。——马克思 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿 11、有勇气承担命运这才是英雄好汉。——黑塞 12、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德
新 课 标 要 求
1.化合反应:“多变一”型
( 1 )单质和氧气的反应:
如:Fe、Mg、Cu、Al、C、S、P、H2
(2 CO
)C一O2氧2_C化_O碳_+_O和_=2点_燃二_2_C氧O,化2 C碳O的2 转C化O:—C+—CO—2高 =温2CO
(3)氧化物和水的反应:
如:CO2+H2O=H2CO3,类似的反应还有SO2、 SO3;同学们可自己完成 Na2O+H2O=2NaOH,类似的还有K2O、CaO 可自己完成
身体健康,学习进步! 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
初中化学科学九年级《化学四大基本反应类型》PPT

2KCl + 3O2
4、复分解反应: AB + CD =AD +CB
化合价一 定不变
H2SO4 + BaCl2 = BaSO4
+ 2HCl
复分解反应能进行的条件
一、生成物的条件: 生成物必须有沉淀或气体或水
NaOH + HCl = NaCl + H2O AgNO3 + NaCl = AgCl + NaNO3 CaCO3 + 2HCl =CaCl2 + H2O +CO2
讨论
下列物质能否反应?为什么? (1)CuSO4+Ba(NO3)2 (3)NaCl+KNO3 (5)Fe(OH)3+HCl (7)Mg(OH)2+FeCl3 (9)CuSO4+Fe(OH)3 (2)H2SO4+Ca(OH)2 (4)K2CO3+HCl (6)MgSO4+BaCO3 (8)ZnCO3+HCl
Ag+
常见离子特性
稀HNO3
二、除杂质
应用
指导思想: (1)尽可能把杂质离子转化为沉淀、气体、水 (2)尽可能把杂质转化为物质本身或其一部分 (3)除杂时不能引入新的杂质或其它离子 (4)加入的物质不能与原有物质反应 例1:请选用恰当的物质除去下列杂质 NaOH(Na2CO3)
CaCl2(Ca(OH)2)
思考:下列反应能进行吗?为什么? (1)NaCl + KNO3 (3)Fe(OH)3 + HCl (2)HCl + H2SO4 (4)BaCO3 + HCl
复分解反应能进行的条件
反应物条件: (1)碱+盐——、盐+盐—— 反应物必须溶 (2)酸+碱—— 不考虑物质的溶解性 (3)酸+盐—— 盐除碳酸盐外,必须可溶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应四种基本类型
能用金属活动性顺序表对有关的置 换反应进行简单的判断,并能解释 日常生活中的一些现象。
初步认识常见的:化合反 应、分解反应、置换反应、 复分解反应;并能根据化 学反应解释与日常生活相 关的一些现象;知道复分 解反应发生的条件。
了解人们如何利 用化学反改善和 提高自身的生活 质量。
么反应类型。 (1)Cu(Fe2O3)
H2SO4(或HCl).
————
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(2)NaCl (CaCl2) —Na—2—CO—3. Na2CO3+ CaCl2=CaCO3↓+2NaCl
三、简答题
9.下图是某同学设计的趣味实验装置,其气密性良好。
Fe、Zn与酸反应) 。
① 2_A_l_+_3_H_2_S_O__4=_Al2(SO4)3+3H2↑
② Mg+H2SO4=MgSO4+H2↑ ③ Fe+H2SO4=FeSO4+H2 ↑ ④ Z_n_+_H__2S__O_4_=_Z_n_S_O_4_+_H2↑ (3)金属和盐的反应:(金属前置后,盐必溶,不用钾钙
B .分解反应
C .置换反应
D.复分解反应
2.下列化学反应类型中,肯定有元素的化合价发生改变的是 (C )
A.化合反应
B .分解反应
C .置换反应
D.复分解反应
3.下列说法中正确的是
A物质与氧发生的反应都是化合反应
B物质与氧气发生的化合反应叫氧化反应
C凡是生成两种或两种以上物质的反应都属于分解反应
D有的氧化反应是化合反应,有的氧化反应不是化合反应
新 课 标 要 求
1.化合反应:“多变一”型
( 1 )单质和氧气的反应:
如:Fe、Mg、Cu、Al、C、S、P、H2
(2 CO
)C一O2氧2_C化_O碳_+_O和_=2点_燃二_2_C氧O,化2 C碳O的2 转C化O:—C+—CO—2高 =温2CO
(3)氧化物和水的反应:
如:CO2+H2O=H2CO3,类似的反应还有SO2、 SO3;同学们可自己完成 Na2O+H2O=2NaOH,类似的还有K2O、CaO 可自己完成
•
7.按要求写出下列反应的化学方程式,并说明该反应在 实际中的一种应用。
化学方程式
实际中应用
有红磷参加的化合反应 4P+5O点=2 燃2P2O5
做烟幕弹
有氧化钙生成的分解反应CaCO3高=温CaO+CO2↑ 制生石灰
8.分别选用一种试剂除去下列物质中的杂质(括号内
为杂质)请写出该反应的化学方程式,并指明属于什
钠)
① —Zn—+C—u—SO—4=—Z—nS—O4+Cu
② Cu+2AgNO3=Cu(NO3)2+2Ag
4、复分解反应:“头尾结合型
(1)酸+碱=盐+水(又叫中和反应) 如:NaOH+HCl=NaCl+H2O (2)酸+盐=新酸+新盐, 如: CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)碱+盐 = 新碱+新盐, 如: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)盐+盐 = 新盐+新盐, 如: NaCl+AgNO3=AgCl ↓ +NaNO3 (5)金属氧化物+酸=盐+水, 如: Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(2)产生二氧化碳的反应:
① _C_aC_O_3_高 =_温_C_a_O_+_CO2↑
② H_2C_O_3_△ =_H_2O__+C_O_2_↑
3.置换反应:“单换单”型
• (1)有关氢气、碳的还原反应:
= •
△ H2+CuO
Cu+H2O。
(2)活泼金属与酸制氢气的反应: (常见的主要是Al、Mg、
(D )
4.“侯氏制碱法”对传统的纯碱生产技术进行了大胆革新后成为当
时世界最先进的制碱法。纯碱是重要的化工产品,用途很广泛。
现以纯碱、石灰石、水三种物质为原料制取氢氧化钠,所发生的
化学反应中不包括 A.化合反应
B .分解反应
(C )
C .置换反应
D.复分解反应
5.在一密闭的容器中有A、B、C、D四种物质,一定条件下使之
的—2—燃H2—料+O—是2点 =液燃2氢H助2O燃剂是液氧,则液氢燃烧的化学方程式为:
液氢作燃料除了单位质量燃烧的热能最大外,还有一个优点是— —无—污—染。 (3)汶川地震灾后救灾需要大量的消毒剂,我国研制出比漂白 粉更高效的消毒剂“ClO2”,制取ClO2反应为X+2NaClO2 = 2ClO2+2NaCl,则X的化学式为—C—l—2 —。
• 5、特殊型、不属于以上四种类型: • (1)一氧化碳的还原反应, • 如:C—O—+C—u—O——C—u—+C—O—2 ———— • (2)非金属氧化物+碱=盐+水,如:
CO2+Ca(OH)2=CaCO3↓+H2O
• (3)碳氢化合物在空气中燃烧的反应:乙 醇、甲烷的燃烧
C—2H—5O—H—+—3O—2—=点—燃—2—C—O—2+;3H2O
2.分解反应:“一变多”型
(1)产生△氧气的反应:
= ①2K_M_n_O_4___K_2M_n_O_4_+MnO2+O2↑
②2K_C_lO__3 _M=△_nO_2 _2_KC_l_+3_O2↑
= ③ 2_H_2_O_2 _Mn_O22_H_2_O_+O__2↑ ④ = 2_H_2_O_通_电_2_H_2↑_+_O_2↑_
反应,一段时间后,测得反应前后各物质的质量如下表,则该密
闭容器中发生的化学反应类型为
(B )
物质
A
B
C
D
反应前质量/g
90
反应前质量/g
11
10
8
2
59.25 29.75
10
A.化合反应 C .置换反应
B .分解反应 D.复分解反应
二、填空题 6.依据所学化学知识回答: (1)奥运火炬燃烧时主要是将化学能转化成热能和---光----------能; 火炬柄表面有一层致密的氧化铝薄膜,它是常温下铝和氧气 反应生成的,该反应的化学方程式为:—4A—l+—3O—2=2Al2O3 (2)将“嫦娥一号”送上太空的火箭推力巨大,因为它所使用
CH4+2O2 =点燃 CO2+2H2O
—————————————
• 一、选择题
1.汽车的尾气中含有氮的氧化物,它们是空气污染物。汽车行驶时,由于电火花
的作用,汽缸里有一系列化学反应发生,其中有 N2+O2放 =电2NO;
2NO+O2 =2NO2。这两个反应所属的反应类型是 ( A )
A.化合反应
能用金属活动性顺序表对有关的置 换反应进行简单的判断,并能解释 日常生活中的一些现象。
初步认识常见的:化合反 应、分解反应、置换反应、 复分解反应;并能根据化 学反应解释与日常生活相 关的一些现象;知道复分 解反应发生的条件。
了解人们如何利 用化学反改善和 提高自身的生活 质量。
么反应类型。 (1)Cu(Fe2O3)
H2SO4(或HCl).
————
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
(2)NaCl (CaCl2) —Na—2—CO—3. Na2CO3+ CaCl2=CaCO3↓+2NaCl
三、简答题
9.下图是某同学设计的趣味实验装置,其气密性良好。
Fe、Zn与酸反应) 。
① 2_A_l_+_3_H_2_S_O__4=_Al2(SO4)3+3H2↑
② Mg+H2SO4=MgSO4+H2↑ ③ Fe+H2SO4=FeSO4+H2 ↑ ④ Z_n_+_H__2S__O_4_=_Z_n_S_O_4_+_H2↑ (3)金属和盐的反应:(金属前置后,盐必溶,不用钾钙
B .分解反应
C .置换反应
D.复分解反应
2.下列化学反应类型中,肯定有元素的化合价发生改变的是 (C )
A.化合反应
B .分解反应
C .置换反应
D.复分解反应
3.下列说法中正确的是
A物质与氧发生的反应都是化合反应
B物质与氧气发生的化合反应叫氧化反应
C凡是生成两种或两种以上物质的反应都属于分解反应
D有的氧化反应是化合反应,有的氧化反应不是化合反应
新 课 标 要 求
1.化合反应:“多变一”型
( 1 )单质和氧气的反应:
如:Fe、Mg、Cu、Al、C、S、P、H2
(2 CO
)C一O2氧2_C化_O碳_+_O和_=2点_燃二_2_C氧O,化2 C碳O的2 转C化O:—C+—CO—2高 =温2CO
(3)氧化物和水的反应:
如:CO2+H2O=H2CO3,类似的反应还有SO2、 SO3;同学们可自己完成 Na2O+H2O=2NaOH,类似的还有K2O、CaO 可自己完成
•
7.按要求写出下列反应的化学方程式,并说明该反应在 实际中的一种应用。
化学方程式
实际中应用
有红磷参加的化合反应 4P+5O点=2 燃2P2O5
做烟幕弹
有氧化钙生成的分解反应CaCO3高=温CaO+CO2↑ 制生石灰
8.分别选用一种试剂除去下列物质中的杂质(括号内
为杂质)请写出该反应的化学方程式,并指明属于什
钠)
① —Zn—+C—u—SO—4=—Z—nS—O4+Cu
② Cu+2AgNO3=Cu(NO3)2+2Ag
4、复分解反应:“头尾结合型
(1)酸+碱=盐+水(又叫中和反应) 如:NaOH+HCl=NaCl+H2O (2)酸+盐=新酸+新盐, 如: CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)碱+盐 = 新碱+新盐, 如: Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (4)盐+盐 = 新盐+新盐, 如: NaCl+AgNO3=AgCl ↓ +NaNO3 (5)金属氧化物+酸=盐+水, 如: Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
(2)产生二氧化碳的反应:
① _C_aC_O_3_高 =_温_C_a_O_+_CO2↑
② H_2C_O_3_△ =_H_2O__+C_O_2_↑
3.置换反应:“单换单”型
• (1)有关氢气、碳的还原反应:
= •
△ H2+CuO
Cu+H2O。
(2)活泼金属与酸制氢气的反应: (常见的主要是Al、Mg、
(D )
4.“侯氏制碱法”对传统的纯碱生产技术进行了大胆革新后成为当
时世界最先进的制碱法。纯碱是重要的化工产品,用途很广泛。
现以纯碱、石灰石、水三种物质为原料制取氢氧化钠,所发生的
化学反应中不包括 A.化合反应
B .分解反应
(C )
C .置换反应
D.复分解反应
5.在一密闭的容器中有A、B、C、D四种物质,一定条件下使之
的—2—燃H2—料+O—是2点 =液燃2氢H助2O燃剂是液氧,则液氢燃烧的化学方程式为:
液氢作燃料除了单位质量燃烧的热能最大外,还有一个优点是— —无—污—染。 (3)汶川地震灾后救灾需要大量的消毒剂,我国研制出比漂白 粉更高效的消毒剂“ClO2”,制取ClO2反应为X+2NaClO2 = 2ClO2+2NaCl,则X的化学式为—C—l—2 —。
• 5、特殊型、不属于以上四种类型: • (1)一氧化碳的还原反应, • 如:C—O—+C—u—O——C—u—+C—O—2 ———— • (2)非金属氧化物+碱=盐+水,如:
CO2+Ca(OH)2=CaCO3↓+H2O
• (3)碳氢化合物在空气中燃烧的反应:乙 醇、甲烷的燃烧
C—2H—5O—H—+—3O—2—=点—燃—2—C—O—2+;3H2O
2.分解反应:“一变多”型
(1)产生△氧气的反应:
= ①2K_M_n_O_4___K_2M_n_O_4_+MnO2+O2↑
②2K_C_lO__3 _M=△_nO_2 _2_KC_l_+3_O2↑
= ③ 2_H_2_O_2 _Mn_O22_H_2_O_+O__2↑ ④ = 2_H_2_O_通_电_2_H_2↑_+_O_2↑_
反应,一段时间后,测得反应前后各物质的质量如下表,则该密
闭容器中发生的化学反应类型为
(B )
物质
A
B
C
D
反应前质量/g
90
反应前质量/g
11
10
8
2
59.25 29.75
10
A.化合反应 C .置换反应
B .分解反应 D.复分解反应
二、填空题 6.依据所学化学知识回答: (1)奥运火炬燃烧时主要是将化学能转化成热能和---光----------能; 火炬柄表面有一层致密的氧化铝薄膜,它是常温下铝和氧气 反应生成的,该反应的化学方程式为:—4A—l+—3O—2=2Al2O3 (2)将“嫦娥一号”送上太空的火箭推力巨大,因为它所使用
CH4+2O2 =点燃 CO2+2H2O
—————————————
• 一、选择题
1.汽车的尾气中含有氮的氧化物,它们是空气污染物。汽车行驶时,由于电火花
的作用,汽缸里有一系列化学反应发生,其中有 N2+O2放 =电2NO;
2NO+O2 =2NO2。这两个反应所属的反应类型是 ( A )
A.化合反应
