化学反应四种基本类型ppt课件
初中化学第19课时 化学反应的类型公开课课件

第19课时┃ 归类示例
► 类型三 非基本反应类型的认识
命题角度:研究氧化反应、还原反应、中和反应等非基本
反应类型。 例3 [2013·广西] 有元素化合价升降的反应是氧化还原
反应。下列属于氧化还原反应的是
(D )
A.CaCO3=高==温==CaO+CO2↑
B.HCl+KOH===KCl+H2O C.SO2+2NaOH===Na2SO3+H2O D.2Na+2H2O===2NaOH+H2↑
然的联系。如:C + O2=点==燃==CO2 是氧化反应又是化合反 应,而 CH4+2O2=点==燃==CO2+2H2O 是氧化反应但不是化合 反应。
第19课时┃ 考点聚焦
考点2 氧化反应与还原反应 1.概念:氧化反应是指物质和__氧__发生的化学反应;
还原反应是指含氧化合物里的_氧___被夺去的反应。 2.特点:①反应物和生成物中一般含有__氧____元素;
第19课时┃ 归类示例
► 类型三 非基本反应类型的认识
命题角度:研究氧化反应、还原反应、中和反应等非基本
反应类型。 例3 [2013·广西] 有元素化合价升降的反应是氧化还原
反应。下列属于氧化还原反应的是
(D )
A.CaCO3=高==温==CaO+CO2↑
B.HCl+KOH===KCl+H2O C.SO2+2NaOH===Na2SO3+H2O D.2Na+2H2O===2NaOH+H2↑
BaCl2、Na2SO4、MgSO4、KMnO4十一种物质中,选出适当的物 质(每种物质只允许选用一次),按下述要求各写一个化学方程式。
光照 D.6CO2+6H2O叶==绿==体= C6H12O6+6O2 复分解反应
第19课时┃ 归类示例
化学反应基本反应类型PPT课件(上课用)

练习10:将一定质量的铁粉放入足量相同
质量分数的Cu(NO3)2和AgNO3混合溶液中,
充分反应后过滤,测得滤渣中只含一种金
Байду номын сангаас
属,该金属是 A. Fe B. Cu
C. Ag
() C
练习11:向含有CuCl2,ZnCl2,HCl的溶液中撒入 过量的铁粉,反应后溶液中一定有
(D)
A. ZnCl2 , HCl B. FeCl2 , CuCl2
113.人生的目的有二:先是获得你 想要的 ;然后 是享受 你所获 得的。 只有最 明智的 人类做 到第二 点总与 幽默的 人相伴 ,健康 总与阔 达的人 相伴。 20、对所学知识内容的兴趣可能成 为学习 动机。 ——赞 科夫 21、游手好闲地学习,并不比学习游手 好闲好 。—— 约翰·贝 勒斯
22、读史使人明智,读诗使人灵秀,数 学使人 周密, 自然哲 学使人 精邃, 伦理学 使人庄 重,逻 辑学使 人善辩 。—— 培根 23、我们在我们的劳动过程中学习思考 ,劳动 的结果 ,我们 认识了 世界的 奥妙, 于是我 们就真 正来改 变生活 了。— —高尔 基 24、我们要振作精神,下苦功学习。下 苦功, 三个字 ,一个 叫下, 一个叫 苦,一 个叫功 ,一定 要振作 精神, 下苦功 。—— 毛泽东
(3)碱 + 盐 新盐 + 新碱(至少一种难溶)
(可溶) (可溶)
(用来制 NaOH)
Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4 (蓝色沉淀)
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl (红褐色沉淀)
化学反应的类型

化学反应的类型第二讲/化学反应的类型知识梳理◤考点一◢化学反应类型的划分1.四种基本反应类型(1)化合反应:①概念:由两种或两种以上物质生成另一种物质的反应。
②表达式:A + B →A B③化合价:可能改变(1)分解反应①概念:由一种物质生成两种或两种以上其他物质的反应。
②表达式:A B →A + B③化合价:可能改变(2)置换反应①概念:由一种单质跟一种化合物反应,生成另一种单质跟一种化合物的反应。
②表达式:A + BC →B + AC ③化合价:一定改变(3)复分解反应①概念:由两种化合物相互交换成分生成另外两种化合物的反应。
②表达式:AB + CD →AD + BC③化合价:一定不变2.从得氧和失氧角度划分物质得到氧的反应叫反应,物质失去氧的反应叫反应。
3.从能量角度划分吸热反应:吸收热量的反应。
如:。
放热反应:放出热量的反应。
如:,锌和稀硫酸的反应等。
4.不属于四大基本反应类型的几种特殊反应:(1)天然气燃烧:。
酒精燃烧:。
(2)用一氧化碳还原金属氧化物的反应:①一氧化碳还原氧化铜:。
②一氧化碳还原氧化铁:。
③一氧化碳还原四氧化三铁:。
(3)碱的溶液(Ca(OH)2、NaOH)与二氧化碳、二氧化硫的反应:;。
;。
◤◢反应发生的条件1.置换反应(1)金属+ 酸→+反应条件:①酸指盐酸或稀硫酸②在金属活动性顺序中,排在氢前面的金属才能置换出酸中的氢,生成氢气。
(2)金属+ 盐→+反应条件:①盐一定溶于水②在金属活动性顺序中,排在前面的金属才能把排在后面的金属从溶液中置换出来。
(Ka、Ca、Na除外)2.复分解反应(1)包括①酸 + 某些金属氧化物→ + ②酸+ 碱→+③酸+ 盐→+④碱+ 盐→+⑤盐+ 盐→+(2)反应条件①生成物种有、、生成。
②碱与盐、盐与盐发生复分解反应时,必须在溶液中进行,即反应物都必须。
③把有关物质间的化学反应规律,熟记常见酸、碱、盐的溶解性。
碱中常见的沉淀有:Cu(OH)2、Fe(OH)3、Mg(OH)2 ;盐酸盐(氯化物)中常见的沉淀有:AgCl、BaCl2; 硫酸盐中常见的沉淀有:BaSO4;碳酸盐中常见的沉淀有:BaCO3、CaCO3。
氧化还原反应课件

在3Cu+8HNO3(稀)= 3Cu(NO3)2+2NO↑+4H2O反应中,若有 64gCu被氧化,则被还原的HNO3的质量 是( ) A.168g B.42g C.126g D.60g
总结
课后练习题:
1.请把符合要求的化学反应方程式的编号填入括号内: (1)既属于分解反应又是氧化还原反应的是( ) (2)属于化合反应,但不是氧化还原反应的是( ) (3)既属于化合反应,又是氧化还原反应的是( ) (4)属于分解反应,但不是氧化还原反应的是( ) (5)不属于四种基本反应类型的氧化还原反应的是( ) A. 2NaHCO3 = Na2CO3+ CO2 + CO2↑ B.2Na+ Cl2 = 2NaCl C.Zn+CuSO4=ZnSO4+Cu D. E.CaO+ CO2= CaCO3 F. 4FeS2+11O2 = 2Fe 2O3+8SO2
【4】分析下列氧化还原反应中化合价的变化关 系,注明电子转移方向和总数,并指出氧化剂 和还原剂,氧化产物与还原产物。 (1)2KMnO4=K2MnO4+MnO2+O2↑ (2)2Fe2O3+3C=4Fe+3CO2 (3)3NO2+H2O=2HNO3+NO (4)HgS+O2=Hg+SO2 (5)2H2S+SO2=3S+2H2O
五、氧化还原的基本规律及其作用:
1.守恒律:原子、电子转移、电荷守恒 还原剂失电子总数(或物质的量)= 氧化剂得电子总数(或物质的量) 作用:有关氧化还原反应的计算 配平氧化还原反应方程式
2.价态律:最高价、最低价、中间价 高价氧化低价还,中间价态两头转 元素处于最高价,只有氧化性;元素 处于最低价,只有还原性;元素处于中 间价,既氧化性又有还原性。 作用:判断物质的氧化性、还原性 金属单质只有还原性,非金属单质大 多数既有氧化性又有还原性
化学反应四种基本类型PPT课件

C2H5OH+3O2 = 2CO2+3H2O
————————————;
点燃 点燃
CH4+2O2 = CO2+2H2O
—————————————
• 一、选择题
1.汽车的尾气中含有氮的氧化物,它们是空气污染物。汽车行驶时,由于电火花 的作用,汽缸里有一系列化学反应发生,其中有 N2+O2 放电 = 2NO;
新 课 标 要 求
1.化合反应:“多变一”型
( 1 )单质和氧气的反应:
如:Fe、Mg、Cu、Al、C、S、P、H2 ( 2 )一氧化碳和二氧化碳的转化: 高温 点燃 = C+CO 2CO 2 = 2CO+O 2CO CO CO2 _ _______ , CO——— 2 2 CO2 (3)氧化物和水的反应: 如:CO2+H2O=H2CO3,类似的反应还有SO2、 SO3;同学们可自己完成 Na2O+H2O=2NaOH,类似的还有K2O、CaO 可自己完成
=
③ Fe+H2SO4=FeSO4+H2 ↑
④ Zn+H ________________ 2SO4=ZnSO4+H2↑ (3)金属和盐的反应:(金属前置后,盐必溶,不用钾钙 钠) 4=ZnSO4+Cu ① Zn+CuSO ———————— ② Cu+2AgNO3=Cu(NO3)2+2Ag
4、复分解反应:“头尾结合型
2.分解反应:“一变多”型
(1)产生氧气的反应: △ ①2KMnO ____________ 4 =K2MnO4+MnO2+O2↑ MnO = 2KCl+3O2↑ ②2KClO ____________ 3 △ MnO ③ 2H ____________ 2O2 = 2H2O+O2↑ 通电 2H O ④ ____________ = 2H2↑+O2↑ 2
初中化学反应四种基本类型

定义:由两种化合物互相交换成分,生成另外一种-化合物的反应。-表达式:AB+CD→AD+CB-特点:双交换 价不变-复分解反应-发生条件:生成物中有沉淀或水或气体-断复分解反应能否发生时:-要考虑生成物中有没有沉淀 气体和水-注意:-要考虑反应物的可溶性-有些难溶物的物质也可以发生复分解反应-如:难溶性的碳酸盐可以与酸反 -难溶性的碱也可以与酸发生反应
பைடு நூலகம்
定义:由一种单质与一种化合物反应,生成-另一种单质与另一种化合物的反应。-寒达式:A+BC→B+AC-特京 一换一(或单换单)-置换反应-依据:金属活功顺序表-较活泼金属+酸→盐+氨气-如:Zn+H2SO4=ZnS 4+H2个-举例:金属+盐→新金属+新盐,-如:Fe+CuSO,=FeSO4+Cw-H,+CuoCu+H, -C+2Cu0惠Cu+C0,个-“前换后”,“盐可溶”,“不用K、Ca、Na等”
?分解反应:-一变多-工、用过氧化氢和二氧化锰制氧气:-6、高温煅烧石灰石:-2H2022H20+02↑ao+cO21-2、用高锰酸钾制氧气:-7、氢氧化铜受热分解:-加热-2KMnO=K2MnO4+Mno2+ 21-CuOH2=Cuo+H2o-3、用氯酸钾和二氧化锰制氧气:-8、碱式碳酸铜受热分解:-MnO,-2K 103=2KC+3021-Cu2OH2C03=2Cu0+H20+C02↑-4水的通电分解:-9、碳酸氢钙受 分解:-2H202H2↑+02↑-CaHC032=CaC03↓+H20+c02↑-5碳酸不稳定,易分解:0、碳酸氢铵受热分解:-H2C03=H20+C02t-NH HCO3 NH31 H2o +CO21
化学反应四种基本类型

化合反应:(多变一)
=2H O 3Fe+2O = Fe O 2、铁燃烧: 4P+5O = 2P O 3、磷燃烧: 2Mg+O =2MgO 4、镁燃烧: 5、碳完全燃烧: C+O = CO 6、一氧化碳燃烧: 2CO+O = 2CO
1、氢气燃烧:
2H2+O2
点燃
2
点燃
2
3
4
点燃
2
2
5
点燃
2
点燃
2
2
点燃
)
2.下列各组物质中能相互反应且反应类型 属于复分解反应的是( )
A.锌和稀盐酸 B.二氧化碳和水 C.氯化钠溶液和硝酸钾溶液 D.氢氧化钠和稀硫酸
3. 物质的用途与其性质密切相关。研 中考热点 究金属的性质可以更好的利用金属
(1)2009年“拍卖风波”中的兔首和鼠首是青铜器, 久置的铜制品表面会锈蚀生成铜绿 [ Cu2 (OH )2 CO3 ],铜绿是铜与空气中的氧气、水 和_ 共同作用的结果。 (2)为探究铝、铁、铜的活动性顺序,某同学设计 了一组实验: 铝片浸入稀硫酸中; 铜片浸入稀硫酸中; 铝片浸入硫酸亚铁溶液中。 这组实验还不能完全证明三种金属的活动性顺序, 请补充一个实验来达到目的(写出实验步骤、现象 和化学方程式)
Fe2O3 +3CO
点燃
=2Fe+3CO
高温
2
CH4 +2O2
=CO +2H O
2 2
CO2 +Ca(OH)2
= CaCO3 ↓+H2O = Na2SO3+H2O
SO2 +2NaOH
中考热点
1.下列对基本反应的类型正确的是(
四种基本反应类型与放热反应和吸热反应

一、四种基本反应类型与放热反应和吸热反应的关系(一)、化合反应中的放热反应和吸热反应绝大多数的化合反应是放热反应,少数化合反应是吸热反应。
1、化合反应中常见的放热反应:(1)氢化物的生成反应是放热反应的实例①氢气与氟气黑暗处就爆炸放热:H2 +F2 =2HF②氢气在氯气中燃烧放热:H2 + Cl2点燃2HCl③氢气和氯气的混合光照爆炸放热:H2 + Cl2光照2HCl④氢气在氧气或空气中燃烧放热:2H2 +O2点燃2H2O⑤氮气和氢气合成氨气是体积缩小的放热反应:N2 +3H2高温高压催化剂2NH3(2)氧化物的生成是放热反应的实例①木炭在空气或氧气中燃烧放热:C+O2点燃CO2②一氧化碳在空气或氧气中燃烧放热:2CO+O2点燃2CO2③氨气催化氧化生成一氧化氮和水放热:4NH3 +5O2催化剂加热4NO+6H2O④硫在空气或氧气中燃烧放热:S+O2点燃SO2⑤二氧化硫与氧气催化氧化反应放热2SO2 +O2催化剂加热2SO3(3)含氧酸的生成反应是放热的实例①三氧化硫溶于水生成硫酸是放热反应:SO3 +H2O=H2SO4(4)强碱的生成反应是放热反应的实例①氧化钠与水反应生成氢氧化钠放热:Na2O+H2O=2NaOH②过氧化钠与水反应生成氢氧化钠和氧气放热:2Na2O2+2H2O=4NaOH+O2↑③生石灰氧化钙和水放应生成氢氧化钙放热:CaO+H2O=Ca(OH)2(5)活泼金属的含氧酸盐的生成是放热反应的实例①氧化钠与二氧化碳生成碳酸钠放热:Na2O+CO2=Na2CO3②生石灰氧化钙与二氧化碳生成碳酸钙放热:CaO+CO2=CaCO32、化合反应中常见的少数吸热反应(1)氢化物的生成反应是吸热反应的实例①氢气与碘持续加热生成碘化氢吸热:H2 +I2加热2HI②氢气和硫蒸气加热反应生成硫化氢吸热:2H2 +S 点燃2H2S(2)氧化物的生成是放热反应的实例①铜在空气中加热生成氧化铜吸热:2Cu+O2点燃2CuO②二氧化碳与碳加热生成一氧化碳吸热:CO2+C 加热2CO(二)、分解反应中的放热反应和吸热反应分解反应少数是放热反应,大多数是放热反应。
化学反应四种基本类型ppt课件
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
初中化学_化学反应四种基本类型 PPT课件 图文

本节课你有哪些收获?
1.化学反应的基本类型:化合反应、分解反应、置换 反应、复分解反应(能够对典型反应分类)。
2.能根据化学反应解释与日常生活相关的一些现象。 3.能用金属活动性表对有关的置换反应进行简单的
判断。 4了解人们如何利用化学反应改善和提高生活质量。
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇 4、与肝胆人共事,无字句处读书。——周恩来 5、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 6、一切节省,归根到底都归结为时间的节省。——马克思 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿 11、有勇气承担命运这才是英雄好汉。——黑塞 12、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德
新 课 标 要 求
1.化合反应:“多变一”型
( 1 )单质和氧气的反应:
如:Fe、Mg、Cu、Al、C、S、P、H2
(2 CO
)C一O2氧2_C化_O碳_+_O和_=2点_燃二_2_C氧O,化2 C碳O的2 转C化O:—C+—CO—2高 =温2CO
(3)氧化物和水的反应:
如:CO2+H2O=H2CO3,类似的反应还有SO2、 SO3;同学们可自己完成 Na2O+H2O=2NaOH,类似的还有K2O、CaO 可自己完成
身体健康,学习进步! 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
化学反应四种基本类型复习 课件(共17张PPT)

错误观点
示例:氧化反应一定是化合 反应
⑴化合反应的反应物都是单 质
⑵分解反应的生成物都是单 质
⑶置换反应的反应物中一定 有金属铁
⑷有盐和水产生的反应一定 是复分解反应
否定例证(化学方程式)
CH4+2O2
CO2+2H2O
小 结
定义
举例 表达式
表达式
化合反应
定 义
定
举例
义
置换反应
表达式 举例
定义
四
种
复分解反应
点燃
• C、CH4+202 = C02+2H20
加热
• D、Cu0+H2 = Cu+H20
定义:由两种化合物互相交换成分, 生成另外两种化合物的反应。
复
分 解
表达式:AB+CD→AD+CB
反
应 发生条件: 反应物必须可溶(若一种不溶,
另一种必须为强酸)
生成物中有沉淀或水或气体
复分解反应举例
1.酸+碱→盐+水 2.酸+盐→新盐+新酸
(1)分解反应:
;
(2)化合反应:
;
(3)置换反应:
;
⑷复分解反应:
。
在化学反应前后,物质所含元素化合价发生变化的 反应是氧化还原反应,它与化学反应基本类型间的 关系如图所示,下列示例中错误的是
A.阴影1:C+O2 B.阴影2:2H2O
点燃 通电
CO2 2H2↑+O2↑
C.阴影3:Mg(OH)2+2HCl=MgCl2+2H2O
贝壳
(主成分CaCO3)
CaO
Ca(OH)2 CaCO3 粉末
四种基本反应类型与氧化还原反应.ppt

2、判断下列反应能否发生,能请完 成并注明反应类型,否说明原因。
1)H2SO4+NaOH 2)NaOH+CuSO4
=_____________ =_____________
3)Na2CO3+CaCl2
=_____________
4)HCl+Na2CO3 5)KNO3+NaCl 6)Na2SO4+NH4NO3
2、根据所掌握的知识分析所有的分解反 应均是氧化还原反应吗?请举例说明。
1)生成物全是单质: 2) 生成物全是化合物: 3)生成物是一种单质和一种化合物:
结论:
3、根据所掌握的知识分析所有的置 换反应均是氧化还原反应吗?请举 例说明 。
1) 金属置换金属: 2)金属置换非金属: 3)非金属置换金属: 4)非金属置换非金属:
m
减小 不变 不变 不变 不变
V
C
不变 增大 减小 增大 不变
减小 减小 增大 减小 不变
讨论
定容时俯视或仰视刻度线,对溶 液的浓度有何影响?
俯 视
俯视刻度线,实 际加水量未到刻 度线,使溶液的 物质的量浓度增 大;
仰 视
仰视刻度线,实 际加水量超过刻 度线,使溶液的 物质的量浓度减 小。
6、Ⅰ、从铁、盐酸、氧气、水、硝酸银溶液 五种物质中选出1种或2种为反应物,按下列 反应类型各写1个化学方程式:
(1)化合反应
;
(2)分解反应
;
(3)置换反应
;
(4)复分解反应
;
以上化学反应属于氧化还原反应的是
号)。
(填序
Ⅱ、按下列要求各写出一个化学反应 方程式:
(1)有水生成的化合反应
;
高中化学人教版必修一课件:2.3氧化还原反应 (共36张PPT)

四、几种特殊的氧化还原反应
(一)部分氧化还原反应
2KMnO4 + 16HCl == 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
(二)歧化反应
Cl2 + H2O = HCl + HClO
(三)归中反应:
H2SO4(浓) + H2S = SO2↑+ S↓+ 2H2O
目录
(一) 部分氧化还原反应 在氧化还原反应中,如果还原剂只有部分被
__2_:_1 __
(三)归中反应 不同价态的同一元素化合价可升高或降低至某
一中间价态。 同种元素不同价态之间发生氧化还原 反应遵循以下归中规律:
高价+低价→相同中间价(注“可靠拢、不交叉”)
例题 2H2S+SO2=3S+2H2O
氧化产物与还原产物的物质的量之比:__2_:1___
练习:C + CO2 = 2CO n(氧化产物):n(还原产物)=__1_:_1____
2、氧化还原的实质是( ) A、有氧化剂和还原剂 B、有氧原子得失的反应 C、有元素化合价升降的反应 D、有电子得失的反应
3、下列说法下说法正确的是(
)
A、氧化剂本身被子还原,生成氧化产物
B、氧化剂是在反应中得到电子(或电子对偏向)的物质
得电子,化合价降低,被还原
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(氧化性) (还原性 )
失电子,化合价升高,被氧化
2、口诀: “失, 升, 氧 , 得, 降, 还, 若 是 剂, 两 相 反 ”
3、Βιβλιοθήκη 氧化剂被还原还原产物
反 (氧化性) 得电子(化合价降低)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
= Fe +CuSO4 Cu+FeSO4
= Cu +2AgNO3 2Ag+Cu(NO3)2
定义:由两种化合物互相交换成分,生成另外一种 化合物的反应。
表达式:AB+CD→AD+CB
复
特点:双交换,价不变
分
发生条件:生成物中有沉淀或水或气体
解
判断复分解反应能否发生时:
反
应
要考虑生成物中有没有沉淀、气体和水
表达式:A+BC→B+AC
置
特点:一换一(或单换单)
换 依据:金属活动顺序表
反
应
较活泼金属+酸→盐+氢气
举例:
如:Z n H 2S4O Zn4 S H 2 O
金属+盐→新金属+新盐,
如H:2F C ue C ΔOCu 4 uS F HO 2O e4 SC O u
高温
C2CuO2CuCO 2
(“前换后”,“盐可溶”,“不用K、Ca、Na等”)
化学反应四种基本类型
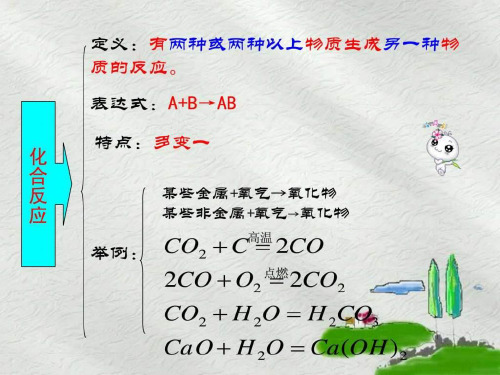
定义:有两种或两种以上物质生成另一种物 质的反应。
表达式:A+B→AB
特点:多变一 化
合
某些金属+氧气→氧化物
反
某些非金属+氧气→氧化物
应
举例: CO2 C高温 2CO
2CO O2 点燃2CO2
CO2 H 2O H 2CO3
CaO H 2O Ca (OH )2
化合反应:(多变一)
注意:
要考虑反应物的可溶性
有些难溶物的物质也可以发生复分解反应 如:难溶性的碳酸盐可以与酸反应 难溶性的碱也可以与酸发生反应
复分解反应举例
1.酸+碱→盐+水,如:
H C Nla O Na H H C 2 Ol
2.酸+盐→新盐+新酸,如:
H CAlg3N AO g C H l N 3 O
3.盐+盐→两种新盐,如:
应
2KClM3OnO22KCl3O2
举例: CaCO3 高温CaO CO2
2H2O通电2H2 O2
H2CO3 H2O CO2
分解反应:(一变多)
1、用过氧化氢和二氧化锰制氧气:
= 2H2O2MnO2 2H2O+ O2 ↑
2、用高锰酸钾制氧气:
=加热
2KMnO4 K2MnO4+MnO2+ O2↑
8、二氧化碳溶于水: CO2+H2O = H2CO3
小结: 1、大多数的单质和无机物的燃烧都是化合反应。
2、大多数酸碱性氧化物与水的反应都是化合反应。
定义:由一种反应物生成两种或两种以上其 他物质的反应。
表达式:AB→A+B
分
特点:一变多2H2OM2nO22H2OO2
解 反
实验室 制氧气
2KMn4 O Δ K2Mn4OMn2OO2
中考热点
1.下列对基本反应的类型正确的是( )
A.置换反应的产物中一定有单质 B.化合反应的反应物都是单质 C.复分解反应的产物都是化合物 D.分解反应的产物都是化合物
2.下列各组物质中能相互反应且反应类型 属于复分解反应的是( )
9、碳酸氢钙受热分解:
= 2H2O 通电 2H2↑+ O2 ↑
5、碳酸不稳定,易分解:
=加热
Ca(HCO3)2 CaCO3↓+ H2O +CO2↑
10、碳酸氢铵受热分解:
H2CO3 = H2O+ CO2↑
=加热
NH4HCO3
NH3 ↑ + H2O +CO2↑
定义:由一种单质与一种化合物反应,生成 另一种单质与另一种化合物的反应。
置换反应:(单换单)
1、氢气还原氧化铜: 2、碳还原氧化铜:
=加热
H2 +CuO
Cu+H2O
=加热
C +2CuO
2Cu+CO2 ↑
3、锌与盐酸制氢气: 4、铁与硫酸制氢气: 5、铁与硫酸铜反应: 6、铜与硝酸银反应:
= Zn +2HCl ZnCl2+H2 ↑
= Fe +H2SO4
FeSO4+H2 ↑
氧化 化 A合
氧
化置
还 原
换
复中 分和 解
= = 点燃
CH4 +2O2 CO2+2H2O Fe +CuSO4
Cu+FeSO4
=点燃
3Fe +2O2 Fe3O4
CuO +H2 Cu+H2O
= CaCl2 +Na2CO3 CaCO3 ↓+2NaCl
=高温
Fe2O3 +3CO 2Fe+3CO2
= CaO +H2O Ca(OH)2
1、氢气燃烧: 2、铁燃烧: 3、磷燃烧: 4、镁燃烧: 5、碳完全燃烧:
=点燃
2H2+O2 2H2O
=点燃
3Fe+2O2 Fe3O4
=点燃
4P+5O2 2P2O5
=点燃
2Mg+O2 2MgO
=点燃
C+O2 CO2
=点燃
6、一氧化碳燃烧: 2CO+O2 2CO2
7、制取澄清石灰水: CaO+H2O = Ca(OH)2
N2C a3 O Ca 2C Cla3 C 2N Oa
4.金属氧化物+酸→盐+水,如: C uH 2 O S4O Cu 4 H S2 O O
复分解反应:(互换成分)
1、盐酸中和氢氧化钠:
6、氯化铵与氢氧化钠反应:
HCl +NaOH=NaCl+H2O
2、硫酸与氢氧化钡反应:
NH4Cl +NaOH=NaCl+NH3 ↑ +H2O
HCl +NaOH =Nacl+H2O
三、其它反应:
1、炼钢炼铁的反应: 2、甲烷的燃烧:
=高温
Fe2O3 +3CO 2Fe+3CO2
=点燃
CH4 +2O2 CO2+2H2O
3、二氧化碳的检验:
= CO2 +Ca(OH)2 CaCO3 ↓+H2O
4、氢氧化钠除二氧化硫: = SO2 +2NaOH Na2SO3+H2O
Na2SO4 +BaCl2=BaSO4 ↓+2NaCl
9、硫酸铜与氢氧化铜反应:
CuSO4 +2KOH=Cu(OH)2↓+K2SO4
103=CaCl2+H2O+CO2 ↑ Na2CO3 +Ca(OH)2=2NaOH +CaCO3 ↓
二、理清关系:
化合与氧化,置换与氧化还原,复分 解与中和,各反应间关系:
7、小苏打与盐酸反应:
H2SO4 +Ba(OH)2=BaSO4 ↓+2H2O
3、盐酸与氢氧化铝反应:
HCl +NaHCO3=NaCl+H2O+CO2 ↑
8、硫酸钠与氯化钡反应:
3HCl +Al(OH)3=ALCl3 +3H2O
4、盐酸与硝酸银反应:
HCl +AgNO3=AgCl↓+HNO3
5、碳酸钙与盐酸反应:
6、高温煅烧石灰石:
= CaCO3 高温 CaO+ CO2 ↑
7、氢氧化铜受热分解:
=高温
Cu(OH)2 CuO+ H2O
3、用氯酸钾和二氧化锰制氧气: 8、碱式碳酸铜受热分解:
=MnO2
2KClO3 加热 2KCl+ 3O2↑
4、水的通电分解:
=加热
Cu2(OH)2CO3 2CuO+ H2O +CO2↑
