不同浓度硫酸铜溶液电极电势的测定 论文
铜的标准电极电势

铜的标准电极电势铜是一种常见的金属元素,具有良好的导电性和导热性,因此在工业生产和日常生活中得到广泛应用。
在化学领域,铜也是一个重要的研究对象,其电化学性质尤为引人关注。
铜的标准电极电势是描述铜在标准状态下(25摄氏度、1大气压)与标准氢电极之间电势差的物理量,是评价铜在电化学反应中的活性和稳定性的重要参数。
铜的标准电极电势的测定是通过将铜电极与标准氢电极进行比较实验得到的。
标准氢电极的电势被定义为0V,因此通过与标准氢电极比较,可以确定其他金属电极的标准电极电势。
在实验中,首先需要制备铜电极,通常是将纯度较高的铜片或铜丝制成电极。
然后将铜电极与标准氢电极放置在同一电解质溶液中,如硫酸铜溶液中。
通过测量两电极之间的电势差,即可得到铜的标准电极电势。
铜的标准电极电势通常用E°表示,其数值为+0.34V。
这表明在标准状态下,铜电极与标准氢电极相比,铜的电极反应是较为容易进行的。
具体而言,当铜处于标准状态时,铜离子会向溶液中释放电子,发生氧化反应,而标准氢电极则会接受这些电子,发生还原反应。
这一过程的电势差就是铜的标准电极电势。
铜的标准电极电势对于铜在电化学反应中的行为具有重要的指导意义。
在电化学反应中,铜的标准电极电势可以用来预测铜的氧化还原性质,以及与其他物质之间的反应倾向。
同时,铜的标准电极电势也可以用来计算电池的电动势,指导电池的设计和应用。
除此之外,铜的标准电极电势还与铜的腐蚀行为密切相关。
在实际应用中,铜常常会受到氧化、硫化等环境因素的影响,导致腐蚀现象的发生。
通过了解铜的标准电极电势,可以更好地理解铜在不同环境条件下的腐蚀行为,为防止铜制品的腐蚀提供科学依据。
总的来说,铜的标准电极电势是描述铜在电化学反应中活性和稳定性的重要参数,对于预测铜的氧化还原性质、指导电池设计和应用,以及理解铜的腐蚀行为都具有重要意义。
通过对铜的标准电极电势的研究,可以更好地认识和利用这一重要金属元素的电化学性质。
不同浓度硫酸铜溶液电极电势的测定

不同浓度硫酸铜溶液电极电势的测定XXXXX学院化学化工学院XX化学班摘要:由于电极电势的大小不仅与电极的种类、溶液的浓度等因素有关、还与电池所处的温度密切相关。
本实验使用不同浓度硫酸铜溶液作为铜电极的电极溶液,采用对消法测定Cu电极-饱和甘汞电极组成的电池的电动势,根据能斯特方程计算实验条件下的铜电极的电极电势,并与理论值进行比较。
实验结果表明,实验值与实验温度下的理论值十分接近。
关键词:电极电势;测定;对消法;硫酸铜溶液前言电动势的测量方法,在物理化学研究工作中具有重要的实验意义,通过电池电动势的测量可以获得还原体系的许多热力学数据。
如平衡常数,电解质活度,解离常数,溶解度,络合常数,酸碱度以及某些热力学函数改变量等。
[1]但在电化学中,电极电势的绝对值至今无法测量,在实际测量中是以标准氢电极的电极电势作为零标准,然后将其它被测的电极(被研究电极)与它组成电池,测量该电动势即为该被测电极的电极电势。
由于使用标准氢电极不方便,在实际测定时常采用第二级的标准电极,甘汞电极(SCE)是其中最常用的一种。
[2]测量电池电动势必须在电池处于可逆条件下进行。
通过因此需用对消法来测定电动势。
对消法测定电动势就是在所研究的电池的外电路上加一个方向相反的电压。
当两者相等时,电路的电流为零,此时测得的电势降为电池真正的电动势。
[3][4][5]1实验部分1.1仪器试剂UJ-25型电位差计1台;检流计1台;低压直流电源1台;标准电池1只;干电池(1.5V)2节;铜电极1支;甘汞电极1支电极管1只;电极架1只;电线若干;烧杯(100mL)6个;容量瓶(50.00mL)5个硫酸铜溶液(0.50mol•L-1);氯化钾(分析纯)1.2实验步骤1.2.1 配制不同浓度的CuSO4溶液将0.50mol/L的CuSO4溶液分别配制成0.40mol/L、0.30mol/L、0.20mol/L、0.10mol/L共计五个不同浓度的溶液作为铜电极的电极溶液1.2.2 制备饱和氯化钾溶液加入适量的氯化钾固体于100mL蒸馏水中,加热搅拌至完全溶解,冷却至室温,溶液有晶体析出制得饱和氯化钾溶液。
铜标准电极电势

铜标准电极电势铜标准电极电势是指以铜/铜离子(Cu/Cu2+)为参比电极的标准电极电势。
在标准状态下,铜标准电极电势被定义为零。
这一概念对于电化学研究和实践具有重要意义,因为它不仅可以用来测定其他金属的标准电极电势,还可以通过与其他物质的反应来推断它们的氧化还原性质。
本文将对铜标准电极电势进行详细介绍,以便更好地理解其在电化学中的应用。
铜标准电极电势的定义是在标准状态下,Cu/Cu2+电极的电势为零。
这里的标准状态指的是溶液中铜离子浓度为1mol/L,温度为25摄氏度,压强为1个大气压。
在这种状态下,铜电极的电势被定义为零,其他物质的标准电极电势就是相对于铜电极的电势差。
这种定义方式的好处在于可以通过实验测定其他物质的标准电极电势,从而推断它们的氧化还原性质。
铜标准电极电势的测定方法一般有两种,一种是使用标准氢电极作为参比电极,另一种是使用饱和甘汞电极作为参比电极。
在实际应用中,一般采用标准氢电极作为参比电极,因为标准氢电极的电势与氢离子的还原电势相关,可以通过理论计算和实验测定得到较为准确的数值。
通过将铜电极与标准氢电极连接成电池,测量它们之间的电势差,就可以得到铜标准电极电势的数值。
铜标准电极电势的应用非常广泛,它可以用来测定其他金属的标准电极电势。
通过将待测金属与铜电极连接成电池,测量它们之间的电势差,就可以得到待测金属的标准电极电势。
这对于研究金属的氧化还原性质非常重要,也为金属腐蚀、电镀等工艺提供了理论依据。
此外,铜标准电极电势还可以用来推断物质的氧化还原性质,如通过测量物质与铜电极的电势差来确定其氧化还原能力。
总之,铜标准电极电势是电化学研究中的重要概念,它的准确测定和应用对于理解物质的氧化还原性质、研究金属的电化学行为具有重要意义。
通过实验测定和理论计算,我们可以得到铜标准电极电势的准确数值,并通过它推断其他物质的氧化还原性质。
希望本文能够对读者对铜标准电极电势有所帮助,也希望在电化学研究和实践中能够更好地应用这一概念。
不同浓度硫酸铜溶液电极电势的测定 论文

不同浓度硫酸铜溶液电极电势的测定摘要:电极电势测定的大小与电极种类、溶液浓度、温度有关。
本实验采用对消法测定不同浓度硫酸铜的Cu电极-饱和甘汞电极组成的电池的电动势,根据能斯特方程计算当时实验条件下铜电极电势,再与理论值进行比较。
关键词:电极电势,对消法,硫酸铜溶液前言:电动势的测量方法,在物理化学研究工作中具有重要的实际意义,通过电池电动势的测量可以获得还原体系的许多热力学数据。
如平衡常数,电解质活度及活度系数,离解常数,溶解度,络合常数,酸碱度以及某些热力学函数改变量等。
但在电化学中,电极电势的绝对值至今无法测定,在实际测量中是以某一电极电势作为零标准,然后将其它的电极(被研究电极)与它组成电池,测量其间的电动势,则该电动势即为该被测电极的电极电势。
由于使用标准氢电极不方便,在实际测定时往往采用第二级的标准电极,甘汞电极(SCE)是其中最常用的一种。
测量电池电动势只能在无电流通过电池的情况下进行,因此需用对消法来测定电动势。
对消法测定电动势就是在所研究的电池的外电路上加一个方向相反的电压。
当两者相等时,电路的电流为零,此时测得的电势降为电池真正的电动势。
1.实验部分1.1试剂与仪器UJ-25型电位差计 1台;检流计 1台;低压直流电源 1台;标准电池 1只;干电池(1.5V) 2节;铜电极 1支;甘汞电极 1支电极管 1只;电极架 1只;电线若干;烧杯(100mL) 6个;容量瓶(50.00mL) 5个硫酸铜溶液(0.50mol·L-1) 氯化钾(分析纯)1.2实验步骤1.2.1配制不同浓度的CuSO4溶液将0.50mol/L的CuSO4溶液分别配制成0.40mol/L、0.30mol/L、0.20mol/L、0.10mol/L共计五个不同浓度的溶液作为铜电极的电极溶液1.2.1制备饱和氯化钾溶液称量约37g的氯化钾固体于100mL蒸馏水中,加热搅拌至完全溶解,冷却至室温,溶液有晶体析出制得饱和氯化钾溶液。
电极电势的测定---电位差计法

电极电势的测定---电位差计法一、实验目的1.测定Cu-Zn电池的电动势和电极的电极电势;2.学会一些电极的制备和处理方法;3.掌握电位差计的测量原理和正确的使用方法。
4.了解通过原电池电动势测定求算有关热力学函数的原理。
二、实验原理电位差计是采用补偿原理测量电动势(或电压)的一种精密仪器,工作原理如图所示。
其中Rx、Rn和具有滑点C点的电阻R均是电位差计的构件。
而由工作电源Ew、电阻Rf(可以调节)、R及Rx串联而成的电路称辅助电路。
通过调节Rf可改变电路的工作电流。
使用电位差计,基本上可分为两个步骤掌握用万用电表测量电流、电压、电阻的方法。
对消法测定可逆电池电动势的电路图如图所示:图中:Ew: 工作电源E n:标准电池E x:被测电动势R n: 标准电池的补偿电阻;Rx:被测电池的补偿电阻;R: 调节工作电流的变阻器; G: 检流计如上图:可逆电池电池电动势可用电位差计法(对消法)测定,所用仪器为电位差计,原理如图:滑动触点C用于调节电阻R分配在测量回路中的电阻R x的大小。
R n的阻值大小根据工作电池选择,R由已知电阻值的各进位盘组成,通过它可以调节不同的电阻数值与其电位降E x相抵消。
测量时先将开关K合在1的位置上,然后调节r使G指向零点,这时:E n=I*R n得到:I= E n/ R n(1)I为通过R n和R的电流,成为电位差计的工作电流。
工作电流调好后,将K合至2的位置上,同时选进各进位盘的触头C,再次使G指向零点,则:E x=I*R c(2)合并(1)式和(2)式得:E x=(E n/ R n)*R c在完全补偿(G=0)时,工作电路与被测回路之间并无电流通过,只要测得E n/ R n的值,即可在高灵敏度示零的情况下准确测出被测电池的电动势。
标准电池电动势E n/V与温度T/K的关系为:E n=1.01865-4.05×10-5(T-293)2-9.5×10-7(T-293)2 +1×10-8 (T-293)3凡把化学能转变为电能的装置称为化学电源(或电池、原电池)。
不同浓度硫酸铜溶液电极电势的测定 论文

不同浓度硫酸铜溶液电极电势的测定L-- 指导老师H--(ZQU 化学化工学院)摘要:电极电势的大小与电极种类、电解质浓度、温度等因素有关。
本文在实验温度下测得浓度分别为0.1mol/L、0.2mol/L、0.3mol/L、0.4mol/L、0.5mol/L硫酸铜溶液的Cu电极-饱和甘汞电极组成的电池电动势,探究硫酸铜浓度对电池电极电势的影响。
关键词:电极电势,电动势,硫酸铜,对消法,电位差计前言电动势的测量方法,在物理化学研究工作中具有重要的实际意义,通过电池电动势的测量可以获得还原体系的许多热力学数据。
如平衡常数,电解质活度及活度系数,离解常数,溶解度,络合常数,酸碱度以及某些热力学函数改变量等[1]。
在教学、科研中广泛使用的测量仪器是电位差计,它是按照对消法测量原理而设计的一种平衡式电学测量装置,能直接给出待测电池的电动势值(以伏特表示) 。
电极电势测定的大小与电极种类、溶液浓度、温度有关。
本文在实验温度下测得不同浓度硫酸铜溶液的Cu电极-饱和甘汞电极组成的原电池电动势,探究硫酸铜浓度对原电池电极电势的影响。
1实验部分1.1试剂与仪器仪器UJ-25型电位差计,电度装置一套,标准电池,直流复射式检流计,甲电池,镀铜溶液,饱和甘汞电极,电极管,铜电极,电极架试剂硫酸铜(分析纯),氯化钾(分析纯)1.2实验步骤1.2.1Cu电极制备将铜电极在约6mol•dm-3的硝酸溶液内浸洗,然后取出用水冲洗,再蒸馏水淋洗。
将铜电极置于电镀烧杯中作阴极,进行电镀。
电镀半小时再取出。
1.2.2 配制不同浓度的CuSO4溶液将0.5mol/L的CuSO4溶液分别配制成0.4mol/L、0.3mol/L、0.2mol/L、0.1mol/L 共计五个不同浓度的溶液作为铜电极的电极溶液。
将饱和KCI溶液注入50ml的小烧杯中作为盐桥,再将上面制备的不同浓度的铜电极和饱和甘汞电极置于小烧杯内,即成Cu-甘汞电池, Hg|Hg2Cl2|KCl(饱和)‖CuSO4(xmol.L-1)|Cu1.2.3 电动势的测定按照电位差计电路图,接好电动势测量路线。
长效硫酸铜参比电极

长效硫酸铜参比电极长效硫酸铜参比电极是一种常用的电化学参比电极,广泛应用于电化学分析和电化学测量领域。
它由铜片和硫酸铜溶液组成,具有较高的稳定性和可重复性。
本文将从长效硫酸铜参比电极的原理、制备方法、应用以及注意事项等方面进行详细介绍。
一、长效硫酸铜参比电极的原理长效硫酸铜参比电极的原理是利用铜和硫酸铜之间的化学反应产生稳定的电势作为参考电势。
在硫酸铜溶液中,铜离子会与电极表面的铜反应,形成一个稳定的铜离子浓度,从而形成一个稳定的电势。
该电势与标准电极电势的差值称为电极电势,可以作为参考电势用于电化学分析和测量中。
二、长效硫酸铜参比电极的制备方法1. 准备硫酸铜溶液:将适量的硫酸铜溶解在去离子水中,搅拌均匀,制成一定浓度的硫酸铜溶液。
2. 制备铜片电极:将铜片清洗干净,用砂纸打磨表面,然后用去离子水反复清洗干净。
3. 组装参比电极:将铜片电极放入硫酸铜溶液中,直至覆盖电极表面,确保电极表面没有气泡,然后将电极连接到测试电路中。
三、长效硫酸铜参比电极的应用长效硫酸铜参比电极广泛应用于电化学分析和测量领域。
它可以用于测量溶液中电离度的变化,测量电解质浓度和电极反应速率等。
另外,它还可以用于研究电极反应机理和电化学反应动力学等方面。
四、长效硫酸铜参比电极的注意事项1. 制备电极时要注意铜片表面的清洁度和光滑度,以确保电极的稳定性和可重复性。
2. 使用电极时要避免电极表面的氧化和污染,可以在使用前将电极浸泡在去离子水中。
3. 在使用过程中,要注意硫酸铜溶液的浓度和温度,以保证电极的稳定性和可靠性。
4. 在存储和运输过程中,要注意避免电极的损坏和污染,可以使用专门的电极保存盒进行保管。
综上所述,长效硫酸铜参比电极是一种重要的电化学参比电极,在电化学分析和测量领域有着广泛的应用。
在实际使用过程中,需要注意电极的制备、使用和存储等方面的问题,以保证电极的稳定性和可重复性。
原电池电动势的测定及应用实验报告

原电池电动势的测定及应用实验报告一、实验目的本实验旨在通过测定原电池的电动势,探究原电池内部化学反应的特性,以及原电池在实际应用中的表现。
通过本实验,能够深入了解电化学领域的知识,为日后的学习和科研打下坚实的基础。
二、实验原理1. 原电池的电动势在实验中,我们将使用铜离子和锌离子构成的原电池作为研究对象。
铜离子在还原反应中接受电子,锌离子在氧化反应中释放电子,从而构成了原电池的电化学反应。
根据纳塔尔方程,可以得到原电池的标准电动势公式如下:E°cell = E°cathode - E°anode其中E°cell表示原电池的标准电动势,E°cathode表示还原反应的标准电势,E°anode表示氧化反应的标准电势。
通过测定原电池的电动势,可以推断出原电池内部化学反应的趋势和特性。
2. 库仑定律根据库仑定律,原电池电动势与反应物浓度的关系可以表示为:Ecell = E°cell - (RT/nF) * lnQ其中Ecell表示原电池的电动势,E°cell表示标准电动势,R表示气体常数,T表示温度,n表示电子转移数,F表示法拉第常数,Q表示反应物的活度积。
通过测定不同反应物浓度下的电动势变化,可以验证库仑定律的成立。
三、实验材料和设备1. 铜离子和锌离子构成的原电池2. 电位计3. 导线4. 盐桥5. 反应物浓度变化实验所需的试剂四、实验步骤1. 将原电池连接至电位计,并记录下初始电动势。
2. 分别测定不同反应物浓度下的电动势,记录实验数据。
3. 根据实验数据,绘制原电池电动势与反应物浓度的关系图。
4. 分析实验结果,总结实验结论。
五、实验结果与分析我们在实验中测定了铜离子和锌离子构成的原电池在不同反应物浓度下的电动势变化情况。
通过实验数据的分析,我们得出了如下结论:1. 随着反应物浓度的变化,原电池的电动势呈现出明显的变化趋势,符合库仑定律的规律。
电极电势与金属——溶液界面电位差

电极电势与金属——溶液界面电位差作为一个化学概念,电极电势与金属——溶液界面电位差一直被广泛研究和应用。
它涉及到金属与溶液之间的电荷转移和电子传递过程,对于电化学、腐蚀学、电化学工程等领域都具有重要的意义。
在这篇文章中,我们将深入探讨电极电势与金属——溶液界面电位差的相关知识,从简单到复杂、由浅入深地介绍其原理、影响因素和应用。
1. 电极电势的基本概念电极电势是指电极与电解质溶液之间由于电荷分布不均匀而产生的电位差。
它反映了电极在特定条件下的氧化还原能力,是电化学反应进行的动力学基础。
在电化学中,电极电势常常被用来描述电解质的还原性和氧化性,是判断化学反应进行方向的重要指标之一。
2. 金属——溶液界面电位差的形成机制金属与溶液接触时,会在界面处形成电位差。
这一电位差的形成机制包括双电层效应、晶面特性和离子间相互作用等。
双电层效应是指金属表面吸附的溶质离子形成一个由负电荷和正电荷组成的双电层结构,从而形成电位差。
晶面特性则影响了金属表面对溶质的吸附和离子交换能力,进而影响了界面电位差的大小和方向。
3. 影响金属——溶液界面电位差的因素金属——溶液界面电位差的大小和方向受到多种因素的影响。
其中,溶液中的离子浓度、溶液的酸碱性、温度和金属表面的形貌等都会对界面电位差产生显著的影响。
金属在溶液中的电化学活性和局部腐蚀情况也会对界面电位差产生重要影响。
4. 电极电势与腐蚀的关系金属——溶液界面电位差直接关系到金属的腐蚀性能。
当金属处于不同的电极电势下时,其在溶液中的腐蚀速率和形式都会发生变化。
通过对电极电势与金属——溶液界面电位差的研究,可以更好地理解金属腐蚀的本质和机理,为腐蚀防护提供重要的理论基础。
5. 应用与展望电极电势与金属——溶液界面电位差的研究不仅在腐蚀学领域有重要应用,而且在电化学工程、电化学储能、材料科学等领域也具有广泛的应用前景。
通过深入研究界面电位差的形成机制和影响因素,可以为材料的设计与加工提供重要的指导。
硫酸铜参比电极参数

硫酸铜参比电极参数引言:参比电极是电化学中常用的一种电极,用于建立电势的基准。
硫酸铜参比电极是一种常用的参比电极,具有一系列独特的参数。
本文将详细介绍硫酸铜参比电极的参数及其相关知识。
一、硫酸铜参比电极的构成硫酸铜参比电极由三个主要部分组成:电极材料、电解质和电极外壳。
1. 电极材料:硫酸铜参比电极的电极材料通常是纯铜,它具有良好的导电性和化学稳定性。
2. 电解质:硫酸铜参比电极的电解质是硫酸铜溶液,其中硫酸铜起到了电导作用,保证了电极的正常工作。
3. 电极外壳:硫酸铜参比电极的电极外壳一般采用陶瓷材料,以保护电极内部结构,防止电极材料与外界环境发生不必要的反应。
二、硫酸铜参比电极的电极电势硫酸铜参比电极的电极电势是通过与标准氢电极进行校准得到的。
标准氢电极被定义为0V的电势基准,硫酸铜参比电极与标准氢电极相连时,可以测量到硫酸铜参比电极的电势。
硫酸铜参比电极的电势被定义为其与标准氢电极之间的电势差,通常以E(Cu2+/Cu)表示。
三、硫酸铜参比电极的电容硫酸铜参比电极的电容是指电极与电解质之间的电容。
电容是指电荷与电势之间的关系,硫酸铜参比电极的电容越大,说明电极与电解质之间的电荷传递速度越快,电势变化越迅速。
硫酸铜参比电极的电容大小与电极的表面积、电解质浓度以及电解质的粘度等因素有关。
四、硫酸铜参比电极的电流响应硫酸铜参比电极的电流响应是指电极对外界电流变化的响应速度。
硫酸铜参比电极的电流响应时间越短,说明电极对外界电流变化的敏感度越高。
硫酸铜参比电极的电流响应时间受到电解质浓度、电解质的离子移动速率以及电极表面积等因素的影响。
五、硫酸铜参比电极的使用方法硫酸铜参比电极在实验中的使用方法如下:1. 首先,将硫酸铜参比电极与待测电极连接,建立电路。
2. 确保硫酸铜参比电极完全浸入待测溶液中,保持电极稳定。
3. 通过测量硫酸铜参比电极的电势变化,可以得到待测电极的电势变化情况。
4. 根据硫酸铜参比电极的电势基准,可以计算出待测电极的电势值。
实验六--不同浓度硫酸铜溶液电极电势的测定

实验六--不同浓度硫酸铜溶液电极电势的测定实验目的:1. 掌握电位计法测定溶液电极电势的基本方法和步骤;2. 研究不同浓度硫酸铜溶液电极电势的变化规律;3. 学习计算半电池电势和标准电极电势的方法。
实验原理:电位计法是一种测定溶液电极电势的方法,它是利用原电池或标准电极与待测电极连成电池,将电池开路时,电荷在两电极间的迁移而产生电势差。
待测电极的电势是相对于标准电极引入的概念,因此用电量法可以测出标准电极电势,并根据标准电极电势的知识,求出待测电极电势。
半电池是指单独存在并能够给出电势的电化学单元。
想象两个形态相同的根本没有电荷的导体系共存在一个均匀电场中。
在均匀电场中,导体系内部的电荷分布是均匀的,但是,由于导体系的两端的电势值不同,因此,导体系两端的电荷密度也不相同,这个现象叫做电势差。
如果导体系内部没有空间电荷,则这个电势差就被称为该导体系的电势。
标准电极电势是指在标准状态下,电极与相应的氧化还原剂或还原剂的物质浓度均为1mol/L时,电极半反应中发生还原的物质的还原电势与标准氢电极的电势之差。
实验步骤:1.实验器材的准备:电位计、电极、硫酸铜溶液、烧杯、药品勺、PH计、清水等。
2.实验前的预备工作:用PH计检验硫酸铜溶液的酸碱度,按比例配制不同浓度的硫酸铜溶液,注意每个浓度的溶液都要配制足够的量。
3.取一只电极并清洁,在常温下准备环境。
根据它的类型,适当的研磨电极以除去表面的生锈和死物质。
插上电流表,甚至这台大部分电位计都会有。
4.将电极按照实验需求连接到电位计上。
该操作会因为电极的类型而有所变化,这是肯定的。
5.选择一个量杯,测量25mL的硫酸铜溶液,并将其倒入烧杯中。
重复此步骤,直到有足够的每个浓度的溶液电位计法测定硫酸铜溶液电势过程图形分别显示为内部均衡过程和外部均衡过程的温度下测定不同浓度硫酸铜溶液的半电池电势。
6.按以下公式计算出所需的相关数据:硫酸铜溶液电势=E-E(标准氢电极)半电池电势=E(反应物)-E(生成物)标准电极电势=E(氧化)-E(还原)根据表1和表2计算出每种溶液在25℃下的标准电极电势E’。
硫酸铜浓度差电池原理

硫酸铜浓度差电池原理说起硫酸铜浓度差电池原理,我有一些心得想分享。
你们有没有发现,在生活中有时候东西的浓度不一样就会产生一些奇特的现象呢?就像我们泡茶的时候,如果茶叶在某一处堆积得多,那这一处的茶水味道就浓,周围淡一点,时间久了,就像是有什么在推动着味道均匀化。
这和硫酸铜浓度差电池原理有点相似之处。
我刚开始接触硫酸铜浓度差电池原理的时候,真的很困惑。
简单来说呢,这就要说到电池是怎么工作的。
在浓度差电池里面,有两个电极浸在硫酸铜溶液里,但这两个溶液的硫酸铜浓度不一样。
就如同两个装着不同水量(相当于溶液中硫酸铜的量)的杯子,中间用一根小管子(可以类比为连接电极的导线等部分)连通起来。
打个比方吧,高浓度的那边就像湖泊,低浓度的那边像小水洼。
硫酸酮里面的铜离子就像一群调皮的小粒子,它们在高浓度这边比较拥挤(因为数量多),就特别想要跑到低浓度那边去,可怎么去呢?这时就会在电极上发生反应,铜离子在高浓度这边得到电子变成铜原子沉积在电极上,而低浓度那边电极上的铜原子则会失去电子变成铜离子跑到溶液里去,这样电子就沿着导线流动了,就产生了电流。
从专业的角度来说,根据能斯特方程,这种浓度的差异会造成电极电势差,而这个电势差就推动了电子的定向移动从而产生电流。
这个原理在实际中有一些应用,比如说我们检测环境中某种离子浓度的时候,如果构建一个这样的浓度差电池,通过测量电流或者电极电势的变化,就可以推测出离子浓度的大小。
不过呀,还有一些东西我也没完全搞明白,比如说在不同环境温度下,这个浓度差电池的效率会不会有很大变化呢?这就像不同的天气下,我们刚刚说的茶叶在茶水里的扩散速度会不会有重大改变一样,我还需要进一步去探究。
说到这里,你可能会问,如果不是硫酸铜形成这样的浓度差,换作其他离子行不行呢?我觉得是有可能的。
就像不同品种的茶叶在水里也会有类似的扩散、浓度均衡的现象,不同的离子在溶液中由于浓度差也有可能构建起能产生电流的体系。
电极电动势实验报告

电极电动势实验报告实验目的1.掌握可逆电池电动势的测量原理和电位差计的操作技术2.学会几种电极和盐桥的制取方法实验原理凡是能够并使化学能转型为电能的装置都称作电池(或原电池)。
可逆电池应满足如下条件:(1)电池反应对称,亦即为电池电极反应对称;(2)电池中不容许存有任何不可逆的液接界;(3)电池必须在对称的情况下工作,即为充放电过程必须在平衡态下展开,即为测量时通过电池的电流应属无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位;用电位差计测量电动势可满足通过电池电流为无限小的条件。
电位差计测定电动势的原理称为对消法,可使测定时流过电池的电流接近无限小,从而可以准确地测定电池的电动势。
对称电池的电动势可以看做正、正数两个电极的电势之差。
设立负极电势为φ+,负极电势为φ-,则电池电动势 e = φ+ - φ- 。
电极电势的绝对值无法测定,手册上所列的电极电势均为相对电极电势,即以标准氢电极作为标准,规定其电极电势为零。
将标准氢电极与待测电极组成电池,所测电池电动势就是待测电极的电极电势。
由于氢电极使用不便,常用另外一些易制备、电极电势稳定的电极作为参比电极。
常用的参比电极有甘汞电极、银-氯化银电极等。
这些电极与标准氢电极比较而得的电势已精确测出,具体的电极电位可参考相关文献资料。
以饱和状态甘汞电极与铜/硫酸铜电极或锌/硫酸锌电极共同组成电池,测量电池的电动势,根据甘汞电极的电极电势,可以求出这两个电极的电极电势。
仪器和试剂sdc-ii型数字式电子电位差计,铜电极,锌电极,饱和状态甘汞电极,0.1 mol?l-1 cuso4 溶液,0.1 mol?l-1 znso4 溶液,饱和状态 kcl 溶液。
实验步骤1. 记录室温,关上sdc-ii型数字式电子电位差计预演 5 分钟。
将测量旋钮旋到“内标”档,用1. v电压展开“采零”。
_影响电极电势因素_的微型化实验设计

摘 要:通过“影响电极电势因素”的微型化实验设计,培养高师学生的研究意识和研究能力,
有利于培养适应基础教育化学新课程要求的研究型教师.
关键词:原电池;电极电势;电动势;微型实验
中图分类号:G424.31
文献标识码:A
基础教育化学新课程的实施对高师无机化学实验教学提出更高的要求,除培养学生的基本实验能力 外,更要注重培养学生的研究意识和实验设计能力,提高学生的综合素质 [1-2] . 为了使学生掌握实验设计的方 法,提高学生运用知识分析问题、解决问题的能力,采用开放实验室及指导学生开展研究性小课题活动的方 法. 笔者以“影响电极电势因素”为课题,进行实验探究,并以论文的形式总结探究的过程和结果.
稀释对电极电势的影响不明显.
对比实验数据可以发现,简单离子形成沉淀和配离子后,电极电势明显改变,尤其是配离子的形成对电
极电势的改变最为显著,这和理论相符合.
4 酸度对电极电势的影响
4.1 实验方案
选择受酸度影响大的氧化还原反应设计成原电池,间接体现酸度对电极电势的影响,使实验效果明显.
例如:
Cr2O72-+3Fe+14H+=2Cr3++3Fe2++7H2O. 2MnO4-+5Fe+16H+=2Mn2++5Fe2++4H2O.
分别测量每组实验的电动势记录实验数据结果见表2322或znnh342配表1原电池电动势ev原电池装置平行实验次数平均偏差平均误差组成123456烧杯u形管琼脂kcl饱和液102100102100100105点滴板孔穴kcl饱和液浸湿的滤纸090093092090090090001011点滴板孔穴kcl饱和液浸湿的海绵060084090070085075009024小药瓶输液管琼脂kcl饱和液080080082080083080001021小孔穴药板输液管琼脂kcl饱和液081080082080080083001021类型常量装置微型装置表2浓度对电极电势的影响znso4溶液cuso4溶液原电池电动势ev123456参考标准10moll10moll090090085090090085实验操作10moll加水稀释沉淀配离子089090083090090085082080075080080082062060060065060060加水稀释沉淀配离子10moll090090086090091085102096100097095095112104110110105110833数据分析和结论通过实验发现加水稀释减小cuso4或znso4浓度后电池电动势几乎不变
电极制备电动势的测定

电极制备电动势的测定物理化学实验报告学号:姓名:班级:电极的制备和电动势的测定平均室温:20.3 ℃平均⽓压: 98.05Kpa同组⼈:⽇期:⼀、实验⽬的1. 学会铜电极、锌电极、⽢汞电极的制备和处理⽅法。
2. 掌握电势差计的测量原理和测定电池电动势的⽅法。
3. 加深对原电池、电极电势等概念的理解。
2、实验原理电池由正、负两个电极组成,电池在⼯作过程中,正极发⽣还原反应,负极发⽣氧化反应,电池反应是电池中所有反应的总和。
电池的电动势等于两个电极的电极电势的差值: E=E=以Cu-Zn电池为例:Zn|ZnSO4(a Zn 2+)||CuSO4(a Cu2+)|Cu电池的总的反应为: Zn+ Cu2+(a Cu2+)→Cu +Zn2+(a Zn2+)根据能斯特⽅程,Cu-Zn电池的电动势为:= 纯固体的活度为1,即a(Cu)=a(Zn)=1 所以 电池电动势不能⽤伏特计直接测量。
因为当伏特计与电池接通后,由于存在电流I,使电动势值发⽣变化;另⼀⽅⾯,由于电池本⾝存在内电阻,所以伏特计所量出的只是两极的电势降,⽽不是电池的电动势。
只有在没有电流通过时的电势降才是电池真正的电动势。
= I(R内+R外)伏特计测量:U=IR外U/ = R外 /(R内 + R外)当R外,I0,U/ 1,U电势差计的测量原理:当转换开关K合⾄1,调节r,使检流计G中⽆电流通过,此时标准电池EN和标准电池的补偿电阻RN两端的电势分别相等,此时有下列关系:EN = IRN(I为⼯作电流)当转换开关K合⾄2,调节滑线电阻A,再次使检流计G指⽰为零,此时在可调电阻R上的电阻值设为R K,则有:E X = IR K式中I仍为前⾯所调的⼯作电流值,因此有:E X = E N·R K/R N即当标准电池电动势E N和标准电池电动势的补偿电阻R N的数值确定时,只要正确读出R K的值,就能正确测出未知电动势E X。
三、仪器与试剂电位差计⼀台,电线若⼲,饱和⽢汞电极⼀只,铜⽚,锌⽚,烧杯三个,U型管。
电动势法测定硫酸铜的离子迁移数

大 学 化 学Univ. Chem. 2021, 36 (12), 2101007 (1 of 5)收稿:2021-01-05;录用:2021-01-26;网络发表:2021-02-22*通讯作者,Email:************.cn基金资助:山东大学教育教学改革项目(2020Y229)•化学实验• doi: 10.3866/PKU.DXHX202101007 电动势法测定硫酸铜的离子迁移数孟德坤,周南,林世泉,周爱秋,林猛*,张树永山东大学化学与化工学院,济南 250100摘要:离子迁移数作为物理化学的重要参数,其测定是大学物理化学实验中的基础内容。
以基础物理化学实验中离子迁移数的测定为基础,结合电动势的测定等实验,设计建立了一套电动势法测量溶液中铜离子与硫酸根离子迁移数的实验装置,得到的离子迁移数与文献值基本一致。
尝试基于大学生在物理化学实验中已掌握的实验技能,综合电化学学科领域的知识,设计探索电动势测量离子迁移数的新方法,有助于提升学生对知识的综合运用能力。
关键词:离子迁移数;电动势法;半透膜中图分类号:G64;O64Determination of Ion Transference Number by Electromotive Forces MethodDekun Meng, Nan Zhou, Shiquan Lin, Aiqiu Zhou, Meng Lin *, Shuyong ZhangSchool of Chemistry and Chemical Engineering, Shandong University, Jinan 250100, China.Abstract: Ion transference number is an important parameter of physical chemistry, and its measurement is the basic content in physical chemistry laboratory. Based on the measurement of ion transference number in “Basic Physical Chemistry Laboratory”, combined with measurements of the electromotive force, a new experiment was designed for measuring the transference number of copper ion and sulfate ion in solution, and the ion transference numbers obtained are basically consistent with the values in the literature. We attempt to use the laboratory skills that college students already mastered in physical chemistry laboratory and integrate the knowledge of electrochemistry to design and explore a new method for measuring ion transference by the electromotive force method. The students’ comprehensive ability can be improved to solve problems.Key Words: Ion transference number; Electromotive force method; Semi-permeable membrane1 引言“离子迁移数的测定”是经典的物理化学教学实验。
第六周化学实验报告电位法测定电池电动势及浓度对电极电位的影响

华南农业大学实验报告专业班次11农学班一组别201130010110 题目电位法测定电池电动势及浓度对电极电位的影响姓名梁志雄日期一、目的要求1、加深对原电池、电极电位的理解2、了解使用酸度计测定电池电动势和电极电位的方法,加深了解浓度的改变对电极电位的影响。
二、实验原理原电池由两个电极组成,在用盐桥消除液体的结界电位的情况下,电池电动势等于正负两电极电位之差,即E=φ+-φ-电池电动势可以用实验测量。
本实验采用酸度计测量电池的电动势,然后改变正极或负极的溶液浓度,是正极或负极的溶液浓度减少,以达到改变电池电动势的目的。
电池电动势的确定能斯特方程Cu2+ +Zn=Cu+Zn2+E=Eθ-(0.059/2)㏒10 [C (Zn2+)/C(Cu2+)]三、实验步骤1、制备电极2、组成原电池并测定电动势将锌电极溶液和铜电极溶液用盐桥连同起来。
然后用导线将铜电极连接到酸度计正极,将锌电极连接到酸度计负极上,组成原电池。
3、浓度对电极电位影响的测定在以上原电池的负极硫酸锌溶液中,加入浓氨水,先有白色沉淀生成,继续加入浓的氨水知道溶液无色,此时可观察到电池电动势增大,并记下读数。
在正极的硫酸铜溶液中,加入饱和的硫化钠溶液知道有大量黑色沉淀生成,此时可观察到电池电动势减少,并记下读数。
4、酸度计的使用●电源●温度“△▽”●定位:CAL●开始测量●电极插入待测液中记下PH读数●电极插入PH=4.0的缓冲溶液中,调节PH=4.0“△▽”●按下ENTER●电极插入PH =6.88的缓冲溶液中,调节PH=6.88●按下ENTER三、数据记录表一五、实验数据的分析1、由表一可以知道,铜锌电池的电动势值为1084mV,当在原电池的负极加入浓氨水,直到产生的白色沉淀完全消失,此时可以观察到电池的电动势是增大了的,因为发生了反应ZnSO4 + 4NH3 = [Zn(NH3)4]SO4实质上分两步进行,更准确写,因为可以反映溶液的碱性增强:1)Zn(2+) + 2NH3.H2O = Zn(OH)2 + 2NH4(+)2) Zn(OH)2 + NH3 = [Zn(NH3)4](2+) + 2OH(-),反应增加了溶液中离子浓度,使得溶液电动势增大;而在正极的硫酸铜溶液中家如硫化钠直至有大量黑色沉淀生成,可知电池电动势减少,因为Na2S + CuSO4 == Na2SO4 + CuS↓,反应使得溶液离子浓度降低,故电动势减少2、由表二的数据可以知道0.1mol/L HAC是弱酸,该浓度下的PH大于1 而0.1mol/LNaCl的PH就应该是7;而醋酸与氯化钠混合,发生同离子效应,PH小于7;而醋酸与氯化钠等体积等浓度混合,配成了缓冲溶液,故第四组数据与第三组数据很接近六、讨论酸度表可以测出电源内部酸浓度,其实化学电池就是电源内化学反应决定的,反应的速率决定了电动势的大小。
基于DIS实验进行原电池电极电势变化的实验探究及其拓展

基于DIS实验进行原电池电极电势变化的实验探究及其拓展欧勇; 黄彦媚【期刊名称】《《物理实验》》【年(卷),期】2019(039)012【总页数】4页(P56-59)【关键词】欧姆定律; DIS实验; 电极电势; 极化; 铜锌原电池【作者】欧勇; 黄彦媚【作者单位】华东师范大学教师教育学院上海200062【正文语种】中文【中图分类】G633.71 问题的提出在人教版高中物理选修3-1第2章第7节“闭合电路的欧姆定律”[1]的备课过程中,参考文献[2]关于原电池实验的改进方案:用铜板和锌板作为两极,可乐作为电解液,外接最大阻值为99 999 Ω的电阻箱,用2只电压传感器分别测量外电压UAB和内电压UCD,电路图如图1所示,分别测量并记录断路状态、外电阻从20 000 Ω减小至0 Ω过程中的内、外电压,在处理数据时发现当外电阻减小至5 000 Ω后,内、外电压之和明显小于开路电压(即电源电动势),如表1所示. 更换电解液为0.005 mol/L的硫酸,仍出现类似结果,如表2所示. 笔者针对外电阻减小使得内、外电压之和小于电源电动势的问题进行了深入研究.图1 DIS实验电路原理图表1 内、外电压随外电阻的变化(电解液为可乐)R/ΩU外/VU内/V(U外+U内)/V∞1.04-0.011.0320 0001.01-0.011.0010 0000.980.010.9950000.930.040.9710000.650.190.845000.480.300.781000.150.560.71500.090.580.67100.030.53 0.5600.010.520.53表2 内、外电压随外电阻的变化(电解液为0.005 mol/L硫酸)R/ΩU外/VU内/V(U外+U内)/V∞1.03-0.011.0220 0001.02-0.011.0110 0001.010.011.025 0000.980.041.0210000.810.191.005000.660.300.961000.250.560.81500.140.580.72100.040.53 0.5700.020.520.542 实验装置及过程实验仪器:铜锌原电池(电解液为可乐)、最大阻值为99 999 Ω的电阻箱、3只电压传感器、数据采集器、2根铜探针、1个开关、计算机、导线若干.实验过程:根据图2所示的电路图,将铜锌原电池与电阻箱相连,以锌板作为零电势点,利用3只电压传感器分别测量并记录在减小电阻箱阻值的过程中,铜板、铜板附近的铜探针、锌板附近的铜探针这几处相对于锌板的电势差变化.图2 DIS实验电路图3 实验结果及讨论如图3所示,以B点为零电势点,将A,D,C 3点电势随外电阻变化的图像以折线图形式画出,图中UCD即为内电压,UAB即为外电压. 从图3中可以发现:图3 电势变化图(电解液为可乐)1)断路状态时,UAD和UDC几乎为0;2)电路接通,随外电阻减小,AD两点的电势都逐渐降低,并且A点的电势低于D点的电势;3)UCB在误差范围内几乎不变.根据上述实验结果,笔者认为出现“外电阻较小时,内、外电压之和小于电源电动势”这一现象的原因与AD两点的电势差变化有关:a.当外电路断路时,AD两点的电势差几乎为0,则UCD(内电压)+UAB(外电压)=E(电动势);b.当外电阻较小时,AD两点的电势差为负值,则UCD(内电压)+UAB(外电压)<E(电动势).3.1 当外电路断路时,AD两点的电势差几乎为0根据教材上的图(图4),铜板电势应该比溶液电势高,实验结果与之不符. 文献[3]指出,铜探针与电解液之间也存在电势差,即铜探针的电势φ探并非是溶液本身的电势φ液,即φ探≠φ液,而是φ探=φ液+U探-液. 所以电压传感器所测的UAD并非铜板与溶液的电势差,而是铜板(A)—溶液(D)—溶液(D′)—铜探针(A′)的电势差UAA′,如图5所示. 故在断路状态(或外电阻较大)时,所测的“UAD”(实际是UAA′)几乎为0.图4 闭合电路的电势图5 铜板与铜探针电势差示意图3.2 当外电阻较小时,AD两点的电势差为负值通过查阅相关文献[4],提出了2个猜想.1)由于铜板与铜探针之间存在电阻,有电流流过时,铜板与铜探针之间产生电势差. 由前所述,利用铜探针测量出的电势差并不是铜板与铜板附近溶液中的电势差UAD,而是铜板与铜探针之间的电势差UAA′. 当回路中有电流时,由于铜探针与铜板之间的溶液有电阻,故两者之间会有电势降落.上述猜想似乎能很好地解释实验结果,但是继续深入分析,会发现这种猜想是不正确的. 在电路接通时,假设是由于铜板与铜探针之间的电阻有电流流过而产生电势差,那么外电阻减小,电流增大,根据欧姆定律铜板与铜探针的电势差UAA′(即φA-φA′)减小,同理可得锌板附近的铜探针与锌板之间的电势差UCB(即φC-φB)也应减小,但实验结果却显示UCB几乎不变,说明上述猜想其实是错误的.2)铜电极发生了极化现象.极化可分为2种:a.由于铜板上有氢气产生,细小的气泡附着在铜板上,从而阻碍了溶液中的氢离子吸附到铜板上. 当外电阻较大时,系统反应速率较慢,产生的细小气泡较少,氢离子吸附到铜板上的过程中受到的阻碍作用较小,因此极化电压几乎为0;当外电阻逐渐减小时,反应速率加快,产生的细小气泡增多,氢离子吸附到铜板上的过程中受到的阻碍作用增加,不能即时与铜板上的电子反应,因此电子聚集导致铜板的电势降低,产生极化电压,且极化电压随外电阻的减小而增大.b.由于电解液中氢离子的浓度较低. 当外电阻较大时,铜板附近的氢离子的消耗速率较慢,周围溶液中的氢离子能及时扩散至被消耗区域,与铜板上的电子持续发生反应,极化电压几乎为0;当外电阻逐渐减小时,铜板附近的氢离子的消耗速率加快,而如果周围溶液中的氢离子浓度较低,来不及扩散至被消耗区域,使得铜板上的电子不能即时参与反应,因此电子聚集,电势降低,产生极化电压,且极化电压随外电阻的减小而增大.4 拓展实验4.1 拓展实验1仍以如图2所示的装置进行实验,此时将电解液更换为0.1 mol/L硫酸,目的是增大溶液中的氢离子浓度,以探究是否由于电解液中氢离子的浓度较低而导致铜电极发生了极化现象. 实验结果如图6所示.图6 电势变化图(电解液为0.1 mol/L硫酸)由图6可见,当外电阻减小至1 000 Ω后,A点的电势仍然要明显低于D点的电势,即铜电极仍然发生了极化现象. 据此可以认为铜电极发生极化现象与电解液中氢离子的浓度无关.4.2 拓展实验2将铜板灼烧,使其表面覆盖致密的氧化铜薄膜,再将其与锌板插入电解液(0.005 mol/L硫酸)中,连接好电路,进行实验. 实验结果如图7所示.图7 电势变化图(电解液为0.005 mol/L硫酸)由图7可见,外电阻减小,AD两点的电势差几乎为0,也就是说,铜电极上的极化现象被消除了. 究其原因,此时铜电极上发生的反应是:CuO+2H+Cu+H2O,无气体生成物,故而无气泡附着在铜板上,无极化电压产生. 这证明了铜电极发生极化现象是因为气泡阻碍了氢离子附着在铜板上.5 结束语本文针对“外电阻减小会使得内、外电压之和小于电源电动势”问题进行了深入的理论分析和实验探究. 为了确定“少的那一部分电压去哪了”,尝试测量了整个回路电势变化情况,结果发现电路中A和D 2点电势差与教材理论描述不符,教材中φA>φD,但实验数据显示:1)当外电路断路时,φA≈φD ;2)当外电阻较小时,φA<φD . 查阅相关文献后,经理论分析提出猜想,并通过2组拓展实验证明产生上述实验现象的原因是铜电极发生了极化现象,即电路接通后,铜板上有氢气产生,细小的气泡附着在铜板上,阻碍了溶液中的氢离子吸附至铜板. 将铜板灼烧,使其表面覆盖一层致密的氧化铜薄膜,可消除铜板上的极化现象.【相关文献】[1] 人民教育出版社,课程教材研究所,物理课程教材研究开发中心. 普通高中课程标准实验教科书·物理(选修3-1)[M]. 北京:人民教育出版社,2010.[2] 李富恩,王晓梅,何彦雨. 基于DIS实验的闭合电路欧姆定律实验探究及其拓展[J]. 物理通报,2018(10):77-79.[3] 马松艳,赵东江. 关于电极电势几个问题的讨论[J]. 绥化师专学报,2003(1):117-118.[4] 李荻. 电化学原理[M]. 3版. 北京: 北京航空航天大学出版社,2008:135-136.[5] 宿丽叔,赵士鹏,拾景忠. 板式电势差计测量电动势及内阻实验的改进[J]. 物理实验,2013,33(9):45-47.。
原电池电动势和电极电势的测定
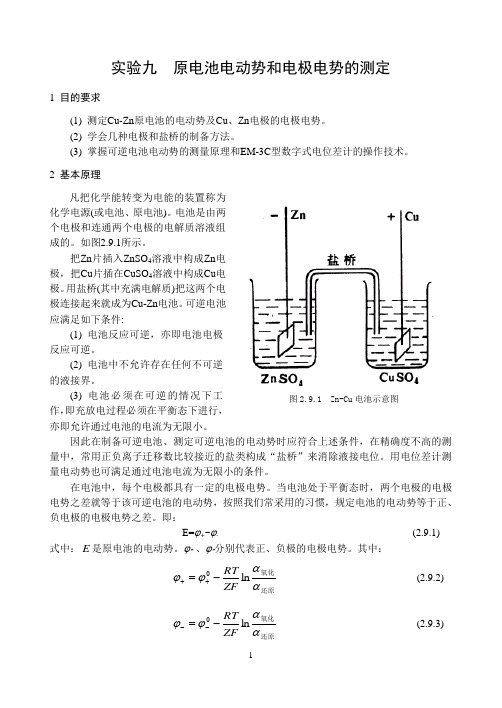
实验九 原电池电动势和电极电势的测定1 目的要求(1) 测定Cu-Zn 原电池的电动势及Cu 、Zn 电极的电极电势。
(2) 学会几种电极和盐桥的制备方法。
(3) 掌握可逆电池电动势的测量原理和EM-3C 型数字式电位差计的操作技术。
2 基本原理凡把化学能转变为电能的装置称为化学电源(或电池、原电池)。
电池是由两个电极和连通两个电极的电解质溶液组成的。
如图2.9.1所示。
把Zn 片插入ZnSO 4溶液中构成Zn 电极,把Cu 片插在CuSO 4溶液中构成Cu 电极。
用盐桥(其中充满电解质)把这两个电极连接起来就成为Cu-Zn 电池。
可逆电池应满足如下条件:(1) 电池反应可逆,亦即电池电极反应可逆。
(2) 电池中不允许存在任何不可逆的液接界。
(3) 电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
用电位差计测量电动势也可满足通过电池电流为无限小的条件。
在电池中,每个电极都具有一定的电极电势。
当电池处于平衡态时,两个电极的电极电势之差就等于该可逆电池的电动势,按照我们常采用的习惯,规定电池的电动势等于正、负电极的电极电势之差。
即:E=ϕ+-ϕ- (2.9.1) 式中:E 是原电池的电动势。
ϕ+ 、ϕ-分别代表正、负极的电极电势。
其中:还原氧化ααϕϕln0ZF RT -=++ (2.9.2) 还原氧化ααϕϕlnZF RT -=--(2.9.3)在式(2.9.2)、(2.9.3)中:ϕ+、ϕ-分别代表正、负电极的标准电极电势。
R=8.134J.mol -1.K -1。
T 是绝对温度。
Z 是反应中得失电子的数量。
F=96500C ,称法拉第常数。
α氧化为参与电极反应的物质的还原态的活度。
对于Cu-Zn 电池,其电池表示式为:Zn|ZnSO 4(m 1)||CnSO 4(m 2)|Cu其电极反应为:⎩⎨⎧+→→+++++e Zn Zn Cu e Zn Cu 2)(2)(Cu 2222αα负极反应:正极反应:其电池反应为:)()(2222+++++→+Zn Cu Zn Cu Cu Zn αα其电动势为: Zn Zn Cu Cu E ,,22++-=ϕϕ (2.9.4)+++-=2221ln20,,Cu CuCu CuCu F RT αϕϕ (2.9.5) +++-=2221ln20,,Zn ZnZn ZnZnF RT αϕϕ (2.9.6) 在式2.9.5和2.9.6中,Cu 2+, Zn 2+的活度可由其浓度m i 和相应电解质溶液的平均活度系数γ±计算出来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不同浓度硫酸铜溶液电极电势的测定摘要:电极电势测定的大小与电极种类、溶液浓度、温度有关。
本实验采用对消法测定不同浓度硫酸铜的Cu电极-饱和甘汞电极组成的电池的电动势,根据能斯特方程计算当时实验条件下铜电极电势,再与理论值进行比较。
关键词:电极电势,对消法,硫酸铜溶液前言:电动势的测量方法,在物理化学研究工作中具有重要的实际意义,通过电池电动势的测量可以获得还原体系的许多热力学数据。
如平衡常数,电解质活度及活度系数,离解常数,溶解度,络合常数,酸碱度以及某些热力学函数改变量等。
但在电化学中,电极电势的绝对值至今无法测定,在实际测量中是以某一电极电势作为零标准,然后将其它的电极(被研究电极)与它组成电池,测量其间的电动势,则该电动势即为该被测电极的电极电势。
由于使用标准氢电极不方便,在实际测定时往往采用第二级的标准电极,甘汞电极(SCE)是其中最常用的一种。
测量电池电动势只能在无电流通过电池的情况下进行,因此需用对消法来测定电动势。
对消法测定电动势就是在所研究的电池的外电路上加一个方向相反的电压。
当两者相等时,电路的电流为零,此时测得的电势降为电池真正的电动势。
1.实验部分1.1试剂与仪器UJ-25型电位差计 1台;检流计 1台;低压直流电源 1台;标准电池 1只;干电池(1.5V) 2节;铜电极 1支;甘汞电极 1支电极管 1只;电极架 1只;电线若干;烧杯(100mL) 6个;容量瓶(50.00mL) 5个硫酸铜溶液(0.50mol·L-1) 氯化钾(分析纯)1.2实验步骤1.2.1配制不同浓度的CuSO4溶液将0.50mol/L的CuSO4溶液分别配制成0.40mol/L、0.30mol/L、0.20mol/L、0.10mol/L共计五个不同浓度的溶液作为铜电极的电极溶液1.2.1制备饱和氯化钾溶液称量约37g的氯化钾固体于100mL蒸馏水中,加热搅拌至完全溶解,冷却至室温,溶液有晶体析出制得饱和氯化钾溶液。
1.2.3待测电极的组装将饱和KCl溶液注入50mL的小烧杯中作为盐桥,将铜电极和饱和甘汞电极置于小烧杯内,即成Cu-甘汞电池,Hg|Hg2Cl2|KCl(饱和) ‖CuSO4 (xmol·L-1) |Cu1.2.4电池电动势的测定1.2.4.1按照电位差计电路图,接好电动势测量路线;1.2.4.2根据标准电池的温度系数,计算实验温度下的标准电动势。
以此对电位差计进行标定;(1)标准电池电动势的温度校正由于标准电池电动势是温度的函数,所以调节前须首先计算出标准电池电动势的准确值。
常用的镉-汞标准电池电动势的温度校正公式为:℃-20)+0.929(t/℃-20)2-0.0090(t/℃-20)3+0.00006(t/℃-20)4]×10-6式中Et为温度为t时标准电池的电动势;t为测量时室内温度;E20为20℃时标准电池的电动势(E20=1.018 45V)。
调节“标准电池温度补偿旋钮”,使其数值与标准电池电动势值一致。
其中的两旋钮数值分别对应着Et数值的最后两位。
(2)电位差计的标定将“换向开关”扳向“N”(校正),然后断续地按下“粗”、“细”按钮,视检流计光点的偏转情况,依“粗、中、细、微”的顺序旋转“工作电流调节旋钮”,通过可变电阻的调节,使检流计光点指示零位,至此电位差计标定完毕。
此步骤即是调节电位差计的工作电流。
(3)未知电动势的测量将“换向开关”扳向“X1”或“X2”(测量),与上述操作相似,断续地按下“粗”、“细”按钮,根据检流计光点的偏转方向,旋转各“测量旋钮”(顺序依次由I~VI)至检流计光点指示零位。
此时,六个测量档所示电压值总和即为被测量电动势Ex。
1.2.4.3分别测定以上五个电池的电动势2.结果与讨论2.1原始数据记录2.1.1室温:25.0℃2.1.2根据温度校正公式,E t=E20-[39.94(t-20)+0.929(t-20)2-0.0090(t-20)3+0.00006(t-20)4]×10-6计算求得标准电池电动势的准确数值为E25=1.01823V2.1.3表1 不同浓度硫酸铜溶液的电极电势C(CuSO 4)/mol ·L -1原电池电动势/V平均电动势/V1230.10 0.034500 0.034400 0.034500 0.034467 0.20 0.038400 0.038400 0.038400 0.038400 0.30 0.042300 0.042400 0.042300 0.042333 0.40 0.045300 0.045300 0.045300 0.045300 0.500.047300 0.047300 0.0473000.047300 2.2数据处理2.2.1根据饱和甘汞电极的电极电势温度校正公式SCE /V=0.2438-6.5×10-4(T/℃-25)实验温度25.0℃时,计算得饱和甘汞电极的电极电势:0.2438V 2.2.2 表2 不同硫酸铜溶液测得的原电池电动势 m (CuSO 4)/mol ·kg -1I/mol·kg -1γ±α±/×10-3αCu2+ φ测/V φ理论/V 相对误差/% 0.1 0.4 0.05156 5.156 0.07181 0.2783 0.3032 8.2 0.2 0.8 0.01509 3.018 0.05494 0.2822 0.2998 5.9 0.3 1.2 0.005884 1.765 0.4201 0.2861 0.2963 3.4 0.4 1.6 0.002659 1.064 0.03261 0.2891 0.29301.30.52.0 0.001320 0.6600 0.02569 0.2911 0.2900 0.38理论值:φθCu2+/Cu =0.337 V 相关计算公式:m(CuSO 4)=n(CuSO 4)/m(H 2O)I=0.5×[m(Cu 2+×4)+m(SO 42-)×4] lg γ±=-0.509|2×(-2)|I 1/2 α±=γ±m (CuSO 4) αCu2+=(α±)1/2φ理论=E+φSCEφ测=φθCu2+/Cu - 2.3讨论2.3.1由实验数据得,测得的原电池电动势随着硫酸铜溶液浓度的增加而增加,这是由于电动势与溶液的浓度增大而变大; 2.3.2.引起误差的可能因素为:a.在每次测量操作的前、后都不是每一次都进行电位差计的标定操作,按照标定—测量—标定的步骤进行。
在标定与测量的操作中,可能遇到电流过大、检流计受到“冲击”的现象。
b.由于检流计光标较难调节,每组测量时间较长,工作回路中电流会发生变化,从而影响测量结果;c.室验室温度的变化对实验结果有影响;d.实验仪器本身的误差;实验仪器有晃动,影响实验结果。
3.结论实验用对消法测定Cu-饱和甘汞电极组成的电池的电动势,求得0.10、0.20、0.30、0.40、0.50mol ·L -1CuSO 4溶液下铜电极的电极电势分别为0.2783V 、0.2822V 、0.2861V 、0.2891V 、0.2911V ,相对误差分别为8.2%、5.9%、3.4%、1.3%、0.38%,相对误差较少,实验较成功。
4.参考文献【1】钟红梅,侯德顺.电动势的测定及应用实验设计的改进[J].辽宁化Cu21ln2αFRT工,2008,(10);【2】阚锦晴,薛树忠,耿文英.原电池电动势测定方法的改进[J]. 大学化学, 1994,(01);【3】《物理化学实验》,东北师范大学等校编,高等教育出版社;【4】《物理化学实验讲义》,肇庆学院化学化工学院物理化学教研组编;【5】陈佩琦,张幸义. 原电池的电动势与电解质的分解电压[J].化学教学,1983,(03).Determination of electrode potential of different concentrations of copper sulfateMa XiaoweiZhaoqing University,College of chemistry and chemical engineering09 Chemistry, Instructor: Hao XiangyingAbstract : The value of the electrode potential is related to the kinds of the electrode、the concentration of the solution and the temperature .In this study ,we determine the electrode potential of primary cell consists of the Cu electrodes–satur ated calomel electrodes with different concentration of Copper sulfate by compensation method .Calculate the copper electrod e potential under the experimental conditions by the Nernst E quation,and the compare with the theoretical v-alue.Key words: electrode potential, copper sulfate solution, compensation method。
