中国化学会2003年全国高中学生化学竞赛(省级赛区)试题
全国高中学生化学竞赛(省级赛区-初赛)试题及答案

中国化学会第26届全国高中学生化学竞赛(省级赛区)试卷(2012年9月2日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
允许使用非编程计算器以及直尺等文具第1题(7分)1-1 向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。
简述实验现象并写出两步主要反应的离子方程式。
无色溶液产生白色沉淀,后逐渐溶解(1分,如只写白色沉淀溶解不扣分,未表明白色,扣0.5分)(1)Zn2++2NH3+2H2O=Zn(OH)2↓+2NH4+(1分)写成如下形式均给分:Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+[Zn(H2O)6]2++2NH3·H2O=Zn(OH)2↓+2NH4+ +6H2O[Zn(H2O)6]2++2NH3=Zn(OH)2↓+2NH4+ +2H2O(2)Zn(OH)2 + 2NH4+ +2NH3 = [Zn(NH3)4]2+ +2H2O如写成Zn(OH)2 +4NH3 = [Zn(NH3)4]2+ +2OH—也对,如产物写成[Zn(NH3)6]2+扣0.5分,因主要产物是[Zn(NH3)4]2+1-2 化合物[Cu(Pydc)(amp)] ·3H2O]的组成为C11H14CuN4O7,热重分析曲线表明,该化合物受热分解发生两步失重,第一个失重峰在200~250℃,失重的质量分数为15.2%。
第二个失重峰在400~500℃,失重后的固态残渣质量为原化合物质量的20.0%。
Pydc和amp是含有芳环的有机配体。
通过计算回答:(1)第一步失重失去的组分。
2003年全国高中学生化学竞赛决赛(冬令营)理论试题

2003年全国高中学生化学竞赛决赛(冬令营)理论试题湖北省化学化工学会命题组HHe相对原子质量1.0084.003LiBeBCNOFNe6.9419.01210.8112.0114.0116.0019.0020.18NaM gAlSiPSClAr22.9924.3126.9828.0930.9732.0735.4539.95φ--标准压力p=1bar(巴)=100000Pa(帕斯卡)R=8.314J·K1·mol1第i题(8分)1990年代初发现了碳纳米管,它们是管径仅几纳米的微管,其结构相当于石墨结构层卷曲连接而成。
近年,人们合成了化合物E的纳米管,其结构与碳纳米管十分相似。
气体A与气体B相遇立即生成一种白色的晶体C。
已知在同温同压下,气体A的密度约为气体B的密度的4倍;气体B易溶于水,向其浓水溶液通入CO2可生成白色晶体D;晶体D的热稳定性不高,在室温下缓慢分解,放出CO2、水蒸气和B;晶体C在高温下分解生成具有润滑性的白色晶体E1;E1在高温高压下可转变为一种硬度很高的晶体E2。
E1和E2是化合物E的两种不同结晶形态,分别与碳的两种常见同素异形体的晶体结构相似,都是新型固体材料;E可与单质氟反应,主要产物之一是A。
(1)写出A、B、C、D、E的化学式。
(2)写出A与B反应的化学反应方程式,按酸碱理论的观点,这是一种什么类型的反应?A、B、C各属于哪一类物质?(3)分别说明E1和E2的晶体结构特征、化学键特征和它们的可能用途。
(4)化合物A与C6H5NH2在苯中回流,可生成它们的1︰1加合物;将这种加合物加热到280℃,生成一种环状化合物(其中每摩尔加合物失去2摩尔HF);这种环状化合物是一种非极性物质。
写出它的分子式和结构式。
第ii题(8分)太阳能发电和阳光分解水制氮,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面。
下图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带(未充填电子的分子轨道构成的能级最低的能带)与价带(已充填价电子的分子轨道构成的能级最高的能带)之间的能量差ΔE(=Ec-Ev)称为-+带隙,图中的e为电子、h为空穴。
全国高中学生化学竞赛(省级赛区)试题与答案

全国高中学生化学竞赛初赛试题考试时间:3小时第1题(1分)(1)金属锰可以用四氧化三锰为原料通过铝热法来制备。
试写出配平的化学方程式。
(2)CS2是一种有恶臭的液体,把它滴入硫酸酸化的高锰酸钾水溶液,将析出硫磺,同时放出CO2,写出配平的化学式方程式。
第2题(10分)(1)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;这个用酶为催化剂的反应的另一个反应物是CO2,它在反应后转变成有机物,可用甲醛来表示,试写出配平的离子方程式。
(2)地球化学家用实验证实,金矿常与磁铁矿共生的原因是:在高温高压的水溶液(即所谓“热液”)里,金的存在形式是[AuS-]络离子,在溶液接近中性时,它遇到Fe2+离子会发生反应,同时沉积出磁铁矿和金矿,试写出配平的化学方程式。
第3题(10分)矿物胆矾就是CuSO4·5H2O,当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积下来;而反应得到的铁和硫则进入水溶液,该溶液无臭味,透明不浑浊,绿色,呈强酸性,在有的矿区常可见到这种具有强腐蚀性的地下水(俗称黑水)渗出地面,上述反应可以用一个化学方程式来表示,试写出配乎的化学方程式。
第4题(10分)制备硫代硫酸钠的方法之一是把二氧化硫通人硫化钠和碳酸钠(摩尔比2︰1)的混合溶液。
在反应过程中,先生成黄色的固体,其量先逐渐增多,然后又逐渐减少,溶液的pH 值降到7左右时,溶液近于无色,反应已经完成。
如果继续通入二氧化硫,溶液的pH值降到5,又会有固体物质出现。
写出和以上现象有关的各个配干的化学方程式。
第5题(10分)取2.5克KClO3粉末置于冰水冷却的锥形瓶中,加入5.0克研细的I2,再注入3cm3水,在45分钟内不断振荡,分批加入9~10cm3浓HCl,直到I2完全消失为止(整个反应过程保持在40℃以下)。
2023年全国高中学生化学竞赛省级赛区试题

中国化学会2023年国初化竞试题(2023年10月13日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
第1题(4分)今年5月底6月初,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。
据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。
根据你的化学知识作出如下判断(这一判断的对的性有待证明):当事人使用的液态洁污剂之一必然含氯,最也许的存在形式是和。
当另一种具有(性质)的液态洁污剂与之混合,也许发生如下反映而产生氯气:第2题(2分)目然界中,碳除了有2种稳定同位素12C和13C外,尚有一种半衰期很长的放射性同位素14C,丰度也十分稳定,如下表所示(注:数据后括号里的数字是最后一位或两位的精确度,14C只提供了大气丰度,地壳中的含量小于表中数据):试问:为什么通常碳的相对原子质量只是其稳定同位素的加权平均值而不将14C也加入取平均值?答:第3题(4分)最近报道在-100℃的低温下合成了化合物X,元素分析得出其分子式为C5H4,红外光谱和核磁共振表白其分子中的氢原子的化学环境没有区别,而碳的化学环境却有2种,并且,分子中既有C-C单键,又有C=C双键。
温度升高将迅速分解。
X的结构式是:第4题(10分)去年报道,在-55℃令XeF4(A)和C6F5BF2(B)化合,得一离子化合物(C),测得Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中有B的苯环。
C是首例有机氙(IV)化合物,-20℃以下稳定。
C为强氟化剂和强氧化剂,如与碘反映得到五氟化碘,放出氙,同时得到B。
【化学奥赛】晶体结构习题new!
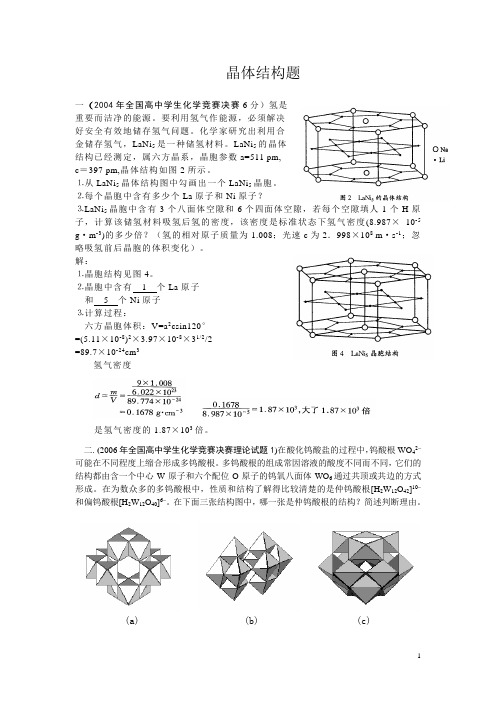
晶体结构题一(2004年全国高中学生化学竞赛决赛6分)氢是重要而洁净的能源。
要利用氢气作能源,必须解决好安全有效地储存氢气问题。
化学家研究出利用合金储存氢气,LaNi5是一种储氢材料。
LaNi5的晶体结构已经测定,属六方晶系,晶胞参数a=511 pm,c=397 pm,晶体结构如图2所示。
⒈从LaNi5晶体结构图中勾画出一个LaNi5晶胞。
⒉每个晶胞中含有多少个La原子和Ni原子?⒊LaNi5晶胞中含有3个八面体空隙和6个四面体空隙,若每个空隙填人1个H原子,计算该储氢材料吸氢后氢的密度,该密度是标准状态下氢气密度(8.987×10-5 g·m-3)的多少倍?(氢的相对原子质量为1.008;光速c为2.998×108 m·s-1;忽略吸氢前后晶胞的体积变化)。
解:⒈晶胞结构见图4。
⒉晶胞中含有1个La原子和5个Ni原子⒊计算过程:六方晶胞体积:V=a2csin120°=(5.11×10-8)2×3.97×10-8×31/2/2=89.7×10-24cm3氢气密度是氢气密度的1.87×103倍。
二. (2006年全国高中学生化学竞赛决赛理论试题1)在酸化钨酸盐的过程中,钨酸根WO42-可能在不同程度上缩合形成多钨酸根。
多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含一个中心W原子和六个配位O原子的钨氧八面体WO6通过共顶或共边的方式形成。
在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2W12O40]6-。
在下面三张结构图中,哪一张是仲钨酸根的结构?简述判断理由。
(a) (b) (c)解:提示:考察八面体的投影图,可以得到更清楚地认识。
三.(2006年全国高中学生化学竞赛决赛理论试题4)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,它的生产以白云石(主要成分是碳酸镁钙)为原料。
2003年化学竞赛山东试题

2003年化学竞赛山东试题相对原子质量:H~1 C.一1 2 N~14 o~16 Mg~24 S--32 Cl~35.5 Fe~56 Cu~65 Zn-65一、选择题(本题包括6小题,每小题1分,共6分。
每小题只有1个选项符合题意) 1.天文工作者已在宇宙中发现了H3分子。
下列关于H3分子的说法正确的是( ) A.H3不能还原氧化铜B.每个H3分子中含有一个H2分子和一个H原子C.H2和H3化学性质完全相同D.H2和H3是不同的物质2.用足量的氢气在加热条件下还原氧化铜,当完全反应后测得生成铜的质量为64g,则消耗氢气的质量( )A.大于2g B.等于2g C.小于2g D.无法确定3.美国一化学公司用纯二氧化碳为起泡剂生产泡沫塑料,代替以往使用的氟氯烃,能防止臭氧层被破坏。
以下方法能制取纯净二氧化碳的是(气体都须经过干燥) ( )A.木炭与氧气反应B.大理石与稀盐酸反应C.碳酸钠与稀盐酸反应D.碳酸钠与稀硫酸反应4.某课外兴趣活动小组的同学,通过实验测定浓硫酸吸水性的有关数据,绘制成如右图的函数图像,其中横坐标表示时间,纵坐标可以表示:①溶质的质量分数②溶液的质量③溶液的体积④溶液中所含水的质量。
其中正确的是( )A.①②B.①②③C.②③④D.①②③④5.落叶中含有大量的无机盐,其中在落叶前后含量最稳定的是( )A.钾盐B.硝酸盐C.钠盐D.钙盐6.在白炽灯泡里可以找到的气体是( )A.氧气和氢气B.水蒸气C.氮气和氩气D.空气二、选择题(本题包括12小题,每小题2分,共24分。
每小题有1个或2个选项符合题意) 7.植物种子里的蛋白质中含有碳、氢、氧、氮、硫、氯等元素。
下列说法错误的是( ) A.光合作用直接合成蛋白质B.氮、硫、氯元素是植物直接吸收空气中的毒气转化而来的C.氮元素是通过施肥或植物固氮而获得的D.硫、氯元素是通过植物的根吸收无机盐转化得到的8.配制一定质量分数的NaOH溶液,会引起溶液中NaOH质量分数偏小的实验操作是( )A.称量完固体NaOH时,天平指针略向左倾斜B.实验所用的固体NaOH 在空气中久置C.用量筒量取水时仰视读数D.移取已配好的溶液时,有少量溶液洒在瓶外9.人类发明阿斯匹林已经有一百多年了,它不仅未被淘汰而且近几年又增添了许多新用途,如防治脑血栓、脑溢血等心血管病。
2003年全国高中学生化学竞赛决赛理论试题参考答案
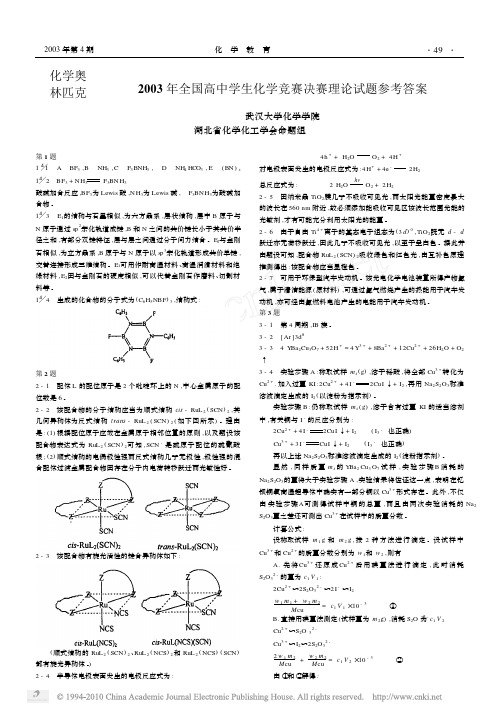
4h + + H2O
hv
O2 + 4 H + 2 H2
对电极表面发生的电极反应式为 :4 H + + 4e 总反应式为 :
2 H2O O 2 + 2 H2
酸碱加合反应 ,BF3为 Lewis 酸 ,N H3为 Lewis 碱 , F3BN H3为酸碱加 合物 。
1% 3 E1的结构与石墨相似 ,为六方晶系 , 层状结构 , 层中 B 原子与 N 原子通过 sp 2杂化轨道成键 ,B 和 N 之间的共价键长小于其共价半
2003 年第 4 期 化 学 教 育
・4 9 ・
化学奥 林匹克
2003 年全国高中学生化学竞赛决赛理论试题参考答案
武汉大学化学学院 湖北省化学化工学会命题组
第1题
1% 1 A BF3 ,B NH3 , C F3 BNH3 , D NH4 HCO3 , E ( BN ) x 1% 2 BF3 + N H3 F3BN H3
θ θ (353. 15 K) = exp [ - Δr ቤተ መጻሕፍቲ ባይዱ m K p / RT]
( NH4 ) 2 SO3 ( s ) (NH4 ) 2 SO4 (s)
θ
(1) (2)
SO2(g) + 2NH3 (g) + H2 O (g) + 1/ 2O2 (g)
4- 2 298. 15 K 下 ,反应的Δr H m 和Δr S m 可由题给数据求出 :
Σvi [Δf H m , θ 反应 (1) :Δr H mθ =Σvi [Δf H m , θ i ] 产物 — i ] 反应物 = - 885. 33 kJ ・ mol - 1 - [ - 296. 83 kJ ・ mol - 1 - 241. - 1 - 1 82 kJ ・ mol - 2 × 45. 90 kJ ・ mol ] = - 254. 88 kJ ・ mol - 1 θ θ θ Δr S m =Σvi [ S m , i ] 产物 — Σvi [ S m , i ] 反应物 = 240. 64 J ・ K- 1・ mol - 1 - [ 248. 11 J ・ K - 1・ mol - 1 + - 1 - 1 - 1 - 1 188. 72 J ・ K ・ mol + 2 × 192. 77 J ・ K ・ mol ] = - 581. 73 J ・ K - 1・ mol - 1 Σvi [Δf H m , θ 反应 (2) :Δr H mθ =Σvi [Δf H m , θ i ] 产物 — i ] 反应物 = - 1180. 85 kJ ・ mol - 1 - [ - 296. 83 kJ ・ mol - 1 - 241.
中国化学会2002年全国高中学生化学竞赛(省级赛区)试题与参考答案

● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
1.008Zr Nb M o TcRu Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLiBeB C N O F Na M g Al Si P Cl S K Ca Sc Ti V Cr M n Fe Co Ni Cu Zn Ga Ge As Se BrRb Cs Fr Sr Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.45 4.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量RfDbSgBhHsMt第1题(5分)阅读如下信息后回答问题:元素M ,其地壳丰度居第12位,是第3种蕴藏最丰富的过渡元素,是海底多金属结核的主要成分,是黑色金属,主要用途: 炼钢,也大量用来制作干电池,还是动植物必需的微量元素。
2003年全国高中化学奥林匹克竞赛山东省预赛试题

2003年全国高中化学奥林匹克竞赛山东省预赛试题(满分100分时间120分钟)可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Cl:35.5N a:23 Mg:24 Ca:40 Fe:56 Cu:64 Ag:108一、选择题(本题包括20小题,每小题有1~2个选项符合题意。
每小题2分,共40分)1.加酶洗衣粉可洗去衣物上的汗渍、油渍和血迹,因而深受人们的喜爱。
下列衣料中不能用加酶洗衣粉洗涤的是:①人造丝织物②蚕丝织物③涤纶织物④羊绒织物⑤维纶织物⑥棉麻织物(A) ①③⑤(B) ②③⑤(C) ②④(D) ②④⑥2.下列做法中不正确的是(A) 水银温度计不慎摔破后,在可能散落水银的地方用硫粉覆盖(B) 苯酚溶液不慎沾到皮肤上,立即用酒精洗涤(C) 被蚊虫叮咬后,可在叮咬处涂抹稀氢氧化钠溶液中和蚁酸,消除红肿(D) 燃着的酒精灯歪倒,撒出酒精并着火,应迅速用湿抹布扑盖3.大脑营养学研究表明,大脑的生长发育与不饱和脂肪酸密切相关。
从深海鱼油中提取出的DHA 是一种不饱和程度很高的脂肪酸,被称为“脑黄金”,它的分子中含有6个碳碳双键,学名为二十六碳六烯酸,它的分子组成为(A) C25H41COOH (B) C25H39COOH(C) C26H31COOH (D) C26H47COOH4.下列实验操作中,仪器末端需插入液面下的有①制备氢氧化亚铁时将氢氧化钠溶液注入硫酸亚铁溶液中所用的滴管②制取氢气的简易装置中的长颈漏斗③实验室里进行石油蒸馏的装置中的温度计④将洗气装置用于排水量取气体的体积时,较长的一根导管⑤用乙醇制取乙烯时所用的温度计(A) ②③④⑤(B) ①②③⑤(C) ①②③④⑤(D) ①②④⑤5.某溶液中含有大量的Ag+、NH4+、Al3+、Fe2+四种金属离子。
往该溶液中加入过量氢氧化钠溶液,充分搅拌后,再加入过量稀硝酸,此时溶液中一定能大量存在的金属离子是(A) Na+、Al3+、Fe3+、Ag+(B) Na+、Al3+、Fe2+(C) Na+、Al3+、Fe3+(D) Na+、Fe3+、Ag+6.测得HClO4·H2O的结构为H3O+ClO4-,下列最能证明该结构正确的叙述是(A) 是酸性最强的无机酸(B) 有强氧化性(C) 遇热易分解(D) 有4个相同的键7.贫铀炸弹是一种杀伤力很强的武器。
2003年全国高中学生化学竞赛(江苏赛区)预赛试题

“扬子石化杯”2003年全国高中学生化学竞赛(江苏省赛区)预赛试题相对原子质量:H:1.01 C:12.01 N:14.01 O:16.00 F:19.00 Na:22.99P:30.96 S:32.06 Cl:35.45 K:39.00 Ti:47.87 V:50.94Cr:52.00 Mn:54.94 Fe:55.85 Cu:63.55 Zn:65.39 Br:79.90Ag:107.9 I:126.9 Ba:137.31.本试卷共26题,用2小时完成,全卷共150分;2.可使用计算器。
一、选择题(每小题有1~2个选项符合题意;每题4分,共15题,共60分。
)1.若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是A.将金粉和铜粉混合B.将牛奶加入水中混合C.蒸发食盐水制取食盐晶体D.用漏斗、滤纸过滤除去水中的泥沙2.关于氢键,下列说法正确的是A.每一个水分子内含有两个氢键B.冰、水中都存在氢键C.分子间形成的氢键使物质的熔点和沸点升高D.H2O是一种非常稳定的化合物,这是由于氢键所致3.三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了八个电子的结构。
在一个三硫化四磷分子中含有的共价键个数是A.7个B.9个C.19个D.不能确定4.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。
根据上述信息,下列说法不正确的是A.CaO2的水解产物是Ca(OH)2和H2O2B.PCl3的水解产物是HClO和PH3C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱5.当弱电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子数占原来总分子数的百分数叫做该电解质的电离度。
现欲粗略测定一未知浓度的CH3COOH溶液中CH3COOH的电离度,应做的实验和所需的试剂(或试纸)是A.电解、NaOH溶液B.蒸馏、Na2CO3溶液C.酯化反应、石蕊溶液D.中和滴定、pH试纸6.下列离子方程式书写正确的是A.二氧化氮溶于水:3NO2+H2O2H++2NO3-+NOB .将标准状况下112mL 氯气通入 10mL 浓度为 1mol · L 1的溴化亚铁溶液中:2Fe 2++4Br -+3Cl 23Fe 3++6Cl -+2Br 2C .次氯酸钙溶液中通入过量二氧化碳:Ca(ClO)2+H 2O+CO 2CaCO 3↓+2HClOD .氯化亚铁溶液中加入硝酸:3Fe 2++4H ++NO 3-3Fe 3++2H 2O+NO↑7.有机物A 的分子式为C 4H 10O ,则A 的结构可能有(不含对映异构) A .4种 B .5种 C .6种 D .7种 8.乙酰水杨酸COOH OCCH 3O又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用。
中国化学会2002年全国高中学生化学竞赛(省级赛区)试题

● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
1.008Zr Nb M o TcRu Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re OsIr Pt Au Hg Tl Pb Bi Po At Ac-LrHLi BeB C N O F Na M gAl Si P Cl S K Ca Sc Ti V Cr M n Fe Co Ni Cu Zn Ga Ge As Se BrRb Cs Fr Sr Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.45 4.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量RfDbSgBhHsMt第1题(5分)阅读如下信息后回答问题:元素M ,其地壳丰度居第12位,是第3种蕴藏最丰富的过渡元素,是海底多金属结核的主要成分,是黑色金属,主要用途: 炼钢,也大量用来制作干电池,还是动植物必需的微量元素。
历年高中化学奥赛竞赛试题及答案
●竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第1题(12分)通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)4。
1-1已知反应分两步进行,试用化学方程式表示上述溶解过程。
早在上世纪50年代就发现了CH5+的存在,人们曾提出该离子结构的多种假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H 键的键长相等。
1-2该离子的结构能否用经典的共价键理论说明?简述理由。
1-3该离子是()。
A.质子酸B.路易斯酸C.自由基D.亲核试剂2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。
该分子的结构简图如下:1-4该分子的分子式为;1-5该分子有无对称中心?1-6该分子有几种不同级的碳原子?1-7该分子有无手性碳原子?1-8该分子有无手性?第2题(5分)羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下:NH2OH+HN﹡O2→A+H2ONH2OH+HN﹡O2→B+H2OA、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。
请分别写出A和B的路易斯结构式。
第3题(8分)X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。
该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。
2003年全国高中学生化学竞赛
河北石家庄二中
张洲豪
河北石家庄二中
冯丹
海南省海南中学
粟骥
长沙市长郡中学
马潇潇
山东烟台三中
赵飞
北京师大附属实验中学
张中岳
东北师范大学附属中学
何海
广州市华师附中
南星
广东深圳市深圳中学
郑桂川
海南省海南中学
魏冰川
华东师大二附中
胡蓉蓉
湖南师范大学附中
乔晓东
山东烟台海阳一中
刘彬
安徽淮南二中
贾维杰
山东寿光现代中学
田湘寅
湖南师范大学附中
王乐
呼市二中
王晗
河北唐山市一中
薛钊
四川南充高中
韩清川郑州Leabharlann 中朱文杰郑州十一中
郑斌
吉林省实验中学
白雪宁
乌鲁木齐市一中
王新炜
杭州二中
刁天宁
成都实验外国语学校
沈况
合肥一中
赵蓉雅
浙江鄞州中学
吴程
福建龙岩第一中学
罗显飞
四川绵阳中学
胡江海
海南省海南中学
杨睿
山西忻州一中
王景昊
安徽无为第一中学
陈斌
北京师大附属第二中学
谭陆西
重庆市一中
孙亚飞
江苏苏州实验中学
仲真珍
湖北黄石二中
谢厅
东北育才学校
环昊
南京师大附属中学
倪犇博
江苏启东中学
二等奖(65名)
姓名
学校
姓名
学校
李君
四川南充高中
向旭
重庆市巴蜀中学
邓鹤翔
武汉49中
李慰
海南省海南中学
王广龙
中国化学会全国高中学生化学竞赛省级赛区试题及答案

第27届中国化学奥林匹克初赛试题、解答、评分标准及评分细则第1题12分 写出下列化学反应的方程式1-1 加热时;三氧化二锰与一氧化碳反应产生四氧化三锰..1-2 将KCN 加入到过量的CuSO 4水溶液中..1-3 在碱性溶液中;Cr 2O 3和K 3FeCN 6反应..1-4 在碱性条件下;ZnCN 42 和甲醛反应..1-5 FeOH 2在常温无氧条件下转化为Fe 3O 4..1-6 将NaNO 3粉末小心加到熔融的NaNH 2中;生成NaN 3没有水生成..1-1 3Mn 2O 3+CO =2Mn 3O 4+CO 2 2分1-2 4CN +2Cu 2+=2CuCN +CN 2 2分1-3 Cr 2O 3+6FeCN 63 +10OH =2CrO 42 +6FeCN 64 +5H 2O 2分1-4 ZnCN 42 +4H 2CO +4H 2O =4 HOCH 2CN +ZnOH 42 2分1-5 3FeOH 2=Fe 3O 4+H 2+2H 2O 2分1-6 NaNO 3+3NaNH 2=NaN 3+NH 3+3NaOH 2分1方程式正确才能得满分..2若全部物质皆写对而未配平;可得1分..第2题23分 简要回答或计算2-1 Bi 2Cl 82-离子中铋原子的配位数为5;配体呈四角锥型分布;画出该离子的结构并指出Bi 原子的杂化轨道类型..Bi 2Cl 82-的结构:BiClClBi Cl ClCl 2-或 BiCl Cl Bi Cl Cl Cl 2- 2分.......未画成楔形键不扣分;不画电子对不扣分;若画了电子对且画成如上图蓝所示的连线;则与电子对相连的线不画成虚线左、虽画成虚线但远离Bi 原子;扣0.5分杂化轨道类型:sp 3d 2 1分2-2在液氨中;E θNa +/Na =-1.89V;E θMg 2+/Mg =-1.74V ;但可以发生Mg 置换Na 的反应:Mg +2NaI =MgI 2+2Na;指出原因..MgI 2在液氨中难溶.. 1分答微溶或溶解度小;也可得1分..2-3将Pb 加到氨基钠的液氨溶液中;先生成白色沉淀Na 4Pb;随后转化为Na 4Pb 9绿色而溶解..在此溶液中插入两块铅电极;通直流电;当1.0 mol 电子通过电解槽时;在哪个电极阴极或阳极上沉积出铅写出沉积铅的量..阳极 1分9/4mol 1分2-4下图是某金属氧化物的晶体结构示意图..图中;小球代表金属原子;大球代表氧原子;细线框出其晶胞..2-4-1写出金属原子的配位数m 和氧原子的配位数n ..2-4-2写出晶胞中金属原子数p和氧原子数q..2-4-3写出该金属氧化物的化学式金属用M表示..2-4-1:m=4;n=4..m: 0.5分; n: 0.5分2-4-2:p=4;q=4.. p: 0.5; q:0.5分2-4-3:MO.. MO:1分2-5向含cis-CoNH34H2O23+的溶液中加入氨水;析出含{CoCoNH34OH23}6+的难溶盐..{ CoCoNH34OH23}6+ 是以羟基为桥键的多核络离子;具有手性..画出其结构..4分未画成楔形键;也得4分只画出1个对应体;也得4分2-6向K2Cr2O7和NaCl的混合物中加入浓硫酸制得化合物X154.9 g mol-1..X为暗红色液体;沸点117 o C;有强刺激性臭味;遇水冒白烟;遇硫燃烧..X分子有两个相互垂直的镜面;两镜面的交线为二重旋转轴..写出X的化学式并画出其结构式..X的化学式:CrO2Cl2 2分X的结构式:1分若画成两个Cr-O单键;只得0.5分; 若画成一个Cr-O单键和一个Cr=O双键;不得分..2-7实验得到一种含钯化合物PdC x H y N z ClO42;该化合物中C和H的质量分数分别为30.15% 和5.06%..将此化合物转化为硫氰酸盐PdC x H y N z SCN2;则C和H的质量分数分别为40.46%和5.94%..通过计算确定PdC x H y N z ClO42的组成..解法一:PdC x H y N z ClO42中;C和H的比例为30.15/12.01 : 5.06/1.008 =1:2即y=2x 1 1分PdC x H y N z SCN2中; C和H的比例为40.46/12.01 : 5.94/1.008 = 0.572即x+2 / y=0.572 2综合1、2;解得:x=13.89 ≈ 14; y=28 1分设PdC x H y N z ClO42的摩尔质量为M:则14×12.01/M=30.15%; 得M=557.7 g mol-11分z={557.7–106.4+12.01×14+ 1.008 28+2×35.45+64.00}/14.01= 3.99= 40.5分PdC x H y N z ClO42的组成为PdC14H28N4ClO42 ..0.5分解法二:设PdC x H y N z ClO42的摩尔质量为M;比较PdC x H y N z ClO42和PdC x H y N z SCN2知;PdC x H y N z SCN2的摩尔质量为:M-2×35.45+64.00-32.01+12.01+14.01=M-82.74 g mol-1根据C的质量分数;有:12.01×x=0.3015 M12.01×x+2 =0.4046 ×M-82.7424.02 =0.4046-0.3015 M-0.4046 ×82.74解得:M=557.7; x=142分根据H的质量分数;有:y =557.7×0.0506 / 1.008 =27.99 =28 1分则:z={557.7-106.4+12.01×14+1.008 ×28+2 ×35.45+64.00}/14.01=3.99=41分其他合理计算且得出正确结果亦得4分2-8甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键..甲烷与空气按一定比例混合;氧气的利用率为85%;计算汽车尾气中O2、CO2、H2O和N2的体积比空气中O2和N2体积比按21: 79计;设尾气中CO2的体积为1..甲烷完全燃烧:CH4+2O2=CO2+2H2O1体积甲烷消耗2体积O2生成1体积CO2和2体积H2O1分由于O2的利用率为85%;反应前O2的体积2/0.85=2.35剩余O2的体积:2.35 – 2 =0.35 1分混合气中N2的体积:2.35 79/21= 8.84 N2不参与反应;仍保留在尾气中..汽车尾气中;O2、CO2、H2O和N2的体积比为0.35:1:2:8.84.. 1分第3题11分白色固体A;熔点182o C;摩尔质量76.12 g mol 1;可代替氰化物用于提炼金的新工艺..A的合成方法有:1142o C下加热硫氰酸铵;2CS2与氨反应;3CaCN2和NH42S水溶液反应放出氨气..常温下;A在水溶液中可发生异构化反应;部分转化成B..酸性溶液中;A在氧化剂如Fe3+、H2O2和O2存在下能溶解金;形成取sp杂化的AuI 配合物..3-1画出A的结构式..3-2分别写出合成A的方法2、3中化学反应的方程式..3-3画出B的结构式..3-4写出A在硫酸铁存在下溶解金的离子方程式..3-5 A和AuI形成的配合物中配位原子是什么3-6在提炼金时;A可被氧化成C:2A→C + 2e ;C能提高金的溶解速率..画出C的结构式..写出C和Au反应的方程式..3-12分3-2反应2:1分反应3:1分3-32分3-4 1分3-5 配位原子为S.. 1分3-6或2分写成下二式不得分:和C和Au反应的方程式:S2C2NH242+ +2Au + 2SCNH22 → 2AuSCNH222+ 1分第4题7分人体中三分之二的阴离子是氯离子;主要存在于胃液和尿液中..可用汞量法测定体液中的氯离子:以硝酸汞II为标准溶液;二苯卡巴腙为指示剂..滴定中Hg2+与Cl 生成电离度很小的HgCl2; 过量的Hg2+与二苯卡巴腙生成紫色螯合物..4-1 简述配制硝酸汞溶液时必须用硝酸酸化的理由..抑制Hg2+水解..1分H3O+浓度增大;阻止HgOHNO3的生成..若写出了水解产物;但又错写为HgO;不扣分..4-2 称取1.713g HgNO32 x H2O;配制成500 mL溶液作为滴定剂..取20.00 mL 0.0100 molL 1 NaCl标准溶液注入锥形瓶;用1mL 5% HNO3酸化;加入5滴二苯卡巴腙指示剂;用上述硝酸汞溶液滴定至紫色;消耗10.20 mL..推断该硝酸汞水合物样品的化学式..n HgNO32=1/2n NaCl=1/2×20.00 mL×10-3L mL-1×0.0100 mol L-1 =1.00 ×10-4 molc HgNO32=1.00 ×10-4 mol÷10.20 mL×10-3L mL-1=9.80×10-3 mol L-1500 mL溶液中硝酸汞的摩尔数即水合物的摩尔数=9.80×10-3 mol L-1×0.500 L=4.90×10-3 mol硝酸汞水合物摩尔质量M=m/n=1.713g /4.90×10-3mol=350 g.mol-1结晶水的摩尔质量M H2O=M HgNO32 .x H2O-M HgNO32=350-324.6 g.mol-1=25 gmol-1 x=n H2O=25 g mol-1÷18.0 g mol-1=1.4该硝酸汞水合物样品的化学式: HgNO32 ·1.4H2O 2分4-3 取0.500 mL血清放入小锥形瓶;加2mL去离子水、4滴5%的硝酸和3滴二苯卡巴腙指示剂;用上述硝酸汞溶液滴定至终点;消耗1.53mL..为使测量结果准确;以十倍于血清样品体积的水为试样进行空白实验;消耗硝酸汞溶液0.80 mL..计算该血清样品中氯离子的浓度毫克/100毫升..0.500 mL血清样品实际消耗的硝酸汞标准溶液为1.53-0.80×0.1 mL=1.45 mL 1分n Cl-=n Hg NO32×2=9.80 ×10-3 mol L-1×1.45×10-3 L×2=2.84×10-5 mol 1分c Cl-=n Cl-/V试样=2.84×10-5 mol÷0.500 mL×10-3L mL-1=5.68 ×10-2 mol L-1 1分相当于35.45 g mol-1×5.68 ×10-2 mol L-1=2.01×102 mg/100mL1分第5题10分M3XY呈反钙钛矿结构;是一种良好的离子导体..M为金属元素;X和Y为非金属元素;三者均为短周期元素且原子序数Z X<Z M<Z Y..M3XY可由M和X 、M和Y的二元化合物在约500K;3MPa的惰性气氛中反应得到..为避免采用高压条件;研究者发展了常压下的合成反应:M + MXA + MY → M3XY + 1/2A2gA2无色无味..反应消耗0.93g M可获得0.50 L A2气体25o C; 100kPa..气体常量R=8.314 kPa L mol-1 K-15-1计算M的摩尔质量..5-2 A、M、X、Y各是什么5-3写出M3XY发生水解的方程式..5-4 M3XY晶体属于立方晶系;若以X为正当晶胞的顶点;写出M和Y的坐标以及该晶体的最小重复单位..5-1 PV=nRTn A2=PV/RT=100 kPa×0.50 L / 8.314 kPa L mol-1 K-1×298K =0.020 mol由反应式知;消耗0.040 mol MM的摩尔质量:0.93 g / 0.040 mol=23 g mol-1 2分5-2 A:H;M:Na;X:O;Y:Cl 每个0.5分;共2分5-3 Na3OCl+H2O 2NaOH+NaCl 1分5-4 M的坐标:1/2; 0; 0;0; 1/2; 0;0; 0; 1/2..Y的坐标:1/2; 1/2; 1/2.. 4分Na3OCl;或1个正当晶胞;或1个素晶胞.. 1分第6题10分某同学从书上得知;一定浓度的Fe2+、CrOH4 、Ni2+ 、MnO42 和CuCl3 的水溶液都呈绿色..于是;请老师配制了这些离子的溶液..老师要求该同学用蒸馏水、稀硫酸以及试管、胶头滴管、白色点滴板等物品和尽可能少的步骤鉴别它们;从而了解这些离子溶液的颜色..请为该同学设计一个鉴别方案;用离子方程式表述反应并说明发生的现象若A与B混合;必须写清是将A滴加到B中还是将B滴加到A中..答案:第1步:在点滴板上分别滴几滴试样;分别滴加蒸馏水;颜色变蓝者为CuCl3 1分CuCl3 +4H2O =CuH2O42++3Cl 1分第2步:另取其他4种溶液;滴加到点滴板上;分别滴加稀硫酸..生成绿色沉淀的是CrOH4 随酸量增加又溶解;溶液变紫红且生成棕色沉淀的是MnO42-.. 2分CrOH4 +H+=CrOH3+H2O 1分CrOH3+3H+ =Cr3++3H2O3MnO42 +4H+=2MnO4 +MnO2+2H2O 1分若第1步用稀H2SO4;评分标准同上..第3步:将CrOH4 分别滴加到Fe2+ 和Ni2+ 的试液中;都得到氢氧化物沉淀..颜色发生变化的是Fe2+;不发生变化的是Ni2+ .. 2分Fe2++2CrOH4 =FeOH2 +2CrOH3 0.5分4FeOH2+O2+2H2O=4FeOH3 0.5分Ni2++2CrOH4=NiOH2 +2CrOH3 1分第7题5分根据所列反应条件;画出A、B、C、D和F的结构简式..每个结构简式1分;其他答案不得分..第8题10分画出下列反应中合理的、带电荷中间体1、3、5、7和8以及产物2、4、6、9和10的结构简式..8-18-28-38-4答案:8-1每结构简式1分;其他答案不得分;8-2每结构简式1分;画成也得分;其他答案不得分;8-3每结构简式1分;5也得1分; 6画成或没有标出得0.5分;其他答案不得分8-4每结构简式1分;其他答案不得分..第9题12分9-1常用同位素标记法研究有机反应历程..如利用18O标记的甲醇钠研究如下反应;发现最终产物不含18O..根据实验事实画出中间体的结构简式..答案:A: 2分B和C可互换;每结构简式2分其他答案不得分..9-2某同学进行如下实验时在碱性条件下得到了两个产物D和E;产率分别为74.3%和25.7%.. 1画出产物D和E的结构简式..2指明此反应所属的具体反应类型..3简述D产率较高的原因..4简述反应体系加入二氧六环的原因..1每结构简式1分;其他答案不得分..2芳香亲核取代反应1分;只答取代反应给0.5分..3正丁胺中氮原子的亲核能力比水中氧原子的强;而二级芳香胺中氮原子的亲核能力比水中氧原子的弱;因此使得D的产率高..2分4为了增加正丁胺和2;4-二硝基氯苯在水中的溶解度.. 1分其他答案不得分..郑重声明:本试题及答案版权属中国化学会所有;未经中国化学会化学竞赛负责人授权;任何人不得翻印;不得在出版物或互联网网站上转载、贩卖、赢利;违者必究..本试卷和相应答案将分别于2013年9月8日12:00和15日12:00在网站http:上公布..。
全国高中化学竞赛试题及答案

评分通则1.凡要求计算或推导的,必须示出计算或推导过程。
没有计算或推导过程,即使结果正确也不得分。
2.有效数字错误,扣0.5分,但每一大题只扣1次。
3.单位不写或表达错误,扣0.5分,但每一大题只扣1次。
4.只要求1个答案、而给出多个答案,其中有错误的,不得分。
5.方程式(不是反应式!)不配平不得分。
6.用铅笔解答(包括作图)无效。
7.使用涂改液涂改的解答无效。
8.不包括在标准答案的0.5分的题,可由省、市、自治区评分组讨论决定是否给分。
9.答案中红色字为标准答案,而蓝字体(加下划线)为注释语不属于答案。
气体常数R =8.31447 J K -1 mol -1 法拉第常数F =96485 C mol -1 阿佛加德罗常数N A =6.022142×1023 mol -1第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk 轰击48Ca 靶合成的,总共得到6个117号元素的原子,其中1个原子经p 次α衰变得到270Db 后发生裂变;5个原子则经q 次α衰变得到281Rg 后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角每式1分,画箭头也得 1分。
两式合并为 23n +Uns 5+Uns =Bk 6+Ca 629397294117249974820也得满分。
(2分)1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如第2题(5 分)最近我国有人报道,将0.1 mol L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2-)分别为0.345 V和-0.476 V,nFEӨ=RT ln K,EӨ表示反应的标准电动势,n为该反应得失电子数。
扬子石化杯 2003年全国高中学生化学竞赛(江苏省赛区)

“扬子石化杯”2003年全国高中学生化学竞赛(江苏省赛区)预赛试题相对原子质量:H:1.01 C:12.01 N:14.01 O:16.00 F:19.00 Na:22.99 P:30.96 S:32.06 Cl:35.45 K:39.00 Ti:47.87 V:50.94 Cr:52.00 Mn:54.94 Fe:55.85 Cu:63.55 Zn:65.39 Br:79.90 Ag:107.9 I:126.9 Ba:137.3 1、本试卷共26题,用2小时完成,全卷共150分;2、可使用计算器。
请将选择题的答案填在后面的表格中一、选择题(每小题有1—2个选项符合题意;每小题4分,15小题,共60分。
)1.若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是A.将金粉和铜粉混合B.将牛奶加入水中混合C.蒸发食盐水制取食盐晶体D.用漏斗、滤纸过滤除去水中的泥沙2.关于氢键,下列说法正确的是A.每一个水分子内含有两个氢键B.冰、水中都存在氢键C.分子间形成的氢键合物质的熔点和沸点升高D.H2O是一种非常稳定的化合物,这是由于氢键所致3.三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了八个电子的结构。
在一个三硫化四磷分子中含有的共价键个数是A.7个B.9个C.19个D.不能确定4.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。
根据上述信息,下列说法不正确的是A.CaO2的水解产物是Ca(OH)2和H2O2B.PCl3的水解产物是HClO和PH3C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱5.当弱电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子数占原来总分子数的百分数叫做该电解质的电离度。
现欲粗略测定一未知浓度的CH3COOH溶液中CH3COOH的电离度,应做的实验和所需的试剂(或试纸)是A.电解、NaOH溶液B.蒸馏、Na2CO3溶液C.酯化反应、石蕊溶液D.中和滴定、pH试纸6.下列离子方程式书写正确的是A.二氧化氮溶于水:3NO2 + H2O = 2H+ + 2NO3—+ NOB.将标准状况下112mL氯气通入10mL浓度为1mol·L-1的溴化亚铁溶液中:2Fe2+ + 4Br—+ 3Cl2 = 3Fe3+ + 6Cl—+ 2Br2C.次氯酸钙溶液中通入过量二氧化碳:Ca(ClO)2 + H2O + CO2 = CaCO3↓+ 2HClOD.氯化亚铁溶液中加入硝酸:3Fe2+ + 4H+ + NO3—= 3Fe3+ + 2H2O + NO↑7.有机物A的分子式为C4H10O,则A的结构可能有(不含对映异构)A.4种B.5种C.6种D.7种8.乙酰水杨酸,又名阿斯匹林(Aspirin)具有退热、镇痛作用,常用于治疗伤风、感冒、头痛、神经痛及风湿性关节痛,近年来又用于防治老年性心血管病,但患有消化道溃疡的人不宜服用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国化学会2003年全国高中学生化学竞赛(省级赛区)试题(2003年9月14日9︰00-12︰00 共计3小时)
●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时
间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸
在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
第一题(5分)
二战期间日本是在战场上唯一大量使用毒气弹的国家,战争结束日军撤退时,在我国秘密地遗弃了大量未使用过的毒气弹,芥子气是其中一种毒气。
芥子气的分子式为(ClCH2CH2)2S。
人接触低浓度芥子气并不会立即感受痛苦,然而,嗅觉不能感受的极低浓度芥子气已能对人造成伤害,而且,伤害是慢慢发展的。
1.用系统命名法命名芥子气。
2.芥子气可用两种方法制备。
其一是ClCH2CH2OH与Na2S反应,反应产物之一接着与氯化氢反应;其二是CH2=CH2与S2Cl2反应,反应物的摩尔比为2︰1。
写出化学方程式。
3.用碱液可以解毒。
写出反应式。
50年前,Watson和Crick因发现DNA双螺旋而获得诺贝尔化学奖。
DNA的中文化学名称是:;构成DNA的三种基本组分是:、和;DNA 中的遗传基因是以的排列顺序存储的;DNA双键之间的主要作用力是。
给出DNA双螺旋结构在现代科技中应用的一个实例:。
第三题(5分)
在正确选项上圈圈。
1.下列化学键中碳的正电性最强的是
A.C-F B.C一O C.C-Si D.C-Cl
2.电子构型为[Xe]4f145d76s2的元素是
A.稀有气体B.过渡元素C.主族元素D.稀土元素
3.下列离子中最外层电子数为8的是
A.Ga3+B.Ti4+C.Cu+D.Li+
第四题(8分)
在30℃以下,将过氧化氢加到硼酸和氢氧化钠的混合溶液中,析出一种无色晶体X。
组成分析证实,该晶体的质量组成为Na 14.90%,B 7.03%,H 5.24%。
加热X,得无色晶体Y。
Y含Na 23.0%,是一种温和的氧化剂,常温下在干燥空气里稳定,但在潮湿热空气中分解放氧,广泛用作洗涤剂、牙膏、织物漂白剂和美发产品,也用于有机合成。
结构分析证实X和Y的晶体中有同一种阴离子Z2-,该离子中硼原子的化学环境相同,而氧原子却有两种成健方式。
1.写出X、Y的最简式,给出推理过程。
X的最简式:Y的最简式:
推理过程:
2.用最恰当的视角画出Z2-离子的立体结构(原子用元素符号表示,共价键用短线表示)。
产的大型蓄电系统。
左右两
侧为电解质储罐,中央为电
池,电解质通过泵不断在储
罐和电池间循环;电池中的
左右两侧为电极,中间为离
子选择性膜,在电池放电和
充电时该膜可允许钠离子通
过;放电前,被膜隔开的电
解质为Na2S2和NaBr3,放
电后,分别变为Na2S4和
NaBr。
1.左、右储罐中的电解质分别为:
左:;右:。
2.写出电池充电时,阳极和阴极的电极反应。
阳极:;阴极:。
3.写出电池充、放电的反应方程式。
4.指出在充电过程中钠离子通过膜的流向。
第六题(12分)
2003年3月日本筑波材料科学国家实验室一个研究小组发现首例带结晶水的晶体在5K 下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构;在以“CoO2”为最简式表示的二维结构
中,钴原子和氧原子呈周期性排列,钴原子被4个氧原子包围,Co-O键等长。
2.以●代表氧原子,以●代表钴原子,画出CoO2层的结构,用粗
线画出两种二维晶胞。
可资参考的范例是:石墨的二维晶胞是右图中用
粗线围拢的平行四边形。
3.据报道,该晶体是以Na0.7CoO2为起始物,先跟溴反应,然后用
水洗涤而得到的。
写出起始物和溴的反应方程式。
杜邦公司因发明了一项新技术而获得了2003年美国总统绿色化学奖。
该技术利用基因工程将酵母菌的基因引入一种大肠杆菌,用来将葡萄糖发酵生成1,3-丙二醇。
1.在上述发酵过程中,葡萄糖首先转化为二羟基丙酮的一磷酸酯,随后转化为目标产物。
该反应对于葡萄糖的原子利用率为%。
原子利用率是目标产物的相对分子质量除以反应物相对原子质量之和乘以100%。
2.生产1,3-丙二醇的传统工艺是以石油为原料按下述路线进行的:石油→乙烯→环氧乙烷→3-羟基丙醛-1,3-丙二醇。
获得3-羟基丙醛的反应在乙醚溶剂中进行,用钴催化剂或铑催化剂,温度80℃,压力107Pa;后一反应用镍催化剂,温度80~120℃,压力1.6×107Pa。
对比之下,新工艺至少具有以下3种绿色化学特征:
①
②
③
第八题(12分)
1.(4分)1摩尔高锰酸钾在240~300℃加热释放出19.2g氧气,写出反应方程式。
(已知K2MnO4 640℃分解,K3MnO4 800℃分解。
)
2.(3分)咖啡因对中枢神经有兴奋作用,其结构式如下。
常温下,咖啡因在水中的溶解度为2g/100g H2O,加适量水杨酸钠[C6H4(OH)(COONa)],由于形成氢键而增大咖啡因的溶解度。
请在附图上添加水杨酸钠与咖啡因形成的氢键。
3.(2分)阿司匹林结构式如右,难溶于水。
若和适量柠檬酸三钠
混合,即可增大溶解度。
解释原因。
4.(3分)氯仿在苯中的溶解度明显比1,1,1-三氯乙烷的大,请给出一种可能的原因(含图示)。
第九题(6分)
钒是我国丰产元素,储量占全球11%,居第四位。
在光纤通讯系统中,光纤将信息导入离光源1km外的用户就需用5片钒酸钇晶体(钇是第39号元素)。
我国福州是全球钒酸钇晶体主要供应地,每年出口几十万片钒酸钇晶体,年创汇近千万美元(1999年)。
钒酸钇是四方晶体,晶胞参数a=712pm,c=629pm,密度d=4.22g/cm3,含钒25%,求钒酸钇的化学式以及在一个晶胞中有几个原子。
给出计算过程。
钒酸钛的化学式:一个晶胞中的原子数:
计算过程:
美国Monsando公司生产了一种除草剂,结构如右图,
酸式电离常数如下:Pk a1 0.8,pK a2 2.3,pK a3 6.0,pK a4 11.0。
与它配套出售的是转基因作物(大豆、棉花、玉米、油菜
籽)的种子,转入了抗御该除草剂的基因,喷洒该除草剂
后其他植物全部死光,唯独这些作物茁壮成长,由此该除草剂得名roundup,可意译为“一扫光”。
这四种转基因作物已在美国大量种植,并已向我国和巴西等国大量出口,但欧洲至今禁止进口。
1.Roundup为无色晶体,熔点高达200℃,根据如上结构式进行的分子间作用力(包括氢键)的计算,不能解释其高熔点。
试问:Roundap在晶体中以什么型式存在?写出它的结构式。
2.加热至200~230℃,Roundup先熔化,后固化,得到一种极易溶于水的双聚体A,其中有酰胺键,在316℃高温下仍稳定存在,但在无机强酸存在下回流,重新转化为Roundup。
画出A的结构式。
3.Roundup的植物韧皮的体液的pH约为8;木质部和细胞内液的pH为5~6。
试写出Roundop后三级电离的方程式(方程式中的型体附加①②③④标注),并问:Roundup在植物动皮液和细胞内液的主要存在型体(用你定义的①②③④表达)。
提示:通常羧酸的电离常数介于磷酸的一、二级电离常数之间。
电离方程式:
植物动皮液的主要型体:细胞内液的主要型体:
4.只有把Roundup转化为它的衍生物,才能测定它的Pk1,问:这种衍生物是什么?
某烯烃混合物的摩尔分数为十八碳-3,6,9-三烯9%,十八碳-3,6-二烯57%,十八碳-3一烯34%。
1.烯烃与过氧乙酸可发生环氧化反应,请以十八碳-3,6,9-三烯为例,写出化学反应方程式。
2.若所有的双键均被环氧化,计算1摩尔该混合烯烃需要多少摩尔过氧乙酸。
3.若上述混合烯烃中只有部分不饱和键环氧化,请设计一个实验方案,用酸碱滴定法测定分离后产物的环氧化程度:简述实验方案;写出相关的反应方程式和计算环氧化程度(%)的通式。
中和1.2312g平面构型的羧酸消耗18.00mL 1.20mol/L NaOH溶液,将该羧酸加热脱水,生成含碳量为49.96%的化合物。
确定符合上述条件的摩尔质量最大的羧酸及其脱水产物的结构式,简述推理过程。
核酸的结构式:脱水产物的结构式:
推理过程:。
