(北京密卷)2019版高考化学一轮复习 第19讲 电解原理及应用作业
2019年北京高三化学一轮复习 高三期末考试(实验探究汇编)

2019年北京高三化学一轮复习高三期末考试(实验探究汇编)1、(北京海淀)某校学习小组探究不同条件对电解FeCl2溶液产物的影响。
所用实验装置如下图所示,其中电极为石墨电极。
【查阅文献】i. Fe2+、Fe3+在溶液中通过与Cl-结合分别形成FeCl42-、FeCl63-,可降低正电荷。
ii. 电解过程中,外界条件(如电解液pH、离子浓度、电压、电极材料等)会影响离子的放电能力。
【实验记录】(1)结合阴极实验现象的分析①实验I中阴极的电极反应式为。
②用化学用语表示实验II中产生阴极现象的原因:。
③对比实验I、II的阴极现象,可以获得的结论是。
(2)结合阳极实验现象的分析①甲同学认为实验I中Cl-没有放电,得出此结论依据的实验现象是________。
阳极附近溶液滴加KSCN溶液变红,依据此现象分析,阳极反应可能是Fe2+ - e- === Fe3+、________。
②对比实验I、II的阳极现象,解释产生差异的原因:。
【实验讨论】(3)有同学提出,改变条件有可能在阳极看到“湿润淀粉碘化钾试纸变蓝”的现象,可能改变的条件是,对应的实验方案是。
答案(12分)(1)①2H+ + 2e- == H2↑②Fe2+ + 2e- == Fe和Fe+ 2H+ == Fe2+ + H2↑(FeCl42-合理正确给分,各1分)③其他条件相同时,pH=0,pH较小,c(H+)较大]时,阴极H+优先于1 mol·L-1 Fe2+放电产生H2,而pH=4.9,pH较大,c(H+)较小时,阴极1 mol·L-1Fe2+优先于H+放电产生Fe或整体回答:由pH=0变为pH=4.9,c(H+)减小,H+放电能力减弱,Fe2+放电能力增强(2)①湿润淀粉碘化钾试纸始终未见变蓝FeCl42- - e- === Fe3+ + 4Cl-(或写为:FeCl42- + 2Cl- - e- === FeCl63-)②随着溶液pH的越低,c(H+)升高,抑制水解平衡Fe3+ + 3H2O Fe(OH)3 + 3H+正向移动,难以生成Fe(OH)3或正向回答:随着溶液pH的增大,c(H+)减小,有利于水解平衡Fe3+ + 3H2O Fe(OH)3 + 3H+正向移动,生成Fe(OH)3(3)可改变条件1:改变c(Cl-)保持其他条件不变,用2 mol/L FeCl2溶液和n(n>0)mol/L NaCl溶液等体积混合的溶液作为电解液[c(Fe2+)= 1 mol/L,c(Cl-)>2 mol/L],观察阳极“湿润淀粉碘化钾试纸”上的现象可改变条件2:改变电压保持其他条件不变,增大电压(或改变电压),观察阳极“湿润淀粉碘化钾试纸”上的现象2、(北京西城)实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。
2019年北京高考化学卷含答案

2019年北京高考化学押题卷(含答案)一、选择题(本题包括14小题,每小题3分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1.化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是()A.家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故B.在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的C.侯氏制碱法的工艺过程中主要应用了物质熔、沸点的差异D.可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气答案 C解析A项,次氯酸钠有强氧化性,盐酸有还原性,两者相遇发生氧化还原反应生成氯气,氯气有毒,正确;B项,防治龋齿的有效成分是氟离子,当氟离子浓度相等时,防治龋齿的作用是相同的,正确;C项,侯氏制碱法的工艺过程中主要应用了物质的溶解度的差异,错误;D项,浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,冒白烟,正确。
2.下列有关物质的分类与性质的说法正确的是()3.设阿伏加德罗常数的值为N A,下列叙述正确的是()A.3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1N A B.0.1 mol 8135Br中含有的中子数为3.5N AC.标准状况下,11.2 L CHCl3中含有的C—Cl键的数目为1.5N A D.0.5 L 1.0 mol·L-1 NH4Al(SO4)2溶液中含有的NH+4数目为0.5N A4.(2018·开封质检)下列关于有机物结构、性质的分析正确的是() A.正丁烷和异丁烷的一氯取代物都只有两种,它们的沸点也相同B.乙烯分子与苯分子都能与H2发生加成反应,说明二者均含碳碳双键C.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应D.乙醛加入Cu(OH)2粉末并加热可看到红色沉淀生成答案 C解析A项,正丁烷和异丁烷是两种不同的物质,正丁烷的一氯代物沸点与异丁烷的一氯代物沸点不同,错误;B项,苯中不含碳碳双键和碳碳单键,但苯能发生加成反应,错误;C项,在一定条件下,烷烃、苯及其同系物、醇、羧酸和酯类都能发生取代反应,注意酯类的水解反应属于取代反应,正确;D项,乙醛与新制Cu(OH)2悬浊液加热煮沸可看到红色沉淀生成,不是Cu(OH)2粉末,错误。
北京高三化学一轮复习 电解原理的应用(学案及强化训练)
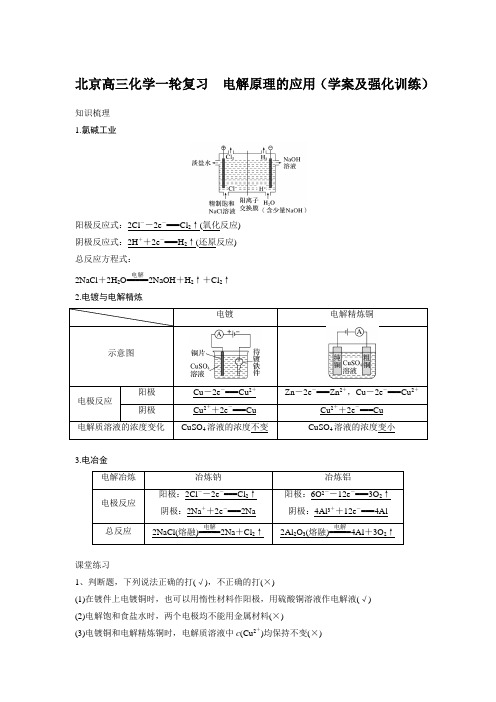
北京高三化学一轮复习 电解原理的应用(学案及强化训练)知识梳理 1.氯碱工业阳极反应式:2Cl --2e -===Cl 2↑(氧化反应) 阴极反应式:2H ++2e -===H 2↑(还原反应) 总反应方程式:2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑ 2.电镀与电解精炼Cu -2e -===Cu 2+Zn -2e -===Zn 2+,Cu -2e -===Cu 2+3.电冶金课堂练习1、判断题,下列说法正确的打(√),不正确的打(×)(1)在镀件上电镀铜时,也可以用惰性材料作阳极,用硫酸铜溶液作电解液(√) (2)电解饱和食盐水时,两个电极均不能用金属材料(×)(3)电镀铜和电解精炼铜时,电解质溶液中c (Cu 2+)均保持不变(×)(4)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3(×)(5)电解精炼时,阳极泥可以作为提炼贵重金属的原料(√)(6)用Zn作阳极,Fe作阴极,ZnCl2作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌(×)强化训练1.金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。
下列叙述中正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)()A.阳极发生还原反应,其电极反应式为Ni2++2e-===NiB.电解过程中,阳极质量的减少量与阴极质量的增加量相等C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中有Cu和Pt答案 D2.利用如图所示装置模拟电解原理在工业生产中的应用。
下列说法正确的是()A.氯碱工业中,X电极上的反应式是4OH--4e-===2H2O+O2↑B.电解精炼铜时,Z溶液中的Cu2+浓度不变C.在铁片上镀铜时,Y是纯铜D.制取金属镁时,Z是熔融的氯化镁答案 D3用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。
(完整word版)2019高考北京卷化学试题解析

2019高考化学北京卷6.下列我国科研成果所涉及的材料中,主要成分为同主族元素形成的无机非金属材料的是A.4.03米大口径碳化硅反射镜B.2022年冬奥会聚氨酯速滑服C.能屏蔽电磁波的碳包覆银纳米线D.“玉兔二号”钛合金筛选网轮答案:A解析:注意审题,两个关键词,同主族元素,无机非金属材料。
A中碳化硅(SiC)符合题目要求,B中聚氨酯为有机高分子材料,C中碳包覆银纳米线不是同主族元素形成的,D中钛合金为金属材料,不是有机物。
7.下列示意图与化学用语标注内容不相符的是(水合离子用相应的离子符号表示)A B C DNaCl=Na++Cl-CuCl2=Cu2++2Cl-CH3COOH CH3COO-+H+H2(g)+Cl2(g)=2HCl(g)△H=-183kJ·mol-1答案:B解析:电解CuCl2溶液,是化学变化,方程式为CuCl2Cu+Cl2↑,故B符合题意。
A、C、D示意图与化学用语标注内容相符,都不符合题意。
8.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。
中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
铟与铷(37Rb)同周期。
下列说法不正确...的是A.In是第五周期第IIIA族元素B.11549In的中子数与电子数的差值为17C.原子半径:In>Al D.碱性:In(OH)3>RbOH答案:D解析:本题是对元素周期表和元素周期律的考查。
铟(49In)与铷(37Rb)均为第五周期元素,故选项A正In的电子数与质子数相等,为49,中子数为质量数(115)-质子数(49)=66,中子数与电子数之差为确;1154966-49=17,选项B正确;In和Al是同主族元素,且原子序数In>Al,因此原子半径In>Al,选项C正确;铟(49In)与铷(37Rb)分别为第五周期第IIIA和第IA族元素,碱性RbOH >In(OH)3,故选项D错误。
2019年北京高考化学真题及答案

2019年北京高考化学真题及答案(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年北京高考化学真题及答案(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年北京高考化学真题及答案(word版可编辑修改)的全部内容。
2019年普通高等学校招生全国统一考试化学能力测试(北京卷)本试卷共16页,共300分。
考试时长150分钟。
考试务必将答案答在答题卡上。
在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 166.下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是A .4。
03米大口径碳化硅反射镜B .2022年冬奥会聚氨酯速滑服C .能屏蔽电磁波的碳包覆银纳米线D .“玉兔二号”钛合金筛网轮7.下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)8.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。
中国科学院院士张青莲教授曾主持测定了铟(49In )等9种元素相对原子质量的新值,被采用为国际新标准.铟与铷(37Rb )同周期。
下列说法不正确的是A .In 是第五周期第ⅢA 族元素A B C DNaCl 溶于水电解CuCl 2溶液CH 3COOH 在水中电离 H 2与Cl 2反应能量变化NaClNa ++Cl −CuCl 2Cu 2++2Cl −CH 3COOHCH 3COO −+H +H 2(g )+Cl 2(g) 2HCl(g )ΔH =−183kJ·mol −1B.11549In的中子数与电子数的差值为17C.原子半径:In〉AlD.碱性:In(OH)3>RbOH9.交联聚合物P的结构片段如图所示。
化学第一轮复习电解池
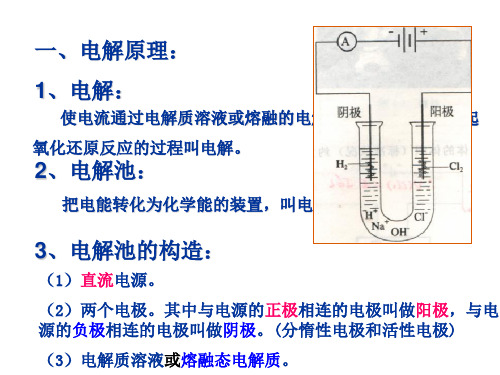
阳极:氧化反应、溶液中 的阴离子失电子,或电极 金属失电子
阴极:还原反应,溶液中 的阳离子得电子
阳极:金属电极失电子
阴极:电镀液中的阳离子 得电子
(08全国Ⅰ卷)电解100mLc(H+)=0.30mol/L的下列溶液,
当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
A.0.10mol/LAg+
B.H+>X3+>Cu2+
C.X3+>H+>Cu2+
D.Cu2+>H+>X3+
练习
1、(08全国Ⅱ卷)右图为直流电源电解稀Na2SO4水溶液的装 置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验 现象正确的是(D )
A.逸出气体的体积:a电极的小于b电 极的 B.一电极逸出无味气体,另一电极逸 出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色 D.a电极附近呈蓝色,b电极附近呈红色
将电能转化成化学能 的装置
应用电解原理在某些金属表 面镀上一层其它金属的装置
①两电极接直流电源
②两电极插入电解质溶液 中 ③形成闭合回路
①镀层金属接电源正极, 待镀金属接电源负极 ②电镀液必须含有镀层 金属的离子
阳极:与电源正极相连 阴极:与电源负极相连
名称同电解,但有限制条件。 阳极:必须是镀层金属 阴极:镀件
电解质 增大 氯化铜
电解质 和水
增大
氯化氢
放O2 生酸型
阴极:电解质阳离子放电 阳极:H2O放O2生酸
CuSO4
电解质 减小 CuO或
和水
CuCO3
②当阳极为活性电极(银以前金属)时,阳极金属失电子
高中化学第19讲 电解池 金属的电化学腐蚀与防护(精练)-2022年一轮复习讲练测(解析版)

第六章 化学反应与能量第19讲 电解池 金属的电化学腐蚀与防护(精练)完卷时间:50分钟可能用到的相对原子质量:H1 N14 O16 Na23 S32 Cl35.5 K39 Cu64一、选择题(每小题只有一个正确选项,共12*5分)1.(2021·山东潍坊市·高三三模)将电化学法和生物还原法有机结合,利用微生物电化学方法生产甲烷,装置如图所示。
下列说法错误的是A .离子交换膜可允许H +通过B .通电时,电流方向为:a →电子导体→离子导体→电子导体→bC .阳极的电极反应式为--+322C 6=H COO +2H O-e 2CO +7HD .生成0.1molCH 4时阳极室中理论上生成CO 2的体积是4.48L(STP)【答案】C【解析】由图示知,左池中CH 3COO -在电极上失电子被氧化为CO 2,故左池为电解的阳极室,右池为电解的阴极室,电源a 为正极,b 为负极。
A .由图示知,阳极反应产生H +,阴极反应消耗H +,故H +通过交换膜由阳极移向阴极,A 正确;B .这个装置中电子的移动方向为:电源负极(b)→电解阴极,电解阳极→电源正极(a),故电流方向为:电源正极(a)→外电路(电子导体)→电解质溶液(离子导体,阳极→阴极)→外电路(电子导体)→电源负极(b),形成闭合回路,B 正确;C .由分析知,左池为阳极,初步确定电极反应为:CH 3COO --8e -→2CO 2↑,根据图示知可添加H +配平电荷守恒,添加H 2O 配平元素守恒,得完整方程式为:CH 3COO --8e -+2H 2O →2CO 2↑+7H +,C 错误;D .由图示知,右池生成CO 2转化为CH 4,根据转移电子关系CH 4~8e -,0.1 mol CH 4生成转移0.8 mol 电子,由C 选项知:CO 2~4e -,故生成CO 2的n (CO 2)=0.8 mol =0.2 mol 4,故V (CO 2)=0.2 mol ×22.4 L/mol=4.48 L ,D 正确;故答案选C 。
【精品】北京专用2019版高考化学一轮复习第19讲电解原理及应用课件

入几滴酚酞,则:
①电解池中X极上的电极反应式是 在X极附近观察到的现象是 ②Y电极上的电极反应式是 。 , ,
检验该电极反应产物的方法是
。
(2)若用电解法精炼粗铜,电解液a选用CuSO4溶液,则: ①X电极的材料是 ②Y电极的材料是 ,电极反应式是 ,电极反应式是 。 (说
明:杂质发生的电极反应不必写出)。 ③当电路中有0.04 mol电子通过时,阴极增重 g。
2.电解原理的应用 (1)氯碱工业——电解饱和食盐水
阳极(放电顺序:Cl->OH-):2Cl--2e- Cl2↑(氧化反应) 阴极(放电顺序:H+>Na+):2H++2e- H2↑(还原反应) 总反应:2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 离子方程式:⑨ 2Cl-+2H2O
2OH +H ↑+Cl ↑
Al2O3+6H+,而阴极电极反应式为6H++6e- 3H2↑,故C错。
1-1 电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下:
电解池中隔膜仅阻止气体通过,阴、阳两极均为惰性电极。
(1)A极为
(2)B极为
,电极反应式为
,电极反应式为
。
。
O 32 2O 答案 (1)阳极 CO(NH2)2+8OH--6e- N2↑+C +6H
2 2
(2)电镀和电解精炼铜
(3)电冶金
a.原理:利用电解原理使矿石中的金属离子获得电子,从它们的化合物中 还原出来。 b.适用范围:制取活泼金属单质,如电解NaCl、MgCl2、Al2O3制取Na、 Mg、Al,化学方程式分别为: 2NaCl(熔融)
(北京专用)2019版高考化学一轮复习 热点题型九 电化学作业

热点题型九电化学1.某燃料电池的工作原理如图所示,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。
下列说法正确的是( )A.该电池放电时K+向石墨Ⅰ电极迁移B.石墨Ⅰ附近发生的反应:NO2-e-+N N2O5C.O2在石墨Ⅱ附近发生氧化反应,Y为NOD.相同条件下,放电过程中消耗的NO2和O2的体积比为2∶12.电池式氧传感器原理构造如图所示,可测定O2的含量。
工作时铅电极表面会逐渐附着Pb(OH)2。
下列说法不正确的是( )A.Pt电极上发生还原反应B.工作时,电解液的pH逐渐减小C.消耗a mol O2,理论上可使Pb电极增重68a gD.Pb电极上的反应式为Pb+2OH--2e-Pb(OH)23.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。
下列叙述错误的是( )A.放电时,正极附近溶液的碱性增强B.充电时,锌电极与外电源正极相连C.放电时,每转移3 mol电子,正极有1 mol K2FeO4被还原D.充电时,阳极反应式为Fe(OH)3 -3e-+5OH-Fe+4H2O4.现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。
电解NaB(OH)4溶液可制备H3BO3,其工作原理如图。
下列叙述错误的是( )A.M室发生的电极反应为:2H2O-4e-O2↑+4H+B.a%<b%C.产品室发生的反应是B(OH+H3BO3+H2OD.理论上每生成1 mol产品,阴极可生成标准状况下5.6 L气体5.H2O2被称为绿色氧化剂。
下图是以甲烷燃料电池为电源,电解制备H2O2的示意图。
下列有关叙述中正确的是( )A.电解池装置应选择阳离子交换膜B.d 极的电极反应式为O2+2e-+2H+H2O2C.当有16 g甲烷参与原电池反应时,可制备4 mol H2O2D.工作时,a、c电极附近的pH均增大6.现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。
高考化学复习 电解池的工作原理及应用含答案及解析

电解池的工作原理及应用(时间:45分钟满分:100分)一、选择题(本题包括10小题,每小题6分,共60分,每小题只有一个选项符合题目要求)1.分析右图装置,下列说法错误的是( )A.虚线框中接直流电源,铁可能会被腐蚀B.虚线框中接灵敏电流计或接直流电源,锌都是负极C.虚线框中接灵敏电流计,该装置可将化学能转化为电能D.若电解质溶液为硫酸锌溶液并接上直流电源,该装置可用于铁皮上镀锌答案B解析若虚线框中接直流电源,且铁连接电源正极,此时铁作阳极,则会加快铁的腐蚀,A项正确;若虚线框中接直流电源,此时为电解池,锌是阳极或阴极,若虚线框中接灵敏电流计,锌是负极,B项错误;虚线框中接灵敏电流计,此时为原电池,可将化学能转化为电能,C项正确;若电解质溶液为硫酸锌溶液并接上直流电源,且铁电极连接电源负极,该装置可用于铁皮上镀锌,D项正确。
2.下列关于电化学知识的说法正确的是( )A.用石墨电极电解饱和食盐水,在阳极得到氯气,阴极得到金属钠B.电解精炼铜时,阳极减少的质量不一定等于阴极增加的质量C.用石墨电极电解FeCl3、CuCl2的混合溶液,在阴极上依次析出Al、Fe、CuD.用石墨电极电解CuSO4溶液一段时间后(Cu2+未反应完),加入适量Cu(OH)2可以使溶液恢复至原状态答案B解析用石墨电极电解饱和食盐水,阴极产生氢气,A错误;电解精炼铜时,阳极除铜放电外,比铜活泼的金属如Zn、Fe也放电,但阴极上只有Cu2+放电,B正确;根据金属活动性顺序可知,阴极上离子的放电顺序是Fe3+>Cu2+>H+>Fe2+>Al3+,不会析出铁和铝,C错误;电解CuSO4溶液,阴极析出Cu,阳极生成氧气,欲使溶液恢复至原状态应加入CuO,D错误。
3.用惰性电极电解下列物质的溶液,一段时间后(溶液过量),再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )A.CuCl2(CuSO4)B.NaOH(NaOH)C.NaCl(HCl)D.CuSO4[Cu(OH)2]答案C解析电解CuCl2溶液时,阴、阳两极放电的离子分别是Cu2+和Cl-,所以要恢复原状需加入CuCl2,A项错;电解NaOH溶液相当于电解水,要恢复原状需加水,B项错;电解NaCl溶液时,阴、阳两极放电的离子分别是H+、Cl-,故需加HCl才能恢复原状,C项正确;电解CuSO4溶液时,阴、阳两极的产物分别是Cu、O2,要恢复原状需加CuO或CuCO3,D项错。
2018——2019学年北京 高三化学一轮复习 电解的原理及其应用(无答案)

2018——2019学年北京高三化学一轮复习电解的原理及其应用(无答案)知识点:一、电解的原理1、实验现象:现象分析:2、电解池的两个极的确定3、活动电电极和惰性电极4、电解池内部离子定向移动的方向5、电解池两个极发生的反应6、电解的概念7、电解池8、离子放电顺序9、电解规律(用惰性电极电解)二、电解的应用1、 若X,Y 为石墨电极,电解质是饱和NaCl 溶液,在两个电极附近分别滴加酚酞溶液,则阴极的现象是: 产生此现象的原因: 阳极的现象是: 写出阳极反应: 总反应: 此过程利用便宜的NaCl 为原料,制备了 , , ,俗称 工业。
但是,使用上图装置反应,存在较大的缺陷,请指出:工业上的解决办法如右图:离子交换膜法电解原理示意图。
它的最大优点是 2.电镀池若要在铁件上镀铜,则上图中Y 电极是 ,反应式 X 电极是 ,反应式 ,电镀液是【小结】镀层金属做 极,待镀金属做 极,电镀液必须含有 阳离子, 电镀液中,该阳离子浓度如何变化?3.电解法精炼铜工业上,用热还原法制备粗铜,含有Zn,Fe,Ni,Ag,Au等金属杂质,利用电解原理将粗通转化为纯铜。
则上图装置中Y电极是,电极反应式有,,,X电极是,电极反应式,电解质溶液中铜离子浓度。
4.金属冶炼若上图装置中X,Y是惰性电极,电解质换为熔融的NaCl,MgCl2,可用于冶炼,,,Al等活泼金属。
请写出电解熔融MgCl2的电极反应和总反应:阴极阳极总反应三:电解总结:阳极:发生氧化反应还原性强的先反应还原性顺序为:活性电极>S2—>I—>Br—>Cl—>OH->含氧酸根离子>F—阴极:发生还原反应氧化性强的先反应Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+>活性电极注意:(1)阳极若是活性电极,则是活性电极失去电子被氧化,若为惰性电极则考虑阴离子放电(2)阴极任何时候都是阳离子放电典型例题:例1右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
(北京专用)2019版高考化学一轮复习 第19讲 电解原理及应用作业

第19讲 电解原理及应用A 组 基础题组1.(2018北京海淀期末)电解Na 2CO 3溶液制取NaHCO 3溶液和NaOH 溶液的装置如下图所示。
下列说法中,不正确...的是()A.阴极产生的物质A 是H 2B.溶液中Na +由阳极室向阴极室迁移 C.阳极OH -放电,H +浓度增大,C转化为HCD.物质B 是NaCl,其作用是增强溶液导电性2.(2018北京朝阳期末)高铁酸钠(Na 2FeO 4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。
实验室以石墨和铁钉为电极,以不同浓度的NaOH 溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:下列说法不正确...的是( ) A.a 为铁钉,b 为石墨 B.阴极主要发生反应:2H 2O+2e-H 2↑+2OH -C.高浓度的NaOH溶液有利于发生Fe-6e-+8OH-Fe+4H2OD.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体3.(2017北京东城期末,11)氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如下图所示:下列叙述不正确...的是( )A.b极附近溶液的pH增大B.a极发生的反应为2H2O-4e- O2↑+4H+C.该法制备LiOH还可得到硫酸和氢气等产品D.当电路中通过1 mol电子时,可得到2 mol LiOH4.如下图所示,请按要求回答下列问题。
(1)打开K2,关闭K1。
A为(填“正”或“负”)极,在该电极可观察到的现象是;B极的电极反应式为。
(2)打开K1,关闭K2。
A为(填“阴”或“阳”)极,在该电极可观察到的现象是;B极的电极反应式为;当有0.2 mol电子转移时,则析出铜的质量为g。
B组提升题组5.(2017北京海淀一模,10)实验室模拟工业制备高纯铁。
用惰性电极电解FeSO4溶液制备高纯铁的原理如下图所示。
下列说法的是( )A.阴极主要发生反应:Fe2++2e- FeB.向阳极附近滴加KSCN溶液,溶液变红C.电解一段时间后,阴极附近pH减小D.电解法制备高纯铁总反应:3Fe2+ Fe+2Fe3+6.(2017北京朝阳一模,10)在一定条件下,用石墨电极电解0.5 mol/L CuSO4溶液(含H2SO4),监测到阳极附近pH随时间变化关系如下图。
北京四中网校高考化学一轮复习 电解原理及其应用综合

电解原理及其应用综合能力测试第I 卷(选择题,共60分)一、选择题(本题包括5小题,每小题只有一个正确答案,5×4=20分)1.某氯碱厂不慎有大量氯气逸出周围空间,此时,可以用浸有某种物质的一定浓度的水溶液的毛巾捂住鼻子。
最适宜采用的物质是( )A.NaOHB.NaClC.KBrD.Na2CO32.1L0.1mol/LAgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断(设电解按理论进行,溶液不蒸发)正确的是( )A.溶液的浓度变为0.08mol/LB.阳极上产生112mLO2(标准状况)C.转移的电子数是1.204×1022个D.反应中有0.01mol的Ag被氧化3.用质量均为100g的铜做电极,电解AgNO3溶液。
电解一段时间后,两电极上的质量差为28g。
则两极的质量分别为( )A.阳极100g,阴极128gB.阳极93.6g,阴极121.6gC.阳极91.0g,阴极119.0gD.阳极86.0g,阴极114.0g4.四个电解装置都以Pt做电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是( )二、选择题(本题包括10小题,有1-2个正确答案,10×4=40分)5.电解硫酸溶液时,放出25mL(标况)O2,若以等量的电量在同样条件下电解盐酸溶液,所放出的气体的体积最接近下列数据中的( )A.45mLB.50mLC.75mLD.100mL6.用惰性电极电解pH=6的CuSO4溶液500mL,当电极上有16mg铜析出时,溶液(设电解前后溶液体积变化可忽略,阴极上无H2析出)的pH约为( )A.1B.3C.6D.97.用指定材料做阳极和阴极来电解一定浓度的溶液甲,然后加入物质乙能使溶液恢复为甲溶液原来的浓度,则合适的组合是( )阳极阴极溶液甲物质乙A Pt Pt NaOH NaOH固体B Pt Pt H2SO4H2OC Pt Pt NaCl NaOHD 粗铜精铜CuSO4Cu(OH)28.如图所示,四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑水解和溶液的体积变化)( )A.①<③<②<④B.②<①<③<④C.②<①<④<③D.①<②<④<③9.用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前浓度的是( )A.AgNO3B.Na2SO4C.CuCl2D.KCl10.将两个铂电极插入500mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积的变化)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第19讲 电解原理及应用A 组 基础题组1.(2018北京海淀期末)电解Na 2CO 3溶液制取NaHCO 3溶液和NaOH 溶液的装置如下图所示。
下列说法中,不正确...的是()A.阴极产生的物质A 是H 2B.溶液中Na +由阳极室向阴极室迁移 C.阳极OH -放电,H +浓度增大,C转化为HCD.物质B 是NaCl,其作用是增强溶液导电性2.(2018北京朝阳期末)高铁酸钠(Na 2FeO 4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。
实验室以石墨和铁钉为电极,以不同浓度的NaOH 溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:下列说法不正确...的是( ) A.a 为铁钉,b 为石墨 B.阴极主要发生反应:2H 2O+2e-H 2↑+2OH -C.高浓度的NaOH溶液有利于发生Fe-6e-+8OH-Fe+4H2OD.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体3.(2017北京东城期末,11)氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如下图所示:下列叙述不正确...的是( )A.b极附近溶液的pH增大B.a极发生的反应为2H2O-4e- O2↑+4H+C.该法制备LiOH还可得到硫酸和氢气等产品D.当电路中通过1 mol电子时,可得到2 mol LiOH4.如下图所示,请按要求回答下列问题。
(1)打开K2,关闭K1。
A为(填“正”或“负”)极,在该电极可观察到的现象是;B极的电极反应式为。
(2)打开K1,关闭K2。
A为(填“阴”或“阳”)极,在该电极可观察到的现象是;B极的电极反应式为;当有0.2 mol电子转移时,则析出铜的质量为g。
B组提升题组5.(2017北京海淀一模,10)实验室模拟工业制备高纯铁。
用惰性电极电解FeSO4溶液制备高纯铁的原理如下图所示。
下列说法的是( )A.阴极主要发生反应:Fe2++2e- FeB.向阳极附近滴加KSCN溶液,溶液变红C.电解一段时间后,阴极附近pH减小D.电解法制备高纯铁总反应:3Fe2+ Fe+2Fe3+6.(2017北京朝阳一模,10)在一定条件下,用石墨电极电解0.5 mol/L CuSO4溶液(含H2SO4),监测到阳极附近pH随时间变化关系如下图。
下列说法的是( )A.ab段,通电瞬间,阳离子向阴极移动B.电解过程中,阳极发生的电极反应是2H2O-4e- 4H++O2↑C.bc段,H+向阴极的移动速率大于其在阳极的生成速率D.bc段,pH下降过程中,阴极发生的主要电极反应是Cu2++2e- Cu7.(2018北京海淀期末)电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(Ⅵ)是主要污染物,可采用多种方法处理将其除去。
查阅资料可知:①在酸性环境下,Cr(Ⅵ)通常以Cr2的形式存在:Cr2+H2O2Cr+2H+②Cr2的氧化能力强于Cr③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:Ⅰ.腐蚀电池法(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。
下列关于焦炭的说法正确的是(填字母序号)。
a.作原电池的正极b.在反应中作还原剂c.表面可能有气泡产生Ⅱ.电解还原法向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。
装置如图所示:(2)A极连接电源的极,A极上的电极反应式是。
(3)电解开始时,B极上主要发生的电极反应为2H++2e-H2↑,此外还有少量Cr2在B极上直接放电,该反应的电极反应式为。
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中Cr元素去除率的关系如下图所示。
①由图知,电解还原法应采取的最佳pH范围为。
a.2~4b.4~6c.6~10②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:。
8.(2017北京西城一模,27)以黄铜矿(主要成分为二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+ Cu2++5Fe2++2S。
(1)该反应中,Fe3+体现性。
(2)上述总反应的原理如下图所示。
负极的电极反应式是。
(3)一定温度下,控制浸取剂pH=1,取三份相同质量的黄铜矿粉末分别进行如下实验:①对比实验Ⅰ、Ⅱ,通入空气,Cu2+浸出率提高的原因是。
②由实验Ⅲ推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:ⅰ.CuFeS2+4Ag+ Fe2++Cu2++2Ag2Sⅱ.Ag2S+2Fe3+ 2Ag++2Fe2++S为证明该催化原理,进行如下实验:a.取少量黄铜矿粉末,加入少量0.000 5 mol·L-1Ag2SO4溶液,充分混合后静置。
取上层清液,加入稀盐酸,观察到溶液中,证明发生反应ⅰ。
b.取少量Ag2S粉末,加入溶液,充分混合后静置。
取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ⅱ。
(4)用实验Ⅱ的浸取液电解提取铜的原理如图所示:①电解初期,阴极没有铜析出。
用电极反应式解释原因: 。
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是。
答案精解精析A组基础题组1.D A项,由图分析可知,阴极室H+得到电子生成H2,所以物质A为H2;B项,Na+为阳离子,可以通过阳离子交换膜向阴极移动;C项,阳极室OH-放电生成O2,同时c(H+)增大,与C结合生成HC;D项,若B是NaCl,则阴极室产物为氢氧化钠和氯化钠的混合液,与题干不符,所以B应为NaOH,增强溶液的导电性。
2.D A项,制备高铁酸钠需要铁在阳极放电,发生氧化反应,即a为铁钉,b为石墨;B项,电解池的阴极为阳离子放电,水电离的H+放电能力强于Na+,故阴极的电极反应为2H 2O+2e-H2↑+2OH-;C项,观察实验现象,碱性越强,越易生成Fe,故高浓度的NaOH溶液有利于发生Fe-6e-+8OH-Fe+4H 2O;D项,若选用饱和NaCl溶液,在阳极Cl-放电能力强于OH-,会更容易产生气体。
3.D 根据离子的移动方向可推出,石墨a是阳极,石墨b是阴极;a极发生氧化反应,即2H 2O-4e-O2↑+4H+,H+结合S得硫酸;b极H+得电子放出氢气,c(OH-)增大,溶液的pH增大,OH-结合Li+生成LiOH;由得失电子守恒知,电路中通过1 mol电子时,得到1 mol LiOH。
4.答案(1)负A极金属不断溶解Cu2++2e- Cu(2)阴A极上有红色金属析出Cu-2e- Cu2+ 6.4- Zn2+;B为正极,发生还原反应生解析(1)打开K成铜,电极反应式为Cu2++2e- Cu。
(2)打开K 1,关闭K2,形成电解池,B为阳极,电极反应式为Cu-2e- Cu2+;A为阴极,电极反应式为Cu2++2e- Cu,该极上析出金属铜,当有0.2 mol电子转移时,析出铜的质量为 6.4 g。
B组提升题组5.C 依据题意和装置图可知,电解硫酸亚铁溶液阴极生成铁,阳极生成Fe3+,电解的总反应方程式是3Fe2+ Fe+2Fe3+;阴极的电极反应式是Fe2++2e- Fe,电解一段时间后,阴极附近Fe2+的浓度降低,酸性减弱,pH增大;阳极的电极反应式是Fe2+-e- Fe3+,因此阳极附近滴加硫氰化钾溶液后溶液变红。
6.C A项,通电后形成电解池,在电解质溶液中阳离子移向阴极;B项,阳极上H2O失去电子发生氧化反应,电极反应为2H 2O-4e- 4H++O2↑;C项,bc段溶液的pH减小,则c(H+)增大,所以氢离子的生成速率大于移动速率;D项,Cu2+的得电子能力强于H+,所以bc 段阴极主要发生反应Cu2++2e- Cu。
7.答案(1)ac(2)正Fe-2e-Fe2+(3)Cr 2+6e-+14H+2Cr3++7H2O(4)①b②曲线Ⅰ的pH较小,此时Cr(Ⅳ)被还原生成的Cr3+难以生成Cr(OH)3沉淀,仍以Cr3+形式存在于溶液中,导致去除率较低;曲线Ⅳ的pH较大,铬元素主要以Cr形式存在,其氧化能力弱于Cr2,Cr(Ⅳ)难以被还原继而生成沉淀,导致去除率较低解析(1)铁屑与焦炭形成原电池,铁作负极,焦炭作正极,主要是Cr2在正极得到电子,因为溶液显酸性,H+也可能在正极得到电子生成氢气,所以焦炭表面可能有气泡。
(2)B极生成氢气,因此是阴极,所以A为阳极,连接电源正极,电极反应式为Fe-2e-Fe2+。
(3)B极是阴极,得到电子发生还原反应,因为是酸性环境,则电极反应式为Cr 2+6e-+14H+2Cr3++7H2O。
(4)①由图知,pH=4和pH=6时去除率高,因此电解还原法应采取的最佳pH范围为4~6。
8.答案(1)氧化(2)CuFeS 2-4e- Fe2++2S+Cu2+(3)①通入O 2后,发生反应4Fe2++O2+4H+ 4Fe3++2H2O,c(Fe2+)降低,c(Fe3+)升高,总反应的平衡正向移动②a.无明显现象b.pH=1的0.10 mol·L-1Fe2(SO4)3(4)①Fe3++e- Fe2+②Fe2+在阳极失电子生成Fe3+:Fe2+-e- Fe3+,S通过阴离子交换膜进入阳极室,Fe 2(SO4)3溶液再生3+ Cu2++5Fe2++2S中,Fe3+转化为Fe2+,铁元素化合价降低,Fe3+作氧化剂,解析(1)在反应CuFeS表现氧化性;(2)观察图像知,CuFeS 2在负极失去电子,被氧化,负极的电极反应式是CuFeS2-4e- Fe2++2S+Cu2+;(3)①对比实验Ⅰ、Ⅱ,通入空气后,发生反应4Fe2++O 2+4H+ 4Fe3++2H2O,c(Fe2+)降低,c(Fe3+)升高,总反应的平衡正向移动,故Cu2+浸出率提高;②a.若发生反应ⅰ,则上层清液中无Ag+,加入稀盐酸,溶液中无明显现象;b.若要发生反应ⅱ,则需加入Fe3+,根据实验Ⅲ可知,应加入pH=1的0.10 mol·L-1Fe2(SO4)3溶液。
取上层清液,加入稀盐酸,有白色沉淀,说明上层清液中含有Ag+,可证明发生了反应ⅱ;(4)①由于Fe3+的得电子能力强于Cu2+,因此电解初期溶液中的Fe3+在阴极得到电子生成Fe2+;②阴极室的流出液中含有Fe2+,将流出液送入阳极室后,Fe2+在阳极失电子生成Fe3+:Fe2+-e- Fe3+,S通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生。
