硫酸工业
高中化学知识点—硫酸工业

高中化学知识点规律大全——硫酸工业(1)环境保护与原料的综合利用.化工生产必须保护环境,严格治理“三废”(废气、废水、废渣),并尽可能把“三废”变为有用的副产品,实现原料的综合利用.①尾气吸收.尾气中含有的SO2气体可用氨水吸收:SO2 + 2NH3 + H2O = (NH4)2SO3(NH4)2SO3 + H2SO4 = (NH4)2SO4 + SO2↑ + H2O经反应得到的SO2气体可再进入硫酸厂循环利用,(NH4)2SO4可作肥料.②污水处理.生产过程中的污水里含有的H2SO4等杂质,可用石灰乳中和处理:Ca(OH)2 + H2SO4 = CaSO4 + H2O③废渣的利用.黄铁矿矿渣可作为制造水泥原料或用于制砖;含铁品位高的矿渣,经处理后可炼铁.(2)能量的充分利用.硫酸生产过程中的化学反应都是放热反应,可充分利用这些反应放出的热能(称之为“废热”)来降低生产成本.例如,在沸腾炉旁设置“废热”锅炉,产生蒸汽来发电;在接触室中设热交换装置,利用SO2氧化为SO3时放出的热量来预热即将参加反应的SO2和O2使其达到适宜的反应温度.因此,在生产中充分利用“废热”,不仅不需要由外界向硫酸厂供给能量,而且还可以由硫酸厂向外界输出大量的能量.(3)生产规模和厂址选择.一般来说,现代化工生产要求有较大的生产规模.化工厂厂址的选择,涉及原料、水源、能源、土地供应、市场需求、交通运输和环境保护等诸多因素,应对这些因素综合考虑,权衡利弊,才能作出合理的选择.由于硫酸是腐蚀性液体,不便贮存和运输,因此要求把硫酸厂建在靠近硫酸消费中心的地区.工厂规模的大小,主要由硫酸用量的多少来决定.硫酸厂选址应避开人口稠密的居民区和环境保护要求高的地区.高中化学知识点——硫酸工业第 1 页共 1 页。
硫酸的工业制法
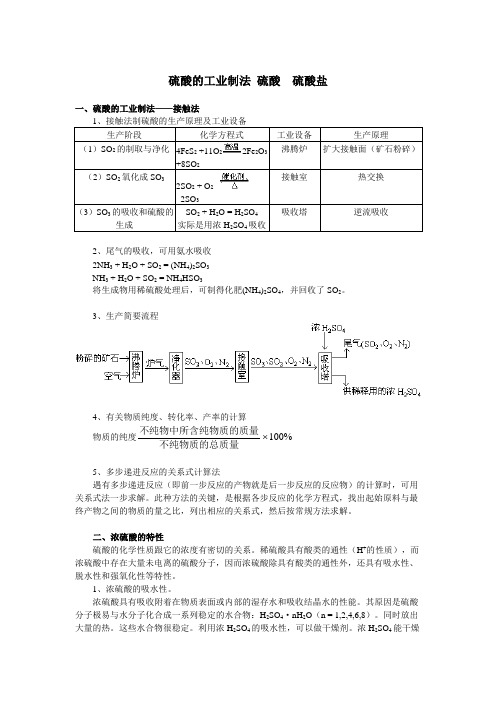
硫酸的工业制法硫酸硫酸盐一、硫酸的工业制法——接触法1、接触法制硫酸的生产原理及工业设备生产阶段化学方程式工业设备生产原理(1)SO2的制取与净化4FeS2+11O22Fe2O3+8SO2沸腾炉扩大接触面(矿石粉碎)(2)SO2氧化成SO32SO2 + O22SO3接触室热交换(3)SO3的吸收和硫酸的生成SO2 + H2O = H2SO4实际是用浓H2SO4吸收吸收塔逆流吸收2、尾气的吸收,可用氨水吸收2NH3 + H2O + SO2 = (NH4)2SO3NH3 + H2O + SO2 = NH4HSO3将生成物用稀硫酸处理后,可制得化肥(NH4)2SO4,并回收了SO2。
3、生产简要流程4、有关物质纯度、转化率、产率的计算物质的纯度不纯物中所含纯物质的质量不纯物质的总质量100%5、多步递进反应的关系式计算法遇有多步递进反应(即前一步反应的产物就是后一步反应的反应物)的计算时,可用关系式法一步求解。
此种方法的关键,是根据各步反应的化学方程式,找出起始原料与最终产物之间的物质的量之比,列出相应的关系式,然后按常规方法求解。
二、浓硫酸的特性硫酸的化学性质跟它的浓度有密切的关系。
稀硫酸具有酸类的通性(H+的性质),而浓硫酸中存在大量未电离的硫酸分子,因而浓硫酸除具有酸类的通性外,还具有吸水性、脱水性和强氧化性等特性。
1、浓硫酸的吸水性。
浓硫酸具有吸收附着在物质表面或内部的湿存水和吸收结晶水的性能。
其原因是硫酸分子极易与水分子化合成一系列稳定的水合物:H2SO4·nH2O(n = 1,2,4,6,8)。
同时放出大量的热。
这些水合物很稳定。
利用浓H2SO4的吸水性,可以做干燥剂。
浓H2SO4能干燥H 2、O 2、CO 等中性气体,也能干燥SO 2、Cl 2、CO 2、HCl 、HF 等酸性气体;但不能干燥NH 3等碱性气体,也不能干燥HBr 、HI 、H 2S 等有强还原性的气体。
2、浓硫酸的脱水性。
硫酸的工业制备

硫酸的工业制备
硫酸工业制备的原料主要有过氧化物及二氧化硫。
过氧化物包括氢过氧化物、铵、氧酸、硝酸铵和四氧化三铁等。
主要反应原料氢过氧化物和二氧化硫的反应,二氧化硫的来源可以为固体硫、硫酸钠或硫酸钙等,它可以从焦炭、石油精制和硫铝铁矿中获得。
1. 准备原料:首先将氢氧化物与二氧化硫混合,或氢氧化物与硫酸钠混合,或硝酸铵和二氧化硫混合。
2. 加热:然后将混合物加热,达到相应的反应温度,在高温条件下反应,当温度高于150℃时,反应速度加快。
3. 离心速度: 在硫酸分馏、冷却的工艺中,需要不断调整离心机的转速,使结晶硫酸分馏出,以确保其纯度。
4. 冷却:冷却后,在离心机中继续旋转,使结晶分离形成结晶硫酸。
5. 成品:结晶硫酸经过纯化提炼处理,调整到特定的含量,并进行包装,成品硫酸可用于制造化学药品、陶瓷、农业化肥等。
1. 在操作过程中应控制反应温度,防止反应温度过高,以免影响反应的进行。
3. 在硫酸的提炼处理和包装时,应遵循相关程序,并对硫酸的存储、运输以及使用应把握在合理的范围之内,以确保硫酸的质量和安全。
高中化学:硫酸工业

3、燃烧黄铁矿为什么不要多加燃料?
4、为什么要净化炉气?
二、用化学原理来研究装置和操作
2SO2+O2 V=2=O==5 2SO3 ;△H= -196.6kJ/mol
接 讨论: 根据反应速率和化学平衡理论,考虑综合经济效益,
触 你认为采取哪些措施(催化剂、浓度、温度、压强)可以提高
室 SO2的利用率?
思考3:在吸收塔中填入了大量瓷环的作用
增大SO3和H2SO4的接 触面积,强化吸收过程.
三、硫酸工业三废处理
思考:硫酸生产中产生的“三废 ”(废气、废水、废渣)处理
废气: 尾气:SO2 、O2 、N2。由于含有SO2,如直接排入大气,会 造成污染;同时也会造成原料的浪费。如何处理尾气?
1.将尾气再次通入到接触室,进行再次氧化,吸收;
浓度:增大廉价原料的用量以增大O2的浓度,
可以提高SO2的利用率,从而降低生产成本。
低温
SO2 O2
压强:常压下400℃-500℃时,SO2的转化率 高温 已经很高。 SO2 O2 温度:从平衡角度看,此反应在较低温度下进
行最为有利,但温度低时催化剂活性不高,反
SO3 SO2 O2 应速率低,从综合经济效益考虑,对生产不利。 故在实际生产中,选定450℃左右。
3.废渣
感谢观看
废渣: 含铁品位高(>45%)的矿渣,经处理后可以炼 铁、制造硫酸铁、氧化铁红颜料等产品。 黄铁矿矿渣一般可作为制造水泥的原料或用于制砖
化工生产必须保护环境,严格治理 “三废”,并尽可能把“三废”变为 有用的副产品,实现原料的综合利用。
四、小结
1.速率 效益
2.转化率
工业上制硫酸要考虑两个方面:
1.废气 环保 2.废液
硫酸工业

3 FeS2+8O2= Fe3O4+6 SO2+Q
§5.2 二氧化硫炉气的制备
(3)产物: 炉气——硫与氧化合生成的SO2及其他气体(过 量O2、空气带入的N2、和水蒸气)的统称; 炉渣——即烧渣,铁与氧化合生成的氧化物及其 他固态物; 杂质——硫铁矿中含铜、铅、锌、钴、镉、砷、 硒等的硫化物,铜、锌、钴、镉的氧化物留在炉 渣中,而PbO, As2O3, SeO2则一部分或全部成为 气态,随炉气进入制酸系统;若矿石中含有氟化 物,则HF 也会进入炉气。
90年代初,世界硫酸生产的原料构成为:
硫黄 黄铁矿 其他
65%
16%
19%(有色冶金烟气占3/4)
•说明:从基建投资、加工费用及环境保护等方面考 虑,硫黄制酸装置均优于硫铁矿制酸装置。只要能 以合理的价格得到硫黄,通常硫黄则是制硫酸的首 选材料。世界硫酸产量的60%以上来自硫黄。另一 方面,由于有色冶金工业的发展和日趋严格的环保 法规,有色金属冶炼烟气制酸的产量逐年增加。相 反,硫铁矿制酸的比重却呈下降趋势。
•如:电解法制锌,首先需将闪锌矿焙烧,其烟道气里 就含有大量二氧化硫,是制造硫酸的原料. 2ZnS+3O2=2ZnO+2SO2↑ •再如:用铜的硫化物炼铜时,烟道气里亦含有7~10 %的SO2和0.3~0.5%的SO3.就炼铜厂来说,从原料 到成品,每生产1t铜,同时可获得7.3t SO2,进而可制 得10t H2SO4.可见综合利用的经济价值大,同时也减 少了对空气的污染,改善了环境卫生.
种类 硫铁矿(我 国) 硫磺 含硫工业废物
原料来源
有色金属冶炼产 普通硫铁矿 石油、天 生的含有SO2的 含煤硫铁矿 烟气 然气净制 时回收 煤炼焦过程产生 浮选尾砂 的H2S
硫酸工业环境保护

利用吸收剂与废气中的有害物质发生化学 反应或物理吸附,将其从气相转移到液相 或固相,适用于处理中低浓度废气。
催化法
膜分离法
在催化剂作用下,使废气中的有害物质与 氧化剂发生氧化反应,转化为无害物质, 具有反应温度低、处理效率高等优点。
利用膜的选择透过性,将废气中的有害物 质与空气分离,适用于处理低浓度废气, 具有能耗低、无二次污染等优点。
固废资源化利用途径
01
02
03
04
生产建材
利用废渣、废水处理污泥等固 废生产水泥、砖块等建筑材料
,实现资源化利用。
回收有价元素
通过废渣、废催化剂等固废中 提取硫、铁、贵金属等有价元
素,实现资源回收利用。
生产肥料
将固废中的有机物和营养元素 转化为肥料,用于农业生产,
提高土壤肥力。
其他应用
探索固废在陶瓷、玻璃等领域 的应用,拓宽资源化利用途径
环境保护提供了基本的法律保障。
《中华人民共和国大气污染防治法》
02
对大气污染防治进行了全面规定,要求硫酸工业企业必须采取
有效措施,减少大气污染物的排放。
《中华人民共和国水污染防治法》
03
对水污染防治进行了详细规定,硫酸工业企业必须严格控制废
水排放,确保废水处理达标后排放。
硫酸工业污染物排放标准
大气污染物排放标准
规定了硫酸工业企业大气污染物排放 的限值、监测和监管要求,包括二氧 化硫、氮氧化物、颗粒物等污染物的 排放浓度和排放量。
水污染物排放标准
规定了硫酸工业企业废水排放的限值 、监测和监管要求,包括pH值、化学 需氧量、氨氮、重金属等污染物的排 放浓度和排放量。
企业环保责任与义务
01
高中化学硫酸工业

有关化学“硫酸工业”的介绍
有关化学“硫酸工业”的介绍如下:
硫酸工业在化学工业中具有悠久的历史,它广泛用于各个工业部门,主要有化肥工业、冶金工业、石油工业、机械工业、医药工业、洗涤剂的生产、军事工业、原子能工业和航天工业等。
硫酸还用于生产染料、农药、化学纤维、塑料、涂料,以及各种基本有机和无机化工产品。
硫酸的生产方法主要有两种:硫磺燃烧法、硫铁矿燃烧法。
其中,硫磺燃烧法是最早的硫酸生产方法,至今仍占一定比例。
硫磺燃烧法的反应原理是:硫磺在空气中燃烧,生成二氧化硫,再与氧气反应生成三氧化硫,最后用98.3%的浓硫酸吸收三氧化硫,得到硫酸。
硫酸的浓度主要有两种:浓硫酸和稀硫酸。
浓硫酸(98.3%)具有吸水性、脱水性、强氧化性等特性,可以用于某些化学反应的催化剂和脱水剂。
稀硫酸则主要用于金属表面除锈、清洗等。
硫酸工业的生产流程主要包括原料准备、燃烧、吸收、尾气处理等步骤。
在生产过程中,需要控制好温度、压力等参数,保证产品质量和安全。
同时,还需要注意环境保护,采取有效的措施减少废气、废水和固废的产生和排放。
总之,高中化学硫酸工业是一个重要的知识点,需要学生掌握其基本概念、生产方法、浓度分类和用途等方面的知识。
同时,还要注意与其他相关知识点进行联系和比较,加深对整个化学学科的理解和掌握。
工业化学-第二章硫酸工业

第
2
章
硫酸工业
2.2 二氧化硫炉气的制备
2.2.2 硫铁矿沸腾焙烧的主要操作条件
2、矿料粒度——颗粒大小及其分布
颗粒愈小,与氧接触面积愈大,而生成的氧化铁层愈薄,
因而反应速度愈快,矿渣残硫量愈低。
颗粒大小分布愈均匀,愈不易发生粗颗粒沉积于床层下部, 使焙烧效果降低的问题;粒度过细会增加炉气含尘量。一般, 平均粒度为0.24~0.70mm。
硫酸产能的增长
80000 70000 60000 50000 40000 30000 20000 10000 0 2002年 总计 2003年 2004年 硫铁矿制酸 2005年 烟气制酸 2006年 其它 硫磺制酸
硫酸产能比例
21%
1% 48%
30%
硫磺制酸
硫铁矿制酸
烟气制酸
其它
二氧化硫的制取 黄铁矿的沸腾焙烧
4FeS2 + 11O2 = 8SO2 + 2Fe2O3 + 3310kJ/mol
其放热量约为标准煤的23.6%,属强放热反应。在正常生产 条件下,反应热即可维持系统在高温下的热量平衡,而不必添
加燃料或其它能源。
2、焙烧反应是不可逆的气-固相非均相反应。 当温度足够高,氧气足够多,反应可进行完全。
第
沸腾炉的过渡段加入二次空气,可适当降低炉底风速,并有
利于使燃烧更加完全。
第
2
章
硫酸工业
2.3 炉气的净化
2.3.1 炉气净化的主要方法 1、炉气成分
SO2,N2,O2 及有害杂质:矿尘(可能堵塞设备和管道,
减低催化剂活性),As2O3(使催化剂中毒), SeO2(使催 化剂中毒,使成品带色), HF(腐蚀设备衬里、填料及催化
第三单元:硫酸工业

下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的, 下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何 采用98.3%的浓硫酸吸收三氧化硫。 的浓硫酸吸收三氧化硫。 采用 的浓硫酸吸收三氧化硫
试填写下列空白: 试填写下列空白: 制取SO 。 (1)写出工业上用 )写出工业上用FeS2制取 2的化学方程式 (2)写出上图中部分装置的作用:甲:①混合SO2和O2;②干燥SO 和O ) 写出上图中部分装置的作用: 混合 ; 干燥SO2 2 ③ 。丙和 观察气泡以调节通入SO 观察气泡以调节通入 2和O2体积比 吸收SO 吸收 3并做对照实验 丁: 。 (3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产 )若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化, 生这种现象的可能原因是: 丙中插入浓硫酸溶液的导管插得太深, 的吸收效果远好于水, 生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差 浓硫酸对SO 浓硫酸对 3的吸收效果远好于水, 较大,导致SO 从丁的水中冒了出来,与水形成酸雾; 较大,导致 3从丁的水中冒了出来,与水形成酸雾;② SO 充分被浓硫酸吸收 。 3 (4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当 )上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应, 接触室 吸收塔 于 ;丙和丁相当于 。 (5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的 是 。 A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧 .硫铁矿燃烧前需要粉碎, B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应 .从沸腾炉出来的炉气需净化, C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 .二氧化硫氧化为三氧化硫时需使用催化剂, D.三氧化硫用 .三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率 的浓硫酸吸收, 的浓硫酸吸收 目的是防止形成酸雾,
硫酸工业的基本流程

硫酸工业的基本流程一、概述硫酸工业涉及到把硫酸转化为具有航空航天、化学农业、特种化学品等多种用途的有效成分,以及其它一些特殊化学产品。
它主要是通过硫酸盐、硫酸盐及其它特殊混合物,进行不同程度高温点火和氧化反应,提炼出硫酸、硫酸盐及其它特殊硫酸盐,最后再在冷却及分离装置中对提炼出的结晶物进行进一步分离,从而获取所需成分的硫酸工业流程。
二、硫酸工业的基本流程1、碱蒸发碱蒸发是一种利用高温水蒸汽蒸发形成硫酸和碳酸钾的蒸发工艺。
这种工艺的原料主要是碱,如碳酸钠、碳酸钾、碳酸氢钠等,通过蒸发时的水蒸汽介质,将碱浸入水中,使碱分解,同时将硫酸等其它挥发物蒸发出来,经过收集处理,就可以得到所需的硫酸及其它挥发物,成为硫酸生产过程中的一项重要基础工艺。
2、碱化工艺碱化法是一种通过将碱溶液与酸溶液相互作用,在特定温度下将某些有机物转化成硫酸的化学反应工艺。
碱化法利用碱溶液中的碱化反应,将有机物转化成硫酸,其基本过程为:将有机物、碱溶液和氧化剂混合混合,然后加热搅拌到恒温;所需的硫酸就会按照室温和一定的渗透压力,从搅拌液中被蒸发出来;然后收集和过滤,从而获得所需的硫酸,并可用来生产特殊的化学物质。
3、水解反应水解反应是指通过水解适当比例的硫酸和硫酸盐,分解成水和硫酸等其它特殊硫酸盐的反应过程。
这种反应十分温和,并且能够较容易的得到硫酸的含量,需要将混合液放入反应桶,并在合适的温度下加热,待到水解反应结束时,就可以得到混合液中的硫酸和硫酸盐,进而经过进一步冷却及分离,可以获得所需的硫酸及其它硫酸盐。
4、冷冻干燥冷冻干燥是指将硫酸和硫酸盐经过液态状态转化成固态粉末状态的干燥工艺,这是硫酸工业生产过程中不可缺少的干燥工艺。
由于硫酸、硫酸盐及其它硫酸盐本身具有结晶特性,因此用水蒸气进行升温蒸发的方法不能获得完全结晶的物料,从而需要采用冷冻干燥的工艺,以获得高洁净度的结晶物料。
除此以外,还可以通过智能化、自动化技术完成硫酸工业的全部流程,从运输、操作、维护等方面提高效率,改进产品质量,从而提升硫酸工业整体的效益。
硫酸工业的基本流程

硫酸工业的基本流程
一、硫酸工业的基本流程
1、原料准备:硫酸工业的原料主要有硫磺、硫酸废物海水和渣滓。
硫磺主要来源于硫黄采矿、污泥和稀土矿的分离处理,或是硫磺贸易商。
硫酸废物海水主要来源于全球大规模的硫酸生产工厂,而渣滓则来源于供应商的处理厂或炼油厂。
2、焙烧:硫磺进入焙烧窑,温度控制在600~800℃,高温内化学反应发生,把硫磺转变成具有催化作用的硫酸钾和硫酸钠。
3、吸收:焙烧的硫酸钾和硫酸钠由精密分级过滤器过滤进入吸收塔。
在吸收塔中利用稀氨水的溶解力,将低温硫酸引发反应,使其反应转变为更高的硫酸,从而达到工业级别的高品位硫酸。
4、洗涤:硫酸可以经过洗涤处理,去除溶解性颜色物质和低聚的有机物,调整其表面张力值等。
5、结晶:经过洗涤处理的硫酸进入结晶器,在适当的温度和温度调整条件下,它会结晶出粒状的硫酸钾和硫酸钠,最终达到分离、净化、纯化的目的。
6、脱水:结晶后的硫酸粉除了可以被直接用于农药、发泡剂、印染料等行业外,还可以经过脱水处理获得硫酸晶体,以供制造一些特殊用途的产品。
7、熔炼:熔炼是硫酸工业的最后一步处理,它将硫酸晶体进行熔融,然后通过各种介质抽取需要的硫酸。
- 1 -。
硫酸工业ppt

沸腾炉也有一些缺点: 沸腾炉也有一些缺点:
主要是炉气中矿尘含量高,炉气净化工序的设备要求高,负荷重; 主要是炉气中矿尘含量高,炉气净化工序的设备要求高,负荷重; 设备要求高 需要采用压头较高的鼓风机,因而,动力消耗较大。 需要采用压头较高的鼓风机,因而,动力消耗较大。
4.4 炉气的净化和干燥
4.4.1 炉气净化的目的和净化原理
破碎 细碎 筛分
3.硫铁矿为原料生产硫酸的原则流程 3.硫铁矿为原料生产硫酸的原则流程 以硫铁矿为原料生产硫酸,主要经历以下三个化学反应: 以硫铁矿为原料生产硫酸,主要经历以下三个化学反应:
原料 工序
焙烧炉内焙烧
炉气净 化工序
转化器
吸收塔
以硫铁矿为原料水洗净化生产硫酸的原则流程,大致如下列框图所示。 硫铁矿为原料水洗净化生产硫酸的原则流程,大致如下列框图所示。 为原料水洗净化生产硫酸的原则流程
⑤按炉床截面积计算,焙烧强度可高达7~40t.(m.s2)-1; 按炉床截面积计算,焙烧强度可高达 40t.( 在沸腾层内固体矿料混合均匀,不易发生局部过热现象, ⑥在沸腾层内固体矿料混合均匀,不易发生局部过热现象,可允许反应温度 高达900℃以上; 900℃以上 高达900℃以上; 可以使用粒径小的碎块矿和有色金属矿的尾砂, ⑦可以使用粒径小的碎块矿和有色金属矿的尾砂,以及其他含硫量少的低品 位矿石为原料,有利于合理使用硫资源 合理使用硫资源; 位矿石为原料,有利于合理使用硫资源; 炉气中二氧化硫浓度高( 体积含量可达13%),而三氧化硫含量低 13%), ⑧炉气中二氧化硫浓度高(SO2体积含量可达13%),而三氧化硫含量低 在炉气中体积含量约为0.1% 0.3%), 0.1%~ ),有利于减少净化过程中硫的 (SO3在炉气中体积含量约为0.1%~0.3%),有利于减少净化过程中硫的 损失。 损失。
硫酸工业制法

②洗涤:除砷、硒等的化合物
③干燥:除水蒸气
② 二氧化硫氧化成三氧化硫 ----接触室 2SO2+O2=4V52=0O0C=5 2SO3+196.6kJ
回答下列问题:
(1)二氧化硫在什么条件下才能氧化成三氧化硫?
(2)这个反应是在什么设备中进行的?为什么?
(3)热交换器的作用是什么?
接触室
热交换器
② 二氧化硫氧化成三氧化硫----接触室 2SO2+O2=4V52=0O0C=5 2SO3+196.6kJ
2H2SO4
196 x×98%
练习:KKP102(7)
附件
流程图
H2SO4
硫酸的工业生产 硫酸工业生产流程动画
沸腾炉
接触室
吸收塔
净 化
冷却
沸
沸腾炉
腾
炉
接触室
低温
接
SO2 O2
触
室
高温 SO2 O2
SO3 SO2 O2
吸
收
吸收塔
塔
六、掌握多步计算的技能---(相当关系式计算) (原子守恒)
高温
4FeS2 +11 O2
2Fe2O3 + 8SO2
催化剂
2SO2 + O2 加 热 2SO3
(一)、反应原理:
S
FeS2=SO2= SO3 =H2SO4
(二硫化亚铁)
(二)、生产过程: 1. 二氧化硫的制取和净化:
(1)主要设备:沸腾炉
(2)主要反应:
4FeS2+11O2
还原剂 氧化剂
2Fe2O3+8SO2
既是氧化产物,又是还原产物
(3)炉气净化:三净化 (防止催化剂中毒) ①除尘:除矿尘
硫酸工业定义

硫酸工业定义硫酸工业是指以硫酸为主要产品的工业化生产过程。
硫酸是一种无机化合物,化学式为H2SO4,具有强酸性。
硫酸广泛应用于化学工业、冶金工业、电力工业、制药工业等领域,是许多产业的重要原料或中间体。
硫酸工业的发展可以追溯到古代。
早在中世纪,人们就开始使用硫酸来制造肥皂、染料和炼金术实验。
然而,真正的硫酸工业化生产始于18世纪末,随着工业革命的兴起和化学工业的发展,硫酸的生产技术不断改进和创新。
硫酸的生产方法有多种,其中最常见的是传统的接触法和浓缩法。
接触法是指将硫磺或硫矿石燃烧生成二氧化硫,再通过催化剂催化氧化反应得到三氧化硫,最终与水反应生成硫酸。
浓缩法则是通过利用稀硫酸(通常为废硫酸)来浓缩,从而得到高浓度的硫酸。
此外,还有一些其他的辅助生产方法,如电解法、氧化法等。
硫酸的应用领域非常广泛。
在化学工业中,硫酸是各种化肥、合成树脂、合成橡胶、合成纤维等的重要原料。
同时,硫酸也广泛应用于金属冶炼过程中的脱硫、除铁、除磷等工艺,以及电镀、电池等工业。
在电力工业中,硫酸被用于脱硫和脱硝技术,以减少燃煤发电厂的大气污染物排放。
此外,硫酸还被用于制药工业中的各种化学反应和药品制造过程中。
然而,硫酸工业也带来了环境和健康问题。
硫酸具有强酸性,容易与其他物质发生反应,产生有害气体和物质,对环境造成污染。
此外,硫酸的生产过程中,也会产生大量的废水、废气和废渣,需要进行处理和排放控制。
因此,硫酸工业需要采取严格的环境保护措施,以减少对环境的影响。
随着工业的快速发展,硫酸工业在中国取得了显著的成就。
中国是世界上最大的硫酸生产国之一,硫酸工业已经成为我国化学工业的重要组成部分。
在过去的几十年里,中国的硫酸工业经历了快速的扩张和技术进步,硫酸的品质和生产能力得到了大幅提升。
总之,硫酸工业是以硫酸为主要产品的工业化生产过程。
硫酸具有广泛的应用领域,但同时也带来了环境和健康问题。
因此,硫酸工业需要积极采取环境保护措施,促进可持续发展。
硫酸工业制法化学方程式

硫酸工业制法化学方程式硫酸,这玩意儿听着就有点吓人,对吧?可它可是工业界的“明星”,用处大得很!咱们今天就聊聊硫酸的工业制法,顺便说说这背后的化学方程式,嘿,别怕,咱不搞深奥的,咱轻松聊。
硫酸的生产,简单说就是把硫、氧和水搞到一起,经过几道工序,嘿,就能得到硫酸。
这其中的关键就在于硫的燃烧。
想象一下,咱把硫放在高温的环境里,它一碰到氧气,哗啦啦地燃烧起来,产生二氧化硫。
这可不是简单的烟雾,真的是一股浓烈的气体,闻了让人想打喷嚏。
不过,这可不是结束,咱得让这个二氧化硫再跟氧气来一场“约会”,这时就需要一个催化剂,通常是五氧化二磷,嘿,这家伙就像个红娘,把二氧化硫和氧气聚在一起,让它们亲密接触,形成三氧化硫。
哎,三氧化硫来了,这可真是个热心肠的家伙,它特别爱水。
一遇到水,就像干渴的游子见到故乡的河流,立马扑上去,咕噜咕噜地化成硫酸。
这个化学反应,看似简单,但可不是每个地方都能随便搞的,环境和条件得合适,才能顺利出产这位“硫酸大咖”。
如果你听到的硫酸的化学方程式是这样的:( S + O2 → SO2 ),然后再有 ( 2SO2 + O2 → 2SO3 ),最后( SO3 + H2O → H2SO_4 ),这可是一个完整的过程。
怎么样,简单吧?没啥高深的理论,真心简单到没朋友。
工业制硫酸可不止这些表面功夫。
还得考虑到设备的安全和效率,毕竟硫酸可不是善茬,弄不好可真是“无妄之灾”。
在高温高压下,得确保反应器的材质耐得住这火力,不能让它出问题。
想想看,反应器里冒着烟,嘶嘶作响,唉,那可真是个令人头疼的场景。
生产出来的硫酸,纯度高、质量好,才能在市场上站稳脚跟。
像什么肥料、清洁剂、电池液,全靠它的“保驾护航”。
所以,咱们的硫酸在生产过程中的每一个环节,都得小心翼翼,确保没有任何意外。
说到这里,不禁让我想起一句话:“细节决定成败”,在硫酸的世界里,这句话可真是实至名归。
硫酸不仅仅是工业的宠儿,它的化学特性也是让人惊叹的。
硫酸的工业制备

3S + 6KOH △ 2K2S + K2SO3 + 3H2O
H2S的性质
【1】无色,有臭鸡蛋气味,剧毒,能溶于水,水溶液称氢硫酸
【2】S为-2价,体现还原性,如 2H2S + SO2 = 2H2O + 3S 【3】能与O2发生反应 2H2S + 3O2 点燃 2H2O + 2SO2 (O2充足) 2H2S + O2 点燃 2H2O + 2S (O2不足) 【4】不稳定性 H2S △ H2 + S
硫酸的工业制备
接触法制硫酸
步骤一:硫铁矿→SO2
设备:沸腾炉 反应方程式:4FeS2 + 11O2 高温 2Fe2O3 + 8SO2
设备:接触室 反应方程式:2SO2 + O2 △催化剂 2SO3
设备:吸收塔 反应方程式:SO3 + H2O = H2SO4 实际先用98.3%的浓H2SO4吸收SO3,再用水稀释成各种浓度的 H2SO4
三设备:沸腾炉(制取SO2)、接触室(催化氧化SO2生成SO3)、 吸收塔(SO3的吸收)
硫酸制取的三设备
沸腾炉
接触室业尾气(SO2)处理
方法一:石灰石-石膏法 SO2 + Ca(OH)2 = CaSO3 + H2O 2CaSO3 + O2 = 2CaSO4
方法二:氨水法 SO2 + 2NH3·H2O = (NH4)2SO3 + H2O 2(NH4)2SO3 + O2 = 2(NH4)2SO4(一种氮肥)
S及含硫化合物的转化关系图
SO3
O2
H2O
O2(不足) H2S H2(Δ)
O2 S
工业制硫酸的三个步骤

工业制硫酸的三个步骤好啦,今天我们来聊聊一个非常重要的化学品——硫酸。
硫酸在我们的生活中可不是什么“花瓶”,它可是个大忙人,广泛应用于化工、冶金、农业等多个领域。
不过,生产硫酸的过程可不简单,分为三个关键步骤,我们一起来看看吧。
1. 硫的燃烧首先,咱们得从燃烧硫开始。
这一步就像给硫酸做个开场白,开个好头。
你想啊,硫的燃烧就像是在过节时放烟花,火焰熊熊,红彤彤的。
一般来说,我们把硫放进一个高温的炉子里,给它充足的氧气,嘿嘿,硫就开始“开Party”了。
燃烧过程中,硫和氧气结合,变成了二氧化硫。
这个二氧化硫就像是烟花的烟雾,飘散在空气中,给人一种“哇,这是什么神奇的东西”的感觉。
不过,燃烧硫可不是随便来的,这里面可是有讲究的。
温度得控制得当,氧气供应也要精准,太多太少都不行。
要是氧气不够,硫就会“闹脾气”,烧不完全;而氧气过多,就会浪费资源,得不偿失。
简而言之,硫的燃烧就像是一场完美的舞蹈,得把握好节奏。
2. 二氧化硫的转化接下来,进入第二步,二氧化硫的转化。
这一步就像是给硫酸换衣服,从一件简单的衣服换成华丽的礼服。
为了让二氧化硫变成更厉害的东西,我们得把它和氧气再“搭伙”,在高温高压的条件下进行反应。
这样一来,二氧化硫就会变成三氧化硫,真的是“脱胎换骨”啊。
而这个反应可不简单,它需要一个“催化剂”,就像是派对上的调解者,让二氧化硫和氧气能更好地结合。
通常,我们用的是五氧化二钒,它就像是一个超级“教练”,帮助二氧化硫们找对节奏,快速成团。
经过一番“热舞”,最终变成了三氧化硫。
这时候的三氧化硫就像是走上了时尚的T台,光彩夺目。
3. 硫酸的合成最后一步,硫酸的合成。
这就像是把所有的精彩瞬间凝聚在一起,最终形成一瓶美味的“魔法饮品”。
三氧化硫可不能单独行动,它得和水结合。
我们把三氧化硫缓缓地加入水中,嘿,眼看着就变成了浓浓的硫酸,真的是让人忍不住想给它点个赞。
不过,这一步也有点小“危险”。
三氧化硫和水反应的时候,会释放出大量的热量,俨然一场小型的火山爆发。
硫酸工业的原理

硫酸工业的原理硫酸工业是指以硫磺、铜矾等为原料,通过一系列的化学反应和工艺过程,制备出硫酸的一种工业生产过程。
下面我将用1200字以上的篇幅来详细介绍硫酸工业的原理。
硫酸工业的原理可以分为三个主要步骤:硫磺的氧化、二氧化硫的吸收和硫酸的制备。
首先是硫磺的氧化过程。
硫磺是硫酸工业中最主要的原料之一。
硫磺被加热到熔化状态,然后进入燃烧炉中,在高温条件下与氧气反应生成二氧化硫。
硫磺的燃烧方程式为:S + O2 →SO2。
硫磺氧化的温度通常为1200-1500,可以通过添加催化剂来降低反应的温度。
常用的催化剂有纳米二氧化钛、铂、铑等。
接下来是二氧化硫的吸收过程。
气态的二氧化硫通过冷却凝结成液态,然后被吸收到水中。
二氧化硫溶于水中形成亚硫酸溶液,反应方程为:SO2 + H2O ⇔H2SO3。
吸收过程通常使用接触吸收法进行,即将气体和吸收剂(水)接触,通过物质的扩散和溶解来实现气体的吸收。
吸收过程的温度和压力对吸收效果有一定的影响,通常较低的温度和较高的压力会提高二氧化硫的吸收率。
最后是硫酸的制备过程。
通过将亚硫酸溶液在反应器中进一步氧化,生成硫酸。
亚硫酸氧化为硫酸的反应方程为:2H2SO3 + O2 →2H2SO4。
亚硫酸氧化反应是一种放热反应,通常需要加热提高反应速率。
反应过程中,通常会加入催化剂以提高反应速率和产量,常用的催化剂有铂、铑、过渡金属等。
在硫酸工业中,硫酸是一种非常重要的化工原料,广泛应用于冶金、化学、制药等领域。
硫酸的生产过程中除了上述主要步骤外,还涉及到一些辅助工艺,如冷凝、干燥、蒸发等。
同时,硫酸的生产还存在一些环境污染问题,如二氧化硫的废气处理和废水处理。
因此,在硫酸工业生产过程中需要采取相应的环保措施,减少污染物的排放。
总结来说,硫酸工业的原理是通过硫磺的氧化、二氧化硫的吸收和硫酸的制备,完成硫酸的生产。
这个过程涉及到一系列的化学反应和工艺过程,其中涉及到温度、压力、pH值、催化剂等因素的控制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N2
思考:从接触室出来的 气体成分是什么?
接
触
室
从吸收塔中排出的气 体有那些成分?能否 直接排入大气?
吸 收 塔
思考:吸收
三氧化硫为什 么不用水和稀 硫酸,而用 98.3%的浓硫 酸?浓硫酸为 什么必须从塔 顶喷下?
小结:接触法制硫酸
三原理 化学反应速率理论 SO2的制备 三阶段 (造气)
速率、平衡理论、 热交换原理
沸腾炉 接触室 吸收塔
净 化 冷却
沸腾炉
思考: 思考:黄铁 矿石为什么 要粉碎?为 什么要通入 强大的空气 流? 空气 从沸腾炉出 来的炉气的 成分有哪些? 是否直接通 入接触室?
矿 渣
思考:此处出来的 气体是什么成分? 说说接触室中热 交换器的作用?
思考:怎样选择适宜的条件
温度:400至500摄氏度 压强:常压 催化剂:五氧化二矾
主题3
接触法制硫酸
硫酸的消费量是一个国家工业发达水平的一种标志
一、接触法制硫酸
第一步:造气 S + O 2
点燃
SO2 2Fe2O3 + 8SO2
高温
4FeS2 +11 O2
第二步:二氧化硫的催化氧化
2SO2 + O2
催化剂 加热
2SO3
第三步:三氧化硫的吸收
SO3 + H2O
H2ቤተ መጻሕፍቲ ባይዱO4
接触法制硫酸的工业流程
分数为:SO2 7%,O211%,N2 82%);
温度℃
压强MPa
400 500 600
0.1
99.2 93.5 73.7
0.5
99.6 96.9 85.8
1
99.7 97.8 89.5
10
99.9 99.3 96.4
(1) 已知SO2的氧化是放热反应,如何利用表中数据推断此结论? (2)在400~500℃时,SO2的催化氧化采用常压而不是高压,主要 原因是: (3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是 或“否”),是否可以增大该反应所放出的热量? (填“是”或 “否”); (4)为提高SO3吸收率,实际生产中用 吸收SO3; (5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ/mol,计 算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所 放出的热量。
逆流吸收原理
SO2的催化氧化
SO3的吸收
三设备
沸腾炉
接触室
吸收塔
三反应 S+O2=SO2
2SO2+O2=2SO3
SO3+H2O=H2SO4
4FeS2+11O2=2Fe2O3+8SO2
(2007年宁夏理综)31.化学选考题(15分)A.化学与技术 工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关 键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积
(2)污水处理 (3)废渣处理 Ca(OH)2 + H2SO4 = CaSO4 + 2H2O 制石膏 黄铁矿矿渣可用来制造水泥、砖和炼铁等。
2、 “废热”利用:能量充分利用 (1)在接触室中设热交换器,预热SO2和O2 。 (2)在沸腾炉旁设置“废热锅炉”,产生蒸汽发电;
三、硫酸厂厂址的选择
选择原则:靠近硫酸消费中心的地区,避开人 口稠密的居民区和环境保护要求高的地区。 例题:A、B、C、D四地的地 理位置如图,交通均较为便利, 其他地理条件如下:A地是风景 旅游城市;B地是硫酸消费中心; C地有较为丰富的黄铁矿资源; D地有少量的硫酸消费。硫酸厂 址应选择在 。 B
练习
1.工业上用接触法制硫酸时,从沸腾炉内导 出的炉气,要经过净化的理由是(B ) A.为了减少对大气的污染 B.防止催化剂中毒 C.炉气还含有一些其他有用成分,以便综合 利用 D.为了制得更纯的H2SO4
2.对于接触法制硫酸的生产操作与说明生 产操作的主要理由两者都正确的是 ( B D ) A.硫铁矿燃烧前需要粉碎,因为大块的硫 铁矿不能燃烧。 B.三氧化硫的吸收采取逆流的形式,目的 是增大其与吸收剂的接触面积。 C.二氧化硫氧化成三氧化硫时需使用催化 剂,这样可以提高二氧化硫的转化率。 D.三氧化硫用98.3%的浓硫酸吸收,目的 是防止形成酸雾,以便使其吸收完全 。
二、硫酸厂“三废”的处理及“废热” 处理 1、“三废”处理
(1)尾气吸收 ①用石灰乳SO2+Ca(OH)2=CaSO3+H2O CaSO3+H2SO4=CaSO4+SO2↑+H2O ②用氨水SO2+2NH3 +H2O = (NH4)2SO3
(NH4)2SO3 + H2SO4 = ( NH4)2SO4 + SO2↑+ H2O
