如何甄别络合物和螯合物
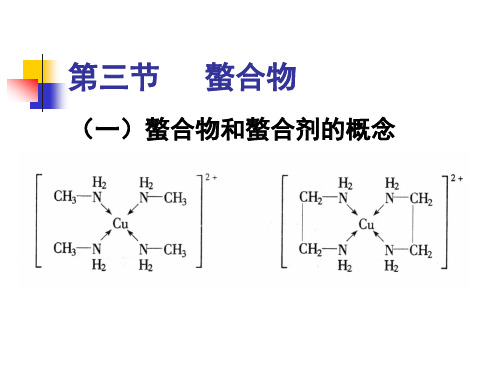
(一)螯合物和螯合剂的概念

二、氨羧螯合剂及氨羧 螯合滴定
(一)氨羧螯合剂的结构和特点 氨羧螯合剂中最重要同时应用最 广的是乙二氨四乙酸( 广的是乙二氨四乙酸(EDTA)及其 ) ),统称为 二钠盐 (EDTA-2Na),统称为 ), EDTA。结构如下: 。结构如下:
EDTA在水中溶解度小,故配制 在水中溶解度小, 在水中溶解度小 标准溶液时,常用它的二钠盐。 标准溶液时,常用它的二钠盐。 EDTA的分子或离子中含有 个氨基 的分子或离子中含有2个氨基 的分子或离子中含有 氮和4个羧基氧可与金属离子配合, 氮和4个羧基氧可与金属离子配合, 个羧基氧可与金属离子配合 生成具有5个五元环的稳定性很高的 生成具有 个五元环的稳定性很高的 螯合物。如下图: 螯合物。如下图:
溶液中螯合物的稳定性除决定于螯 合物稳定常数的大小外, 合物稳定常数的大小外,还与溶液 值有关。 的pH值有关。不同的金属离子与 值有关 EDTA生成的螯合物的稳定性不同, 生成的螯合物的稳定性不同, 生成的螯合物的稳定性不同 滴定时所需溶液的pH值也不同 值也不同。 滴定时所需溶液的 值也不同。因 此,在两种以上金属离子的混合溶 液中,常可以通过调节溶液的pH值 液中,常可以通过调节溶液的 值, 进行选择滴定。 用EDTA进行选择滴定。 进行选择滴定
例如, 离子和Zn 例如,在Mg2+离子和 2+离子的混合 溶液中,调节溶液的pH ≈ 6.8, 这时 溶液中,调节溶液的 , EDTA仍可与 Zn2+离子完全螯合,而与 离子完全螯合, 仍可与 Mg2+离子则完全不螯合,即Mg2+离子 离子则完全不螯合, 的存在不会干扰EDTA 对Zn2+离子的螯 的存在不会干扰 合滴定。 合滴定。 由于滴定时不断有离子的生成, 由于滴定时不断有离子的生成,为了 保持合适的pH值 使反应进行完全, 保持合适的 值,使反应进行完全,滴 定前必须加入合适的缓冲溶液控制溶液 的pH值。 值
第六章1络合物和螯合物

质子化常数
p169
形成常数----质子化常数 形成常数 质子化常数: 质子化常数 解离常数的倒数
6.1.4 EDTA螯合物 螯合物 EDTA与大多 与大多 数金属离子形 成螯合物时络 合比为1:1. 合比为
EDTA试剂 试剂 的性质和特点: 的性质和特点:
a. 配位能力强;氨氮和羧氧 配位能力强; 两种配位原子; 两种配位原子; b. 多元弱酸;EDTA可获得 多元弱酸; 可获得 两个质子,生成六元弱酸; 两个质子,生成六元弱酸; c. 与金属离子能形成多个多 元环,配合物的稳定性高; 元环,配合物的稳定性高; d. 与大多数金属离子 ∶1配 与大多数金属离子1∶ 配 位, 计算方便; 计算方便;
EDTA的螯合物特点 的螯合物特点
⒈配位性能广泛,络合物稳定 配位性能广泛,
O C H2 C N H2 C C O O O C O Co O H2 O C CH2 N CH2 C CH2 O
2.络合比 络合比(coordination)简单(一般为1∶1 ) 简单( 络合比 简单 ∶ 少数为2:1型 如 少数为 型 (如:Mo(Ⅴ) Ⅴ 酸度高时形成酸式鳌合物MHY 不稳定, 酸度高时形成酸式鳌合物 不稳定, 可忽略 酸度低时形成碱式鳌合物MOHY 酸度低时形成碱式鳌合物 可定性分析 3.络合物易溶于水 络合物易溶于水, 3.络合物易溶于水,与无色离子形成无色螯 合物,与有色离子形成颜色更深的螯合物。 合物,与有色离子形成颜色更深的螯合物。
简单配合物: 简单配合物: Cu(NH3)42+ 2+:中心离子, Cu 中心离子, 轨道未充满,电子对接受体; d轨道未充满,电子对接受体; N:配位原子, :配位原子, 含有孤对电子,电子给予体; 含有孤对电子,电子给予体; 配位体,络合剂; NH3:配位体,络合剂; 4个N:配位数; 4:配位体数. 个 :配位数; :配位体数.
螯合物的定义

螯合物的定义螯合物是指那些在分子结构上能与金属离子形成稳定络合物的化合物。
这种络合物在溶液中可以作为一种特殊的离子载体而起到传递信息的作用,即“传递信息”。
螯合物主要有两大类型,即金属螯合物和非金属螯合物。
非金属螯合物如 EDTA、 CMA、 EDTMP 等。
金属螯合物包括氨基酸及蛋白质的衍生物,如谷氨酸、天冬酰胺、二肽、三肽、四肽等,均具有很好的络合性能,对钙、镁、锌、铜等金属离子都有良好的螯合作用。
另外还有某些含氮杂环化合物,如吡啶、喹啉、噻唑、嘧啶、吲哚等也具有较强的螯合性能。
螯合物通过螯合作用将金属离子连接在一起形成螯合物。
这样既保证了金属离子的生理功能,又增加了分子的稳定性。
从某种意义上讲,螯合物比一般配位剂更安全。
因此,利用螯合物来解决生产实际问题时,不仅考虑到所需螯合物的稳定性,同时也必须考虑螯合物本身的毒性。
当然,由于存在络合物的空间位阻效应,因此在进行螯合反应时,必须严格控制螯合条件,使得络合物尽量小,才能提高螯合物的选择性。
金属螯合物与其他无机或有机配位剂相比,具有以下优点:1.对人体健康危害少,且容易被生物降解。
2.具有明显的抗肿瘤活性。
3.具有生物活性,易被生物体内酶系统水解。
4.具有特异性,不会引入新的杂质。
5.对细胞膜通透性影响极小。
6.与蛋白质或多糖形成的螯合物,有助于药物吸收。
7.具有缓释性,不会出现快速排泄。
8.无毒,对环境友好。
9.价廉,容易获取。
10.具有独特的生物相容性。
11.适宜 pH 范围宽。
12.可通过重组 DNA 技术修饰,改变其结构,增强其功能。
13.易于获得。
螯合物的缺点:1.螯合物的稳定性差,不耐光、热和碱。
2.在低温下,螯合物容易失去活性。
3.对金属离子敏感,特别是铜离子。
4.螯合物的分子结构复杂,不便于进行纯化处理。
螯合物广泛应用于日常生活中的各个方面:工业上制造螯合铁、铬等金属和其它金属的氢氧化物;农业上制造多种微量元素肥料;医学上用于临床治疗肝炎、肾病综合征、癌症、心血管疾病、老年痴呆症、糖尿病等;食品添加剂、饲料添加剂等方面也有广阔前景。
螯合剂和络合物的区别

螯合剂和络合物的区别作者admin 文章来源本站原创点击数1511 更新时间2007-11-21 一、螯合剂的概念由一个简单正离子称为中心离子和几个中性分子或离子称为配位体结合而成的复杂离子叫配离子又称络离子含有配离子的化合物叫配位化合物。
在配合物中中心离子与配位体通过配位键结合。
配位键是一种特殊的共价键通常的共价键是由两个成键·原子绷出一个电子形成共同电子对的而在配位键中是由一个原子提供电子对另一原手提供攀删道形成的。
为了区别把共价键用“一”表示如H··HHHH—H配位键奶删“←”表示箭头指向提供空轨道的原子如CuNH3CuNH3Cu←NH3。
如果配位体中只有一个配位原子则中心离子与配位体之间只能形成一个配位键。
而有些配位体分瑚中含有两个以上的配位原子而且这两个原子间相隔着两至三个其他非配位原子时这个硼体就可以与中心离子或原子同时形成两个以上的配位键并形成一个包括两个配位剿五元或六元环的特殊结构把这种配合物称为螯合物。
螯合物比一般配合物更稳定。
把能形成螯合物的配位体叫整合剂。
螯合剂包括无机和有机两类。
它们在清洗过程中蕉着重要用途。
二、无机金属离子螯合剂聚磷酸盐螯合剂的缺点是它们在高温下会发生水解而分解使螯合能力减弱或丧失。
而且其螯合能力受pH值影响较大兰般只适合在碱性条件下作螯合剂。
一般说来这些无机螯合剂对重金属离子特别是铁离子的螯合能力较差。
由于以上缺点使无机螯合剂的用途受到限制通常只用于对钙、镁离子螯合所以常作为硬水软化剂。
三、有机金属离子螯合剂能与重金属离子起螯合作用的有机化合物很多如羧酸型、有机多元膦酸等。
1羧酸型在清洗剂中使用的羧酸型螯合剂主要有氨基羧酸类和羟基羧酸类等。
1氨基羧酸类氨基羧酸用作螯合剂的有乙二胺四乙酸EDTA氨基三乙酸又称次氮基三乙酸NTA二亚乙基三胺五乙酸及其盐等。
它们对钙、镁离子均有较强的螯合作用。
从单位质量的三种酸螯合钙离子的数量看以NTA螯合最多ZDTA其次DTPA再次。
螯合物-配合物-络合物

配位键,又称配位共价键,或简称配键,是一种特殊的共价键。
当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。
配位键形成后,就与一般共价键无异。
形成条件配位键的形成需要两个条件:一是中心原子或离子,它必须有能接受电子对的空轨道;二是配位体,组成配位体的原子必须能提供配对的孤对电子。
当一路易斯碱供应电子对给路易斯酸而形成化合物时,配位键就形成了。
例如气态氨NH3和气体三氟化硼BF3形成固体NH3BF3化合价在配位化合物中,由电负性小的元素原子向电负性大的元素原子提供孤对电子形成配位键时,每个有一对孤对电子的前者(电负性小的原子)显示+2价,后者显示-2价。
反之,由电负性大的元素原子提供孤对电子与电负性小的元素原子之间形成配位键时,两种元素都无价态变化。
常见配位键化合物∙一氧化碳CO,其中碳氧间的三对共用电子对有一配位键,两个正常共价键。
∙铵根NH4+,其中N原子与左下右的H原子以极性键结合,与上边的H以配位键结合,由N原子提供孤对电子螯合物(英语:Chelation)是配合物的一种在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。
“螯”指螃蟹的大钳,此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。
金属EDTA螯合物螯合物通常比一般配合物要稳定,其结构中经常具有的五或六元环结构更增强了稳定性。
正因为这样,螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。
使用螯合物还可以掩蔽金属离子。
可形成螯合物的配体叫螯合剂。
常见的螯合剂如下:∙乙二胺(en),二齿∙2,2'-联吡啶(bipy),二齿∙1,10-邻二氮杂菲(phen),二齿∙草酸根(ox),二齿∙乙二胺四乙酸(EDTA),六齿值得一提的是EDTA。
它能提供2个氮原子和4个羧基氧原子与金属配合,可以用1个分子把需要6配位的钙离子紧紧包裹起来,生成极稳定的产物。
螯合物在工业中用来除去金属杂质,如水的软化、去除有毒的重金属离子等。
络合物和螯合物的区别

络合物和螯合物的区别络合物络合物之一络合物通常指含有络离子的化合物,例如络盐[Ag(NH3)2]Cl、络酸H2[PtCl6]、络碱[Cu(NH3)4](OH)2等;也指不带电荷的络合分子,例如[Fe(SCN)3]、[Co(NH3)3Cl3]等。
配合物又称络合物。
络合物的组成以[Cu(NH3)4]SO4为例说明如下:(1)络合物的形成体,常见的是过渡元素的阳离子,如Fe3+、Fe2+、Cu2+、Ag+、Pt2+等。
(2)配位体可以是分子,如NH3、H2O等,也可以是阴离子,如CN-、SCN-、F-、Cl-等。
(3)配位数是直接同中心离子(或原子)络合的配位体的数目,最常见的配位数是6和4。
络离子是由中心离子同配位体以配位键结合而成的,是具有一定稳定性的复杂离子。
在形成配位键时,中心离子提供空轨道,配位体提供孤对电子。
络离子比较稳定,但在水溶液中也存在着电离平衡,例如:[Cu(NH3)4]2+Cu2++4NH3因此在[Cu(NH3)4]SO4溶液中,通入H2S时,由于生成CuS(极难溶)络合物之二含有络离子的化合物属于络合物。
我们早已知道,白色的无水硫酸铜溶于水时形成蓝色溶液,这是因为生成了铜的水合离子。
铜的水合离子组成为[Cu(H2O)4]2+,它就是一种络离子。
胆矾CuSO4·5H2O就是一种络合物,其组成也可写为[Cu(H2O)4]SO4·H2O,它是由四水合铜(Ⅱ)离子跟一水硫酸根离子结合而成。
在硫酸铜溶液里加入过量的氨水,溶液由蓝色转变为深蓝。
这是因为四水合铜(Ⅱ)离子经过反应,最后生成一种更稳定的铜氨络离子[Cu(NH3)4]2+而使溶液呈深蓝色。
如果将此铜氨溶液浓缩结晶,可得到深蓝色晶体[Cu(NH3)4]SO4,它叫硫酸四氨合铜(Ⅱ)或硫酸铜氨,它也是一种络合物。
又如,铁的重要络合物有六氰合铁络合物:亚铁氰化钾K4[Fe(CN)6](俗名黄血盐)和铁氰化钾K3[Fe(CN)6](俗名赤血盐)。
如何甄别络合物和螯合物?

如何甄别络合物和螯合物?如何甄别络合物和螯合物Dr.Richard Murphy(奥特奇欧洲生物科学中心)市场上有多种为动物补充营养的金属络合物形式的产品,并且根据微量元素是络合的形式或以其他形式与有机分子相联系,来决定其是否命名为“有机微量元素”。
络合或螯合越来越被熟知,但是在动物饲料行业其概念常常被混淆。
诸如金属氨基酸络合物、金属氨基酸螯合物、金属多糖络合物和金属蛋白盐比比皆是,并且官方并未给出明确的定义来区分。
例如,在表1中是由美国饲料控制官员协会(AAFCO,1998年)所规定的农业实践中所用的有机微量金属的各种定义。
那么在这些模糊的定义中,我们如何区分络合物和螯合物呢?1 络合物与螯合物一般来讲,术语“络合体”可用于描述金属离子与一个分子或离子(配体)的反应所形成的物质,这种物质是含有具有孤对电子的原子。
复杂的金属离子通过供电子原子氧、氮和硫结合到配体上。
仅包含一个供体原子的配体被称为“单原子螯合配体”,而那些包含两个或更多的供电子原子键结合至金属离子的配体被称为。
二、三或四配位基的配体。
这些多供体种类,也可以称为多配基配体。
当这样的配体由两个或更多个供电子原子键结合到金属离子上,所形成的络合物包含含有金属原子的一个或多个杂环,这种络合物被称为“螯合物”。
氨基酸就是二配基的一个例子,经由羧酸基团的氧和氨基的氮键合到金属离子上。
与此相反,乙二胺四乙酸(EDTA)是一种六配基配体,其包含六个供体原子。
它与大多数金属离子形成高度稳定的络合物,但事实上,EDTA不是特别适用于形成微量元素螯合物,因为这种络合物的生物利用效率极低。
虽然螯合物可以形成四、五、六或七元环,但研究表明具有五元环的螯合物稳定性最好。
值得注意的是,尽管所有螯合物是络合物,但并非所有的络合物都是螯合物。
的确,螯合总体理论很简单,但是形成稳定的微量元素螯合物必须满足以下标准:(1)螯合配体至少含有两个原子能与金属离子形成键;(2)配体必须与金属形成封闭杂环;(3)空间上必须能够螯合金属;(4)所述配体与微量元素的比值必须满足稳定性最低要求。
懵!肥料里的螯合物、络合物、糖醇物……到底都是啥?

懵!肥料里的螯合物、络合物、糖醇物……到底都是啥?我们经常会在某些肥料的包装袋上看到像螯合铁、螯合钙、糖醇钙……的字眼,很多厂家推广时也会把它们当作一个卖点。
有些用过的人也反应说,这类肥料好像效果还不错,只是相对于没有添加螯合、糖醇的肥料卖得也贵一些!那它们到底都是些什么东西,为啥卖那么贵?今天,咱们就一起来看一下。
螯合物与络合物好多人对“螯合”、“络合”这些词很陌生,不知道它们都是啥意思,我们就先来看看它们都表示的啥以及为啥要在肥料上应用这些技术!1.概念螯合这个词是化学上的一种叫法,它是络合的一种。
指的是一些具有特殊结构的分子(螯合剂)通过配位键作用将金属离子比较牢固的结合起来的意思。
当配位键就一个的时候属于普通络合,当配位键两个或两个以上的时候(因为多个配位键像虾、蟹的螯一样将金属离子牢牢夹在中间),就叫做螯合。
2特点无论是螯合物还是络合物,它们都具有热稳定性高、自身结构比较稳固和容易溶于水的特点。
但络合物的热稳定性和自身结构的稳固性都没有螯合物那样高,组成也较螯合物简单。
所以市面上我们见到的还是螯合的产品要多一些。
人们之所以把一些营养元素应用螯合或络合技术制成螯合物(肥)或络合物(肥)就是利用了它们稳定性高和容易溶于水的特点,让这些营养元素更容易被农作物吸收利用,提高了利用率。
相比于普通肥料,它们的优势主要有:(1)具有缓释、控释效果,能深入到作物的内部,作用更明显。
经过螯合处理的肥料会缓慢将营养元素释放出来,按照作物的需肥规律释放。
另外,因为其释放缓慢,而且螯合剂本身也能被作物吸收利用,所以金属离子(营养元素)能够均匀的散部到植物体内,深入到作物内部,对缺素作物的补充也相比于普通肥料更加均匀,不会导致治表不治里的现象。
(2)吸收利用率高螯合中微量元素肥料在土壤中不易被固定,易溶于水,又不离解,能很好地被植物吸收利用。
(3)能与其它肥料混合施用,不会降低肥效。
螯合肥对氮肥具有缓释、控释作用,对磷、钾元素具有活化功能,而且还能提高土壤中钙、镁、锌、锰等中、微量元素的有效性。
(一)螯合物和螯合剂的概念
铬黑T能与许多金属离子如Ca2+ 铬黑 能与许多金属离子如 Mg2+ Zn2+Cd2+ 等形成红色的配合物。 形成红色的配合物。 显兰色, 在pH为7~11时,铬黑 显兰色,与 为 时 铬黑T显兰色 形成配合物的红色有明显区别, 形成配合物的红色有明显区别,则 终点时颜色变化明显。因此, 终点时颜色变化明显。因此,用铬 黑T作指示剂时最适宜的pH值为 作指示剂时最适宜的 值为
C
EDTAV EDTA V水样
×1000
9~10.5,一般用NH3-NH4Cl缓冲溶液 ,一般用 缓冲溶液 控制溶液pH值在 左右进行滴定。 值在10左右进行滴定 控制溶液 值在 左右进行滴定。
对于含有两种或两种以上金属离子 的混合溶液, 的混合溶液,可以通过调节溶液的
pH值,选择性地滴定其中某一离子。例 值 选择性地滴定其中某一离子。 离子和Zn 如,在Mg2+离子和 2+离子的混合溶液 可首先调节溶液pH ≈ 6.8,用铬黑 中,可首先调节溶液 , 离子, T作指示剂,用EDTA滴定Zn2+离子, 作指示剂, 作指示剂 此时Mg2+离子不干扰。然后再调节溶液 离子不干扰。 此时 pH ≈ 10,用EDTA滴定Mg2+离子。 离子。 ,
例如, 离子和Zn 例如,在Mg2+离子和 2+离子的混合 溶液中,调节溶液的pH ≈ 6.8, 这时 溶液中,调节溶液的 , EDTA仍可与 Zn2+离子完全螯合,而与 离子完全螯合, 仍可与 Mg2+离子则完全不螯合,即Mg2+离子 离子则完全不螯合, 的存在不会干扰EDTA 对Zn2+离子的螯 的存在不会干扰 合滴定。 合滴定。 由于滴定时不断有离子的生成, 由于滴定时不断有离子的生成,为了 保持合适的pH值 使反应进行完全, 保持合适的 值,使反应进行完全,滴 定前必须加入合适的缓冲溶液控制溶液 的pH值。 值
络合物和配合物和螯合物

络合物和配合物和螯合物哎呀呀,说起络合物、配合物和螯合物,这可真是让我这个小脑袋瓜转了又转!先来讲讲络合物吧。
络合物就好像是一个团结的小班级,里面的金属离子就像是班长,而围着它的那些配体就像是一群听话的小伙伴。
比如说,铜离子和氨分子结合形成的那种东西就是络合物。
这就好像我们在体育课上分组做游戏,铜离子是组长,氨分子们都紧紧围绕着它,谁也不离开谁。
你说神奇不神奇?再来说说配合物。
配合物和络合物有点像双胞胎兄弟,有时候让人分不清。
但仔细想想,配合物就像是一个超级组合,金属原子或者离子在中间,周围的配体们有序地排列着,它们之间有着特殊的吸引力,就像好朋友之间那种心有灵犀的默契。
最后讲讲螯合物。
螯合物呀,那可厉害了!它就像是一只大螃蟹的钳子,紧紧地抓住中心的金属离子不放手。
配体们就像螃蟹的钳子一样,形成了一个环,把金属离子牢牢地“锁”在中间。
这难道不像我们紧紧抓住自己最喜欢的玩具,生怕被别人抢走吗?有一次,在化学课上,老师给我们展示了一些关于络合物、配合物和螯合物的实验。
同学们都瞪大了眼睛,好奇得不得了。
“哇,老师,这到底是怎么回事呀?”小明忍不住问道。
老师笑着回答:“同学们,别着急,慢慢看,慢慢理解。
”“老师,那这些在生活中有什么用呢?”小红也举起了手。
老师耐心地说:“用处可大啦!比如说在医药领域,一些药物就是通过形成络合物来发挥作用的;在工业上,也能用于提取金属呢。
”我在心里想:“原来这些看起来复杂的东西,和我们的生活这么息息相关呀!”总之,络合物、配合物和螯合物虽然听起来很复杂,但是只要我们认真去了解,就会发现它们就像一个个神奇的小世界,充满了奥秘和惊喜。
它们可不是那种遥不可及的科学怪物,而是实实在在能为我们的生活带来改变的好东西!。
络合物和配合物区别

络合物和配合物区别
络合物是指具有络合功能的配位体与金属离子形成的稳定的络
合物。
络合物一般都可以发生水解、酸碱性、氧化还原等作用,它们在反应中主要起络合作用。
络合反应的机理:络合物( compound)
指具有络合功能的配位体与金属离子形成的稳定的络合物。
络合物在化学上被认为是高度配位化合物。
络合物分子可以看做电子对给予体,其原因是络合物分子中存在着大量的共价键,而且每个共价键都含有未成对的电子。
这样就使得络合物分子不仅可以提供电子对,同时也可以接受电子对。
络合反应又称络合反应,是指配位体与金属离子结合生成新的配位化合物的过程。
例如, Fe (ⅲ)+2Na= Fe2(ⅲ)+2Na+ H2O。
配位体与金属离子间通常会形成一个或几个配位键,但并非所有的配位体都能够直接参加络合反应。
只有那些带有孤对电子的配位体才能进行络合反应。
除此之外,某些金属元素的原子还可以与另一种金属元素的原子形成双核络合物。
例如,铜与铁形成的二元络合物 CuFeSn。
络合物
分子可以看做电子对给予体,其原因是络合物分子中存在着大量的共价键,而且每个共价键都含有未成对的电子。
这样就使得络合物分子不仅可以提供电子对,同时也可以接受电子对。
有些离子化合物具有两种或多种官能团,当它们彼此相互作用后,便产生了络合物。
例如,硫酸根离子与氯离子形成的络合物为
[ SO4Cl]-,硫酸根离子与碘离子形成的络合物为[ I3Cr2SO4]-。
由
于络合物分子中存在着大量的共价键,而且每个共价键都含有未成对的电子,故络合物比较稳定。
微量元素螯合物的鉴别

微量元素螯合物的鉴别
1. 热稳定性测试:将样品加热至高温,观察是否发生分解或燃烧。
如果样品在高温下仍保持稳定,可能表明存在热稳定的螯合物。
2. 溶解性测试:将样品溶解于水或有机溶剂中,观察其溶解性。
某些微量元素螯合物具有较好的溶解性,而纯元素通常不会溶解。
3. 常规分析方法:使用常规分析方法,如红外光谱、质谱、核磁共振等,对样品进行分析。
这些方法可以检测到螯合结构,并确定样品是否是螯合物。
4. 晶体学分析:通过X射线衍射技术对样品进行晶体学分析。
螯合物通常会形成特定的晶体结构,通过分析晶体结构可以确定样品是否是螯合物。
5. 氧化还原试剂测试:使用适当的氧化还原试剂与样品反应,观察是否发生氧化还原反应。
螯合物通常具有较强的氧化还原特性,因此往往会发生氧化还原反应。
综合使用以上方法可以对微量元素螯合物进行鉴别。
络合物和螯合物

络合物和螯合物
络合物和螯合物
络合指的是过渡金属离子(Cu2+,Fe2+,Co2+,Ni2+等)也就是配位中心离子与有孤对电子的非金属元素(比如说N O Cl S P)也就是配位原子发生作用,这种作用是指配位原子的孤对电子进入金属离子的空轨道,从而形成配位键,以前曾称做络合键;螯合指一个有机分子中有多个配位原子跟中心离子进行配位,这样就形成了一个环状的配位化合物;所以,螯合剂一定是络合剂,但络合剂不一定是螯合剂,因为不一定在配位后能够形成环状结构。
配位化学中的螯合物(Chalet )是一种特殊的络合物。
在其化学结构中,配位体(Ligands)通过配位基和自身的碳链与金属离子形成环状结构。
该环状结构如同蟹、虾等动物(配位体)以螯足夹持着金属离子。
因此,这种络合物被形象地称为螯合物。
配位体又称螯合剂(Chelating Agents)。
如柠檬酸、草酸、水杨酸、酒石酸、乙二胺四醋酸(EDTA )及氨基酸等都是螯合剂。
螯合与络合的区别

螯合与络合的区别
化学中,螯合和络合是两种重要的化学反应,它们与金属离子的配位有关。
螯合和络合的区别,主要在于它们与金属离子形成的化学键的不同。
螯合是指通过某些配体中的原子(通常是氧、氮、硫等)与金属离子形成共价键,从而形成一种稳定的化合物。
在螯合反应中,配体中的原子与金属离子形成的化学键称为螯合键。
这种键的稳定性通常较高,因此螯合配合物具有较强的稳定性和化学性质。
例如,乙二胺四乙酸(EDTA)是一种常用的螯合剂,它能与多种金属离子配位,形成稳定的络合物,用于分析和处理废水等。
络合是指通过配体中的非配位原子(如羰基、烷基、芳基等)与金属离子形成的键,形成一种稳定的化合物。
在络合反应中,配体中的非配位原子与金属离子形成的化学键称为络合键。
这种键的稳定性较低,因此络合配合物的稳定性和化学性质通常较差。
例如,甲醛、乙酰丙酮等化合物都是常用的络合剂,它们能与金属离子形成络合物,但这种络合物的稳定性较低,容易被水和其他配体替换掉。
螯合和络合的区别,主要在于它们与金属离子形成的化学键的不同。
螯合反应中配体中的原子与金属离子形成的是共价键,而络合反应中配体中的非配位原子与金属离子形成的是配位键。
由于化学键的稳定性不同,因此螯合配合物比络合配合物更加稳定和化学性质更
加活泼。
总的来说,螯合和络合是两种不同的化学反应,它们都与金属离子的配位有关,但形成的配位键不同,从而导致了它们的稳定性和化学性质的不同。
在实际应用中,我们需要根据具体情况选择不同的配位剂,以达到最佳的效果。
络合物和螯合物的区别

络合物和螯合物的区别络合物络合物之一络合物通常指含有络离子的化合物,例如络盐[Ag(NH3)2]Cl、络酸H2[PtCl6]、络碱[Cu(NH3)4](OH)2等;也指不带电荷的络合分子,例如[Fe(SCN)3]、[Co(NH3)3Cl3]等。
配合物又称络合物。
络合物的组成以[Cu(NH3)4]SO4为例说明如下:(1)络合物的形成体,常见的是过渡元素的阳离子,如Fe3+、Fe2+、Cu2+、Ag+、Pt2+等。
(2)配位体可以是分子,如NH3、H2O等,也可以是阴离子,如CN-、SCN-、F-、Cl-等。
(3)配位数是直接同中心离子(或原子)络合的配位体的数目,最常见的配位数是6和4。
络离子是由中心离子同配位体以配位键结合而成的,是具有一定稳定性的复杂离子。
在形成配位键时,中心离子提供空轨道,配位体提供孤对电子。
络离子比较稳定,但在水溶液中也存在着电离平衡,例如:[Cu(NH3)4]2+Cu2++4NH3因此在[Cu(NH3)4]SO4溶液中,通入H2S时,由于生成CuS(极难溶)络合物之二含有络离子的化合物属于络合物。
我们早已知道,白色的无水硫酸铜溶于水时形成蓝色溶液,这是因为生成了铜的水合离子。
铜的水合离子组成为[Cu(H2O)4]2+,它就是一种络离子。
胆矾CuSO4·5H2O就是一种络合物,其组成也可写为[Cu(H2O)4]SO4·H2O,它是由四水合铜(Ⅱ)离子跟一水硫酸根离子结合而成。
在硫酸铜溶液里加入过量的氨水,溶液由蓝色转变为深蓝。
这是因为四水合铜(Ⅱ)离子经过反应,最后生成一种更稳定的铜氨络离子[Cu(NH3)4]2+而使溶液呈深蓝色。
如果将此铜氨溶液浓缩结晶,可得到深蓝色晶体[Cu(NH3)4]SO4,它叫硫酸四氨合铜(Ⅱ)或硫酸铜氨,它也是一种络合物。
又如,铁的重要络合物有六氰合铁络合物:亚铁氰化钾K4[Fe(CN)6](俗名黄血盐)和铁氰化钾K3[Fe(CN)6](俗名赤血盐)。
螯合物配位键判断

螯合物配位键判断螯合物是指由一个中心金属离子通过配位键与多个配位原子形成的化合物。
在螯合物化学中,对螯合物的配位键进行正确的判断是非常重要的。
本文将从配位键的定义、共价键与离子键、配位数等方面对螯合物的配位键进行详细解释。
一、配位键的定义配位键是指在螯合物中,中心金属离子与配位原子之间的化学键。
配位原子可以是氮、氧、硫等元素,它们通过孤对电子或共价键与中心金属离子形成配位键,构成螯合物的结构。
二、共价键与离子键在判断螯合物中配位键的类型时,需要明确共价键和离子键的概念。
共价键是指两个原子通过共享电子形成的复合物,这种键的形成需要原子间的电负性差异不大。
离子键是由两个离子之间的静电作用形成的化学键,这种键的形成需要原子间的电负性差异很大。
在螯合物中,一般情况下,配位原子与中心金属离子之间的配位键是离子键,因为孤对电子与金属离子之间的电负性差异很大。
但是,特殊情况下,配位原子与中心金属离子之间的配位键可以是共价键。
例如,一些过渡金属离子与氨分子之间的配位键就是共价键。
三、配位数配位数是指中心金属离子周围被配位原子占据的数目。
配位物的性质与其配位数有关,因此,在判断螯合物中配位键类型时,需要考虑配位数的影响。
在一般情况下,若螯合物的配位数为2,则配位键类型为线性型;配位数为4,则配位键类型为四面体型;配位数为6,则配位键类型为八面体型。
若螯合物的配位数大于6,则称为高配位数络合物,这种络合物的配位键类型较为复杂,需要根据具体情况进行判断。
总之,在判断螯合物中配位键类型时,需要考虑配位原子与中心金属离子之间的电负性差异、配位数等因素,才能做出准确的判断。
同时,在实验研究中,还需通过各种分析手段进行确定。
配位化学-络合与螯合

M
O—C=O M O—C=O
●●
●●
草酸根离子,有两个配位原子,和金属离子形成五员环
—
O—C
●●
●●
C—O—
●●
乙二胺四乙酸根离子, 共有6个配位原子,和Ca、 Mg等离子结合,形成5个五员环。
N—CH2 —CH2 —N
●●
—
O—C
●●
C— O—
●●
在螯合物中,中心离子和鏊合剂的分子比一般不叫配位数,而叫鏊 合比。例如:一个中心离子和一个配体结合,螯合比为1∶1。 例如: 在[Zn(en)2]中,Zn2+:en的螯合比为1∶2, 在[Zn(EDTA)]中,Zn2+:en的螯合比为1∶1
9.2螯合物
9.2.1螯合物的定义
前面见到的络合物中,配体如F 、—OH 、CN 、 —SCN 、
— — — —
— NO2 、NH3、H2O等全以一个配位原子与中心离子(原子)结合,因此这类配 体叫单齿(单基)配体。
如果一个配体上有两个配位原子同时与中心离子结合时,这个配体叫二齿配体。 — — 如C2O4 、H2N—CH2 —CH2 —NH2、 H2N —CH2 —COO
9.2.2螯合物的性质
螯合物比普通络合物要稳定得多,五元环或六元环的螯合物最为稳定, 四元环、七元环和八元环的螯合物比较少见,形成螯环的数目越多,稳定 性也越大。 金属螯合物不仅有较高的稳定性,还常常是难溶于水的或带有特征颜 色的化合物,在分析工作中利用这一特点可作为离子的分离和检验试剂。
例如:丁二酮肟是鉴定Ni2+的特效试剂,它与Ni2+在稀氨溶液中生成樱桃红色 的沉淀,生物学中测定蛋白质用的二缩脲反应也是利用二缩脲与Cu 2+生产特殊的兰 色螯合物。 生物中的血红素是Fe2+的螯合物,叶绿素是Mg2+离子的螯合物,配体都是卟啉。 土壤中直接施加磷肥,P会和Fe3+,Al3+等金属离子形成难溶解的AlPO4 FePO4,不能被作物吸收。当施加磷肥后,在施加有机肥,其中的羟基酸,如柠檬 酸、酒石酸等与Fe3+,Al3+等金属离子形成易溶解的螯合物,可提高可溶性P的肥效。 微量元素在人体内几乎全部以螯合物的形式吸收和利用。
螯合物的定义

螯合物的定义
螯合物又称内络合物,是螯合物形成体(中心离子)和某些合乎一定条件的螯合剂(配位体)配合而成具有环状结构的配合物。
“螯合”即成环的意思,犹如螃蟹的两个螯把形成体(中心离子)钳住似的,故叫螯合物。
形成螯合物的第一个条件是螯合剂必须有两个或两个以上都能给出电子对的配位原子(主要是N,O,S等原子)。
第二个条件是每两个能给出电子对的配位原子,必须隔着两个或三个其他原子,因为只有这样医学教育网|搜集整理,才可以形成稳定的五原子环或六原子环。
例如,在氨基乙酸根离子(H2N-CH2-COO-)中,给出电子的羟基氧和氨基氮之间,隔着两个碳原子,因此它可以形成稳定的具有五原子环的化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016·
19
市场上有多种为动物补充营养的金属络合物形式的产品,并且根据微量元素是络合的形式或以其他形式与有机分子相联系,来决定其是否命名为“有机微量元素”。
络合或螯合越来越被熟知,但是在动物饲料行业其概念常常被混淆。
诸如金属氨基酸络合物、金属氨基酸螯合物、金属多糖络合物和金属蛋白盐比比皆是,并且官方并未给出明确的定义来区分。
例如,在表1中是由美国饲料控制官员协会(AAFCO,1998年)所规定的农业实践中所用的有机微量金属的各种定义。
那么在这些模糊的定义中,我们如何区分络合物和螯合物呢?
1络合物与螯合物
一般来讲,术语“络合体”可用于描述金属离子与一个分子或离子(配体)的反应所形成的物质,这种物质是含有具有孤对电子的原子。
复杂的金属离子通过供电子原子氧、氮和硫结合到配体上。
仅包含一个供体原子的配体被称为“单原子螯合配体”,
而那些包含两个或更多的供电子原子键结合至金属离子的配体被称为二、三或四配位基的配体。
这些多供体种类,也可以称为多配基配体。
当这样的配体由两个或更多个供电子原子键结合到金属离子上,所形成的络合物包含含有金属原子的一个或多个杂环,这种络合物被称为“螯合物”。
氨基酸就是二配基的一个例子,经由羧酸基团的氧和氨基的氮键合到金属离子上。
与此相反,乙二胺四乙酸(EDTA )是一种六配基配体,其包含六个供体原子。
它与大多数金属离子形成高度稳定的络合物,但事实上,EDTA 不是特别适用于形成微量元素螯合物,因为这种络合物的生物利用效率极低。
虽然螯合物可以形成四、五、六或七元环,但研究表明具有五元环的螯合物稳定性最好。
值得注意的是,尽管所有螯合物是络合物,但并非所有的络合物都是螯合物。
的确,螯合总体理论很简单,但是形成稳定的微量元素螯合物必须满足以下标准:
(1)螯合配体至少含有两个原子能与金属离子形成键;
(2)配体必须与金属形成封闭杂环;
(3)空间上必须能够螯合金属;
(4)所述配体与微量元素的比值必须满足稳定性最低要求。
真正的螯合物具有金属离子与氨基酸的氨基和羧基末端形成的“环状结构”。
螯合物是由无机矿物质盐在一定的条件下,与氨基酸和小肽发生酶促反应制备的。
这些氨基酸和肽配体通过一个以上的点与金属结合,确保金属原子成为生物学上稳定的环结构的一部分。
氨
基酸和
如何甄别络合物和螯合物
Dr.Richard Murphy
(奥特奇欧洲生物科学中心)
作者简介:Dr.Richard Murphy ,奥特奇欧洲生物科学中心研发总监。
HORIZON OF SCIENCE AND TECHNOLOGY 科技视野
33
2016·
19
蛋白质的消化产物如小肽是理想的配位体,因为它们具有至少两个官能团(氨基和羟基),使得与微量元素形成环结构。
只有所谓的“过渡元素”,如铜、铁、锰和锌具备的物理化学特性,使它们能够与氨基酸和肽形成配位共价键,并因此生成稳定的络合物。
2氨基酸和肽作为配基
许多观点认为,在形成微量元素螯合物方面,氨基酸比肽更适宜、更具优势,比其他产品的生物利用度更高。
我们已经考虑到确保矿物螯合物生物稳定性的一些必要标准,但是,还必须考虑许多参与螯合过程的其他的影响因素,其中主要包括:
(1)相对平衡-包括金属离子和配体;
(2)水合金属离子和存在的络合物的置换反应动力学;
(3)金属离子和其络合物的氧化还原行为;(4)涉及调节配基的反应。
虽然我们很难简化和解释这些复杂的化学反应,但是,为了证明一些氨基酸比肽更适宜与微量元素肽螯合这样的观点是错误的,我们将主要考虑影响络合物平衡和稳定的因素。
当金属盐如硫酸铜溶解在水中与二齿配位体氨基酸配合,会形成一系列的络合物。
每个络合物都有稳定常数,同时受溶液的pH 影响。
如图1,其中铜(II )硫酸盐与甘氨酸反应,强调了许多显著特征:
(1)根据溶液pH 的不同,在给定浓度的金属和氨基酸浓度条件下,金属离子的分布;
(2)二价金属离子的螯合物不一定呈中性;(3)不同金属离子具有不同的稳定常数,因此,金属作为特定物质的比例不仅取决于溶液的pH 值,而且决定于络合物的稳定性常数。
金属络合物的稳定性最终取决于金属离子和配体的化学性质。
就金属离子对稳定性的影响而言,增加离子电荷和提高电子亲和力都将引起有较高稳定性的络合物的形成。
配体也具有影响络合物稳定性的特点,包括:(1)配体的碱度;(2)每个配体金属-螯合环的数目;(3)螯合环的大小;(4)位阻效应;(5)共振效应;(6)配体原子。
由于配位化合物作为路易斯酸-碱反应的产物,其中金属离子是酸性
而配体是碱性,它们结合一般的基本配体,形成更稳定的络合物。
螯合环的大小同样是影响稳定性的一个重要因素。
进一步分析图1可以发现,金属氨基酸螯合物和金属蛋白盐的相对稳定性有明显的区别。
鉴于金属蛋白盐是从与氨基酸和部分水解蛋白的可溶性盐的螯合得到的产物,因此对于给定的金属离子,所述离子分布曲线对蛋白盐的复杂性将远大于相应的金属氨基酸螯合物。
如果我们认为该产品分布曲线是在给定的pH 值下相对稳定的指标,并考虑二、三甚至四肽中的单个氨基酸混合物的无限结合,那么总的蛋白盐稳定性在较宽pH 范围内理论上应远比特定金属氨基酸螯合物更大。
图1含有二价铜离子(0.001M )
与甘氨酸(0.002M )的溶液中金属离子解离曲线
3生物稳定性
先前讨论的其他影响因素有助于解释螯合物的整体稳定性。
同时这些因素也可以用来评估在
pH 值改变的条件下金属蛋白盐物化性质的稳定。
虽然业界存在各种关于螯合的混淆和矛盾的观点,但是微量元素螯合其实是一种相对简单的化学合成过程。
通常,我们能够区分两种真正的螯合形式,每一种都有特定的化学和生物物理特性。
可以通过仔细研究影响微量元素螯合的重要因素,在生物稳定性乃至生物利用率和有效率的基础上对产品进行区分。
■
科技视野HORIZON OF SCIENCE AND TECHNOLOGY
金属离子的存在形式不仅取决于溶液的pH 值,同时也取决于络合物的稳定常数。
34。
