植物组织中可溶性糖含量的测定(蒽酮法)
植物组织中可溶性糖含量的测定实验报告
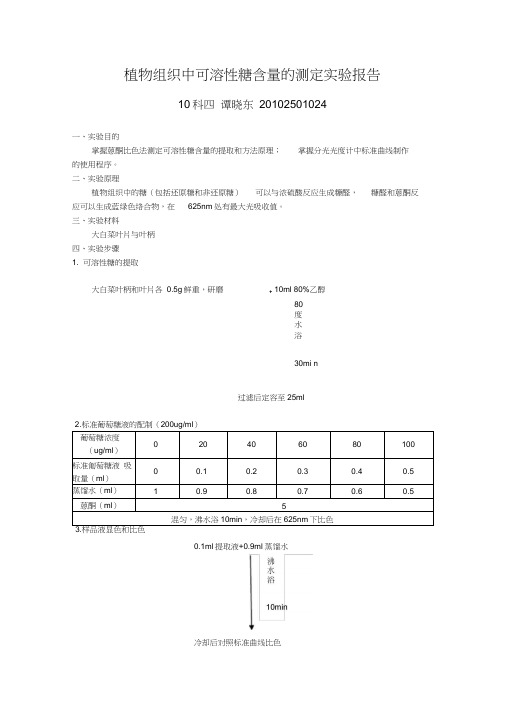
植物组织中可溶性糖含量的测定实验报告10科四谭晓东20102501024一、实验目的掌握蒽酮比色法测定可溶性糖含量的提取和方法原理;掌握分光光度计中标准曲线制作的使用程序。
二、实验原理植物组织中的糖(包括还原糖和非还原糖)可以与浓硫酸反应生成糠醛,糠醛和蒽酮反应可以生成蓝绿色络合物,在625nm处有最大光吸收值。
三、实验材料大白菜叶片与叶柄四、实验步骤1. 可溶性糖的提取大白菜叶柄和叶片各0.5g鲜重,研磨+10ml 80%乙醇80度水浴30mi n过滤后定容至25ml2.标准葡萄糖液的配制(200ug/ml)葡萄糖浓度020*********(ug/ml)标准匍萄糖液吸00.10.20.30.40.5取量(ml)蒸馏水(ml)10.90.80.70.60.5蒽酮(ml)5混匀,沸水浴10min,冷却后在625nm下比色3.样品液显色和比色0.1ml提取液+0.9ml蒸馏水冷却后对照标准曲线比色五、实验结果1.葡萄糖标准曲线标准方程:y=184.6x-1.973 R=0.99402. 根据标准曲线测到,叶片的吸光度是0.249,葡萄糖浓度为43.96ug/ml,含糖量为13.82% ;叶柄的吸光度为0.276,葡萄糖浓度为49.01ug/ml,含糖量为15.41%六、分析与讨论植物体内的可溶性糖和淀粉均是光合作用产物。
可溶性糖以蔗糖为主,是植物糖类运输的主要形式,其次是葡萄糖、果糖、麦芽糖、戊糖和糖苷等。
可溶性糖在硫酸作用下生成糖醛或羟甲基糠醛化合物,糖醛或羟甲基糠醛可与蒽酮作用形成蓝绿色络合物(糖醛衍生物),在一定波长范围内,其颜色的深浅与糖含量有定量关系,在625 nm波长下的吸光值与可溶性糖含量成正比。
由于蒽酮与可溶性糖反应的呈色强度随时间变化,故必须在反应后立即在同一时间内比色。
该实验方法简便,灵敏度高,可溶性糖含量在30卩g左右就能进行测定,所以可作为测定微量可溶性糖之用。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量.在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值•但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差.此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。
蒽酮法测定可溶性糖

蒽酮法测定可溶性糖一、原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖,而且可以测所有寡糖类和多糖,共中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量,在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值。
但在测定水溶性碳水化合物时,因与蒽酮试剂发生反应而增加了测定误差。
此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。
糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为630nM,故在此波长下进行比色。
二、仪器与用具电子天平;容量瓶:100ml 4个,50ml 2个;漏斗;小试管若干支;电炉;刻度吸管0.5ml1支,2.0ml 3支,5ml 4支;分光光度计;记号笔。
三、试剂蒽酮乙酸乙酯试剂:取分析纯蒽酮1g,溶于50ml乙酸乙酯中,贮于棕色瓶中,在黑暗中可保存数周,如有结晶析出,可微热溶解;浓硫酸(相对密度1.84)。
四、方法1. 标准曲线的制作按方法一标准曲线的制作方法加入标准的蔗糖溶液,然后按顺序向试管中加入0.5Ml蒽酮乙酸乙酯试剂和5Ml浓硫酸,充分振荡,立即将试管放入沸水浴中,逐管准确保温1Min,取出后自然冷却至室温,以空白作对照,在630nM波长下测其光密度,以光密度为纵坐标,以糖含量为横坐标,绘制标准曲线,并求出标准线性方程。
2.可溶性糖的提取取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0.10~0.30g,共3份,分别放入3支刻度试管中,加入5~10ml蒸馏水,塑料薄膜封口,于沸水中提取30min(提取2次),提取液过滤入25ml容量瓶中,反复冲洗试管及残渣,定容至刻度。
植物生理指标检测方法
植物组织中可溶性糖含量的测定在作为营养物质主要是指可溶性糖和淀粉。
它们在营养中的作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为NH 3 的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。
由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。
Ⅰ蒽酮法测定可溶性糖一、原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。
在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值。
但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差。
此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。
糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为 620 nm ,故在此波长下进行比色。
二、实验材料、试剂与仪器设备(一)实验材料任何植物鲜样或干样。
(二)试剂1. 80 %乙醇。
2. 葡萄糖标准溶液(100 μg/mL ):准确称取100 mg 分析纯无水葡萄糖,溶于蒸馏水并定容至100 mL ,使用时再稀释 10 倍( 100 μg/mL )。
植物组织中可溶性糖含量的测定

植物组织中可溶性糖含量的测定碳素营养中,作为营养物质主要是指可溶性糖和淀粉。
它们在营养中的作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为NH 3 的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。
由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。
Ⅰ蒽酮法测定可溶性糖一、原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。
在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值。
但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差。
此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。
糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为 620 nm ,故在此波长下进行比色。
二、实验材料、试剂与仪器设备(一)实验材料任何植物鲜样或干样。
(二)试剂1. 80 %乙醇。
2. 葡萄糖标准溶液( 100 μg/mL):准确称取 100 mg 分析纯无水葡萄糖,溶于蒸馏水并定容至 100 mL ,使用时再稀释 10 倍( 100 μg/mL)。
植物中可溶性糖含量的测定

植物组织中可溶性糖含量的测定在作物的碳素营养中,作为营养物质主要是指可溶性糖和淀粉。
它们在营养中的作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为 NH 3 的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。
由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。
Ⅰ蒽酮法测定可溶性糖一、原理糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。
在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值。
但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差。
此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。
糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为 620 nm ,故在此波长下进行比色。
二、实验材料、试剂与仪器设备(一)实验材料任何植物鲜样或干样。
(二)试剂1. 80 %乙醇。
2. 葡萄糖标准溶液(100 μg/mL ):准确称取 100 mg 分析纯无水葡萄糖,溶于蒸馏水并定容至 100 mL ,使用时再稀释 10 倍(100 μg/mL )。
植物组织中可溶性糖含量测定

实验报告课程:植物生理学实验题目:植物组织中可溶性糖含量的测定一.【实验原理】植物的代谢活动随着植物的发育过程而不断发生着变化,碳水化合物的代谢也不例外,其含量也随之发生变化,在种子萌发过程中,在光合作用受到影响时和受到外界环境的胁迫等情况下植物可溶性糖含量都会发生变化。
了解植物可溶性糖含量的变化,在生理上与实践上都有重要意义。
蒽酮比色法是常用的测定可溶性五碳糖和六碳糖的方法,糖在硫酸的作用下脱水生成糠醛,糠醛再与蒽酮作用形成一种绿色的络合物,在一定的浓度范围内颜色的深浅与糖含量成正比,可以用比色法测定。
该法简便,但没有专一性,绝大部分的碳水化合物都能与蒽酮反应产生颜色。
二.【实验步骤】1、标准曲线的绘制2、可溶性糖的提取3、提取液的显色及比色三.【实验结果】实验中测得的数据如下所示:若以1号管调零,处理后数据如下:作出标准曲线如下:将y=0.261,0.269,0.247分别代入上述函数公式,得到:x=45.000,46.379,42.586;即三样品溶液中糖浓度分别为:45.000μg/mL,46.379μg/mL,42.586μg/mL。
样品中可溶性糖含量(m g·g-1)= A × c/(W × 103)式中,A——植物样品稀释后的体积(mL);C——提取液的含糖量(μg/mL);W——植物组织鲜重(g)。
四.【讨论】1、误差分析实验中的误差来源主要有:(1)植物材料称取的误差;(2)植物样品在转移过程中的损失;(3)最后过滤得到的提取液中尚有未除尽的醋酸铅;(4)移液管未润洗等等。
2、注意事项(1)样品提取液的显色应与标准曲线的绘制同步;(2)比色时以蒸馏水调零;(3)醋酸铅一定要除尽;(4)在样品转移过程中,尽量减少材料的损失;(5)进行第二次过滤时要更换滤纸,并将漏斗洗净。
3、植物组织中糖的测定方法还有很多种,举例说明它们的原理和优缺点。
(1)苯酚-硫酸法原理:糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10~100mg范围内其颜色深浅与糖的含量成正比,且在485nm 波长下有最大吸收峰,故可用比色法在此波长下测定。
植物组织中可溶性糖含量的测定

植物组织中可溶性糖含量的测定九植物组织中可溶性糖含量的测定⼀.实验⽬的学习可溶性糖测定的蒽酮⽐⾊法⼆.实验原理植物在个体发育的各个时期,代谢活动也发⽣相应的变化,碳⽔化合物的代谢也不例外其含量也随之发⽣变化。
了解可溶性糖含量的变化,在⽣理上和实践上都有重要的意义。
本实验采⽤蒽酮⽐⾊法测定可溶性糖的含量。
糖在硫酸的作⽤下⽣成糠醛,糠醛再与蒽酮作⽤,形成⼀种绿⾊的络合物.在低浓度时,625nm 的OD值与糖含量成正相关。
该实验⽅法简便,但没有专⼀性,对于绝⼤部分的碳⽔化合物都能与蒽酮反应,产⽣颜⾊。
三.实验⽤品721型分光光度计分析天平研钵恒温⽔浴锅烧杯刻度试管⼤试管活性炭移液管漏⽃酒精(80%)葡萄糖标准溶液:称取已在80℃烘箱中烘⾄恒重葡萄糖100mg,配制成500mL溶液,即得每mL含糖为200µg的标准溶液。
蒽酮试剂:称取1g经过纯化的蒽酮,溶解于1000mL稀硫酸中即得。
稀硫酸溶液由760mL浓硫酸(⽐重1.84)稀释成1000mL ⽽成。
四.实验步骤1.可溶性糖的提取称取0.5g的新鲜植物(青菜)叶⽚,于研钵中加80%酒精4ml,仔细研磨成匀浆,倒⼊离⼼管内,置于80℃⽔浴中不断搅拌30min,离⼼10分钟(5000转/min),收集上清液于10ml的刻度试管中,其残渣加2ml80%酒精重复提1次,合并上清液。
在上清液中加0.5g活性炭,80℃⽔浴脱⾊30min,定容⾄10ml,过滤后取滤液(稀释10倍或20倍后)测定。
2.显⾊及⽐⾊吸取上述糖提取液1mL,放⼊⼀⼲洁的试管中,加蒽酮试剂5mL混合之,于沸⽔浴中煮沸10分钟,取出冷却,然后于分光光度计上进⾏测定,波长为625nm,测得吸光度。
从标准曲线上查得滤液中得糖含量(或经直线回归公式计算),然后再⾏计算样品中含糖百分数。
3.绘制标准曲线取标准葡萄糖溶液将其稀释成⼀系列不同浓度的溶液,浓度分别为每mL含糖0、5、10、20、40、60、80µg。
实验8-可溶性总糖的测定(蒽酮法)

三、实验器材
1、仪器:分光光度计 2、试剂 1%蔗糖标准液:P110 100ug/L蔗糖标准液:P110 浓硫酸; 蒽酮乙酸乙酯试剂:1g 蒽酮溶于50 mL 乙酸 乙酯中,贮藏在棕色瓶中。 3、材料:植物叶片
四 实验步骤
1、植物样品中可溶性糖的提取与测定 (1)可溶性糖提取:将干净植物叶片剪碎混匀,准确称取0.10 克-0.30g3份(三个平行),放入刻度试管中,管内加入510ml蒸馏水,盖上塞子,沸水中提取30min,提取液过滤至 25ml容量瓶,反复冲洗试管及残渣,定容至刻度。 (2)测定:吸取0.5ml提取液于大试管中,加入蒸馏水1.5ml,加 入蒽酮乙酸乙酯试剂0.5ml和5ml浓硫酸,混匀,盖上塞子, 沸水浴中准确保温1min取出,自然冷却至室温,在630nm波长 下比色。
2、蔗糖标准曲线的制作
(1)取6支大试管,按下表数据配制一系列不同浓度 的蔗糖溶液:
管号
水(ml) 蔗糖含量(μg)
0
2 0
1
0.2 1.8 20
2
0.4 1.6 40
30.6 1.4 60 Nhomakorabea4
0.8 1.2 80
5
1.0 1.0 100
100ug/L蔗糖标准液(ml) 0
(2)在每支试管中立即加入蒽酮乙酸乙酯试剂0.5ml 和5ml浓硫酸,混匀,盖上塞子,沸水浴中准确保温 1min取出,自然冷却至室温,在630nm波长下比色。 以标准蔗糖含量作横坐标,以吸光值作纵坐标作标 准曲线。
3、结果计算
(C×V×n)
植物样品含糖量(%)=
×100
(a×W×106)
C-糖含量(μg); V-提取液体积(ml) a-吸取样品液体积(ml);n-稀释倍数 W-样品重(g)
植物中可溶性糖含量的测定

一、原理
糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值。但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差。此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。
表24-2苯酚法测可溶性糖绘制标准曲线的试剂量
试剂
100μg/L蔗糖标准液
(mL)
蒸馏水(mL)
蔗糖量(μg)管号00
2.0
01、2
0.2
1.8
203、4
0.4
1.6
405、6
0.6
1.4
607、8
0.8
1.2
809、10
1.0
1.
01002.可溶性糖的提取取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0.1~0.3 g,共3份,分别放入3支刻度试管中,加入5~10 mL蒸馏水,塑料薄膜封口,于沸水中提取30 min(提取2次),提取液过滤入25 mL容量瓶中,反复冲洗试管及残渣,定容至刻度。
实验植物组织中可溶性糖含量的测定

实验方案一、实验目的通过实验,掌握测定萝卜品质的方法(一)萝卜外部形态的测定1、实验材料取鲜样3个∕小区直尺、蒸馏水、笔、记录本、吸水纸2、实验方法.用自来水将各组萝卜洗净后,再用蒸馏水洗涤,擦干表面水分.每个小区取3个重复,用电子天平称量每株的鲜重,用直尺测量植株的茎长、茎粗、叶长,取平均值作为指标值实验(二) 植物体内可溶性糖含量的测定(蒽酮法)一、实验目的了解蒽酮法测定可溶性糖含量的原理;掌握分光光度计的使用二、实验原理糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。
不同载培条件,不同成熟度都可以影响水果、蔬菜中糖类的含量。
因此对水果、蔬菜中可溶性糖的测定,可以了解和鉴定水果、蔬菜品质的高低。
蒽酮比色定糖法是一个快速而方便的定糖方法,在强酸性条件下,蒽酮可以与游离的或多糖中存在的己糖、戊糖及己糖醛酸(还原性和非还原性)作用生成蓝绿色的糖醛衍生物,其颜色的深浅与糖的含量在一定范围内成正比。
蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。
当存在含有较多色氨酸的蛋白质时,反应不稳定,呈现红色。
上述特定的糖类物质,反应较稳定。
该法特点:灵敏度高,测定量少,快速方便。
三、材料、仪器及试剂1.材料:植物种子、白菜叶、柑桔2.仪器:分光光度计;恒温水箱; 20ml具塞刻度试管(3支)漏斗;100ml容量瓶;刻度试管;试管架;剪刀;研钵3.试剂(1)200μg/ml标准葡萄糖:AR级葡萄糖100mg,蒸馏水溶解,定容至500ml。
(2)蒽酮试剂:1g蒽酮,用乙酸乙酯溶解,定容至50ml,棕色瓶避光处贮藏;(3)浓硫酸四、实验方法1.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡2.称取1克白菜叶,剪碎,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20ml刻度试管中,用10ml蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。
植物生理指标检测方法

植物生理指标检测方法植物组织中可溶性糖含量的测定作为一种营养素,主要指可溶性糖和淀粉。
其营养功能主要包括:合成纤维素形成细胞壁;转化并形成其他有机物质,如核苷酸、核酸等;分解产物是合成许多其他有机化合物的原料,例如糖在呼吸过程中形成的有机酸,可以转化为氨基酸作为NH3受体;作为呼吸基质,糖为作物的各种合成过程和生命活动提供能量。
因为碳水化合物具有这些重要的功能,它是营养中最基本、最需要的物质。
ⅰ蒽酮法测定可溶性糖一、原则糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。
该方法的特点是,它可以测定几乎所有的碳水化合物,不仅是戊糖和己糖的含量,还可以测定所有低聚糖和多糖,包括淀粉和纤维素(因为反应溶液中的浓硫酸可以将多糖水解成单糖并反应),所以蒽酮法测得的碳水化合物含量实际上是溶液中所有可溶性碳水化合物的总量。
不需要对所有种类的碳水化合物进行详细的划分,可以用蒽酮法一次测量总量,省去了很多麻烦。
因此,它具有特殊的应用价值。
然而,在测定水溶性碳水化合物时,应注意不要将样品的未溶解残留物添加到反应溶液中,否则由于细胞壁中的纤维素和半纤维素与蒽酮试剂反应,会增加测量误差。
此外,不同糖和蒽酮试剂的显色深度不同,果糖最深,葡萄糖次之,半乳糖和甘露糖较浅,戊糖较浅。
因此,在测定糖混合物时,误差通常由不同糖的不同比例引起,但在测定单一糖时,可以避免这种误差。
糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为620nm,故在此波长下进行比色。
二、实验材料、试剂与仪器设备(一)实验材料任何植物鲜样或干样。
(二)试剂1.80%乙醇。
2.葡萄糖标准溶液(100)μG/ml):准确称取分析纯无水葡萄糖100mg,溶于蒸馏水中,定容至100ml,使用时稀释10倍(100%)3.蒽酮试剂:称取1.0g蒽酮,溶于80%浓硫酸(将98%浓硫酸稀释,把浓硫酸缓缓加入到蒸馏水中)1000ml中,冷却至室温,贮于具塞棕色瓶内,冰箱保存,可使用2~3周。
植物组织中可溶性糖含量的测定(蒽酮法)

Ⅳ、植物组织中可溶性糖含量的测定(蒽酮法)一、目的掌握蒽酮法测定糖的原理和技术。
二、原理糖类(包括单糖、双糖、寡糖)在浓硫酸存在下,脱水生成糠醛或羟甲基糠醛,然后蒽酮与糠醛或羟甲基糠醛经脱水缩合,生成蓝绿色的糠醛衍生物,颜色深浅与糖浓度成正相关。
其反应式如下:显色反应与反应温度、加热时间、反应系统中水和硫酸比例有关。
本实验通过控制反应系统中水和硫酸比例,利用硫酸与水发生水合作用释放的热能,使反应系统自行升温而达到显色效果免去外加热步骤。
蒽酮法具有很高灵敏度,适用于糖的微量测定,且试剂简单,操作简便,因而得到普遍应用。
三、材料、仪器设备及试剂1.材料:烘干材料粉末(过筛100目)或剪碎混匀鲜样品。
2.仪器设备: 分光光度计;电子分析天平;水浴锅;100ml容量瓶;试管;漏斗;剪刀;移液管;洗耳球等。
3.试剂及配制:蒽酮试剂:称取蒽酮200mg溶于100ml浓硫酸中。
该试剂不能久贮,宜用前配制。
100μg·ml-1蔗糖标准母液:准确称取蔗糖100mg于烧杯加少量水溶解后,洗入100ml容量瓶中定容至刻度。
四、实验步骤1.蔗糖标准曲线制作1.1取6支试管,编号,按下表配制每管含量为0~100μg蔗糖标准液加入表中试剂后,向各管沿管壁迅速加入蒽酮试剂6.5ml,并立即摇动使混合均匀,置试管架上室温下显色,冷却后倒入比色杯,以0号管作空白对照,在620nm波长处,以多点校准总量法,制作标准曲线。
2.样品提取称取干样品粉末100mg或剪碎混匀的鲜样品1g,放入试管中,加入蒸馏水10ml,置于沸水浴中提取20min,冷却后过滤入100ml容量瓶中,以热水冲洗残渣2~3次,一并滤入容量瓶中,待冷至室温,定容至刻度,即为样品待测液。
3.糖含量测定吸取待测液0.2ml(含糖量30~80μg),加入试管中,再加蒸馏水2.3ml,摇匀。
随后沿试管壁迅速加入蒽酮试剂6.5ml,立刻摇动混合均匀,置于试管架上显色,冷却至室温后,以空白管作对照,在620nm波长处,按多点校准定量法测定待测管中提取液糖含量。
实验8 植物组织中可溶性糖含量的测定(蒽酮比色法)

实验七植物体内可溶性糖含量的测定(蒽酮法)一、实验目的了解蒽酮法测定可溶性糖含量的原理;掌握分光光度计的使用二、实验原理糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。
不同载培条件,不同成熟度都可以影响水果、蔬菜中糖类的含量。
因此对水果、蔬菜中可溶性糖的测定,可以了解和鉴定水果、蔬菜品质的高低。
蒽酮比色定糖法是一个快速而方便的定糖方法,在强酸性条件下,蒽酮可以与游离的或多糖中存在的己糖、戊糖及己糖醛酸(还原性和非还原性)作用生成蓝绿色的糖醛衍生物,其颜色的深浅与糖的含量在一定范围内成正比。
蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。
当存在含有较多色氨酸的蛋白质时,反应不稳定,呈现红色。
上述特定的糖类物质,反应较稳定。
该法特点:灵敏度高,测定量少,快速方便。
三、材料、仪器及试剂1.材料:植物种子、白菜叶、柑桔2.仪器:分光光度计;恒温水箱; 20ml具塞刻度试管(3支)漏斗;100ml容量瓶;刻度试管;试管架;剪刀;研钵3.试剂(1)200μg/ml标准葡萄糖:AR级葡萄糖100mg,蒸馏水溶解,定容至500ml。
(2)蒽酮试剂:1g蒽酮,用乙酸乙酯溶解,定容至50ml,棕色瓶避光处贮藏;(3)浓硫酸四、实验方法1.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡称取1克白菜叶,剪碎,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20ml刻度试管中,用10ml蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。
置沸水浴中加盖煮沸10分钟,冷却后过滤,滤液收集于100ml容量瓶中,用蒸馏水定容至刻度,摇匀备用。
3.糖含量测定用移液管吸收1ml提取液于20ml具塞刻度试管中,加1ml水和0.5ml 蒽酮试剂。
实验十蒽酮比色法测定植物组织中总糖和可溶性糖的含量

实验十蒽酮比色法测定植物组织中总糖和可溶性糖的含量一、实验目的掌握蒽酮法测定总糖和可溶性糖含量的原理和方法。
二、实验原理蒽酮比色法是一个快速而简便的定糖方法。
酸可使糖类(如已糖基,戊醛糖及已糖醛酸)脱水生成糠醛,生成的糠醛或烃甲基糖醛与蒽酮脱水缩合,形成糠醛的衍生物,呈蓝绿色,该物质在620nm处有最大光吸收值。
在10~100ug范围内其他颜色的深浅与可溶性糖含量成正比。
蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。
当存在含有较多色氨酸蛋白质时,反应不稳定,呈现红色。
而对于上述特定的糖类物质,反映较稳定。
多糖和寡糖可用酸水解成单塘和蒽酮试剂反应,因此利用蒽酮法可测组织中总糖和可溶性糖。
这一种方法具有很高的灵敏度,糖含量在30ug左右时就能进行测定,所以可作为微量测糖之用。
一般样品少的情况下,采用这一方法比较合适。
三、仪器,试剂和材料1.仪器(1)分光光度计;(6)漏斗,漏斗架个6个(2)电子天平;(7)容量瓶:50ml2个;(3)三角瓶:50ml2个(8)移液管;(4)刻度具塞试管;10ml13支;(9)水浴锅。
(5)试管架,试管夹各2个;2.试剂(1)葡萄糖标准液:100ug/ml;(2)浓硫酸;(3)蒽酮试剂:0.2g蒽酮,溶于100ml浓流酸中,现当日配制使用。
3.材料小麦幼苗分蕖节或其植物的幼嫩组织(大白菜心)。
四、操作步骤1.葡萄糖标准曲线的制作取7支试管,按下表配制一系列不同浓度的葡萄糖溶液;管号1234567葡萄糖标准液/mL00.10.20.30.40.50.6蒸馏水/mL 1.00.90.80.70.60.70.8葡萄糖含量/ug0102030405060在每支试管中,加入蒽酮试剂4.0ml,迅速浸入冰水浴中冷却。
各加完后一起浸入沸水浴中,管口加盖玻璃球,以防蒸发。
自水浴重新煮沸起,准确煮沸10min取出,用流水冷却,室温放置10min,在620nm波长下比色。
以标准葡萄糖含量(ug)做横坐标,以吸光值作纵坐标,做出标准曲线。
实验四___植物组织中可溶性糖含量的测定

一、实验目的:掌握蒽酮比色法测定可溶性糖含量的 提取和方法原理;掌握分光光度计中标准曲线制作的 使用程序。 二、实验原理:(P48) 三、实验材料:绿豆黄化苗四、实验步骤: 1.可溶性糖的提取:材料不需烘干(1 g鲜重)加入10 mL
纯水,80℃水浴30min,过滤后定容至50mL 。(不必脱色和离 心)
按“SET”进行设置,按“↓翻页”可在标样间切换,设置完毕后。 按“100T%”调零,出现:
请将参比杯拉入光路! ENT确认
参比测量后按“ENT”,出现:
请置入样品比色皿标号:
输入标号后,出现:
请将样品拉入光路! ENT确认
按“ENT”确认,拉动拉杆,进入下一比色皿的测量。测量结 束后,得到标准曲线,按“ESC”退回上一层界面。
按“1”进入样品“测量”功能。(此功能是对样品的测量,需 要有参比杯做对照。)按“ENT”,出现:
请将参比杯拉入光路! ENT确认
测量后,按“ENT”,出现:
请置入样品比色皿标号:
依次测量。 按“3”进入“置入曲线”,(此功能主要用于标准曲线做 完后无法及时做样品测量,故记下曲线公式,在进行测量 前直接输入曲线)页面如下: 置入曲线 当前曲线:C= A+ SET修改↓翻页
723G型分光光度计“标准曲线”建立方法
浓度测量 1 测量 2 AC建 曲线 3 置入 曲线 1-4选择 4 参数 PRN打印 设置 进行此功能操作流程如下:
Байду номын сангаас
在主界面下,按“2”进入“浓度测量”功能,出现如下界面:
按“2”进入“AC建曲线”功能,出现如下界 面: 比色皿: 测建曲线 波长: 标样个数: 标样A1: SET修改↓翻页
实验8植物组织中可溶性糖含量测定(蒽酮比色法)

实验方案一、实验目的通过实验,掌握测定萝卜品质的方法(一)萝卜外部形态的测定1、实验材料取鲜样3个∕小区直尺、蒸馏水、笔、记录本、吸水纸2、实验方法.用自来水将各组萝卜洗净后,再用蒸馏水洗涤,擦干表面水分.每个小区取3个重复,用电子天平称量每株的鲜重,用直尺测量植株的茎长、茎粗、叶长,取平均值作为指标值实验(二) 植物体内可溶性糖含量的测定(蒽酮法)一、实验目的了解蒽酮法测定可溶性糖含量的原理;掌握分光光度计的使用二、实验原理糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。
不同载培条件,不同成熟度都可以影响水果、蔬菜中糖类的含量。
因此对水果、蔬菜中可溶性糖的测定,可以了解和鉴定水果、蔬菜品质的高低。
蒽酮比色定糖法是一个快速而方便的定糖方法,在强酸性条件下,蒽酮可以与游离的或多糖中存在的己糖、戊糖及己糖醛酸(还原性和非还原性)作用生成蓝绿色的糖醛衍生物,其颜色的深浅与糖的含量在一定范围内成正比。
蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。
当存在含有较多色氨酸的蛋白质时,反应不稳定,呈现红色。
上述特定的糖类物质,反应较稳定。
该法特点:灵敏度高,测定量少,快速方便。
三、材料、仪器及试剂1.材料:植物种子、白菜叶、柑桔2.仪器:分光光度计;恒温水箱; 20ml具塞刻度试管(3支)漏斗;100ml容量瓶;刻度试管;试管架;剪刀;研钵3.试剂(1)200μg/ml标准葡萄糖:AR级葡萄糖100mg,蒸馏水溶解,定容至500ml。
(2)蒽酮试剂:1g蒽酮,用乙酸乙酯溶解,定容至50ml,棕色瓶避光处贮藏;(3)浓硫酸四、实验方法1.葡萄糖标准曲线的制作取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。
在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标准葡2.称取1克白菜叶,剪碎,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20ml刻度试管中,用10ml蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。
植物组织中可溶性糖含量测定方案

植物组织中可溶性糖含量的测定—蒽酮比色法一、原理糖类在浓硫酸作用下经脱水反应生成糠醛或羟甲基糖醛,生成的糠醛或羟甲基糖醛与蒽酮(C14H10O)脱水缩合,形成糠醛的衍生物,呈蓝绿色。
该物质在630 nm处有最大吸收,在150 µg/mL范围内,其颜色的深浅与可溶性糖含量成正比。
该方法的特点是几乎可以测定所有的糖类(包括单糖:戊糖、已糖;多糖:蔗糖、淀粉、纤维素),所以用该方法测出的糖类含量是溶液中全部可溶性糖类含量。
二、仪器、试剂和材料1.仪器:电子天平,电热恒温水浴锅,分光光度计,容量瓶,刻度吸管等2.试剂:(1) 蒽酮浓硫酸试剂:1.0 g蒽酮溶于100 mL浓H2SO4中,贮藏于棕色瓶中(当日配置)(2) 浓硫酸3.材料:草莓新鲜果实三、实验步骤1、标准曲线的制作1、1 1 %蔗糖标准液:将分析纯蔗糖在80℃下烘干至恒重,精确称取1.000g。
加蒸馏水溶解,转入100mL容量瓶中,用蒸馏水定容至刻度。
1、2 100ug/mL蔗糖标准液:精确吸取1%蔗糖标准液1mL至100mL容量瓶中,加水至刻度。
取10mL刻度试管11支,从0~10分别编号,按下表一次加入蔗糖标准液和蒸馏水。
1、3 按顺序依次向试管中加入5mL蒽酮浓硫酸试剂,充分振荡,立即将试管放入96℃沸水浴中,每管均保温3min,取出后流水冷却后取出至室温下放置15min,以空白作参比,在630 nm处测其吸光度,以吸光度为横坐标,以糖浓度为纵坐标,绘制标准曲线,并求出标准线性方程。
2、可溶性糖提取称取具有代表性样品的可食部分100 g,放人组织捣碎机中,迅速捣成匀浆(或研磨),称取0.50 g浆状样品,共三份。
分别放入3支试管中,加入10 mL蒸馏水,塑料薄膜封口,于沸水中提取30min(提取2次),提取液过滤到50 mL容量瓶中,用蒸馏水反复洗涤试管及残渣并定容至刻度。
吸取上述1.0mL提取液至10mL容量瓶中,用蒸馏水定容。
植物组织中可溶性糖含量的测定
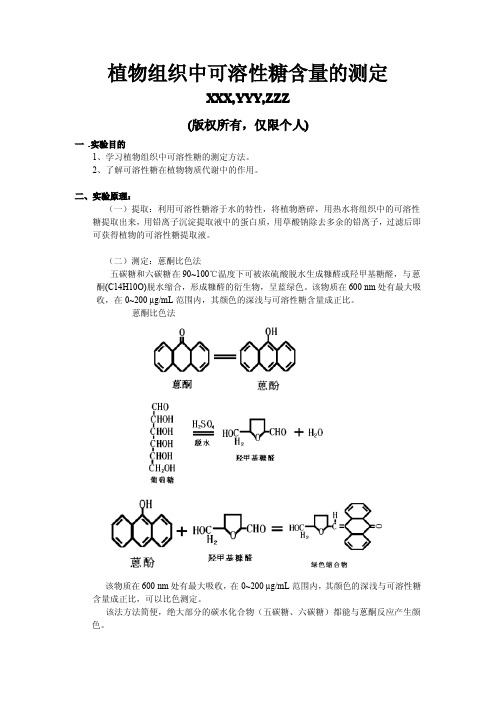
植物组织中可溶性糖含量的测定XXX,YYY,ZZZ(版权所有,仅限个人)一.实验目的1、学习植物组织中可溶性糖的测定方法。
2、了解可溶性糖在植物物质代谢中的作用。
二、实验原理:(一)提取:利用可溶性糖溶于水的特性,将植物磨碎,用热水将组织中的可溶性糖提取出来,用铅离子沉淀提取液中的蛋白质,用草酸钠除去多余的铅离子,过滤后即可获得植物的可溶性糖提取液。
(二)测定:蒽酮比色法五碳糖和六碳糖在90~100℃温度下可被浓硫酸脱水生成糠醛或羟甲基糖醛,与蒽酮(C14H10O)脱水缩合,形成糠醛的衍生物,呈蓝绿色。
该物质在600nm处有最大吸收,在0~200µg/mL范围内,其颜色的深浅与可溶性糖含量成正比。
蒽酮比色法该物质在600nm处有最大吸收,在0~200µg/mL范围内,其颜色的深浅与可溶性糖含量成正比,可以比色测定。
该法方法简便,绝大部分的碳水化合物(五碳糖、六碳糖)都能与蒽酮反应产生颜色。
三、实验材料:大白菜Brassica campestris ssp.pekinensis四.实验步骤:1.标准曲线的绘制配制浓度分别为0,50,100,150,200µg/ml的糖标准溶液各10ml。
显色:取糖标准液lml于一干洁的试管中,加蒽酮试剂5ml混合,于沸水浴中煮沸10分钟。
比色:测定A600nm的吸光度值。
浓度:ug/mL050100150200吸光度:a00.1950.3550.5150.689绘制标准曲线:.可溶性糖的提取:称取0.250g待测植物叶片,放入研钵中,加少许乙醚研磨成均浆,用70℃的热水洗涤研钵,植物材料和洗涤后的溶液全量转移到100ml烧杯中,使总体积在30~ 40ml,将烧杯放在水浴锅中70~80℃半小时,冷却后滴加饱和中性醋酸铅以除去溶液中的蛋白质,连同残渣一起全量转移到100ml容量瓶中,定容,充分摇匀,用干燥漏斗过滤于一干燥的三角瓶中,瓶中事先放入少量(约0.2-0.4g)的草酸钠粉末,除去滤液中过量的铅,使生成草酸铅沉淀再行过滤,所得透明滤液即为可溶性糖提取液。
植物组织中可溶性糖和

实验十三、植物组织中可溶性糖和淀粉含量的测定——硫酸蒽酮法一、实验目的和意义可溶性糖和淀粉是粮食作物、蔬菜和水果中C素营养的主要营养物质。
糖类作为呼吸基质,为植物的各种合成过程和各种生命活动提供所需的能量,因此通过测定植物组织中可溶性糖和淀粉的含量可以在一定程度上了解植物各组织器官中的营养状况。
测定植物组织中可溶性糖的方法有苯酚法、蒽酮法;测定植物组织中淀粉含量方法有酮法、双波长法、农业部法和国标法。
二、实验方法原理(硫酸蒽酮法)淀粉是由葡萄糖残基组成,在酸性条件下加热使其水解成葡萄糖,然后在浓硫酸的作用下,使单糖脱水生成糠醛类化合物,利用蒽酮试剂与糠醛化合物的显色反应,即可进行比色测定。
1 实验方案高氯酸(2次提取)蒽酮试剂样品中淀粉葡萄糖80%乙醇蒽酮试剂样品可溶性糖浸提液2 显色原理可溶性糖类遇浓硫酸,就会脱水形成羟甲基糠醛,羟甲基糠醛与蒽酮再脱水,形成蓝绿色的糠醛衍生物,其颜色深浅与含糖量高低成正相关。
该蓝绿色在620nm波长处有最大吸收值,故可进行比色测定。
己糖羟甲基糠醛糠醛衍生物(蓝绿色)蒽酮(本法适于测定己糖、蔗糖和可溶性淀粉)3 仪器药品(1)仪器:分光光度计;天平(万分之一);离心管(4000转/分);恒温水浴;容量瓶;试管(25*200mm);移液管(5、1、0.5ml);量筒;水浴锅;电炉;漏斗;滤纸。
(2)药品:80%乙醇;标准葡萄糖(100ug.l-1);准确称取100mg分析纯无水葡萄糖,溶于蒸馏水并定容至100ml,使用时再稀释10倍;蒽酮试剂:称取200mg蒽酮,溶于100ml浓硫酸(比重1.84)中,冷却至室温,贮存在棕色瓶内,当天配制当天使用;9.2mol.l-1和4.6mol.l-1高氯酸。
4 测定方法(1)样品中可溶性糖提取对于淀粉含量高的样品,要用80%的乙醇提取。
称取0.1g粉碎过100目筛的烘干样品,置于10ml离心管中,加入6-7ml 80%乙醇,在80℃水浴中提取30分钟,取出离心(3000转/分)5分钟,收集上清夜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ⅳ、植物组织中可溶性糖含量的测定(蒽酮法)
一、目的
掌握蒽酮法测定糖的原理和技术。
二、原理
糖类(包括单糖、双糖、寡糖)在浓硫酸存在下,脱水生成糠醛或羟甲基糠醛,然后蒽酮与糠醛或羟甲基糠醛经脱水缩合,生成蓝绿色的糠醛衍生物,颜色深浅与糖浓度成正相关。
其反应式如下:
显色反应与反应温度、加热时间、反应系统中水和硫酸比例有关。
本实验通过控制反应系统中水和硫酸比例,利用硫酸与水发生水合作用释放的热能,使反应系统自行升温而达到显色效果免去外加热步骤。
蒽酮法具有很高灵敏度,适用于糖的微量测定,且试剂简单,操作简便,因而得到普遍应用。
三、材料、仪器设备及试剂
1.材料:烘干材料粉末(过筛100目)或剪碎混匀鲜样品。
2.仪器设备: 分光光度计;电子分析天平;水浴锅;100ml容量瓶;试管;漏斗;剪刀;移液管;洗耳球等。
3.试剂及配制:
蒽酮试剂:称取蒽酮200mg溶于100ml浓硫酸中。
该试剂不能久贮,宜用前配制。
100μg·ml-1
蔗糖标准母液:准确称取蔗糖100mg于烧杯加少量水溶解后,洗入
100ml容量瓶中定容至刻度。
四、实验步骤
1.蔗糖标准曲线制作
1.1取6支试管,编号,按下表配制每管含量为0~100μg蔗糖标准液
加入表中试剂后,向各管沿管壁迅速加入蒽酮试剂6.5ml,并立即摇动使混合均匀,置试管架上室温下显色,冷却后倒入比色杯,以0号管作空白对照,在620nm波长处,以多点校准总量法,制作标准曲线。
2.样品提取
称取干样品粉末100mg或剪碎混匀的鲜样品1g,放入试管中,加入蒸馏水10ml,置于沸水浴中提取20min,冷却后过滤入100ml容量瓶中,以热水冲洗残渣2~3次,一并滤入容量瓶中,待冷至室温,定容至刻度,即为样品待测液。
3.糖含量测定
吸取待测液0.2ml(含糖量30~80μg),加入试管中,再加蒸馏水2.3ml,摇匀。
随后沿试管壁迅速加入蒽酮试剂6.5ml,立刻摇动混合均匀,置于试管架上显色,冷却至室温后,以空白管作对照,在620nm波长处,按多点校准定量法测定待测管中提取液糖含量。
五、结果计算。
