热力学作业答案讲解
工程热力学课后作业答案(第三章)第五版

3-1 安静状态下的人对环境的散热量大约为400KJ/h,假设能容纳2000人的大礼堂的通风系统坏了:(1)在通风系统出现故障后的最初20min内礼堂中的空气内能增加多少?(2)把礼堂空气和所有的人考虑为一个系统,假设对外界没有传热,系统内能变化多少?如何解释空气温度的升高。
解:(1)热力系:礼堂中的空气。
闭口系统根据闭口系统能量方程Q+=∆UW因为没有作功故W=0;热量来源于人体散热;内能的增加等于人体散热。
⨯Q=2.67×105kJ2000⨯=2060/400(1)热力系:礼堂中的空气和人。
闭口系统根据闭口系统能量方程∆=Q+UW因为没有作功故W=0;对整个礼堂的空气和人来说没有外来热量,所以内能的增加为0。
空气温度的升高是人体的散热量由空气吸收,导致的空气内能增加。
3-5,有一闭口系统,从状态1经a变化到状态2,如图,又从状态2经b回到状态1;再从状态1经过c 变化到状态2。
在这个过程中,热量和功的某些值已知,如表,试确定未知量。
解:闭口系统。
使用闭口系统能量方程(1)对1-a-2和2-b-1组成一个闭口循环,有⎰⎰=WδQδ即10+(-7)=x1+(-4)x1=7 kJ(2)对1-c-2和2-b-1也组成一个闭口循环x2+(-7)=2+(-4)x2=5 kJ(3)对过程2-b-1,根据W U Q +∆==---=-=∆)4(7W Q U -3 kJ3-6 一闭口系统经历了一个由四个过程组成的循环,试填充表中所缺数据。
解:同上题3-7 解:热力系:1.5kg 质量气体闭口系统,状态方程:b av p +=)]85115.1()85225.1[(5.1---=∆v p v p U =90kJ由状态方程得1000=a*0.2+b200=a*1.2+b解上两式得:a=-800b=1160则功量为2.12.0221]1160)800(21[5.15.1v v pdv W --==⎰=900kJ 过程中传热量 WU Q +∆==990 kJ3-8 容积由隔板分成两部分,左边盛有压力为600kPa ,温度为27℃的空气,右边为真空,容积为左边5倍。
【精品】热力学作业题答案

【关键字】精品第二章2-1.使用下述方法计算1kmol 甲烷贮存在体积为0.1246m 3、温度为50℃的容器中产生的压力:(1)理想气体方程;(2)R-K 方程;(3)普遍化关系式。
解:甲烷的摩尔体积V =0.1246 m 3/1kmol=124.6 cm 3/mol查附录二得甲烷的临界参数:T c =190.6K P c =4.600MPa V c =99 cm 3/mol ω=0.008 (1) 理想气体方程P=RT/V=8.314×323.15/124.6×10-6=21.56MPa(2) R-K 方程 ∴()0.5RT aPV b T V V b =--+=19.04MPa (3) 普遍化关系式323.15190.6 1.695r c T T T === 124.6 1.259r c V V V ===<2∴利用普压法计算,01Z Z Z ω=+∵ c r ZRTP P P V == ∴c r PV Z P RT =迭代:令Z 0=1→P r0=4.687 又Tr=1.695,查附录三得:Z 0=0.8938 Z 1=0.462301Z Z Z ω=+=0.8938+0.008×0.4623=0.8975此时,P=P c P r =4.6×4.687=21.56MPa同理,取Z 1=0.8975 依上述过程计算,直至计算出的相邻的两个Z 值相差很小,迭代结束,得Z 和P 的值。
∴ P=19.22MPa2-4.将压力为2.03MPa 、温度为477K 条件下的2.83m 3NH 3压缩到0.142 m 3,若压缩后温度448.6K ,则其压力为若干?分别用下述方法计算:(1)Vander Waals 方程;(2)Redlich-Kwang 方程;(3)Peng-Robinson 方程;(4)普遍化关系式。
解:查附录二得NH 3的临界参数:T c =405.6K P c =11.28MPa V c =72.5 cm 3/mol ω=0.250 (1) 求取气体的摩尔体积对于状态Ⅰ:P=2.03 MPa 、T=447K 、V=2.83 m 3477405.6 1.176r c T T T === 2.0311.280.18r c P P P ===—普维法∴01.6 1.60.4220.4220.0830.0830.24261.176r BT =-=-=- 11c r c rBP PV BP P Z RT RT RT T =+==+→V=1.885×10-3m 3/mol∴n=2.83m 3/1.885×10-3m 3/mol=1501mol对于状态Ⅱ:摩尔体积V=0.142 m 3/1501mol=9.458×10-5m 3/mol T=448.6K (2) Vander Waals 方程 (3) Redlich-Kwang 方程 (4) Peng-Robinson 方程 ∵448.6405.6 1.106r c T T === ∴220.3746 1.542260.269920.3746 1.542260.250.269920.250.7433k ωω=+-=+⨯-⨯=∴()()()a T RTPV b V V b b V b =--++- (5) 普遍化关系式 ∵559.458107.2510 1.305r c V V V --==⨯⨯=<2 适用普压法,迭代进行计算,方法同1-1(3)2-7:答案: 3cm第三章3-3. 试求算1kmol 氮气在压力为10.13MPa 、温度为773K 下的内能、焓、熵、V C 、p C 和自由焓之值。
热力学练习题全解

热力学练习题全解热力学是研究热能转化和热力学性质的科学,它是物理学和化学的重要分支之一。
在热力学中,我们通过解决一系列练习题来巩固和应用所学知识。
本文将为您解答一些热力学练习题,帮助您更好地理解和应用热力学的基本概念和计算方法。
1. 练习题一题目:一个理想气体在等体过程中,吸收了50 J 的热量,对外界做了30 J 的功,求该气体内能的变化量。
解析:根据热力学第一定律,内能变化量等于热量和功之和。
即ΔU = Q - W = 50 J - 30 J = 20 J。
2. 练习题二题目:一摩尔理想气体从A状态经过两个等温过程和一段绝热过程转变为B状态,A状态和B状态的压强和体积分别为P₁、P₂和V₁、V₂,已知 P₂ = 4P₁,V₁ = 2V₂,求这个过程中气体对外界做的总功。
解析:由两个等温过程可知,气体对外界做的总功等于两个等温过程的功之和。
即 W = W₁ + W₂。
根据绝热过程的特性,绝热过程中气体对外做功为零。
因此,只需要计算两个等温过程的功即可。
根据理想气体的状态方程 PV = nRT,结合已知条件可得:P₁V₁ = nRT₁①P₂V₂ = nRT₂②又已知 P₂ = 4P₁,V₁ = 2V₂,代入式①和式②可得:8P₁V₂ = nRT₁③4P₁V₂ = nRT₂④将式③和式④相减,可得:4P₁V₂ = nR(T₁ - T₂) ⑤由于这两个等温过程温度相等,即 T₁ = T₂,代入式⑤可得:4P₁V₂ = 0所以,这个过程中气体对外界做的总功 W = 0 J。
通过以上两个练习题的解答,我们可以看到在热力学中,我们通过应用热力学第一定律和理想气体的状态方程等基本原理,可以解答各种热力学问题。
熟练掌握这些计算方法,有助于我们更深入地理解热力学的基本概念,并应用于实际问题的解决中。
总结:本文对两道热力学练习题进行了详细解答,分别涉及了等体过程和等温过程。
通过这些例题的解析,读者可以理解和掌握热力学的基本计算方法,并将其应用于实际问题的求解中。
热力学课后习题04答案

空气
10cm
热量
图 4-19 习题 4-12
解:(1) Q = ∆U +W = mcV ∆T + p∆V
Q
=
∆U
+W
=
mcV ∆T
+
p∆V
=
pV RgT
Rg ∆T κ −1
+
p∆V
Q
=
⎛⎝⎜101325
+
20× 9.80665 40 ×10−4
⎞ ⎟⎠
×
⎛ ⎜⎜⎝
40 ×10−4 ×10 ×10−2
0.4MPa,然后又可逆绝热地膨胀至初始体积。已知该气体的 cp=0.93kJ/(kg•K),k=1.4。求:
(1)该气体的气体常数和质量;
(2)压缩过程中气体与外界交换的热量;
(3)膨胀过程中气体热力学能的变化。
解:(1)由 cp
=
κ κ −1 Rg
,得 Rg
=
265.7J/ (kg ⋅ K)
根据
= 87572.9J
4-9 2kg 某理想气体按可逆多变过程膨胀到原有容积的 3 倍,温度从 300℃下降至 60℃, 膨胀过程中的膨胀功为 100kJ,自外界吸热 20kJ。求该气体的 cp 和 cv。
解: Q = ∆U +W , ∆U = 20 −100 = −80kJ
∆U = mcV (T2 − T1 ) , −80 = 2× cV × (60 − 300) ,得 cV = 0.1667kJ/ (kg ⋅ K)
∆S A
=
⎛ m⎜cp
⎝
ln TA2 TA1
− Rg
ln
pB 2 pB1
第8章热力学作业老师用含答案

班级 姓名 学号一、填空题1.一卡诺热机的低温热源温度为280K ,效率为40%,若使效率提高到50%而保持低温热源的温度不变,高温热源温度必须增加 K 。
解:121T T -=ηΘ 4.028*******=-=-=∴T T T η 5.0280111122='-='-=∴T T T η 解得 K T T T 3.9311=-'=∆2.10 mol 的单原子分子理想气体,在压缩过程中外力作功209 J ,气体温度升高1 K ,则气体内能 的增量△E 为 J 。
气体吸收的热量Q 为 J 。
解:3.一台冰箱工作时,其冷冻室中的温度为 -10℃,室温为15℃。
若按理想卡诺致冷循环计算, 则此致冷机每消耗103J 的功。
可以从冷冻室中吸出 ×104J 的热量 。
解:2122T T T W Q e -==Θ 可得 J W T T T Q 4321221005.110)27310()27315(27310⨯=⨯+--++-=⨯-=4.一理想气体经历一次卡诺循环对外作功1000 J ,卡诺循环的高温热源温度T 1 = 500 K ,低温热源的温度T 2 = 300 K ,则在一次循环过程中,在高温热源处吸热Q 1 = 2500 J ;在低温热源处放热Q 2 = 1500 J 。
解:4.050030011112121=-=-=-==T T Q Q Q W ηΘ 可得J W Q 25004.010004.01===; J Q Q 150025006.06.012=⨯== 5.1摩尔的单原子理想气体,在等体过程中温度从27℃加热到77℃,则吸收的热量为 J 。
解:6.一定量的空气吸收了×103J 的热量,并保持在×105Pa 下膨胀,体积从×10-2m 3增加到J T R T T C M m E V 65.124131.823102310)(12m ,=⨯⨯⨯=∆⨯⨯=-=∆JW E Q 35.8420965.124-=-=+∆=J T R T T C M m Q V V 25.623)300350(31.8231231)(12m ,=-⨯⨯⨯=∆⨯⨯=-=×10-2m 3,则空气对外界做的功为 500 J ;空气的内能改变了 ×103J 。
第八章的热力学作业(答案详解)

一、选择题[ A ]1.(基础训练4)一定量理想气体从体积V 1,膨胀到体积V2分别经历的过程是:A →B等压过程,A→C 等温过程;A →D 绝热过程,其中吸热量最多的过程(A)是A →B. (B)是A →C. (C)是A →D.(D)既是A →B 也是A →C , 两过程吸热一样多。
【提示】功即过程曲线下的面积,由图可知AD AC AB A A A >>; 根据热力学第一定律:E A Q ∆+= AD 绝热过程:0=Q ; AC 等温过程:AC A Q =;AB 等压过程:AB AB E A Q ∆+=,且0>∆A B E[ B ]2.(基础训练6)如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是(A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ.【提示】该过程是绝热自由膨胀:Q=0,A=0;根据热力学第一定律Q A E =+∆得 0E ∆=,∴0T T =;根据状态方程pV RT ν=得00p V pV =;已知02V V =,∴0/2p p =.[ D ]3.(基础训练10)一定量的气体作绝热自由膨胀,设其热力学能增量为E ∆,熵增量为S ∆,则应有(A) 0......0=∆<∆S E (B) 0......0>∆<∆S E . (C) 0......0=∆=∆S E . (D) 0......0>∆=∆S E 【提示】由上题分析知:0=∆E ;而绝热自由膨胀过程是孤立系统中的不可逆过程,故熵增加。
[ D ]4.(自测提高1)质量一定的理想气体,从相同状态出发,分别经历等温过程、等压过程和绝热过程,使其体积增加1倍.那么气体温度的改变(绝对值)在 (A) 绝热过程中最大,等压过程中最小. (B) 绝热过程中最大,等温过程中最小. (C) 等压过程中最大,绝热过程中最小.(D) 等压过程中最大,等温过程中最小. 【提示】如图。
工程热力学作业答案解析——第一章作业

姓名:舒小华 学号:0618003139.容器被分隔成A 、B 两室,如1-27所示,已知当场大气压P b =0.1013MPa ,气压表2的读数P e2=0.04MPa ,气压表1的读数P e1=0.294MPa ,求气压表的3的读数(用MPa 表示)。
解:用P 表示绝对压力,则有Pe P P +=环境得到1e b A P P P += (1)2e B A P P P += (2)3P e b B P P += (3)(1)(2)(3)联立可得213e P e e P P -==(0.294-0.04)MPa=0.254MPa所以气压表3的读数为0.254MPa 。
16. 某种气体在气缸中进行缓慢膨胀过程,其体积由0.13m 增加到0.253m 。
过程中气体压力依{p}MPa =0.24-0.4{v}3m 变化。
若过程中气缸和活塞的摩擦保持在1200N ,当地大气压为0.1MPa ,气缸截面积为0.12m ,试求:(1)气体所做的膨胀功W ;(2)系统输出的有用功Wu ;(3)活塞与气缸无摩擦时,系统输出的有用功W u.re ;解:(1)J V V dV 25500)2.024.0(10dV 10)4.024.0(P W |25.01.026625.01.0=-⨯=⨯-==⎰⎰(2)系统做出的有用功Wu=a f W W W -- (Wf 表示摩擦力做的功,Wa 表示克服大气压力做的功)W f =F f *s=1200*(△V/A )=1200*[(0.25-0.1)/0.1]J=1800JWa=Pb*A*s=J 1.0/1.025.01.0101.06)(-⨯⨯⨯=15000J Wu=(25500-1800-15000)J=8700J(3)当无摩擦时W f =0JW u.re =W -Wa=(25500-15000)J=10500J2. 英制系统中的兰氏温标(兰氏温标和华氏温标关系相当于热力学温标与摄氏温标),其温度已符号R 表示。
傅秦生工程热力学作业题解答

1-3 解:根据压力单位换算关系,有2H O Hg 2009.8067Pa 800133.322Pa p p =⨯=⨯所以有(735133.3222009.8067800133.322)Pa 206610.6Pa 206.6kPap =⨯+⨯+⨯==1-4 解:根据微压计的原理,烟道中的压力应等于环境压力和水柱压力之差,所以4sin 2000.89.80.5784Pa=7.8410MPa V p L g ρα-==⨯⨯⨯=⨯0.10.0007840.0992MPa b V p p p =-=-=1-5 解:,,, - = 45k P a g C b g A b g B p p p p p p p p p =+=+=左左右右 ,,,11045155kPa g A g B g C p p p ∴=+=+=2-3 解:(1)根据热一律,有 3573570u q w ∆=-=-= (2)由于完成了一个循环过程,有 120u u u ∆=∆+∆=而 120 0u u ∆=∴∆=(3) 2220590k J u q w ∆=∴=- 2-4 解:(1)a c b a d b a c b a c b a d b a d b U U Q W Q W ----------==∆=∆∴-=-904010 60kJ a d b a d b Q Q ====-=-=(2)50k J (23) 73k Jb a a cb b a b aU U Q Q -----∆=-∆=-=--∴=-(3)50k J5055k Ja db b a b a U U U U U --∆=-=∴=+=5545010kJ 60kJ 50kJd b d b d b a d d b a d Q U W Q Q Q ------=∆+=-+=+==2-5 解:(1)由于流体不可压缩,所以不做功。
(2)由于不做功及绝热,所以0U ∆=。
33()1(30.5)10 2.510kJ H U pV V p ∆=∆+∆=∆=⨯-⨯=⨯3-1 解:(1)2027310.771000273C η+=-=+(2) 92412000.77924kJ 15.4kW 60C W Q P η==⨯=== (3) 211200924276kJ Q Q W =-=-= 3-2 解:(1)建立如图的模型,有,,1 1L A H A B H B H T T W Q W Q T T ⎛⎫⎛⎫=-=- ⎪ ⎪⎝⎭⎝⎭根据题意,有 ,,L A H B Q Q = 而 ,,,,=11L A A L A H A H AH HQ T TQ Q Q T T η-=-∴= 所以 ,,11L L B H B H AH T T T W Q Q T T T ⎛⎫⎛⎫=-=- ⎪ ⎪⎝⎭⎝⎭由A B W W =,得,,1=1L H A H AHH T T T Q Q T T T ⎛⎫⎛⎫-- ⎪ ⎪⎝⎭⎝⎭()()11900300600K 22H L T T T =+=+= (2)根据 A B ηη=,有11 519.6K L H T TT T T-=-∴=== 3-5 解:循环A 为卡诺循环,其效率为1LA HT T η=-对于循环B ,有 (),,12L B L B H B H L B Q T S Q T T S =∆=+∆,所以 (),, 211112L B L B LB H BH LH L B Q T S T Q T T T T S η∆=-=-=-++∆故11221L H LA H H H L L L H L LB H HH L H LT T T T T T T T T T T T T T T T T T ηη--+====++--++3-6 解:(1) i s o1500800= 1.92J /K 02000300H L H L Q Q S T T -∆+=+=> 所以该循环可行,且不可逆进行。
热力学习题及答案解析

热力学习题及答案解析
热力学学习题及答案解析
热力学是物理学的一个重要分支,研究能量转化和热力学系统的性质。
在学习
热力学的过程中,我们经常会遇到各种热力学学习题,通过解题可以加深对热
力学知识的理解。
下面我们就来看看一些常见的热力学学习题及答案解析。
1. 问题:一个理想气体在等温过程中,体积从V1扩大到V2,求气体对外界所
做的功。
答案解析:在等温过程中,理想气体对外界所做的功可以用以下公式表示:
W = nRTln(V2/V1),其中n为气体的摩尔数,R为气体常数,T为温度。
根据这
个公式,我们可以计算出气体对外界所做的功。
2. 问题:一个物体从20摄氏度加热到80摄氏度,求其温度变化时吸收的热量。
答案解析:物体温度变化时吸收的热量可以用以下公式表示:Q = mcΔT,其
中m为物体的质量,c为物体的比热容,ΔT为温度变化。
根据这个公式,我们
可以计算出物体温度变化时吸收的热量。
3. 问题:一个热机从高温热源吸收了500J的热量,向低温热源放出了300J的
热量,求该热机的热效率。
答案解析:热机的热效率可以用以下公式表示:η = 1 - Q2/Q1,其中Q1为
热机从高温热源吸收的热量,Q2为热机向低温热源放出的热量。
根据这个公式,我们可以计算出该热机的热效率。
通过以上几个热力学学习题及答案解析,我们可以看到在解题的过程中,需要
灵活运用热力学知识,并且掌握一定的计算方法。
希望通过不断的练习和思考,我们能够更好地理解和掌握热力学知识,提高解题能力。
热力学习题与答案(原件)讲解

材料热力学习题1、阐述焓H 、内能U 、自由能F 以及吉布斯自由能G 之间的关系,并推导麦克斯韦方程之一:T P PST V )()(∂∂-=∂∂。
答: H=U+PV F=U-TS G=H-TS U=Q+W dU=δQ+δWdS=δQ/T, δW=-PdV dU=TdS-PdVdH=dU+PdV+VdP=TdS+VdP dG=VdP-SdTdG 是全微分,因此有:TP P TP ST V ,PT G T P G ,T V P G T P T G P S T G P T P G )()()()()()(2222∂∂-=∂∂∂∂∂=∂∂∂∂∂=∂∂∂∂=∂∂∂∂∂-=∂∂∂∂=∂∂∂因此有又而2、论述: 试绘出由吉布斯自由能—成分曲线建立匀晶相图的过程示意图,并加以说明。
(假设两固相具有相同的晶体结构)。
由吉布斯自由能曲线建立匀晶相图如上所示,在高温T 1时,对于所有成分,液相的自由能都是最低;在温度T 2时,α和L 两相的自由能曲线有公切线,切点成分为x1和x2,由温度T 2线和两个切点成分在相图上可以确定一个液相线点和一个固相线点。
根据不同温度下自由能成分曲线,可以确定多个液相线点和固相线点,这些点连接起来就成为了液相线和固相线。
在低温T 3,固相α的自由能总是比液相L 的低,因此意味着此时相图上进入了固相区间。
3、论述:通过吉布斯自由能成分曲线阐述脱溶分解中由母相析出第二相的过程。
第二相析出:从过饱和固溶体α中(x0)析出另一种结构的β相(xβ),母相的浓度变为xα. 即:α→β+ α1α→β+ α1 的相变驱动力ΔGm的计算为ΔGm=Gm(D)-Gm(C),即图b中的CD段。
图b中EF是指在母相中出现较大为xβ的成分起伏时,由母相α析出第二相的驱动力。
4、根据Boltzman方程S=kLnW,计算高熵合金FeCoNiCuCrAl和FeCoNiCuCrAlTi0.1(即FeCoNiCuCrAl各为1mol,Ti为0.1mol)的摩尔组态熵。
物理参考解答 热力学

可知 TA TC
1 02
C 8 V (m3)
单原子分子:i=3
=
i
i
2
1.672
全过程 A B C E 0
18
3
2016/12/20
A B 等压过程,有
p(atm)
QAB Cp (TB TC )
4A B
5 2
(
pBVB
pAVA
)
14.9 105 J
1
C
B C 绝热过程,有 QBC 0
6.一定量的某种理想气体在等压过程中对外作功为
200J,若此种气体为单原子分子气体,则该过程中需 吸热 500 J;若为双原子分子气体,则需吸热 700 J。
V2
解:等压过程中 A PdV P(V2 V1) RT 单原子分子: i=3 V1
Qp
CP,mT
i
2 2
RT
52RT
5 2
A 500J
• (D) 热机的效率不可能等于1
(C) 5
6. 在 273K和一个 1atm下的单原子分子理想气体占有 体积 22.4升.将此气体绝热压缩至体积为 16.8升,需要 作多少功?
(A) 330 J; (B) 680 J ; (C) 719 J ; (D) 223 J .
绝热方程: T1V1 1 T2V2 1
时气体的压强是
1 2
Po
自由膨胀
W 0,Q0
E 0 T 0
T1 To V1 2Vo
PoVo P1V1
P1
1 2
Po
12
22016/12/20 Nhomakorabea5.一定量理想气体,从体积V1膨胀到体积V2 ,分别经历 的过程是: A→B等压过程; A→C等温过程;A→D 绝
第一章化学热力学习题参考答案
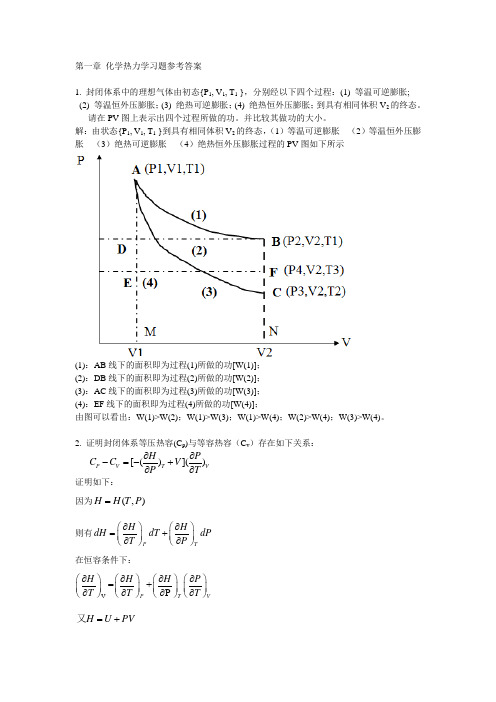
第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀; (2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)]; (2):DB 线下的面积即为过程(2)所做的功[W(2)]; (3):AC 线下的面积即为过程(3)所做的功[W(3)]; (4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭=V P VT VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫--⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P PP T P C V S dT dP T T∂∆=+-∂⎰⎰解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T HCpdT dp p∂=+∂ dH TdS Vdp =+又()()T T H ST V p p∂∂=+∂∂则 (2) ()()T P S Vp T∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P VdH C dT T V dp T∂=+-+∂ 积分得:2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S SdS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S VdS dT dP T T∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S HT T T T∂∂==∂∂将(6)式代入(5)式得:[()](7)P P C VdS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C VS dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下:Q 2卡诺循环经如下过程(理想气体) 1、等温可逆膨胀22U 0T Q W ∆=+=,2222121lnV T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V WPdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313lnV T V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=- 220,,Q Q U W =∆=,214213411Q V V nRT V WPdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则12144323,V V V VV V V V ==则有即或:根据绝热可逆过程方程PV γ=常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221lnln =ln V VnRT nRT V V Q Q W VQ Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
工程热力学课后作业答案

p734-1 1kg 空气在可逆多变过程中吸热40kJ ,其容积增大为1102v v =,压力减少为8/12p p =,设比热为定值,求过程中内能旳变化、膨胀功、轴功以及焓和熵旳变化。
解:热力系是1kg 空气过程特性:多变过程)10/1ln()8/1ln()2/1ln()1/2ln(==v v p p n =0.9由于T c q n ∆=内能变化为R c v 25==717.5)/(K kg J •v p c R c 5727===1004.5)/(K kg J •=n c ==--v v c n kn c 51=3587.5)/(K kg J •n v v c qc T c u /=∆=∆=8×103J膨胀功:u q w ∆-==32 ×103J轴功:==nw w s 28.8 ×103J焓变:u k T c h p ∆=∆=∆=1.4×8=11.2 ×103J熵变:12ln 12lnp p c v v c s v p +=∆=0.82×103)/(K kg J •4-2 有1kg 空气、初始状态为MPa p 5.01=,1501=t ℃,进行下列过程:(1)可逆绝热膨胀到MPa p 1.02=;(2)不可逆绝热膨胀到MPa p 1.02=,K T 3002=;(3)可逆等温膨胀到MPa p 1.02=;(4)可逆多变膨胀到MPa p 1.02=,多变指数2=n ;试求上述各过程中旳膨胀功及熵旳变化,并将各过程旳相对位置画在同一张v p -图和s T -图上解:热力系1kg 空气(1) 膨胀功:])12(1[111k k p p k RT w ---==111.9×103J熵变为0(2))21(T T c u w v -=∆-==88.3×103J12ln 12ln p p R T T c s p -=∆=116.8)/(K kg J •(3)21ln1p p RT w ==195.4×103)/(K kg J • 21ln p p R s =∆=0.462×103)/(K kg J • (4)])12(1[111n n p p n RT w ---==67.1×103J n n p p T T 1)12(12-==189.2K 12ln 12ln p p R T T c s p -=∆=-346.4)/(K kg J •4-3 具有1kmol 空气旳闭口系统,其初始容积为1m 3,终态容积为10 m 3,当时态和终态温度均100℃时,试计算该闭口系统对外所作旳功及熵旳变化。
热力学课程习题解答-109页精选文档

目录第一章 (1)第二章 (18)第三章 (258)第一章 温 度1-1 在什么温度下,下列一对温标给出相同的读数:(1)华氏温标和摄氏温标;(2)华氏温标和热力学温标;(3)摄氏温标和热力学温标? 解:(1)Q 9325F t t =+∴当F t t =时,即可由9325t t =+,解得325404t ⨯=-=- 故在40c -o 时 F t t =(2)又Q 273.15T t =+ ∴当F T t =时 则即9273.15325t t +=+ 解得:241.155301.444t ⨯== ∴273.15301.44574.59T K =+= 故在574.59T K =时,F T t =(3)Q 273.15T t =+ ∴若T t = 则有273.15t t += 显而易见此方程无解,因此不存在T t =的情况。
1-2 定容气体温度计的测温泡浸在水的三相点槽内时,其中气体的压强为50mmHg 。
(1)用温度计测量300K 的温度时,气体的压强是多少? (2)当气体的压强为68mmHg 时,待测温度是多少? 解:对于定容气体温度计可知:()273.15trPT P K P = (1) 115030055273.16273.16tr P T P mmHg ⨯===(2) 2268273.16273.1637250tr P T KK K P === 1-3 用定容气体温度计测得冰点的理想气体温度为273.15K ,试求温度计内的气体在冰点时的压强与水的三相点时压强之比的极限值。
题1-4图解:根据00lim ()273.16limtr tr P P trP T T P K P →→==已知 冰点273.15T K =你∴0273.15lim0.99996273.16273.16tr P trP T KP K K →==。
1-4 用定容气体温度计测量某种物质的沸点。
原来测温泡在水的三相点时,其中气体的压强500tr P mmHg =;当测温泡浸入待测物质中时,测得的压强值为734P mmHg =,当从测温泡中抽出一些气体,使tr P 减为200mmHg 时,重新测得293.4P mmHg =,当再抽出一些气体使tr P 减为100mmHg 时,测得146.68P mmHg =.试确定待测沸点的理想气体温度.解:根据273.16trPT K P =333146.68273.16273.16400.67100tr P T KK K P === 从理想气体温标的定义:0273.16limtr P trPT K P →=依以上两次所测数据,作T-P 图看趋势得出0tr P →时,T 约为400.5K 亦即沸点为400.5K. 1-5 铂电阻温度计的测量泡浸在水的三相点槽内时,铂电阻的阻值为90.35欧姆。
工程热力学-第三章作业答案

p1 = 2068.4kPa,V1 = 0.03m3
T1
=
p1V1 mR
=
2068.4×103 × 0.03 1× 287
= 216.2K
由题意,可知:
p2 = p1 = 2068.4kPa,T2 = 2T1 = 2× 216.2 = 432.4K
根据理想气体状态方程,可得:
V2 = T2 = 2 V1 T1
第三章作业答案
3-1 解: (1)取礼堂中的空气为热力系统,此时为闭口系 根据闭口系统能量方程
Q = ΔU +W
因为没有作功故 W=0;热量来源于人体散热;热力学能的增加等于人体散热。
ΔU = Q = 2000× 400× 20 = 2.67 ×105 KJ 60
(2)取礼堂中的空气和人为热力系统,此时为闭口绝热系 根据闭口系统能量方程
3-10
解:
(1)设风机的出口温度为 tout ,取风机为控制体,属稳定流动开口系统 由稳定流动系统能量方程:
Q
=
ΔH
+
1 2
mΔc2
+
mgΔz
+ Ws
忽略风机动能、位能的变化,可得:
Q = ΔH +Ws
由题意,可知: Q = 0,Ws = −1kW
•
即 m cp (tout − t1) −1000 = 0
系统储存能增量: uδ m
可得: dU = hinδ min − δWg
积分得: (m2u2 − m1u1) + Wg = minhin
因容器开始时为真空,则有 m1 = 0;u1 = 0; min = m2 可知: m2u2 + Wg = m2hin KK(1) Wg = pAL = p2V2 = m2RT2 KK(2)
化学热力学基础习题解答

第一章 化学热力学基础1-1 气体体积功的计算式 dV P W e ⎰-= 中,为什么要用环境的压力e P 在什么情况下可用体系的压力体P答: 在体系发生定压变化过程时,气体体积功的计算式 dV P W e ⎰-= 中,可用体系的压力体P 代替e P ;1-2 298K 时,5mol 的理想气体,在1定温可逆膨胀为原体积的 2 倍; 2 定压下加热到373K ;3定容下加热到373K;已知 C v,m = ·mol -1·K -1;计算三过程的Q 、W 、△U 、△H 和△S;解 1 △U = △H = 02 kJ nC Q H m P P 72.13)298373(,=-==∆W = △U – Q P = - kJ3 kJ nC Q U m V V 61.10)298373(,=-==∆W = 01-3 容器内有理想气体,n=2mol , P=10P,T=300K;求 1 在空气中膨胀了1dm 3,做功多少 2 膨胀到容器内压力为 lP,做了多少功3膨胀时外压总比气体的压力小 dP , 问容器内气体压力降到 lP 时,气体做多少功解:1此变化过程为恒外压的膨胀过程,且Pa P e 510=2此变化过程为恒外压的膨胀过程,且Pa P e 510=3 VnRT P dP P P e =≈-= 1-4 1mol 理想气体在300K 下,1dm 3定温可逆地膨胀至10dm 3,求此过程的 Q 、W 、△U 及△H;解: △U = △H = 01-5 1molH 2由始态25℃及P 可逆绝热压缩至 5dm -3, 求1最后温度;2最后压力; 3 过程做功;解:1 3511178.2410298314.81-=⨯⨯==dm P nRT V W f dl p A dl p dVδ=-⋅=-⋅⋅=-⋅外外外2 Pa V nRT P 53222104.91053.565314.81⨯=⨯⨯⨯==- 3 )2983.565(314.85.21)(12,-⨯⨯⨯-=--=∆-=T T nC U W m V1-6 40g 氦在3P 下从25℃加热到50℃,试求该过程的△H 、△U 、Q 和W ;设氦是理想气体; He 的M=4 g·mol -1解: J nC Q H m P P 3.519625314.825440)298323(,=⨯⨯⨯=-==∆ W = △U – Q P =1-7 已知水在100℃ 时蒸发热为 J·g -1,则100℃时蒸发30g 水,过程的△U 、△H 、 Q 和W为多少计算时可忽略液态水的体积解: mol n 67.11830== 1-8 298K 时将1mol 液态苯氧化为CO 2 和 H 2O l ,其定容热为 -3267 kJ·mol -1 , 求定压反应热为多少解: C 6H 6 l + g → 6CO 2 g +3 H 2O l1-9 300K 时2mol 理想气体由ldm -3可逆膨胀至 10dm -3 ,计算此过程的嫡变;解: 11229.3810ln 314.82ln -⋅=⨯==∆K J V V nR S 1-10.已知反应在298K 时的有关数据如下C 2H 4 g + H 2O g → C 2H 5OH l△f H m /kJ·mol -1 - -C P , m / J·K -1·mol -1计算1298K 时反应的△r H m ;2反应物的温度为288K,产物的温度为348K 时反应的△r H m ;解1 △r H m = - + - = - kJ·mol -12 288K C 2H 4 g + H 2O g → C 2H 5OH l 348K↓△H 1 ↓△H 2 ↑△H 3298K C 2H 4 g + H 2O g → C 2H 5OH l 298K△r H m = △r H m 298K + △H 1 + △H 2 + △H 3= - + + ×298-288 + × 348-298×10-3= - kJ·mol -11-11 定容下,理想气体lmolN 2由300K 加热到600K ,求过程的△S;已知11,,)006.000.27(2--⋅⋅+=mol K J T C N m P解: T R C C m P m V 006.069.18,,+=-=1-12 若上题是在定压下进行,求过程的嫡变;解: ⎰+=∆600300006.000.27dT T T S 1-13 下,2mol 甲醇在正常沸点时气化,求体系和环境的嫡变各为多少已知甲醇的气化热△H m = ·mol -1解: 132.2082.337101.352-⋅=⨯⨯=∆=∆K J T H n S m 体系 1-14 绝热瓶中有373K 的热水,因绝热瓶绝热稍差,有4000J 的热量流人温度为298K 的空气中,求1绝热瓶的△S 体;2环境的△S 环;3总熵变△S 总;解:近似认为传热过程是可逆过程△S 总 = △S 体 + △S 环 = ·K -11-15 在298K 及标准压力下,用过量100%的空气燃烧 1mol CH 4 , 若反应热完全用于加热产物,求燃烧所能达到的最高温度;CH 4 O 2 CO 2 H 2O g N 2△f H m /k J ·mol -1- 0 - -C P , m / J·K -1·mol -1解; 空气中 n O 2 = 4mol , n N 2 = n O 2 ×79%÷21%= 15molCH 4g +2 O 2 → CO 2 g + 2H 2O g△r H m 298K = 2× + – = - kJ反应后产物的含量为:O 2 CO 2 H 2O g N 2n / mol 2 1 2 15 - ×103 + 2×+ 15× + + 2× T-298 = 0T = 1754K1-16.在110℃、105Pa 下使 1mol H 2Ol 蒸发为水蒸气,计算这一过程体系和环境的熵变;已知H 2Og 和H 2Ol 的热容分别为 J·K -1·g -1和 J·K -1·g -1,在100℃、105Pa 下H 2Ol 的的汽化热为 J·g -1;解: 1mol H 2Ol , 110℃, 105Pa ----→ 1mol H 2Og , 110℃, 105Pa↓H1 , S1↑H3 , S31mol H2Ol , 100℃, 105Pa ----→1mol H2Og , 100℃, 105PaH2 , S2= kJ= J·K-11-17 1mol ideal gas with C v,m= 21J·K-1·mol-1,was heated from 300K to 600K by 1 reversible isochoric process; 2reversible isobaric process. Calculate the △U separately.解:1由题知△U = n C v,m △T = 1×21×600-300= 6300J2 对由于△U只是温度的函数,所以△U2 = △U1 = 6300J1-18 Calculate the heat of vaporization of 1mol liquid water at 20℃, . △vap H m water = kJ·mol-1, C p,m water = J·K-1·mol-1, C p,m water vapor = J·K-1·mol-1 at 100℃, .解:1mol H2Ol , 20℃, 105Pa ----→1mol H2Og , 20℃, 105Pa↓H1 , ↑H3 ,1mol H2Ol , 100℃, 105Pa ----→1mol H2Og , 100℃, 105PaH2H+ nCp,mg △T△H =△H1 + △H2 +△H3 = nCp,ml △T+ n△vapθm= 1××100-20×10-3+ 1× + 1××20-100×10-3= kJ。
高等工程热力学答案

3.4 热力学第二定律作业一、单项选择题1.关于热力学定律和分子动理论,下列说法正确的是()A.一定量气体吸收热量,其内能一定增大B.不可能使热量由低温物体传递到高温物体C.若两分子间距离增大,分子势能一定增大D.若两分子间距离减小,分子间引力和斥力都增大解析:选D.根据热力学第一定律,A错;假如有外界的影响,可以使热量由低温物体传递给高温物体,比如空调工作时有电的参与,B错;当r<r0时,两分子间作用力表现为斥力,距离增大.分子力做正功,分子势能减小,C错;由分子力的特点知,D对.2.下列说法,正确的是()A.一切自然过程总是沿着分子热运动的无序性增大的方向进行B.一切自然过程总是沿着分子热运动的有序性增大的方向进行C.在任何自然过程中,一个孤立系统的总熵一定不会增大D.在任何自然过程中,一个孤立系统的总熵可能减小解析:选 A.根据熵增加原理,不可逆过程总是朝着熵增大的方向进行,故选A.3.我们绝不会看到:一个放在水平地面上的物体,靠降低温度,可以把内能自发地转化为动能,使这个物体运动起来,其原因是()A.违反了能量守恒定律B.在任何条件下内能不可能转化为机械能,只有机械能才能转化为内能C.机械能和内能的转化过程具有方向性,内能转化成机械能是有条件的D.以上说法均不正确解析:选 C.机械能和内能的相互转化,必须通过做功来实现.机械能可以自发地转化为内能,但内能不能自发地转化为机械能.4.下列过程中,可能发生的是()A.某工作物质从高温热源吸收20 kJ的热量,全部转化为机械能,而没有产生其他任何影响B.打开一高压密闭容器,其内气体自发溢出后又自发跑进去,恢复原状C.利用其他手段,使低温物体温度更低,高温物体的温度更高D.将两瓶不同液体混合,然后它们又自发地各自分开解析:选 C.根据热力学第二定律,热量不可能从低温物体自发地传递给高温物体,而不引起其他的变化,但通过一些物理手段是可以实现的,故C项正确;内能转化为机械能不可能自发地进行,要使内能全部转化为机械能必定要引起其他影响,故A项错;气体膨胀具有方向性,故B项错;扩散现象也有方向性,D项也错.5.下面关于熵的有关说法错误的是()A.熵是系统内分子运动无序性的量度B.在自然过程中熵总是增加的C.热力学第二定律也叫做熵减小原理D.熵值越大代表着越无序解析:选 C.如果过程是可逆的,则熵不变,如果不可逆,则熵是增加的,而且一切自然过程都是沿着分子热运动的无序性增大的方向进行.6.下列说法中正确的是()A.一切形式的能量间的相互转化都具有方向性B.热量不可能由低温物体传给高温物体C.气体的扩散过程具有方向性D.一切形式的能量间的相互转化都不具有可逆性解析:选 C.热力学第二定律反映的是所有与热现象有关的宏观过程都具有方向性,A、D错;热量不是不能从低温物体传给高温物体,关键是看能否还产生其他影响,B错;气体的扩散过程具有方向性,C对.7.有经验的柴油机维修师傅,不用任何仪器,只要将手伸到柴油机排气管附近,去感知一下尾气的温度,就能够判断出这台柴油机是否节能,真是“行家伸伸手,就知有没有”.关于尾气的温度跟柴油机是否节能之间的关系,你认为正确的是()A.尾气的温度越高,柴油机越节能B.尾气的温度越低,柴油机越节能C.尾气的温度高低与柴油机是否节能无关D.以上说法均不正确解析:选 B.气体的内能不可能完全转化为柴油机的机械能,柴油机使柴油燃料在它的汽缸中燃烧,产生高温高压的气体,是一个高温热源;而柴油机排气管排出的尾气是一个低温热源.根据能量守恒,这两个热源之间的能量差就是转换的机械能,燃烧相同的燃料,要想输出的机械能越多,尾气的温度就越低.二、双项选择题8.根据热力学第二定律,下列说法中正确的是()A.不可能从单一热源吸热并把它全部用来做功,而不引起其他变化B.没有冷凝器,只有单一的热源,能将从单一热源吸收的热量全部用来做功,而不引起其他变化的热机是可以实现的C.制冷系统将冰箱里的热量传给外界较高温度的空气而不引起其他变化D.在火力发电中,燃气的内能不可能全部变为电能解析:选AD.热力学第二定律揭示了与热现象有关的物理过程的方向性,不可能从单一热源吸收能量,意味着不仅要从一个热源吸热,而且一定会向另一个热源放热,故A对;机械能和内能的转化过程具有方向性,机械能可以全部转化为内能,而内能要全部转化为机械能必须有外界的帮助,故B错;冰箱向外传递热量时消耗了电能,故C错;火力发电时,能量转化的过程为内能→机械能→电能,因为内能向机械能转化过程中会对外放出热量,故燃气的内能必然不会全部变为电能,故D对.9.对于孤立体系中发生的实际过程,下列说法中正确的是()A.系统的总熵只能增大,不可能减小B.系统的总熵可能增大,可能不变,还可能减小C.系统逐渐从比较有序的状态向更加无序的状态发展D.系统逐渐从比较无序的状态向更加有序的状态发展解析:选AC.在孤立体系中发生的实际过程,其系统的总熵是增加的,它不可能减小,故A正确,B错误.根据熵增加原理,该系统只能是从比较有序的状态向更加无序的状态发展,故C正确,D错误.故选AC.10.下列关于能量转化的说法中,正确的是()A.机械能可以转化为内能,但内能不能转化为机械能B.机械能可以转化为内能,内能也能转化为机械能C.机械能不可以转化为内能,但内能可以转化为机械能D.机械能可以转化为内能,但内能不能全部转化为机械能,同时不引起其他变化解析:选BD.由能的转化和守恒定律及能量守恒定律知,各种形式的能量之间可以相互转化,但是内能在转化为机械能的过程中,由于内能的各种耗散,不会完全转化为机械能.故B、D正确.三、非选择题11.质量相同、温度相同的水,如图所示分别处于固态、液态和气态三种状态下,它们的熵的大小有什么关系?为什么?解析:分子的无规则运动就是一种无序运动,气体分子的无规则运动最剧烈,无序程度最大.所以质量相同、温度相同的水分别处于固、液、气三种状态时,固态的无序程度最小,气态的无序程度最大,而熵的大小表示无序程度大小,所以气态的熵最大,液态的熵较大,固态的熵最小.答案:见解析☆12.某热机使用热值q=3.0×107 J/kg的燃料,燃烧效率为η1=80%,汽缸中高温、高压的燃气将内能转化为机械能的效率为η2=40%,热机传动部分的机械效率为η3=90%,若热机每小时燃烧m=40 kg的燃料,那么热机输出的有用功率为多少?解析:根据题意,热机每小时做的功为W=qmη1η2η3=3.0×107×40×80%×40%×90% J=3.456×108 J由功率的定义式P =W t =3.456×10860×60W =96 000 W =96 kW. 答案:96 kW。
工程热力学作业解答——第二章作业

姓名:舒小华 学号:0618003138. 如右图所示,气缸内的空气体积为0.008m ³,温度为17℃,初始时空气压力为0.1013MPa ,弹簧处于自由状态。
现向空气加热,使其压力升高,并推动活塞向上运动而压缩弹簧,已知活塞的面积为0.08m ²,弹簧的刚度为400N/cm ,空气的热力学能变化关系式为△u=0.717{△T}k KJ/Kg.环境大气压力Pb=0.1MPa ,试求使气缸内空气压力达到0.15MPa 所需的热量。
解:查阅资料得空气的气体常数为Rg=287J/(kg.K)初始时弹簧处于自由状态,活塞处于平衡状态即(0.1013-0.1)*106*0.08-G=0解得重力力等于G=104N当气缸压力达到0.15MPa 时由活塞的平衡方程可得(0.15-0.1)*106*0.08-G-△l*k=0解得△l=9.74cm=0.0974m气体大气压所做的功Wa.re=⎰⎰=⨯=0977.0*08.0066.781101.0P J dV bdV 克服弹簧弹力所做的功=J 7352.1890.0974*******1l K 2122=⨯⨯⨯=∆ 克服重力力所做的功W Ff =G*s=104*0.0974J=10.1296J气体所做的功W=Wa.re+We+W Ff =781.6+189.7352+10.1296=981.4648J有理想气体方程PV=m RgT 得101100T T V P V P = 即1T 15.273170.097408.0008.015.0008.01013.0+=⨯+⨯⨯)( 解得T 1=848.11KP 0V 0=m RgT 0解得m=PoVo/RgT 0Kg 00973.0)15.27317(28710008.01013.06≈+⨯⨯⨯= 由=0.717{△T}k KJ/Kg.得△u=0.717{T1-T0}*m=0.72*{848.11-(17+273.15)}*0.00973KJ=3.89256KJ由热力学第一定律Q=△U+W 得Q=(3.89256310⨯+981.4648)J=4874.02J=4.87402KJ所需吸收热量为4.87402KJ9.有一橡皮气球,当其内部气体压力和大气压相同为0.1MPa 时呈自由状态,体积为0.3m ³。
热学作业(附解答)

热力学1.1mol理想气体(设γ=C p/C V为已知)的循环过程如T – V图所示,其中CA为绝热过程,A点状态参量(T1,V1)和B点状态参量(T2,V2)为已知。
试求C点的状态参量:则V c= ___________________ ,T c= ____________________,p c= ____________________,V2(V1/V2)γ-1T1(RT1/V2)(V1/V2)γ-12.所示的T – S(温熵)图表示热力学系统经历了一个ABCDA循环过程,该循环称为______________循环。
若图中矩形ABCD的面积是矩形ABEF的面积的1/3,则该循环的效率为__________________。
卡诺1/33.1 mol理想气体在气缸中进行无限缓慢的膨胀,其体积由V1变化到V2。
(1)当气缸处于绝热情况下时,理想气体熵的增量ΔS= _______________。
(2)当气缸处于等温情况下时,理想气体熵的增量ΔS= _______________。
1)02)R ln4.常温常压下,一定量的某种理想气体(其分子可视为刚性分子,自由度为i),在等压过程中吸热为Q,对外做功为W,内能增加为ΔE,则W/Q= ___________。
ΔE/Q= ___________。
5.一卡诺热机(可逆的),低温热源的温度为27℃,热机效率为40%,起高温热源温度为___________K。
今欲将该热机效率提高到50%,若低温热源保持不变,则高温热源的温度应增加____________K。
5001006.从统计的意义来解释,不可逆过程实质上是一个_________________的转变过程,一切实际过程都向着__________________的方向进行。
从几率较的状态到几率较大的状态状态的几率增大(或熵值增加)7.一个能透热的容器,盛有各为1mol的A、B两种理想气体,C为具有分子筛作用的活塞,能让A种气体自由通过,不让B种气体通过,如图所示。
热力学作业解

A A 962 13.4%
Q1 Qbc Qca 7200
四、证明题:
1. 根据热力学第二定律证明两条绝热线不能相交.
证: 反证法
设两绝热线相交于c 点,在 两绝热线上寻找温度相同
p
a• •b
绝热线 等温线
的两点a、b。在ab间作一条
等温线,abca构成一循环过
c•
程。在此循环过程该中
Qp
1CpT
7 2
Rቤተ መጻሕፍቲ ባይዱ
A R
7 2
A
2.在如图所示的p-V 中,1mol理想气体从状态 A (2p1, V1) 沿
直线到达 B (p1, 2V1),则此过程系统对外做的功 A = ,
内能的增量为 E =
。
解:
A
S梯形
12(p1
2 p1)(2V1
V1 )
3 2
p1V1
由 pV νRT, pAVA pBVB
(3)与外界不交换热量。试分别计算各过程中气体吸收的
热量、内能的改变和对外所做的功。
解: 氦i=3,
Mmol 0.004 kg/mol CV=3R/2, Cp=5R/2 ΔE
M
M mol
CV (T2 T1)
0.02 0.004 623 J
5
mol
(1) 体积保持不变 A=0 Q ΔE A 623 J
1
p1 p2
1
解: =1, 循环所做的净功(净热量)
A ( p2 p1)(V3 V2 ) Q 1.13102 (J)
T1
p1V1
R
27.3(K)
T2
p2V2
R
54.6(K)
T3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、计算题 1. 如图,系统由状态a沿acb到达状态b的过程 中,有350J热量传入系统,而系统作功126J。 (1)沿abd,系统作功42 J,多少热量传入系统? (2)由b沿曲线ba返回a,外界对系统作功84 J,
问系统是吸热还是放热?热量传递多少?
解:(1) Qabc=350 J Aabc=126 J Ec – Ea=Qabc – Aabc=224J
i2
P(105Pa)
2 (PaVa PcVc ) 2.0 b
250J
1.0 a
(3)
Q1 Q2 Q1
13.8%
O
1.0
c 2.0 V(10-3m3)
4.一摩尔单原子分子理想气体作如图所示循环,
已知a点的温度为T,且,试求:
(1)一次循环过程中气体吸收的热量
(2)一次循环过程中气体对外所作的净功
P(105Pa) b
2.0
1.0 a
c
O 1.0 2.0 V(10-3m3)
150 140 290J
3.单原子分子理想气体作如图所示循环,bc为等温过
程,在bc中吸热140J,试求: (2)在一次循环过程中系
统向外界放出的热量; (3)循环效率
M
解:(2) Q2 Qca C p (Ta Tc )
解:(1)QV
m M
i RT
2
3 8.31 50 2
623J
EV QV 623J AV 0
(2)Qp
m M
i
2 2
RT
5 8.31 50 2
1039J
EP EV 623J
AP QP EP 1039 623 416J
已知a点的温度为T,且,试求:
(1)一次循环过程中气体吸收的热量
(2)一次循环过程中气体对外所作的净功
(3)循环效率
解: Q1 Aab Eab
P b
39
RT RT 6RT 22
a
c
1
A净 2 (Vc Va ) (Pb Pc )
O
V
1 2
PaVa
1 2
RT
A1
4. 已知1mol 某种理想气体,在等压过程中温度 上升1K,内能增加 20.78J,则气体对外作功为
8.31 J ,气体吸收热量为 29.09 J。 Cp R CV
5.某理想气体等温压缩到给定体积时外界对气体 作功 A1 ,又经绝热膨胀返回原来体积时气体对外 作功 A2 ,则整个过程中气体从外界吸收的热量 Q=___A_1 _,内能增量E=___A_2___。
热力学作业答案
一、选择题
1.单原子分子组成的理想气体自平衡态A变化 到平衡态B,变化过程不知道,但A、B两点的压 强、体积和温度都已确定,则可求出 A.气体膨胀所做的功 B.气体内能变化 C.气体传递的热量 D.气体分子的质量
2.理想气体的温度越高,则
A.热量越多
B.作功越多
C.内能越大
D.不能确定
6. 理想气体的定压摩尔热容量和定容摩尔热容 量的关系式是_C__p __R__C_V_____,CP>CV 的物理意 义是_等__压__比__等__容__多__吸__收__的__热__量__用__于__对__外__作__功___。
7. 第二定律开尔文表述说明 热功转化过程 不可 逆,克劳修斯表述说明 热传递过程 不可逆。
3.单原子分子理想气体作如图所示循环,bc为
等温过程,在bc中吸热140J,试求:
(1)在一次循环过程中系统从外界吸收的热量
(2)在一次循环过程中系统向外界放出的热量
(3)循环效率
解:(1)
Qab
M
CV T
3
i 2
(
PbVb
PaVa
)
(2102 1102 ) 150J
2
Q1 Qab Qbc
Q1 12
5. 如图示,为1摩尔单原子分子理想气体的循环过程( ln2 = 0.69 )。求:(1)状态的状态参量;(2)求循环效率。
解:(1) PaVa RTa
V(L)
40
a
600
Pa = 40 ×8.31 = 124.6( Pa ) 20
b
c
300
0
Pb = 20 ×8.31 = 124.6( Pa ) = Pa
(3)循环效率
P
解:由状态曲线得 Vb=Vc=2Va ,
b
Pb=2Pa, Pc=Pa , Tb=4Ta=4T, Tc=2T
a
c
Eab
CV T
3 2
R( Tb
Ta
)
9 2
RT
O
V
Aab
1 2
(
PbVb
PaVa
)
3 2
PaVa
3 2
RT
2V V
4.一摩尔单原子分子理想气体作如图所示循环,
Qadc=Aadc+ Ec – Ea= 42 + 224= 266 J
(2) Aca= - 84 J
Qca= Aca+ Ea – Ec = - 224 - 84 = -308 J
2. 1 mol单原子理想气体从300 K加热到350 K, 问在下列两过程中吸收了多少热量?增加了多少 内能? 对外作了多少功? (1) 体积保持不变;(2) 压力保持不变。
定容摩尔热容量
;
2
(3) 5 R : 定压摩尔热容量
;
2
10.绝热的容器被一隔板分为两半。设两边温度
相同。左边充满理想气体,其压强为P0,右边是 真空。当把隔板抽出时,左边的气体对真空作自
由膨胀,达到平衡后,气体的温度变化T_=__0
(填>,=或<)。气体的压强P=_P_0_/_2_,熵值_增__加__(填 增加或减少)。
A.1/3 C.2/5
B.1/4 D.2/7 A / Q R / Cp
7.一理想气体经过一循环过程ABCA,如图所示,
AB为等温过程,BC是等体过程,CA是绝热过程,
则该循环效率可用下列面积之比来表示
A.
面积(1) 面积(2)
B.
面积(1) 面积(1) 面积(2)
C.
面积(1) 面积(1) 面积(2)
D.不能用面积来表示
8. 在温度分别为327℃和27℃的高温热源和低温 热源之间工作的热机,理论上最大效率为
A.25% C.75%
B.50% D.91.74%
9. 高温热源热力学温度是低温热源热力学温度
的n倍,则理想气体在一次卡诺循环中,传给低
温热源的热量是从高温热源吸取的热量的
A. n倍 B. (n 1)倍 C. 1 倍 D. n 1 倍
Qbc
M
CV (Tc
Tb
)
3 2
8.31(600
300)
3.7 103
J
c→a等温膨胀 吸热
Qca
M
RT
lnVa Vc
8.31 600 ln
40 20
3.4103 J
V (L)
Q1 Q2 3.7 3.4 一定量的理想气体内能E随
压强p的变化关系为一直线(延长线过E-p图原
点)则该过程为 A.等温过程
E
m M
CVT
E
B.等压过程 m i RT
C.等容过程 D.绝热过程
M2 i PV
2
p
6. 室温双原子分子理想气体,在等压膨胀时,
系统对外作功与从外界吸收热量之比A/Q 是
= 1-T2 = 1- 1 =1-Q2
T1
n
Q1
n
→
Q2
=
1 n
Q1
n
10.根据热力学第二定律可知:
A. 功可以全转换为热,热不能全转换为功;
B. 热可以从高温物体传到低温物体,但不能
从低温物体传到高温物体
C. 不可逆过程是不能向相反方向进行过程
D. 一切自发过程都是不可逆的
二、填空题
1.在等压过程中,理想气体吸收热量一部分用来 做功 ,另一部分用来 增加内能 ,故在吸收一
20
a
b
c
= 12 .7%
0
300 600 T(K )
6.已知1mol理想气体的定容热容量为CV,由 状态a(T1,V1)经过下列三个可逆过程:先绝 热膨胀到体积V2=2V1,再等容加热至温度恢复到 T1,最后等温压缩回到状态a。 又(因为 1)每一个过程的熵变是多少?
(2)整个循环过程系统的熵变是多少?
300 600 T(K )
a→b等压压缩 放热
Qab
M
C p ( Tb
Ta
)
5 8.31(300 600) 6.2103 J 2
5. 如图示,为1摩尔单原子分子理想气体的循环过程( ln2
= 0.69 )。求:(1)状态的状态参量;(2)求循环效率。
(2) b→c等体升温 吸热
定热量的情况下, 做功 小于等温过程, 增加内能 小于等容过程。
2.理想气体作绝热膨胀时,依靠 减少内能 而作
功;如果此时的体积增量与作等温膨胀时的体
积增量相同,则 压强降低 比作等温膨胀时
要快。
dP
dP
dV dQ0 dV dT 0
3.摩尔热容量数值可以有 无数 个,在 绝热 过程 中,摩尔热容量为零,在 等温 过程中,摩尔热 容量为无穷大。
