南京工业大学物理化学课件——第十一章化学动力学基础
合集下载
南大物化PPT11章化学动力学基础二
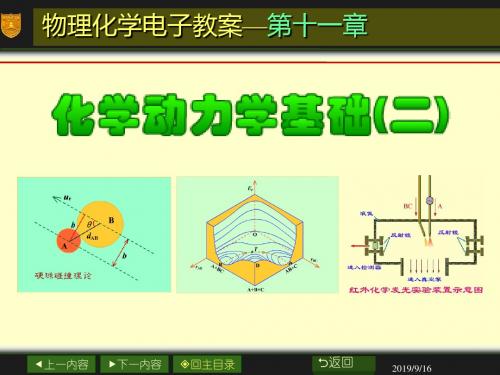
E P E P ( r A ,r B B ,r C C )或 A E P E P ( r A ,r B B , C A )B
这要用四维图表示,现在令 ∠ABC=180°,即A与BC发生 共线碰撞,活化络合物为线型 分子,则EP=EP(rAB,rBC),就可 用三维图表示。
上一内容 下一内容 回主目录
d A B 称为有效碰
撞直径,数值上等
于A分子和B分子的 半径之和。
虚线圆的面积称为碰
d AB
A
B
撞截面(collision
cross section)。数
值上等于
d
2 AB
。
分子间的碰撞和有效直径
上一内容 下一内容 回主目录
返回
2019/9/16
A与B分子互碰频率
将A和B分子看作硬球,根据气体分子运动论, 它们以一定角度相碰。 互碰频率为:
RT 2
dlnk dT
REcT2
1 2T
总结:阈能Ec与温度无关,但 无法测定,要从实验活化能Ea 计算。在温度不太高时,
Ea≈ Ec
上一内容 下一内容 回主目录
返回
2019/9/16
概率因子(probability factor)
由于简单碰撞理论所采用的模型过于简单, 没有考虑分子的结构与性质,所以用概率因子 来校正理论计算值与实验值的偏差。
返回
2019/9/16
碰撞参数(impact parameter)
碰撞参数用来描述粒子碰撞激烈的程度,通常 用字母b表示。
在硬球碰撞示意图上,A
和B两个球的连心线 d AB 等于
两个球的半径之和,它与相对
u 速度 之r 间的夹角为 。 u 的平通行过线A球,质两心平,行画线平间行的于距离r 就是碰撞参数b 。数值上:bdABsinbmax dAB
这要用四维图表示,现在令 ∠ABC=180°,即A与BC发生 共线碰撞,活化络合物为线型 分子,则EP=EP(rAB,rBC),就可 用三维图表示。
上一内容 下一内容 回主目录
d A B 称为有效碰
撞直径,数值上等
于A分子和B分子的 半径之和。
虚线圆的面积称为碰
d AB
A
B
撞截面(collision
cross section)。数
值上等于
d
2 AB
。
分子间的碰撞和有效直径
上一内容 下一内容 回主目录
返回
2019/9/16
A与B分子互碰频率
将A和B分子看作硬球,根据气体分子运动论, 它们以一定角度相碰。 互碰频率为:
RT 2
dlnk dT
REcT2
1 2T
总结:阈能Ec与温度无关,但 无法测定,要从实验活化能Ea 计算。在温度不太高时,
Ea≈ Ec
上一内容 下一内容 回主目录
返回
2019/9/16
概率因子(probability factor)
由于简单碰撞理论所采用的模型过于简单, 没有考虑分子的结构与性质,所以用概率因子 来校正理论计算值与实验值的偏差。
返回
2019/9/16
碰撞参数(impact parameter)
碰撞参数用来描述粒子碰撞激烈的程度,通常 用字母b表示。
在硬球碰撞示意图上,A
和B两个球的连心线 d AB 等于
两个球的半径之和,它与相对
u 速度 之r 间的夹角为 。 u 的平通行过线A球,质两心平,行画线平间行的于距离r 就是碰撞参数b 。数值上:bdABsinbmax dAB
第11章 化学动力学基础
r def 1 d
Q dt 若催化剂用量Q改用质量表示,则
rm
1 m
d
dt
若催化剂用量
若催化剂用量Q改用表面积表示
rA
1 A
d
dt
rA 称为表面反应速率,单位为 mol m2 s1
化学反应速率与速度
速度 velocity 是矢量,有方向性。
速率 rate 是标量 ,无方向性,都是正值。
§11.1 化学动力学的任务和目的
化学热力学的研究对象和局限性
研究化学变化的方向、能达到的最大限度以及
外界条件对平衡的影响。化学热力学只能预测反应
的可能性,但无法预料反应能否发生?反应的速率
如何?反应的机理如何?例如:
1 2
N2
3 2
H2
NH3 (g)
rGm / kJ mol1 16.63
1 H2 2 O2 H2O(l)
物理化学电子教案—第十一章
积分法
微分法
半衰期法
孤立法
一级反应 对峙反应 平行反应 连续反应 链反应
2020/11/23
第十一章 化学动力学基础(一)
§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程 §11.4 具有简单级数的反应 §11.5 几种典型的复杂反应 *§11.6 基元反应的微观可逆性原理 §11.7 温度对反应速率的影响 *§11.8 关于活化能 §11.9 链反应 2020/11*/2§3 11.10 拟定反应历程的一般方法
基元反应和非基元反应 (3) H2 Br2 2HBr 的反应历程为
(10) Br2 M 2Br M (11) Br H2 HBr H (12) H Br2 HBr Br (13) H HBr H2 Br (14) Br Br M Br2 M
《化学动力学》PPT课件

§11.1 化学反应的速率及速率方程
速率常数 k
物理意义:当反应物 A、B 的物质的量浓度 cA、cB均为单 位物质的量浓度时的反应速率。
单位: [k]= [浓度]1-n [时间]-1
一级反应: [时间]-1 二级反应: [浓度]-1[时间]-1
k 与反应物的物质的量浓度无关,当催化剂等其它条件确 定时,它只是温度的函数。
υp
1
A
dpA dt
1
B
dpB dt
1
Y
dpY dt
1
Z
dpZ dt
υp,A υp,B υp,Y υp,Z
- A - B Y Z
§11.1 化学反应的速率及速率方程
2. 基元反应与反应分子数
基元反应:宏观的反应过程一般在微观上包含有多个反应 步骤,称微观上的每一步反应为一个基元反应。
§11.2 速率方程的积分形式
3. 二级反应
(1) 只有一种反应物:a A
P
dcA
dt
kcA2
积分:
cA dcA
c cA,0
2 A
k
t
dt
0
11 积分结果: kt
cA cA,0
用转化率表示:
xA cA,(0 1
xA)
kt
§11.2 速率方程的积分形式
该类型二级反应的特征
① k 的单位是 浓度-1时间-1; ② 反应的t1/2与cA,0 成反比
1. 零级反应(n = 0)
速率方程:
υA
dcA dt
kcA0
k
积分:
dc CA
CA,0
A
k
t
dt
0
cA,0 cA kt
物理化学课件-化学动力学基础(一)

基元反應和非基元反應
基元反應簡稱元反應。如果一個化學反應,反 應物分子在碰撞中相互作用,在一次化學行為中就 能轉化為生成物分子,這種反應稱為基元反應。
例如上述反應歷程中,(4)-(14)的反應都是 基元反應。
如果一個化學計量式代表了若干個基元反應 的總結果,那這種反應稱為總包反應或總反應, 是非基元反應。
基元反應和非基元反應
(1) H2 I2 2HI 的反應歷程為
(4) I2 M
2I M
(5) H2 2I 2HI
式中M是指反應器的器壁,或是不參與反應只起 傳遞能量作用的第三物種。
基元反應和非基元反應
(2) H2 Cl2 2HCl 的反應歷程為 (6) Cl2 M 2Cl M (7) Cl H2 HCl H (8) H Cl2 HCl Cl
物理方法有可能做原位反應。
測定反應的初速率,這時干擾少,對研究反 應動力學很有用
對於一些快速反應,要用特殊的測試方法
§11.3 化學反應的速率方程
何謂速率方程?
速率方程又稱動力學方程。它表明了反應速 率與濃度等參數之間的關係或濃度等參數與時間 的關係。速率方程可表示為微分式或積分式。
速率方程必須由實驗來確定
反應機理(reaction mechanism)
反應機理又稱為反應歷程。在總反應中,連續 或同時發生的所有基元反應稱為反應機理,在有些 情況下,反應機理還要給出所經歷的每一步的立體 化學結構圖。
同一反應在不同的條件下,可有不同的反應機 理。瞭解反應機理可以掌握反應的內在規律,從而 更好的駕馭反應。
t1/ 2 ln 2 / k1
3. ln(a x) 與 時間 t 呈線性關係。
引 (1)
伸 的
(2)
物理化学下课件:第11章-化学动力学1

t
dcR dt t
图1 反应物和产物的浓度随时间的变化
3、反应速率的测定
测定反应物或生成物在不同时刻浓度的方法 化学法 在不同时刻取出少量反应混合物的样品, 立即用骤冷、加阻化剂、除去催化剂等方法使反应 停止,然后进行化学分析。这种方法的速度较慢。 物理法 用各种仪器监测与浓度有线性关系的物理量的变化 如压力、体积、旋光率、折光率、电导率、吸光 度、介电常数、黏度和导热率等 可用谱仪(IR, UV-VIS, NMR 等)做原位反应
如果 a b
总结:课本P175 表11.2
准级反应
C12H22O11 H2O H C6H12O6 C6H12O6 (葡萄糖) (果糖)
第11章 化学动力学基础(一)
如下面两个反应:
(1)
H2
(g)
1 2
O2
(g)
H
2O(l)
(2) 2NO 2 (g) N2O4 (g)
rGm (298 K) kJ mol -1
K
p
237.19 3.781041
5.39
8.8
从热力学角度,反应(1)发生趋势比反应(2)大得
多,且在平衡时反应完成的程度很高;但在上述条件下 即使把H2、 O2 控制比例放在一起,经过数年都看不到有 H2O(l)生成,而反应(2)的速率快到很难测的程度,为什 么?热力学不能说明原因,可见热力学不能解决反应速
dt
dt
r d[R] d[P] 0 dt dt
1、一般定义
任意反应 aA + bB ⇌ yY + z Z
rA =
1 V
dnA dt
rY =
1 dnY V dt
rB =
1 V
物理化学第十一章 化学动力学基础

对(2)式,如果两反应物寝浓度与计量系数成正比 即 C A, 0 =a
C B,0 b
那么反应过程中,每一瞬间 2 此时 dC A = kC A C B = kC A (b )C A = k `C A
dt a
t= 1 1 1 k ` C A C A, 0
CA
CB
=a
b
同样有 这就是二级反应的速率方程的积分形式。 二级反应的动力学特征: (1)以 (2)当反应物消耗一半时,即 C A = 2 ,则半衰期 半衰期与反应物的初始浓度成正比。
HI
dt
2
2
dt
§10—2 化学反应的速率方程 1 d [HBr ] k [H 2 ][Br2 ]2 再如 H2 +Br2 = 2 HBr VHI = = [HBr ] dt 1+ k` [Br2 ] 以上三个反应虽然都是合成卤化氢的反应,但由于它们有着完全 不同的反应机理,因而速度方程完全不同。
dt = kC A
§10—3 速率方程的积分形式 整理
dC A = kdt CA
CA
dC A 1 C A, 0 定积分:t = ∫C A, 0 v = k ln C A A
或; 1 C A, 0 或: k = t ln C A 一级反应的动力学特征: dC (1)从式子 k= C
C A = C A.0 e kt
k c [I 2 ]
k c 为动力学平衡常数
若以HI的生成速率来表示反应的速率 d [HI ] 2 = k 2 [H 2 ][I ] = k 2 [H 2 ] k c [I 2 ] = k [H 2 ][I 2 ]
dt
这就是由该非基元反应得出来的速率方程,与实验相符合。 四、化学反应速率方程的一般形式 对于某一个化学反应,一般说来,不能根据其化学反应式来 预言,其速率方程而是要通过实验测定其具体形式: d [HI ] 例如:H2 + I2 = 2 HI V HI = = k [H 2 ][I 2 ] dt 而对于H2 +Cl2 = 2 HCl 1 d [HCl ] V HI = = k [H 2 ][Cl 2 ]2 d [HCl ] V = ≠ k [H ][Cl ]
物理化学PPT化学动力学(催化作用基础)

三、催化作用的共同特征
2、催化剂通过改变反应途径而显著地改变其活 、 化能,从而改变反应速率。 化能,从而改变反应速率。
尽管催化剂本身在反应终了时其化学组成和数 量不变,但它是反应的积极参与者: 量不变,但它是反应的积极参与者:即在反应中催 某种不稳定的中间物或中间络合物, 化剂参与形成某种不稳定的中间物或中间络合物 化剂参与形成某种不稳定的中间物或中间络合物, 从而使反应可能沿着能量上择优的途径进行, 从而使反应可能沿着能量上择优的途径进行,而后 又在反应中再生。 又在反应中再生。许多溶液中的催化反应可以与非 催化反应形象地表示为: 催化反应形象地表示为:
四、酸碱催化作用
可见,在任一情况下, 可见,在任一情况下, logkapp 与 pH 值之间均存 在线性关系, 在线性关系,其斜率分别为 0,-1 与 +l。由其截距可 。 分别求得 k0、kH+ 及 kOH- 值。当 k0、kH+ 及 kOH- 值 均不为零时得三段直线构成的折线 。当 k0、kH+ 及 kOH- 之一为零时,则得二段直线构成的折线。若仅 之一为零时,则得二段直线构成的折线。 kH+ 或 kOH- 之一不等于零时,则得直线。 之一不等于零时,则得直线。 例如,乙酸乙酯的水解反应, 例如,乙酸乙酯的水解反应,可以通过改变溶液的 pH 值,分别测出其相应的速率常数为: 分别测出其相应的速率常数为:
四、酸碱催化作用
丙酮碘化反应为此类酸碱催化的典型实例: 丙酮碘化反应为此类酸碱催化的典型实例:
在水溶液中此反应的速率随丙酮及各种广义酸的浓度 变化均为一级的,但与碘浓度无关。可以证明, 变化均为一级的,但与碘浓度无关。可以证明,丙酮 烯醇化是速率决定步骤,由之此酸催化反应为: 烯醇化是速率决定步骤,由之此酸催化反应为: 值得指出,酸碱催化反应机理的研究, 值得指出,酸碱催化反应机理的研究,对提供酶催 化模型是有重要价值的。在酶催化中经常假定氨基 化模型是有重要价值的。 酸侧链是作为广义的酸或碱的。 酸侧链是作为广义的酸或碱的。
第十一章 化学动力学基础(一)
物理化学电子教案—第十一章
积分法
微分法
半衰期法
孤立法
一级反应 对峙反应 平行反应 连续反应 链反应
精品课件
第十一章 化学动力学基础(一)
§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程 §11.4 具有简单级数的反应 §11.5 几种典型的复杂反应 *§11.6 基元反应的微观可逆性原理
率如何?反应的机理如何?例如:
1 2
N2
3 2
H2
NH3 (g)
rG m / kJ m ol1 16.63
H2
1 2
O2
H2O(l)
237.19
热力学只能判断这两个反应都能发生,但如
何使它发生,热力学无法回答。
精品课件
§11.1 化学动力学的任务和目的
化学动力学的研究对象
化学动力学研究化学反应的速率和反应的机理
(9 )C l C l M C l2 M
精品课件
基元反应和非基元反应 (3)H 2B r22H B r的反应历程为
(1 0 )B r2 M 2 B r M (1 1 )B r H 2 H B r H (1 2 )H B r2 H B r B r (1 3 )H H B r H 2 B r (1 4 )B r B r M B r2 M
t t c A a xx
速率方程的微分式为:
rdcA dt
dcP dt
k1cA
或
r
dx dt
k1(ax)
精品课件
对微分式进行不定积分
r
dx dt
k1(ax)
dx (a x)
k1dt
dx
(ax) k1dt
积分法
微分法
半衰期法
孤立法
一级反应 对峙反应 平行反应 连续反应 链反应
精品课件
第十一章 化学动力学基础(一)
§11.1 化学动力学的任务和目的 §11.2 化学反应速率的表示法 §11.3 化学反应的速率方程 §11.4 具有简单级数的反应 §11.5 几种典型的复杂反应 *§11.6 基元反应的微观可逆性原理
率如何?反应的机理如何?例如:
1 2
N2
3 2
H2
NH3 (g)
rG m / kJ m ol1 16.63
H2
1 2
O2
H2O(l)
237.19
热力学只能判断这两个反应都能发生,但如
何使它发生,热力学无法回答。
精品课件
§11.1 化学动力学的任务和目的
化学动力学的研究对象
化学动力学研究化学反应的速率和反应的机理
(9 )C l C l M C l2 M
精品课件
基元反应和非基元反应 (3)H 2B r22H B r的反应历程为
(1 0 )B r2 M 2 B r M (1 1 )B r H 2 H B r H (1 2 )H B r2 H B r B r (1 3 )H H B r H 2 B r (1 4 )B r B r M B r2 M
t t c A a xx
速率方程的微分式为:
rdcA dt
dcP dt
k1cA
或
r
dx dt
k1(ax)
精品课件
对微分式进行不定积分
r
dx dt
k1(ax)
dx (a x)
k1dt
dx
(ax) k1dt
物理化学第十一章课件

2013-11-15
化学动力学
4
8. 碰撞理论 9. 过渡状态理论 10. 溶液反应 11. 多相反应 12. 光化反应 13. 催化反应
14. 分子动态学*
2013-11-15
化学动力学
5
第一节 反应速率及速率方程—浓度对反应速率的影响 Reaction rates & rate laws—the concentration
y = -0.0942x - 0.365
lnc
0
2
4
6
8
10 t/h
12
14
16
18
20
lnc—t图
2013-11-15
化学动力学
20
(P518)例:N2O5在惰性溶剂CCl4中的分解反应是一级反应:
N2O4(aq)
N2O5(aq) → 2NO2(aq) + 0.5O2(g)
反应物N2O5和分解产物NO2、N2O4均溶于溶液中,O2则逸出,故 用量气管测定O2的体积(定温定压下)即可确定反应的进程。某 次实验在40℃下进行,实验数据如下。试求此温度下反应的速率 常数和半衰期。 t/s 0 2400 ∞ V (O2) / cm3 10.75 29.65 45.50 解题步骤: 类似平衡题。 列反应式; 写出量的变化关系; 代入动力学方程求解。
concentration as a function of time
variation of concentrations with time
动力学方程
2013-11-15
化学动力学
16
零级反应 zero-order reactions:
如表面催化(NH3在钨丝上的分解)、光化反应(光强恒定)。 速率方程:
物理化学课件第11章_化学动力学基础(2)
物理化学—第十一章
上一内容 下一内容 ²回主目录
O返回
2021-3-12
11.1 酶催化反应
•酶催化反应历程 •用稳态近似法处理 •酶催化反应的级数 •酶催化的反应速率曲线 •米氏常数 •酶催化反应特点
上一内容 下一内容 ²回主目录
O返回
2021-3-12
酶催化反应历程
Michaelis-Menten,Briggs,Haldane,Henry等人 研究了酶催化反应动力学,提出的反应历程如 下:
k1 k2
KM
上一内容 下一内容 ²回主目录
O返回
2021-3-12
酶催化反应的级数
令酶的原始浓度为[E]0,反应达稳态后,一 部分变为中间化合物[ES],余下的浓度为[E]
[E] [E]0 -[ES]
[ES] [E][S] ([E]0 -[ES])[S]
KM
KM
[ES] [E]0[S] KM [S]
2.当[S]<<KM时,r =k2[E]0[S]/KM 对[S]呈一级。
3.当[S]→∞时,r = rm=k2[E]0。
上一内容 下一内容 ²回主目录
O返回
2021-3-12
酶催化的反应速率曲线
上一内容 下一内容 ²回主目录
O返回
2021-3-12
米氏常数KM
为了纪念Michaelis-Menten对酶催化反应的贡献,
他们认为酶(E)与底物(S)先形成中间化合物 ES,中间化合物再进一步分解为产物(P),并释放 出酶(E),整个反应的速控步是第二步。
上一内容 下一内容 ²回主目录
O返回
2021-3-12
用稳态近似法处理
S
E
k1
上一内容 下一内容 ²回主目录
O返回
2021-3-12
11.1 酶催化反应
•酶催化反应历程 •用稳态近似法处理 •酶催化反应的级数 •酶催化的反应速率曲线 •米氏常数 •酶催化反应特点
上一内容 下一内容 ²回主目录
O返回
2021-3-12
酶催化反应历程
Michaelis-Menten,Briggs,Haldane,Henry等人 研究了酶催化反应动力学,提出的反应历程如 下:
k1 k2
KM
上一内容 下一内容 ²回主目录
O返回
2021-3-12
酶催化反应的级数
令酶的原始浓度为[E]0,反应达稳态后,一 部分变为中间化合物[ES],余下的浓度为[E]
[E] [E]0 -[ES]
[ES] [E][S] ([E]0 -[ES])[S]
KM
KM
[ES] [E]0[S] KM [S]
2.当[S]<<KM时,r =k2[E]0[S]/KM 对[S]呈一级。
3.当[S]→∞时,r = rm=k2[E]0。
上一内容 下一内容 ²回主目录
O返回
2021-3-12
酶催化的反应速率曲线
上一内容 下一内容 ²回主目录
O返回
2021-3-12
米氏常数KM
为了纪念Michaelis-Menten对酶催化反应的贡献,
他们认为酶(E)与底物(S)先形成中间化合物 ES,中间化合物再进一步分解为产物(P),并释放 出酶(E),整个反应的速控步是第二步。
上一内容 下一内容 ²回主目录
O返回
2021-3-12
用稳态近似法处理
S
E
k1
物理化学PPT

3. 快速流动法
因快速反应完成迅速,用静态法无法准确 计时以作出动力学曲线; 一般流动法适合的反应半寿期:10 +210 3 s;
例如,生物体系中: 酶 (E) + 基质 (S) 络合物 (ES)
为一快速反应。
流动法测反应速率装置示意图:
反应一段时间后达到稳态,即反应管内各测 量点 xi 的组成浓度不变,设测得气体流速 1000 cm/s,则:xi 处的反应时间为:
1 dc i r i dt
i :反应计量系数;
反应物: R 0;产物:P 0 • 显然,反应速率 r 是一个强度量。
说明:
1)反应常有中间步骤、中间产物,因而时刻 t
时反应物、产物的浓度变化率瞬时关系式:
d[R] d[P] ( : ) t : dt dt
可能复杂化,即上式不是严格地成立。但 通常中间物寿命短、浓度非常小,其影响 可忽略。
3 H2 + N2 2 NH3(300 atm,500C)
考虑动力学因素:
反应若无催化剂,其反应速率 0,完全不 能用于生产; 若采用适合的催化剂,改变其反应历程,
则可加快反应的速度(常用 Fe 催化剂)。
研究反应机理,能为控制反应产物、反应
速度提供依据。
2. a)研究反应机理,有助了解分子结构,如化
……
2. 实验检测技术的限制
反应的中间产物(常为自由基或自由
原子)的活泼性、短寿命,导致极难
检测它们的存在及浓度之变化;
因此也就难以用实验手段来验证所假 设的反应机理(如上述的反应中自由 原子 I· H· , 的测定)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
r= 1 dC A β = kC α C B L A γ A dt
五、反应级数 对于反应 aA + bB + … →lL + mM + … β r = kC α C B L A 若由实验测定其速率方程式具有浓度的幂乘积形式 式中各浓度的方次为α , β L 分别称为反应物A、B……的分级数 速率方程式中所有浓度项指数和总称为反应级数,用n表示
在化学动力学中为研究的方便,因而往往用某指定反应物A的消 耗速率,或某指定产物Z的生成速率来表示反应进行的速率。 dc A的消耗速率 VA = − A
dt
Z的生成速率
VZ =
dc Z dt
式中:cA、cZ 为A、Z在t时刻的浓度。
§10—1 化学反应速率的表示法 注意的是,若参加反应的各物质的计量系数不相同,则各物质的 浓度变化也不同,因而它们的反应速率也不相等。 推广到任意化学反应:
k1 [I •]2 = =k [I 2 ] c k −1
∴
[I •] =
k c [I 2 ]
k c 为动力学平衡常数
若以HI的生成速率来表示反应的速率 d [HI ] 2 = k 2 [H 2 ][I •] = k 2 [H 2 ] • k c [I 2 ] = k [H 2 ][I 2 ]
dt
这就是由该非基元反应得出来的速率方程,与实验相符合。 四、化学反应速率方程的一般形式 对于某一个化学反应,一般说来,不能根据其化学反应式来 预言,其速率方程而是要通过实验测定其具体形式: d [HI ] 例如:H2 + I2 = 2 HI V HI = = k [H 2 ][I 2 ] dt 而对于H2 +Cl2 = 2 HCl 1 d [HCl ] V HI = = k [H 2 ][Cl 2 ]2 d [HCl ] V = ≠ k [H ][Cl ]
§10—1 化学反应速率的表示法 一、参加反应的物质的浓度变化表示反应速率: 对于在等容系统中所发生的化学反应 aA + bB → yY + zZ 或写成化学计量式 0 = ∑ν B • B B 可以用单位时间内反应物或产物的浓度变化来表示反应速率。用 偏分数商表示如下:
V= 1
γB
•
dc B dt
def
反应速率:
ξ
=
dξ 1 dnB = • dt γ B dt
γB
• dn B
§10—1 化学反应速率的表示法 三、反应速率的实验测定 根据反应速率的浓度定义,测定反应速率,实际上是测定不同时 刻的反应物或产物的浓度,而测定物质浓度的方法有物理法和化 学法。 化学方法要求比较苛刻,需要采用突然降温,稀释或其它方法来 冻结反应,然后再进行化学分析。 而物理方法比较简单,利用产物或反应物的某一物理性质:如压 力、体积、折光率、旋光度等的差别来测定该物质的浓度。 比如:蔗糖水解一级反应速度常数的测定是利用蔗糖、葡萄糖、 果糖三种物质的旋光度不同而测定其浓度变化的。 20 [α ]20 = 66.6 葡萄糖右旋 [α ]20 = 52.5 果糖左旋 [α ] = −91.9 蔗糖右旋 乙酸乙酯皂化二级反应速度常数的测定是利用乙酸乙酯和NaOH 的电导不同而采用电导法来测其浓度变化的。
− dt = kC A
§10—3 速率方程的积分形式 整理
dC A − = kdt CA
CA
dC A 1 C A, 0 定积分:t = ∫C A, 0 − v = k ln C A A
C A = C A.0 • e − kt
或; 1 C A, 0 或: k = t ln C A 一级反应的动力学特征: dC − (1)从式子 k= C
1
γA
•
dc A 1 dcB 1 dcY 1 dcZ = • = • = • dt γ B dt γ Y dt γ Z dt
因而定义一个化学反应的反应速率。
V= 1
γB
•
dc B dt
二、用反应进度的变化来表示反应速度 0 = ∑ν B • B 对于一个化学反应 B def 1 反应进度的定义:
dξ =
§10—2 化学反应的速率方程
表示反应速率与浓度等参数间的关系,或者表示浓度等参数与时 间关系的方程式称为化学反应的速率方程式,简称速率方程或称 动力学方程。 一、基元反应和非基元反应 热力学方程式
:只反映反应物和最终产物的计量关系,
实际上,一个化学反应可能是一步完成的,也可能是经历了一系 列的步骤完成的,反应方程式的动力学含义应该是能代表反应的 真实历程,即反应机理。 基元反应 :在动力学中,把能够代表反应机理的,由反应物微粒 子(分子、原子、离子或自由基等)一步直接实现的变化 。 非基元反应 :不能由反应物微粒一步直接实现而是由几步间接实 现的变化或者说成是多个基元反应所组成的总反应 。
§10—1 化学反应速率的表示法
(一)化学反应的速率方程 影响反应速率的基本因素是浓度和温度。所谓速 率方程:也就是浓度C、时间t和温度T间的函数 关系式 f (C , t , T ) = 0 即速率方程。在速率方程中有三 个变量,一般说来,用双变量方程来讨论某个问 题,因此我们分为两步来讨论: (1)温度不变时,浓度和时间的函数关系 f (C , t ) = 0 (2)再研究C不变时,温度对反应速率的影响。
o
§10—2 化学反应的速率方程 上述每一个简单的反应步骤,都是一个基元反应,而总的反应为 非基元反应。 二、反应分子数和质量作用定律 在基元反应中,发生反应所需要的反应物微粒数称之为该反应的 反应分子数。 根据基元反应的反应分子数,可将基元反应分为:单分子反应、 两分子反应、三分子反应。 (1)单分子反应:经过碰撞而活化的单分子分解反应,或异构化 反应。 通式: A → B + … 例: CH3COCH3 → C2H4 + CO + H2 分子在单位体积内的数目越多(浓度越大)则单位体积内,单位 时间内起反应的物质的数量越多,即反应物的消耗速率与反应物 dc A = kc A 的浓度成正比。即 − dt
§10—2 化学反应的速率方程
(2)双分子反应:可分了异类分子和同类分子间的反应 A + B → C A + A → C 两个分子要发生反应必须碰撞,因而反应速率应与单位体积单位 时间内的碰撞数成正比,按分子运动论,单位何种单位时间内的 碰撞数与浓度乘积成正比。 dc − A = kc A c B 对A + B → C dt dc A 2 − = kc A 对A + A → C dt aA + bB + ⋅ ⋅ ⋅ → yY + zZ + ⋅ ⋅ ⋅ 依次类推,对基元反应 dc a b 其速率方程: − dtA = kc A • c B ⋅ ⋅ ⋅ a、b表示基元反应的分子数目。 也就是说,基元反应的速率与各反应物浓度的幂乘积成正比,其 中各浓度的方次为反应方程中相应组分的化学计量数,这就是质 量作用定律,它只适用于基元反应,对非基元反应不适用。
§10—2 化学反应的速率方程
三、由机理推导速率方程 质量作用定律的应用,还是以 H2 + I2 = 2 HI为例
I2 + M ∗
1 → k
2I • +M o ←
k −1
2 I • + H 2 → 2 HI
k2
根据质量作用定律,对于可逆反应来说,正反应的反应速率
V A,1 = k1 [I 2 ] M ∗
§10—2 化学反应的速率方程
例:在气相中,氢气和碘反应,人们一度曾认为氢分子与碘分子 经碰撞直接转化为碘化氢(HI)分子,用式子可表达成: H2 + I2 = 2 HI 认为该过程是一个基元反应。 而实际并非如此,人们通过精密的研究现已否定了传统的看法, 根据大量的实验结果现已知道,H2和 I2反应一般分为两步进行: ㈠ I 2 + M ∗ ←2I • + M o 2 I • + H 2 → 2 HI ㈡ 式子中:(1)表示I2分子与动能足够高的 M ∗分子发生碰撞,生成 两个自由原子 I • 和一个能量较小的 M 0 分子。 I • 自由原子很活泼,与周围H2分子进行三体碰撞,生成两个HI分 M 子,同时若与之发生碰撞的是能量较低的分子,则又重新生成I2, 把过剩能量传递给 M ∗ 。
对(2)式,如果两反应物寝浓度与计量系数成正比 即 C A, 0 =a
C B,0 b
CA
那么反应过程中,每一瞬间 2 此时 − dC A = kC A C B = kC A • (b )C A = k `C A
dCA t = ∫ dt = ∫ − 0 C A, 0 vA
t CA
α β v A = kC A C B L 代入上式,不同级数的反应就得出不同的结果。 将
下面我们就不同的反应级数n,讨论其动力学特征。 一、一级反应 定义:某反应的反应速率与反应物浓度的一次方成正比的反应就 称为一级反应。 α β v A = kC A C B L = kC A 该反应的速率方程 其微分形式 dC A
2 2
[ ]
[ ]
[ M 0 ] = y • [M ]
T一定时,x、y为常数,故 k1 = k1` x 应达到平衡时
V A,1 = V A, −1
` k −1 = k −1 y ,
皆为常数,当正逆反
§10—2 化学反应的速率方程 ∴
k1 [I 2 ] M
[ ] = k [I •] [M ]
2 −1
[ ]
V A, −1 = k − 1 [I •] M o
2
[ ]
若高能分子M ∗ 和低能分子 M 0 占全体分子数 M 的分数分别为x、 y,即
[ M ∗ ] = x • [M ]
V A,1 = k `1 x[I 2 ] M ∗ = k1 [I 2 ][M ]
五、反应级数 对于反应 aA + bB + … →lL + mM + … β r = kC α C B L A 若由实验测定其速率方程式具有浓度的幂乘积形式 式中各浓度的方次为α , β L 分别称为反应物A、B……的分级数 速率方程式中所有浓度项指数和总称为反应级数,用n表示
在化学动力学中为研究的方便,因而往往用某指定反应物A的消 耗速率,或某指定产物Z的生成速率来表示反应进行的速率。 dc A的消耗速率 VA = − A
dt
Z的生成速率
VZ =
dc Z dt
式中:cA、cZ 为A、Z在t时刻的浓度。
§10—1 化学反应速率的表示法 注意的是,若参加反应的各物质的计量系数不相同,则各物质的 浓度变化也不同,因而它们的反应速率也不相等。 推广到任意化学反应:
k1 [I •]2 = =k [I 2 ] c k −1
∴
[I •] =
k c [I 2 ]
k c 为动力学平衡常数
若以HI的生成速率来表示反应的速率 d [HI ] 2 = k 2 [H 2 ][I •] = k 2 [H 2 ] • k c [I 2 ] = k [H 2 ][I 2 ]
dt
这就是由该非基元反应得出来的速率方程,与实验相符合。 四、化学反应速率方程的一般形式 对于某一个化学反应,一般说来,不能根据其化学反应式来 预言,其速率方程而是要通过实验测定其具体形式: d [HI ] 例如:H2 + I2 = 2 HI V HI = = k [H 2 ][I 2 ] dt 而对于H2 +Cl2 = 2 HCl 1 d [HCl ] V HI = = k [H 2 ][Cl 2 ]2 d [HCl ] V = ≠ k [H ][Cl ]
§10—1 化学反应速率的表示法 一、参加反应的物质的浓度变化表示反应速率: 对于在等容系统中所发生的化学反应 aA + bB → yY + zZ 或写成化学计量式 0 = ∑ν B • B B 可以用单位时间内反应物或产物的浓度变化来表示反应速率。用 偏分数商表示如下:
V= 1
γB
•
dc B dt
def
反应速率:
ξ
=
dξ 1 dnB = • dt γ B dt
γB
• dn B
§10—1 化学反应速率的表示法 三、反应速率的实验测定 根据反应速率的浓度定义,测定反应速率,实际上是测定不同时 刻的反应物或产物的浓度,而测定物质浓度的方法有物理法和化 学法。 化学方法要求比较苛刻,需要采用突然降温,稀释或其它方法来 冻结反应,然后再进行化学分析。 而物理方法比较简单,利用产物或反应物的某一物理性质:如压 力、体积、折光率、旋光度等的差别来测定该物质的浓度。 比如:蔗糖水解一级反应速度常数的测定是利用蔗糖、葡萄糖、 果糖三种物质的旋光度不同而测定其浓度变化的。 20 [α ]20 = 66.6 葡萄糖右旋 [α ]20 = 52.5 果糖左旋 [α ] = −91.9 蔗糖右旋 乙酸乙酯皂化二级反应速度常数的测定是利用乙酸乙酯和NaOH 的电导不同而采用电导法来测其浓度变化的。
− dt = kC A
§10—3 速率方程的积分形式 整理
dC A − = kdt CA
CA
dC A 1 C A, 0 定积分:t = ∫C A, 0 − v = k ln C A A
C A = C A.0 • e − kt
或; 1 C A, 0 或: k = t ln C A 一级反应的动力学特征: dC − (1)从式子 k= C
1
γA
•
dc A 1 dcB 1 dcY 1 dcZ = • = • = • dt γ B dt γ Y dt γ Z dt
因而定义一个化学反应的反应速率。
V= 1
γB
•
dc B dt
二、用反应进度的变化来表示反应速度 0 = ∑ν B • B 对于一个化学反应 B def 1 反应进度的定义:
dξ =
§10—2 化学反应的速率方程
表示反应速率与浓度等参数间的关系,或者表示浓度等参数与时 间关系的方程式称为化学反应的速率方程式,简称速率方程或称 动力学方程。 一、基元反应和非基元反应 热力学方程式
:只反映反应物和最终产物的计量关系,
实际上,一个化学反应可能是一步完成的,也可能是经历了一系 列的步骤完成的,反应方程式的动力学含义应该是能代表反应的 真实历程,即反应机理。 基元反应 :在动力学中,把能够代表反应机理的,由反应物微粒 子(分子、原子、离子或自由基等)一步直接实现的变化 。 非基元反应 :不能由反应物微粒一步直接实现而是由几步间接实 现的变化或者说成是多个基元反应所组成的总反应 。
§10—1 化学反应速率的表示法
(一)化学反应的速率方程 影响反应速率的基本因素是浓度和温度。所谓速 率方程:也就是浓度C、时间t和温度T间的函数 关系式 f (C , t , T ) = 0 即速率方程。在速率方程中有三 个变量,一般说来,用双变量方程来讨论某个问 题,因此我们分为两步来讨论: (1)温度不变时,浓度和时间的函数关系 f (C , t ) = 0 (2)再研究C不变时,温度对反应速率的影响。
o
§10—2 化学反应的速率方程 上述每一个简单的反应步骤,都是一个基元反应,而总的反应为 非基元反应。 二、反应分子数和质量作用定律 在基元反应中,发生反应所需要的反应物微粒数称之为该反应的 反应分子数。 根据基元反应的反应分子数,可将基元反应分为:单分子反应、 两分子反应、三分子反应。 (1)单分子反应:经过碰撞而活化的单分子分解反应,或异构化 反应。 通式: A → B + … 例: CH3COCH3 → C2H4 + CO + H2 分子在单位体积内的数目越多(浓度越大)则单位体积内,单位 时间内起反应的物质的数量越多,即反应物的消耗速率与反应物 dc A = kc A 的浓度成正比。即 − dt
§10—2 化学反应的速率方程
(2)双分子反应:可分了异类分子和同类分子间的反应 A + B → C A + A → C 两个分子要发生反应必须碰撞,因而反应速率应与单位体积单位 时间内的碰撞数成正比,按分子运动论,单位何种单位时间内的 碰撞数与浓度乘积成正比。 dc − A = kc A c B 对A + B → C dt dc A 2 − = kc A 对A + A → C dt aA + bB + ⋅ ⋅ ⋅ → yY + zZ + ⋅ ⋅ ⋅ 依次类推,对基元反应 dc a b 其速率方程: − dtA = kc A • c B ⋅ ⋅ ⋅ a、b表示基元反应的分子数目。 也就是说,基元反应的速率与各反应物浓度的幂乘积成正比,其 中各浓度的方次为反应方程中相应组分的化学计量数,这就是质 量作用定律,它只适用于基元反应,对非基元反应不适用。
§10—2 化学反应的速率方程
三、由机理推导速率方程 质量作用定律的应用,还是以 H2 + I2 = 2 HI为例
I2 + M ∗
1 → k
2I • +M o ←
k −1
2 I • + H 2 → 2 HI
k2
根据质量作用定律,对于可逆反应来说,正反应的反应速率
V A,1 = k1 [I 2 ] M ∗
§10—2 化学反应的速率方程
例:在气相中,氢气和碘反应,人们一度曾认为氢分子与碘分子 经碰撞直接转化为碘化氢(HI)分子,用式子可表达成: H2 + I2 = 2 HI 认为该过程是一个基元反应。 而实际并非如此,人们通过精密的研究现已否定了传统的看法, 根据大量的实验结果现已知道,H2和 I2反应一般分为两步进行: ㈠ I 2 + M ∗ ←2I • + M o 2 I • + H 2 → 2 HI ㈡ 式子中:(1)表示I2分子与动能足够高的 M ∗分子发生碰撞,生成 两个自由原子 I • 和一个能量较小的 M 0 分子。 I • 自由原子很活泼,与周围H2分子进行三体碰撞,生成两个HI分 M 子,同时若与之发生碰撞的是能量较低的分子,则又重新生成I2, 把过剩能量传递给 M ∗ 。
对(2)式,如果两反应物寝浓度与计量系数成正比 即 C A, 0 =a
C B,0 b
CA
那么反应过程中,每一瞬间 2 此时 − dC A = kC A C B = kC A • (b )C A = k `C A
dCA t = ∫ dt = ∫ − 0 C A, 0 vA
t CA
α β v A = kC A C B L 代入上式,不同级数的反应就得出不同的结果。 将
下面我们就不同的反应级数n,讨论其动力学特征。 一、一级反应 定义:某反应的反应速率与反应物浓度的一次方成正比的反应就 称为一级反应。 α β v A = kC A C B L = kC A 该反应的速率方程 其微分形式 dC A
2 2
[ ]
[ ]
[ M 0 ] = y • [M ]
T一定时,x、y为常数,故 k1 = k1` x 应达到平衡时
V A,1 = V A, −1
` k −1 = k −1 y ,
皆为常数,当正逆反
§10—2 化学反应的速率方程 ∴
k1 [I 2 ] M
[ ] = k [I •] [M ]
2 −1
[ ]
V A, −1 = k − 1 [I •] M o
2
[ ]
若高能分子M ∗ 和低能分子 M 0 占全体分子数 M 的分数分别为x、 y,即
[ M ∗ ] = x • [M ]
V A,1 = k `1 x[I 2 ] M ∗ = k1 [I 2 ][M ]
