实验4循环伏安法测定电极反应参数实验报告
循环伏安法实验报告

循环伏安法实验报告一、实验目的1、学习并理解可逆电极反应的发生条件。
2、学习循环伏安法测定电极反应参数的基本原理和方法。
3、熟悉仪器的使用并根据所测数据验证并判断电极反应是否是可逆反应。
二、实验原理1、溶液中的电解质会离解出阴、阳离子,在外电场作用下发生定向移动产生电流使整个回路导通。
在电场的作用下,阴、阳离子分别向阳极、阴极移动,并在电极表面发生氧化或还原反应。
如果电极反应的速度足够快以致使得当离子刚移动到电极表面的反应区便立刻被反应掉,即电极表面总是处于缺少反应物的状态,这时电极表面的反应是可逆的,能量损失较小。
2、凡是能够测出电流电压关系获得I-U曲线的方法都可成为伏安法。
循环伏安法便是让电压做循环变化同时测出电流的改变的方法。
因此对于可逆的电极反应,所获得的曲线具有某种对称性,曲线会出现两个峰,电位差为:其中,Epa和Epc分别对应阴极和阳极峰电势。
对应的正向峰电流满足Randles-Savcik方程:其中ip为峰电流(A),n为电子转移数,A为电极面积(cm2),D为扩散系数(cm2/s),v1/2为扫描速度(V/s),c为浓度(mol/L)。
3、对本实验:该电极反应时可逆的。
用循环伏安法测量时,所得曲线会出现最大值和最小值,比较两个峰值所对应的电势之间的差值,若大小为0.056则说明该反应是可逆的;同时根据Randles-Savcik方程,ip 和v1/2 和浓度c都成直线关系,若两个峰电流比值接近于1,也可说明该电极反应是可逆的。
因此,本实验中,用循环伏安法测出峰电流、峰电位是关键。
三、实验试剂和仪器1、伏安仪,工作电极、辅助电极、参比电极,0.5ml移液管,50ml容量瓶,烧杯2、0.50mol/L氯化钾溶液,0.10mol/L铁氰化钾空白溶液,0.10mol/LH3PO4-KH2PO4溶液,0.10mol/L抗坏血酸溶液.四、实验步骤1、a)移取0.50mol/L氯化钾溶液20mL于50mL烧杯中,插入工作电极、对电极和参比电极,将对应的电极夹夹在电极接线上,设置好如下仪器参数:初始电位:0.60V; 开关电位1:0.60V; 开关点位2:0.0V电位增量:0.001V;扫描次数:1;等待时间:2电流灵敏度:10μA 滤波参数:50Hz; 放大倍率:1;b) 以50mV/s的扫描速度记录氯化钾空白溶液的循环伏安曲线并保存。
循环伏安法实验报告

循环伏安法实验报告循环伏安法实验报告引言:循环伏安法(Cyclic Voltammetry)是一种常用的电化学分析方法,通过测量电流与电位之间的关系,研究电化学反应的动力学和热力学性质。
本实验旨在通过循环伏安法对某种物质的电化学行为进行研究,并探讨其在实际应用中的潜力。
实验原理:循环伏安法是在电化学工作电极上施加一定的电位扫描范围,记录电流与电位的变化关系。
在实验中,我们使用了三电极系统,包括工作电极、参比电极和计时电极。
工作电极是我们感兴趣的物质所在的电极,参比电极用于提供一个稳定的参考电位,计时电极用于记录电位扫描的时间。
实验步骤:1. 准备工作:清洗和抛光电极,准备电解质溶液。
2. 装置搭建:将电解质溶液倒入电化学池中,将工作电极、参比电极和计时电极插入溶液中,连接电极和电位扫描仪。
3. 参数设置:设置扫描速率、起始电位和终止电位等参数。
4. 开始实验:启动电位扫描仪,进行电位扫描,记录电流与电位的变化关系。
5. 数据处理:根据实验结果,绘制循环伏安曲线,并进行数据分析。
实验结果与讨论:通过实验,我们得到了一组循环伏安曲线。
根据曲线的形状和特征,我们可以得到一些有关电化学反应的信息。
首先,我们可以通过观察峰值电位和峰电流的变化来确定物质的电化学反应类型。
对于可逆反应,峰电位与峰电流呈线性关系;对于不可逆反应,峰电位与峰电流之间存在一定的差异。
其次,我们可以通过计算峰电位之间的差值来确定电化学反应的电位差。
这个差值反映了反应的活化能,对于一些催化反应的研究具有重要意义。
另外,我们还可以通过循环伏安曲线的形状来研究电化学反应的速率。
如果曲线呈现出对称的波形,说明反应速率较快;如果曲线呈现出不对称的波形,说明反应速率较慢。
在实际应用中,循环伏安法可以用于研究电化学催化剂、电化学传感器和电化学能源等领域。
例如,通过研究某种催化剂的循环伏安曲线,可以评估其催化活性和稳定性,为催化剂的设计和合成提供依据。
循环伏安 实验报告

循环伏安实验报告循环伏安实验报告引言:循环伏安(Cyclic Voltammetry,简称CV)是一种广泛应用于电化学研究的实验技术。
通过在电极上施加一定的电位扫描,测量电流与电位之间的关系,可以获得电极反应动力学和电化学行为的信息。
本实验旨在通过CV技术,研究某种化合物在不同电位下的氧化还原行为,并分析其电化学特性。
实验方法:1. 实验仪器:使用一台循环伏安仪进行实验。
2. 实验电极:选用玻碳电极作为工作电极,银/银氯化银电极作为参比电极,不锈钢电极作为对比电极。
3. 实验溶液:制备待测化合物溶液,并添加适量的电解质以提高电导性。
4. 实验条件:设置扫描速度、起始电位、终止电位等参数,保持实验条件一致。
实验结果与讨论:在实验过程中,我们对待测化合物进行了CV测试,并记录了电流-电位曲线。
通过对曲线的分析,我们得到了以下结论:1. 氧化还原峰的观察:在CV曲线中,我们可以观察到氧化还原峰的出现。
氧化峰对应着化合物从还原态转变为氧化态的过程,而还原峰则表示还原态到氧化态的反应。
通过测量氧化还原峰的位置、峰电流和峰电位差等参数,可以获得化合物的氧化还原反应动力学信息。
2. 电极反应机理的推测:通过分析氧化还原峰的形状和位置,我们可以初步推测化合物的电极反应机理。
例如,如果氧化还原峰对称且位置固定,可能说明电极反应是可逆的;而不对称的峰则可能暗示着化合物的电极反应是不可逆的。
进一步的实验和数据处理可以帮助我们验证这些推测。
3. 电化学活性的评估:CV实验还可以用来评估化合物的电化学活性。
电化学活性是指化合物在电极上发生氧化还原反应的能力。
通过比较不同化合物的峰电流大小,我们可以初步判断它们的电化学活性。
峰电流越大,表示化合物的电化学活性越高。
4. 影响实验结果的因素:CV实验的结果受到多种因素的影响,如扫描速度、电解质浓度、电极材料等。
这些因素会改变氧化还原峰的形状、位置和峰电流大小。
因此,在进行CV实验时,需要注意控制这些因素,以保证实验结果的准确性和可重复性。
循环伏安法标定电极实验报告

循环伏安法【实验目的】学习和掌握循环伏安法的原理和实验技术。
了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。
【实验原理】循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。
从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。
与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。
一般对这类问题要根据固体电极材料不同而采取适当的方法。
对于碳电极,一般以Fe(CN)63-/4-的氧化还原行为作电化学探针。
首先,固体电极表面的第一步处理是进行机械研磨、抛光至镜面程度。
通常用于抛光电极的材料有金钢砂、CeO2、ZrO2、MgO和α-Al2O3粉及其抛光液。
抛光时总是按抛光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨后,再用一定粒度的α-Al2O3粉在抛光布上进行抛光。
抛光后先洗去表面污物,再移入超声水浴中清洗,每次2∼3分钟,重复三次,直至清洗干净。
最后用乙醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。
将处理好的碳图2:循环伏安曲线(i—E曲线)电极放入含一定浓度的K 3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。
如得到如图2所示的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc / i pa =1),峰峰电位差ΔE p 约为70 mV (理论值约59/n mV ),即说明电极表面已处理好,否则需重新抛光,直到达到要求。
有关电极有效表面积的计算,可根据Randles-Sevcik 公式: 在25°C 时,i p =(2.69×105)n 3/2AD o 1/2ν1/2C o其中A 为电极的有效面积(cm 2),D o 为反应物的扩散系数(cm 2/s),n 为电极反应的电子转移数,ν为扫速(V/s ),C o 为反应物的浓度(mol/cm 3),i p 为峰电流(A )。
循环伏安法实验报告

循环伏安法实验报告在电化学研究中,循环伏安法是一种简单而又强大的研究方法。
通过循环伏安法,可以对电极可逆性进行判断:反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称;判断电极反应机理的判断:如电极吸附现象、电化学反应过程中产物等;更重要的是,循环伏安法能够用于实验中的定量分析。
接下来,运用实验数据来答疑解惑。
通常我们选择铁氰化钾体系(Fe(CN)63-/4-)对电化学行为中的可逆过程进行研究,它的氧化与还原峰对称,两峰的电流值相等,两峰电位差理论值为0.059V。
通常电极表面的处理对该理论值有很大的影响,一般选择玻碳电极为工作电极、铂电极为对电极、饱和甘汞电极为参比电极。
选择Al2O3抛光粉将电极表面磨光,然后在抛光机上抛成镜面,最后分别在1:1乙醇、1:1HNO3和蒸馏水中超声波清洗15秒。
另外,溶液是否除氧,这个也是必须考虑的,我们选择通高纯N2除O2。
在电解池中放入5.00×10-4mol/LK3(内含0.20mol/L KNO3,作为支持电解质。
支持电解质的浓度实际上也对实验有影响,此处暂不考虑)。
插入工作电极、铂丝辅助电极和饱和甘汞电极。
设置电化学工作站中的参数,参数的设定需要不断的尝试,根据电化学工作站窗口显示的图形调节出合适的参数。
图一:K3Fe(CN)6溶液的循环伏安曲线图一的i-E曲线即为循环伏安图。
从循环伏安图中可以看出有两个峰电流和两个峰电位,阴极峰电流ipc,峰电位以Epc(jpc)表示;阳极峰电流ipa,峰电位以Epa表示。
ipc或ipa的下标的a代表anode,c代表cathode。
我们可知道,ΔEp=Epa-Epc=56/n(单位:mV)(n为反应过程中的得失电子数),ipc与ipa的比值越接近于1,则该体系的可逆程度就越高。
这是判断可逆体系的最直接的方法。
从电化学工作站的工作界面,可以得出氧化峰电位为Epa=227mV,峰电流为ipa=-1.91´10-6A;还原峰电位是Epc=170mV,峰电流是ipc=1.9´10-6A。
电化学-循环伏安法

实验四 循环伏安法一、 实验目的(1)学习如何运用CHI 电化学工作站进行循环伏安法的测定; (2) 学习循环伏安法测定电极反应参数的基本原理二、实验原理循环伏安法是在面积恒定的工作电极上,加上对称的三角波扫描电压,记录i-E 曲线,称为循环伏安图。
若三角波的前半部分是阴极扫描过程,电极发生还原反应,电流响应是峰形的阴极波;而三角波的后半部分是阳极扫描过程,电极上发生氧化反应,电流响应是峰形的阳极波。
因此三角波扫描,电极上完成一个还原-氧化的循环,故称为循环伏安法。
发生的电化学反应为O + ne -R 和/或 R O + ne -25ºC 时,其峰电流可表示为c v D An 212123p 269i = 其中,i p 为峰电流(A );A 为电极面积 (cm 2); n 为电子转移数;D 为扩散系数 (cm 2·s -1);v 为扫描速率 (V·s -1);c 为浓度 (mol·L -1)循环伏安法是研究电极过程机理的重要手段。
阴极峰电流i pc 和阳极峰电流i pa 的数值是循环伏安法中最为重要的参数。
对于一个简单的电极反应过程,下面两式是判别电极是否可逆的重要依据: 1i i pc pa≈V n 059.0E E E pc pa p ≈-=∆ 三、仪器与试剂CHI-电化学系统,玻碳电极,甘汞电极,铂电极电化学活性溶液:含1.0×10-3 mol·L -1 铁氰化钾溶液、1.0×10-3 mol·L -1 亚铁氰化钾溶液、0.1 mol·L -1 NaClN 2 (99.9%)α-Al 2O 3 抛光粉四、实验步骤(1)将玻碳电极用抛光粉抛光后,用蒸馏水和无水乙醇交替超声波清洗三次,每次20 s 。
电极彻底洗净后,用N 2吹干。
(2)将玻碳电极、甘汞电极、铂丝对电极插入到电化学活性溶液中,连接好电路。
红色:铂丝对电极绿色:玻碳电极白色:甘汞电极(3)通入N 2,除去O 2。
循环伏安法测定电极反应参数

循环伏安法测定电极反应参数
循环伏安法是一种电化学测试方法,用于测量电化学反应(例如电极反应)的参数。
具体步骤如下:
1. 准备电解质溶液和两个电极:一个工作电极、一个参比电极和一个辅助电极。
2. 把工作电极放入电解质溶液中并加入足够的电解质。
参比电极和辅助电极也必须放在溶液中,并且它们应该尽可能接近工作电极。
3. 将工作电极连接到电位计和电源,并将参考电极连接到电位计。
4. 通常会在一定范围内缓慢扫描电势范围。
开始时电位设置在较高值,随后电位逐渐减小至较低值,然后再逐渐升高至较高值。
扫描速率也是一个重要参数。
5. 当工作电极的电位被扫描时,会观察到电流变化。
这个输出信号可以记录下来。
可以用这个变化来确定电极反应参数,如反应速率、电荷转移系数、扩散系数和电化学反应的机理等。
6. 根据所得到的数据,可以进行一些计算,以确定电极反应的参数和性质。
循环伏安法是一种多用途的方法,适用于很多种电化学反应,包括金属离子的还原和氧化、化学反应的动力学参数等。
循环伏安法测定铁氰化钾实验报告(华南师范大学)

实验四循环伏安法研究铁氰化钾的电极反应过程一、实验目的(1)学习电化学工作站的使用及固体电极表面的处理方法(2)掌握用循环伏安法判断电极过程的可逆性二、实验原理循环伏安法(CV法)是以等腰三角形的脉冲电压加在工作电极上,在电极上施加线形扫描电压,从设定的起始电压开始扫描,到达设定的终止电压后,再反向回扫至设定的起始电压。
如果前半部分电压由高向低扫描,电活性物质在电极上还原(Ox + n e Red),产生还原波;则后半部分电压由低向高扫描时,还原产物又会在电极上氧化(Red -n e Ox),产生氧化波。
得到的电流~电压曲线(i ~ E曲线)称为循环伏安图(CV图)。
一次三角波扫描,完成一个还原和氧化过程的循环。
Fe(CN)63- + e Fe(CN)64-铁氰化钾(K3Fe(CN)6)的峰电流(i p)与电极表面活度的关系式为:式中,n、c和v分别为电活性物质的电子转移数、浓度和扫描速率。
i p与v1/2、c成正比。
对于可逆体系,氧化峰电流(i pa)与还原峰电流(i pc)之比i pa / i pc≈ 1,氧化峰电位(E pa)与还原峰电位(E pc)之差∆E p = E pa- E pc≈ 0.059/n,条件电位Eө' = (E pa + E pc)/2。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差,∆E p > 0.059/n,i pa / i pc < 1。
甚至只有一个氧化或还原峰,电极过程即为不可逆。
由此可判断电极反应过程的可逆性。
三、仪器和试剂(1)仪器:CHI620E电化学工作站、三电极系统(玻碳电极、铂丝电极、参比电极)(2)试剂:1.0 × 10-2 mol·L-1 K3Fe(CN)6溶液、1.0 mol·L-1 KNO3溶液四、实验步骤1. 玻碳电极的处理用Al2O3粉将电极表面抛光,用去离子水清洗,超声。
循环伏安法实验报告

直流循环伏安法一、实验目的1.掌握用循环伏安法判断电极过程的可逆性。
2.学会使用电化学工作站测定循环伏安曲线。
3.学会测量峰电流和峰电位。
二、实验原理循环伏安法是在工作电极上施加一个线性变化的循环电压来记录电流随电位的变化曲线,施加的电压为等边三角波或等边阶梯波,电位可向阳极方向扫描,也可向阴极方向扫描。
它能在很宽的电位范围内迅速观察研究对象的氧化还原行为。
图为电化学实验装置图RE﹑WE﹑CE分别为参比电极、工作电极和对电极采用三电极体系,分别为参比电极、工作电极和对电极。
仪器输出的电信号加到工作电极和对电极上,被研究的物质在工作电极上发生电化学反应。
辅助电极与工作电极连成通路, 反应的电流通过工作电极和对电极。
参比电极用于稳定工作电极的电位并确定电流-电势曲线中的峰电位、半波电位等。
若溶液中存在氧化态O,电极上将发生还原反应:反向回扫时,电极上生成的还原态R将发生氧化反应:峰电流表示为:其峰电流与被测物质的浓度c、扫描速度v等因素有关。
从循环伏安图可以确定氧化峰电流pa i 和还原峰峰电流pc i ,氧化峰电位φpa 和还原峰电位φpc 的值。
对于可逆体系,氧化峰峰电流与还原峰峰电流比:1=pcpa i i氧化峰峰电位与还原峰峰电位差:Zpc pa 058.0≈-=∆ϕϕϕ(V ) 条件电位:2'pcpa ϕϕϕ+=︒ 由此可判断电极过程的可逆性。
三、仪器与试剂仪器:CHI 电化学工作站440;玻碳工作电极,铂丝对电极和饱和甘汞电极。
试剂:四、实验步骤1.玻碳电极(金圆盘电极或铂圆盘电极)的预处理用Al 2O 3粉将电极表面抛光,然后用蒸馏水清洗,用超声处理,待用。
2.K 3Fe(CN)6溶液的循环伏安图在电解池中放入配制好的K 3Fe(CN)6溶液,插入玻碳工作电极、铂丝辅助电极和Ag/AgCl 参比电极;以扫描速率20 mV/s ,从+0.80~-0.20 V 扫描,记录循环伏安图;以不同扫描速率:40、60、80、100和150 mV/s ,分别记录从+0.80~-0.20 V 扫描的循环伏安图。
循环伏安法测定(精)

i—E 曲 线
作图并验证以下公式
ip ~ C
ip ~ v1/ 2 ip 2.69 105 n3/ 2 ACD1/ 2v1/ 2
实验注意事项
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静
止下进行电解。
实验前电极表面要处理干净。 在0.10 mol.L-1 NaNO3溶液中[Fe(CN)6]的扩散系数为0.63×10-5 cm.s-1; 电子转移速率大,为可逆体系(1.0 mol.L-1 NaNO3溶液中,25℃时,标 准反应速率常数为5.2×10-2 cm· s-1)。
ipa、ipc与相应v1/2的关系曲线
峰电流与电极表面活度的Randles-Savcik方程
ip 2.69 105 n3/ 2 ACD1/ 2v1/ 2
循环伏安法
在一定扫描速率下,从起始电位( +0.8 V )负向扫描到 转折电位( -0.2 V )期间,溶液中 [Fe(CN)6]3- 被还原生成 [Fe(CN)6]4-,产生氧化电流;当正向扫描从转折电位(-0.2 V) 变到原起始电位( +0.8 V )期间,在工作电极表面生成的 [Fe(CN)6]3- 被氧化生成[Fe(CN)6]3- ,产生还原电流。
0
ipa Epa
0.6 0.6 0.5 0.5 0.4 0.4 0.3 0.3 0.2 0.1 0.0
-1
• 所得到的i-E曲线成为循 环伏安图。 • 由图可见,循环伏安图 有两个峰电流和两个峰 电位。 • 阴极峰电流ipc,峰电位 以Epc(pc)表示。 • 阳极峰电流ipa,峰电位 以Epa(pa)表示。 两个峰电位差Δ Ep(ΔP) 重要参数。
循环伏安法测定
电极反应参数
一、实验目的
仪器分析实验 循环伏安法测定电极反应参数

ΔEp/V 079 0.069 0.068 0.070 0.070
ipa/ ipc 1.745 1.419 1.223 1.230 1.206
表 1 不同浓度下铁氰化钾伏安曲线数据(*由于小组成员的操作失误,故本实验使用的浓度与实验讲义有所不同)
实验二:不同扫描速度下铁氰化钾伏安曲线:
扫描速度/mV·s-1 5
• 可逆与不可逆过程: (准)可逆过程:循环伏安法是一个方便的测量标准电极电位的方法。曲线形状与可逆度有关,一般来说, △EP >59mV/n,且峰电位随扫描速度的增加而变化,阴极峰变负,阳极峰变正。此外, 根据电极反应性质的不同,iPa / iPc 可大于 1,等于 1 或小于 1,但均与扫描速度的平方根 成正比,因为峰电流仍是由扩散速度所控制的; 不可逆过程:反扫时没有峰,但峰电流仍与扫描速度的平方根成正比,峰电位随扫描速度的变化而变化。
图 5 铁氰化钾 ipc 与 v1/2 的关系曲线
4
仪器分析实验
循环伏安法测定电极反应参数
2015 年 6 月 2 日
图 6 铁氰化钾 ipc 与 c 的关系曲线
由表 1 可以看出,扫描速度对 Epa/Epc 以及 ipa/ipc 没有太大影响,其原因可能是,电极表面氧化还原电位 不随扫面速率控制,但由于电极电流和当前电压与电极电势的差值有关,扫描越快,因反应滞后而产生的电 位差越大,则电流越大。此外,Epa 与 v1/2 成正比。
由图 5、6 可看出,电流大小与 v1/2、以及 c 成正比,且 v1/2 越大,电流值越大;浓度越大,电流也越大。
4、求算 Fe(CN)63-/ Fe(CN)64- 的电极反应的 E0。 E0=(Epa+Epc)/2 E0=(E01 +E02 +E03 +E04 +E05)/ 5=(0.2055+0.2155+0.211+0.211+0.211) / 5 = 0.21V
循环伏安法测定电极反应参数实验原理

循环伏安法(Cyclic Voltammetry)是一种常用的电化学实验方法,用于研究电极上的反应动力学和电化学过程。
下面是循环伏安法测定电极反应参数的实验原理:
1. 实验装置:循环伏安法需要一个电化学工作站或循环伏安仪,以及电极(工作电极、参比电极和计数电极)和电解质溶液。
2. 实验步骤:首先,将待测溶液放置在电解质容器中,电解质溶液中可以加入适量的外加试剂或电化学活性物质。
然后,将工作电极插入溶液中,参比电极和计数电极也分别插入。
最后,通过设定电位扫描的起始电位和终止电位,以及扫描速率,进行电位扫描实验。
3. 电位扫描过程:在实验过程中,起始电位逐渐增加或减小,电位之间的差值称为扫描电位范围。
扫描速率决定了电位的变化速度。
电位的变化将引起电流的变化。
通过记录电位和电流之间的关系,可以得到电流-电位曲线,称为循环伏安曲线。
4. 分析和参数计算:通过分析循环伏安曲线,可以得到电极反应的参数,包括峰电位、峰电流、电荷转移系数、电荷转移速率常数等。
这些参数可以揭示电极反应的机理和动力学特性。
循环伏安法通过控制电位的变化,观察电流的响应,从
而研究电极反应的动力学和电化学过程。
它广泛应用于电化学分析、电化学催化、电化学能源存储等领域的研究和应用。
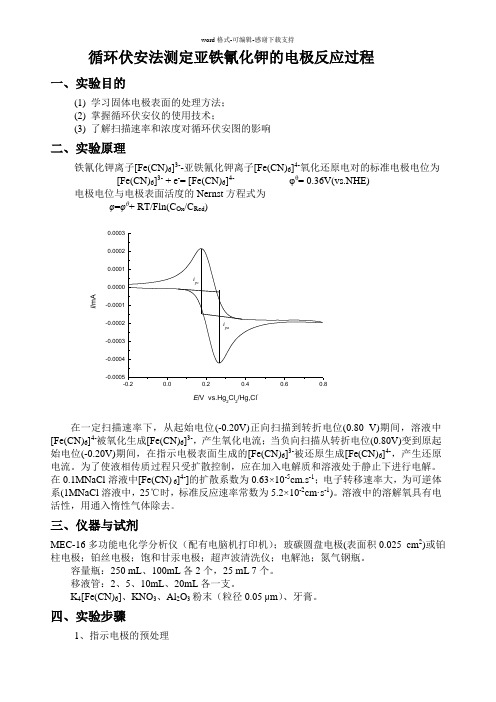
(新)实验四 循环伏安法测定亚铁氰化钾的电极反应过程

循环伏安法测定亚铁氰化钾的电极反应过程一、实验目的(1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术;(3) 了解扫描速率和浓度对循环伏安图的影响二、实验原理铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red )-0.20.00.20.40.60.8-0.0005-0.0004-0.0003-0.0002-0.00010.00000.00010.00020.0003i pai pcI /m AE /V vs.Hg 2Cl 2/Hg,Cl-在一定扫描速率下,从起始电位(-0.20V)正向扫描到转折电位(0.80 V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(0.80V)变到原起始电位(-0.20V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
在0.1MNaCl 溶液中[Fe(CN) 6]4-]的扩散系数为0.63×10-5cm.s -1;电子转移速率大,为可逆体系(1MNaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2cm·s -1)。
溶液中的溶解氧具有电活性,用通入惰性气体除去。
三、仪器与试剂MEC-16多功能电化学分析仪(配有电脑机打印机);玻碳圆盘电极(表面积0.025 cm 2)或铂柱电极;铂丝电极;饱和甘汞电极;超声波清洗仪;电解池;氮气钢瓶。
容量瓶:250 mL 、100mL 各2个,25 mL 7个。
(新)实验四-循环伏安法测定亚铁氰化钾的电极反应过程
循环伏安法测定亚铁氰化钾的电极反应过程一、实验目的(1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术;(3) 了解扫描速率和浓度对循环伏安图的影响二、实验原理铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为 [Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red )-0.20.00.20.40.60.8-0.0005-0.0004-0.0003-0.0002-0.00010.00000.00010.00020.0003i pai pcI /m AE /V vs.Hg 2Cl 2/Hg,Cl-在一定扫描速率下,从起始电位(-0.20V)正向扫描到转折电位(0.80 V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(0.80V)变到原起始电位(-0.20V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
在0.1MNaCl 溶液中[Fe(CN) 6]4-]的扩散系数为0.63×10-5cm.s -1;电子转移速率大,为可逆体系(1MNaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2cm·s -1)。
溶液中的溶解氧具有电活性,用通入惰性气体除去。
三、仪器与试剂MEC-16多功能电化学分析仪(配有电脑机打印机);玻碳圆盘电极(表面积0.025 cm 2)或铂柱电极;铂丝电极;饱和甘汞电极;超声波清洗仪;电解池;氮气钢瓶。
容量瓶:250 mL 、100mL 各2个,25 mL 7个。
循环伏安法测定电极反应参数

实验名称循环伏安法测定电极反应参数指导教师姓名年级学号成绩一、预习部分1.1、实验目的1、学习循环伏安法测定电极反应参数的基本原理2、熟悉伏安法测量的实验技术1.2、实验基本原理循环伏安法(CV)是重要的电分析化学研究方法之一。
在电化学、有机化学、生物化学的研究领域应用广泛。
由于它的仪器简单,操作方便,图谱解析直观,因此是最常用方法之一。
CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加的电压之间的关系曲线。
这种方法也常被称为三角波线性电位扫描方法。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流对电位作图,称为循环伏安图。
典型的循环伏安图如下图所示。
该图是在1.0 mol/L KNO3电解质溶液中,6x10-3 mol/L K3Fe(CN)6在Pt工作电极上的反应所得到的结果。
6x10-3 mol/L K3Fe(CN)6在1.0 mol/L KNO3电解质溶液中的循环伏安图扫描速度: 50 mV/s 铂电极面积: 2.54 mm2由图可见,起始电位Ei为+0.8 V (a点), 电位比较正的目的是为了避免电极接通后Fe(CN)63-发生电解。
然后沿负的电位扫描,如箭头所指方向,当电位至Fe(CN)63-可以还原时,即析出电位,将产生阴极电流(b点)。
其电极反应为:FeⅢ(CN)63-+ e-→ FeⅡ(CN)64-随着电位的变负,阴极电流迅速增加(b→d),直至电极表面的FeⅢ(CN)63-浓度趋近于零,电流在d点达到最高峰。
然后电流迅速衰减(d→g), 这是因为电极表面附近溶液中的Fe(CN)63-几乎全部电解转变为Fe(CN)64-而耗尽,即所谓的贫乏效应。
当电压扫描至-0.15 V (f点)处,虽然已经转向开始阳极化扫描,但这时的电极电位仍然相当的负,扩散至电极表面的Fe(CN)63-仍然在不断还原,故仍呈现阴极电流,而不是阳极电流。
当电极电位继续正向变化至Fe(CN)64-的析出电位时,聚集在电极表面附近的还原产物Fe(CN)64-被氧化,其反应为:Fe(CN)64-- e-→ Fe(CN)63-这时产生阳极电流(i→k)。
循环伏安法原理及结果分析

循环伏安法原理及结果分析循环伏安法(Cyclic voltammetry,CV)是一种电化学分析方法,常用于研究电极上的化学和电化学反应以及物质的电化学行为。
它通过改变电极电位并测量所引起的电流变化,得到一个电流-电压(I-V)曲线,从而分析电化学反应的特性和机理。
CV实验通常使用一个工作电极、一个参比电极和一个辅助电极的电化学电池。
工作电极是用来进行电化学反应的电极,参比电极用来测量工作电极与参比电极之间的电位差,辅助电极用来提供能量以促进电化学反应的进行。
实验中,通过改变工作电极的电位,可以在电化学电池中引起氧化还原反应。
结果是电流的变化,这个变化被记录下来以产生I-V曲线。
CV实验中的结果分析包括几个方面:1.反应的电位范围:通过改变工作电极的电位扫描范围,可以确定反应的电位范围。
通常将电位从一个初始电位线性地扫描到另一个终止电位,然后再返回到初始电位。
扫描速率和电位范围的选择取决于所研究的电化学反应和物质的性质。
2.峰电位和峰电流:CV曲线通常包含多个峰,每个峰对应于一个电化学反应。
峰电位是峰的中心电位,表示氧化和还原反应的临界电位。
峰电流是峰的最大电流值,表示反应速率和物质浓度的关系。
通过测量峰电位和峰电流,可以确定反应的动力学和热力学参数。
3.峰形:CV曲线的峰形可以提供有关反应机理的信息。
对于可逆反应,峰电流正比于扫描速率;对于不可逆反应,峰电流与扫描速率无关。
峰形也可以显示反应的控制步骤,如扩散控制、电极控制或混合控制。
4.电化学反应的类型:通过分析CV曲线的形状和特征,可以确定电化学反应的类型。
例如,CV曲线中的一个峰表示一个氧化还原反应,而CV曲线中的两个峰表示一个两步反应。
5.物质的电化学行为:CV实验也可以用来研究物质在电极上的电化学行为。
通过改变溶液pH、阳离子或阴离子的浓度,可以观察到电化学反应的变化。
此外,还可以测量不同溶液中的CV曲线并进行比较,以了解物质在不同环境中的电化学性质。
实验4循环伏安法测定电极反应参数实验报告

华南师范大学实验报告学生姓名学号2014专业新能源材料与器件年级、班级2014课程名称电化学实验实验项目循环伏安法测定电极反应参数实验类型□√验证□设计□综合实验时间2016年4月25日实验指导老师吕东生实验评分一、实验目的1.了解循环伏安法的基本原理及应用2. 掌握循环伏安法的实验技术和有关参数的测定方法。
二、实验原理循环伏安法(Cyclic Voltammetry)是一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛使用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),,一支参比电极,一支对电极。
外加电压在工作电极和辅助电极之间,反应电流通过工作电极与辅助电极。
图1 循环伏安法测得的氧化还原曲线正向扫描的峰电流ip与v^0.5和C都成线性关系,对研究电极过程具有重要意义。
标准电极电势为:EΘ=(Epa +Epc)/2。
所以对可逆过程,循环伏安法是一个方便的测量标准电极电位的方法。
三、实验器材CHI电化学工作站;玻碳电极;铂电极;Hg/Hg2SO4电极;0.1 mol/L VO2+ + 0.1 mol/L VO2+ +3 mol/L H2SO4溶液四、实验步骤1. 预处理电极2. 连接好电极,打开CHI电化学工作站,测试完开路电压后选择“Cyclic Voltammetry Parameters”方法。
循环伏安法测定电极反应参数实验报告

循环伏安法测定电极反应参数实验报告
一、实验目的
本实验旨在通过循环伏安法测定电极反应参数,以便了解电极反应的过程。
二、实验原理
循环伏安法是一种常用的电化学测试方法,它可以测定电极反应的参数,如活化能、电极电势和反应速率常数等。
该方法基于在固定的电极电势范围内,电极反应的当量电流随伏安曲线的变化而变化的原理。
三、实验步骤
1. 将电极放入循环伏安仪的测试槽中,并将仪器设置为循环伏安模式。
2. 设置电极电势范围,并调节仪器的参数,如循环次数、循环间隔时间等。
3. 执行测试,记录电极反应的当量电流值。
4. 根据测试结果,用计算机软件绘制伏安曲线,并计算电极反应的参数。
四、实验结果
电极反应的参数如下:
活化能:3.14eV
电极电势:0.2V
反应速率常数:1.2×10-3 s-1
伏安曲线如下:

五、实验总结
本实验通过循环伏安法测定电极反应参数,掌握了电极反应的过程,了解了活化能、电极电势和反应速率常数等参数的大小,为进一步研究电极反应提供了参考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华南师范大学实验报告
学生姓名学号2014
专业新能源材料与器件年级、班级2014
课程名称电化学实验实验项目循环伏安法测定电极反应参数实验类型□√验证□设计□综合实验时间2016年4月25日
实验指导老师吕东生实验评分
一、实验目的
1.了解循环伏安法的基本原理及应用
2. 掌握循环伏安法的实验技术和有关参数的测定方法。
二、实验原理
循环伏安法(Cyclic Voltammetry)是一种常用的电化学研究方法。
该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。
对于一个新的电化学体系,首选的研究方法往往就是循环伏安法。
该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛使用。
循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),,一支参比电极,一支对电极。
外加电压在工作电极和辅助电极之间,反应电流通过工作电极与辅助电极。
图1 循环伏安法测得的氧化还原曲线
正向扫描的峰电流i
p
与v^0.5和C都成线性关系,对研究电极过程具有重要意义。
标准
电极电势为:EΘ=(E
pa +E
pc
)/2。
所以对可逆过程,循环伏安法是一个方便的测量标准电极
电位的方法。
三、实验器材
CHI电化学工作站;玻碳电极;铂电极;Hg/Hg2SO4电极;0.1 mol/L VO2+ + 0.1 mol/L VO2+ +3 mol/L H2SO4溶液
四、实验步骤
1. 预处理电极
2. 连接好电极,打开CHI电化学工作站,测试完开路电压后选择“Cyclic Voltammetry Parameters”方法。
3. 设置实验参数。
初始电位为0.3598V(开路电压),阴极终止电位-12V,阳极终止电位+2V,扫描速率为20mV/s,循环次数2次,即“Sweep Segment”为5。
sensitivity取1.e^-6取第二次的数据。
保存实验数据。
4. 换电解液,处理电极后,将扫速设置为5mV/s,阴极终止电位-0.3V,阳极终止电位1.3V,循环次数为2次,取第二次的数据。
保存实验数据。
5. 在扫描速度分别为10mV/s,15mV/s,20mV/s下按照步骤5的实验条件测量循环伏安曲线。
保存实验数据。
6.清洗电极和电解槽,关闭仪器和电脑。
五.实验数据处理与分析
1.作出玻碳电极在-1.5V~
2.0V范围内测出的循环伏安曲线图 (选第2次扫描的曲线)。
指出玻碳电极上的析氢电位、析氧电位以及另外一对氧化峰和还原峰的电位及其对应的电化学反应。
图2 玻碳电极在0.1mol/L VO2++0.1mol/L VO2++3mol/L H2SO4,-2V~+2V范围内的循环伏安曲线图析氢电位:-1.638V 析氧电位:0.945V
另一个还原峰电位:-1.124V 对应反应为VO2++2H++e-= VO2++H2O
另一个氧化峰电位:-0.394V 对应反应为VO2++H2O = VO2++e-+2H+
2. 在同一张图中做出-0.3V~1.1V范围内不同扫速下的循环伏安曲线。
列表总结不同扫速下的测量结果。
C u r r e n t (A )
Potential (V)
图3 玻碳电极在-0.3V~1.1V 范围内不同扫速下的循环伏安曲线
根据ΔE p 和i pa /i pc 随扫描速度的变化趋势,说明扫速对VO 2+/ VO 2+ 电对的可逆性的影响。
从表1数据可见,ΔEp 随扫速增大而增大,i pa /i pc 也越来越偏离1,说明VO2+/ VO2+电对的扫速越大,电化学极化会增大,电对可逆性会降低。
3. 在同一张图中作出i pa 和i pc 对v 1/2的曲线,并指出这两条曲线是否都是通过原点的直线。
图4.i pc和i pa对v1/2的曲线由图像可知,两条曲线都没有通过原点。
