GLP1037道路试验认可报告
GLP认证程序

注销认可:已认可机构自愿提出不再维持认可,或有效期满未申请继续认可、或已认可机构终止认可范围内活动或倒闭,认可委员会终止对该机构的认可资格的活动。
4.13 授权签字人:经认可委员会认可,可以签发带认可标志的报告或证书的人员。
4.14 能力验证:利用实验室间对比确定实验室的校准/检测能力。
实验室认可程序规则2009-08-02 10:461.前言
1.
1中国实验室国家认可委员会(以下简称:认可委员会,英文缩写:CNAL)依据国家相关法律法规和国际规范开展自愿性认可工作,遵循的原则是:客观公正、会认可工作公正性和规范性的重要保障,认可委员会依据《中国实验室国家认可委员会章程》制定本规则。
6.2.2 缩小认可范围
6.2.2.1 缩小认可范围的条件
在下列情况下,可以导致缩小认可范围:
a) 已认可机构自愿申请缩小其原认可范围;
b) 业务范围变动使已认可机构失去原认可范围内的部分能力;
c)
监督评审、复评审或能力验证的结果表明已认可机构在某些检测、校准、检查项目的技术能力或质量管理不在满足认可要求,且在认可委员会规定的时间内不能恢复。
6.1.3 评审准备
6.1.3.1 认可委员会秘书处指定评审组并征得申请方同意,如申请方基于公正性理由对评审组的任何成员表示拒绝时,秘书处经核实后应给予调整。
6.1.3.2
评审组审查申请方提交的质量体系文件和相关资料,当发现文件不符合要求时,评审组长应以书面方式通知申请方采取纠正措施。秘书处根据评审组长的提议,认为需要时,可与申请方协商进行预评审。预评审只对资料审查中发现的问题进行核实或做进一步了解,不做咨询,也不发表评价意见,但需向秘书处提交书面的预评审报告。在申请方采取有效纠正措施解决发现的问题后,评审组长方可进行现场评审。
沥青道路试验报告模板

沥青道路试验报告模板一、试验目的本次试验旨在评估沥青道路的性能与可靠性,检测其在不同环境条件下的变化以及对车辆行驶的影响,为道路工程设计和维护提供科学依据。
二、试验设备与材料1. 沥青道路样品:采用常见的沥青混凝土或改性沥青混凝土作为试验材料。
2. 试验设备:包括洛磯硬度仪、抗剪仪、冻融循环试验机、温度控制室等。
3. 其他辅助设备与材料:如试验砂、水、温度计等。
三、试验内容与方法1. 洛磯硬度测试:将洛磯硬度仪放置在沥青道路上,以标定的测试方法进行洛磯硬度的测定,得到道路表面硬度值。
2. 抗剪强度测试:采用抗剪仪按照标准试验方法进行抗剪强度的测试,得到沥青道路的抗剪强度值。
3. 冻融循环试验:在冻融循环试验机中对沥青道路样品进行冻融循环试验,模拟道路在严寒环境下的变化情况,评估沥青道路的耐久性。
4. 温度变化试验:将沥青道路样品放置于温度控制室中,使其在不同温度下进行变化,观察沥青道路的表面变形情况。
四、试验结果与分析经过上述试验,我们得到以下结果:1. 洛磯硬度测试结果显示,沥青道路的表面硬度达到标准要求,满足正常车辆行驶的基本需求。
2. 抗剪强度测试结果表明沥青道路的抗剪能力较强,能够承受一定的车辆负荷和外力影响。
3. 冻融循环试验结果显示,沥青道路在冰冻融化过程中表现出较好的耐久性,没有出现明显的损坏和开裂现象。
4. 温度变化试验结果表明,在不同温度条件下,沥青道路的表面变形较小,仍能保持较好的平整性。
综合上述试验结果可以得出结论:沥青道路在各项性能指标上表现良好,能够满足正常车辆行驶的要求。
然而,在实际应用中仍需根据具体情况进行综合评估和优化设计,以确保道路的安全性和可靠性。
五、结论与建议根据试验结果和分析,可以得出以下结论和建议:1. 沥青道路在洛磯硬度、抗剪强度和耐久性方面表现出良好的性能,可以考虑在适当的场合推广应用。
2. 针对沥青道路在不同温度下的表面变形情况,可以研究和改善其温度敏感性,减少道路变形对车辆行驶的影响。
国家认监委实验室与检测监管部关于修订良好实验室规范(GLP)及评价程序的有关文件的通知

国家认监委实验室与检测监管部关于修订良好实验室规范(GLP)及评价程序的有关文件的通知文章属性•【制定机关】国家认证认可监督管理委员会•【公布日期】2013.02.06•【文号】•【施行日期】2013.02.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】标准化正文国家认监委实验室与检测监管部关于修订良好实验室规范(GLP)及评价程序的有关文件的通知各省、自治区、直辖市质量技术监督局、各直属检验检疫局、各有关国家资质认定行业评审组、各有关检测机构:为保护环境和动植物、人类生命健康,推进生态文明建设,提升我国化学品安全管理水平,进一步加强国家认监委良好实验室规范(GLP)监控体系建设工作的科学性、有效性,根据认监委良好实验室规范评价试点工作实践经验,经组织有关专家研讨,国家认监委对2008年发布的《良好实验室规范原则》(试行)等相关文件进行了修订和完善,现将有关事项通知如下。
一、制修订文件内容1.对《良好实验室规范(GLP)原则》(试行)进行了修订;2.对《良好实验室规范(GLP)符合性评价程序》(试行)进行了修订;3.对《良好实验室规范(GLP)符合性评价申请书》(试行)进行了修订;4.对《良好实验室规范(GLP)评价的领域》(试行)进行了修订;5.新制定了《国家认监委认监委良好实验室规范标识使用及管理规定》。
二、实施要求修订后的程序及有关文件从2013年2月1日起实施,并替代原国家认监委2008年第17号公告内容。
请申请国家认监委良好实验室规范的试验机构认真学习并使用新发布的文件(不印发纸质文件,请从认监委网站下载)。
国家认监委实验室与检测监管部2013年2月6日附件1良好实验室规范(GLP)原则一、范围本规范原则规定了良好实验室规范(Good Laboratory Practice,以下简称GLP)的相关术语和定义,以及主要技术规范,包括试验机构的组织和人员、质量保证计划、机构、仪器、材料及试剂、试验系统、试验样品和参照物、标准操作程序、研究的实施、研究结果的报告、记录和材料的存储与保管。
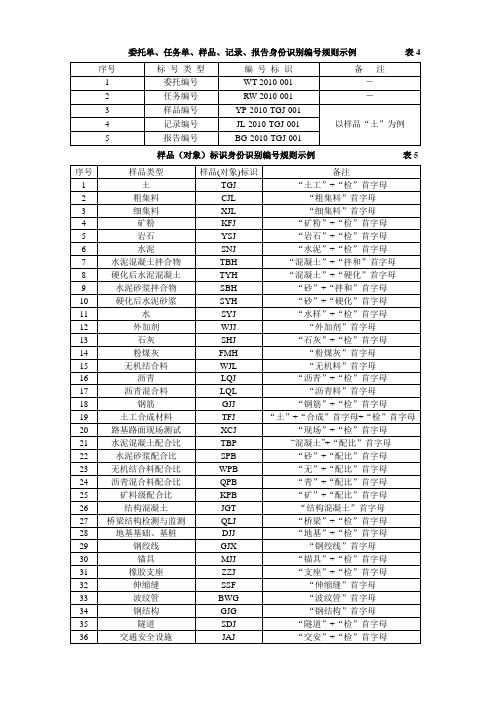
《公路试验检测数据报告编制导则》编号规则示例
锚具
MJJ
“锚具”+“检”首字母
31
橡胶支座
ZZJ
“支座”+“检”首字母
32
伸缩缝
SSF
“伸缩缝”首字母
33
波纹管
BWG
“波纹管”首字母
34
钢结构
GJG
“钢结构”首字母
35
隧道
SDJ
“隧道”+“检”首字母
36
交通安全设施
JAJ
“交安”+“检”首字母
无机结合料配合比
WPB
“无”+“配比”首字母
24
沥青混合料配合比
QPB
“青”+“配比”首字母
25
矿料级配合比
KPB
“矿”+“配比”首字母
26
结构混凝土
JGT
“结构混凝土”首字母
27
桥梁结构检测与监测
QLJ
“桥梁”+“检”首字母
28
地基基础、基桩
DJJ“地基”+“检Fra bibliotek首字母29
钢绞线
GJX
“钢绞线”首字母
委托单、任务单、样品、记录、报告身份识别编号规则示例表4
序号
标号类型
编号标识
备注
1
委托编号
WT-2010-001
―
2
任务编号
RW-2010-001
―
3
样品编号
YP-2010-TGJ-001
以样品“土”为例
4
记录编号
JL-2010-TGJ-001
5
报告编号
BG-2010-TGJ-001
样品(对象)标识身份识别编号规则示例表5
道路工程检测报告模板

道路工程检测报告模板一、引言此份道路工程检测报告模板旨在规范和统一相关检测报告的格式和内容,便于相关方面进行查阅和分析。
本模板适用于道路建设、维护和改建等方面的工程检测。
在使用本模板时,需要根据具体情况进行内容调整和填写,尤其是涉及到道路状况和建设质量等方面的内容。
二、检测内容本次道路工程检测涉及到以下方面:1.道路基础及场地条件;2.道路面层及标线等墙面装饰;3.道路排水及照明设施等。
三、检测人员本次道路工程检测人员组成如下:1.检测主管:XXX;2.检测人员:XXX、XXX、XXX。
四、检测流程1. 检测准备1.1 审批手续检测前需按规定进行相关审批手续,如工程验收和竣工验收等。
1.2 准备设备检测前需准备好相关检测设备,如测距仪、测速仪、相机等。
1.3 人员培训检测人员需接受相关培训,了解检测方法和要求等。
2. 现场实验在现场根据检测要求进行实验及数据采集等工作。
3. 数据处理对采集到的实验数据进行处理和分析,生成相关报告及图表等。
4. 报告撰写根据检测要求及数据处理结果,撰写检测报告。
五、检测结果1. 道路基础及场地条件道路基础及场地条件均符合相关规定和标准,未发现明显安全隐患。
2. 道路面层及标线等墙面装饰道路面层及标线等墙面装饰等符合设计要求及相关标准,未发现明显安全隐患。
3. 道路排水及照明设施等道路排水及照明设施等符合设计要求及相关标准,未发现明显安全隐患。
六、结论根据本次道路工程检测结果,道路建设符合相关标准和要求,未发现明显安全隐患。
但仍需在日常维护中及时处理路面损坏和交通设施等问题,确保道路畅通和行车安全。
七、参考资料•道路工程施工及验收规范;•道路交通安全标准;•道路建设质量管理规定。
吉利PPAP模版

GLP1036 GLP1037
表单编号
GLP1001 GLP1002 GLP1003 GLP1004 GLP1005 GLP1006 GLP1007 GLP1007 GLP1008 GLP1009 GLP1010 GLP1011 GLP1012 GLP1013
GLP1014
GLP1015 GLP1016 GLP1017 GLP1018 GLP1019 GLP1020 GLP1021 GLP1022 GLP1023 GLP1024 GLP1025 GLP1026 GLP1027 GLP1028 GLP1029 GLP1030 GLP1031 GLP1032 GLP1033 GLP1034 GLP1035
序号 表单名称
1 初始样件提交保证书 2 尺寸结果 3 材料试验结果 4 性能试验结果 5 外观件批准报告 6 过程流程图 7 设计失效模式和后果分析(如供方负责设计) 8 过程失效模式和后果分析 9 生产过程控制计划 10 非正式批准申请单 11 尺寸结果(复验) 12 材料试验结果(复验) 13 工装样件入库单 14 工装样件认可报告 15 生产线装车(机)试验单? 16 尺寸认可报告 17 材料认可报告 18 性能认可报告 19 道路试验报告 20 试装认可报告 21 生产件最终批准报告 22 生产件批准状况通知 23 特殊生产件最终批准报告 24 包装规格书 25 初始管理计划书(协定书) 26 过程能力调查一览表 27 检查基准书 28 产品管理基准书 29 供方的二次、三次分供方选定批准书 30 检具夹辅具检测报告 31 性能复检 32 试装报告 33 工装样件接收清单 34 工装样件标识 35 设计/过程更改通知书 36 检验规格承认申请书
glp报告格式范文

glp报告格式glp报告格式范文glp报告格式范文篇一:GLP的基本介绍GLP的基本介绍一,GLP的基本概念GLP(Good Laboratory Practice,即良好实验室操作规范),广义上是指严格实验室管理(包括实验室建设,设备和人员条件,各种管理制度和操作规程,以及实验室及其出证资格的认可等)的一整套规章制度.包括对实验设计,操作,记录,报告,监督等整个环节和实验室的规范要求. GLP的概念GLP最早起源于药品研究.与GCP(药品临床试验规范)和GMP(药品良好生产过程)相对应,药品GLP是指药品非临床(或临床前)研究的质量管理规范.药品的非临床(临床前)研究主要指在实验室进行的安全性毒理学评价和药理,药效学评价(包括药代动力学和毒代动力学研究),故此GLP即指从事药品非临床研究的实验室管理规范.其后,GLP的概念逐渐扩展到其他有毒有害物质(如农药,环境和食品污染物,工业毒物,射线等)的实验室安全性评价,以及各类健康相关产品(食品和保健食品,化妆品,涉水产品,消毒产品等)的实验室评价(包括安全性和功效学评价),甚至还包括了对临床实验室大部分检验工作的管理.因此,可以说目前GLP的范围已经覆盖了与人类健康有关的所有实验室研究工作,并有进一步向与整个环境和生物圈有关的实验室研究工作扩展的趋势.二,国内外GLP的发展历史和现状发达国家在二十世纪六,七十年代即开始正式发展和实施GLP.如美国FDA在1979年即制定并发布了第一部药品GLP.日本于1982年由厚生省药物局发布第一部药品GLP,经修订后于1997年3月26日以厚生省令正式颁布.目前已实施GLP制度的有美,日,英,德,荷兰,瑞典和瑞士等国家.我国于二十世纪八十年代末和九十年代初相继开展了药品和其他相关产品,毒物的GLP研究和实施工作.1993年12月以国家科委主任令形式发布《药品非临床研究管理规定(试行)》,经几年试用和修订后于1999年10月由国家药品监督管理局第14号令发布《药品非临床研究质量管理规范》(试行).近期将颁布GLP实施指南,并已开展对全国GLP实验室的认证工作.卫生部十分重视健康相关产品检验和化学物毒性评价的GLP管理工作.1999年3月发布了《卫生部健康相关产品检验机构工作制度》和《卫生部健康相关产品检验机构认定与管理办法》;2000年1 月发布《卫生部健康相关产品检验机构认定与管理规范》.2000年11月卫生部发布《化学品毒性鉴定管理规范》(包括化学品毒性鉴定实验室条件及工作准则,即GLP);2001年6月发布《化学品毒性鉴定机构资质认证工作程序》和《化学品毒性鉴定机构资质认证标准》.三,GLP的基本内容对于承担不同产品或化学物检验的实验室的GLP,其内容和要求亦不完全相同,但GLP的基本原则,要求与内容是相似的.实施GLP的主要目的是提高实验室研究与检验工作的质量,确保实验数据和结果的真实性和可靠性.一般而言,GLP通常包括以下几个主要部分1. 对组织机构和人员的要求2. 对实验设施,仪器设备和实验材料的要求3. 标准操作规程(SOP)4. 对研究工作实施过程的要求5. 对档案及其管理工作的要求6. 实验室资格认证及监督检查四,GLP的若干要点详述(一)标准操作规程(SOP—Standard Operating Procedures)编写和使用SOP的主要目的是保证操作的重现性和保证结果数据的可信性.接受过教育和培训的人员按SOP进行试验时,其试验操作及操作结果的重现性较好.亦即在同一研究机构或实验室内,由不同的人按SOP进行操作和试验,可保证能够达到较一致的结果.编写和建立一套合乎GLP要求且合乎本研究机构实际情况的标准操作规程(SOP)是GLP软件建设的主要内容.在SOP的建设方面,人的作用是主要的,而经费是次要的.因此,在进行GLP实验室建设时,先从制定SOP开始是通常的做法.SOP需在实践中不断加以完善和修订.必须注意的是,SOP应有良好的可操作性,而不能将其视为一种形式.一套合格的,可操作性强的SOP,必须经过实践—修订—再实践—再修订的长期反复过程才能逐渐形成.另外还应强调,SOP的编写,修订和管理过程本身也应有相应的SOP 来加以规范.一般而言,下列工作都需要制定相应的SOP1. SOP的编写,修订和管理.2. 动物房及实验室的准备及环境因素的调控;实验设施及仪器设备的维护,保养,校正,使用和管理;计算机系统的操作和管理.3. 受试物和对照物的接收,标识,保存,处理,配制,领用及取样分析.4. 实验动物的运输,检疫,编号,分配,搬运及饲养管理;实验动物的观察记录及实验操作;动物的尸检以及组织病理学检查;濒死或已死亡动物的检查处理.5. 各种实验和分析样品,标本的采集,编号;指标的检查,测定和检验等操作技术.6. 各种实验数据的统计处理与计算.7. 质量保证工作制度与措施.8. 实验操作人员的防护和保护措施;废弃物处理和防止污染环境的措施;实验室工作人员的健康检查制度等.除上述各类工作外,研究机构或实验室认为有必要制定SOP的其它工作也应制定相应的SOP. SOP必须经质量保证部门签字确认并经机构负责人批准方为有效.失效的SOP应留一份存档, 其余应及时销毁.SOP的制定,修改,生效日期及分发,销毁情况应记入档案并妥善保存.SOP的存放应以方便使用为原则.研究或检验过程中任何偏离或违反SOP的操作,不论问题大小,都应及时向项目负责人报告或经项目负责人批准,并在原始资料中加以清楚的记录.SOP 原则上不能复印.SOP的重大改动,应经质量保证部门确认,并经研究机构或实验室负责人书面批准二)质量保证部门(QAU—Quality Assurance Unit)QAU指检验机构内负责保证其各项工作符合GLP规范要求的部门或组织.QAU是GLP建设的关键.有了良好的实验方案和各种具体操作的SOP,并不一定能保证有高质量的试验结果.在试验方案的制定和试验进行的各个环节中,由于人为的疏忽,或由于个人的习惯或惰性等因素,难免会发生一些错误,遗漏或执行不当之处.例如,所制定的试验方案不一定完全符合GLP的要求,某些实验操作不一定完全能够准确地执行相应的SOP,以及原始记录,统计计算的错误和检验报告的书写或打印错误等.如果没有一套行之有效的质量保证体系,则无法保证试验结果的真实可靠性.为了能够保证各种试验工作的质量和客观性,可靠性,并使其能够严格地达到GLP的有关要求,各国的GLP中都明确规定,检验机构必须建立独立的QAU,对试验的全过程进行审察和检查,以确保试验设施,设备,人员,各种实验操作和业务管理等符合GLP的规定.因此,建立QAU和培养QA人员,是贯彻执行GLP和确保试验质量的关键环节.QAU的主要职责如下1. 对各种试验和检验过程的核查:包括对实验操作现场(实验条件,实验方案和主要操作环节)的核查,以及对原始记录,数据,报告书和档案的审核等.对每项研究或检验实施检查和监督时,应根据其内容和持续时间制定检查和审核计划,并详细记录检查的内容,存在的问题,采取的措施等.同时应在记录上签名并妥善保存以备查.2.一般性检查及报告:包括对实验室和动物饲养设施,设备,仪器和试剂管理状态的检查;对原始数据,资料档案管理情况的检查;对检验人员的检查及考核;对有关组织和系统的运行情况及其记录的检查等.此类检查应包括定期检查及不定期抽查.检查后应及时向机构负责人和项目负责人报告检查发现的问题,提出解决问题的建议,并写出检查报告.3.保存本机构的各类工作计划表,实验方案和总结报告的副本;4.参与SOP的制定,并保存SOP的副本.5.参与机构认证,评估和上级有关部门检查的准备工作.QAU应有专门的负责人,其职责是:①指定每一试验项目的质量保证责任人(必须是不参加该试验项目的人员,即能够以"第三者"的身份和客观的立场进行审查);②制定QAU的工作计划并检查其实施情况;③确认项目负责人和质量保证责任人是否称职,以及试验是否严格按GLP和SOP进行; GLP的若干要点详述④确认本机构中进行的各类工作符合GLP的要求及最终报告的正确性;⑤SOP,总体工作计划,实验方案,试验设施相关资料复印件等重要资料的保存.(三)项目负责人(SD—Study Director,即研究指导者)SD指负责组织实施某项研究或检验工作的人员.但根据各国GLP 中对SD职责的规定,GLP实验室中的SD亦即我们通常所称的项目负责人或课题负责人.SD是由GLP机构或实验室的负责人聘任,任命或指定的.试验开始前,SD应通过各种途径了解受试物的化学结构特点,药理作用和其它有关资料,并根据有关试验的国家标准,规范和GLP的规定,制定试验方案(或接受委托单位提供的实验方案),送交QAU审察和实验室负责人审批.然后将整个试验的日程安排分送给与各试验有关的`业务部门,同时必须检查已有的SOP是否适用于该项试验,是否需要修改和补充.试验过程中,SD要检查各业务部门执行实验方案和SOP的情况,检查实验工作记录,存在和可能出现的问题及采取的处理措施并及时记录备查.试验结束后,SD要收集各业务部门的有关试验记录,进行统计处理,利用生理学,药理学,毒理学,病理学和生物化学等有关知识,进行去粗取精,去伪存真,实事求是的分析,并撰写出总结报告.然后将实验方案,各种原始记录,各种标本及总结报告等按GLP的规定送档案室保管.由此可见,SD是检验机构中具体组织管理的核心人物.SD必须具备较坚实的相关学科的理论基础和较广博的知识结构,还必须有较丰富的具体工作经验.因此,SD的培养和素质对GLP实验室来说是至关重要的.一些国家已明确规定,博士毕业后要参加安全性试验工作四年后才有资格担任SD.SD的主要职责是:1. 全面负责该项研究工作的运行管理;2. 制定实验方案(试验计划书),提出修订或补充相应SOP的建议,分析研究结果,撰写总结报告;3. 严格执行实验方案的规定,若有修改,应经本机构或实验室负责人批准;4. 确保参与该项研究的全体人员明确各自所承担的工作,并掌握相应的SOP;5. 掌握研究工作进展;检查各种实验记录,确保其及时,直接(原始),准确和清楚;6. 详细记录实验中出现的意外情况和采取的补救措施,以及影响试验质量的不可预测因素及其处理措施;7. 实验结束后, 将实验方案,原始资料,标本,各种有关记录文件和总结报告等, 送资料档案室保存;8. 确保研究工作各环节符合GLP的要求,并按照QAU的指导和建议进行相应的改进和完善.(四)动物饲养设施在GLP所要求的硬件设施中,以实验动物的饲养及其配套设施最为重要.这一方面是由于受试物各种生理,药理和毒性作用的评价主要是根据动物试验的资料,另一方面则因为实验动物有较大的个体差异并处于不断变化的状态,饲养环境条件稍有变化即可导致实验结果的偏差.动物饲养设施应包括:1. 不同种属动物和不同实验用动物的饲养和管理设施;2. 动物的检疫和患病动物的隔离治疗设施;3. 收集和处置试验废弃物和动物尸体的设施;4. 清洗和消毒设施;5. 受试物和对照品含有挥发性,放射性和生物危害性等物质时,应有相应的饲养和管理设施;6. 饲料,垫料,笼具及其它动物用品的存放设施.以上各类设施的配置应合理,防止与实验系统相互污染.易腐败变质的物品应有适当的保管措施.动物饲养环境使用的清洁剂,消毒剂及杀虫剂等,不应影响实验结果, 并应详细记录其名称,浓度,使用方法及使用的时间等.动物的饲料和饮水应定期检验, 确保其符合营养标准以及影响实验结果的污染因素低于规定的限度, 检验结果应作为原始资料保存.(五)实验方案与实施,原始记录和总结报告项目负责人应制定书面的实验方案,签名盖章后交QAU审查, 报机构负责人批准后方可执行.接受他人委托的研究, 实验方案应经委托单位审查认可.实验方案应包括:1. 研究专题的名称或代号及研究目的;2. 检验机构和委托单位的名称及地址;3. 项目负责人和参加实验的工作人员姓名;4. 受试物和对照品的名称,缩写名,代号,批号,有关理化性质及生物特性;5. 实验系统及选择理由;6. 实验动物的种,系,数量,年龄,性别,体重范围,来源和等级;7. 实验动物的识别方法;8. 实验动物饲养管理的环境条件;9. 饲料名称或代号;10. 实验用的溶媒,乳化剂及其它介质;11. 受试物和对照品的给药途径,方法,剂量,频率和用药期限及选择的理由;12. 所用方法的国家标准,规范或指南等文件的名称;13. 各种指标的检测频率和方法;14. 数据统计处理方法;15. 实验资料的保存地点.研究过程中需要修改实验方案时, 应经QAU审查,机构负责人批准.变更的内容,理由及日期,应记入档案, 并与原实验方案一起保存.专题负责人全面负责研究专题的运行管理.参加实验的工作人员,应严格按照相应的SOP执行实验方案,发现异常现象时应及时向专题负责人报告.研究工作结束后, 专题负责人应及时写出总结报告,签名盖章后交质量保证部门负责人审查和签署意见, 机构负责人批准.总结报告应包括1. 研究专题的名称或代号及研究目的;2. 检验机构和委托单位的名称和地址;3. 研究起止日期;4. 受试物和对照品的名称,缩写名,代号, 批号,稳定性,含量,浓度,纯度,组分及其它特性;5. 实验动物的种,系,数量,年龄,性别,体重范围,来源,动物合格证号及发证单位,接收日期和饲养条件;篇二:GLP规范对比篇三:GLP相关知识整理20150925GLP相关知识整理GLP的定义GLP是英文Good Laboratory Practice 的缩写,中文直译为优良实验室规范。
通过GLP认证实验室清单

通过GLP认证实验室清单1 中国药品生物制品检定所(国家药物安全评价监测中心)2 上海医药工业研究院(国家上海新药安全评价研究中心)3 江苏省药物研究所(江苏省药物安全性评价中心)4 沈阳化工研究院安全评价中心(国家沈阳新药安全评价研究中心)5 四川省天然药物研究所(安全性评价中心)6 中国科学院上海药物研究所(药物安全评价研究中心)7 广州市医药工业研究所(新药安全评价研究重点实验室)8 浙江省医学科学院(新药安全评价研究重点实验室)9 国家成都中药安全性评价中心10 北京协和建昊医药技术开发有限责任公司11 湖北省医药工业研究院有限公司(湖北省药物安全性评价中心)12 军事医学科学院毒物药物研究所(国家北京药物安全评价中心)13 山东大学(山东大学新药评价中心药物安全性评价实验室)14 北京昭衍新药研究中心15 云南省药物研究所(药物安全性评价中心)16 山东省医药工业研究所(药物安全性评价中心)17 中国辐射防护研究院(药物安全性评价中心)18 新疆维吾尔自治区维吾尔医研究所(药物安全性评价中心)19 四川抗菌素工业研究所有限公司(国药控股安全性评价研究中心)20上海中医药大学(药物安全评价研究中心)21 第二军医大学(药物安全性评价中心)22 湖北省预防医学科学院(食品药品安全性评价研究所)23 中国医学科学院实验动物研究所2(非啮齿类)24 天津药物研究院(天津市新药安全评价研究中心)25 广州中医药大学科技产业园有限公司(新南方药物安全性评价中心)26 辽宁省食品药品检验所(药物安全评价中心)27 北京市药品检验所(药物安全评价中心)28 青岛市药品检验所(新药安全评价中心)29 山东大学(新药评价中心药物安全性评价实验室)30上海市计划生育科学研究所(中国生育调节药物毒理检测中心)31 山东绿叶制药有限公司(山东绿叶药物安全评价中心)32 苏州西山中科实验动物有限公司(苏州药物安全性评价研究中心)33 重庆市中药研究院(重庆市药物安全评价中心)34 郑州大学(郑州大学药物安全性评价研究中心)35 上海市食品药品检验所(药物安全评价中心)36 海南海医药物安全性评价研究有限责任公司(海南医学院海南省药物安全性评价研究中心)37 海南省药品检验所(安全性评价研究中心)38 河北医科大学(新药安全评价研究中心)。
GLP的基本介绍

GLP的基本介绍一,GLP的基本概念GLP(Good Laboratory Practice,即良好实验室操作规范),广义上是指严格实验室管理(包括实验室建设,设备和人员条件,各种管理制度和操作规程,以及实验室及其出证资格的认可等)的一整套规章制度.包括对实验设计,操作,记录,报告,监督等整个环节和实验室的规范要求. GLP的概念GLP最早起源于药品研究.与GCP(药品临床试验规范)和GMP(药品良好生产过程)相对应,药品GLP是指药品非临床(或临床前)研究的质量管理规范.药品的非临床(临床前)研究主要指在实验室进行的安全性毒理学评价和药理,药效学评价(包括药代动力学和毒代动力学研究),故此GLP即指从事药品非临床研究的实验室管理规范.其后,GLP的概念逐渐扩展到其他有毒有害物质(如农药,环境和食品污染物,工业毒物,射线等)的实验室安全性评价,以及各类健康相关产品(食品和保健食品,化妆品,涉水产品,消毒产品等)的实验室评价(包括安全性和功效学评价),甚至还包括了对临床实验室大部分检验工作的管理.因此,可以说目前GLP的范围已经覆盖了与人类健康有关的所有实验室研究工作,并有进一步向与整个环境和生物圈有关的实验室研究工作扩展的趋势.二,国内外GLP的发展历史和现状发达国家在二十世纪六,七十年代即开始正式发展和实施GLP.如美国FDA在1979年即制定并发布了第一部药品GLP.日本于1982年由厚生省药物局发布第一部药品GLP,经修订后于1997年3月26日以厚生省令正式颁布.目前已实施GLP制度的有美,日,英,德,荷兰,瑞典和瑞士等国家.我国于二十世纪八十年代末和九十年代初相继开展了药品和其他相关产品,毒物的GLP研究和实施工作.1993年12月以国家科委主任令形式发布《药品非临床研究管理规定(试行)》,经几年试用和修订后于1999年10月由国家药品监督管理局第14号令发布《药品非临床研究质量管理规范》(试行).近期将颁布GLP实施指南,并已开展对全国GLP实验室的认证工作.卫生部十分重视健康相关产品检验和化学物毒性评价的GLP管理工作.1999年3月发布了《卫生部健康相关产品检验机构工作制度》和《卫生部健康相关产品检验机构认定与管理办法》;2000年1 月发布《卫生部健康相关产品检验机构认定与管理规范》.2000年11月卫生部发布《化学品毒性鉴定管理规范》(包括化学品毒性鉴定实验室条件及工作准则,即GLP);2001年6月发布《化学品毒性鉴定机构资质认证工作程序》和《化学品毒性鉴定机构资质认证标准》.三,GLP的基本内容对于承担不同产品或化学物检验的实验室的GLP,其内容和要求亦不完全相同,但GLP的基本原则,要求与内容是相似的.实施GLP的主要目的是提高实验室研究与检验工作的质量,确保实验数据和结果的真实性和可靠性.一般而言,GLP通常包括以下几个主要部分1. 对组织机构和人员的要求2. 对实验设施,仪器设备和实验材料的要求3. 标准操作规程(SOP)4. 对研究工作实施过程的要求5. 对档案及其管理工作的要求6. 实验室资格认证及监督检查四,GLP的若干要点详述(一)标准操作规程(SOP—Standard Operating Procedures)编写和使用SOP的主要目的是保证操作的重现性和保证结果数据的可信性.接受过教育和培训的人员按SOP进行试验时,其试验操作及操作结果的重现性较好.亦即在同一研究机构或实验室内,由不同的人按SOP进行操作和试验,可保证能够达到较一致的结果.编写和建立一套合乎GLP要求且合乎本研究机构实际情况的标准操作规程(SOP)是GLP软件建设的主要内容.在SOP的建设方面,人的作用是主要的,而经费是次要的.因此,在进行GLP 实验室建设时,先从制定SOP开始是通常的做法.SOP需在实践中不断加以完善和修订.必须注意的是,SOP应有良好的可操作性,而不能将其视为一种形式.一套合格的,可操作性强的SOP,必须经过实践—修订—再实践—再修订的长期反复过程才能逐渐形成.另外还应强调,SOP的编写,修订和管理过程本身也应有相应的SOP来加以规范.一般而言,下列工作都需要制定相应的SOP1. SOP的编写,修订和管理.2. 动物房及实验室的准备及环境因素的调控;实验设施及仪器设备的维护,保养,校正,使用和管理;计算机系统的操作和管理.3. 受试物和对照物的接收,标识,保存,处理,配制,领用及取样分析.4. 实验动物的运输,检疫,编号,分配,搬运及饲养管理;实验动物的观察记录及实验操作;动物的尸检以及组织病理学检查;濒死或已死亡动物的检查处理.5. 各种实验和分析样品,标本的采集,编号;指标的检查,测定和检验等操作技术.6. 各种实验数据的统计处理与计算.7. 质量保证工作制度与措施.8. 实验操作人员的防护和保护措施;废弃物处理和防止污染环境的措施;实验室工作人员的健康检查制度等.除上述各类工作外,研究机构或实验室认为有必要制定SOP的其它工作也应制定相应的SOP. SOP必须经质量保证部门签字确认并经机构负责人批准方为有效.失效的SOP应留一份存档, 其余应及时销毁.SOP的制定,修改,生效日期及分发,销毁情况应记入档案并妥善保存.SOP的存放应以方便使用为原则.研究或检验过程中任何偏离或违反SOP的操作,不论问题大小,都应及时向项目负责人报告或经项目负责人批准,并在原始资料中加以清楚的记录.SOP 原则上不能复印.SOP的重大改动,应经质量保证部门确认,并经研究机构或实验室负责人书面批准二)质量保证部门(QAU—Quality Assurance Unit)QAU指检验机构内负责保证其各项工作符合GLP规范要求的部门或组织.QAU是GLP建设的关键.有了良好的实验方案和各种具体操作的SOP,并不一定能保证有高质量的试验结果.在试验方案的制定和试验进行的各个环节中,由于人为的疏忽,或由于个人的习惯或惰性等因素,难免会发生一些错误,遗漏或执行不当之处.例如,所制定的试验方案不一定完全符合GLP的要求,某些实验操作不一定完全能够准确地执行相应的SOP,以及原始记录,统计计算的错误和检验报告的书写或打印错误等.如果没有一套行之有效的质量保证体系,则无法保证试验结果的真实可靠性.为了能够保证各种试验工作的质量和客观性,可靠性,并使其能够严格地达到GLP的有关要求,各国的GLP中都明确规定,检验机构必须建立独立的QAU,对试验的全过程进行审察和检查,以确保试验设施,设备,人员,各种实验操作和业务管理等符合GLP的规定.因此,建立QAU和培养QA人员,是贯彻执行GLP和确保试验质量的关键环节.QAU的主要职责如下1. 对各种试验和检验过程的核查:包括对实验操作现场(实验条件,实验方案和主要操作环节)的核查,以及对原始记录,数据,报告书和档案的审核等.对每项研究或检验实施检查和监督时,应根据其内容和持续时间制定检查和审核计划,并详细记录检查的内容,存在的问题,采取的措施等.同时应在记录上签名并妥善保存以备查.2.一般性检查及报告:包括对实验室和动物饲养设施,设备,仪器和试剂管理状态的检查;对原始数据,资料档案管理情况的检查;对检验人员的检查及考核;对有关组织和系统的运行情况及其记录的检查等.此类检查应包括定期检查及不定期抽查.检查后应及时向机构负责人和项目负责人报告检查发现的问题,提出解决问题的建议,并写出检查报告.3.保存本机构的各类工作计划表,实验方案和总结报告的副本;4.参与SOP的制定,并保存SOP的副本.5.参与机构认证,评估和上级有关部门检查的准备工作.QAU应有专门的负责人,其职责是:①指定每一试验项目的质量保证责任人(必须是不参加该试验项目的人员,即能够以"第三者"的身份和客观的立场进行审查);②制定QAU的工作计划并检查其实施情况;③确认项目负责人和质量保证责任人是否称职,以及试验是否严格按GLP和SOP进行; GLP的若干要点详述④确认本机构中进行的各类工作符合GLP的要求及最终报告的正确性;⑤SOP,总体工作计划,实验方案,试验设施相关资料复印件等重要资料的保存.(三)项目负责人(SD—Study Director,即研究指导者)SD指负责组织实施某项研究或检验工作的人员.但根据各国GLP中对SD职责的规定,GLP 实验室中的SD亦即我们通常所称的项目负责人或课题负责人.SD是由GLP机构或实验室的负责人聘任,任命或指定的.试验开始前,SD应通过各种途径了解受试物的化学结构特点,药理作用和其它有关资料,并根据有关试验的国家标准,规范和GLP的规定,制定试验方案(或接受委托单位提供的实验方案),送交QAU审察和实验室负责人审批.然后将整个试验的日程安排分送给与各试验有关的业务部门,同时必须检查已有的SOP是否适用于该项试验,是否需要修改和补充.试验过程中,SD要检查各业务部门执行实验方案和SOP的情况,检查实验工作记录,存在和可能出现的问题及采取的处理措施并及时记录备查.试验结束后,SD要收集各业务部门的有关试验记录,进行统计处理,利用生理学,药理学,毒理学,病理学和生物化学等有关知识,进行去粗取精,去伪存真,实事求是的分析,并撰写出总结报告.然后将实验方案,各种原始记录,各种标本及总结报告等按GLP的规定送档案室保管.由此可见,SD是检验机构中具体组织管理的核心人物.SD必须具备较坚实的相关学科的理论基础和较广博的知识结构,还必须有较丰富的具体工作经验.因此,SD的培养和素质对GLP实验室来说是至关重要的.一些国家已明确规定,博士毕业后要参加安全性试验工作四年后才有资格担任SD.SD的主要职责是:1. 全面负责该项研究工作的运行管理;2. 制定实验方案(试验计划书),提出修订或补充相应SOP的建议,分析研究结果,撰写总结报告;3. 严格执行实验方案的规定,若有修改,应经本机构或实验室负责人批准;4. 确保参与该项研究的全体人员明确各自所承担的工作,并掌握相应的SOP;5. 掌握研究工作进展;检查各种实验记录,确保其及时,直接(原始),准确和清楚;6. 详细记录实验中出现的意外情况和采取的补救措施,以及影响试验质量的不可预测因素及其处理措施;7. 实验结束后, 将实验方案,原始资料,标本,各种有关记录文件和总结报告等, 送资料档案室保存;8. 确保研究工作各环节符合GLP的要求,并按照QAU的指导和建议进行相应的改进和完善.(四)动物饲养设施在GLP所要求的硬件设施中,以实验动物的饲养及其配套设施最为重要.这一方面是由于受试物各种生理,药理和毒性作用的评价主要是根据动物试验的资料,另一方面则因为实验动物有较大的个体差异并处于不断变化的状态,饲养环境条件稍有变化即可导致实验结果的偏差.动物饲养设施应包括:1. 不同种属动物和不同实验用动物的饲养和管理设施;2. 动物的检疫和患病动物的隔离治疗设施;3. 收集和处置试验废弃物和动物尸体的设施;4. 清洗和消毒设施;5. 受试物和对照品含有挥发性,放射性和生物危害性等物质时,应有相应的饲养和管理设施;6. 饲料,垫料,笼具及其它动物用品的存放设施.以上各类设施的配置应合理,防止与实验系统相互污染.易腐败变质的物品应有适当的保管措施.动物饲养环境使用的清洁剂,消毒剂及杀虫剂等,不应影响实验结果, 并应详细记录其名称,浓度,使用方法及使用的时间等.动物的饲料和饮水应定期检验, 确保其符合营养标准以及影响实验结果的污染因素低于规定的限度, 检验结果应作为原始资料保存.(五)实验方案与实施,原始记录和总结报告项目负责人应制定书面的实验方案,签名盖章后交QAU审查, 报机构负责人批准后方可执行.接受他人委托的研究, 实验方案应经委托单位审查认可.实验方案应包括:1. 研究专题的名称或代号及研究目的;2. 检验机构和委托单位的名称及地址;3. 项目负责人和参加实验的工作人员姓名;4. 受试物和对照品的名称,缩写名,代号,批号,有关理化性质及生物特性;5. 实验系统及选择理由;6. 实验动物的种,系,数量,年龄,性别,体重范围,来源和等级;7. 实验动物的识别方法;8. 实验动物饲养管理的环境条件;9. 饲料名称或代号;10. 实验用的溶媒,乳化剂及其它介质;11. 受试物和对照品的给药途径,方法,剂量,频率和用药期限及选择的理由;12. 所用方法的国家标准,规范或指南等文件的名称;13. 各种指标的检测频率和方法;14. 数据统计处理方法;15. 实验资料的保存地点.研究过程中需要修改实验方案时, 应经QAU审查,机构负责人批准.变更的内容,理由及日期,应记入档案, 并与原实验方案一起保存.专题负责人全面负责研究专题的运行管理.参加实验的工作人员,应严格按照相应的SOP执行实验方案,发现异常现象时应及时向专题负责人报告.研究工作结束后, 专题负责人应及时写出总结报告,签名盖章后交质量保证部门负责人审查和签署意见, 机构负责人批准.总结报告应包括1. 研究专题的名称或代号及研究目的;2. 检验机构和委托单位的名称和地址;3. 研究起止日期;4. 受试物和对照品的名称,缩写名,代号, 批号,稳定性,含量,浓度,纯度,组分及其它特性;5. 实验动物的种,系,数量,年龄,性别,体重范围,来源,动物合格证号及发证单位,接收日期和饲养条件;6. 受试物和对照品的给药途径,剂量,方法,频率和给药期限;7. 受试物和对照品的剂量设计依据;8. 影响研究可靠性和造成研究工作偏离实验方案的异常情况;9. 各种指标检测的频率和方法;10. 专题负责人和所有参加工作的人员姓名和承担的工作;11. 分析数据所用的统计方法;12. 实验结果和结论;13. 原始资料和标本的贮存处.总结报告经机构负责人签字后,需要修改或补充时, 有关人员应详细说明修改或补充的内容,理由和日期, 经专题负责人认可,并经质量保证部门负责人审查和机构负责人批准.(六)实验室资格认证与监督检查为确保GLP得到准确的贯彻执行,各国都规定了对GLP机构或实验室的资格认定,检查和监督措施.检查和评价的标准各国有所不同,但检查的内容一般都很广,通常包括:组织管理体系;各类工作人员的文化层次,专业工作经历及培训记录;SOP的制订和管理,是否与所进行的试验工作相适应,实验室内是否随手可得到相应的SOP;质量保证部门的工作;各类试验工作的运行和管理,档案室及其档案管理是否规范;仪器设备的维修,保管和使用记录,环境调控的实施记录是否完整;动物房及其配套设施是否合理,各种运行路线是否能明确地分开;实验方案及实验总结是否符合GLP的规定;原始记录的质量等等.检查的方式包括评阅GLP机构或实验室按检查要求提供的材料,询问实验室有关人员,查阅有关资料,试验现场检查等.程序举例为:1. 实验室向有关主管部门提出申请.2. 主管部门向申请GLP检查的实验室发放检查资料编写纲要.3. 实验室按要求提交检查资料.4. 检查组从该实验室完成的试验一览表中随机选择10个左右的试验,要求提供有关的原始资料.5. 检查组对该实验室的原始资料进行审核.6. 检查组对实验室进行GLP检查(通常5天).7. 检查组完成GLP检查报告并作出评价.8. 主管部门认可检查组的评价报告,颁发GLP 合格证书._全球经济合作暨开发组织(Organization for Economic Cooperation and Development,简称OECD)就公布了一部GLP汇编,OECD的十六个成员国就将GLP收录到各自的法规当中。
公路工地试验室试验报告结论参考范本 (1)

公路工地试验室试验报告结论参考范本(仅供参考)序号名称报告结论1 土的击实报告经检测,该土样品的最大干密度为——,最佳含水率为——。
2 土的液塑限报告经检测,该土样品液限为——,塑限为——,塑性指数为——。
3 CBR报告经检测,该土样品在压实度为93%时,CBR值为——,压实度为94%时,CBR值为——,压实度为96%时,CBR值为——。
4 颗粒分析报告经检测,该土样品定名为——,代号为——。
5 土的比重报告经检测,该土样比重为——。
6 水泥报告经检测,该水泥样品28d(3d)胶砂强度及其它所检指标符合GB175-2007《通用硅酸盐水泥》中的技术要求。
7 沥青混合料用粗集料报告经检测,该粗集料样品以上所检指标均符合JTG/F40-2004《公路沥青路面施工技术规范》中的技术要求。
8 沥青混合料用细集料报告经检测,该机制砂(矿粉、天然砂)样品以上所检指标均符合JTG/F40-2004《公路沥青路面施工技术规范》中的技术要求。
9 结构水泥混凝土用粗集料报告经检测,该粗集料样品(或该粗集料经掺配后)(详细写明所检指标均)符合JTG/T F50-2011《公路桥涵施工技术规范》中的技术要求。
10 结构水泥混凝土用细集料报告经检测,该天然砂样品以上所检指标均符合JTG/T F50-2011《公路桥涵施工技术规范》中的技术要求。
11 道面水泥混凝土用粗集料报告经检测,该粗集料样品(该粗集料经三级掺配后)以上所检指标均符合JTG/F30-2003《公路水泥混凝土路面施工技术规范》中的技术要求。
12 道面水泥混凝土用细集料报告经检测,该天然砂样品以上所检指标均符合JTG/F30-2003《公路水泥混凝土路面施工技术规范》中的技术要求。
13 岩石报告经检测,该岩石样品饱和状态单轴抗压强度为——,满足JTG/T F50-2011《公路桥涵施工技术规范》(或设计)要求。
——若为母岩,写规范,若用于砌体,写设计。
14 钢筋报告经检测,该组热轧带肋钢筋样品以上所检指标均符合GB1499.2-2007《钢筋混凝土用钢第2部分:热轧带肋钢筋》、(或GB1499.1-2008《钢筋混凝土用钢第1部分:热轧光圆钢筋》)中的技术要求。
glp认证解读 -回复

glp认证解读-回复什么是GLP认证?GLP(Good Laboratory Practice)是一种国际性的质量管理体系,用于实验室进行非临床安全性研究(Non-clinical Safety Studies)。
GLP认证则是指实验室通过了经过认可的认证机构的审核与评估,证明其对GLP的实施符合国际标准和要求。
那GLP认证有哪些必要性?GLP认证的必要性主要体现在以下几个方面:1.质量保证:GLP认证确保实验室进行的实验研究过程符合国际标准和要求,提供高质量的数据和结果,保证研究的准确性和可靠性。
这有助于减少数据的不确定性,并为科学决策提供有效的依据。
2.合规性:GLP认证使得实验室可以符合国际和国内的法规和要求,尤其是FDA(美国食品药品监督管理局)和其他监管机构对于药物、食品、化妆品等产品的安全性评估所规定的要求。
实验室的合规性是获得政府批准和注册的前提条件。
3.市场竞争力:GLP认证是国际范围内公认的权威性认证,使得实验室在国际市场上具备竞争优势。
许多大型医药公司和产品开发者要求其合作伙伴或供应商必须具备GLP认证,以确保实验室能够提供满足要求的研究服务和报告。
那GLP认证的具体过程是怎样的?GLP认证的具体过程主要包括以下几个步骤:1.申请:实验室先向认可的GLP认证机构提交申请,包括申请表和相关材料,例如实验室设施、设备和人员组织结构等信息。
申请材料要求详细、准确,以满足GLP认证机构的审查要求。
2.初步评估:GLP认证机构收到申请后,将对申请材料进行初步评估,确保申请符合GLP认证的基本要求和标准。
如果申请通过初步评估,认证机构会与实验室进行初步沟通和交流,确认进一步的认证流程。
3.现场审核:认证机构将安排专业的审核员前往实验室进行现场审核。
审核员将对实验室设施、设备、记录和标准操作程序等进行审查和评估,以确认实验室对GLP的实施情况是否符合要求。
审核过程中通常包括文件审查、访谈和实地观察等环节。
glp认证调研报告

glp认证调研报告GLP(Good Laboratory Practice)是一种国际上通用的、质量管理规范,主要用于指导和规范实验室的研究工作。
GLP认证是对实验室质量管理体系的认可和验证,通过对实验室的设备、实验流程、记录和报告的审核,可以确定实验室是否具有合格的技术能力和良好的质量保证体系。
本文将对GLP认证进行调研,并总结调研结果。
首先,GLP认证的重要性不可忽视。
GLP认证可以确保实验室工作的准确性、可靠性和可重复性。
它要求实验室建立完善的记录和报告制度,并对实验过程进行严格的监督和管理。
这可以有效减少实验误差和偏差,提高实验结果的可靠性和可重复性。
GLP认证还促使实验室按照国际标准进行工作,提高实验室在国际上的声誉和竞争力。
其次,GLP认证的具体要求多样且严格。
GLP认证要求实验室具备适用的设备和试剂,并对其进行严格的管理和维护。
实验室需要制定详细的实验操作规程,并对实验人员进行培训以确保操作的准确性和一致性。
同时,实验室需要建立完善的记录和报告制度,保留实验数据和原始记录,并对实验结果进行审查和验证。
这些要求的执行需要实验室具备高度的组织能力和执行能力。
再次,GLP认证的应用范围广泛。
GLP认证适用于各种类型的实验室,包括环境监测实验室、生物医药实验室、化学分析实验室等。
实验室的GLP认证不仅对实验室自身具有重要意义,还对相关行业和领域有着积极的影响。
例如,GLP认证可以提高环境监测数据的可靠性和可比性,保障环境监测结果的准确性和可信度。
GLP认证还可以帮助生物医药实验室规范实验流程,确保研究结果的准确性和可重复性,促进新药研发的进展。
最后,GLP认证在我国的应用和发展还存在一些问题。
一方面,我国实验室大多缺乏GLP的认识和意识,对GLP的要求和标准了解不足。
另一方面,我国对GLP认证的监管还不够严格,实验室存在一些违反GLP原则的现象。
因此,我国实验室需要加强GLP认证的宣传和培训,并加强对实验室的监管和执法力度,以提升我国实验室的质量管理水平。
公路试验检测数据报告编制导则

行业标准《公路试验检测数据报告编制导则》编写说明(征求意见稿)《公路试验检测数据报告编制导则》编写组2011年09月07日编写说明一.任务来源行业推荐标准《公路试验检测数据报告编制导则》是由交通运输部工程质量监督局提出、交通运输部科技司交科技发〔2011〕389号文《关于下达2011年交通运输标准化计划的通知》下达的标准项目,任务编号:JT2011-13,交通运输部公路科学研究院、国家交通安全设施质量监督检验中心、中国交通建设监理协会试验检测工作委员会承担了此标准的编写任务。
二.编制目的和必要性随着公路工程技术的快速发展与进步,各类新材料、新工艺、新方法等日新月异,创新性复杂工艺大量涌现,各种新情况、新问题对公路工程技术的科学化管理,都有了更高、更多的诠释和要求。
目前,交通行业现行的试验检测、检验评定等各门类试验检验规程中尚没有对相关记录和报告格式做出协调统一的规定。
仅以《公路水运工程试验检测机构等级标准》中对综合甲级的要求为例,就涉及了19项210 多个试验检测参数,构成的各类材料、半成品、成品、设施等试验检测记录报告目前使用较为广泛的就多达百余种,如算计同类但有细微差异的格式更是不胜枚举。
由此引伸出的问题就是,当需要用同一类数据表征同一类试验项目时,会发现数据描述在不同的地方经常是千差万别的,甚至对某些共同的质量特性根本无法进行比较分析,这就造成难以在宏观范围内横向衡量同类项目的真实情况,必然会影响准确把握公路技术的整体质量水平。
而各省市、各委托机构对试验检测管理的具体要求的不尽相同、记录和报告的格式设计不尽科学合理,也是导致全国各地的试验检测记录和报告格式差别很大的原因之一。
面对纷繁复杂的记录报告类型,如果对记录报告不进行统一规范和科学表述,势必会带来以下问题:格式类型过多的记录报告将大量消耗用于记录报告出版、引用和保存的媒介材料;标准化程度不高的记录报告将造成试验检测成果的应用、检索和共享的效率大为下降;同时,记录报告的不统一还会降低记录报告的通用性、规范性和科学性,将直接影响到记录报告对质量管理的指导作用。
glp认证解读 -回复

glp认证解读-回复GLP认证解读引言:GLP,即Good Laboratory Practice(良好实验室规范),是指在进行非临床安全性评价试验时遵循的一系列国际标准和要求。
作为一项实验室质量管理体系,GLP认证对于保证实验室数据的可靠性、可溯源性和互认性具有重要意义。
本文将一步一步回答关于GLP认证的问题,以帮助读者更好地了解和应用该认证。
一、什么是GLP认证?GLP认证是指实验室在进行非临床安全性评价试验时遵循的一种规范,确保试验数据的可靠性和准确性。
它是一种质量标准,要求实验室建立健全的质量管理体系,从试验设计、操作程序、数据记录到报告编制都需要严格遵守标准规范。
二、GLP认证的目的是什么?GLP认证的主要目的是保证实验室数据的可靠性和一致性,以便不同实验室之间的数据可以相互比较和交流。
它主要通过对试验的全过程进行管理和监督,确保试验能够按照一定的标准和规范进行,数据能够真实、准确地反映试验结果。
三、GLP认证的内容有哪些?GLP认证的内容主要包括以下几个方面:1. 质量管理体系:要求实验室建立一套完整的质量管理体系,包括质量方针、质量目标、质量手册等,以确保试验符合GLP标准要求。
2. 设施和设备的管理:要求实验室有适宜的试验设施和设备,并对其进行定期的检验、校准和维护,以保证试验结果的准确性。
3. 试验人员的培训和管理:要求实验室对试验人员进行培训,使其熟悉GLP要求和操作规范,并对其进行管理,确保试验操作的一致性和准确性。
4. 样品管理:要求实验室对样品进行正确的标识、保存和处理,保证试验样品的完整性和可靠性。
5. 数据记录与报告编制:要求实验室对试验过程中的数据进行准确记录,并按照规定格式编制试验报告,确保试验数据的可溯源性和可读性。
6. 质量审计和质量控制:要求实验室进行定期的质量审计,发现问题及时纠正和改进,并建立有效的质量控制措施,确保试验结果的可靠性。
四、为什么要进行GLP认证?GLP认证对于实验室来说具有重要意义。
GLP良好实验室规范原则系列标准系列标准—化学品检测和安全评价

国际GLP情况 日本GLP的情况 4)农药 GLP-《农药取缔法》:农林渔业部农用化 学品检查局负责 5)兽药 GLP-《药事法》:农林渔业部国立兽医分 析实验室负责 6)饲料添加剂 GLP:农林渔业部东京肥料 &饲料检 查局负责 日本GLP原则基本上以 OECD MAD-GLP体系为基础, 与许多国家已经签署了双边协议, GLP 在日本 之实施各有其负责单位,但最近有逐渐形成单 一GLP制度之趋势。
提 纲
GLP概述
国际GLP情况
我国GLP情况
GLP概述
定义:良好实验室规范(Good Laboratory
Practice,GLP)最早是美国FDA 颁布实施的针对
非临床安全性研究的法规。
GLP内容:包括试验的设计、实施、检测、记录、 报告撰写、归档保存等组织过程和全程实验条件 监管的一整套质量保证体系。 GLP的目的:在于规范非临床安全性评价研究的行
OECD关于GLP的情况 OECD的GLP原则规定“凡是登记和认可管 理的医药、农药、食品和饲料添加剂、化 妆品、兽药和类似产品,以及工业化学品, 在进行非临床人类健康和环境安全试验时, 都应当遵循GLP原则”,该GLP原则已被国 际上广泛接受。 目前通行的是OECD的GLP准则,其成员国 之间签署GLP协议,互通情况,共同检查, 相互承认,其实验结果可在双方国家登记, 减少不必要的重复实验。
国际GLP情况美国GLP的情况
国家环保局(EPA)
负责化学品和农药方面的 GLP 管理和认证工作; 依据《联邦杀虫药、杀霉菌药和杀鼠药法》 ( Federal Insecticide, Fungicide, and Rodenticide Act ,简称 FIFRA )及《联邦毒物 管 理 法 》 ( Toxic Substances Control Act , 简称 TSCA ),于一九八三年分别发布了两个几 乎与上述FDA同样的法规。 用于农产品、工业用化学品的卫生与安全测试 管理。一九八九年,EPA法规因应需要而作了修 正,GLP制度正式实施;
良好实验室规范(GLP)应用于我国农业转基因生物安全管理的探讨

中国农业科技导报,2021,23(4):20-26Journal of Agricultural Science and Technology良好实验室规范(GLP)应用于我国农业转基因生物安全管理的探讨李文龙1,徐俊锋彳,徐琳杰1,孙卓媾1,李鹭1,宋贵文"(1.农业农村部科技发展中心,北京100122;2.浙江省农业科学院农产品质量标准研究所,杭州310021)摘要:良好实验室规范(good laboratory practice,GLP)是世界上广泛应用于医药、兽药、食品等非临床安全性评价试验的实验室质量管理体系,同时也正被世界上美国、欧盟等发达国家应用于转基因生物(genetically modified organisms,GMOs)领域。
介绍了GLP的概念和基本要素,分析了其确保安全性评价数据真实性和可追溯性等主要特点,结合我国农业转基因生物产业需求,从提升转基因生物安全评价数据质量、保证转基因生物安全评价的科学性等多方面,分析了在我国农业GMOs领域中应用GLP的必要性和可行性。
同时提出加快法规制定、推进GLP实验室建设、开展培训研究等5项建议,以期为转基因生物安全管理、研发和产业发展提供借鉴。
关键词:良好实验室规范;GLP;转基因生物;安全管理doi:10.13304/j.nykjdb.2020.0437中图分类号:S513.01文献标识码:A文章编号:1008-0864(2021)04-0020-07Discussion on Good Laboratory Practice(GLP)in theSafety Management of Agricultural GMOs in ChinaLI Wenlong1,XU Junfeng2,XU Linjie1,SUN Zhuojing1,LI Lu1,SONG Guiwen1* (1,Development Center for Science and Technology,Ministry of Agriculture and Rural Affairs,Beijing100122,China;2.Institute of Quality and Standard of Agro-Products,Zhejiang Academy of Agricultural Sciences,Hangzhou310021,China)Abstract:Good laboratory practice(GLP)as a test quality management system,has been widely used in non-clinical trial safety evaluation of medicine,veterinary drug and foods all over the world.At the same time,GLP has also been used in the field of management of genetically modified organisms(GMOs)by many developed countries.In this paper,the concept and basic elements of GLP were introduced,and its main characteristics such as ensuring the authenticity and traceability of safety evaluation data were analyzed.In addition,combining with the characteristics of GLP and the development requirements of agricultural GMOs,this paper analyzed the necessity and feasibility of GLP in the safety management of agricultural GMOs from the aspects of improving the data quality of safety evaluation of GMOs and ensuring the scientific nature of safety evaluation of GMOs.Based on above,five suggestions were put forward,including fonnulating GMOs GLP regulations,building the GLP laboratories,organizing training and research,accelerating GLP application,and promoting international cooperation,so as to provide reference for the safety management,research and development,and industry development of GMOs.Key words:good laboratory practice;GLP;genetically modified organisms(GMOs);safety management良好实验室规范(good laboratory practice, GLP)是规范实验室行为的质量管理体系,主要目的是确保试验结果的真实、完整和可靠,进而为行政审批提供高质量的数据,更好地保护人类健康和环境安全⑴。
glp认证解读 -回复

glp认证解读-回复初步理解,"glp认证"指的是"Good Laboratory Practice"(良好实验室规范)认证。
良好实验室规范是一种国际公认的实验室质量管理体系,主要确保实验室在科学研究和测试中遵循一系列指导原则和标准。
本文将分步解析glp认证的内涵、流程和作用。
第一步:基本概念与原则1.1 定义:glp认证是一种确保实验室遵循良好实验室规范的认证机制。
1.2 原则:1.2.1 可追溯性:实验室的每个过程和操作都应有明确的文档记录,以确保结果的可追溯性。
1.2.2 质量控制:实验室应建立和维护适当的质量控制措施,以确保测试结果的准确性和可靠性。
1.2.3 培训和教育:实验室应提供必要的培训和教育,确保实验人员具备必要的技能和知识。
1.2.4 仪器和设备:实验室应使用经过校准和维护的仪器设备,以保证实验结果的准确性。
1.2.5 文件管理:实验室应建立恰当的文件管理系统,确保记录和报告的准确性和完整性。
第二步:认证流程2.1 审核申请:实验室首先向认证机构提交申请,包括组织机构信息、实验室设施和仪器设备清单、质量管理计划等。
2.2 认证准备:实验室进行内部评估,以确定是否符合glp认证标准。
若不符合,需要进行改进和调整。
2.3 外部审核:认证机构派遣专业审核团队对实验室进行现场审核,包括检查设备、记录和操作程序等。
2.4 报告和建议:审核团队提交审核报告,并给出改善建议和意见。
2.5 认证决定:认证机构基于审核报告和实验室的改善措施,决定是否颁发glp认证证书。
第三步:作用与价值3.1 维护科学研究的可靠性:glp认证确保实验室在科学研究中遵循标准和程序,提高研究结果的可靠性和准确性。
3.2 促进国际合作与交流:glp认证是国际公认的质量管理体系,使得实验室能够在国际合作和交流中获得更多机会与认可。
3.3 提升实验室竞争力:glp认证是实验室质量管理的重要证明,能够提升实验室的竞争力,获得更多合作伙伴与资金支持。
