分析化学08_ckwx
分析化学实验基础知识ppt

——1.2 常用试剂的规格及试剂的使用和保存
(4)专用试剂 专用试剂顾名思义是指专门用途的试剂。例如在色谱
分析法中用的色谱纯试剂、色谱分析专用载体、填料、固 定液和薄层分析试剂,光学分析法中使用的光谱纯试剂和 其它分析法中的专用试剂。专用试剂除了符合 高纯试剂的要求外,更重要的是在特定的用途 中、其干扰的杂质成分不产生明显干扰的限度 之下。
1.1分析化学实验用水
分析化学实验应使用纯水,一般是蒸馏水或去离子 水。有的实验要求用二次蒸馏水或更高规格的纯水(如: 电分析化学、液相色谱等的实验)。纯水并非绝对不含杂 质,只是杂质含量极微而已。分析化学实验用水的级别及 主要技术指标,见表1.1。
——1.1分析化学实验用水
表1.1 —— 分析化学实验室用水的级别及主要技术指标(载自GB6682-92)
——1.2 常用试剂的规格及试剂的使用和保存
表1.2.1(2)—— 一般化学试剂的规格及选用:
级别
中文名称
英文符号
适用范围
标签颜色
一级
优级纯
GR
精密分析实验
绿色
(保证试剂)
二级
分析纯
AR
一般分析实验
红色
(分析试剂)
三级
化学纯
CP
一般化学实验
蓝色
四级 生化试剂
实验试剂
生化试剂 生物染色剂
LR
一般化学实验 棕色或其它颜
以下几点: (1)所有电器必须由专业人员安装; (2)不得任意另拉、另接电线用电; (3)在使用电器时,先详细阅读有关的说明
书及资料,并按照要求去做;
——1.3实验室安全常识
(4)所有电器的用电量应与实验室的供电及用电端口匹配, 决不可超负荷运行,以免发生事故。谨记:任何情况下发 现用电问题(事故)时,首先先关电源! (5)发生触电事故的应急处理:如若遇触电事故,应立即 使触电者脱离电源——拉下电源或用绝缘物 将电源线拔开(注意千万不可徒手去拉触电 者,以免抢救者也被电流击倒)。同时,应 立即将触电者抬至空气新鲜处,
湘潭大学08级分析化学

湘潭大学《分析化学》08 级期末考试试题(A卷)学院专业班级学号姓名一、选择题(每题2分,共30分)1、可用于减少测定过程中的偶然误差的方法是.........................( )。
A、进行对照试验;B、进行空白试验;C、进行一期校准;D增加平行试验次数;2、在定量分析中,精密度与准确度之间的关系是.................()。
A、精密度高,准确度必然高;B、准确度高,精密度不一定高;C、精密度是保证准确度高的前提;D、准确度是保证精确度高的前提;3、已知0.1mol/L HB溶液的pH =3.0,则0.1mol/L NaB溶液的pH 是..............................................................................................( )。
A、8.5B、9.0C、9.5D、11.04、NaHCo3水溶液的质子条件..............................................( )。
A、[H +]+[HCO3--]=[H2CO3]+[OH--] +[CO32--]B、[H +]+[H2CO3]=[OH--] +[CO32--]C、[H +]+2[H2CO3]=[OH--] +[CO32--]D、[H +]=[OH--] +[CO32--]5、欲配制pH为4左右的缓冲溶液,最好选用下列哪种酸及其共轭碱(括号内为pK a值)...............................................................( )。
A、乙酸(4.74)B、甲酸(3.74)C、一氯乙酸(2.86)D、二氯乙酸(1.30)6、在下列基准物质中,能用来标定NaOH的基准物质是....().A、硼砂B、草酸钠C、邻苯二甲酸氢钾D、碳酸钠7、Fe3+、Mg2+、Ca2+混合溶液中用EDTA测定Fe3+、消除Mg2+、Ca2+干扰的最简单的方法是.............................................( )。
分析化学知识点总结

教学资料范本分析化学知识点总结编辑:__________________时间:__________________第一章 绪论第一节 分析化学及其任务和作用定义:研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的科学,是化学学科的一个重要分支,是一门实验性、应用性很强的学科第二节 分析方法的分类一、按任务分类定性分析:鉴定物质化学组成(化合物、元素、离子、基团)定量分析:测定各组分相对含量或纯度结构分析:确定物质化学结构(价态、晶态、平面与立体结构)二、按对象分类:无机分析,有机分析三、按测定原理分类(一)化学分析定义:以化学反应为为基础的分析方法,称为化学分析 法.分类: 定性分析重量分析:用称量方法求得生成物W重量定量分析滴定分析:从与组分反应的试剂R的浓度和体积求得组分C的含量反应式:mC+nR→CmRnX V W特点:仪器简单,结果准确,灵敏度较低,分析速度较慢,适于常量组分分析(二)仪器分析:以物质的物理或物理化学性质为基础建立起来的分析方法。
仪器分析分类:电化学分析 (电导分析、电位分析、库伦分析等)、光学分析(紫外分光光度法、红外分光光度法、原子吸收分光光度核磁共振波谱分析等)、色谱分析(液相色谱、气相色谱等)、质谱分析、放射化学分析、流动注射分析、热分析特点:灵敏,快速,准确,易于自动化,仪器复杂昂贵,适于微量、痕量组分分析四、按被测组分含量分类-常量组分分析:>1%;微量组分分析:0.01%~1%;痕量组分分析;< 0.01%五、按分析的取样量分类试样重 试液体积常量分析 >0.1g >10ml半微量 0.1~0.01g 10~1ml微量 10~0.1mg 1~0.01ml超微量分析 <0.1mg ﹤0.01ml六、按分析的性质分类:例行分析(常规分析)、仲裁分析第三节 试样分析的基本程序1、取样(采样):要使样品具有代表性,足够的量以保证分析的进行2、试样的制备:用有效的手段将样品处理成便于分析的待测样品,必要时要进行样品的分离与富集。
2008分析化学讲稿3

2008---2009学年 第二学期 第2 周 第1 页 第一部分:复习引入:举例说明什么叫有效数字?第二部分:讲授新课§2.2 有效数字及其运算规则一、有效数字(significant figure )的概念指在分析工作中实际能测到的数字,它包括所有的准确数字和最后一位可疑数字。
在有效数字中, 只有最后一位数是不确定的,可疑的。
有效数字位数由仪器准确度决定,它直接影响测定的相对误差。
零的作用:在1.0008中,“0” 是有效数字;在0.0382中,“0”定位作用,不是有效数字;在0.0040中,前面3个“0”不是有效数字,后面一个“0”是有效数字。
在3600中,一般看成是4位有效数字,但它可能是2位或3位有效数字,分别写3.6×103,3.60×103或3.600×103较好。
pH ,pM ,lgc ,lgK 等对数值,有效数字的位数取决于小数部分(尾数)位 数,因整数部分代表该数的方次。
如pH=11.20,有效数字的位数为两位。
有效数字的位数,直接与测定的相对误差有关。
例:测定某物质的含量为0.5180g ,即0.5180±0.0001g 相对误差 %02.0%10051801±=⨯±=Er二、数字的修约规则 “四舍六入五成双,五后有数就进一,五后没数要留双”规则:2008---2009学年第二学期第2 周第2页1、当测量值中修约的那个数字等于或小于4时,该数字舍去;等于或大于6时,进位;等于5时(5后面无数据或是0时),如进位后末位数为偶数则进位,舍去后末位数位偶数则舍去。
5后面有数时,进一位。
2、修约数字时,只允许对原测量值一次修约到所需要的位数,不能分次修约。
有效数字的修约举例:0.32554 → 0.3255(修约为4位有效数字)0.36236 → 0.3624(修约为4位有效数字)10.2150 → 10.22 (修约为4位有效数字)150.65 → 150.6 (修约为4位有效数字)75.5 → 76 (修约为2位有效数字)16.0851 → 16.09 (修约为4位有效数字)三、有效数字的运算法则1.加减法:当几个数据相加减时,它们和或差的有效数字位数,应以小数点后位数最少的数据为依据,因小数点后位数最少的数据的绝对误差最大。
高等教育:分析化学第一章

这门课程的目的和要求目的:学习分析化学的基本理论知识,建立起严格的量的概念,掌握分析化学实验的基本操作技能要求:预习、笔记、习题、实验报告考核形式:实验(30%),作业(10%), 期末考试(60%) oJ 第一章绪论尸分析化学的任务和作用任务:确定物质的化学组成(定性分析)、化学结构(结构分析)、各组分的相对含量(定量分析)。
作用:工农业生产、尖端科学和国防科技2.分析方法的分类•:.按任务分•按测定原理分•按研究对象分•按试样用量和操作规模分按具体要求分>按任务分定性分析:鉴定组成定量分析:测定含量结构分析:研究结构>按测定原理分化学分析:重量分析,滴定分析仪器分析:光学分析,电分析,色谱分析NMR, MS,电子显微镜,x-射线分析>按试样用量和操作规模分常量分析:s > 0.1g 5 V > 10mL 半微量分析:s 0.01~0.1g, V 1~10mL 微量分析:S 0.1~10mg , V 0.01 ~1mL 超微量分析:S < 0.1 mg 5 V < 0.01 mL>按具体要求分例行分析:是指一般化验室日常生产中的分析仲裁分析:是指不同单位对分析结果有争议时请权威单位进行裁判的分析>按对象分无机分析:鉴定组成和测定含量有机分析:官能团的分析和结构鉴定2.1定量和定性分析龈驕勰由哪些元素、原子定量分析:是准确测定物质中有关成分的含量。
结瞬鹦物质的分子结构或者晶22化学分析方法定义:以物质的化学反应为基础的分析方法,称为化学分析方法。
如重量分析法和滴定分析法。
(P3)重量分析法:通过化学反应及一系列操作步骤使试样中的待测组分转化为另一种纯粹的、固定化学组成的化合物,再称量该化合物的重量,从而计算出待测组分的含量或者质量分数,这样的分析方法称为重量分析方法。
例如:测定试液中的SO4' 含量。
滴定分析方法:将已知浓度的试剂溶液,滴加到待测物质溶液中,使其与待测组分发生反应,而加入的试剂量恰好为完成反应所必需分析法。
分析化学第八版第一章绪论docx(二)2024

分析化学第八版第一章绪论docx(二)引言概述:《分析化学第八版》是分析化学领域的经典教材之一,在第一章中,绪论部分是对分析化学的基本概念和原理进行介绍和概述。
本文将对该部分内容进行分析和总结,包括样品的特点、化学分析的基本步骤、分析化学的应用领域以及分析化学的发展历程等。
通过对这些内容的深入研究,我们可以更好地理解和应用分析化学知识。
正文:1. 样品的特点- 样品是进行化学分析的基础和研究对象,其特点包括多样性、复杂性和不确定性。
- 样品的种类包括固体样品、液体样品和气体样品,每种样品都有不同的特征和处理方法。
2. 化学分析的基本步骤- 化学分析通常包括样品的采集、前处理、分析方法的选择和实验操作等几个基本步骤。
- 样品的采集和前处理是确保分析结果准确和可靠的关键环节,需要注意样品的保存条件和处理方法选择。
- 分析方法的选择要根据样品的性质和分析结果的要求,选择合适的分析方法和仪器设备。
- 实验操作需要按照操作规程进行,严格控制实验条件和遵循安全操作要求。
3. 分析化学的应用领域- 分析化学广泛应用于环境监测、药物分析、食品安全、化工生产等领域。
- 环境监测中,可以通过分析化学方法对大气、水体、土壤等环境中的污染物进行检测和监测。
- 药物分析中,可以通过分析化学方法对药物的成分和纯度进行分析和检测。
- 食品安全领域,分析化学可以检测食品中的残留农药、添加剂、重金属等有害物质。
- 化工生产中,分析化学可以进行原料分析、产品检验和工艺控制,保证产品质量和生产安全。
4. 分析化学的发展历程- 分析化学作为一门独立的科学学科,经历了从定性到定量、从传统化学方法到现代分析技术的发展过程。
- 传统的定性分析方法包括重金属离子反应、有机物官能团反应等,但这些方法常常受限于灵敏度和特异性。
- 现代分析技术的出现,如光谱法、电化学分析法、质谱法等,极大地提高了分析的准确度和灵敏度。
- 当前,分析化学正朝着高通量、高灵敏度、高选择性和无损分析等方向发展。
厦门大学分析化学课程作业008参考答案

Ni Ni NH 3 Ni OH 1 10 3.4 10 0.1 1 10 3.4
lg K ' NiY lg K NiY lg Ni lg Y H 18.6 3.4 1.4 13.8
(2)pH=9.0,c(NH3)=0.2 mol L ,[CN ]=0.01 mol L ; 解:
Ni CN 1 CN 4 1 10 2 4 3)中的计算:
Ni Ni NH NiOH Ni CN 2 103.4 100.1 1023.3 2 1023.3
[CN ] c(CN - )
Ni CN 1 [CN ]4 4 1 102.4431.3 1021.7
根据上面(1)中的计算:
Ni Ni NH NiOH Ni CN 2 103.4 100.1 1021.7 2 1021.7
3
lg K ' NiY lg K NiY lg Ni lg Y H 18.6 23.3 1.4 6.1
-1 另: (2)pH=9.0,c(NH3)=0.2 mol L ,c(CN )=0.01 mol.L
解:查表得:KH(CN )=9.2
厦门大学分析化学课程
继续用甲基橙作指示剂时消耗盐酸量为 V2 = 47.70 mL,
V2 > 2V1,所以试样由 Na2CO3,NaHCO3 组成。 Na 2 CO3 %= CHClV1 103 M Na 2CO3 m总 100% 0.1060 20.10 103 106 100% 75.03% 0.3010
药学、中药学《分析化学》教学大纲08版
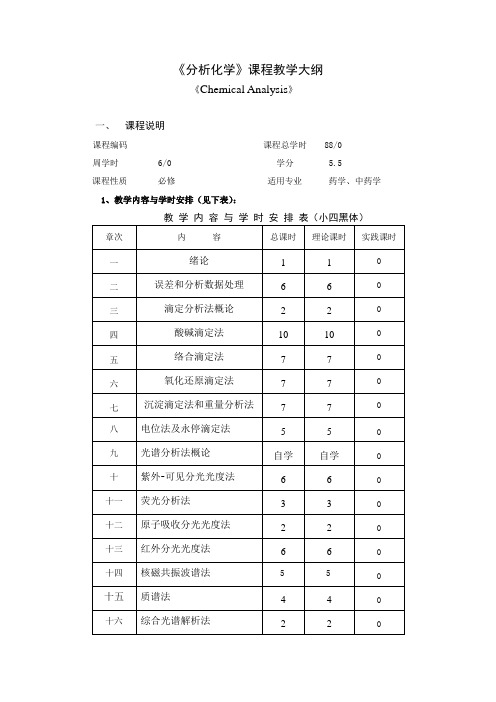
《分析化学》课程教学大纲《Chemical Analysis》一、课程说明课程编码课程总学时 88/0周学时 6/0 学分 5.5课程性质必修适用专业药学、中药学1、教学内容与学时安排(见下表):2、课程教学目的与要求:该课程教学目的在于掌握各种不同物质的分析鉴定方法的理论和技术,让学生学会科学研究的方法,培养学生观察判断问题的能力和精密地进行科学实验的技能。
通过本课程的教学,使学生:1、了解定性分析、定量分析、结构分析的方法、技术方法。
2、掌握电化学分析、光学分析、色谱分析、质谱等仪器分析基本原理和方法。
3、本门课程与其它课程关系:分析化学(仪器分析)是高等学校药学专业必修的专业基础课,它是药学和中药学专业课的基础,药学专业课程都要应用分析化学的理论和方法,来解决该门学科中的某些问题,如:药物化学中的原料、中间体及成品分析,理化性质与化学结构关系的探索;药物分析中的方法选择及药品质量标准的制定;药剂学中制剂的稳定性及生物利用度的测定;天然药物化学中天然药物有效成分的分离、定性鉴别及化学结构测定;药理学中药物分子的理化性质与药理作用、药效的关系及药物代谢动力学研究等,无不与仪器分析有着密切的关系。
分析化学对医药卫生、国民经济、科学研究等方面都起着重要作用,尤其是医药卫生事业方面,如:药品鉴定、新药研究、体内药物分析、临床检验等都离不开分析化学。
可以说它是工业生产的“眼睛”,是药品质量和人体健康的保障。
4、推荐教材及参考书:推荐教材:分析化学(第二版),孙毓庆主编,科学出版社,2006.9参考书:分析化学(第六版),李发美主编,人民卫生出版社,2007.8仪器分析(第三版),朱明华主编,高等教育出版社,2008.25、课程考核方法与要求:总成绩=期中(40%)+期末(50%)+平时(10%)6、实践教学内容安排:实践教学已独立成一门课程。
二、教学内容纲要第1章:绪论(1学时)一:目的与要求:1:了解分析化学的任务和作用及发展和趋势。
分析化学基础知识

化学分析:
*
酸碱滴定
配位滴定
氧化还原滴定
沉淀滴定
电化学分析
光化学分析
色谱分析
波谱分析
滴定分析
电导、电位、电解、库仑极谱、伏安
发射、吸收,荧光、光度
气相、液相、离子、超临界、薄层、毛细管电泳
红外、核磁、质谱
化学分析
分 析 化 学
仪器分析
分析化学的作用
在化学学科发展中的作用:分子科学、遗传密码 在化学研究工作中的作用:新物质鉴定 结构与性能 在现代化学工业中的作用:质量控制与自动检测 分析化学与社会:环境、体育、破案
*
第三节 定量分析数据处理
一、误差的种类、性质、产生的原因及减免
1. 系统误差 (1) 特点 a.对分析结果的影响比较恒定; b.在同一条件下,重复测定, 重复出现; c.影响准确度,不影响精密度; d.可以消除差——选择的方法不够完善
*
2. Q 检验法 步骤: (1) 数据排列 X1 X2 …… Xn (2) 求极差 Xn - X1 (3) 求可疑数据与相邻数据之差 Xn - Xn-1 或 X2 -X1 (4) 计算:
01
例:重量分析中沉淀的溶解损失;滴定分析中指示剂选择不当
b.仪器误差——仪器本身的缺陷
02
例:天平两臂不等,砝码未校正;滴定管,容量瓶未校正。
03
例:蒸馏水不合格;试剂纯度不够(含待测组份或干扰离子)。
04
例:对指示剂颜色辨别偏深或偏浅;滴定管读数不准。
2.偶然误差
( 1) 特点 不恒定 难以校正 服从正态分布(统计规律) ( 2) 产生的原因 偶然因素 滴定管读数
*
3.注意点
分数;比例系数;实验次数等不记位数;
分析化学课程AnalyticalChemistry化学分析部分

化学分析的原理和方法
总结词
掌握化学分析的原理和方法是进行准确分析的关键。
详细描述
化学分析的原理主要包括质量守恒定律、当量定律、滴定反应等。常用的化学 分析方法有滴定法、重量法、分光光度法、色谱法等,每种方法都有其适用的 范围和限制。
化学分析的误差和数据处理
总结词
了解误差的来源和数据处理的方法可以提高分析的准确性和可靠性。
素质目标
培养学生的科学素养、创新思维 和实践能力,使其具备良好的专 业道德和职业操守。
02
化学分析基础
化学分析的定义和分类
总结词
理解化学分析的定义和分类是学习分析化学的基础。
详细描述
化学分析是对物质进行定性和定量分析的科学,可以分为定性分析和定量分析。定性分析是确定物质中含有的元 素或离子的种类,而定量分析则是确定物质中各种组分的含量。
THANKS
感谢观看
滴定分析是一种通过滴加标准溶液至待 测溶液中,直到达到化学计量点,根据 消耗的标准溶液体积和浓度计算待测组 分含量的方法。
VS
详细描述
滴定分析基于化学反应计量关系,通过滴 加标准溶液与待测溶液中的组分发生化学 反应,达到化学计量点时,根据消耗的标 准溶液体积和浓度即可计算出待测组分的 含量。根据滴定剂的不同,滴定分析可分 为酸碱滴定、氧化还原滴定、配位滴定等 多种类型。
高效液相色谱法
总结词
高效液相色谱法是一种常用的色谱分析方法,适用于分 析热不稳定、极性强、分子量大的物质。该方法具有高 分离效能、高灵敏度、可分离范围广等优点。
详细描述
高效液相色谱法适用于分析热不稳定、极性强、分子量 大的物质,其原理是将样品中的组分在液相状态下分离 ,并利用不同的检测器进行检测。该方法具有高分离效 能、高灵敏度、可分离范围广等优点,广泛应用于化学 、生物、医学等领域。
分析化学

识别酸类的一般性质酸类溶解在水里后都有或轻或重的酸味,通常使甲基橙呈红色,酸类分子中都是非金属元素,都含有H,常含有氧(盐酸是无氧盐)。
酸分为无机酸和有机酸,无机酸酸性比较强,有机酸酸性比较弱,它们中有挥发性的,也有非挥发性的酸。
酸在印染上的应用:酸在印染厂里是主要性的染化药剂,如退浆,丝光都要用酸,拔染,防染酸起到重要的作用,配置的纳夫妥显色液要用酸,阿尼林黑染液要用酸,酸性料和分散料染色离不开酸,防染印花必须是酸性色浆,所以印染加工是自始至终在非酸的介质中进行。
执行标准:中国纺织—染化药剂验收标准:H2SO4 ≧ 98%硫酸的性质:工业用凝固点随硫酸浓度高低而不同,91.5%硫酸凝固点在35℃以上,98%硫酸凝固点在+0.1℃。
含多量的氧,所以是一强氧化剂。
酸能与水混合成各种不同浓度的溶液,但硫酸与水相遇即吸收水分而发出大量热能,因此稀释硫酸时只能把硫酸慢慢倾入冷水中,绝对不能把水注入硫酸中,如果把水注入硫酸里,因为硫酸为热的不良导体,并且具有极强的吸水能力,遇水发生高热,大量热能一时无处发散,一部分的水迅速沸腾,使硫酸飞溅伤人(硫酸的腐蚀性很强,溅于皮肤即剧烈灼伤),甚至有引起爆炸的危险。
酸的滴定分析法(有比重计测定法和滴定分析法):2.1 硫酸成分滴定分析法:精确称取试品约2克左右,倾注于250毫升锥形瓶中,然后由此稀淡硫酸液中抽取20毫升,加酚酞指示剂数滴,用0.1M NaOH 标准溶液滴定,滴定至溶液呈微粉红色不消失为止,记录NaOH 的用量V 。
反应式:2NaOH + H2SO4 Na2SO4 + 2H2O 计算公式VNaOH ˙MNaOH˙ 98.08 2000H2SO4% = × 100 试样重量˙ 20 250盐酸的性质:盐酸是氯化氢气体溶解在水中的溶液(但不是油状物,所以不同于硫酸)。
浓盐酸的氯化氢容易逸出有刺鼻的臭味,与空气中的水蒸气相遇就成白雾,氯化氢气体逸出浓度就会逐渐降低。
分析化学基础知识-(正式)

数目一定是相同的。
8
例1 判断题
2mol的氧原子与2mol的氢原子所包含的分子个 数相等。 (√ )物质的量反应了粒子数目的多少
2. 2g氧原子与2g氢原子所包含的分子个数相
等。 (× ) 质量与粒子数目无直接关系
9
例题2
90g水相当于多少摩尔的水分子?
M(H 2O)= g / m ol 18 m 90g n 5m ol M 18g / m ol
40
(2)形成定向楔的界面 乳化剂的亲水端和憎水端的截面积常大小不等。 它吸附在油-水界 面上时, 常呈现“大头”朝外, “小头”朝里的构型, 使分 散相液滴的面积最小, 界面吉布斯函数最低, 且界面膜更牢 固。
• “大头”朝外形成两种类型的乳状液
• 若亲水基是“大头”, 则亲水基朝外形成水包油型乳浊液, 如K, Na等碱金属皂类。 但一价的银肥皂例外。 • 若憎水基是“大头”, 则憎水基朝外形成油包水型乳浊液, 如Ca, Mg, Zn等两价金属皂类。 41
27
2.
3.
粒子直径 分子或离子 <10-9m 分散系 (真溶液)
组成 单个的分 子或离子
界面 无
分散体系 均匀
透过性 滤纸-能 半透膜 –能
透光性 能透光 透明的 稳定的
胶体分散系 10-9~ (胶体溶液) 10-7m
许多分子 聚集而成
有
非均匀
滤纸-能 半透膜-不
可透部分光线, 外观也是透明的,
之比,用 w B 表示。
mB w B= m
13
例题 4
将35g葡萄糖溶解于65g水中,求该溶液中 葡萄糖的质量分数。
答案:0.35或35%,无单位! ★因为构成比值的分子和分母都是质量,且同 单位,因此质量分数是一个纯数值,无单位。
分析化学第八版知识总结

分析化学第八版知识总结1、共振吸收线:原子从基态激发到能量最低的激发态(第一激发态),产生的谱线。
2、分配系数K:是在一-定温度和压力下,达到分配平衡时,组分在固定相(s)与流动相(m)中的浓度(c)之比。
K=Cs/C.3、分离度R:是相邻两组分色谱峰保留时间之差与两色谱峰峰宽均值之比。
4、化学位移δ:由于屏蔽效应的存在,不同化学环境的氢核的共振频率(进动频率,吸收频率)不同,这种现象称为化学位移。
5、保留值:表示试样中各组分在色谱柱中停留的时间或将组分带出色谱柱所需流动相体积的数值。
6、直接电位法:是选择合适的指示电极与参比电极,浸入待测溶液中组分原电池,通过测量原电池的电动势,根据Nernst方程直接求出待测组分活(浓)度的方法。
7、电极电位:金属与溶液之间的相界电位就是溶液中的电极电位。
8、离子选择电极(ISE),饱和甘汞电极(SCE),紫外-可见分光光度法(UV),红外吸收光谱发(IR),原子吸收分光光度法(AAS),核磁共振波谱法(NMIR),质谱法(MS),高效液相色谱法(HPLC),9、紫外可见光分光光度计:光源→单色器→吸收池→检测器-+信号指示系统,影响紫外一可见吸收光谱的因素:温度,溶剂,PH,时间。
10、化学位移标准物一般为四甲基硅烷(TMS),影响因素屏蔽效应和磁各向导性、氢键。
11、自旋偶合是核自旋产生的核磁矩间的相互干扰。
12、有机质谱中的离子:分子离子、碎片离子、同位素离子、亚稳离子。
13、色谱法:气相(GC),液相(LC),超临界(SFC),气固(GSC),气液(GLC),液固(LSC),液液(LLC),柱(填充柱、毛细管柱、微填充柱),平面(纸、薄层TLC、薄膜)14、色谱法基本理论:热力学理论、塔板理论、动力学理论、速率理论。
15、评价柱效:塔板数和塔板高度。
16、气相色谱仪:气路系统、进样系统、色谱柱系统、检测和记录系统、控制系统17、气相色谱检测器:质量:氢焰离子化(FID)火焰光度(FPD)、热离子化(TID),浓度:热导(TCD)、电子捕获(ECD)a,热导检测器(TCD)浓度型,原理:根据物质具有不同的热导系数原理制成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
参考书目
1. 李发美主编. 分析化学(第5版). 北京:人民卫生出版社,2003
2. 刘密新主编. 仪器分析(第2版). 北京:清华大学出版社,2002
3. 汪尔康主编. 分析化学新进展. 北京:科学出版社,2002
4. 方惠群主编. 仪器分析. 北京:科学出版社,2002
5. 蒲国刚主编. 电分析化学. 合肥:中国科学技术大学出版社,1993
6. 朱明华主编. 仪器分析(第3版). 北京:高等教育出版社,2003
7. 武汉大学. 分析化学. 第4版北京:高等教育出版社,2000
8. 李发美,白小红等. 分析化学. 北京:中国医药科技出版社,2006
9. 李克安. 分析化学. 北京:北京大学出版社2005
10. Kenneth A. Rubinson Judityh F. Rubinson. Contemporary Instrumental Analysis(影印版). 北京:科学出版社2003
11. J.A.迪安,常文保译.分析化学手册(第一版).北京:科学出版社,2003
12. 邹学贤.分析化学.北京:人民卫生出版社,2001
13. 汪尔康.二十一世纪的分析化学. 北京:科学出版社,2001
14. 国家药典委员会.中华人民共和国药典2010年版(二部).北京:化学工业出版社,2010
相关网址:
1. Sciencedirect数据库
/science/journal/00399140
2. The Chemistry Hypermedia Project
/chem-ed/vt-chem-ed.html
3. 超星数据库
/login.jsp
4. 网上图书馆
http://
5. 英国皇家化学学会
http:// /is/journals/current/analyst/anlpub.htm
6. 中国期刊全文数据库(CNKI)
/kns50/
7.PubMeb期刊全文库
/pubmed/。
