初中二年级科学八年级下册(八下)经典化学式练习3
初中科学浙教版八年级下册第三章第三节化学方程式练习题-普通用卷
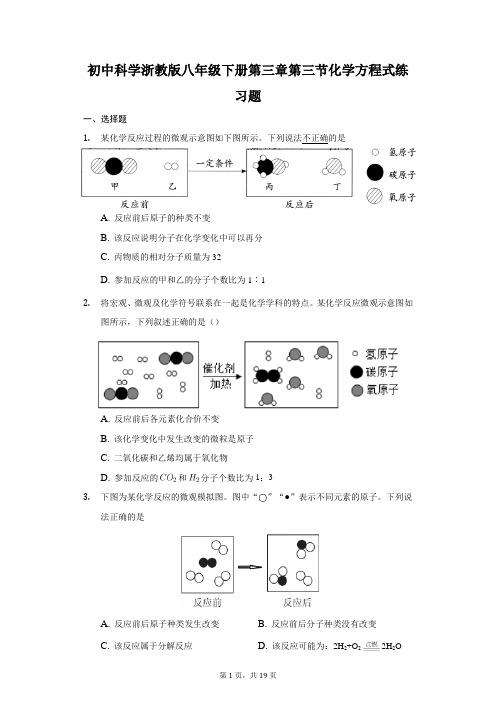
初中科学浙教版八年级下册第三章第三节化学方程式练习题一、选择题1.某化学反应过程的微观示意图如下图所示。
下列说法不正确的是A. 反应前后原子的种类不变B. 该反应说明分子在化学变化中可以再分C. 丙物质的相对分子质量为32D. 参加反应的甲和乙的分子个数比为1︰12.将宏观、微观及化学符号联系在一起是化学学科的特点。
某化学反应微观示意图如图所示,下列叙述正确的是()A. 反应前后各元素化合价不变B. 该化学变化中发生改变的微粒是原子C. 二氧化碳和乙烯均属于氧化物D. 参加反应的和分子个数比为1:33.下图为某化学反应的微观模拟图。
图中“”“●”表示不同元素的原子。
下列说法正确的是A. 反应前后原子种类发生改变B. 反应前后分子种类没有改变C. 该反应属于分解反应D. 该反应可能为:2H2+O22H2O4.尿素[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图,如下图所示:则下列说法正确的是()A. 反应中A,B两种物质的质量比为17∶22B. A,B,D三种物质都是氧化物C. 该反应属于复分解反应D. 该反应前后分子种类没有改变5.自来水消毒过程中常发生下列转化。
下列说法不正确的是()A. 反应前后分子种类改变,原子种类不变B. 转化①、②中氯元素的价态都发生变化C. 转化②中丙丁的分子个数比为1:1D. 转化①的化学方程式为:Cl2 + H2O = HClO + HCl6.我国为航天大国,火箭发射成功率世界领先。
一种新型火箭推进剂在火箭发射过程中,发生反应的微观过程如下图所示,下列说法不.正.确.的是A. 甲的化学式为N2O4B. 生成丙和丁的分子个数比为1:1C. 乙中氮、氢原子的个数比为1:2D. 丙的相对分子质量为287.一密闭容器内有A、B、C、D 共4种物质。
在一定条件下发生化学反应,一段时间后反应停止,A、B、C、D的微观示意图和反应前后各物质的质量如表所示。
浙教版科学八年级下册第三章第三节-化学方程式-三课时练习( 含答案)

化学方程式第一课时1.质量守恒定律(1)定义:在中,参加化学反应的各物质的质量总和等于反成后生成的各种物质的质量总和。
(2)质量守恒的原因是:反应前后原子的和都没有改变,原子间只是进行重新组合,因此反应前后各物质的质量总和是一样的。
(3)理解质量守恒定律的含义时应注意“参加”、“化学反应”、“各反应物质量和等于各生成物质量和”,突出“两和相等”。
在运用质量守恒定律时还应注意:a.质量守恒定律的运用范围是一切变化,不包括物理变化。
b.质量守恒定律指的是“质量守恒”,并不包括其他方面的守恒,即不包括分子数目、体积大小等。
c.质量守恒定律中的“质量”指的是参加化学反应的反应物的质量和生成物的质量,不是反应物和生成物任意质量的简单相加。
2.化学方程式。
(1)书写要领:左写反应物,右写生成物;写对化学式,系数要配平;中间连等号,条件须注明,气体和沉淀,上下箭头来表示。
a.化学式务必写正确。
b.催化剂只能写在“”的上下方,不能当成反应物、生成物。
c.要注意反应条件,如:点燃、加热、高温、通电、催化剂等。
d.注明生成物的状态:气体用“↑”(若反应物中也有气态物质,则生成物的气体不用“↑”来标明),沉淀用“↓”。
(2)配平。
a.方法:观察法、最小公倍数法、奇数配偶法;b.标志:等号左右两边每一种物质的原子个数分别相等。
题型一质量守恒定律1.常用燃烧法测定物质的组成。
现取3.2g某物质在足量氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则该物质中(相对原子质量:H-1,C-12,O-16)()A.一定含有C、H两种元素,可能含有O元素B.一定含有C、H、O三种元素C.一定含有C、O两种元素,可能含有H元素D.只含有C、H两种元素,不含O元素2.某物质W在空气中完全燃烧后的产物只有二氧化碳和水。
根据以上信息,下列关于物质W组成的说法中正确的是()A.含有C、H、O三种元素B.只含C、H元素C.含有C、H元素,可能含有O元素D.含有C元素,可能含有H、O元素3.在一个密闭容器内有a、b、c、d四种物质,在一定条件下充分反应,测得反应前后各物A.该反应可能是化合反应B.表中待测值应为5C.物质a与b变化的质量比为3︰8 D.物质d可能是该反应的催化剂4.把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,物质 a b c d 反应前的质量(g) 6.4 3.2 4.0 2.8反应后的质量(g) 5.2 X 7.2 2.8 A.a和c是反应物B.d一定是催化剂C.X=2.0g D.该反应是化合反应题型二化学式的推断1.镁在二氧化碳中燃烧的化学方程式为2Mg+CO22MgO+X,则X的化学式为()A.CO B.C C.Mg(OH)2D.MgCO32.化学反应:铅丹+4HNO3PbO2+2Pb(NO3)2+2H2O,由此反应可推测,铅丹的化学式为。
八年级科学化学式练习(含答案)

八年级科学化学式基础练习一、元素符号:碳 C 氢H 氧O 氮N 氯Cl 硫S 磷P ,钾K 钙Ca 钠Na 镁Mg 铝Al 铁Fe 锌Zn ,溴Br 碘I 锰Mn 钡Ba 铜Cu 硅Si 银Ag ,氦He 氖Ne 氩Ar 氟 F 铍Be 汞Hg 金Au二、原子团的符号及化合价:硝酸根离子 NO3- 、 -3 硫酸根离子 SO42-、 -2 碳酸根离子+ CO32-、 -2 碳酸氢根离子 HCO3-、 -1 氢氧根离子 OH-、 -1 铵根离子 NH+、 +1二、物质的化学式:1.单质的化学式:(1)铜 Cu 铁 Fe 汞 Hg 铝 Al 钙 Ca 钡 Ba(2)硫黄S 硅Si 金刚石 C 石墨 C 黄磷P(3)氦气 He 氖气 Ne 氩气 Ar(4)碘 I2溴 Br2氢气 H2氧气 O2氯气 Cl2氮气 N22、根据化合价写出下列化合物的化学式:(1)氧化物:(A)金属氧化物:氧化钠Na2O 氧化钾K2O 氧化钙CaO氧化铜CuO 氧化铁Fe2O3氧化亚铁FeO 四氧化三铁Fe3O4氧化铝Al2O3(B)非金属氧化物:水 H20 、二氧化碳 CO2一氧化碳 CO二氧化硫 SO2三氧化硫 SO3五氧化二磷 P2O5冰 H2O(2)酸:(某酸:H+ + 某酸根阴离子)硫酸 H2SO4 硝酸 HNO3盐酸(酸根Cl-) HCl 碳酸 H2CO3 (3)碱:氢氧化钠 NaOH 氢氧化钾 HOH 氢氧化钙 Ca(OH)2氢氧化镁 Mg(OH)2氢氧化铝Al(OH)3氢氧化铜 Cu(OH)2氢氧化钡 Ba(OH)2氢氧化铁 Fe(OH)3氢氧化亚铁 Fe(OH)2(4)盐酸盐:氯化钠 NaCl 氯化钾 K Cl 氯化钡 Ba Cl2 氯化钙Ca Cl2氯化铜CuCl2氯化铝 Al Cl3氯化亚铁 Fe Cl2氯化铁Fe Cl3氯化银 AgCl(5)碳酸盐:碳酸钾K2CO3 碳酸钠Na2CO3 碳酸钙CaCO3碳酸镁MgCO3 碳酸钡BaCO3 碳酸氢钠NaHCO3 碳酸氢铵NH4HCO3(6)硫酸盐:硫酸钾K2SO4硫酸钠Na2SO4硫酸钙CaSO4硫酸镁 MgSO4硫酸钡BaSO4硫酸亚铁FeSO4硫酸铵(NH4)2SO4硫酸铁 Fe2(SO4)3(7)硝酸盐:硝酸银AgNO3硝酸钠NaNO3硝酸钙Ca(NO3)2硝酸镁MgNO3)2硝酸钡Ba(NO3)2硝酸亚铁Fe(NO3)2硝酸铵NH4NO3硝酸铁Fe(NO3)3四、用化学符号表示:1、铁离子Fe3+2、氯离子Cl-3、氢离子H+4、铜离子Cu2+5、3个亚铁离子3Fe2+6、2个铜离子2Cu2+7、2个钠离子2Na+8、氢气H29、氢元素H 10、1个氢原子H11、2个氢原子2H 12、一个氢分子H2 13、2个氢分子2H2+2 14、2个氢离子2 H+15、2个水分子 2 H2016、正2价的钙元素Ca17、2个一氧化氮分子2NO 18、2个氧离子2O2-19、带2个单+2位负电荷的硫离子S2-20、氧化镁中镁元素的化合价为+2价MgO五、说出下列“2”的含义1、2Cl 2个氯原子2、3Cl2 1个氯分子中有2个氯原子+23、2K+2个钾离子4、BaCO3 碳酸钡中钡元素的化合价是正2价5、2Fe3+2个铁离子6、SO21个二氧化硫分子中有2个氧原子7、2SO32个三氧化硫分子8、S042-1个硫酸根离子带2个单位的负电荷9、Ca2+1个钙离子带2个单位的正电荷10、3Fe2+ 1个亚铁离子带2个单位的正电荷11、H21个氢分子中有2个氢原子12、2Cl-2个氯离子六、标出下列加点元素的化合价-1 +2 0 +5 +1 +5 +31、H Cl..Cl..O2Cl..2K Cl..O3Ca(Cl..O)2H Cl..O3H Cl..O2+6 +4 0 +6 -2 +4 +62、S.O3S.O2S .H2S.O4H2S.H2S.O3Na2S.O4+4 +2 0 +7 +6 +7 +63、Mn.. O4Mn..O42-..O4-Mn..O4K2 Mn..O2Mn..Cl2Mn..K Mn0 +3 +5 +2 +4 +5 +5 -3 +54、N.2N.2 O3N.2 O5N. O N. O2H N. O3N. O3-N. H4 N. O3-3 +5 +5N. H4+ Al(N. O3)3Mg(N. O3)2七、标出下列物质中各.元素的化合价+4 -2 +2 -2 +1 +4 2 +1 +5 -21、CO22、CO3、H2CO34、NaNO3+3 -2 +1 +1 -2 +3 -2 +2 -15、Fe(OH)36、K2O7、Al2O38、FeCl2+1 -2 +6 -2 +5 -2 +2 +6 -29、H2O 10、SO311、P2O5、12、BaSO4八、写出下列符号的名称或含义1、O21个氧分子氧气2、FeCl3氯化铁(1个氯化铁分子)3、FeO 氯化亚铁(1个氯化亚铁分子)4、Cu 铜元素1个铜原子金属铜5、3H2O 3个水分子6、Cl 氯元素1个氯原子-27、S 负2价的硫元素8、S2-1个带2个单位负电荷的硫离子九、说一说“SO2”表示的含义1、二氧化硫这种物质2、1个二氧化硫分子3、二氧化硫中含有硫元素和氧元素4、二氧化硫分子的相对分子质量为645、1个二氧化硫分子由1个硫原子和2个氧原子构成十、根据化学式计算(相对原子质量质量Fe-56,O-16,Cu-64,S-32)1、Fe2O3:(1)铁、氧元素质量比7:3 (2)铁、氧原子个数比2:3(3)铁元素的质量分数70% (4)铁元素的化合价+3(5)320克Fe2O3中含铁元素的质量224 克,含氧元素的质量96克2、CuSO4:(1)由铜、硫、氧元素组成,(2)原子个数比:Cu:S:O = 1:1:4(3)元素质量比:Cu:S:O = 2:1:3(4)硫元素的化合价+6(5)各元素的质量分数:Cu%= 33.3% S%= 16.7%O%= 50%(6)160克硫酸铜中各元素的质量:Cu:53.3克S:26.7克O:80克钡餐——硫酸钡碱石灰主要成分——生石灰+氢氧化钠水煤气——一氧化碳,氢气1、铁锈和稀盐酸2、锌和稀硫酸3、氯化钡和稀硫酸4、硫酸铜和氢氧化钠5、氢氧化钠吸收二氧化硫6、氢氧化钠和氯化铁溶液中氯离子(cl-)的检验方法溶液中硫酸根离子(SO42-)的检验方法不小心把浓硫酸或氢氧化钠溅到皮肤上。
初中二年级科学八年级下册(八下)经典化学式练习1

化学基础知识练习(1)
一、写出元素或原子团符号并标出化合价:
1.写出常见元素的符号:
碳氢氧氮氯硫磷钾钙钠镁铝铁锌
溴碘锰钡铜硅银氦氖氩氟钨汞金
2.原子团符号及化合价:
硝酸根、氢氧根、铵根、
碳酸根 ___ __、硫酸根、碳酸氢根 ___ _、
亚硫酸根、磷酸根、
二、写出下面物质的化学式:
1.单质的化学式:
铜 ___ 铁__ _ 汞 ___ 铝 ___ 硫 ___ 碳 ___ 磷 ___ 硅 ___ 氦气 ___ 氖气 ___ 氩气 __
氢气 __ 氧气 __ 氯气 __ 氮气 __ 碘 __
2.化合物的化学式:
氧化物:氧化钠氧化钾氧化钙氧化镁
氧化铜氧化铁氧化亚铁氧化铝水
三、标出加点元素的化合价:
N.2N.O2N.H3N.2O5 N.H4N.O3C.l2C.lO2KC.l KC.lO3
KC.lO4HC.lO S.S.O2S.O3H2S.O4 H2S.F.eS.
四.写出下列元素组成的化学式
Cl OH NO3SO4CO3 H
Mg
Ca
Al
Na
Fe(+2)
Zn
Ba
NH4。
八年级科学下册3-3化学方程式3同步练习新版浙教版 (2)

3.3 化学方程式(3)A 组1.八年级(二)班同学计算30克炭完全燃烧可以得到多少克二氧化碳时,出现了以下几种算式,其中正确的是 (B )A. 1230克=x 44B. 1244=30克xC. 12x =30克44D. 12x =4430克2.在化学反应2A +3B===2C +D 中,已知8克物质A(相对分子质量为32)与12克B 完全反应,则物质B 的相对分子质量为(B )A. 16B. 32C. 48D. 643.在反应2CO +O 2=====点燃2CO 2中,各物质之间的质量比为7∶4∶11,各物质之间分子个数比为2∶1∶2,化学计量数之和为5。
4.某学习小组的同学用KClO 3和MnO 2的混合物加热制取O 2,收集到4.8克O 2后停止加热,称得剩余固体的质量为28.0克,继续加热至不再产生O 2,最终剩余固体质量为23.2克。
试计算(不考虑O 2的损耗):(1)两次生成O 2的总质量为9.6克。
(2)理论上可回收MnO 2的质量(写出计算过程)。
【解】 设生成氯化钾的质量为x 。
2KClO 3=====MnO 2△2KCl +3O 2↑ 149 96 x 9.6克 14996=x 9.6克,x =14.9克。
二氧化锰作催化剂,反应前后质量不变,则可回收到MnO 2的质量为23.2克-14.9克=8.3克。
5.某氯碱工厂排放的尾气里含有有毒的氯气(Cl 2),为防止其污染空气,工厂用20%的NaOH 溶液吸收氯气(反应的化学方程式为Cl 2+2NaOH===NaClO +NaCl +H 2O)。
计算:4吨溶质质量分数为20%的NaOH 溶液,理论上可吸收氯气的质量为多少?【解】 设理论上可吸收氯气的质量为x 。
Cl 2+2NaOH===NaCl +NaClO +H 2O 71 80x 4吨×20%71x =804吨×20%x =0.71吨答:理论上可吸收氯气的质量为0.71吨。
初二下册科学专题化学式练习

对第6、7节内容的补充【复习】常见物质的化学式【常见物质化学式】硫酸 盐酸 硝酸 磷酸 硫化氢 溴化氢 碳酸 (常见的酸)H 2SO 4 HCl HNO 3 H 3PO 4 H 2S HBr H 2CO 3甲烷 乙炔 甲醇 乙醇(酒精) 乙酸(醋) (常见有机物)CH 4 C 2H 2 CH 3OH C 2H 5OH CH 3COOHHClO 次氯酸、HClO 3氯酸、HClO 4高氯酸氢氧化钙(澄清石灰水/熟石灰)Ca(OH)2氧化钙(生石灰)CaO【讲解】1.相对原子质量以一种碳原子(碳—12)的质量1/12作为标准,把其他原子的质量跟这个标准相比较所得的比值,叫做这种原子的相对的原子质量。
注意:根据最新国家计量标准,相对原子质量的单位符号为“1”,“1”不用明确写出,因此,相对质量是有单位的。
以下的相对分子质量的单位也为“1”。
【理解】由于原子的质量较小使得计算不便,所以采用了相对原子质量的概念,相对原子量就是找一个基准,把碳的原子量定为12,其它原子的质量和它比得出的就是其相对原子量,被求原子相对质量=12*被求原子的重量/碳原子的质量例如:氧原子的质量为2.657×10-26千克,那么氧原子的相对原子质量=1610661.110657.22726=⨯⨯--KgKg 质子:1.6726×10-27千克 中子:1.6748×10-27千克【注意】(1)质子和中子的质量与C —12原子质量的1/12(标准量)相当,因此,一个质子或中子的相对质量即为1;(2)电子的质量很小,其相对质量可以忽略;(3)某原子的相对原子质量等于该原子的质子数与中子数之和。
相对原子质量不是原子的实际质量【延伸】不以 碳原子(碳—12)的质量1/12作为标准,以其他为标准,求解原子的相对原子质量例1:质子数和中子数都是6的碳原子的质量2610993.1-⨯千克,另一种原子的质量是2710975.14-⨯千克,求这种原子的相对原子质量?答案:9 例题2:一个C -12原子的质量为m千克,某元素一个原子的质量为n千克,则该元素相对原子质量为相对原子质量=———————————— 一个该原子的质量 1/12(一个碳原子的质量) =—————————— 一个该原子的质量 1.661×10-27千克( )A 、m/12n B 、12n/m C 、n/12m D 、12m/n延伸:若一个SO 2分子质量为n 千克,一个SO 3分子的质量为m 千克,若以一个硫原子质量的1/32作为标准,则SO 2的相对分子质量为( )A .32n/(m - n )B .32n/(3m - 2n)C .32n/(3n - 2m)D .16n/(3m - 2n)例题3:已知某元素的原子与碳—12原子的质量比为9,则该元素的相对原子质量为( )A 108B 1.33C 108克D 1.33克【基础练习】1.铁的相对原子质量是……………( )A .1个铁原子的质量B .56C .9.288×10-26kgD .56g2.已知原子核内有6个质子和6个中子的碳原子质量为a 克,若另一种原子的质量为b 克,则另一种原子的相对原子质量为( )A a/b B b/a C 12b/a D 12a/b3、一种原子核内有6个质子和6个中子的碳原子的质量为m 千克,已知R 原子核内有a 个中子,R 原子的实际质量为n 千克,则R 原子的质子数为多少?【知识梳理】要求熟练应用公式根据化学式的计算类型:以AxBy 为例1.根据化学式计算相对分子质量相对分子质量=xa + yb2.根据化学式求各元素的原子个数比A 原子个数:B 原子个数= x :y3.根据化学式求化合物中各元素的质量比A 元素质量:B 元素质量=x a :yb4.根据化学式求某元素的质量分数某元素的质量分数 = 化学式中该元素相对原子质量×该元素的原子个数化学式的相对分子质量A 元素的质量分数A%= —————100%5.根据化学式计算某元素的质量(重点讲解)元素A 的质MA = M A x O y ×A%【基础练习】1、计算下列物质的相对分子质量FeSO 4·7H 2O Fe 2O 3 KCl Fe 3O 4 H 2O Na 2SO 4 H 2O 2答案:278;320;74.5;232;182、计算物质组成元素的质量比(上面物质);计算上述物质中氧元素质量分数【第7节计算题训练】1、如图是市售某品牌牙膏包装盒上的部分说明。
八年级下化学方程式书写、配平专项练习

八年级下化学方程式书写、配平专项练习氢气和氧气反应生成水,写出化学方程式并配平。
2H₂ + O₂→2H₂O氧化铁和硫酸反应生成铁硫酸和水,写出化学方程式并配平。
Fe₂O₂ + H₂SO₂→Fe₂(SO₂)₂ + H₂O硝酸和钠反应生成硝酸钠和氢氧化钠,写出化学方程式并配平。
HNO₂ + Na →NaNO₂ + NaOH硫酸与钙氢氧化物反应生成水和硫酸钙,写出化学方程式并配平。
H₂SO₂ + Ca(OH)₂→CaSO₂ + 2H₂O二氧化硫和水反应生成亚硫酸和氧气,写出化学方程式并配平。
SO₂ + H₂O →H₂SO₂ + O₂一种化合物分解成氧气和二氧化碳,写出化学方程式并配平。
C₂H₂O₂→CO₂ + H₂O铜和硝酸反应生成硝酸铜和氮氧化物,写出化学方程式并配平。
Cu + HNO₂→Cu(NO₂)₂ + NO碳酸钠和盐酸反应生成二氧化碳、水和氯化钠,写出化学方程式并配平。
Na₂CO₂ + 2HCl →CO₂ + H₂O + 2NaCl氢氧化铵和盐酸反应生成氯化铵和水,写出化学方程式并配平。
NH₂OH + HCl →NH₂Cl + H₂O硫酸钠和氯化钙反应生成氯化钠和硫酸钙,写出化学方程式并配平。
Na₂SO₂ + CaCl₂→2NaCl + CaSO₂铁和硫酸反应生成氢气和铁(II)硫酸,写出化学方程式并配平。
Fe + H₂SO₂→FeSO₂ + H₂氮氧化物和水反应生成硝酸和氢氧化氮,写出化学方程式并配平。
NO + H₂O →HNO₂ + NO₂一种有机化合物和氧气反应生成二氧化碳和水,写出化学方程式并配平。
C₆H₂₂O₆+ 6O₂→6CO₂ + 6H₂O硫酸铜和氢氧化钠反应生成氢氧化铜和硫酸钠,写出化学方程式并配平。
CuSO₂ + 2NaOH →Cu(OH)₂ + Na₂SO₂钙和水反应生成氢气和氢氧化钙,写出化学方程式并配平。
Ca + 2H₂O →H₂ + Ca(OH)₂硝酸和氢氧化钾反应生成硝酸钾和水,写出化学方程式并配平。
初中二年级科学八下化学之化学式完整复习总结

四氧化三铁 Fe3O4 五氧化二磷 P2O5 三氧化钨
WO3
过氧化氢
H2O2
盐酸
HCl
硝酸
HNO3
硫酸
H2SO4
磷酸
H3PO4
碳酸
H2CO3
氢硫酸
H2S
氢氧化钠 NaOH 氢氧化钾 KOH 氢氧化钙 Ca(OH)2 氢氧化镁 Mg(OH)2
氢氧化铝 Al(OH)3 氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2 氢氧化铜 Cu(OH)2
氯化钾
KCl
氯化钠
NaCl
氯化锌
ZnCl2
氯化铁
FeCl3
氯化亚铁 FeCl2
氯化铜
CuCl2 氯化亚铜 CuCl
氯化银
AgCl
氯化钡
BaCl2
硝酸钾
KNO3
硝酸钠
NaNO3
硝酸锌 Zn(NO3)2
硝酸镁 Mg(NO3)2 硝酸铁 Fe(NO3)3 硝酸铜 Cu(NO3)2 硝酸汞 Hg(NO3)2
氢氧化钡 Ba(OH)2
硫酸钾
K2SO4 硫酸氢钾 KHSO4
硫酸钠
Na2SO4 亚硫酸钠
Na2SO3
硫酸氢钠 NaHSO4 硫酸镁
MgSO4
硫酸铝 Al2(SO4)3 硫酸铁 Fe2(SO4)3
硫酸亚铁 FeSO4
硫酸锌
ZnSO4
硫酸铜
CuSO4
硫酸钡
BaSO4
碳酸钙
CaCO3
碳酸钠
Na2CO3 碳酸氢钠 NaHCO3 硫酸铜晶体 CuSO4·5H2O
硝酸银
AgNO3
硝酸钙 Ca(NO3)2 高锰酸钾 KMnO4
氯酸钾
初中化学式练习及答案

初中化学式练习及答案初中化学式练习(一)(书写) ?写出下列原子团离子的符号氢氧根离子硝酸根离子碳酸根离子硫酸根离子磷酸根离子铵根离子一、单质:氟气氦气磷银钠氯气氖气镁钡锰碘氩气铝钙铂氧气碳铁汞氮气硅铜铅氢气硫锌钾二、氧化物:水五氧化二磷氧化铁二氧化硫氧化镁氧化亚铁三氧化硫氧化钙四氧化三铁二氧化碳氧化锌氧化铜一氧化碳氧化铝氧化钠三、酸: 盐酸硫酸碳酸硝酸磷酸四、碱:氢氧化钠氢氧化镁氢氧化铜氢氧化钾氢氧化铝氢氧化钙氢氧化铁氢氧化钡氢氧化亚铁四、盐:硝酸钾氯化钾硫酸钾硝酸钠氯化钠硫酸钠硝酸钡氯化钡硫酸钡硝酸钙氯化钙硫酸钙硝酸镁氯化镁硫酸镁硝酸铝氯化铝硫酸铝硝酸锌氯化锌硫酸锌硝酸铁氯化铁硫酸铁硝酸亚铁氯化亚铁硫酸亚铁硝酸铜氯化铜硫酸铜硝酸银氯化银硝酸铵氯化铵硫酸铵碳酸钾碳酸锌碳酸钠高锰酸钾碳酸钡碳酸铜锰酸钾碳酸钙碳酸铵氯酸钾碳酸镁化学式练习(一)答案一、单质:氟气氦气磷银钠 F He P Ag Na 2氯气氖气镁钡锰 Cl Ne Mg Ba Mn 2碘氩气铝钙铂 I Ar Al Ca Pt 2氧气碳铁汞 O C Fe Hg 2氮气硅铜铅 N Si Cu Pb 2氢气硫锌钾 H S Zn K 2二、氧化物:水五氧化二磷氧化铁 HO PO FeO 22523二氧化硫氧化镁氧化亚铁 SO MgO FeO 2三氧化硫氧化钙四氧化三铁 SO CaO FeO 334二氧化碳氧化锌氧化铜 CO ZnO CuO 2一氧化碳氧化铝氧化钠 CO AlO NaO 232三、酸:盐酸硫酸碳酸 HCl HSO HCO 2423硝酸磷酸 HNO HPO 334四、碱:氢氧化钠氢氧化镁氢氧化铜 NaOH Mg(OH) Cu(OH) 22氢氧化钾氢氧化铝KOH Al(OH) 3氢氧化钙氢氧化铁 Ca(OH)2 Fe(OH) 3氢氧化钡氢氧化亚铁 Ba(OH)2 Fe(OH) 2五、盐:硝酸钾 KNO 氯化钾 KCl 硫酸钾 KSO 324硝酸钠氯化钠硫酸钠 NaNO NaCl NaSO4 32硝酸钡氯化钡硫酸钡 BaSO Ba(NO) BaCl 4322硝酸钙氯化钙硫酸钙 CaSO Ca(NO) CaCl 4322硝酸镁氯化镁硫酸镁 MgSOMg(NO) MgCl 4322硝酸铝 (SO) 氯化铝硫酸铝 AlAl(NO) AlCl 432333硝酸锌氯化锌硫酸锌 ZnSO Zn(NO) ZnCl 4322硝酸铁 (SO) 氯化铁硫酸铁 FeFe(NO) FeCl 432333硝酸亚铁氯化亚铁硫酸亚铁 FeSOFe(NO) FeCl 4322硝酸铜氯化铜硫酸铜 CuSO Cu(NO) CuCl 4322硝酸银氯化银硫酸银 AgSO AgNO AgCl 423硝酸铵 )SO 氯化铵硫酸铵 (NHNHNO NHCl 244434碳酸钾 KCO 23 碳酸钠高锰酸钾 NaCO KMnO 234碳酸钡 BaCO 碳酸锌 ZnCO 锰酸钾 3KMnO 324碳酸钙 CaCO 碳酸铜 CuCO 氯酸钾 33KClO 3碳酸镁 MgCO 碳酸铵 (NH)CO 33 42。
浙教版科学八年级下册第二章《微粒的模型与符号》化学式练习含答案

八年级科学化学式练习写出下列元素符号:二、写出下列物质的化学式:1.单质的化学式:2、根据化合价写出下列化合物的化学式:(1)氧化物:(A)金属氧化物:氧化钠氧化钾氧化钙氧化铜氧化铁氧化亚铁四氧化三铁______ 氧化铝(B)非金属氧化物:水、二氧化碳 _________ 一氧化碳___________ 二氧化硫 _______ 三氧化硫_______ 五氧化二磷__________ 冰________四、用化学符号表示:11、2个氢原子12 、一个氢分子13 、2个氢分子____________14、2个氢离子15 、2个水分子16 、正2价的钙元素_________ 17、2个一氧化氮分子18 、2个氧离子19 、带2个单位负电荷的硫离子 _________ 20 、氧化镁中镁元素的化合价为+2价_________________五、说出下列“ 2”的含义1、2CI2、3CI2+23、2K+4、BaCQ5、2Fe3+6、SQ7、2SQ8、S042-9、Ca2+102+、3Fe11、H212、2CI-六、标出下列加点元素的化合价1、HCI CIQ Cl 2K CIQ Ca( CIO)2H CIQ H CIQ2、SO SQ S H 2SO H 2S H2SQ Na2SO3、MrO MrCl2Mn K Mn O K 2Mn O4Mn O4-Mn O2-4、r NQ3 N O5N O NO2 H N O3 NO3NH4 N O3+NH4Al( NQ3)3Mg( N O3)2七、标出下列物质中各元素的化合价1、CO 2 、CO3、HCO4、NaNO5、Fe(OH)3 6 、K2O7、AI2Q8、FeCb 9、H2O10 、SO11 、BO、12、BaSO八、写出下列符号的名称或含义1、Q ____________________2、FeCb ______ 3 、Fe ________4、Cu ______________ ___________________________________5、3H2O 6 、Cl __________________________-27、S 8 、S2-__________________________九、说一说“ SQ”表示的含义1、______________ 2 _________ 、_____________________________3、_____________ 4 _________ 、_______________________________5、_____________________________________________十、根据化学式计算(相对原子质量质量Fe-56,Q-16,Cu-64,S-32 )1、F^Q: (1)铁、氧元素质量比_______ (2)铁、氧原子个数比______ (3)铁元素的质量分数____________ (4)铁元素的化合价___________ (5)320克FeO中含铁元素的质量________ ,含氧元素的质量 _______2、CuSQ (1)由___ 、 ______ 、______ 元素组成,(2)原子个数比: ____ = __________________________(3)元素质量比: ____ = ___________________________(4) ________________________ 硫元素的化合价(5)各元素的质量分数:Cu%= S%= Q%= ______________(6)160 克硫酸铜中各元素的质量:Cu: S : _________Q : ______________八年级科学练习班级 ____________ 姓名 ____________ 二、写出下列元素符号:二、写出下列原子团的符号及化合价:_ 2-硝酸根离子? NO3_ 、?? _3 ? 硫酸根离子? SO 4 _ ?? 、?? _2碳酸根离子CO 3 、? _2 碳酸氢根离子HCO 3 、? _1氢氧根离子? OH 、? _1 铵根离子NH 、+1二、写出下列物质的化学式:1.单质的化学式:2、根据化合价写出下列化合物的化学式:(1)氧化物:(A)金属氧化物:氧化钠Na2O氧化钾K 2O 氧化钙CaO氧化铜CuO 氧化铁Fe 2O3 氧化亚铁FeO 四氧化三铁Fe3O_氧化铝Al 2Q(B)非金属氧化物:水H20 、二氧化碳CO2—一氧化碳CO 二氧化硫S02 三氧化硫S03五氧化二磷P 2C5 冰H20(2)酸:(某酸:H+ +某酸根阴离子)硫酸H 2SO4 硝酸HN03 盐酸(酸根Cl-) HCI 碳酸H 2CO⑶碱:氢氧化钠NaOH 氢氧化钾HOH 氢氧化钙Ca(OH) 2氢氧化镁Mg(OH) 2 氢氧化铝AI(OH) 3 氢氧化铜Cu(OH) 2氢氧化钡Ba(OH) 2 氢氧化铁Fe(OH) 3氢氧化亚铁Fe(OH) 2⑷盐酸盐:氯化钠NaCI 氯化钾K CI 氯化钡Ba Cl 2 氯化钙Ca Cl 2氯化铜CuCl2氯化铝Al Cl 3氯化亚铁Fe Cl 2 氯化铁Fe Cl 3氯化银AgCI⑸碳酸盐:碳酸钾_&CO _碳酸钠Na^CO _______________ 碳酸钙?_CaCO _碳酸镁?_MgCO _碳酸钡BaCO碳酸氢钠_NaHCO碳酸氢铵NHHCO.(6)硫酸盐:硫酸钾K 2SQ硫酸钠Na 2SQ 硫酸钙CaSO4硫酸镁?MgSO硫酸钡BaSO 硫酸亚铁FeSO 硫酸铵(NH^SO 硫酸铁Fe 2(SO4)3⑺硝酸盐:硝酸银AgNO3 ?硝酸钠NaNO3硝酸钙Ca(NO) 2硝酸镁? MgNO0 2硝酸钡Ba(NO)2硝酸亚铁Fe(NQh硝酸铵NHNO硝酸铁Fe(NQh四、用化学符号表示:I、铁离子Fe 3 2 、氯离子CI 3 、氢离子H 4 、铜离子Cu ? _______________________5、3个亚铁离子3Fe 2+ 6 、2个铜离子2Cu 2+7 、2个钠离子2Na +8、氢气H 2 9 _____ 、氢兀素H 10 、1 个氢原子H ___________________ II、2个氢原子2H 12 、一个氢分子H 2 13 、2个氢分子2H 2+2 14、2个氢离子2 H + 15 、2个水分子_2_H20 16 、正2价的钙元素_Ca ___________17、2个一氧化氮分子2NO 18 、2个氧离子2O 2-19 、带2个单+211、H 2 1 个氢分子中有 2个氢原子12、2CI六、标出下列加点元素的化合价1、 -1HCI+2+5CIQ+1+5+3Cl 2 K CIQCa( CIQ )2 H CIQ HCIQ+6+40 +6 -2+4 +62、 SQSC 2 SH 2SQH 2SH2SQ Na2SQ +4+2+7+6+7 +63、 MrOMrCbMn K Mn Q K2Mn Q 4Mn Q -Mn Q 2-0 +3 +5+2+4+5 +5 -3 +54、 MNN Q 3卜2Q 5 N Q N Q 2 H N Q3NQ 3 NH 4 N Q 3-3+5+5+NH 4Al( NQ 3) 3 Mg( N Q 3) 2七、 标出下列物质中各兀素的化合价+4 -2+2 -2 +1 +4 2 +1 +5 -21、C Q 2 、CQ3、 I4CQ4NaNQ+3 -2 +1+ 1 -2+3 -2+2 -15、 Fe(OH )36、&Q 7 、 AI 2Q8 、FeCb+1 -2+6 -2+5 -2+2 +6 -29、 H 2Q 10 、SQ 11BQ 、12、BaSQ八、写出下列符号的名称或含义1、 Q 1 个氧分子 氧气5、3HO 3个水分子 6 、Cl 氯元素 1个氯原子 ____________-2五、 说出下列“ 2”的含义 1、 2Cl 2 个氯原子2、3CI 21 个氯分子中有2个氯原子+23、2K + 2 个钾离子 BaCQ 碳酸钡中钡元素的化合价是正 2价5、2Fe 3+ 2 个铁离子 、SQ 1个二氧化硫分子中有 2个氧原子7、 2SQ 2个三氧化硫分子、S042- 1个硫酸根离子带2个单位的负电荷 9、C a 2+ 1个钙离子带2个单位的正电荷 10、 3Fe 2+ 1个亚铁离子带2个单位的正电荷2 个氯离子2、FeCb 氯化铁 (1个氯化铁分子)3、FeQ 氯化亚铁(1个氯化亚铁分子)4、Cu 铜元素个铜原子金属铜位负电荷的硫离子S 2 20 、氧化镁中镁元素的化合价为+2价MgO7、S 负2价的硫元素8 、扌1个带2个单位负电荷的硫离子九、说一说“ SQ”表示的含义1、二氧化硫这种物质 2 、1 个二氧化硫分子3、二氧化硫中含有硫元素和氧元素4、二氧化硫分子的相对分子质量为645、1个二氧化硫分子由1个硫原子和2个氧原子构成十、根据化学式计算(相对原子质量质量Fe-56,Q-16,Cu-64,S-32 )1、FeO: (1)铁、氧元素质量比7:3 (2)铁、氧原子个数比2:3(3)铁元素的质量分数70% (4)铁元素的化合价+3(5)320克FeO中含铁元素的质量224克,含氧元素的质量96克2、CuSQ (1)由___ 、硫、氧元素组成,(2) ________________________________________ 原子个数比:Cu: S:Q= 1:1:4 ___________________________________(3) __________________________________ 元素质量比:Cu: S: Q= 2:1:3(4)硫元素的化合价+6(5)各元素的质量分数:Cu%= 33.3% S%= 16.7%Q%= 50% __________(6)160 克硫酸铜中各元素的质量:Cu: 53.3克S : 26.7克80 克。
八年级科学化学方程式习题3(含答案)

八年级科学化学方程式习题3学校:___________姓名:___________班级:___________考号:___________一、选择题1.氨的催化氧化是制硝酸的主要反应之一。
该反应前后分子种类变化的微观示意图如下。
下列说法错误的是()A.甲中氮、氢原子个数比为1∶3B.乙的相对分子质量为32C.两种生成物均为化合物D.生成的丙与丁的分子个数比为1∶12.在一密闭的容器中四种物质,使其在一定条件下反应了一段时间后,测得数据如下:则下列叙述不正确的是()A.未测值为 12g B.甲与乙的相对分子质量比一定为 11:3C.丙不一定是该反应的催化剂D.该反应为化合反应3.复旦大学投毒案中用的N-亚硝基二甲胺,又称二甲基亚硝胺,是一种半挥发性有机化学品,气味与味道很弱,易溶于水、醇、醚等,是一种有毒物品,具有强肝脏毒性,对人类很可能有致癌性。
主要用于火箭燃料、抗氧剂等制造。
其结构如图,对其认识错误的是A.该物质由四种元素组成B.该物质元素质量分数最高的是C 元素C.该物质应该密封保存D.该物质燃烧的产物中可能有CO、氮气、水等4.下列对质量守恒定律的理解错误的是()A.质量守恒定律只适用于化学反应,不适用于物理变化B.质量守恒定律研究的内容仅是指“质量”,不能推广到其他物理量C.催化剂可以改变其他物质的化学反应速率,有催化剂参加的反应也遵守质量守恒定律D.蜡烛燃烧后质量减轻,不符合质量守恒定律5.现有32g某可燃物在密闭容器中可完全燃烧后,测得生成88g二氧化碳和72g水,关于该可燃物的说法正确的是()A.一定是氧化物B.一定含有碳、氢元素,可能含有氧元素C.一定含有碳、氢、氧三种元素D.只含有碳、氢两种元素6.如图为某化学反应的微观示意图,下列有关说法中,不正确的是( )A.该反应属于置换反应B.相对分子质量最小的是甲C.反应前后有两种元素的化合价发生了变化D.生成丙和丁的质量比为14:97.如图为某化学反应的微观模拟示意图,下列说法中,正确的是( )A.反应前后氢元素的化合价没有改变B.x=3C.反应过程中原子种类发生了变化D.该反应生成了两种单质8.在化学变化中,下列说法不正确的是()①原子的种类、元素的种类、分子的种类均不变②原子的数目、分子的数目均不变③原子的质量、元素的质量均不变④物质的总质量不变A.①②B.①③C.③④D.②④9.在实验室用高锰酸钾制取氧气过程中,下列图象能正确表示对应变化关系的是()A.B.C.D.10.氯气(Cl2)和氧气一样,都是活泼的非金属单质。
八年级科学下册3.3化学方程式3同步练习新版浙教版36

3.3 化学方程式(3)A 组1.八年级(二)班同学计算30克炭完全燃烧可以得到多少克二氧化碳时,出现了以下几种算式,其中正确的是 (B )A. 1230克=x 44B. 1244=30克xC. 12x =30克44D. 12x =4430克2.在化学反应2A +3B===2C +D 中,已知8克物质A(相对分子质量为32)与12克B 完全反应,则物质B 的相对分子质量为(B )A. 16B. 32C. 48D. 643.在反应2CO +O 2=====点燃2CO 2中,各物质之间的质量比为7∶4∶11,各物质之间分子个数比为2∶1∶2,化学计量数之和为5。
4.某学习小组的同学用KClO 3和MnO 2的混合物加热制取O 2,收集到4.8克O 2后停止加热,称得剩余固体的质量为28.0克,继续加热至不再产生O 2,最终剩余固体质量为23.2克。
试计算(不考虑O 2的损耗):(1)两次生成O 2的总质量为9.6克。
(2)理论上可回收MnO 2的质量(写出计算过程)。
【解】 设生成氯化钾的质量为x 。
2KClO 3=====MnO 2△2KCl +3O 2↑ 149 96 x 9.6克 14996=x 9.6克,x =14.9克。
二氧化锰作催化剂,反应前后质量不变,则可回收到MnO 2的质量为23.2克-14.9克=8.3克。
5.某氯碱工厂排放的尾气里含有有毒的氯气(Cl 2),为防止其污染空气,工厂用20%的NaOH 溶液吸收氯气(反应的化学方程式为Cl 2+2NaOH===NaClO +NaCl +H 2O)。
计算:4吨溶质质量分数为20%的NaOH 溶液,理论上可吸收氯气的质量为多少?【解】 设理论上可吸收氯气的质量为x 。
Cl 2+2NaOH===NaCl +NaClO +H 2O 71 80x 4吨×20%71x =804吨×20%x =0.71吨答:理论上可吸收氯气的质量为0.71吨。
八年级下化学方程式书写、配平专项练习

化学方程式的专项练习姓名:班级:一、①有关氧气的化学性质的化学方程式:1、木炭在氧气中燃烧(完全燃烧,白光无火焰): ______________________________________2、木炭在氧气中燃烧(不充分燃烧):___________________________________________3、硫在氧气中燃烧生成二氧化硫(深蓝色火焰,空气中淡蓝色火焰)___________________________4、铁在氧气中燃烧生成四氧化三铁(火星四射):___________________________________________5、红磷在氧气中燃烧生成五氧化二磷(大量白烟):_________________________________________6、镁在氧气中燃烧生成氧化镁(耀眼白光):___________________________________________7、铝在氧气中燃烧生成氧化铝(常温下也可反应):________________________________________8、氢气在氧气中燃烧生成水(淡蓝色火焰):___________________________________________9、甲烷(CH4)在空气中燃烧生成二氧化碳和水(蓝色火焰): _______ _________________________10、电解水的试验:___________________________________________实验室制取氧气的化学方程式:1、加热高锰酸钾制氧气:___________________________________________2、氯酸钾与二氧化锰共热制氧气:___________________________________________3、过氧化氢和二氧化锰混合制氧气: __________________________________________工业制取氧气的方法:利用不同的沸点分离氮气和氧气。
八年级科学下册3.3化学方程式习题2浙教版

《第3节化学方程式》习题一.选择题(共20小题)1.(2013•株洲)某纯净物X在空气中燃烧,反应的化学方程式为:3X+2O 22CO+CO2+3H2O,则X的化学式(分子式及有机物的结构简式等都可称为化学式)为()A.C3H6B.C H3OH C.H CHO D.H COOH 2.(2013•自贡)某密闭容器中有X、氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表.根据表中信息,判断下列说法正确的是()物质X O2CO2H2O反应前质量/g167010反应后质量/g0待测4536A.该反应为置换反应 B。
X中一定含有碳、氢两种元素C.表中“待测”值为5 D.反应生成的CO2和H2O的质量比为45:36 3.(2013•昭通)同学们对化学反应方程式:C+O 2CO2有下面的四种说法,其中错误的是()A.B.C.D.4.(2013•永州)硝酸是一种具有强氧化性的酸,它不仅能与活泼金属发生反应,也能与许多不活泼金属发生反应.其中金属铜与稀硝酸反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)+2X↑+4H2O,则X的化学式为()2A.N O2B.N O C.N2O D.N2O4 5.(2013•潍坊)现有10gA和足量的B混合加热,A与B发生化学反应,10gA完全反应后生成8gC和4gD,则参加反应的A与B的质量比是()A.5:1B.4:1C.2:1D.1:1 6.(2013•泰安)关于化学方程式CH4+2O2CO2+2H2O的描述正确的是( )A.甲烷加氧气在点燃条件下,反应生成二氧化碳和水B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水C.1个CH4分子和2个O2分子在点燃条件下,生成1个CO2分子和2个H2O分子D.1 g CH4和2 g O2在点燃条件下,生成1 g CO2和2 g H2O7.(2013•衢州)表示氢原子,表示氧原子,它们组成的分子发生了如图所示的反应.关于该反应的说法不正确的是()A.该反应属于化合反应B.反应前后元素种类没有改变C.原子在化学反应中不能再分D.反应前后分子的种类没有改变8.(2013•南京)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示:下列说法正确的是( )A.丙可能是单质 B。
初中化学式练习及答案

ZnCO3
锰酸钾
K2MnO4
碳酸钙
CaCO3
碳酸铜
CuCO3
氯酸钾
KClO3
碳酸镁
MgCO3
碳酸铵
(NH4)2CO3
硫酸铜
硝酸银
氯化银
硝酸铵
氯化铵
硫酸铵
碳酸钾
碳酸锌
碳酸钠
高锰酸钾
碳酸钡
碳酸铜
锰酸钾
碳酸钙
碳酸铵
氯酸钾
碳Hale Waihona Puke 镁化学式练习(一)答案一、单质:
氟气
F2
氦气
He
磷
P
银
Ag
钠
Na
氯气
Cl2
氖气
Ne
镁
Mg
钡
Ba
锰
Mn
碘
I2
氩气
Ar
铝
Al
钙
Ca
铂
Pt
氧气
O2
碳
C
铁
Fe
汞
Hg
氮气
N2
硅
Si
铜
Cu
铅
Pb
氢气
H2
硫
S
锌
Zn
钾
K
二、氧化物:
水
H2O
五氧化二磷
P2O5
氧化铁
Fe2O3
二氧化硫
SO2
氧化镁
MgO
氧化亚铁
FeO
三氧化硫
SO3
氧化钙
CaO
四氧化三铁
Fe3O4
二氧化碳
CO2
氧化锌
ZnO
氧化铜
CuO
一氧化碳
CO
氧化铝
Al2O3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学基础知识练习(3)
1.可能用到的相对原子质量
H- N- C- O- Na- Cl- S-
K- Fe- Ca- Cu- Ag- Zn- Ba-
2.求下列物质的相对分子质量
(1)10H2O:_______________________ (2)HCl:_________________________ (3)H2SO4:_______________________ (4)CaCO3:_______________________ (5)Na2CO3:______________________ (6)CuSO4:_______________________ (7)AgCl:________________________ (8)CaSO4·2H2O:__________________ (9)C6H12O6:_____________________ (10)(NH4)2SO4:___________________ (11)KClO3:______________________ (12)NH4HCO3:____________________ 3.在北方家庭蒸馒头常用到纯碱,它的晶体(Na2CO3 ·10H2O )的相对分子质量
是。
计算组成该化合物各元素的质量比。
4.求NH4NO3中各元素的质量比。
5.在食盐中加入适量的碘酸钾(KIO3),可以有效地预防碘缺乏症。
⑴根据碘酸钾的化学式计算其中碘元素的质量百分含量为。
⑵计算该化合物中碘元素的质量分数。
6.多少克Fe3O4中的铁元素的质量跟320克Fe2O3中的铁元素的质量相等?
7.阿司匹林仅含氢、氧、碳三种元素,质量分数分别为4.5%、35.5%、60%,测得其相对分子质量为180,求阿司匹林的化学式(按C、H、O顺序排列)。
8.4.6 g某有机物在氧气中完全燃烧,测得生成CO2的质量为8.8 g,生成H2O 为
5.4克,试确定该有机物的化学式。
