第十二章氮族元素
氮族元素PPT课件全文

(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
氮族元素ppt 人教课标版

3.NO2 红棕色,有刺激性,有毒的气体,溶于 水,跟水反应。 (l) NO2不能用排水法收集,只能用排空气法。 (2) NO2具有氧化性,可使KI淀粉试纸变蓝, 鉴别NO2和溴蒸气不能用淀粉KI试纸。可用加水 振荡法或加AgNO3溶液法。 (3)氮的氧化物都是大气污染物,其中NO2是 造成光化学污染的主要因素。
二、氮的氧化物 十l +2 +3 +4 +5 +6
1.五种正价,六种氧化物: N2O、NO、N2O3、NO2、N2O4、N2O5,只有N2O3 、
N2O5, 分别属于HNO2 和 HNO3的酸酐。
2.NO 无色有毒的气体,难溶于水,主要表 现还原性。 2NO+O2=2NO2(红棕色)(NO检验方法) 故:NO与 O2不能共存,收集NO只能用排水法 不能用排空气法。
(3)NO、O2混合气体溶于水用方程式 4NO+3O2+2H2O=4HNO3讨论分析计算 (4)NO2、NO、O2三种混合气体通入水中先用方程式: 3NO2+H2O=2HNO3+NO 求出NO2和水反应生成的NO,然后按(3)法进行分析 计算。
三、磷
2.P2O5 白色团体,易吸水,是一种酸性固 体干燥刑,属酸性氧化物
读一本好书,就是和许多高尚的人谈话。 ---歌德 书籍是人类知识的总结。书籍是全世界的营养品。 ---莎士比亚 书籍是巨大的力量。 ---列宁 好的书籍是最贵重的珍宝。 ---别林斯基 任何时候我也不会满足,越是多读书,就越是深刻地感到不满足,越感到自己知识贫乏。 ---马克思 书籍便是这种改造灵魂的工具。人类所需要的,是富有启发性的养料。而阅读,则正是这种养料。 ---雨果 喜欢读书,就等于把生活中寂寞的辰光换成巨大享受的时刻。 ---孟德斯鸠 如果我阅读得和别人一样多,我就知道得和别人一样少。 ---霍伯斯[英国作家] 读书有三种方法:一种是读而不懂,另一种是既读也懂,还有一种是读而懂得书上所没有的东西。 ---克尼雅日宁[俄国剧作家・诗人] 要学会读书,必须首先读的非常慢,直到最后值得你精读的一本书,还是应该很慢地读。 ---法奇(法国科学家) 了解一页书,胜于匆促地阅读一卷书。 ---麦考利[英国作家] 读书而不回想,犹如食物而不消化。 ---伯克[美国想思家] 读书而不能运用,则所读书等于废纸。 ---华盛顿(美国政治家) 书籍使一些人博学多识,但也使一些食而不化的人疯疯颠颠。 ---彼特拉克[意大利诗人] 生活在我们这个世界里,不读书就完全不可能了解人。 ---高尔基 读书越多,越感到腹中空虚。 ---雪莱(英国诗人) 读书是我唯一的娱乐。我不把时间浪费于酒店、赌博或任何一种恶劣的游戏;而我对于事业的勤劳,仍是按照必要,不倦不厌。 ---富兰克林 书读的越多而不加思索,你就会觉得你知道得很多;但当你读书而思考越多的时候,你就会清楚地看到你知道得很少。 ---伏尔泰(法国哲学家、文学家) 读书破万卷,下笔如有神。---杜甫 读万卷书,行万里路。 ---顾炎武 读书之法无他,惟是笃志虚心,反复详玩,为有功耳。 ---朱熹 读书无嗜好,就能尽其多。不先泛览群书,则会无所适从或失之偏好,广然后深,博然后专。 ---鲁迅 读书之法,在循序渐进,熟读而精思。 ---朱煮 读书务在循序渐进;一书已熟,方读一书,勿得卤莽躐等,虽多无益。 ---胡居仁[明] 读书是学习,摘抄是整理,写作是创造。 ---吴晗 看书不能信仰而无思考,要大胆地提出问题,勤于摘录资料,分析资料,找出其中的相互关系,是做学问的一种方法。---顾颉刚 书犹药也,善读之可以医愚。 ---刘向 读书破万卷,胸中无适主,便如暴富儿,颇为用钱苦。 ---郑板桥 知古不知今,谓之落沉。知今不知古,谓之盲瞽。 ---王充 举一纲而万目张,解一卷而众篇明。 ---郑玄
氮族元素教案范文

氮族元素教案范文一、教学目标:1.理解氮族元素的特点和周期表中的位置。
2.掌握氮族元素的性质、用途和产生的环境问题。
3.了解氮族元素在生活中的重要性,并能运用所学知识解决实际问题。
二、教学重点:1.氮族元素的特点和周期表中的位置。
2.氮族元素的性质和用途。
3.氮族元素在生活中的应用和环境问题。
三、教学内容:1.氮族元素的特点和周期表中的位置。
(1)氮族元素包括氮、磷、砷、锑和铋,它们位于周期表的第15族。
(2)氮族元素的原子结构特点:外层电子结构为ns2np3(3)氮族元素的原子半径增大、电离能减小、电负性和氧化态的正负两种。
2.氮族元素的性质和用途。
(1)氮:是一种气体,具有无色、无味、不可燃的性质。
在大气中占比最大,广泛应用于农业、化工和生物工程等领域。
(2)磷:是一种固体,具有多种颜色和形态。
广泛应用于农业、医药和化工等领域。
(3)砷:是一种固体,具有金属和非金属的性质。
广泛应用于化工和医药等领域。
(4)锑:是一种金属,具有脆性和导电性。
广泛应用于化工、电子和冶金等领域。
(5)铋:是一种金属,具有高密度和熔点。
广泛应用于化工、电子和冶金等领域。
3.氮族元素在生活中的应用和环境问题。
(1)氮族元素在农业中的应用:作为化肥、杀虫剂和农药等,提高农作物产量和质量。
(2)氮族元素在化工中的应用:用于制造肥料、药品和塑料等,满足人们对生活和工业产品的需求。
(3)氮族元素的环境问题:过量使用氮肥会导致土壤酸化、水体富营养化和大气污染等,对环境造成负面影响。
四、教学方法:1.启发式教学法:通过引导学生提出问题、讨论和实践探究,培养学生的思维能力和创新意识。
2.实验教学法:通过做实验观察氮族元素的性质变化,培养学生的动手操作能力和科学思维能力。
3.图片、视频和实物展示法:通过展示图片、视频和实物,直观地展示氮族元素的应用和环境问题。
五、教学过程:1.思维导图展示氮族元素的特点和周期表中的位置。
2.实验观察氮气和磷的性质变化。
氮族元素说课稿

说课稿:氮族元素何文惠一.考纲解读氮族元素及其化合物所涉及的知识内容极其丰富,与工农业生产、环境保护及日常生活联系紧密,在历年高考中均有所体现。
本章考查的重点是:1.了解氮族元素的单质及某些氧化物、氢化物的性质。
2.了解氮族元素性质的相似性及递变规律。
3.了解氨气、铵盐的性质,掌握氨气的实验室制法和铵根离子的检验。
4.掌握硝酸的化学性质及用途,了解硝酸的工业制法。
5.了解氮的氧化物对大气的污染及防治,以及含磷洗涤剂对环境和人类健康的影响。
6.初步了解常见化肥的基本性质。
《氮族元素》是在继《卤素》、《硫和硫的化合物环境保护》之后必须学好的又一章重要的非金属元素及其化合物知识。
氮族元素是元素及其化合物知识中的重点内容。
《氮族元素》有“三多”,即:新物质多,涉及氮和磷元素的单质及化合物共有二十多种;化学反应多,且以氧化还原反应为主;计算题型多,包括氮氧化合物与水反应、工业制硝酸、硝酸与金属反应等。
氮族元素的有关知识是历年高考命题的热点,常以氮、磷及化合知识为载体与化学基本概念,基本理论、化学实验及化学计算有机结合,来考查学生的综合分析问题的能力。
氮、磷是生物体中不可缺少的元素,在植物生命活动中占有极其重要的地位,与生物学科有点紧密的联系。
农业生产中常使用氮肥,其生产过程中常产生氮的氧化物给环境带来严重的污染,而且大量含氮、磷化肥的生产和使用及工业废水的排放,会使水体富营养化,容易形成“水华”或“赤潮”。
高考主要考点有:1.氮气的分子结构及其稳定性。
2.氨的分子结构及其水溶性和化学性质。
3.铵盐与铵根离子的检验与推断。
4.硝酸的化学特性;硝酸的有关计算。
5.白磷的分子结构及保存方法。
白磷和红磷的性质、同素异形体;磷及其化合物之间的转化关系;6.磷酸与碱反应产物的判断及环境保护等知识。
7.氨、铵盐、NO、NO2、HNO3等物质的性质及相互转化关系;8.NO、NO2、O2等物质组成的混合气体与水反应的有关计算;9.氮及其化合物的有关反应为载体,考查对氧化还原反应、化学反应速率和化学平衡、电离、水解等概念和理论的掌握程度及应用能力;氧化还原反应方程式的配平等。
化学课件《氮族元素》优秀ppt 人教课标版

2.NO 无色有毒的气体,难溶于水,主要表 现还原性。
2NO+O2=2NO2(红棕色)(NO检验方法) 故:NO与 O2不能共存,收集NO只能用排水法 不能用排空气法。
3.NO2 红棕色,有刺激性,有毒的气体,溶于 水,跟水反应。
(l) NO2不能用排水法收集,只能用排空气法。 (2) NO2具有氧化性,可使KI淀粉试纸变蓝, 鉴别NO2和溴蒸气不能用淀粉KI试纸。可用加水 振荡法或加AgNO3溶液法。 (3)氮的氧化物都是大气污染物,其中NO2是 造成光化学污染的主要因素。
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
第十二章 氮族、碳族和硼族元素(一)

微波等离子体
H2 H2*解离、吸附 2H(a)
表面反应
NH3
(2)性质: 物性:易液化 ,常温下加压(9.9atm)或常压下冷 却至-33℃即液化。液氨也是一种良好的溶剂,能 溶解碱金属和碱土金属,有微弱解离。
2NH3(l) NH +NH 4 2 K (NH3,l)=10-30(-50℃)
(b)金属单质: ① 对浓HNO3,无论金属活泼与否,还原产物均 为NO2, 如Cu、Zn等。 ②对稀HNO3,被不活泼金属(如Cu)还原为NO。 ③对稀HNO3,被活泼金属(如Zn)还原为N2O。 ④对很稀HNO3,被活泼金属(如Zn)还原为NH3, 在过量酸中形成NH 4 。
(4)硝化作用,HNO3能与一些有机化合物发生硝化反应, 硝基化合物一般为黄色 。
2
2
2
3
2
2
2
2
3
2
氧化性: 2NO +2I-+4H+→2NO +I2+2H2O (Fe2+ Fe3+等)此反应可用于鉴定I-,和定量测 定亚硝酸盐。 +→2Mn2++5NO +3H O 还原性:2MnO 4 +5NO 2 +6H 3 2
2
④NO 是一种很好的配体。 2 如 用Na3[Co(NO2)6]作鉴定试剂,鉴定K+,若溶 液中有K+,会生成 K2Na[Co(NO2)6]↓(金黄色) 注意:亚硝酸盐均具有毒性,进入体内后易转化 为致癌物质亚硝胺(有机胺)。
特性:①H3PO4 有很强的配位能力,能与许多金属离子 形成化合物。②H3PO4 变热会发生缩合作用,形成多种 缩合酸。
高中知识点规律大全《氮族元素》

高中知识点规律大全《氮族元素》氮族元素是元素周期表中第15族的元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
氮族元素具有共同的电子配置ns2np3,其中n 代表主量子数。
1.氮(N):-原子序数:7- 原子半径:65 pm- 密度:1.25 g/cm³-熔点:-210.1°C-沸点:-195.8°C氮是一种无色、无味、无毒的气体,在常温下存在于大气中。
它是空气中的主要成分,占据了78%的体积比例。
氮具有高度的化学稳定性,因此在自然界中很少以单质形式存在。
氮气可以通过固体氨的热分解或通过空气经过液氮的冷却得到。
氮与氢可以形成氨气(NH3),它是一种无色气体,具有强烈的刺激性气味。
氨气是一种重要的化学试剂,广泛用于农业和工业生产中。
氮还可以与氧形成氮氧化物(NOx),它们是空气污染的主要成分之一2.磷(P):-原子序数:15- 原子半径:100 pm- 密度:1.82 g/cm³-熔点:44.1°C-沸点:280.5°C磷是一种多态元素,有黑磷、红磷和白磷等多种形式。
白磷是最常见和最活泼的形式,它是一种蜡状固体,具有强烈的气味。
白磷在空气中容易燃烧,产生白烟和脱氧酸气。
红磷是一种比较稳定的形态,它不易燃烧。
磷是生物体中的关键元素之一,它在骨骼和牙齿的形成中起着重要作用。
磷还是DNA、RNA和ATP等核酸和能量储存分子的组成成分。
3.砷(As):-原子序数:33- 原子半径:119 pm- 密度:5.776 g/cm³-熔点:817.0°C-沸点:613.0°C砷是一种灰色金属,常形成硫化物矿物,如砷矿。
纯砷以三价形式存在,它具有金属和非金属两类性质。
砷的化合物有毒,并且对人体和环境有害。
砷化氢是一种无色气体,具有强烈的臭酸味。
4.锑(Sb):-原子序数:51-原子质量:121.760- 原子半径:140 pm- 密度:6.687 g/cm³-熔点:630.63°C-沸点:1587°C锑是一种蓝白色的金属,具有良好的导电性和导热性。
无机课后习题答案12-17、20

3Cu+8HNO3(稀)==3Cu(NO3)2+2NO+4H2O (4)实验室制备 NO2 的反应为: Cu+4HNO3==Cu(NO3)2+2NO2+2H2O
12.3 解:N2 分子中氮氮三键键能很大,不易参加反应;而 NH3 分子中的 N—H 键则键能较小,易 断裂参加反应,故常作为制备含氮化合物的原料。
市售硝酸的百分比浓度为:68%;密度为:1.4g/cm-3;;体积摩尔浓度为:15.1mol/cm-3。市售 磷酸的百分比浓度为:85%密度为 1.6g/cm-3; 体积摩尔浓度为:13.9mol/cm-3。 12.25 解:向 SbCl5 溶液中通入 H2S 时,伴随 Sb2S5 的生成,溶液的酸度提高,Sb5+氧化能力提高而 与 H2S 发生氧化还原反应,有 Sb2S3 和 S 沉淀生成。 2Sb5++5H2S==Sb2S5+10H+ 2Sb5++5H2S==Sb2S3+2S+10H+ 若制较纯的 Sb2S5,应在碱性条件下先得到 SbS43-,再小心加入稀酸即可。 2Sb5++5S2-==Sb2S5 Sb2S5+3S2-==2SbS432SbS43-+6H+==Sb2S5+3H2S 12.26 解:Sb2S3 是两性氧化物,故可以和碱性氧化物反应。反应方程式为: 3Na2S+Sb2S3==2Na3SbS5 而 Bi2S3 没有酸性,不溶于碱金属硫化物中。 Sb2S3 具有还原性,它们可以和具有氧化性的多硫化物反应生成硫代锑酸盐,方程式为: Sb2S3+(NH4)2S2==(NH4)2SbS4 由于 Bi2S3 中 Bi(III)的还原性极若,故不和多硫化物反应。 12.27 解:并不矛盾。碱性条件下:E(AsO43-/AsO2-)=-0.68V,E(I2/I-)=0.5355V,故碘单质可以
氮族元素

单 质 氧 化 性 减 弱
最 高 价 氧 化 物 对 应 水 化 物 的 酸 性 减 弱
氢 化 物 的 稳 定 性 减 弱
氮及其化合物
氮族元素 氮气 NO和NO2 硝酸
物质类别 单质 氢化物 氧化物 含氧酸 碱 盐 络合物 有机物
化学式或微粒符号 N2 NH3 N2O、 NO、 N2O3、 NO2、 N2O4、N2O5 HNO3 NH3.H2O NH4+ NO3Ag(NH3)2OH C6H5NO2 CH3C6H2(NO2)3
是一种红棕色、有刺激性气味的有毒的气体; 易液化;密度比空气大。
溶于水跟水反应生成硝酸和一氧化氮。强氧化 氨和铵盐 性;与N2O4(无色)可相互转化。
磷
3NO2 + H2O === 2HNO3 + NO
氮的氧化物---NO与NO2的性质比较
氮族元素 氮气 NO和NO2 硝酸 与NaOH
NO
NO2
红棕色,刺激性气味 有毒
红磷
加热到416℃ ( 升华后冷却 )
磷的分子结构
1、白磷的分子结构:
氮族元素 氮气 NO和NO2 60° 硝酸
P4 (正四面体,键角为60°)
2、红磷的分子结构:结构复杂(不作要求)
氨和铵盐 磷
磷的化学性质
氮族元素 氮气 NO和NO2 硝酸
两种磷在物理性质上有很大的差异, 但在化学性质基本相同。 点燃 (1)与氧的反应:P + 5O2 = 2P2O5
与O2、H2O 4NO + 3O2 + 2H2O = 4HNO3 4NO2 + O2 + 2H2O = 4HNO3
氨和铵盐 磷
制备
开瓶瓶口有白雾 硝酸的物理性质 挥发性酸用浓硫酸制取 氮族元素 与浓氨水产生白烟 1、 纯硝酸是无色、有刺激性气味的液体 参与化学反应温度不宜过高
氮族元素知识点归纳

氮族元素【知识归纳】 一.氮族元素概况1.概况:N 2是一种无色无味的气体,密度比空气略小,不溶于水。
分子结构式为__ N ≡N ,该化学键很牢固,键能很大,难以破坏,所以通常情况下氮气性质__很稳定 。
2.化学性质:(1)工业合成氨的反应方程式:(2)高温或闪电时与O 2的反应的反应方程式:________________________ (3)点燃时与金属Mg(或Ca, Sr, Ba)的反应方程式:___________________以上反应均为__氮的固定,即将空气中_游离_态的氮气转化为化合态的氮。
三.氮的氧化物:N 2O 、(笑气 麻醉剂)NO 、N 2O 3、NO 2、N 2O 4、N 2O 5注意:N 2O 3是 HNO 2 酸酐;N 2O 5是 HNO 3 酸酐。
其它的氧化物都不是酸酐。
N 2 + 3H 22N H 3N 2+O 2 2NO高温或闪电3M g +N 2M g 3N 2点燃)3Cu(NO注意:2NO 2N2O4(通常情况下NO2气体不是纯净物)2.如何鉴别一瓶红棕色气体是二氧化氮或溴蒸气?(找出尽可能多的方法)①AgNO3 :加入少量硝酸银溶液振荡,若有浅黄色沉淀生成,是溴蒸气,若无浅黄色沉淀生成,是二氧化氮。
(二者的共同现象是红棕色消失)② H2O:加入少量的水后振荡,若红棕色消失,是二氧化氮,若红棕色不消失,是溴蒸气。
③CCl4:加入少量CCl4后振荡,若红棕色消失且CCl4由无色变为橙红色,是溴蒸气。
若红棕色不消失,是二氧化氮。
④降温:冷凝成红棕色液体的是溴蒸气,颜色变浅的是NO2。
不能用湿润的淀粉—KI试纸鉴别二者四.氨气1.概况:氨是一种无色,有刺激性气味的气体,易液化形成液氨,极易溶于水,2.性质:(1)氨水显弱碱性,在溶液中存在如下转化(方程式表示) NH3+H2O NH3·H2O NH4+ +OH—。
氨水密度小于水的密度,所以氨水的浓度越大,密度越小。
第12章 氮族、碳族和硼族元素

氮化学时间表(续)
1908年
1909年 和 , 分
1925年
1928年
W.Ostwald 把NH3经过催化氧化以制取HN03(1901)的 方法扩大为工业规模(由于他在催化方面的成就,获得 1909年诺贝尔化学奖)。
在1913年以前,F.Haber 和 C.Bosch 合作,把氨的 催化合成扩大为大规模的工业过程 (Haber因在“由氮 氢合成氨”方面的贡献,而获得1918年诺贝尔化学奖 Bosch由于他对“化学高压法的发明和发展的贡献”而 享1931年诺贝尔奖,Haber法合成氨,是第一个高压工 业过程)。
明星分子NO
1992年NO被Science评为年度明星分子
广泛存在于各类细胞中独特的信息因子和效应因子,参 与机体心血管系统,神经系统,免疫系统等多方面生理 和病理的活动
掀起NO生物化学、生理学、病理学和药理学研究的热潮
1998年三位科学家因发现NO在心血管系统中的重要 作用获得诺贝尔奖
(2) 二氧化氮(NO2)
N原子外围电子是2S22P3,当2个N原子结合成N2 时,形成一个б键和二个π键。 键能:
2. 固氮
把空气中的N2转化为可利用的氮化合物,叫固氮 (Nitrogen fixation)。如:
CaC2十N2=CaCN2十C Na2CO3十4C十N2=2NaCN十3CO N2十3H2=2NH3
从六十年代开始,人们仿生物固氮的方法,用过渡金 属的有机化合物和N2作用,在常温、常压下生成NH3。 固氮研究的主要原理是:或夺走N2分子中成键轨道中的 电子,或向N2分子反键轨道上加电子,使氮容易发生化 学反应。
(NH4 )3 PO4 3NH3 (g) H3PO4
(NH4 )2 SO4 NH3 (g) NH4HSO4
《高二化学氮族元素》课件

- 工业:合成氨、焊接、气瓶 - 农业:肥料、农药 - 化学:生产氮化物、硝化物,如硝酸铵
磷的应用
- 农业:磷肥、农药 - 工业:太阳能电池、LED、半导体材料 - 医药:治疗肾结石、骨折等疾病
砷的应用和危害
- 工业:染料、涂料、玻璃、农药 - 危害:长期接触砷化物可导致各种癌症和其他疾病
总结
高二化学氮族元素
这是一份关于氮族元素的 PPT 课件。我们将介绍氮族元素的概念、特点、性 质、应用价值以及它们在工业和生物体中的重要性。
概念和特点
氮族元素是第五族元素,包括氮、磷、砷等。这些元素具有电子亲和力小、电负性小、化学活性稳定等 特点,因此具有独特的化学性质。
氮
氮具有很高的稳定性,在自然界中是一种气体。它在生命体中的重要性体现在构成蛋白质、核酸等有机 化合物中。此外,氮气还是一种广泛运用于工业的气体,如合成氨、焊接等。
氮族元素的反应
氮族元素之间是可以相互反应氮和氧可以反应生成 二氧化氮,磷和氧反应会产生五氧化二磷等。
元素 氮 磷 砷
化合物 二氧化氮(N2O) 五氧化二磷(P4O10) 三氧化二砷(As2O3)
应用及危害
氮族元素在生命体中扮演重要的角色,也广泛应用于工业和生活中。例如,氮气广泛用于冶金、化学和 电力行业中;磷化物应用于LED、太阳能电池等产业。然而,它们也可能造成环境污染和生物毒性,需 要注意和严密控制。
工业中的砷化物
砷化物广泛应用于染料、涂料、 玻璃等领域,但长期暴露在砷 化物中会对人类健康造成危害。
磷
磷是一种非金属元素,常见的有磷酸盐矿物。磷具有很高的生物活性,是构成DNA、ATP等分子的重要 元素。此外,磷的化合物广泛用于农业生产、医疗、建筑材料等领域。
高中化学氮族元素知识点
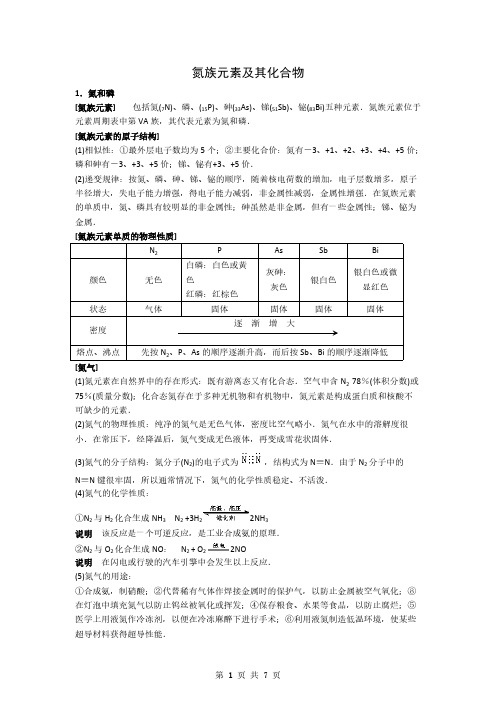
2NO + O2= 2NO2
②NO 中的氮为+2 价,处于中间价态,(工业制 HNO3 原理.在此反应中,
既有氧化性又有还原性
二氧化氮(NO2) 为红棕色、有刺激性气味、有毒的 气体,易溶于水
与 H2O 反应:
3NO2 + H2O=2HNO3 + NO
NO2 同时作氧化剂和还原剂)
2NO (2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO
可缺少的元素.
(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很
小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.
(3)氮气的分子结构:氮分子(N2)的电子式为
N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼. (4)氮气的化学性质:
①N2 与 H2 化合生成 NH3 N2 +3H2
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电,通力根1保过据护管生高线产中敷工资设艺料技高试术中卷0资不配料仅置试可技卷以术要解是求决指,吊机对顶组电层在气配进设置行备不继进规电行范保空高护载中高与资中带料资负试料荷卷试下问卷高题总中2体2资,配料而置试且时卷可,调保需控障要试各在验类最;管大对路限设习度备题内进到来行位确调。保整在机使管组其路高在敷中正设资常过料工程试况1卷中下安,与全要过,加度并强工且看作尽护下可1都关能可于地以管缩正路小常高故工中障作资高;料中对试资于卷料继连试电接卷保管破护口坏进处范行理围整高,核中或对资者定料对值试某,卷些审弯异核扁常与度高校固中对定资图盒料纸位试,置卷编.工保写况护复进层杂行防设自腐备动跨与处接装理地置,线高尤弯中其曲资要半料避径试免标卷错高调误等试高,方中要案资求,料技编试术写5、卷交重电保底要气护。设设装管备备置线4高、调动敷中电试作设资气高,技料课中并3术试、件资且中卷管中料拒包试路调试绝含验敷试卷动线方设技作槽案技术,、以术来管及避架系免等统不多启必项动要方高式案中,;资为对料解整试决套卷高启突中动然语过停文程机电中。气高因课中此件资,中料电管试力壁卷高薄电中、气资接设料口备试不进卷严行保等调护问试装题工置,作调合并试理且技利进术用行,管过要线关求敷运电设行力技高保术中护。资装线料置缆试做敷卷到设技准原术确则指灵:导活在。。分对对线于于盒调差处试动,过保当程护不中装同高置电中高压资中回料资路试料交卷试叉技卷时术调,问试应题技采,术用作是金为指属调发隔试电板人机进员一行,变隔需压开要器处在组理事在;前发同掌生一握内线图部槽 纸故内资障,料时强、,电设需回备要路制进须造行同厂外时家部切出电断具源习高高题中中电资资源料料,试试线卷卷缆试切敷验除设报从完告而毕与采,相用要关高进技中行术资检资料查料试和,卷检并主测且要处了保理解护。现装场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
氮族元素PPT课件

实验室:氯化铵和亚硝酸钠饱和溶液相互作用 NH4Cl + NaNO2 NaCl + NH4NO2 NH4NO2 煮沸 N2(g) + 2H2O
2020/1/6
8
2、氮的氢化物
-3 -2 -1
-1/3
NH3 N2H4 NH2OH HN3
-3 -3
最大配
位数 4
6
-3 (-3) 两性 碱性
氨 膦 胂 SbH3 BiH3 碱性减弱,稳定性下降
氮、磷是非金属元素,砷和锑为准金属,铋是金属元素
氮族价电子层结构是ns2np3
最高氧化数为+5;与电负性较大元素结合氧化值主要是+3和+5 自上而下,+3化合物稳定性增强,+5的化合物稳定性减弱
与有空轨道的化合物直接化合,如:F3B NH3、NH4+ 2)取代反应 (氨解反应)
Na + 2 NH3 623K 2NaNH2 + H2
Ca + 2 NH3
CaNH + H2
2Al + 2 NH3
2AlN + 3H2
COCl2 + 2NH3 = CO(NH2)2 + 2HCl
2020/1/6
11
3)氧化反应
氢化物的酸碱性取决于与氢直接相连原子上
的电子云密度, 电子云密度越小,酸性越强。
(1)氨和铵盐
NH3分子中N采取不等性sp3杂化,三角锥形分子结构 NH3制备
实验室: (NH4)2SO4 + CaO → CaSO4 + H2O + NH3 2NH4Cl Ca(OH)2 CaCl2 2H2O 2NH3 (g)
《氮族元素》课件

03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
【精品】氮族元素概述

氮族元素概述王振山一、氮族元素通性周期系ⅤA族包括N、P、As、Sb、Bi五种元素称为氮族元素。
氮在地壳中的丰度为0.0046%,氮主要以单质存在于大气中;磷在地壳中的丰度为0。
118%,磷主要以磷酸盐形式分布在地壳中;砷、锑、铋是亲硫元素,它们在自然界中主要以硫化物矿形式存在。
⑴、结构:①、有获得3个电子成为-3氧化态而达到稀有气体结构的趋势,但要完全夺得3个电子成为—3价离子则困难,只有电负性较大的N和P在个别化合物中能成为-3价离子,如Li3N,Mg3N2,Na3P,Ca3P2等,但只能存在于干态,因N3-,P3—离子半径大,变形性强,遇水会强烈水解生成NH3和PH3.本族元素与电负性较小的元素化合时,可形成-3氧化态的共价化合物。
②、本族元素与电负性较大元素化合时,主要形成氧化数为+3或+5的化合物,这与共价层电子相关,即前者相当于用3个np电子成键,而后者则用2个ns电子和3个np电子成键。
本族元素从上→下,+5氧化态化合物稳定性递减,而+3氧化态的稳定性递增。
2、性质变化规律NPAsSbBi单质物态:气固固固固非金属元素准金属元素金属元素I1──────────────────〉减小X──────────────────>减小EA1─────────────────>递增,负值减小N在本族中半径最小,电负性最大,价电子层数为2,故具有一些与本族其它元素不同的特性。
如形成化合物时,只有2s、2p轨道可用,故最高配位数为4;r小,故易形成重键。
共价半径(单键)/pm:N,70;O,66;F,64;(双键)/pm:N,60;O,55;F,(54);(叁键)/pm:N,55;O,(51);—与氧族元素及卤素比较⑴、本族元素的金属性更强,同族从上到下非金属性向金属性过渡完整。
⑵、ⅥA、ⅦA族元素均存在8-族数的负氧化态离子,本族则只有N和P两元素在固态下个别化合物中有—3氧化态离子,As,Sb,Bi不形成负离子。
十二章氮族元素

(1)强还原性
P4(s) + 5O2(g) = P4O10(s) △rH = -298.3kJ·mol-1
部分能量以光能形式转化,40℃,P4自燃 P4(s )+ 6Cl2 →4 PCl3 或(PCl5) P4(s) + 3S = P4S3 工业制火柴
3P + 5HNO3+2H2O = 3H3PO4 + 5NO↑
一、主要氢化物比较:教材P81表3-5
氢化物 NH3 PH3 AsH3 SbH3
分子结构 sp3
纯p轨道
m.p.和b.p.
><
<
△f G / kJ·mol-1
-16.48 18.24 68.9
Lewis碱性 强
BiH3
弱
§3-3 氮族元素氢化物
一、主要氢化物比较:教材P81表3-5
氨 膦胂
氢化物 NH3 PH3 AsH3 SbH3 BiH3 键角(ºC) 107 93 91.8 91.3
P(III)、 As (III)、 Sb (III)、 Bi (III) 稳定性增大
P(V)、 As (V)、 Sb (V)、 Bi (V)
稳定性增大
第四、第六周期高价态不稳定、强氧化性
(次周期性、6s2惰性电子对效应,) p102
-2
-2 +1 +1
N2H4 P2H4 N2O H3PO2 Li3N、Mg3N2、 Na3P遇水强烈水解成NH3、PH3
NH H O(2.20) 32 AsH (1.62) 3 SbH (1.53) 3 PH (0.089) 3
NH 24
(2.31)
NH OH 2
(3.04)
氮族元素完整版

三、氨
1.氨分子的结构
键角:109°48’
思考:氨分子 为极性还非极 性分子? 极性分子,因 为分子内正负 电荷中心不重 合,偏移。
三角锥形 正四面体
2.氨气的物理性质
氨气是无色、有剌激性气味的气体,比空气轻,极易 溶于水和易液化。
※常见气体的溶解性:
NH3 HCl SO2 H2S Cl2 CO2 700 500 40 2.6 2 1
单 质 氧 化 性 减 弱
最 高 价 氧 化 物 对 应 水 化 物 的 酸 性 减 弱
氢 化 物 的 稳 定 性 减 弱
3、化学性质的具体表现
(1)最高价氧化物所对应的水化物的酸性 HNO3 > H3PO4 > H3AsO4 (2)气态氢化物的稳定性 NH3 > PH3 > AsH3
4、单质的性质:
一氧化氮、二氧化氮的反应
氮氧化物溶于水的有关计算
(1)NO2溶于水:
3NO2+H2O=2HNO3+NO
(2)NO2、O2的混合气体溶于水:
4NO2+O2+2H2O=4HNO3
(3)NO、O2的混合气体溶于水:
4NO+3O2+2H2O=4HNO3
(4)NO2、NO、O2的混合气体溶于水:
分子:NH3、H2O、NH3· 2O H 离子:NH4+、OH-、H+
◆氨水中的粒子
◆学会比较
物质分类 构成微粒 主要性质 存在条件
分子: H2O 、NH3 、NH3· 2O H
离子: NH4+、OH- 、H+
液氨 氨水
(既不是电解质也
纯净物 (非电解质) 混合物 不是非电解质)
NH3分子 不具有碱性 常温常压下 不能存在 (致冷剂) NH3 H2O NH3·2O H NH4+ OH- H+ 具有弱碱性 常温常压下 可存在
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H AsO (1.914)
3
4
SbO (1.91)
5
1 0
N O(0.94) 2
B iO +(0 .9 6 )
H PO (-0.51) 32
N O -(1.27)
3
S b O +(0 .6 3 )
H AsO (0.744)
3
3
Z
Bi (-0.83)
2
-1
Bi O (-1.38) 23
H P O (-1.13)
相应的氮化物
Ti
6L N 2 i 23 L N 2i
例4 与一些d过渡金属生成配合物: [Ru(NH3)3(N2)]2+ [(NH3)5Ru-N2-Ru(NH3)5]4+
N2有未成对电子,可配位给过渡金属离子, 本身有空轨道,Ru2+ 的d电子反馈到N2的π* 空
轨道,形成d →π*反馈π键, 使N-N键级 ↘,N2 分子被“活化”——
2.鉴定
2.1 气室法与碱共热放出氨气。晶体受热易分 解。
NH4Cl (加热) = NH3↑ + HCl ↑ (NH4)2SO4 (加热)= NH3↑ + NH4HSO4 强氧化性的酸的铵盐受热时,可发生氧化还原
反应而分解
例:NH4NO3 ==
N2O
+
2 H2O
(NH4)2Cr2O7 == N2 ↑+ Cr2O3 +
第十二章氮族元素
P(III)、 As (III)、 Sb (III)、 Bi (III) 稳定性增大
P(V)、 As (V)、 Sb (V)、 Bi (V)
稳定性增大
第四、第六周期高价态不稳定、强氧化性
(次周期性、6s2惰性电子对效应,) p102
-2
-2 +1 +1
N2H4 P2H4 N2O H3PO2 Li3N、Mg3N2、 Na3P遇水强烈水解成NH3、PH3
φ(As/AsH4+)= - 0.54V φ(Sb/SbH4+)= -0.51V 碱性介质
φ(N2/NH3)= -0.73V φ(P/PH3)= -0.87V
φ(As/AsH3)= - 1.43V
φ(Sb/SbH3)= -1.34V
还原性AsH3 > SbH3 >PH3 >NH3
△ G° / F(V)
NH4Cl + 3Cl2 = 4HCl + NCl3 ②氨解反应:
NH3以-NH2(氨基)或>NH2(亚氨基)取代 其它化合物中的原子或原子团:
例1: Cl-Hg-Cl + 2NH3 = Cl-Hg-NH2↓+NH4Cl 氯化氨基汞
对比“水解反应”:
Cl-Hg-Cl + H-OH = Cl-Hg-OH + HCl 氯化羟基汞
请你评价下面的二个方程式是否矛盾?
2H2S(g) +3 I2 → 2HI + S
8H H 2 S I4 (浓 O ) H 2 S 4 I2 42 O H
四、氨的衍生物
N氧化态 ФA /Ⅴ
ФB /Ⅴ
联氨NH2-NH2 -2
N2H5+/NH4+
1.27
N2/N2H4
-0.23
N2H4/NH3
0.11
“固氮工程”。
例如:[Ru(NH3)3(N2)]2+ [(NH3)5Ru-N2-Ru(NH3)5]4+
钌的抗肿瘤药物
NAMI-A的分子结构
Na2[{trans-RuCl4(dmso-S)}2(m-L)] 的分子结构
2002年9月,在荷兰的阿姆斯特丹进入了二期临床
我 们 刘杰,计亮年等
合
成 部分配合物具有
氮 族 元 素 的 △ G ° / F —Z 图
二、氨及其衍生物
1.氨NH3(Ammonia) 1.1 分子结构
μ(NH3)<μ(H2O)
1.47D
1.85D
1.2 化学性质
(1)强还原性(△G/F-Z图)
酸介质
φ(N2/NH4+)= 0.27V 碱介质
φ(N2/NH3)= -0.73V
例:4 NH3 + 5 O2 = 4 NO + 6 H2O ΔrH = - 903.7 kJ. mol-1
例2 Cl CO
+ 4 H NH2
Cl
光气(二氯碳酰)
H2N C
O+
H2N
尿素
NH4Cl
(5) 弱碱性(质子碱-Lewis碱)
NH3 + H2O = NH4+ + OHK b = 1.8×10-5
三、铵盐(酸性,热稳定性,还原性)
1.水解
NH4+ + H2O → NH3 + H3O+ 酸1 碱2 碱1 酸2
2.1. 白磷 P4 分子晶体,结构单元:P4, 四面体,键角60° 张力大,易断键→白磷化性活泼。
(1)强还原性
P4(s) + 5O2(g) = P4O10(s) △rH = -298.3kJ·mol-1
部分能量以光能形式转化,40℃,P4自燃 P4(s )+ 6Cl2 →4 PCl3 或(PCl5) P4(s) + 3S = P4S3 工业制火柴 3P + 5HNO3+2H2O = 3H3PO4 + 5NO↑ 2P + 5CuSO4+ 8H2O = 5Cu + 2H3PO4 +5H2SO4 11P + 15CuSO4+ 24H2O = 5Cu3P + 6H3PO4 +15H2SO4
2NH3+ 3Cl2 = N2+ 6 HCl
2NH3(ag) + 3H2O2 → N2(g) + 6H2O
2 N 3 (+ H g 3 C ) u O 3 C (+ s u N 2 ( )( + g H s 2 O ) ) (
(2)Lewis 碱性(络合作用)
Ag+ + 2 NH3 = [Ag(NH3)2]+ (Cu2+、Co2+、Co3+、Ni2+ …)
液氨 水
2AgNO3 + BaCl2
K + x NH3(l) = K+ + [e(NH3)x]稀溶液蓝色,浓溶液青铜色。
金属液氨溶液:导电(似金属)
金属液氨溶液:高浓度时是强的还原剂,
Na + 2NH3 = Na+ + 2 NH2- + H2↑ Na + xNH3 = Na+ + e (NH3)x碱金属的液氨溶液是产生电子的试剂
氨 膦胂
氢化物 NH3 PH3 AsH3 SbH3 BiH3 键角(ºC) 107 93 91.8 91.3
分子结构 sp3
纯p轨道
m.p.和b.p. > <
<
△f G / kJ·mol-1 -16.48 18.24 68.9
Lewis碱性 强
弱
还原性酸性介质 φ(N2/NH4+)= 0.27V φ(P/PH4+)= -0.03V
对比 :O2、F2 、Ne2: E (2px) < E (2p)
分子轨道能级次序
3.化性
R.T. N2很不活泼,在化学反应中常作保护气体。 高温下,N≡N键断开, N电负性大 → N2显出化学活泼性。
例 1: N2O2 放 电2NO
例 2: N23H 2 催 化 剂 2N3 H
Mg
例3. Ba + N2 Al
BF3 +
NH3 =
Lewis acid Lewis base
F3B←NH3 酸碱加合物
H2O + NH3 = NH4+ + OHHCl(g) + NH3(g) = NH4Cl(s)
(3)液氨自偶电离
NH3(l) + NH3(l) = NH4+ + NH2240K, K =10-29, 很小 → 液氨是电不良导体
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5
Sb2S3, Sb2S5
Bi2S3 3.2 As、Sb、Bi与N、P的比较
N、P 氧化态 -3常见
As、Sb、Bi +3、+5为主
杂化态 sp、sp2、sp3
类似 H2O+H2O = H3O+ + OH- 295K, Kw =1.0×10-14 ∵μ(NH3) < μ(H2O) ∴极性弱的化合物在液氨中溶解度↑
例1 水中溶解度 AgF > AgCl > AgBr > AgI
液氨中溶解度 AgF < AgCl < AgBr < AgI
例2 一些反应的方向
2AgCl(s) + Ba(NO3) 2
sp3d、sp3d2常见 (∵r↑, C.N.↑)
氧化-还原性
As(III)、Sb(III) 还原性 As(V)、Sb(V)、Bi(V) 氧化性
例题:红磷与空气中的氧气作用生成某种氧化物,经 实验证明,它的分子结构如图所示(p123), (1)写出该氧化物与冷水反应的化学方程式 (2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的 化学方程式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生 成,请设计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
