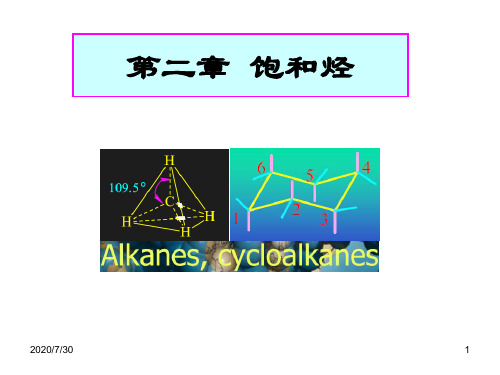
第二章 饱和烃的同分异构和命名
合集下载
第2章饱和烃讲义
2.2.1 烷基的概念 1) 烷烃中碳原子和氢原子的分类(P32)
2020/7/30
9
➢ 分析下列化合物所含碳原子种类
11ºº
CH3
11ºº 11ºº
3º
2º 4CºH34CºH3 2º 1º1º
CH CH2 C C CH2 CH3
CH2 C1ºH3 C1ºH3C1ºH3
2º
1º
1º 1º
2020/7/30
18
CH3CH2CH2CH3
C4
CH3
CH3CHCH3
中文名
正丁烷 异丁烷
英文名
n-butane isobutane
CH3(CH2)3CH3
正戊烷
n-pentane
CH3
C5 CH3CHCH2CH3
CH3 CH3CCH3
CH3
异戊烷 新戊烷
isopentane neopentane
➢ 异构词头用词头“正”、“异”和“新”等区分
17
一、普通命名法
中文名
英文名
C1
CH4
甲烷
C2
CH3CH3
乙烷
C3
CH3CH2CH3
丙烷
methane ethane propane
➢ 碳原子数目 + 烷 ➢ 英文命名用词尾-
ane表示烷烃
➢ 碳原子数为1~10用天干 (甲、乙、丙、……壬、 癸)表示
2020/7/30
碳原子数为10以上时用大写数字表示
英文简写 Me Et n-Pr i-Pr n-Bu s-Bu i-Bu t-Bu
neo-Pentyl
16
2.2.2 烷烃的命名(P33)
学习要求:由构造式写出名称,由名称写出构造式。
2020/7/30
9
➢ 分析下列化合物所含碳原子种类
11ºº
CH3
11ºº 11ºº
3º
2º 4CºH34CºH3 2º 1º1º
CH CH2 C C CH2 CH3
CH2 C1ºH3 C1ºH3C1ºH3
2º
1º
1º 1º
2020/7/30
18
CH3CH2CH2CH3
C4
CH3
CH3CHCH3
中文名
正丁烷 异丁烷
英文名
n-butane isobutane
CH3(CH2)3CH3
正戊烷
n-pentane
CH3
C5 CH3CHCH2CH3
CH3 CH3CCH3
CH3
异戊烷 新戊烷
isopentane neopentane
➢ 异构词头用词头“正”、“异”和“新”等区分
17
一、普通命名法
中文名
英文名
C1
CH4
甲烷
C2
CH3CH3
乙烷
C3
CH3CH2CH3
丙烷
methane ethane propane
➢ 碳原子数目 + 烷 ➢ 英文命名用词尾-
ane表示烷烃
➢ 碳原子数为1~10用天干 (甲、乙、丙、……壬、 癸)表示
2020/7/30
碳原子数为10以上时用大写数字表示
英文简写 Me Et n-Pr i-Pr n-Bu s-Bu i-Bu t-Bu
neo-Pentyl
16
2.2.2 烷烃的命名(P33)
学习要求:由构造式写出名称,由名称写出构造式。
华东理工 有机化学 第 2 章 饱和烃

第二章 饱和烃 (烃 : 碳,氢组合. 烷烃 脂肪烃 烯烃 炔烃 二烯烃 烃 脂环烃 芳香烃 烷: parattin (缺乏活力) 碳四价完全饱和) 不饱和
来源 : 石油 ,天然气,动植物 : 植物表皮腊 : 正 C29H60 (洋白菜) 正C27H56 (苹果皮) ,一些昆虫的性外激素等. 附: 肖莱马 (现代科学有机化学的奠基人之一)
§ 2-6 烷烃的化学性质 烷烃 : C-C 键能 348KJ/mol , 在特殊条件能反应. C-H 415KJ/mol ,性质稳定
一 : 取代反应 ----烷烃氢原子被其它原子取代 (取代反应为有机物最基本的反应之一) 1: 卤代反应 Halogenation
RH
+ X2 光 hυ RX + HX 或加热
熔点规律: C1~C3 无规则, C4以上随分子量增加而升高, 形成两条熔点曲线, 随分子量增大而接近. 偶数碳升高快 : 晶格排列整齐,紧密,对称性大,规则. (见书 P35) 支连越多,对称性大, 熔点高, 沸点低.
密度 : < 0.8 , 随分子量增大而增大 (分子间力加大,间距更小) 折射率: 纯的有机物有一定折射率,随温度升高而降低,用于鉴定有机物纯度, 并定性鉴定. 有机物的物理常数介绍.
CH4
+
Cl 2
日光
C
+
4 HCl 爆炸
CH4 + Cl2 漫射光 CH3Cl Cl2
CH3Cl + HCl CHCl3 CCl 4
CH2Cl2 Cl2
控制 CH4, Cl2 比例,选择性制备产物. CH4 + Cl2 400~500℃ CH3 Cl + -----+ CCl4 + HCl
来源 : 石油 ,天然气,动植物 : 植物表皮腊 : 正 C29H60 (洋白菜) 正C27H56 (苹果皮) ,一些昆虫的性外激素等. 附: 肖莱马 (现代科学有机化学的奠基人之一)
§ 2-6 烷烃的化学性质 烷烃 : C-C 键能 348KJ/mol , 在特殊条件能反应. C-H 415KJ/mol ,性质稳定
一 : 取代反应 ----烷烃氢原子被其它原子取代 (取代反应为有机物最基本的反应之一) 1: 卤代反应 Halogenation
RH
+ X2 光 hυ RX + HX 或加热
熔点规律: C1~C3 无规则, C4以上随分子量增加而升高, 形成两条熔点曲线, 随分子量增大而接近. 偶数碳升高快 : 晶格排列整齐,紧密,对称性大,规则. (见书 P35) 支连越多,对称性大, 熔点高, 沸点低.
密度 : < 0.8 , 随分子量增大而增大 (分子间力加大,间距更小) 折射率: 纯的有机物有一定折射率,随温度升高而降低,用于鉴定有机物纯度, 并定性鉴定. 有机物的物理常数介绍.
CH4
+
Cl 2
日光
C
+
4 HCl 爆炸
CH4 + Cl2 漫射光 CH3Cl Cl2
CH3Cl + HCl CHCl3 CCl 4
CH2Cl2 Cl2
控制 CH4, Cl2 比例,选择性制备产物. CH4 + Cl2 400~500℃ CH3 Cl + -----+ CCl4 + HCl
2 饱和烃2

1.原子序数大的次序大,原子序数小的次序小,同位素中 质量高的次序大。 I >Br >Cl >S >P >F >O >N >C >D >H
2.如果原子团的第一个原子相同,则比较与它相连的其它 原子(第二个原子)的原子序数大小 ,其它依次类推。
3.含有双键或叁键的原子团,可以认为连有二个或三个相 同的原子。
H
饱和烃: 开链烃 不饱和烃: H2C 烃 脂环烃: 环烃 芳香烃:
H C H CH2
H C H HC
CH
H
C H
H
CH2 H2C CH2
烷烃(alkane):开链的饱和烃叫烷烃。
2,烷烃的同系列
甲 烷 分 式 子 CH4 H 结构式 H C H 碳 数 氢 数 H H 乙 烷 C2H6 H C H H C H H H H C H 丙 烷 C3H8 H C H H C H H H H C H 丁 烷 C4H10 H C H H C H H C H H
一个sp3杂化轨道
四个sp3杂化轨道
(3)烷烃分子的形成
在形成甲烷分子时,4个氢原子的1s轨道分别沿着碳原 子的sp3杂化轨道的对称轴靠近,当它们之间的吸引力 与斥力达到平衡时,通过电子云重叠交盖形成了4个碳 氢σ 键。 C-Hσ键
在形成乙烷分子时, 碳原子的sp3轨道沿着对称轴的方向与另一个碳的sp3轨道相 互重叠成C-C σ键;
2
10
3
9
4
8
5 6
7 6
7
5
8
4
9
3
10
2
11
1
CH3-CH-CH2-CH-C-CH2-CH2-CH2-CH-CH-CH3 CH3 CH3CH2CH3
第二章 饱和烃(I 链烷烃)

仲 丁 基 s e c b u t y l 异 丁 基 i s o b u t y l
C H ( C H ) C H 2 2 2 3
正 丁 基 n b u t y l
(3)含有双键或叁键的基团,可以认为连有两个或三个相同原子。
H C C C
视为
H C C C C C
O C H 视为
O C H
C O
A
乙烷构象能量变化图
重叠式构象能量(势
能)比交叉式构象高 12kJ/mol
分子由一个交叉式转到另一个交叉式需经过能量较高的重叠式,亦 称能垒。因此,碳碳单键的旋转并非自由。 转动能垒:分子由一个稳定的交叉式构象转为一个不稳定的重叠式构
象所需的最低能量。(25°时转速达1011次/秒)
单键旋转的能垒一般在12~41.8kJ/mol范围内,所以,室温下的分子热 运动即可克服此能垒而使构象迅速互变。
C C C
C C
C C C C
C C
C C C C
bp.
36.1℃ 沸点:直链 > 支链
28℃
9.5℃
2、熔点:
固体受热使分子内能增加到能克服分子间范德华力,晶体开始熔化变
为液体时的温度称之。 (与分子间作用力和分子结构对称性有关) (1)同系列中:
C奇
C偶,m.p. 升高的多
呈锯齿状
(偶数碳原子对称性较好)
(二)丁烷的构象
2 C H C H 3 2 3 C H C H 2 3
丁烷可看成是1,2-二甲基乙烷,沿C2、C3旋转,
产生各种构象,其典型的构象有四种:
CH3 CH2 CH2 CH3 2 1
2 1
60 o 1
2
60 o 1
C H ( C H ) C H 2 2 2 3
正 丁 基 n b u t y l
(3)含有双键或叁键的基团,可以认为连有两个或三个相同原子。
H C C C
视为
H C C C C C
O C H 视为
O C H
C O
A
乙烷构象能量变化图
重叠式构象能量(势
能)比交叉式构象高 12kJ/mol
分子由一个交叉式转到另一个交叉式需经过能量较高的重叠式,亦 称能垒。因此,碳碳单键的旋转并非自由。 转动能垒:分子由一个稳定的交叉式构象转为一个不稳定的重叠式构
象所需的最低能量。(25°时转速达1011次/秒)
单键旋转的能垒一般在12~41.8kJ/mol范围内,所以,室温下的分子热 运动即可克服此能垒而使构象迅速互变。
C C C
C C
C C C C
C C
C C C C
bp.
36.1℃ 沸点:直链 > 支链
28℃
9.5℃
2、熔点:
固体受热使分子内能增加到能克服分子间范德华力,晶体开始熔化变
为液体时的温度称之。 (与分子间作用力和分子结构对称性有关) (1)同系列中:
C奇
C偶,m.p. 升高的多
呈锯齿状
(偶数碳原子对称性较好)
(二)丁烷的构象
2 C H C H 3 2 3 C H C H 2 3
丁烷可看成是1,2-二甲基乙烷,沿C2、C3旋转,
产生各种构象,其典型的构象有四种:
CH3 CH2 CH2 CH3 2 1
2 1
60 o 1
2
60 o 1
有机化学第2章饱和烃

CH3 CH3CH2CH2CH2CH3 CH3 CH CH2CH3 CH3 CH3 C CH3 CH3
沸点℃
36
28
9.5
2. 熔点
烷烃熔点(mp)的变化基本上与沸点相似,直链烷烃的熔点变化 也是随着相对分子质量的增减而相应增减。但因在晶体中,分子间 的作用力不仅取决于分子的大小,而且与晶体中晶格排列的对称性 有关,对称性大的烷烃晶格排列比较紧密,熔点相对要高些。
沸点是与分子间的作用力——van der Waals力有关的,烷烃是非极 性分子,van der Waals力主要产生于色散力。
直链烷烃的沸点与分子中所含碳原子数的关系图 一般在常温常压下,四个碳以下的直链烷烃是气体,由戊烷开始 是液体,大于十七个碳的烷烃是固体。
在碳原子数相同的烷烃异构体中,含支链越多的烷烃,相应 沸点越低。
为了使成键电子之间的排斥力最小、最稳定,四个sp3杂化轨 道在空间的排布,是以碳原子为中心,四个轨道分别指向正四面体 的四个顶点,使sp3 杂化轨道具有方向性。同时两个轨道对称轴之 间的夹角 (键角)为109.5°。
1/4s + 3/4p
2. σ键的形成及其特性
原子轨道沿核间联线(键轴)相互交盖,形成对键轴呈圆柱形对称 的轨道,称为σ轨道。σ轨道上的电子称为σ电子。 σ轨道构成的共价 键称为σ键。
当含有不止一个相等的最长碳链可供选择时,一般选取包含支链最多 的最长碳链作为主链。根据主链所含碳原子数称为“某烷”。
“庚烷”
②将主链上的碳原子从靠近支链的一端开始依次用阿拉伯数字编号;
当主链编号有几种可能时,应选定支链具有“最低系号相同时,给小的取代基较小的编号:
异丁烷
为了形象地表示分子的立体形状,常采用立体模型表示。常用 的模型有两种:球棒模型(Kekule模型)和比例模型(Stuart模型,它与
沸点℃
36
28
9.5
2. 熔点
烷烃熔点(mp)的变化基本上与沸点相似,直链烷烃的熔点变化 也是随着相对分子质量的增减而相应增减。但因在晶体中,分子间 的作用力不仅取决于分子的大小,而且与晶体中晶格排列的对称性 有关,对称性大的烷烃晶格排列比较紧密,熔点相对要高些。
沸点是与分子间的作用力——van der Waals力有关的,烷烃是非极 性分子,van der Waals力主要产生于色散力。
直链烷烃的沸点与分子中所含碳原子数的关系图 一般在常温常压下,四个碳以下的直链烷烃是气体,由戊烷开始 是液体,大于十七个碳的烷烃是固体。
在碳原子数相同的烷烃异构体中,含支链越多的烷烃,相应 沸点越低。
为了使成键电子之间的排斥力最小、最稳定,四个sp3杂化轨 道在空间的排布,是以碳原子为中心,四个轨道分别指向正四面体 的四个顶点,使sp3 杂化轨道具有方向性。同时两个轨道对称轴之 间的夹角 (键角)为109.5°。
1/4s + 3/4p
2. σ键的形成及其特性
原子轨道沿核间联线(键轴)相互交盖,形成对键轴呈圆柱形对称 的轨道,称为σ轨道。σ轨道上的电子称为σ电子。 σ轨道构成的共价 键称为σ键。
当含有不止一个相等的最长碳链可供选择时,一般选取包含支链最多 的最长碳链作为主链。根据主链所含碳原子数称为“某烷”。
“庚烷”
②将主链上的碳原子从靠近支链的一端开始依次用阿拉伯数字编号;
当主链编号有几种可能时,应选定支链具有“最低系号相同时,给小的取代基较小的编号:
异丁烷
为了形象地表示分子的立体形状,常采用立体模型表示。常用 的模型有两种:球棒模型(Kekule模型)和比例模型(Stuart模型,它与
饱和烃(烷烃)

7
5
8
4
9
3
10
2
11
1
CH3-CH-CH2-CH-C-CH2-CH2-CH2-CH-CH-CH3 CH3 CH3CH2CH3 CH3CH3
红色从左向右编号取代基位置是2,4,5,5,9,10 – (错误)
蓝色从右向左编号取代基位置是2,3,7,7,8,10 – (正确)
蓝色第个二取代基为3, 符合最小规则
+
2S
+
-
+
2Px
+
+
+
2Py
- + - -
+
平面三角形
sp2杂化轨道
sp杂化
+
2s
+
2p
+
+ -
- +
直线型 sp杂化轨道
S轨道
P轨道
SP3轨道(简化)
SP3轨道
四个SP3轨道
成键能力: S轨道=1;P轨道=1.73;SP3杂化轨道=2 主要特征: 正四面体 SP3杂化, 键, H-C-H夹(键)角109.5, C-C键长0.154nm, C-H键长0.110nm 有机
1 2 1+2
2 2 2+2
3 2 3+2
4 2 4+2
开链烷烃通式:CnH2n+2
CH2 H2C CH2 H2C H2C CH2 CH2 H2C H2C CH2 CH2 CH2 H2C H2C CH2 CH2 CH2 CH2
环丙烷
环丁烷
环戊烷
环己烷
环烷烃的通式:CnH2n
同系列:通式相同,且结构(分子结构上相差 若干个CH2) 及化学性质相似,物理性质则随着 碳原子数目的增加而有规律地变化的化合物 称为同系列 例:甲烷/丙烷/丁烷 (同糸列) 甲醇/丙醇/丁醇 (同糸列) 甲醚/乙醇 (非同糸列) 丙酮/丁醛 (非同糸列) 同系列中的化合物互称为同系物。相邻 的同系物在组成上相差CH2,这个CH2 称为系列 差。 有机
大学有机化学第二章饱和烃

a、链的引发
hv
Cl2
2Cl
b、 链的增长
C H 4 + lC H 3 +HC Cl
H= 7. 5KJ/mol
C H 3+ C l2 C H 3 C l+C l
H= -112. 9 KJ/mol
c、链的终止
Cl + Cl Cl—Cl
CH 3 + C3H CH 3—C3H
CH 3 +Cl
CH 3Cl
芳香烃基:用“Ar-”表示。
CH3
甲基 (Me)
常见 CH3CH2
乙基 (Et)
的烷 烃基
C H 3C H 2C H 2 丙基(n-pr)
CH3 CH CH3 异丙基(iso-pr)
CH3CH2CH2CH2
CH3CHCH2CH3
丁基 (n-Bu) 仲丁基 (sec-Bu)
CH3 CH CH2 CH3
(反叠式) (反错式)
H
H
H
邻位交叉式 (顺错式)
CH 3CH 3
0。
H H
H
H
全重叠式 (顺叠式)
四种极限构象的稳定性次序:
对位交叉式>邻位交叉式>部分重叠式>全重叠式
四、烷烃的化学性质
1、烷烃的卤代反应
取代反应(substitution reaction):有机化合物
中氢原子(或其它原子或原子团)被另一原子或 原子团取代的化学反应称取代反应。
CH3
含有 CH3 C端基,而无其
CH3
它支链的烷烃,则称“新某烷”。
CH 3 CH3 C CH3
CH 3
新戊烷(neopentane)
CH3 CH3 C CH2 CH3
2饱和烃

,1’2-甲基-5-1’,1 -二甲基丙基癸烷 甲基,1 或2-甲基-5-(1,1-二甲基丙基)癸烷 甲基- (1,1-二甲基丙基)
练习: 练习
CH3CH2CH CH3 CH CH2 CHCH3 CH3
CH3 CH3CHCH2CH2CH2CH2CHCHCH2CH3 CH3 CH3
CH2
CHCH3 CH3
-1
每个 CH2 的 张力 ( kj.mol ) 38.5 27.4 5.4 0 3.8 5.0 5.5 5.0 0
-1
整个环的张力 ( kj.mol ) 115.5 109.6 27.0 0 26.6 40.0 49.5 50.9 0
-1
每个CH 的燃烧热越大,分子内能越大,越不稳定。 每个CH2的燃烧热越大,分子内能越大,越不稳定。 环的稳定性:三元环<四元环<五元环< 环的稳定性:三元环<四元环<五元环<六元环
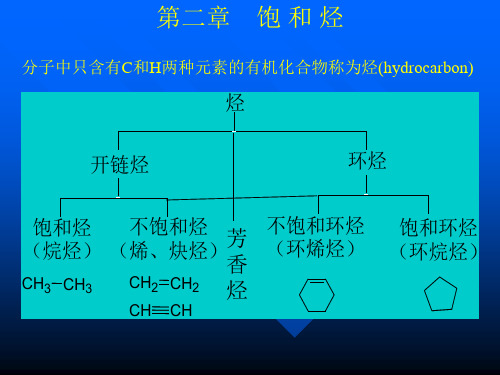
第二章 饱和烃
分子中只含有C 分子中只含有C、H两种元素的有机化合物叫 碳氢化合物,简称烃. 碳氢化合物,简称烃.
链烷烃
饱和烃
环烷烃
烃
不饱和烃 芳烃
烯烃 炔烃
一、饱和烃的通式和构造异构
• 链烷烃通式:CnH2n+2 链烷烃通式: • 环烷烃通式:CnH2n(单环) 环烷烃通式: (单环)
• 同分异构体:分子式相同而结构不同的化 同分异构体: 合物 • 构造异构体:分子式相同而原子连接顺序 构造异构体: 或方式不同
C5H10除了构造异构之外,还有立体异构 除了构造异构之外,
二、饱和烃的命名
1、碳原子和氢原子的分类
H H CH3CH3 H C C C C CH3 H H H CH3 1
。
2
。
3
练习: 练习
CH3CH2CH CH3 CH CH2 CHCH3 CH3
CH3 CH3CHCH2CH2CH2CH2CHCHCH2CH3 CH3 CH3
CH2
CHCH3 CH3
-1
每个 CH2 的 张力 ( kj.mol ) 38.5 27.4 5.4 0 3.8 5.0 5.5 5.0 0
-1
整个环的张力 ( kj.mol ) 115.5 109.6 27.0 0 26.6 40.0 49.5 50.9 0
-1
每个CH 的燃烧热越大,分子内能越大,越不稳定。 每个CH2的燃烧热越大,分子内能越大,越不稳定。 环的稳定性:三元环<四元环<五元环< 环的稳定性:三元环<四元环<五元环<六元环
第二章 饱和烃
分子中只含有C 分子中只含有C、H两种元素的有机化合物叫 碳氢化合物,简称烃. 碳氢化合物,简称烃.
链烷烃
饱和烃
环烷烃
烃
不饱和烃 芳烃
烯烃 炔烃
一、饱和烃的通式和构造异构
• 链烷烃通式:CnH2n+2 链烷烃通式: • 环烷烃通式:CnH2n(单环) 环烷烃通式: (单环)
• 同分异构体:分子式相同而结构不同的化 同分异构体: 合物 • 构造异构体:分子式相同而原子连接顺序 构造异构体: 或方式不同
C5H10除了构造异构之外,还有立体异构 除了构造异构之外,
二、饱和烃的命名
1、碳原子和氢原子的分类
H H CH3CH3 H C C C C CH3 H H H CH3 1
。
2
。
3
第二章 饱和烃(烷烃)
烷烃 饱和烃:
开链烃 (脂肪烃)
烃
环状烃
烯烃 不饱和烃 炔烃 二烯烃 脂环烃
芳香烃
3
2.1 同系列与同分异构
一、 烷烃的同系列 烷烃的通式: CnH2n+2 同系列:具有相同的通式,结构相似,组成上相差CH2
及其整数倍,化学性质也相似,物理性质随碳数的增加有 规律地变化的化合物系列。组成上的差叫同系差 同系物:同系列中的各化合物互为同系物。 烷烃是碳氢化合物,我们以H-H为起点,依次插入CH2 可以导出所有的烷烃:
CH2
亚甲基
CHCH3
亚乙基
CH
次甲基
8
注意异丁基与仲丁基的区别
注意叔戊基与新戊基的区别
9
二、 系统命名法 说明:IUPAC命名法与系统命名法并不等同。 IUPAC命名法:是国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,简称IUPAC)制定的命法。 系统命名法:是中国化学会(CCS:Chinese chemical society) 根据IUPAC的命名原则,结合我国文字特点所制定的命名 法。 在系统命名法中:
H C H
H H H C C H H H
: 伸出纸平面之前 : 伸向纸平面之后 : 在纸平面之上
H H
甲烷分子的楔形式
乙烷分子的楔形式
简言之: 楔前、虚 后、实平面。 22
▲所谓直链烷烃,碳链并非是直的,只是它不含侧链而
已。 ≥ C3的直链烷烃固态时碳链呈锯齿状,气态、液态 下由于围绕σ- 键的旋转而呈多种不规则的形状:
2、根据物理性质来分离提纯化合物
32
二、烷烃的物理性质 1、熔点(m.p) 分子熔点的高低取决于分子间的作用力和晶格堆积的密 集度.烷烃分子之间只有极弱的色散力。
有机化学第二章饱和烃

06:32
31
第二章 饱和烃
四、乙烷和丁烷的构象 看书回答:乙烷交叉式和重叠式之间的内能差相有多大? 室温下两种构象能否完成转化?几乎全都是交叉式构象 的条件是什么?在常温条件能否将它们分离?
概念:扭转能(torsional energy);扭张力 (torsional strain)
06:32
32
第二章 饱和烃
四、乙烷和丁烷的构象 乙烷构象间转换时的能量变化。
E
重叠式构象
HH
H H
H
HH
HH
交叉式构象
H
H
H
HH
HH
HH
H
H
H
H
H
H
12.1 kJ / mol
60120Fra bibliotek180
240 旋转角度
能量最低的构象最稳定,最稳定的构象称为优势构象。
06:32
33
第二章 饱和烃
丁烷的构象:P20中间的图
支链化的结果是接触部分减少见,沸点降低,见表2-3。
06:32
36
第二章 饱和烃
五、烷烃的物理性质 另外:分子的动能是气态的大于液态的,液态的大于 固态的。相对分子质量增大后,使分子动起来的能量 要增大,所以要提高温度。
1.状态:室温下,碳原子数:1—4 气态;5—17 液 态;18以上 固态。同分异构体中,有支链者沸点低; 支链越多,沸点越低。
C原子的杂化轨道
23
第二章 饱和烃
C的sp3杂化轨道与H的1s轨道重叠示意图
06:32
24
第二章 饱和烃
乙烷分子中原子轨道重叠示意图
C-H键或C-C键中成键原子的电子云是沿着它们的轴 向重叠的,这样形成的键叫做σ键。
有机化学 第二章 饱和烃

只含有碳和氢两种元素的化合物叫碳氢化合物,简称
烃。烃是最简单的有机化合物。 烃可以分为开链烃和环状烃两大类:
烃
{
开链烃
{ {
饱和烃(烷烃) 不饱和烃(烯烃、炔烃) 脂环烃(环烷烃、环烯烃、环炔烃) 芳香烃
环状烃
{
单环 多环
{
多苯代 联苯
2-1 同系列和同分异构
1 烷烃的同系列和同系物
CH4 C2H6 C3H8 C4H10 C5H12 …… 烷烃的通式CnH2n+2 同系列:具有一个通式,结构相似,性质相似的化合 物系列。 组成上相差CH2及其整数倍 同系物:同系列中的各个化合物互称同系物。 系列差:CH2称为同系列的系列差,也称系差。
bp./ ℃ 36.1
CH3(CH2)4CH3
68.9
CH3(CH2)5CH3
98.4
相同分子量的烷烃,支链越多,沸点越低。
CH3
CH3CH2CH2CH2CH3
CH3CHCH2CH 3 CH3
bp./ ℃ 36.1 27.9
CH3
C
CH3
CH3
9.5
液体的沸点取决于分子间引力的大小,分子间引力越 大,沸点就越高。 分子间作用力主要有偶极力、色散力和氢键。 丁烷、2-甲基丁烷、戊烷、2,2-二甲基戊烷、庚烷、辛烷
空间的分布。
分子的构型和它的化学反应性能有密切的关系,因此,
学习有机化学时应注意化合物的立体概念。
1 甲烷的构型
碳原子的电子构型是1s22s22p2; 在有机化合物中碳是四价的,都是sp3杂化。
激发
2s 2p
杂化
2s
2p
sp3
每一个sp3轨道都含有1/4的s成份和3/4的p成份。
烃。烃是最简单的有机化合物。 烃可以分为开链烃和环状烃两大类:
烃
{
开链烃
{ {
饱和烃(烷烃) 不饱和烃(烯烃、炔烃) 脂环烃(环烷烃、环烯烃、环炔烃) 芳香烃
环状烃
{
单环 多环
{
多苯代 联苯
2-1 同系列和同分异构
1 烷烃的同系列和同系物
CH4 C2H6 C3H8 C4H10 C5H12 …… 烷烃的通式CnH2n+2 同系列:具有一个通式,结构相似,性质相似的化合 物系列。 组成上相差CH2及其整数倍 同系物:同系列中的各个化合物互称同系物。 系列差:CH2称为同系列的系列差,也称系差。
bp./ ℃ 36.1
CH3(CH2)4CH3
68.9
CH3(CH2)5CH3
98.4
相同分子量的烷烃,支链越多,沸点越低。
CH3
CH3CH2CH2CH2CH3
CH3CHCH2CH 3 CH3
bp./ ℃ 36.1 27.9
CH3
C
CH3
CH3
9.5
液体的沸点取决于分子间引力的大小,分子间引力越 大,沸点就越高。 分子间作用力主要有偶极力、色散力和氢键。 丁烷、2-甲基丁烷、戊烷、2,2-二甲基戊烷、庚烷、辛烷
空间的分布。
分子的构型和它的化学反应性能有密切的关系,因此,
学习有机化学时应注意化合物的立体概念。
1 甲烷的构型
碳原子的电子构型是1s22s22p2; 在有机化合物中碳是四价的,都是sp3杂化。
激发
2s 2p
杂化
2s
2p
sp3
每一个sp3轨道都含有1/4的s成份和3/4的p成份。
第二章 饱和烃

CH 3 CH 2 CH 2 CH 2 CH 3 CH 3 CH 2 CH CH 3 CH 3 CH 3 H 3C C CH 3 CH 3
正(n-)戊烷 异(iso-)戊烷
新(neo-)戊烷
烷基 CH3CH 3
通式:CnH2n+1 , R-。 甲基
CH
C2H5异丙基 仲丁基
乙基
CH3CH2CH2-
乙烷
C-C σ 键
- +
+
- +
C-Hσ键(SP3-S)
C-Cσ键(SP3-SP3)
σ键:价电子云具有轴对称的共价键。 σ电子: σ键上的电子。 单键是σ键,可以自由旋转。
- +
分子模型:
球棒模型 凯库勒(Kekü )模型 lé
比例模型 斯陶特(Stuart)模型
其它烷烃的结构:成锯齿型
CH 2 H 3C CH 2
1)构造(constitution):分子中原子间的连接方式和次序; 2)构型(configuration):一定构造的分子中,原子和基 团在空间的排布; 3)构象(conformation):一定构型的分子中,由于单键 的旋转而导致原子和基团在空间的不同排布。 构型是固定的,而构象一般是瞬间的。构型的变化须破 坏化学键,而构象的变化则不会发生键的断裂。
CH 3 CH 2CH 2CH 3
1 2 3 4
丁烷(普通命名法:正丁烷)
• 支链烷烃: 1. 选择主链:最长、支链最多的碳链。称 “某烷”。甲、 乙、…
2. 编号:从最靠近支链的一端开始。使取代基位次最小。
3. 命名:先写取代基(标出取代基的位置),再写某烷。
CH 3
2
CH 3 CH CH 2 CH 2 CH 3
正(n-)戊烷 异(iso-)戊烷
新(neo-)戊烷
烷基 CH3CH 3
通式:CnH2n+1 , R-。 甲基
CH
C2H5异丙基 仲丁基
乙基
CH3CH2CH2-
乙烷
C-C σ 键
- +
+
- +
C-Hσ键(SP3-S)
C-Cσ键(SP3-SP3)
σ键:价电子云具有轴对称的共价键。 σ电子: σ键上的电子。 单键是σ键,可以自由旋转。
- +
分子模型:
球棒模型 凯库勒(Kekü )模型 lé
比例模型 斯陶特(Stuart)模型
其它烷烃的结构:成锯齿型
CH 2 H 3C CH 2
1)构造(constitution):分子中原子间的连接方式和次序; 2)构型(configuration):一定构造的分子中,原子和基 团在空间的排布; 3)构象(conformation):一定构型的分子中,由于单键 的旋转而导致原子和基团在空间的不同排布。 构型是固定的,而构象一般是瞬间的。构型的变化须破 坏化学键,而构象的变化则不会发生键的断裂。
CH 3 CH 2CH 2CH 3
1 2 3 4
丁烷(普通命名法:正丁烷)
• 支链烷烃: 1. 选择主链:最长、支链最多的碳链。称 “某烷”。甲、 乙、…
2. 编号:从最靠近支链的一端开始。使取代基位次最小。
3. 命名:先写取代基(标出取代基的位置),再写某烷。
CH 3
2
CH 3 CH CH 2 CH 2 CH 3
第二章 饱和烃(烷烃和环烷烃)

CC CH3CH2CHCH3 CH2CH3
主链
3 1
C-C-C-C-C-C-C C-C-C C
2
25
表2-2 直链烷烃的系统命名 碳数 1 2 3 名称
4 5 6 7 8 9 10
11
甲烷 乙烷 丙烷 丁烷
戊烷 己烷
结构 CH4 CH3CH3 CH3CH2CH3
庚烷 辛烷 壬烷 癸烷
十一烷
CH3CH2CH2CH3 CH3(CH2)3CH3 CH3(CH2)4CH3 CH3(CH2)5CH3 CH3(CH2)6CH3 CH3(CH2)7CH3 CH3(CH2)8CH3
思考:C6H14共有几种同分异构体?请写出其构造式
11
共5种
C H 3C H 2C H 2C H 2C H 2C H 3
C H 3C H C H 2C H 2C H 3 CH3
C H 3C H 2C H C H 2C H 3 CH3
CH3 C H 3C H C H C H 3 CH3
CH3 C H 3C C H 2C H 3 CH3
普通命名法的局限
CH3CH2CH2CH2CH2CH3
CH3CHCH2CH2CH3 CH3
己烷
CH3 H 3C C CH2CH3
异己烷
CH3CH CHCH3
新己烷
CH3
CH3 CH3
?
CH3CH2CHCH2CH3 CH3
?
24
系统命名法 IUPAC Rules
选主链:选最长碳链作主链, 并以此链为母体 烷烃.若遇多个等长碳链, 则取代基多的为主 链。
13
不同的碳架结构 C4H10 不同的官能团 C2H6O 不同的官能团位置 C3H9N
主链
3 1
C-C-C-C-C-C-C C-C-C C
2
25
表2-2 直链烷烃的系统命名 碳数 1 2 3 名称
4 5 6 7 8 9 10
11
甲烷 乙烷 丙烷 丁烷
戊烷 己烷
结构 CH4 CH3CH3 CH3CH2CH3
庚烷 辛烷 壬烷 癸烷
十一烷
CH3CH2CH2CH3 CH3(CH2)3CH3 CH3(CH2)4CH3 CH3(CH2)5CH3 CH3(CH2)6CH3 CH3(CH2)7CH3 CH3(CH2)8CH3
思考:C6H14共有几种同分异构体?请写出其构造式
11
共5种
C H 3C H 2C H 2C H 2C H 2C H 3
C H 3C H C H 2C H 2C H 3 CH3
C H 3C H 2C H C H 2C H 3 CH3
CH3 C H 3C H C H C H 3 CH3
CH3 C H 3C C H 2C H 3 CH3
普通命名法的局限
CH3CH2CH2CH2CH2CH3
CH3CHCH2CH2CH3 CH3
己烷
CH3 H 3C C CH2CH3
异己烷
CH3CH CHCH3
新己烷
CH3
CH3 CH3
?
CH3CH2CHCH2CH3 CH3
?
24
系统命名法 IUPAC Rules
选主链:选最长碳链作主链, 并以此链为母体 烷烃.若遇多个等长碳链, 则取代基多的为主 链。
13
不同的碳架结构 C4H10 不同的官能团 C2H6O 不同的官能团位置 C3H9N
高教版 有机化学 第二章 饱和烃
-ane 烷 -ene 烯 -yne 炔 -ol 醇或酚 benzene 苯 aldehyde 醛 -one 酮 ester 酯 ether 醚 phenol 酚
butane 丁烷 butene butyne butanol benzol 苯甲醇 butanal butanone yl 基 R-(radical) 有机基团 phenyl 苯基(Ph-)
CH3CH2CH2CHCH 2CH3 CH3
CH3CHCH 2CH2CHCH 2CH3 CH2CH3 CH2CH2CH3
B编号:对主链碳原子编号,以便与确定取代基的位置。 原则:小的取代基位次最小为宜(劣势基团优先原则)。
例3
1 2 3 4 5 6 6 5 4 3 2 1 CH3CH2CH2CHCH 2CH3 CH3
C C C C C C
(1)
2. 写出少一个碳原子的直链式作为主链。如:比己烷少一 个碳的直链烃为正戊烷。把那一个碳当作支链(即甲基), 依次取代直链上的各个碳原子的氢,就能写出可能的同分 异构体的构造式。用一个碳原子取代这个碳链中五个碳原 子上的氢原子,有三个可能的异构体,
C
C C (2)
C
C
C
CH3CH2CH2CH2CH2CH2CH3
普通命名为: IUPAC命名为: 正庚烷 庚烷
(2)含有支链的烷烃,把它当作直链烷烃的衍生物。
例1
CH3CH2CH2CHCH 2CH3 CH3
命名为: 取代基 主链 3-甲基己烷
具体命名步骤为: A选择主链(母体)。 原则:含碳原子数最多,不一定要写成直型。碳原子数相同时, 取代基最多的作为主链。 例2
3-甲基-6-乙基壬烷
Chapter 02 饱和烃(烷烃和环烷烃)

CH3
1,7-二甲基螺[4.5]葵烷
CH3
2.3 烷烃和环烷烃的结构
2.3.1 碳的SP3杂化和σ键的形成 基态时 C:1S2 2S2 2Px1 2Py1 2Pz0
英文名
结构
methyl
ethyl
H2 C
propyl
H2 C
Iso-propyl
CH3
butyl
Iso-butyl
H2 C CH3 CH
CH3
CH3
C H2
CH3
CH
CH3
CH2(CH2)2CH3
CH3
中文名 英文名 结构
仲丁基 Sec-butyl
CH3
叔丁基 Tert-butyl
CH3 CH3
CH3
单 环 (上 ) 环 炔 烃 碳环数目 双环 多环
(1) 单环环烷烃 1)按成环碳原子数目称为环某烷。
1-甲基-3-乙基环己烷 2)长链作母体,环作取代基。(以下两种情况) 3-甲基-4-环丁基庚烷
1,3-二环己基丙烷
练习:命名以下化合物
H 3C H 2C
C H 2 (C H 2 ) 4 C H 3
H
H
顺-1, 4-二甲基环己烷
反-1, 4-二甲基环己烷
(2) 双环环烷烃(分子的碳架中含有两个饱和碳环的烃) 按两个环的不同的连接方式分为联环、螺环、稠环和桥环 四种。
a)双环桥环烃命名 桥头碳原子:两环共用的碳原子。
桥:两个桥头碳原子之间的碳链或一个键。
(1 ) 桥 (2) 桥 桥头碳 桥 (3) 桥头碳
第二章 饱和烃(Saturated hydrocarbons) (烷烃alkane和环烷烃cyclic alkane )
1,7-二甲基螺[4.5]葵烷
CH3
2.3 烷烃和环烷烃的结构
2.3.1 碳的SP3杂化和σ键的形成 基态时 C:1S2 2S2 2Px1 2Py1 2Pz0
英文名
结构
methyl
ethyl
H2 C
propyl
H2 C
Iso-propyl
CH3
butyl
Iso-butyl
H2 C CH3 CH
CH3
CH3
C H2
CH3
CH
CH3
CH2(CH2)2CH3
CH3
中文名 英文名 结构
仲丁基 Sec-butyl
CH3
叔丁基 Tert-butyl
CH3 CH3
CH3
单 环 (上 ) 环 炔 烃 碳环数目 双环 多环
(1) 单环环烷烃 1)按成环碳原子数目称为环某烷。
1-甲基-3-乙基环己烷 2)长链作母体,环作取代基。(以下两种情况) 3-甲基-4-环丁基庚烷
1,3-二环己基丙烷
练习:命名以下化合物
H 3C H 2C
C H 2 (C H 2 ) 4 C H 3
H
H
顺-1, 4-二甲基环己烷
反-1, 4-二甲基环己烷
(2) 双环环烷烃(分子的碳架中含有两个饱和碳环的烃) 按两个环的不同的连接方式分为联环、螺环、稠环和桥环 四种。
a)双环桥环烃命名 桥头碳原子:两环共用的碳原子。
桥:两个桥头碳原子之间的碳链或一个键。
(1 ) 桥 (2) 桥 桥头碳 桥 (3) 桥头碳
第二章 饱和烃(Saturated hydrocarbons) (烷烃alkane和环烷烃cyclic alkane )
第02章 饱和烃

H HH H–C–C–C–H H HH 丙烷 C3H8
H2 C H2 C H2 C CH2 CH2
H H H H H–C–C–C–C–H H H H H 丁烷 C4H10
H2 C H 2C H 2C C H2 CH2 CH2
环丙烷 C3H6
环丁烷 C4H8
环戊烷 C5H10
环己烷 C6H12
可得烷烃通式:CnH2n
选择支链位号较小的为主碳链。 例 2:
C H3
7
C H2
6
CH CH3
5
4
CH CH2 CH CH3
4
3
C H2 CH3
3
2
CH CH3
2
1
C H3
1
5 6 7
2、编位次 ―最低系列”
是指碳链以不同方向编号时,若有不止一种可能的 系列,则需顺次逐项比较各系列的不同位次,最先遇到 的位次最小者定为最低系列。
(1)取代基或官能团的第一个原子,其 原子序数大的为“较优基团” 。 (2)第一个原子相同,则比较与之相连 的第二个原子,依此类推。
衍生物命名法举例: C H3
C H3 C C H3 C H3
C2H5
四甲基甲烷
C H3 C C H2C H2C H2C H3 C H3 C HC H 3
?
甲基乙基正丁基异丙基甲烷
分子燃烧热 名 称 ( kj.mol ) 2091 2744 3320 3951 4637 5310 5981 6636
-1
C H2 的平均燃 烧热 ( kj.mol ) 697.1 686.2 664.0 658.6 662.4 663.6 664.1 663.6 658.6
-1
每个 C H2 的 张力 ( kj.mol ) 38.5 27.4 5.4 0 3.8 5.0 5.5 5.0 0
有机化学第2章饱和烃

反-1,4-二甲基环己烷
饱和烃 的结构
第二章 饱和烃:烷烃和环烷烃 2.3 烷烃和环烷烃的结构
2.3.1 σ键的形成及其特性 2.3.2 环烷烃的结构与环的稳定性
第二章 饱和烃:烷烃和环烷烃
2.3 烷烃和环烷烃的结构
2.3.1 σ键的形成及其特性
C: 2s2 2p2
两个成单电子, 呈2价?
实验事实:
第二章 饱和烃:烷烃和环烷烃
2.2.1 伯、仲、叔、季碳及伯、仲、叔氢
与三个氢原子相连的碳原子,叫伯碳原子(第一碳原子、一级碳原子),用1°表示 与二个氢原子相连的碳原子,叫仲碳原子(第二碳原子、二级碳原子),用2°表示 与一个氢原子相连的碳原子,叫叔碳原子(第三碳原子、三级碳原子),用3°表示 与四个碳原子相连的碳原子,叫季碳原子(第四碳原子、四级碳原子),用4°表示
第二章 饱和烃:烷烃和环烷烃
一些环烷烃的燃烧热如下所示:
环烷烃的环张力越大,说明分子的能量越高,稳定性越差,越容易开环 加成。
为什么环的稳定性顺序有:环丙烷<环丁烷<环戊烷<环己烷? 结构所致!!
环烷烃的结构与环的稳定性
环丙烷的结构:
物理方法测得,环丙烷分子中三个碳原子共平面。 显然,环丙烷中没有正常的C-C键,而是形成“弯曲键〞:
H HH
H HH H
HC CC H
HC CC C H
H
H
H HH H
HC H
m.p b.p
--103.85。。CC
H。 m.p -159 。C
b.p 11.7 C
这两种不同的丁烷,具有相同的分子式和不同的结构式,互为同分异 构体。
同分异构体——分子式相同,结构式不同的化合物。 同分异构现象——分子式相同,结构式不同的现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7
同 分 异 构 体
构造异构
碳链异构 官能团异构
位置异构 互变异构
顺反异构 立体异构 构型异构 对映异构
构象异构
构造异构:仅由分子中各原子连接方式和次序 不同而引起的异构。 碳链异构:仅由分子中碳原子的连接方式不同 而产生的异构。
8
C、H的类别
CH3 CH3 CH3 CH2 。 。 1 2 CH C 。CH3 。 4 3 CH3
6 6
3
5
17
“优先次序规则”P45
从基开始,依次比较原子序数,大则优
(CH3)3C
CH3 C CH3
(CH3)2CH
CH3CH2
CH3
>
CH3
CH3
H C CH3
>
CH3
H C H
>
H H C H
HOCH2- > H2NCH2- > CH3CH2-
双键看做两个单键;叁键看做单个单键
18
(3)写全名: 取代基(前) 母 体(后)
★ 位置——阿拉伯数字标位(多个的话用“,” 隔 开 ★ 数目——中文数字计数 ★ 名称:按“优先次序规则” (P45)排列,较优基 团列后。 “重头戏在后面” ★ 取代基之间用“—”隔开,取代基与母体之间无 间隔号
19
优先次序规则
1 2
①编号 ②命名
CH3-CH-CH-CH2-CH3 4 CH3 CH CH3 5 CH2 6 CH3
1o 1o 1o 1o
1o 1o
1o 1o 3o 3o 2o 2o
3 3 1o 1o
o o
CH3 CH3-CH2-C-CH2-CH3 CH3
1o 1o
CH3-CH-CH2-CH-CH3 CH3
1o 1o
1o 1o
2o 2o
4o 2o2o 1o 1o
CH3
1o 1o
12
参考答案:
1 o 1o
CH3
1o o 1
2,4-二甲基-3-乙基己烷
20
3
CH2CH2CH3 4 1 3 2 5| 8 6 7 CH3-CH-CH-CH-CH-CH-CH2-CH3 | | | | CH3 CH3 CH(CH3)2 CH2CH3 2,3 -二甲基-6-乙基- 5-丙基-4- 异丙基辛烷
21
CH3 7 3 4 | 6 CH3-CH2-CH-CH2-5 C-CH2-CH3 | | 2 CH-CH CH3 3 | 1CH 3
2, 5, 5 -三甲基-3-乙基庚烷
22
CH3 CH3 CH3CH2CH CHCH CH CH3
2,3,5-三甲基-4-丙基-庚烷
CH3 CH2CH2CH3
CH2 CH3 CH3CHCH2 CHCH2CH3 CH2 CH2CH3
3-甲基-5-乙基辛烷
23
2,4-二甲基-3-乙基庚烷
CH3 CH3CH2CH2CHCHCH2CH3 CH CH3 CH3
5
练习:写出戊烷的同分异构体的结构
C—C—C—C—C C | C—C—C—C C | C—C—C | C 正戊烷 b· p· 36.1℃
戊烷 C5H12
异戊烷
27.9℃
新戊烷
9.5℃
6
烷烃的同分异构体数目【了解】
碳原子数 异构体数 碳原子数 4 5 6 7 8 9 10 11 2 3 5 9 18 35 75 159 12 13 14 15 20 25 30 异构体数( 推算) 355 802 1858 4347 36319 36797588 4111646763
CH3-CH2-CH2-CH2-CH2-CH2-CH3
1o1o 2o 2o 2o 2o 2o 2o 2o 2o 2o 2o 1o 1o
1o 1o 3o 3o 2o 2o
2o 2o 2o 2o
1o 1o
CH3-CH-CH2-CH2-CH2-CH3 CH3
1o 1o
1o 1o 2o 2o
o o o o o o 1 2 2 2 2 1 3 3 o o
烃:仅由碳、氢两种元素组成的化合物统称碳
氢化合物,简称烃。
1
2.1
烷烃(alkane)
烷烃:分子中碳和碳以单键相连,碳 的其余价键都为氢原子所饱和的化合 物。
石油——各种烃的混合物 天然气——主要成份是甲烷 来源 动植物 白菜叶 C29烷 苹果皮 C27-C29烷 烟叶 C27-C31烷 蜂蜡 C29-C31烷
丁烷 C4H10 p· -0.6℃ CH3 CH2CH2CH3 b· CH3— CH—CH3 CH3 正丁烷
-11.7℃ 异丁烷
正丁烷
异丁烷
4
( 1 )同分异构现象:化合物分子式相同,但
结构不同的现象。 ( 2 )同分异构体:分子式相同而结构式不同 的化合物。 说明:同一分子式,C数越多,异构体数越多
CH3-CH-C-CH3 CH3 CH3
1 1
o o
3 3
o o
4o 1 o 1o
CH3-CH2-CH-CH2-CH3
2o
1o 1o
o 2o 2o 3o3o 2 2o
1o 1o
CH2 CH3
1o 1o
2o
1 1
o
o
13
2.1.3 烷烃的命名
1.普通命名法(适用于简单、含碳原子 数较少的烷烃) C10以内用天干次序表示(甲、乙、丙、丁、 戊、己、庚、辛、壬、癸)
2
2.1.1、烷烃的同系列和同分异构
通式 CnH2n+2 R-H
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3……
同系列:结构相似,组成上相差 CH2 或其倍数 的一系列化合物。 同系物:同系列中的各化合物互称同系物。 系 差:—CH2—。
3
2.1.2.异构现象 甲、乙、丙烷无异构现象
CH3-CH2-CH-CH2-CH2-CH3 CH3
1o 1o
11
参考答案:
1o 1o
CH3
1o 1o
1o 1o 3o 3o 3o 3o 2o 2o 1o 1o
o 4o 2o 2 2o 2o 1o 1o
CH3-C-CH2-CH2-CH3 CH3
1o 1o
CH3-CH-CH-CH2-CH3 CH3 CH3
1°
碳 原 子
伯(一级)1°:与另外一个C相连 叔(三级)3°:与另外三个C相连 季(四级)4°:与另外四个C相连
仲(二级)2°:与另外二个C相连 H 2°
3°
9
课下练习:
请写出庚烷(C7H16)的同分异构体的结 构式并标明1º 、2º、3º、4º 碳原子及1º 、
2º 、3º氢原子。
10
参考答案:
CH3CH2CH- CH3
CH3—C— CH3
异丙基
异丁基
仲丁基
叔丁基
16
2.系统命名法:
(1)选主链(定母体):最长最多(相同长 链,含支链多的为主链) (2)编号:“最低系列”规则 (近链端)
1 2
CH -CH-CH-CH -CH 3 2 3 (6) (5) (4) 4 CH3 CH CH3 (3) 5 CH (2) 6 2 CH 3 (1)
C10以上用中文数字表示(十一、十二…) 直链烷烃 名称前冠“正”
CH3(CH2)13CH3 正十五烷
14
CH3CH2CH2CH2CH2CH3
正已烷
侧 链 烷 烃
在 链 端 具 有 (CH3)2CH- 结 构 异 构 体 为
“异” “iso-” 在链端具有(CH3)3C-结构异构体为“新” “neo-”
C C C C C C C C C C C
P17 问题2-2
24
2,4-二甲基-3,3-二异丙基戊烷
C C-C C C—C—C—C—C C C-C C
CH3 CH3-CH CH3 CH3—CH—C—CH—CH3 CH3 CH-CH3 CH3
25
CH3 | CH3-C-CH2-CH3 | CH3 新己烷
15
CH3-CH-CH2CH2CH3 | CH3 异己烷
烷基:烷烃分子中去掉一个氢原子剩下的基团。
CnH2n+1-, R-
CH3- CH3CH2- CH3CH2CH2- CH3CH2CH2CH2-
甲基
乙基
丙基
丁基
CH3
CH3CH- CH3
CH3CHCH2- CH3
同 分 异 构 体
构造异构
碳链异构 官能团异构
位置异构 互变异构
顺反异构 立体异构 构型异构 对映异构
构象异构
构造异构:仅由分子中各原子连接方式和次序 不同而引起的异构。 碳链异构:仅由分子中碳原子的连接方式不同 而产生的异构。
8
C、H的类别
CH3 CH3 CH3 CH2 。 。 1 2 CH C 。CH3 。 4 3 CH3
6 6
3
5
17
“优先次序规则”P45
从基开始,依次比较原子序数,大则优
(CH3)3C
CH3 C CH3
(CH3)2CH
CH3CH2
CH3
>
CH3
CH3
H C CH3
>
CH3
H C H
>
H H C H
HOCH2- > H2NCH2- > CH3CH2-
双键看做两个单键;叁键看做单个单键
18
(3)写全名: 取代基(前) 母 体(后)
★ 位置——阿拉伯数字标位(多个的话用“,” 隔 开 ★ 数目——中文数字计数 ★ 名称:按“优先次序规则” (P45)排列,较优基 团列后。 “重头戏在后面” ★ 取代基之间用“—”隔开,取代基与母体之间无 间隔号
19
优先次序规则
1 2
①编号 ②命名
CH3-CH-CH-CH2-CH3 4 CH3 CH CH3 5 CH2 6 CH3
1o 1o 1o 1o
1o 1o
1o 1o 3o 3o 2o 2o
3 3 1o 1o
o o
CH3 CH3-CH2-C-CH2-CH3 CH3
1o 1o
CH3-CH-CH2-CH-CH3 CH3
1o 1o
1o 1o
2o 2o
4o 2o2o 1o 1o
CH3
1o 1o
12
参考答案:
1 o 1o
CH3
1o o 1
2,4-二甲基-3-乙基己烷
20
3
CH2CH2CH3 4 1 3 2 5| 8 6 7 CH3-CH-CH-CH-CH-CH-CH2-CH3 | | | | CH3 CH3 CH(CH3)2 CH2CH3 2,3 -二甲基-6-乙基- 5-丙基-4- 异丙基辛烷
21
CH3 7 3 4 | 6 CH3-CH2-CH-CH2-5 C-CH2-CH3 | | 2 CH-CH CH3 3 | 1CH 3
2, 5, 5 -三甲基-3-乙基庚烷
22
CH3 CH3 CH3CH2CH CHCH CH CH3
2,3,5-三甲基-4-丙基-庚烷
CH3 CH2CH2CH3
CH2 CH3 CH3CHCH2 CHCH2CH3 CH2 CH2CH3
3-甲基-5-乙基辛烷
23
2,4-二甲基-3-乙基庚烷
CH3 CH3CH2CH2CHCHCH2CH3 CH CH3 CH3
5
练习:写出戊烷的同分异构体的结构
C—C—C—C—C C | C—C—C—C C | C—C—C | C 正戊烷 b· p· 36.1℃
戊烷 C5H12
异戊烷
27.9℃
新戊烷
9.5℃
6
烷烃的同分异构体数目【了解】
碳原子数 异构体数 碳原子数 4 5 6 7 8 9 10 11 2 3 5 9 18 35 75 159 12 13 14 15 20 25 30 异构体数( 推算) 355 802 1858 4347 36319 36797588 4111646763
CH3-CH2-CH2-CH2-CH2-CH2-CH3
1o1o 2o 2o 2o 2o 2o 2o 2o 2o 2o 2o 1o 1o
1o 1o 3o 3o 2o 2o
2o 2o 2o 2o
1o 1o
CH3-CH-CH2-CH2-CH2-CH3 CH3
1o 1o
1o 1o 2o 2o
o o o o o o 1 2 2 2 2 1 3 3 o o
烃:仅由碳、氢两种元素组成的化合物统称碳
氢化合物,简称烃。
1
2.1
烷烃(alkane)
烷烃:分子中碳和碳以单键相连,碳 的其余价键都为氢原子所饱和的化合 物。
石油——各种烃的混合物 天然气——主要成份是甲烷 来源 动植物 白菜叶 C29烷 苹果皮 C27-C29烷 烟叶 C27-C31烷 蜂蜡 C29-C31烷
丁烷 C4H10 p· -0.6℃ CH3 CH2CH2CH3 b· CH3— CH—CH3 CH3 正丁烷
-11.7℃ 异丁烷
正丁烷
异丁烷
4
( 1 )同分异构现象:化合物分子式相同,但
结构不同的现象。 ( 2 )同分异构体:分子式相同而结构式不同 的化合物。 说明:同一分子式,C数越多,异构体数越多
CH3-CH-C-CH3 CH3 CH3
1 1
o o
3 3
o o
4o 1 o 1o
CH3-CH2-CH-CH2-CH3
2o
1o 1o
o 2o 2o 3o3o 2 2o
1o 1o
CH2 CH3
1o 1o
2o
1 1
o
o
13
2.1.3 烷烃的命名
1.普通命名法(适用于简单、含碳原子 数较少的烷烃) C10以内用天干次序表示(甲、乙、丙、丁、 戊、己、庚、辛、壬、癸)
2
2.1.1、烷烃的同系列和同分异构
通式 CnH2n+2 R-H
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3……
同系列:结构相似,组成上相差 CH2 或其倍数 的一系列化合物。 同系物:同系列中的各化合物互称同系物。 系 差:—CH2—。
3
2.1.2.异构现象 甲、乙、丙烷无异构现象
CH3-CH2-CH-CH2-CH2-CH3 CH3
1o 1o
11
参考答案:
1o 1o
CH3
1o 1o
1o 1o 3o 3o 3o 3o 2o 2o 1o 1o
o 4o 2o 2 2o 2o 1o 1o
CH3-C-CH2-CH2-CH3 CH3
1o 1o
CH3-CH-CH-CH2-CH3 CH3 CH3
1°
碳 原 子
伯(一级)1°:与另外一个C相连 叔(三级)3°:与另外三个C相连 季(四级)4°:与另外四个C相连
仲(二级)2°:与另外二个C相连 H 2°
3°
9
课下练习:
请写出庚烷(C7H16)的同分异构体的结 构式并标明1º 、2º、3º、4º 碳原子及1º 、
2º 、3º氢原子。
10
参考答案:
CH3CH2CH- CH3
CH3—C— CH3
异丙基
异丁基
仲丁基
叔丁基
16
2.系统命名法:
(1)选主链(定母体):最长最多(相同长 链,含支链多的为主链) (2)编号:“最低系列”规则 (近链端)
1 2
CH -CH-CH-CH -CH 3 2 3 (6) (5) (4) 4 CH3 CH CH3 (3) 5 CH (2) 6 2 CH 3 (1)
C10以上用中文数字表示(十一、十二…) 直链烷烃 名称前冠“正”
CH3(CH2)13CH3 正十五烷
14
CH3CH2CH2CH2CH2CH3
正已烷
侧 链 烷 烃
在 链 端 具 有 (CH3)2CH- 结 构 异 构 体 为
“异” “iso-” 在链端具有(CH3)3C-结构异构体为“新” “neo-”
C C C C C C C C C C C
P17 问题2-2
24
2,4-二甲基-3,3-二异丙基戊烷
C C-C C C—C—C—C—C C C-C C
CH3 CH3-CH CH3 CH3—CH—C—CH—CH3 CH3 CH-CH3 CH3
25
CH3 | CH3-C-CH2-CH3 | CH3 新己烷
15
CH3-CH-CH2CH2CH3 | CH3 异己烷
烷基:烷烃分子中去掉一个氢原子剩下的基团。
CnH2n+1-, R-
CH3- CH3CH2- CH3CH2CH2- CH3CH2CH2CH2-
甲基
乙基
丙基
丁基
CH3
CH3CH- CH3
CH3CHCH2- CH3
