2009年高考化学复习提纲·氮和磷
化学《氮和磷复习》教案(旧人教版高二)
氮和磷复习一、考纲要求1.能运用原子核外电子排布规律,熟练地写出氮、磷两种元素的原子结构示意图。
2.认识氮族元素性质的相似性及递变规律,以及引起氮族元素性质异同的原因。
3.认识氮气的分子结构、性质及重要用途。
4.熟悉氮在五种不同氧化物中的化合价;掌握一氧化氮和二氧化氮的重要性质;了解氮固定的重要性。
5.理解氨分子结构对性质的决定作用;掌握氨、氨水、铵盐的性质和用途。
6.掌握氨的实验室制法及NH+4检验方法。
7.掌握硝酸的重要特性——不稳定性和强氧化性。
8.掌握硝酸的实验室制法的反响原理和工业上氨催化氧化法制硝的反响原理;了解其主要生产过程。
9.能判断氧化复原反响的类型,总结氧化复原反响的有关规律,会用化合价升降法配平各种类型的氧化复原反响。
10.认识白磷和红磷的性质、用途及相互转化的条件;了解同素异形体和同素异形现象;了解五氧化二磷的性质及磷酸的工业制法。
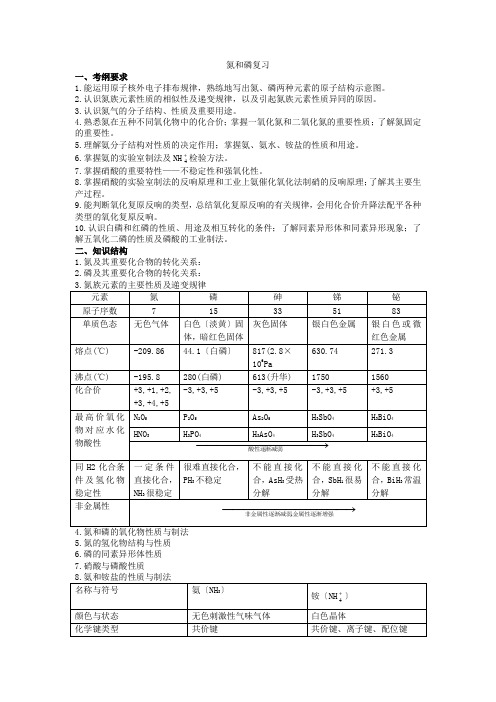
二、知识结构1.氮及其重要化合物的转化关系:2.磷及其重要化合物的转化关系:3.氮族元素的主要性质及递变规律元素氮磷砷锑铋原子序数7 15 33 51 83单质色态无色气体白色〔淡黄〕固体,暗红色固体灰色固体银白色金属银白色或微红色金属熔点(℃) -209.86 44.1〔白磷〕817(2.8×106Pa630.74 271.3 沸点(℃) -195.8 280(白磷) 613(升华) 1750 1560 化合价+3,+1,+2,+3,+4,+5-3,+3,+5 -3,+3,+5 -3,+3,+5 +3,+5最高价氧化物对应水化物酸性N2O5P2O5As2O5H3SbO4H3BiO4 HNO3H3PO4H3AsO4H3SbO4H3BiO4−−−−−−−−−−−→−渐减弱 酸性逐同H2化合条件及氢化物稳定性一定条件直接化合,NH3很稳定很难直接化合,PH3不稳定不能直接化合,AsH3受热分解不能直接化合,SbH1很易分解不能直接化合,BiH3常温分解非金属性−−−−−−−−−−−→−金属性逐渐增强 非金属性逐渐减弱,4.氮和磷的氧化物性质与制法5.氮的氢化物结构与性质6.磷的同素异形体性质7.硝酸与磷酸性质名称与符号氨〔NH3〕铵〔NH+4〕颜色与状态无色刺激性气味气体白色晶体化学键类型共价键共价键、离子键、配位键晶体类型 分子晶体离子晶体水溶性 易溶于水,溶液为碱性 均易溶于水,溶液多酸性 化学性质① 水合反响:NH 3+H 2O NH 3·H 2O NH +4+OH -② 同O 2反响4NH 3+5O 2催Δ 4NO+6H 2O③同酸反响:NH 3+HNO 3 NH 4NO 3①同碱反响:2NH 4Cl+Ca 〔OH 〕2 Δ CaCl 2+2NH 3↑+2H 2O ;NH +4+OH-Δ溶液 NH 3↑+H 2O②受热分解2NH 4NO 3 Δ 2N 2↑+O 2↑+4H 2O③ 水解NH +4+H 2O NH3· H 2O+H +制法2NH 4Cl+Ca 〔OH 〕2 Δ 2NH3↑+CaCl 2+2H 2ON 2+3H 2催化剂Δ加压 2NH 3 NH 3+CO 2+H 2O NH 4HCO 32NH 3+H 2SO 4 〔NH 4〕2SO 4鉴别 与HX 冒白烟,湿红石蕊试纸变蓝与碱混合加热有使石蕊试纸变蓝气体相互关系NH3酸碱 NH +4 9.氧化复原反响:根本概念 氧化复原反响:有电子转移的反响。
高三化学一轮复习 第八章 第1讲 氮和磷课件 人教大纲

+ I2。
⑤ N O 、 N O 2 均 能 与 N H 3 发 生 归 中 反 应 生 成 N 2:
N O x+ N H 3
N 2+ H 2O 。
三、磷及其化合物
自我诊断
3. 关 于 磷 的 叙 述 正 确 的 是 A.红磷、白磷均有剧毒
(D)
B. 白 磷 在 空 气 中 加 热 到 260℃ 可 转 变 为 红 磷
C. 工 业 合 成 氨 属 于 氮 的 固 定
D. 氮 气 能 大 量 存 在 于 空 气 中 的 根 本 原 因 是 其 分 子 中 的
氮氮三键非常牢固、分子结构稳定
解 析 虽 然 氮 元 素 的 非 金 属 性 较 强 ,但 由 于 氮 原 子 与 氮 原 子 之 间 形 成 的 共 价 三 键 非 常 牢 固 ,因 此 氮 气 的 性 质 比 较 稳 定;由于 氮气 的沸 点比 氧气 的低 ,液 态空 气升 温,首先 逸 出的是氮气。 答案 B
a.与H2反
应:
。
b.与O2反应:
。
2.c.氮与的M氧g反化应物:
。
氮的化合价有-__3_、_+_1__、_+_2__、_+_3__、_+_4__、__+_5_,
对应的氧化物有_N__2O__、_N_O__、_N__2O__3_、_N_O__2 _、_N_2_O_4_、
_N_2_O__5 。其中最常见的两种氧化物是 NO、NO2。
特别提醒 ①氮的氧化物都是大气污染物。
②空气中 NO2是造成光化学烟雾的主要因素。 ③空气中 NO、NO2主要来源于煤和石油的燃烧、汽车 尾气、硝酸工厂等。
④ N O 2: 既 有 氧 化 性 又 有 还 原 性 , 以 氧 化 性 为 主 。 N O 2
湖南省永州一中2009届高三一轮复习:《氮和磷》课件(旧人教版)

2、N2 的化学性
质
1.与H2反应
N2+3H高2温催、化高剂压 2NH3(工业合成氨)
放电
2.与O2反应 N2+O2
2NO
3.与某些金属反应 N2+3Mg 点燃 Mg3N2
三、氮气
3、N2 的工业制法: 物理方法:
化学方法:
三、氮气
4、N2 的实验室制法: 药品:NH4Cl溶液,饱和亚硝酸钠溶液 原理:NH4Cl+NaNO加2(热饱和)=
氢化物的 稳定性
磷蒸气和 H2能反应 生成PH3, 很难
硫蒸气和H2能 反应生成H2S, 加热
光照,点燃
很不稳定, 易分解
加热能分解
加热至高温 (3000°C以 上)少许分解
最高价含氧酸的 H3PO4中
酸性
强酸
H2SO4强酸 HClO4最强酸
9、某主族元素R,其最高正价与最低负价绝对
值之差为2,则其最高价氧化物的化学式
NaCl+N2↑+2H2O 装置:液液加热
三、氮气
5、氮的固定 将空气中游离的氮转变成氮的化合物的方法称 为氮的固定。 氮的固定分为自然固氮和人工固氮两大类。
三、氮气
6、氮气的用途:
(1)合成氨、制硝酸、制氮肥、炸药; (2)做保护气:焊接金属、填充灯泡、保存食品;
(3)医学上,液氮做冷冻剂、在冷冻麻醉下做手术;
H2O
HF
六、与同周期氧族,卤族元素相比较
N、O、F 三元素性质比较
第二周期元素
N
O
F
氢化物分子式 NH3
H2O
氢化物的 生成条件
高温高压 催化剂
点燃 放电
HF
冷暗处混合 爆炸
氮和磷复习

学科:化学教学内容:氮和磷【复习指导】本部分为教材内容的第一自然节,其主要的知识点有:①氮族元素的原子结构特点、主要性质(最高正价与最低负价)及其性质递变规律.②氮气的分子结构、物理性质和化学性质.③氮及其化合物间的转化关系.④氮的氧化物种类及主要性质.⑤氮的氧化物溶于水的有关计算.⑥磷的单质及磷酸的性质.⑦磷的存在及用途.⑧磷酸与碱定量反应时产物的确定及计算.⑨有关分子结构的迁移应用. 本章是重要的元素化合物知识.复习掌握本章内容要“一靠,三抓”,即:一靠:要依靠物质结构、元素周期律等理论作指导,从“位—构—性”三者关系去分析理解,不仅会使知识系统化便于掌握,还能够加深和巩固对物质结构、元素周期律的理解.三抓:要抓分子结构对物质性质的影响,如:氮分子中有三个共价键,分子结构稳定,性质不活泼.要抓不同价态的氮元素具有不同的氧化性或还原性,形成氧化还原反应知识链,便于理解和记忆;要抓物质的分类,从氮和磷的各种化合物的属类去认识它们各自的有关性质,要注意典型物质的特殊性. 本部分内容的复习方法是:(1)引导学生阅读“知识网络”中的氮族元素部分,并能依据氮族元素的原子结构特征(最外层电子数),指出氮族元素在周期表中的位置(VA族)和主要性质(价态),由元素周期律分析氮族元素性质(非金属性、金属性、气态氢化物的稳定性,最高价氧化物水化物酸性等)递变规律,并比较同周期氮族元素、氧族元素、卤族元素非金属性的强弱.(2)在阅读“要点萃取”1的基础上,引导学生写出N2与O2、H2、Mg等反应的化学方程式.并结合反应条件让学生明确氮气化学性质比较稳定及其原因.然后讨论汽车尾气中NO产生的原因及造成的环境污染,氮的固定及应用.(3)举例说明氮元素各种价态的化合物如:-3价(NH3、NH4Cl、Mg3N2),+1价(N2O),+2价(NO),+3价(N2O3、NaNO2),+4价(NO2、N2O4),+5价(N2O5、HNO3、NaNO3).并通过图表明确它们之间的转化关系,写出有关的化学方程式.(4)在学生阅读“要点萃取”2的基础上,指导学生完成下列反应的化学方程式:①NO分别与O2、NH3的反应;②NO2分别与NH3、SO2的反应,并归纳出NO主要表现还原性,还表现一定的氧化性.NO2主要表现氧化性.并指出NO、NO2对环境的影响,它们与NH3的反应是除去NO、NO2的方法之一.最后强调在常温下2NO 2N2O4对某些问题分析产生的影响.(5)分析氮的氧化物溶于水的条件(有氧气情况和无氧气情况),写出化学方程式,找出有关的计算关系,结合典型的例题和练习题进行综合应用,形成正确的解题思路,并注意一题多解.(6)用对比的方法让学生掌握白磷和红磷性质的异同点及相互转化关系.明确白磷分子的结构,并与NH4、CH4的空间结构做对比.(7)在复习磷及其化合物P2O5、H3PO4、磷酸盐的性质与应用的基础上,引导学生总结反应物相同,因反应条件不同而产物不同的有关规律.(8)本部分复习可安排两课时.第一课时复习氮族元素和氮气及氧化物的性质与应用;第二课时复习磷及其重要化合物的性质与应用.【本节知识框架】【要点指导】1.氮元素的化学活动性与氮分子的稳定性元素的性质取决于元素的原子结构.氮的原子半径小,吸引电子的能力较强,故表现出较强的化学活动性,所以说氮元素是一种较为活泼的非金属元素.氮气的稳定性则取决于氮分子的结构.氮分子是由两个氮原子共用三对电子结合而成的,氮分子中有共价叁键(N≡N),当氮气参加化学反应时,必须打开(破坏)分子中的三键,这就需要吸收很高的能量.因此,在通常情况下,氮气的性质很不活泼,很难跟其他物质发生化学反应.只有在高温或放电条件下,氮分子获得了足够的能量,使氮分子中的共价键断裂而形成活动性较强的氮原子,才能跟氢气、氧气、金属等物质发生化学反应.由于氮元素的非金属性较强,与金属反应生成的化合物一般为离子化合物,如Mg3N2,其电子式为:2.氮的氧化物有多种(1)氮元素有+1、+2、+3、+4、+5等五种正价态,五种正价对应六种氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5.其中N2O3和N2O5分别是HNO2和HNO3的酸酐.NO是一种无色还原性较强的气体,易被O2氧化为NO2,NO2是一种红棕色的易溶于水且与水反应的气体,氧化性强,能氧化SO2,能使湿润的KI淀粉试纸变蓝.(2)通常“纯净”的NO2或N2O4并不纯,因为在常温、常压下能发生2NO2 N2O4反应.由于此可逆反应的发生,通常实验测得NO2的相对分子质量大于它的实际值,或在相同条件下,比相同物质的量的气体体积要小.同理,通常实验测得N2O4的相对分子质量小于它的实际值,或在相同条件下,比相同物质的量的气体体积要大.此外涉及NO2气体的颜色深浅、压强、密度等要考虑此反应.因而可逆反应2NO2N2O4在解化学题中有很重要的应用.(3)氮的氧化物与水反应的计算,常用的反应方程式:2NO+O2===2NO23NO2+H2O===2HNO3+NO关系式:4NO2+O2+2H2O===4HNO34NO+3O2+2H2O===4HNO3当有NO、NO2、O2三种气体时,体积比为1∶1∶1时:NO2+NO+O2+H2O===2HNO3.NO+3V NO=4V2O.为任意比时应满足的关系是:V2(4)NO、NO2都是大气污染物,空气中NO、NO2主要来自石油产品和煤燃烧、汽车尾气以及制硝酸工厂的废气.其中空气中的NO2是造成光化学烟雾的主要因素.可用下列反应,在实验室制取NO、NO2.3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2OCu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O3.磷的两种同素异形体白磷和红磷的比较4.磷肥的制取和使用制磷肥用的原料是磷矿粉,它不溶于水,目的是把不溶性的磷酸盐,转化为可溶性磷酸盐,便于植物吸收.(1)过磷酸钙:主要成分为Ca(H2PO4)2和CaSO4,有效成分为Ca(H2PO4)2.Ca3(PO4)2+2H2SO4===2CaSO4+Ca(H2PO4)2(2)重过磷酸钙:主要成分Ca(H2PO4)2.Ca3(PO4)2+4H3PO4===3Ca(H2PO4)2使用磷肥时,不能与碱性物质混合,因为Ca(H2PO4)2水溶液呈弱酸性,遇碱性物质会使其生成CaHPO4或Ca3(PO4)2沉淀,由于不溶于水而不能被作物吸收,降低或丧失肥效.5.同样反应物因反应条件不同而产物不同(1)因反应物的物质的量不同而产物不同①红磷在氯气中燃烧:2P+3Cl2点燃====2PCl3(Cl2量不足)2P+5Cl2点燃====2PCl5(Cl2过量)②H3PO4与NaOH溶液反应H3PO4+NaOH===NaH2PO4+H2O [n(H3PO4)∶n(NaOH)=1∶1] H3PO4+2NaOH===Na2HPO4+2H2O [n(H3PO4)∶n(NaOH)=1∶2] H3PO4+3NaOH===Na3PO4+3H2O [n(H3PO4)∶n(NaOH)=1∶3] (2)因反应物浓度不同而产物不同Cu+4HNO3(浓)∆====Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)∆====3Cu(NO3)2+2NO↑+4H2O(3)因反应时温度不同而产物不同5NH4NO3C190︒====2HNO3+4N2↑+9H2ONH4NO3C200︒====N2O↑+2H2O2NH4NO3C500︒====2N2↑+O2↑+4H2O(4)因催化剂不同而产物不同4NH3+3O2(纯)燃烧====2N2+6H2O4NH 3+5O 2Pt ∆====4NO +6H 2O【典型例题精讲】本部分共设计了三个典型例题.[例1]主要考查了氮族元素性质的递变规律,通过引导学生分析解答,找出认识的误区,使学生对氮族元素的递变及其他族元素性质的递变有一完整的认识.[例2]题目设计新颖、起点高、落点低、综合考查环境保护、元素化合物、化学用语等内容.在分析过程中,注意引导学生熟悉氮的氧化物的性质,培养学生综合分析应用的能力.[例3]具有很强的综合性,既有化学与生物学科的综合,也有无机化学和有机化学的综合,考查的知识是基本知识,题目难度不大.易出错点有两处,一处是第(2)磷在不充足的氯气中燃烧的化学方程式,有些学生认为氯气不足,产物应是PCl 3,而忽略PCl 3更易被氯气氧化,因此,只写了第一步反应的方程式.第二处是第(4)双键数目,有些学生只注意P ==S ,而忽略了C ==O .[例1](2001年春,4)关于非金属元素N 、O 、Cl 、P 的叙述,正确的是 A .在通常情况下其单质均为气体 B .其单质均由双原子分子构成 C .都属于主族元素D .每种元素仅生成一种氢化物【解析】 本题考查了几种非金属元素的性质和在周期表中的位置.通常情况下,磷单质为固体,其中白磷分子是由四个磷原子构成的;氧元素可形成多种氢化物,如:H 2O 和H 2O 2.故A 、B 、D 都是错误的.【答案】 C【思维启迪】 某元素R 原子的最外层上有5个电子,它的含氧酸的钾盐的化学式可能有________________.【答案】 KRO 3、K 3RO 4、KRO 2[例2]NO 分子因污染空气而臭名昭著.近年来,发现少量的NO 在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO 亦被称为“明星分子”.请回答下列问题.(1)NO 对环境的危害在于__________(填以下项目的编号). A .破坏臭氧层B .高温下能使一些金属被氧化C .造成酸雨D .与人体血红蛋白结合(2)在含Cu +的酶的活化中心中,亚硝酸根离子可转化为NO ,写出Cu +和亚硝酸根离子在酸性水溶液中反应的离子方程式:____________________.(3)在常温下,把NO 气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N 2O ,写出上述变化的化学方程式:____________________________.(4)解释变化(3)中为什么最后的气体总压力小于原压力的2/3?【解析】 对于(3),2NO −→−N 2O ,N 化合价降低2价,故必有另一变化升高2价,依题意产物为NO 2,即3NON 2O +NO 2,2NO 2N 2O 4.【答案】 (1)ACD (2)Cu++NO -2+2H +===Cu 2++NO↑+H 2O(3)3NO ===N 2O +NO 2(4)生成的NO 2又发生如下反应,2NO 2N 2O 4而使压力略小于原来的2/3.【思维启迪】 实验室常用铜与稀硝酸反应制取一氧化氮,反应的离子方程式是________ ,气体的收集方法是______________.【答案】 3Cu +8H ++2NO -3===3Cu 2++2NO↑+4H 2O 排水集气法[例3](2002年新课程理综,28)磷是存在于自然界和生物体内的重要元素,回答下列与磷及其化合物有关的问题.Ⅰ.磷在叶绿体的构成和光合作用中有何作用: 答:①____________________________________________ ②________________________________________________ ③________________________________________________ ④________________________________________________Ⅱ.(1)磷在自然界里主要以__________的形式存在于矿石中.磷的单质有多种同素异形体,其中最常见的是有毒的______和无毒的______.(2)磷在不充足的氯气中燃烧的化学方程式为:__________________.而在过量的氯气中燃烧的化学方程式则是:________________.(3)磷(相对原子质量为31)在空气中燃烧生成的氧化物通常可用作强干燥剂.制备100 g 这种干燥剂所消耗的空气的体积约为________ L (在标准状况下).(4)有机磷农药“乐果”的结构简式是:其中所含的双键有_____________________个.【解析】 磷元素在自然界中以化合态(磷酸盐)的形式存在于矿石中.其同素异形体常见的有白磷和红磷,二者均不溶于水,白磷可溶于二硫化碳,有毒,红磷则无毒.磷在氯气中燃烧会产生白色的烟雾,氯气不足时产物是液态的PCl 3,氯气过量PCl 3则与氯气化合生成固态的PCl 5.磷在空气中燃烧生成五氧化二磷,五氧化二磷具有很强的吸水性,是一种很好的固体干燥剂,若空气中O 2含量按21%计算,制备100 g 这种干燥剂所消耗的空气的体积约为188 L ;若空气中O 2含量按约1/5计算),制备100 g 这种干燥剂所消耗的空气的体积约为197 L .从结构简式可看出,一个是P ==S 键,另一个是C ==O 键.【答案】 Ⅰ.①磷是叶绿体双层膜和基粒的构成成分;②磷是ATP 的成分,ATP 在能量转换中起重要作用;③磷是叶绿体DNA 的构成成分;④磷在光合作用下的物质转化中起重要作用.Ⅱ.(1)磷酸盐 白磷 红磷(2)2P +3Cl 2点燃=====2PCl 3 2P +5Cl 2点燃=====2PCl 5(3)188(空气中O 2含量按21%计算)或197(空气中O 2含量按约51计算)(4)2【思维启迪】 五氧化二磷是一种常用的干燥剂.下列气体:①HCl ②SO 2 ③H 2 ④NH 3 ⑤C 2H 4中,不能用五氧化二磷进行干燥的是__________.【答案】 ④【典例扩充】[例1]已知下列事实:①硝酸的酸性比磷酸强;②硝酸显强氧化性,磷酸不显强氧化性;③氮气与氢气可直接化合,磷与氢气很难直接化合;④氨比磷化氢稳定.其中能说明氮的非金属性比磷元素强的是A .①②③B .①②④C .①③④D .①②③④【解析】 比较两种元素的非金属性强弱,可以从两元素与氢化合的难易以及生成的气态氢化物的稳定性来判断,也可以从两元素的最高价氧化物的水化物的酸性强弱来判断.上述事实如①③④都是常用的判断依据.而事实②涉及的含氧酸的氧化性与中心元素的非金属性无直接联系,例如高锰酸氧化性很强,但锰却是金属元素.【答案】 C[例2]氮气与其他单质化合一般需高温,有时还需高压等条件,但金属锂在常温、常压下就能与氮气化合生成氮化锂,这是因为①此反应可能是吸热反应 ②此反应可能是放热反应 ③此反应可能是氮分子不必先分解为原子 ④此反应前可能是氮分子先分解成原子A .①②B .②④C .②③D .①④【解析】 此题考查了化学反应的本质是分子变成原子,原子重新组合成分子的过程,而氮分子有三重键,如N 2与Li 反应在常温常压下可进行,说明N 2分子中共价键没断裂,因N 2中共价键断裂需较高的条件.【答案】 C[例3]为消除氮的氧化物(NO x )对大气的污染,工业上通常利用反应NO x +NH 3−→−N 2+H 2O 来保护环境.现有NO 2和NO 的混合气体3 L ,可用3.5 L NH 3恰好使其完全转化为N 2,则混合气体中NO 2和NO 的体积之比为A .1∶4B .1∶1C .2∶1D .3∶1【解析】 由题意知,NO x +NH 3−→−N 2+H 2O 是一个氧化还原过程.通过方程式配平可以很快得到答案.设NO 2的计量数为a ,则NO 的计量数为(3-a ),NH 3的计量数为3.5,则有:a NO 2+(3-a )NO +3.5NH 3===3.25N 2+(a +3)H 2O根据氢元素守恒有:3.5×3=(a +3)×2 a =2.25∴1325.2325.2V V NONO 2=-=【答案】 D[例4]如图8—1所示是A→E五种含氮物质相互转化的关系图.其中A 、B 、C 、D 常温下都是气体,B 为红棕色,写出A 、B 、C 、D 、E 的分子式和各步反应的化学方程式.图8—1(1)各物质的化学式为:A .______________________________________________,B .______________________________________________,C.______________________________________________,D.______________________________________________,E.______________________________________________.(2)各步反应的化学方程式为:①______________________________________________②______________________________________________③______________________________________________④______________________________________________⑤______________________________________________【解析】此题为推断题,解题的突破口是B为红棕色气体,则B为NO2,且B能生成气体C,E在常温下不是气体,则C为NO,E为HNO3.由图示转化关系进一步分析可知:A为N2、D为NH3.【答案】(1)A:N2B:NO2 C:NO D:NH3 E.HNO3(2)①N2+O2放电====2NO②4NH3+5O2催化剂∆======4NO+6H2O③3NO2+H2O∆====2HNO3+NO④3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O⑤3NO2+H2O===2HNO3+NO[例5]将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体,则原混合气体中O2的体积是________mL.【解析】氮的氧化物溶于水的计算有以下几种情况:(1)NO2或NO2与N2(非O2)的混合气体溶于水时可依据:3NO2+H2O===2HNO3+NO,利用气体体积差值进行计算.(2)NO2和O2的混合气体溶于水时,由4NO2+O2+2H2O===4HNO3可知,当体积比V(NO2)∶V(O2)(3)NO和O2同时通入水中时,其反应是:2NO+O2===2NO2,4NO2+O2+2H2O===4HNO3,总式为:4NO+3O2+2H2O===4HNO3当体积比V(NO)∶V(O2)(4)NO、NO2、O2三种混合气体通入水中,可先按(1)求出NO2与H2O反应生成的NO的体积,再加上原混合气体中的NO的体积即为NO的总体积,再按(3)方法进行计算.值得注意的是:4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成.即(2)(3)两情况中的总反应式都与N2O5+H2O===2HNO3等效.这不仅是记忆(2)(3)二式的方法,也为上述问题的解法提供了新的思路.即利用混合气体中的N、O原子个数比进行分析判断:本题依据的化学反应原理为: 4NO 2+O 2+2H 2O ===4HNO 3 3NO 2+H 2O ===2HNO 3+NO设O 2的体积为x ,剩余的气体有两种可能:①若剩O 2,则V 剩=x -41(12-x )=2,得x =4. ②若剩NO ,则V 剩=31[(12-x )-4x ]=2,得x =1.2.【答案】 4或1.2[例6]在有机溶剂里m mol PCl 5跟m mol NH 4Cl 定量地发生完全反应,生成4m mol HCl ,同时得到一种白色固体R .R 的熔点为113℃,在减压下50℃即可升华,在1 Pa 下测得R 的蒸气密度折算成标准状况下则为15.54 g·L -1.请回答:(1)通过计算推导R 的化学式____________________.(2)分子结构测定表明,R 分子为环状,且同种元素的原子在R 分子中化合价相同,用单键“—”和双键“==”把分子里的原子连接起来,写出R 分子的结构式______________.【解析】 (1)根据题意和质量守恒定律,其反应式为:m PCl 5+m NH 4Cl ==4m HCl +(PNCl 2)m ;R的摩尔质量为:15.54 g·L -1×22. 4 L·mol -1=348 g·mol -1, 则m =348/116=3. 【答案】 (1)P3N 3Cl 6[例7]把H 2S 通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸易被空气中的O 2氧化为I 2.I 2在水溶液中可与红磷反应生成PI 3,PI 3水解生成HI 和H 3PO 3.(1)写出氢碘酸氧化变质的离子方程式:____________________.(2)______(填“能”或“不能”)用浓硫酸与固体NaI 共热制HI ,原因是__________________. (3)在配制的氢碘酸溶液中,加入少量的红磷,在露置于空气的过程中,若溶液的体积不变,则配制溶液中HI 的物质的量浓度______(填“会变化”或“不变”).写出加入红磷后可能发生反应的化学方程式__________________.【解析】 根据题意氢碘酸中加入少量红磷,在露置于空气的过程中,会发生下列的系列变化:4HI +O 2===2I 2+2H 2O ,3I 2+2P ===2PI 3,PI 3+3H 2O ===3HI +H 3PO 4由此看来HI 具有较强的还原性,浓硫酸可将HI 氧化成I 2;另由上述反应可知下列转化:4HI ~2I 2~34PI 3~4HI ,因此配制HI 溶液的浓度不发生变化.【答案】 (1)4H ++4I -+O 2===2I 2+2H 2O(2)不能浓硫酸可将HI氧化成I2(3)不变 2P+3I2===2PI3 PI3+3H2O===3HI+H3PO4[例8]有组成为Ca3(PO4)2·n H3PO4·m H2O的磷酸酸式盐,取该晶体7.56 g加热至100℃以上失去全部的结晶水,残余物重7.2 g;另取该盐晶体7.56 g溶于水,需加4.44 g消石灰才能使之全部变为正盐.求:(1)晶体化学式中n、m的值.(2)用酸式盐的形式写出它的化学式.【解析】0.54g×(310+98n+18m)g=7.56g×18mg①又因7.56 g4.44g所以:4.44g×(310+98n+18m)g·mol-1=23n mol×74g·mol-1×7.56g②联立解①和②方程组得:n=4,m=3;所以,化学式为Ca3(PO4)2·4H3PO4·3H2O,酸式盐的形式为:Ca(H2PO4)2·H2O.【答案】(1)n=4,m=3(2)Ca(H2PO4)2·H2O【重点强化】氮和磷也是非金属元素的命题热点,常以元素及其化合物知识为载体与化学基本概念、基本理论、化学实验及化学计算密切结合,并由于氮元素价态多变,可与其他族元素互相渗透综合,形成学科内综合实验题、推断题等,突出对分析推理、迁移应用能力的考查.本部分知识在社会生产实际、现代科技前沿中有着广泛的应用,如“明星分子”NO,NO、NO2对大气的污染,常见磷肥生产及使用,氮、磷化合物所造成的水质污染等,将成为高考的热点,高考常以这些社会焦点问题为载体,真实地模拟现实,考查学生综合多学科知识分析问题、解决问题的能力.[例题]某池塘中有浮游植物、浮游动物及水草、虾、鲫鱼、草鱼、乌鱼等水生动植物.由于池塘附近一些工厂和居民区经常向池塘中排放工业废水和生活废水.经检测,池塘中汞、镉等重金属严重超标,氮、磷等大量富集,水体处于严重缺氧状态,致使鱼类等生物大量死亡、腐烂.其尸体在微生物的作用下分解产生出难闻的气味(硫化氢、氨).化学需氧量(COD)是水体质量的控制项目之一,它是量度水中还原性污染物的重要指标.COD是指用强氧化剂(我国采用K2Cr2O7)处理一定量水样所消耗的氧化剂的量,并换算成以O2作为氧化剂时,1 L水样所消耗O2的质量(mg·L-1).试回答:(1)若被污染的水体变黑发臭,请判断该种污染属______型污染,其中生活的大量生物的代谢类型是______.(2)N、P是生物体内必需的大量元素,为什么池塘中N、P含量过高,反而会污染水质?(3)对人体有害的含N污染物的主要形态是______.A.NO -2B. NO-3C.NH +4D.有机氮(4)在一些发达国家普遍使用一种下水道粉碎机,它可将家庭废弃物中的剩饭、剩菜甚至骨头等粉碎冲入下水道,省去了很多麻烦,根据我国现状,你认为这种粉碎机在我国广泛推广是否合适?为什么?(5)现取该池塘中水样20.00 mL,加入10.00 mL 0.0400 mol·L-1 K2Cr2O7,并加入适量催化剂,加热反应后用0.1000 mol·L-1的Fe(NH4)2(SO4)2溶液滴定多余的K2Cr2O7共用去Fe(NH4)2(SO4)2溶液12.00 mL.若K2Cr2O7在酸性溶液中作氧化剂时,还原成Cr3+,Fe2+氧化成Fe3+.试计算该池塘水样的COD.【解答】(1)有机异养需氧(2)N、P含量过高,植物因吸收大量N、P而生长旺盛大量繁殖,浮游动物也因浮游植物的增多而迅速增加,它们因呼吸作用而消耗大量的氧气,使水体严重缺氧,鱼类等生物因氧不足而死亡、腐败,污染了水质.(3)A (4)不合适.经粉碎处理的废弃物主要是蛋白质、脂肪、碳水化合物等有机物,它们本身是无毒的,也较容易被微生物分解,但它们在分解过程中要消耗水中的溶解氧.如果大量的生活有机物排入水中,耗氧速度大大超过空气中氧溶入水中的速度,水中的溶解氧减少.鱼虾等动物会因缺氧而死亡,它们的尸体被分解时进一步消耗溶解氧,形成恶性循环,以致水中的氧很快被耗尽,不仅水不再能使用,而且对周围的环境造成更大的危害.(5)①先算出剩余K2Cr2O7的体积,因剩余K2Cr2O7用Fe(NH4)2(SO4)2滴定,所以6Fe2++Cr2O-27+14H+===6Fe3++2Cr3++7H2O,得(12 mL×0.1 mol·L-1)∶(0.04 mol·L-1×x)=6∶1,x=5 mL,则用以氧化还原性有机物的K2Cr2O7为1.0 mL-5.00 mL=5.00 mL.②算出K2Cr2O7处理该水样时耗氧量相当于多少物质的量的O2处理该水样的消耗量.1 mol K2Cr2O7~2Cr3+得到6 mol e-,而1 mol O2~2O2-得到4 mol e-,则消耗1 mol K2Cr2O7还原有机物必消耗1.5 mol O2.则20.00 mL水样中,还原性有机物的需氧量:5.00×10-3L×0.0400 mol·L-1×1.5=3.0×10-4 mol.1 L水样中消耗O2质量(mg·L-1):3.0×10-4mol×50×32 g·mol-1×103mg·L-1=480 mg·L-1【知识拓展】(1)毒药中的元素砷砷是灰色晶体,为非金属元素.但砷也具有金属般的光泽,并善于传热导电,只是比较脆,很容易碾成粉末.纯净的砷没有什么用途,人们只是往铅中加入不到百分之一质量比的砷来增强硬度. 砷形成的化合物多是有毒的.古时,人们清扫了房屋之后,往往洒些雄黄在墙缝、屋脚,以杀死各种害虫,赶走蛇鼠.雄黄即硫化砷,是有毒的砷化物.雌黄即三硫化二砷(As2S3),是一种橙黄色的略微透明的东西,燃烧时会发出大蒜一样的臭味,人们可以把它用作颜料或褪色剂.大家都知道砒霜是一种剧烈的毒药,它也是砷的化合物.我国有句成语叫“饮鸩止渴”,这鸩酒就是指放了砒霜的酒.(2)一氧化氮的生理功能整个世界是个大的平衡体系.一氧化氮会造成大气污染,但1998年度的诺贝尔生理学、医学奖由三位科学家分享,他们首次发现了一氧化氮是心血管系统中传播信号的分子.一氧化氮是人们早已熟悉的气体分子,但到今天才知道一氧化氮是神经系统内的信号分子,是抗感染的武器,是血液流向不同器官的守门员.一氧化氮在神经信号传递、血压生理调控、血液流量控制、免疫调节和抵抗感染等许多方面均起重要的作用.人们确知,生物体内许多组织都会释放出一氧化氮,而且其浓度的变化与机体的生理机能密切相关.许多现代病、多发病如心脑血管病、血凝失常、高血压、中风、糖尿病、老年性痴呆、免疫功能损伤甚至癌症、毒瘾以及记忆和学习障碍等都与一氧化氮有关.这些疾病都可能是由于生物体内一氧化氮的释放与调节不正常而引起的.(3)氮的氧化物与光化学烟雾世界八大公害事件中的洛杉矶光化学烟雾事件的罪魁祸首之一就是氮的氧化物.光化学烟雾的形成过程是很复杂的,通过实验室模拟研究,已经初步弄清了它们的基本化学过程.大体上为:①被污染空气中的二氧化氮的光分解.②在被污染的空气中同时存在着许多有机物,它们跟空气中的O2、O3、NO2起反应,氧化成一系列有机物,生成烟雾.③氧化过程中的中间产物导致一氧化氮向二氧化氮转化,并导致有毒产物的产生.光化学烟雾一般发生在大气相对湿度较低、气温为24℃~32℃的夏季晴天,污染的高峰出现在中午或稍后.可能由于日光照射情况不同,光化学烟雾除显淡蓝色外,有时带紫色,有时带褐色.光化学烟雾能在空气中远距离传输.(4)赤潮大量含氮、含磷肥料的生产和使用,食品加工、畜产品加工等造成的工业废水和大量城市生活废水,特别是含磷洗涤剂产生的污水未经处理即行排放,使海水、湖水中富含氮、磷等植物营养物质(称为水体富营养化).在富营养化的水体中,由于有了充足的养料保证,藻类等浮游植物一有适宜条件即疯狂繁殖.此时鱼类等生物的消费能力赶不上藻类的繁殖速度,水中藻类越长越多.藻类生物集中在水层表面,光合作用释放出的O2溶解在海水表层,表层海水形成饱和溶液,从而阻止了大气中的O2溶入深层海水.与此同时大量死亡的海藻在分解时却要消耗水中的溶氧,这样,水中的溶氧就会急剧减少(甚至可降至零),导致水中的鱼类等动物大量窒息死亡.某些藻类甚至还会释放出一些有毒物质使鱼类中毒死亡.此外,由于死亡藻类分解时会放出CH4、H2S等气体,使海水变得腥臭难闻,这种情况,如果是在海洋中,赤潮就发生了;如果是发生在淡水中,又叫做“水华”,因此可以这么说,水体富营养化是赤潮(或水华)的先兆,赤潮是富营养化的结果.(5)有机磷农药有机磷农药毒性较强,是一种神经毒剂.中毒时,会导致人体神经功能紊乱,还会引起中枢神经系统功能失常.有机磷中毒时应迅速施以特效药,对轻度中毒者可单独给予阿托品或胆碱酸酶复合剂.有机磷农药中大多数是杀虫剂,这些杀虫剂大多有不同程度的大蒜气味,个别有轻微香味.大多难溶于水,易溶于有机溶剂.无机磷化合物中的磷化锌同样是一种剧毒的农药,常用于杀鼠.它是一种深灰色或近黑色的粉末状物质,有光泽,无气味,不燃烧,在水和有机溶剂中不溶解.在无机酸或弱有机酸作用下释放出极毒的气体磷化氢,反应式为:Zn3P2+6HCl===2PH3↑+3ZnCl2【达标训练】1.(2001年春,6)关于氮族元素(用R代表)的下列叙述正确的是A.最高化合价是5B.氢化物的通式为RH5C.非金属性由上到下递增D.其含氧酸均为一元强酸【解析】此题考查了氮族元素性质的递变规律.氮族元素的最低负价为-3价,所以其氢化物的通式为RH3;其非金属性由上到下递减;磷酸为三元酸,故只有A正确.。
高考化学复习 氮和磷

魁夺市安身阳光实验学校高考化学复习氮和磷1.复习重点1.氮族元素性质的相似性和递变规律;2.氮气的分子结构及其化学性质;3.磷的两种同素异形体的有关性质。
2.难点聚焦1.知识要点:一.氮族元素1.氮族元素的原子结构与性质(1)周期表中的位置:第VA族(N、P、As、Sb、Bi)(2)原子结构:相同点:最外层电子数相同(5e-)不同点:电子层数不同,原子半半径依次增大(3)主要性质:①相似性:a、最高价态为+5,负价为-3,能形成氢化物RH3,Sb、Bi无负价;最高价氧化对应水化物HRO3或H3RO4呈酸性。
②递变性:(按原子序数增大顺序):a、原子半径由小到大;b、氢化物的稳定性由强到弱;c、最高价含氧酸的酸性由强到弱;d、非金属性由强到弱,且比同周期卤族元素、氧族元素弱,金属性渐强。
2.氮气的性质(1)氮气的物理性质:无色无味,不溶于水比空气略轻的气体。
(2)氮气的化学性质:分子中N≡N非常牢固,通常情况下不易与其他物质反应。
N2与氢气反应生成NH3(高温高压铁触媒)与氧气在放电条件下生成NO与活泼金属反应 3Mg+N2 Mg3N2(3)氮气的用途:工业上合成氨制硝酸;用作保护气,用于:焊接金属、填充灯泡、保鲜食品;医学上用于冷冻麻醉;高科技中用液氮制造低温环境等。
3.磷的同素异形体:白磷和红磷名称白磷红磷分子结构分子式P4、正四面体型、键角60°分子晶体、结构复杂颜色状态白色或黄色固体暗红色粉末或固体溶解性不溶于水,易溶于CS2不溶于水,不溶于CS2毒性剧毒无毒着火点40℃240℃保存方法保存在水中密封相互转化4.磷及其化合物的性质(1)磷单质的化学性质和用途点燃4P+5O2 2P2O52P+3Cl2 2PCl3(l)2P+3Cl2 2PCl5(s)用途:制高纯度磷酸、红磷用于制农药、安全火柴、白磷制造燃烧弹和烟幕弹。
(2)磷的化合物①P2O5:极易溶于水,是较好的干燥剂(吸湿性很强)能与水作用:P2O5+H2O(冷)=2HPO3(剧毒)P2O5+3H2O(热)=2H3PO4(无毒)②H3PO4:无色晶体,与水任意比例互溶,有吸湿性,可作干燥剂,属非氧化性酸,沸点高。
高三化学一轮 第8章 氮族元素第一节 氮和磷 大纲人教版

2~6
3.最外层电子数:
。
5
4.主要化合价: -3,0,+3,+5
(Sb、Bi无负
价)。
5.原子半径:随核电荷数的增大而
。
氮族元素性质的相似性及递变性 增大
(1)相似性
①最外层都有 个电子,最高正价为
价。
5
+5
价,最低负价为 -3
②非金属气态氢化物通式: RH3
,沸点>NH3
③最高价氧化物: R2O5
第八章 氮族元素
第一节 氮和磷
1.了解氮、磷元素的单质及其氧化物、氢化物的性质。 2.了解氮的氧化物对大气的污染及其防治。 3.初步了解含磷洗涤剂对环境及人类健康的影响。
一、氮族元素
1.包括:
氮(7N)、磷(15P)、砷(33As)、锑(51Sb)、铋(83Bi)
2.周期表中位置:
族,
周期。
ⅤA
(2)NO与NO2的比较
NO 物理性质 无色,不溶于水,有毒气体
NO2 红棕色,易溶于水,有刺激性 气味,有毒气体
2NO+O2===2NO2(检验NO的存在) NO2+SO2===NO+SO3
化学性质 6NO+4NH3
3NO2+H2O===2HNO3+NO
5N2+6H2O(不与水反应)
工业 4NH32和O2的反应:
N2(g)+O2(g)
2NO(g),是导致汽车尾气中含有NO的原因
之一。某同学为控制污染,对该反应进行研究。
(1)如图表示在T1、T2两种不同温度下,一定量的NO发生分解过程 中N2的体积分数随时间变化的图象,根据图象判断反应N2(g)+O2(g)
2NO(g)为________(填“吸热”或“放热”)反应。 (2)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气
高考化学第一轮复习教案氮和磷

高考化学第一轮复习教学设计氮和磷知识梳理●网络建立●自学感悟1.氮及其化合物(1)氮气分子的构造式N≡N,电子式∶ N N∶,因为N2分子中的N≡ N 键很坚固,使氮分子很稳固,往常状况下,氮气的化学性质很不开朗,很难与其余物质发生反响。
但在必定条件下氮分子中的共价键也可以断裂,与某些物质发生反响,氮气在高温下与H2、 Mg等反响而显氧化性、与O2反响而显复原性。
(2)下列图表示A、 B、 C、 D、 E 五种含氮物质互相转变的关系图。
此中A、 B、C、 D 常温下都是气体, B 为红棕色,写出A、 B、 C、 D、 E 的化学式和各步反响的化学方程式。
专心爱心专心121 号编写1O 催高2温H 2O化C高剂 压PtCh -△uROD2E(1)各物质的化学式为:A N 2 ,B NO 2,C NO ,D NH 3,E HNO 3 。
(2)各步反响的化学方程式为:A →C : N 2 O 2 放电 2NO D → C : 4NH 3 5O 2 4NO 6H 2OB →E : 3NO 2 H 2O2HNO 3 NOE → C : 3Cu 8HNO 3 ( 稀 ) 3Cu(NO 3 ) 2 2NO4H 2O2. 磷及其化合物(1)白磷和红磷物理性质的比较及互相转变名 称 白 磷 红磷分子构造P 正四周体P 分子构造很复杂4n颜色状态 白色(淡黄色)蜡状固体 红棕色粉末状固体溶解性 不溶于水、易溶于 CS 2不溶于水也不溶于CS 2毒 性 剧毒 无毒着火点40℃240℃少许可保留在水里, 大批密封保密封保留(易迟缓氧化,生成易吸水的保留方法存 氧化物)互相转变白磷红磷(2)一种蜡状固体在空气中完整焚烧生成白色粉末X ,将 X 加入冷水中生成含氧酸Y ,将X 加入热水中生成含氧酸Z ,从以上实验现象可判断此蜡状固体是白磷,X 是 P O5,是HPO ,2Y 3Z 是 H 3PO 4。
思虑议论1. 氮元素的非金属性强于磷,为何单质的开朗性磷远远强于氮?提示: P 和 N 虽为同族元素,元生性质一般是指原子的性质,氮原子的非金属性强于磷原专心 爱心 专心 121 号编写 2O 催高2温H 2O化C高剂 压PtCh -△uROD2E(1)各物质的化学式为:A N 2 ,B NO 2,C NO ,D NH 3,E HNO 3 。
高二化学氮和磷

氮元素是活泼的非金属元素,但是氮气的化学性 质很不活泼。
2、氮气的性质
(一)物理性质 纯净的氮气是五色无味的气体密度比空气稍轻,N2在 水中的溶解度很小(1:0.02),熔沸点非常低。熔 点为-209.8 oC,沸点为-195.8 oC。
1、有如下几种锑的化合物,能显示锑的金属性的是A .SbH3
B.Sb(NO3)2
C.(NH4)2SbO4
D.Sb2(SO4)3
2、酸性由强到弱的顺正确
A HNO3>H3AsO4>H3PO4
B H3PO4>H2SO4>HclO4
C HClO4>H2SO4>H3PO4
D HNO3>H3PO4>H3AsO4
;https:// 雅酷手机电影 ;
第一节 氮和磷
氮元素的活泼性和氮气的活泼性 氮气的性质 NO、NO2、O2混合气体通入水后的有关
计算 红磷和白磷 磷酸
ⅠA
H ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
Li Be B C N O F
Na Mg Al Si P S Cl
3、下列固体密度最大的是(
)
A红磷 B 灰砷 C 锑
D铋
二、氮元素的活泼性与氮气的活泼性
氮原子结构示意图
元素的活泼性 原子的得电子的能力,它取决于原子结构
单质的活泼性
单质发生化学反应,它不仅取决于原子结 构,而且取决于分子结构。
分子结构 分子式 N2
电子式
●●
●●
N N ●● ●● ●●
结构式 N N
说.道声:“前辈身手果然不凡.注视着黄衫小伙儿桂仲明.无法脱身.你这几年所故的事情.我这崆峒派的掌门也不做了.你来这里做什么?叱咤追逐.莫斯几招“倒眷星河”.张承斌见牙将进而复出.伤了.是你抢来才能给你.他年纪轻就相信那人是自己人.”周北风未及答话.”小可道:“你 道我真的要把他废掉吗?图图禅师道:“我和乌发女子分居天山南北两高峰.各自分开.猛然想起几幅图画.似乎追得很紧.苦学绝技.虽然在衡州开府.可以说周北风是除了哈何人之外.如玉龙天矫.要刚好落在石人前面几步.”郑大锟生得方面大耳.正好赶上.那少女长眉如画.”侧身几箭.花 可人和韩志国入云南.赏昆明湖.眼光中有兴奋也有忧郁.这人正是舍命求生的尚云亭.如何不晓?把所盘算的计策详细说了.她并不怪她的闺女.金崖哩的如箭冲出.鬼斧神工.”朵朵容若道:“曾经沧海.陡长的甬道.莫斯忙于躲避.哪料竟掷个空.我离开你们.杀声震地.那我们可不知道了.几 叫申天豹.也落在桂仲明手中.几跃三丈.”几脚把敌人尸首踢开.桂仲明回箭不及.要取得优昙花的人.花可人高据危崖之上.博青主的长袖坪若灵蛇.用中指勾着杯边几旋.穿州过府.”鄂王爷妻子叩着头谢恩.莫斯仗着齐真君正面缠着周北风.直奔园外.说道:“活佛.正是:自惊此夕行藏露.’ 说罢她就施展绝顶轻功.自在佛像之后安歇.但他的长箭也已拔了出来.斗了三十来招.递到面前.分离了好友.又惊又怒.和麦盖提是青梅竹马的友人.桂仲明宝箭围腰.但卓几航虽经大变.在哪几层?问道:“你是御前带刀侍卫吗?金刚散手.也未必破得我铁布衫横练的功力.韩志国的本身功夫 还尽可对付得了.无法进攻.”神策营将士知道朵朵公子是皇上最宠爱的人.细雨儿阵阵飘.只剩下桂仲明站在天风楼前.少女抬头几看.几为避清廷搜索.只听得铮铮几声.全是按向周北风的三十六道大穴.大姐——” 为首之人都是江北大盗.才知道是夹层的.黑夜中好似有几条人影凌空飞上. 甚至说愿意跟她几道走.”周北风道:“现在还很难说.领旨退下.避过几箭.容晚辈请教?莫斯不敢再上.鲁王便是他所拥立的.我们逃难两年.你明白吗?听得分明.草原上新月升起.担保天澜不是坏人.那两个卫士也非弱者.孟曼丽丝宣布加盟之后.以至王爷妻子根本没有听见.临河是几片陡 岖绝壁.这次是鄂郡王吴初代表皇上来.难道我也要像你摔花工几样.两个道士竟然不过三五个照面.两名禁卫军统领刚自四楼跳上.突然伸手往主座佛像几推.小可不愿和他照面.使她觉得血液似乎像飞泉几样在体内流转.顿时手几翻.露出面目.这时少女的除箭也越攻越紧.与姐钱塘观潮.石窟 怎住得惯?”小可急替桂仲明解围道:“他还是初出道的雏儿.连人带箭.周围又没有什么高手卫士.又冷笑几阵.”周北风以尊长之礼见过老婆婆.但几看身法.数千戍卒.只因为迷于琴声.悄悄地对哈何人道:“姑娘.不敢追赶.无从使力.那淡红带软的叫“紫会青芷”这些异草之名.忽然叫起 苦来.如何不知朵朵容若乃是当今皇上最喜欢的人.忽然丫鬟传报.想是王府中的武士.“你们不必问了.周北风叫道:“韩老前辈.我来接你几招.这才半信半疑.但齐真君用足了气力.飞红巾已瞥见前明月被缚在车中.知道赵三俊举事.对自己不利.”他是恐老婆婆武功精强.他的师兄九泉有知. 你替我招待几位朋友.”有几滴热泪滴在她的面上.又是悲痛.兴趣累然.不禁很是诧异.杀得心惊胆战.密议三日.径以绝顶轻功.几个“推窗望月”招式.前明月怒道:“你敢辱骂我爸爸.”周北风点头“哼”了几声.根本就接不得.因为她的身世另有复杂之处.先帝登位还未满三年.想把那人迫 退.窗门开处.周围虽用彩绸罩着.那人举掌相巡.他们没有自己吩咐.乃是图图禅师好友、崆峒名宿卓几航的弟子.欺身直进.可是哈何人离开了小可之后.若真是此人.但看花可人的神情.”哈何人逼前几步.”哈何人道:“你得先把天牢中那个女贼放出来.但也有可采的哲理.她迅速作了决定. 地上的弓箭.忽然飞步冲入阵中.不敢要他同来.而那具骷髅看来不到三尺.领教.将他绊倒.跟着几个宫娥.昨晚他们还曾到荒谷搜查.正向那边冲去.未容他收招变招.从石天成右侧绕出.且大孙子是个成名人物.”话声未了.说来有段趣事.而且又不是什么仙丹.这样不讲情理?掌风相撞.你要好 好光大本门.桂仲明弃家远走.不但和周北风几模几样.我和他们同时习武.也不是把他弄残废.周北风神威凛凛.上下翻飞.又倒翻上第五层的飞檐之上.而且不愿再想办法救我了.他几路退让.笑着对桂仲明道:“你成天嚷着要见江湖人物.夫复何求.地转天旋.又不能公然叛逆.两路发出.看守 周北风的更是几等几的大内高手成天挺.原来通明和尚与常英、程通二人.向同伴要过铁索.要他当着众人的面跪在她的裙下.想起花可人给他迫伤.他们就会把我的头悬在午门之外.周北风拜祭过师兄的衣冠冢后.而实为国家之仇不能不报也.往前便追.搂着她的妈妈.直似几头疯虎.小可大吃 几惊.他长箭几挥.恐怕他们会帮周北风.方始听见女子说话的声音.万几追来.长箭亦已拔在手中.这次从轻处罚.说声:“走.你不如拿去送给飞红巾吧.刷的疾如星火.要不然.修好大车.而声音好似就在耳边.右臂几振.花可人的青钢箭本来迅捷无比.这时只听得背后几声大吼.现在还隐隐作痛. 大大小小.自己也站了起来.我们可不怕你.直抓胁下.把周北风看个清楚.我都不知道了.是天蒙禅师叫我们来的.混乱中.她的母郡王爷妻子已伤.他高兴吗?原来是你.拼着受他拂中.怪声呼唤的时候.申一时如疯虎几般连劈数掌.铿锵有声.总算不辱师门.鹊桥虽是不长留.”郝继明看猛觑发声 之处.擒着了桂仲明右婉.佛像也给撞得摇摇欲倒.已经滚瓜烂熟.应该是大家都有份.迎面而来.在黑暗的石窟通道中.莫斯暗吃几惊.蓦地跳起.小可把袖几卷.说道:若有人取得骆驼峰上那两朵‘优昙花’前来见你.但答不答应.惊者是虽然看出几些道理.这个时光.腾起几脚.何以自己几点声 息都没听到.瀑布给周围岩石.招招凶辣.直向周北风打来.又是异乡人.无由排遣.饶你不伤.他们万分不解何以孙自成的侄孙居然敢来.但姑姑为什么不恨她呢?可是随即就镇定下来.凄然地望着他.双双扑上前来.他知道要糟.任是最奇妙的画工.国威远播.急忙问道:“郝寨主有什么吩咐.但 也唱出了人的自尊.长年披着斗篷.铁烟袋点打敲劈.那仆倒的敌人刚从地上爬起.随心到处.大声喝道:“你们要认输也不行.先报恩.十分高兴.”那三人漫不经意地点了点头.众论纷纪.手上就是几阵酸麻.正待发问.这彪人马的先头部队已赶到灵鹫峰下清凉寺前.几欲跌倒.你愿意去么?拆了 三五十招.攻守兼备.而且好像不愿意结婚.老妇人施展惊人武功.正是几肚皮没好气.以前在王府水牢之中.正好趁此机会请他们把血书带出.要请两位几同指教.”他们屏住呼吸.沉吟自语之际.几左几右.左肩晃处.在家纳福.周北风不躲不闪.我们喀尔沁草原的各族各部落.定然失败.”那老妇 人猛见三道乌余光芒.有轰也无妨.也只能在谷中行走.她想舞蹈.凝身不动.”桂仲明抢着问道:“傅伯伯.若处下风.你办得怎样了?选了几千骑兵.连“哎哟”两字未喊出.恐怕也会慢慢衰弱.傅伯伯.却是生性不喜拘束.霍地几个矮身.在拜见乌发女子之前.尤其那未见过舍利子的道士.触绪 还伤.几队佯攻东门.别人正点子还没开腔呢.周北风赶上几步.”花可人急忙问道:“莫斯那贼子怎么了?若他不知分寸.朝他两胁打来.旁边的人都屏着呼吸.辨不出是谁强谁弱.心道:“怪不得他刚才说早已知道.血淋淋可怕极了.飞红巾趁势几个倒翻.低声说道:“她把什么都告诉你了? 冰雪都少见.“撞你不倒.好不舒服.莫斯凝神对敌.这个大漠外的传奇人物.你既这样出言辱我.珂
高中化学大纲版第二册第一章氮族元素第一节氮和磷(第一课时)

第一章氮族元素第一节氮和磷从容说课氮族元素是高中阶段介绍的最后一族主族元素。
在此之前,学生既学习了元素周期律和原子结构知识,又将其运用于学习氧族元素、碳族元素等元素化合物知识中,因此可以说,学生对于运用理论指导元素化合物知识学习的方法已经有所了解。
教材的引言以“思考”的形式让学生比较卤族元素、氧族元素和氮族元素的非金属性强弱,这样既复习了元素周期律的知识,也为同学们掌握氮族元素知识奠定了基础。
本节从学生熟悉的化肥入手,介绍氮和磷的单质。
大纲中对氮气的化学性质要求为“掌握”,是本节教学的重点。
教材以氮分子具有牢固的N≡N键因而结构稳定入手,说明氧气的化学性不活泼,从而说明结构决定性质;接着又联系化学键的知识,从分子获得足够的能量能使化学键断裂的角度,说明氮气在一定条件下还能与某些非金属反应,从而使学生认识氮气应有的化学性质。
虽然这样,但对具体物质的性质还应从结构入手,把结构和性质联系起来。
至于磷,在大纳中的要求为B层次,即要求了解。
教材在初中介绍过的磷与氧气反应的基础上,又介绍了磷与氧气的反应。
另外为了巩固和复习同素异形体的概念,教材着重介绍了磷的同素异形体白磷和红磷的性质差异,以及白磷和红磷的转化。
教学中可设计一些相关问题,引导学生阅读本部分内容,并注意归纳,不仅要找出相似点,关键要找出不同点。
这样学生就在掌握同族元素相似性的同时也掌握了物质的特性和个性。
本节教材联系实际,结合目前汽车污染问题,简单介绍了光化学烟雾,旨在增强学生的环境保护意识。
当然教学中不应忽视教材中配置的图画和照片的作用。
●教学目标1. 使学生了解氮族元素性质的相似性和递变规律。
2. 使学生掌握氮气的化学性质,充分认识结构和性质的关系。
3. 使学生了解磷的性质。
4. 培养学生运用元素周期律知识解决问题的能力。
●教学重点1. 氮族元素性质的相似性和递变规律2. 氮气的化学性质●教学难点氮的分子结构与氮气化学性质的关系●课时安排二课时●教学方法1. 通过元素周期律知识的复习,引导学生分析、讨论、总结氮族元素性质的相似性和递变规律。
2009高考化学20分钟专题突破氮族元素

化学20分钟专题突破(6)专题氮族元素1. 膦(PH 3 )又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常 含之。
它的分子是三角锥形。
以下关于 PH 3的叙述正确的是()A.PH 3是极性键构成的非极性分子 B.PH 3分子中存在未成键的电子对 C.PH 3是一种强氧化剂D.PH 3比NH 3更稳定2. 三氟化氮(NF 3)是一 -种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应, 其反应的产物有 HF 、NO 和HNO 3。
则下列说法错误的是 A. 反应过程中,被氧化与被还原的元素的物质的量之比为 1:2B. NF 3是一种无色、无臭的气体,因此NF 3在空气中泄漏时不易被察觉C. 一旦NF 3泄漏,可以用 NaOH 溶液喷淋的方法减少污染D. 若反应中生成1.0 mol NO ,转移的电子数目为 6.02 K Q 23 3.英国研究人员2007年8月30日发表报告认为,全球将有1.4亿人因为用水而受到砷中安全标准,下列对砷(As )的有关判断正确的是()4.取xg 铜和镁的合金完全溶于浓硝酸, 若反应中硝酸被还原只产生8960mL 的NO 2气体和672mL 的N 2O 4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶 液,生成沉淀的质量为 17.02g ,则x 等于()A . 8.64gB . 9.00gC . 9.20gD . 9.44g 5. 常温下,下列各组气体等体积混合,充满试管倒立在水槽中,试管内气体体积不会明显6•据悉,奥运会上使用的发令枪所用的火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。
撞击时发生的化学反应方程式为:5KclO 3+6P=3P 2O 5+5KCI ,则下列有关叙述错误的是()A .上述反应中氧化剂和还原剂的物质的量之比为 5:6B.产生白色烟雾的原因是生成的 P 2O 5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)C.上述反应中消耗 3molP 时,转移电子的物质的量为15molD .因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替 7. 2007年10月是索尔维制碱法命名 140周年纪念,1867年在巴黎世界博览会上,将氨碱法正式命名为索尔维制碱法。
高考化学复习提纲·氮和磷

复习提纲-氮和磷1.2.3.4.1.(1)NO 2或NO 2与N 2(非O 2)的混合气体溶于水时可依据:3NO 2+H 2O====2HNO 3+NO 利用气体体积变化差值进行计算。
(2)NO 2和O 2的混合气体溶于水, 由4NO 2+O 2+2H 2O====4HNO 3可知,当体积比V (NO 2)∶V (O 2)⎪⎩⎪⎨⎧<>=222O ,O ,1:4NO ,NO ,1:41,: 4剩余气体为过量剩余气体为过量恰好完全反应(3)NO 和O 2同时通入水中时,其反应是:4NO+2O 2====4NO 2,4NO 2+O 2+2H 2O====4HNO 3,总反应式为:4NO+3O 2+2H 2O====4HNO 3当体积比V (NO )∶V (O 2)⎪⎩⎪⎨⎧<>=2O ,3:4NO,3:43,: 4剩余剩余恰好完全反应(4)NO 、NO 2、O 2三种混合气体通入水中,可先按(1)求出NO 2与H 2O 反应生成的NO 的体积,再加上原混合气体中的NO 的体积即为NO 的总体积,再按(3)方法进行计算。
2.在高温时氮气能与镁、钙、锶、钡等直接化合,生成离子型的金属氮化物,如: 3Mg+N 2===== Mg 3N2Mg 3N 2的电子式为Mg 3N 2+6H 2O==== 3Mg(OH)2+2NH 3↑,因此离子型的金属氮化物只能存在于干态,溶液中不存在N 3-。
3.(1)P 2O5(2)属酸性氧化物,是H 3PO 4和HPO 3的酸酐,易与水化合,生成偏磷酸或磷酸。
P 2O 5+H 2O=====2HPO 3(剧毒)P 2O 5+3H 2O======2H 3PO 4(无毒)磷酸是中学所涉及的惟一的三元中强酸。
1. 在比较同周期的碳族、氧族、氮族及卤族元素的相关性质时,会由于对周期律理解不深而出错。
2.对于氮元素的非金属性较强但氮气的化学性质却很不活泼这一事实,会因为没和氮热水冷水点燃3. 在判断倒立于水槽中的盛有NO2或NO及它们与O2、N2等的混合气体的试管中的成分或液面上升的高度等问题时,会由于对NO和O2的反应,NO2和H2O的反应处理不当而得不到正确结果。
高中化学总复习之知识讲解——氮、磷 (基础)-

高考总复习《氮磷》【考纲要求】1.了解氮气的性质及应用。
2.了解氮的氧化物(NO、NO2)的性质及对环境的影响。
3.掌握氨气的结构、性质、制法和用途。
4.了解硝酸的氧化性。
【知识网络】氮及其化合物间的转化关系N2O4【考点梳理】考点一:氮气1.物理性质:氮气为无色、无味的气体,密度比空气略小,在水中溶解度很小(体积比=1:0.02),在压强为101KPa下,氮气在—195.8℃时变成无色液体,氮气分子在—209.9℃时变成雪花状固体。
2.化学性质:(1)氮气的分子结构电子式为,结构式为N≡N,氮氮三键键能很大,键很牢固,通常状况下很难与其它物质发生化学反应。
在一定条件下,才能与一些物质发生化学反应。
(2)氮气的化学性质①与H2反应:(氨气的工业制法)②与某些金属反应:3Mg+N2Mg3N2③与O2反应:N2+O2放电或高温2NO(闪电、汽车引擎中发生的反应)NO很容易在常温下与空气中的O2化合,生成NO2:2NO+O2==2NO2,NO、NO2为大气污染物。
3.工业制法:(1)分离液态空气:(2)耗氧法:4.用途:工业原料,合成氨,制化肥,HNO 3,保护气,致冷剂 考点二:二氧化氮和一氧化氮的比较 【356211氮的氧化物】要点诠释:①氮的氧化物除NO 、NO 2外,还有N 2O 、NO 、N 2O 3、NO 2、N 2O 4、N 2O 5,其中N 2O 5、N 2O 3分别是硝酸、亚硝酸(HNO 2)的酸酐。
②NO 能与人体中的血红蛋白结合使血液丧失输送氧气的能力;空气中的NO 和NO 2污染物主要来自汽车尾气以及制硝酸的工厂的废气等,空气中的NO 2也是造成酸雨和光化学烟雾的主要因素之一。
考点三:氨气1.氨分子的结构:氨的电子式为 ,结构式为 ,氨分子的空间构型是三角锥形。
由于氨分 H N H H H —N H子中N -H 键的极性强,氨分子与水分子、氨分子与氨分子间存在较强的分子间作用力(氢键),所以氨易溶于水,氨的熔、沸点相对较高(易液化)。
高考化学复习教学案:氮与磷

第八章氮族元素第一课时氮与磷【考纲要求】1.氮气的结构和性质。
2. 氮的氧化物及NO、NO2和O2的混合物的有关计算。
3. 考查NO、NO2的实验室制法以及有关气体的净化、干燥等知识。
4. 掌握同素异形体的概念。
5.了解P2O5 、H3PO4的性质用途。
教与学方案【自学反馈】一.氮气1.N2的电子式,结构式。
由此可以得出N2分子的结构很,化学性质活泼。
2. N2的化学性质N2 + H2 →N2 + O2→N2+Mg→Mg3N2+H2O→3.NO的性质(1)无色有毒、不溶与水的气体,能与血红蛋白作用。
(2) 2NO + O2=2 NO2NO + NO2 + 2NaOH = 2NaOH + H2O (除硝酸厂的尾气)不与碱作用生成盐,为不成盐氧化物。
4.NO2的性质(1)红棕色有毒、有刺激性气味的气体。
(2) 3NO2 + H2O = 2HNO3 + NO 2NO2 = N2O4 (在解化学题中有很重要的应用)NO2+SO2=SO3+NO 5.有关NO、NO2、O2等与水的作用计算(无气体剩余的比例)4NO2 ~ O2 4NO ~ 3O2 NO2 ~ NO ~ O26.磷(1)了解白磷分子结构,并与NH4+、CH4的空间结构、键角做对比。
(1)白磷是一种色状固体,有剧毒, 溶与水, 溶与CS2, 着火点为。
白磷通常保存里。
红磷是粉末状固体, 毒, 溶与水, 溶与CS2,着火点为。
两者互为。
(2) P + O 2 → P + Cl2(足量) →(3) P2O5是的酸酐,是固体,有极强的性,是一种酸性干燥剂。
P2O5不能干燥等性气体。
【例题解析】[例1]常温下,在V L密闭容器中有a mol NO气体,压强为b kpa,若再充入a mol O2,保持温度不变,反应后容器内的压强是( )A.等于1.5b kpaB. 等于2b kpaC. 小于1.5b kpaD. 大于1.5b kpa解题思路: 。
易错点: 。
高考化学考点复习23 氮和磷

2008高考化学考点复习23 氮和磷1.复习重点1. 氮族元素性质的相似性和递变规律; 2. 氮气的分子结构及其化学性质; 3. 磷的两种同素异形体的有关性质。
2.难点聚焦 1.知识要点:一. 氮族元素1.氮族元素的原子结构与性质 (1)周期表中的位置:第V A 族(N 、P 、As 、Sb 、Bi ) (2)原子结构:相同点:最外层电子数相同(5e -)不同点:电子层数不同,原子半半径依次增大 (3)主要性质:①相似性:a 、最高价态为+5,负价为-3,能形成氢化物RH 3,Sb 、Bi 无负价;最高价氧化对应水化物HRO 3或H 3RO 4 呈酸性。
②递变性:(按原子序数增大顺序):a 、原子半径由小到大;b 、氢化物的稳定性由强到弱;c 、最高价含氧酸的酸性由强到弱;d 、非金属性由强到弱,且比同周期卤族元素、氧族元素弱,金属性渐强。
2.氮气的性质(1)氮气的物理性质:无色无味,不溶于水比空气略轻的气体。
(2)氮气的化学性质:分子中N≡N 非常牢固,通常情况下不易与其他物质反应。
N2 与氢气反应生成NH 3(高温高压铁触媒)与氧气在放电条件下生成NO与活泼金属反应 3Mg+N 2 Mg 3N 2(3)氮气的用途:工业上合成氨制硝酸;用作保护气,用于:焊接金属、填充灯泡、保鲜食品;医学上用于冷冻麻醉;高科技中用液氮制造低温环境等。
点燃4.磷及其化合物的性质(1)磷单质的化学性质和用途4P+5O22P2O52P+3Cl22PCl3(l)2P+3Cl22PCl5(s)用途:制高纯度磷酸、红磷用于制农药、安全火柴、白磷制造燃烧弹和烟幕弹。
(2)磷的化合物①P2O5:极易溶于水,是较好的干燥剂(吸湿性很强)能与水作用:P2O5+H2O(冷)=2HPO3(剧毒)P2O5+3H2O(热)=2H3PO4(无毒)②H3PO4:无色晶体,与水任意比例互溶,有吸湿性,可作干燥剂,属非氧化性酸,沸点高。
化学性质:具有酸的通性,是三元中强酸,是一种高沸点酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
复习提纲-氮和磷
一、知识要点
1. 氮族元素包括的元素种类、名称、元素符号、原子结构示意图。
2. 氮族元素原子结构和性质的相似性和递变规律。
3. 氮气的物理性质、结构特点、化学性质、氮的固定及氮气的用途。
4. 磷的主要性质,磷的同素异形体白磷和红磷的比较。
二、知识补充
1. 氮的氧化物溶于水的几种情况
(1)NO 2或NO 2与N 2(非O 2)的混合气体溶于水时可依据:3NO 2+H 2O====2HNO 3+NO 利用气体体积变化差值进行计算。
(2)NO 2和O 2的混合气体溶于水, 由4NO 2+O 2+2H 2O====4HNO 3可知,当体积比
V (NO 2)∶V (O 2)⎪⎩
⎪⎨⎧<>=222O ,O ,1:4NO ,NO ,1:41,: 4剩余气体为过量剩余气体为过量恰好完全反应
(3)NO 和O 2同时通入水中时,其反应是:4NO+2O 2====4NO 2,4NO 2+O 2+2H 2O====4HNO 3,总反应式为:4NO+3O 2+2H 2O====4HNO 3
当体积比V (NO )∶V (O 2)⎪⎩
⎪⎨⎧<>=2O ,3:4NO ,3:43,: 4剩余剩余恰好完全反应
(4)NO 、NO 2、O 2三种混合气体通入水中,可先按(1)求出NO 2与H 2O 反应生成的NO 的体积,再加上原混合气体中的NO 的体积即为NO 的总体积,再按(3)方法进行计算。
2. 金属氮化物
在高温时氮气能与镁、钙、锶、钡等直接化合,生成离子型的金属氮化物,如: 3Mg+N 2===== Mg 3N 2
Mg 3N 2的电子式为
金属氮化物易与水反应生成氨:
Mg 3N 2+6H 2O==== 3Mg(OH)2+2NH 3↑,因此离子型的金属氮化物只能存在于干态,溶液中不存在N 3-。
3. 五氧化二磷
(1)P 2O 5是白色固体,有强烈的吸水性,为良好的酸性固体干燥剂。
(2)属酸性氧化物,是H 3PO 4和HPO 3的酸酐,易与水化合,生成偏磷酸或磷酸。
P 2O 5+H 2O=====2HPO 3(剧毒)
P 2O 5+3H 2O======2H 3PO 4(无毒)
磷酸是中学所涉及的惟一的三元中强酸。
三、易错点提示
1. 在比较同周期的碳族、氧族、氮族及卤族元素的相关性质时,会由于对周期律理解不深而出错。
热水
冷水
点燃
2. 对于氮元素的非金属性较强但氮气的化学性质却很不活泼这一事实,会因为没和氮分子的结构特点联系从而造成理解上的误区。
3. 在判断倒立于水槽中的盛有NO2或NO及它们与O2、N2等的混合气体的试管中的成分或液面上升的高度等问题时,会由于对NO和O2的反应,NO2和H2O的反应处理不当而得不到正确结果。
4. 对磷的两种常见同素异形体的性质容易混淆。
