酸碱中和滴定
酸碱中和滴定

酸碱中和滴定原理利用已知浓度的酸(或碱)滴定一定体积未知浓度的碱(或酸),通过测定反应完全时消耗已知浓度的酸(或碱)的体积,从而推算出未知浓度的碱(或酸)的浓度的方法。
一、主要仪器二、主要试剂未知浓度的称为已知浓度的称为判断滴定终点依靠,一般用或甲基橙 3.1 ——4.4 酚酞8.2 ——10.0红黄无红三、酸碱中和滴定步骤1、验漏2、洗涤3、注液4、滴定左手控制右手摇动眼睛注视的变化终点判断:滴入最后一滴溶液时颜色发生变化,且内颜色不变色。
5、数据处理计算依据:n(H+)=n(OH—)四、滴定误差分析C待= C标· V标/ V待以标准盐酸溶液滴定未知浓度的氢氧化钠溶液为例1、盛待测液前锥形瓶中有蒸馏水。
2、滴定管未用标准溶液润洗3、锥形瓶用待测液润洗4、碱式滴定管取待测溶液时尖嘴内开始有气泡,最后无气泡5、酸式滴定管滴定前滴定管尖嘴内有气泡,滴定后无气泡6、滴定前俯视读数或滴定后仰视读数7、标准液滴入锥形瓶外8、滴入一滴盐酸时溶液红色褪去,就马上读数9、取待测液的滴定管未用待测液润洗10、待测液附在锥形瓶口11、摇荡锥形瓶使溶液溅出12、确定终点过迟练习1.当酸碱完全中和时……………………………………………………………………()A.酸和碱的物质的量一定相等B.酸能够提供的H+与碱所能提供的OHˉ的物质的量相等C.酸与碱的质量相等D.溶液呈中性2.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是………()A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液C.滴定时没有排除滴定管下端的气泡D.滴定时视线与滴定管内液体的凹液面最低处保持水平3.在中和滴定实验中,调节滴定管内液面位置这一操作的要求是…………………()A.滴去多余的溶液,使液面处于刻度“0”的位置B.调节液面使其处于“0”或“0”以下的位置C.调节液面使其处于“0”或“0”以下的位置,且尖嘴内不留气泡D.调节液面使其处于“0”或“0”以上的位置,且尖嘴内不留气泡4.有一支50ml酸式滴定管,其中盛的溶液恰好在10.00ml刻度处,现把管内溶液全部流下排出,并且量筒承接,所得溶液的体积为…………………………………………()A.10 ml B.小于10ml C.40 ml D.大于40ml 5.为了测定苛性钾(KOH)的纯度,取样品0.56g,溶于水制成1L溶液,取此溶液25.00ml,用去0.005 mol·Lˉ1硫酸标准溶液24.00ml恰好完全反应,则苛性钾的纯度为………()A.96% B.48% C.9.6% D.56%6.当用酸滴定碱时,下列操作中使测定结果(碱的浓度)偏低的是………………()A.酸式滴定管滴至终点时,俯视读数B.碱液移入锥形瓶后,加了10 ml蒸馏水再滴定C.酸式滴定管用蒸馏水润洗后,未用标准液润洗D.酸式滴定管注入酸液后,尖嘴留有气泡,开始滴定7.下列仪器中,没有“0”刻度线的是……………………………………………………()A.温度计B.量筒C.酸式滴定管D.托盘天平游码刻度尺8.准确量取25.00 ml高锰酸钾溶液,可选用的仪器是………………………………()A.50ml 量筒B.25ml 容量瓶C.50ml 酸式滴定管D.50ml 碱式滴定管9.下列有关滴定操作的顺序正确的是:①用标准溶液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤洗涤……………………………………()A.⑤①②③④B.③⑤①②④C.⑤②③①④D.②①③⑤④10.下列实验操作中,所用仪器合理的是………………………………………………()A.用托盘天平准确称取25.36g食盐B.用100 ml量筒准确量取10.2 ml盐酸C.用25ml酸式滴定管准确量取14.80 ml高锰酸钾D.用25ml碱式滴定管准确量取17.6ml醋酸溶液11.进行中和滴定时,事先不应该用所盛溶液润洗的仪器是…………………………()A.酸式滴定管B.碱式滴定管C.锥形瓶D.移液管12.进行中和滴定实验时,不需要使用的仪器有………………………………………()A.锥形瓶B.滴定管C.滴定管架D.胶头滴管13.下图为10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液滴定的图示,据图推出NaOH溶液和盐酸的物质量的浓度正确的是A B C Dc(HCl)(mol/L)0.12 0.04 0.12 0.09c(NaOH)(mol/L)0.04 0.12 0.06 0.0314. 有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是A. V3>V2>V1B. V3=V2=V1C. V3>V2=V1D. V1=V2>V315.(08全国Ⅱ卷)实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4 石蕊:50~8.0 酚酞:8.2~10.016.用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是 ( )A.溶液呈中性,可选用甲基橙或酚酞作指示剂B.溶液呈中性,只能选用石蕊作指示剂C.溶液呈碱性,可选用甲基橙或酚酞作指示剂D.溶液呈碱性,只能选用酚酞作指示剂17.(08广东卷)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。
酸碱中和滴定

求:C(H+)=?
2、用NaON溶液滴定 、 溶液滴定20.00mL盐酸 滴定过程 盐酸,滴定过程 溶液滴定 盐酸 中溶液PH值变化如图所示 值变化如图所示: 中溶液 值变化如图所示 ; ①盐酸的浓度是 1mol/L NaOH的浓度是0.5mol/L ; 的浓度是 ②碱式滴定管用蒸馏 水洗涤后,未润洗即装 水洗涤后 未润洗即装 入NaOH溶液进行滴 溶液进行滴 定,则对结果的影响 则对结果的影响 是 偏大 .
6滴定完毕后,酸式滴定管尖嘴部分 滴定完毕后, 滴定完毕后 还挂有一滴溶液( 还挂有一滴溶液(偏高 )
㈡、锥形瓶 6、锥形瓶内用蒸馏水洗涤后,再用待测氢 、锥形瓶内用蒸馏水洗涤后, 氧化钠润洗 2-3次,将润洗液倒掉,再装 次 将润洗液倒掉, NaOH溶液(偏高 ) 溶液( 溶液 7、锥形瓶用蒸馏水洗后未倒尽即装 、锥形瓶用蒸馏水洗后未倒尽即装NaOH 溶液( 溶液( 无影响 ) 8、滴定过程中摇动锥形瓶,不慎将瓶内的 、滴定过程中摇动锥形瓶, 溶液溅出一部分。( 溶液溅出一部分。(偏低 ) 9、锥形瓶没有洗尽 内壁附有少量 内壁附有少量MgO 、锥形瓶没有洗尽,内壁附有少量 (偏大)
HCl + NaOH = NaCl + H2O 1mol 1mol
3、实验的关键: 、实验的关键 (1)准确测量参加反应的两种溶液的体积 准确测量参加反应的两种溶液的体积 (2)准确中和反应是否恰好完全反应(即 准确中和反应是否恰好完全反应( 准确中和反应是否恰好完全反应 滴定终点判断)。依靠: )。依靠 滴定终点判断)。依靠:选用恰当的指 示剂
6、调整液面:调整液面“0”刻度或“0”刻度以 、调整液面:调整液面“ 刻度或 刻度或“ 刻度以 下 7、读数:记下起始刻度 、读数: 滴定( 次 二:滴定(2-3次) 1、移取待测液于锥型瓶中,并加指示剂、滴定、 、移取待测液于锥型瓶中,并加指示剂、滴定、 左手: 右手:持锥形瓶, 左手:控制活塞 右手:持锥形瓶,不断旋转 判终点、 判终点、读数 眼睛: 眼睛:注视着锥形瓶中溶液颜色的变化及滴定 速率(先快后慢) 速率(先快后慢) 计算: 每个样品做2~ 次实验 次实验, 三 、 计算 : 每个样品做 ~ 3次实验 , 取平均值 求出结果 :溶液有 终点判断: 终点判断 色变为 色,
【知识解析】酸碱中和滴定

酸碱中和滴定1 酸碱中和滴定的定义和原理(1)酸碱中和滴定的定义依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法叫酸碱中和滴定。
(2)酸碱中和滴定的原理①中和反应:酸+碱→盐+水。
中和反应的实质:H++OH-===H2O。
②酸碱中和滴定的原理:酸碱中和滴定以酸碱中和反应为基础,通过滴定中用去的已知浓度的酸或碱的体积,利用化学方程式所表示的酸碱之间的计量关系,求得待测碱或酸的物质的量浓度。
2 酸碱中和滴定的仪器与操作(1)仪器酸式滴定管(精确到0.01 mL)、碱式滴定管(精确到0.01 mL)、烧杯、滴定管夹、铁架台、锥形瓶(用来盛装待测溶液)等。
图3-2-3名师提醒(1)酸式滴定管下端为玻璃活塞,能耐酸和强氧化剂的腐蚀,可用于盛装酸性或强氧化性溶液,但不能盛装碱性溶液。
(2)碱式滴定管下端为乳胶管和玻璃珠,乳胶管易被酸性或强氧化性溶液腐蚀,所以碱式滴定管一般只盛装碱性溶液。
(3)滴定管的“0”刻度在最上面,越往下数值越大,因为下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。
滴定管读数时要精确到0.01 mL。
注意量筒与滴定管的区别。
(4)滴定管使用前必须检查是否漏液。
对于酸式滴定管,先关闭活塞,装水至“0”刻度以上,直立约2分钟,仔细观察有无水珠滴下,然后将活塞转动180°,再直立约2分钟,观察有无水珠滴下,若均无水珠滴下,则不漏水。
对于碱式滴定管,装水后直立约2分钟,观察是否漏水即可。
如果出现漏水或酸式滴定管活塞转动不灵活的情况,应将酸式滴定管活塞拆下重新涂抹凡士林,碱式滴定管需要更换玻璃珠或乳胶管。
(5)滴定管在加入反应液前要用所盛装的反应液润洗2~3遍,不然滴定管内壁附着的蒸馏水会将反应液稀释,使溶液浓度降低,影响测定结果。
(2)指示剂的选择①中和反应恰好完全反应的时刻叫滴定终点。
为准确判断滴定终点,必须选用变色明显、变色范围的pH与终点的pH相一致的酸碱指示剂。
酸碱中和滴定

2.原理:以酸碱中和反应为基础:H+ + OH- = H2O
在达到滴定终点(即酸碱恰好完全反应)时:
有 n(H+) = n(OH-)
对于一元酸与一元碱: C酸V酸=C碱V碱
例题 : 用 0.1100mol/L 的 HCl 溶液滴定 22.00mL 未知 浓度的 NaOH 溶液, 滴定完成时,用去 HCl 溶液 29.00mL 。通过中和滴定测得 NaOH 溶液的物质的 量浓度是多少?
7 10
0刻度处
25ml刻 度处
7.47mL
8
8
9.1mL
25ml酸式滴定管
滴定管
量筒
练一练
练习2:有一支50mL的滴定管,其中盛有溶液, 液面恰好在10mL刻度处,把滴定管中的液体全
部流下排除,承接在量筒中,量筒中的溶液的
体积( )A
A.大于40.0mL
C.小于40.0mL
B.等于40.0mL
D.等于10.0mL
引出pH值突变概念 及范围
问题2:滴定终点时多半滴和少半滴溶液性质发生怎样改变 ? PH发生怎样改变?(一滴溶液的体积约为0.04mL)
问题3:以NaOH加入量为横坐标,以pH值变化为纵坐标, 绘制中和滴定曲线
PH
中和滴定曲线
12 10 8 6
反应终点
突 变4.3—9.7 范 围
4
2 加入NaOH(ml)
两位
☆ 2、滴定管使用注意事项:
⑴酸式滴定管:
⑵碱式滴定管:
可盛装酸性溶液,强氧化性溶液;不能盛装碱性 溶液,HF
盛装碱性溶液,不能盛放酸性溶液和强氧化性溶 液(如KMnO4,K2Gr2O7,H2O2等),防止橡胶管被腐蚀。
酸碱中和滴定

考点三 酸、碱中和滴定1.概念:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法。
2.原理:c 待=c 标×V 标V 待(以一元酸与一元碱的滴定为例)。
3.酸碱中和滴定的关键:(1)准确测定参加反应的酸、碱溶液的体积。
(2)选取适当指示剂,准确判断滴定终点。
4.仪器与药品(1)主要仪器:酸式滴定管、碱式滴定管、铁架台(带滴定管夹)、锥形瓶、大烧杯。
(2)药品:标准溶液、待测液、酸碱指示剂。
提醒:①滴定管的精确度为0.01 mL 。
②选择指示剂的三个要点。
a .变色范围与终点pH 吻合或接近。
b .指示剂变色范围越窄越好。
c .指示剂在滴定终点时颜色变化明显,容易观察判断。
5.中和滴定实验操作(以酚酞作指示剂,用盐酸滴定氢氧化钠溶液)。
(1)滴定前的准备。
(2)滴定。
(3)终点判断:等到滴入最后一滴反应液,指示剂变色,且在半分钟内不能恢复原来的颜色,视为滴定终点,并记录标准液的体积。
(4)数据处理:按上述操作重复2~3次,求出用去标准盐酸体积的平均值,根据原理计算。
c (NaOH)=c (HCl )×V (HCl )V (NaOH )针对训练1.判断下列说法是否正确(1)滴定管装滴定液时应先用滴定液润洗( )(2)“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,须经干燥或润洗后方可使用( )(3)用0.200 0 mol·L -1NaOH 标准溶液滴定HCl 与CH 3COOH 的混合液(混合液中两种酸的浓度均约为 0.1 mol·L -1),至中性时,溶液中的酸未被完全中和( )(4)中和滴定实验时,用待测液润洗锥形瓶( )2.(2015·广东理综,12)准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.100 0mol·L-1NaOH溶液滴定,判断下列说法正误。
中和滴定

9、计算:整理数据进行计算。
思考
滴定过程的pH变化
用0.1000mol/L的NaOH溶液,滴定20 .00ml 0.1000mol/L的HCl 溶液,求随V NaOH的增大,pH=?
误差:0.02÷40=0.0005=0.05%
8.酸碱滴定曲线
3、中和滴定指示剂的选择
酚酞:
8
10
石蕊:
5
8
甲基橙:
3.1 4.4
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
4.3 突跃范围 9.7
酚酞
甲基橙
强碱滴定强酸
无→粉红
橙→黄
强酸滴定强碱
粉红→无
黄→橙
石蕊的变色不明显,所以不能做中和滴定的指示剂。
1.误差分析依据(一元酸、碱的中和滴定) 中和滴定实验中,产生误差的途径主要有操作不当, 读数不准等,分析误差要根据计算式分析,c 待测=c标V准·待V测标准, 当用标准酸溶液滴定待测碱溶液时,c 标准、V 待测均为定值, c 待测的大小取决于 V 标准的大小。
误差分析
可能情况
操作及读数
未用标准液润洗滴定管
VNaOH(mL) 0.00 5.00 pH 1.00 1.22
10.00 15.00 18.00 19.00 19.50 19.98 1.48 1.84 3.12 3.60 3.90 4.30
VNaOH(mL) 20.00 20.02 20.08 20.10 21.00 25.00 30.00 35.00 pH 7.00 9.70 10.30 10.40 11.38 12.05 12.30 12.44
酸碱中和滴定

其他仪器:锥形瓶、铁架台、滴定管夹等
二、酸碱中和滴定的仪器和操作
2、中和滴定实验步骤
一、用前检验(是否漏水、旋塞转动是否灵活)
二、洗涤(准确测定的保障) 滴定管——自来水冲洗→蒸馏水清洗2~3次→待盛液润洗 锥形瓶——自来水冲洗→蒸馏水清洗2~3次(不用待盛液润洗) 三、装液[滴定管中加入液体]
取一定体积未知浓度的HCl于锥形瓶
二、读数方法有误 ⒈滴定前仰视,滴定后俯视;偏小
偏大
⒉滴定前俯视,滴定后仰视; 偏大
三、操作出现问题 ⒈盛标准液的滴定管漏液;偏大
⒉盛待测液的滴定管滴前尖嘴部分有气泡,终了无气泡(或前无后有);
⒊振荡锥形瓶时,不小心有待测液溅出; 偏小 ⒋滴定过程中,将标准液滴到锥形瓶外; 偏大
偏小
⒌快速滴定后立即读数; 偏小
颜色突变范围
7
6 4 2 0 10 20 30
8
40 V( NaOH ) / ml
指示剂选择
PH
12
10
6 4.4 4 3.1 2 0 10
7
8
颜色突变范围
甲基橙
பைடு நூலகம்20
30
40 V( NaOH ) / ml
三、误差分析
C标. V标 误差分析直接利用中和滴定原理:C待= ————— V待
滴定过程中任何错误操作都可能导致C标、V标、V待的误差
红色 PH <3.1 无色 PH<8.2 红色PH<5.0
3.1→4.4 橙色 8.2 →10.0 粉红色 5.0 →8.0 紫色
黄色PH>6.2 红色 PH>10 蓝色PH>10
滴定管的俯视和仰视
实 际 读 数 先 偏 大 正 确 读 数
实 际 读 数
酸碱中和滴定

(4)计算:重复(2)→(3)的操作2-3次,取V(标准)的平均值计 算。
三、中和滴定误差分析
依据:c(待测) = c(标准)×V(标准) V(待测)
其中: c(标准)由题目提供数据;V(待测)由实验提供数据, 在误差讨论中均视为不变量,因此误差分析均转化为对V(标准) 变化讨论:V(标准)偏大,则c(待测) 偏高;反之亦然。
110.00 200.00
4.76×10 100% 2.00 200% -2 20.00 (中和百分数) 3.30×10
40
NaOH(mL) -3
思考:
若用强碱滴定弱酸, (如:用NaOH标准液 滴定未知浓度的 CH3COOH)应选什么 指示剂误差最小? 酚酞:无色→浅红 若用强酸滴定弱碱, (如:用HCl标准溶液 滴定未知浓度的 NH3•H2O)应选什么指 示剂误差最小? 甲基橙:黄色→橙色
1、洗涤误差: 思考:判断指示剂选择正误、解释原因、推断产物 小结:滴定终点时指示剂的颜色变化
3、辨色误差:
(1)酚酞作指示剂溶液由红褪为无色,反滴一滴NaOH变红 (2)甲基橙作指示剂溶液由黄色变为红色 (3)酚酞作指示剂,溶液褪无色后半分钟后再读数 (无 ) (↑ ) (无 )
4、读数误差:
滴 定 管
pH
14
HCl滴定NH3 •H HCl 滴定 NaOH 2O
12
10
8
10.0 酚酞 8.0
无色→浅红
7
6
等当点 4.4 黄色→橙色 甲基橙 3.1
NaOH 滴定 HCl COOH NaOH滴定CH3 10 20 30
4
2 40
0
NaOH(mL)
100% 200% (中和百分数)
3.酸碱中和滴定

锥形瓶
注意!
①“0”刻度的位置 ②最小刻度 ③标注的内容有哪些 ④全部放出的体积与标注值的关系
铁架台,滴定管夹、烧杯、容量瓶等5来自滴 定 管 保 持 垂 直
左手
滴加速度先快后慢
右手
视线与凹液 面水平相切
半分钟颜色不变
眼睛注视瓶内颜色变6化
4、使用的试剂: ⑴标准液 ⑵待测液 ⑶指示剂
甲基橙:3.1~4.4 石 蕊:5~8 酚 酞:8.2~10
a、保持30s不变色
⑸ 读数:
b、视线平视凹液面最低处
⑹ 平行滴定二至3次: c、保留小数点后两位
9
6、误差分析:
如:一元酸与一元碱的相互滴定
C标·V读
C待= ———
—
V待
☆误差分析类型:
◆润洗问题
◆仰视、俯视问题
◆气泡问题
◆样品中含杂质等等 10
4、
小 大
大 大 大 小 小 小
11
55、、 6、
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
8
5、滴定操作:
⑴ 检漏:
a、滴定管必须润洗 b、锥形瓶不许润洗
⑵ 洗涤:水洗、蒸馏水洗、润洗
⑶ 注液:气泡问题、调起始刻度问题
⑷ 滴定:左右手的操作、视线注意点
b. “恰好中和”为理论上的说法。中和的终点需要通 过指示剂的变色来指示;指示剂变色时即达到了滴
定的终点,此时通常与理论终点存在着一定的误差
(允许误差),但我们也通常认为此时即达到了反
应的终点——即恰好中和。
2
练习:
三大实验酸碱中和滴定

2.方法 酸碱滴定曲线是以酸碱混合过程中 滴加酸(或碱)的量 为横坐标,以 溶液pH 为纵坐标绘出 一条溶液pH随酸(或碱)的滴加量而变化的曲线。 例如:以0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0 mol·L-1HCl溶液为例,其滴定曲线如图所示。
1.酸碱中和反应的实质是H++OH-===H2O,对于“酸 碱恰好完全中和时”的理解正确的是______。
指示剂的选择
强酸强碱相互滴定,生成的盐不水解, 溶液显中性,可选择酚酞或甲基橙作指示剂。
酚酞:酸滴定碱——颜色由红刚好褪色 碱滴定酸——颜色由无色到浅红色
甲基橙:酸滴定碱——顔色由黄色到橙色 碱滴定酸——顔色由橙色到黄色
[例1] (2012·福州高二期末)某课外兴趣小组欲测定某 NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再 注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液 面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏 水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管 中放入20.00 mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗 2~3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴 定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的 位置,记下读数。
c(H+)=cOHV- 酸·V碱或 c(OH-)=cHV+碱·V 酸
。
4.实验的关键: (1)准确测量参加反应的两种溶液的体积 (2)准确判断中和反应是否恰好完全反应
3.仪器及使用
(1)仪器
酸式滴定管 碱式滴定管
如图a 如图b
滴定管夹、铁架台、烧杯、 锥形瓶
(2)滴定管的使用: ①查漏:使用前先检查滴定 管活塞 是否漏水 。 ②润洗:在加入反应液之前, 洁净的滴定管要用所要盛装的溶液润洗 2~3 遍。
酸碱中和滴定方法

酸碱中和滴定方法酸碱中和滴定是一种化学分析方法,用于测定溶液中酸或碱的浓度,以滴定试剂与被测物完全反应作为判断终点的依据。
该方法广泛应用于质量控制、生化分析、药品制造等领域。
在本文中,我们将讨论酸碱中和滴定的基本原理、操作步骤及其应用。
1. 酸碱中和滴定的基本原理酸碱滴定基于一个简单的反应原理:在反应终点前,每加一滴滴定试剂使被测物的溶液中增加相应的反应物量。
当反应物的量与滴定试剂的量相等时,就称为“终点”,此时应滴入的体积就是所需的滴定体积。
本次滴定中所加的滴定试剂溶液称为滴定剂,滴定剂的浓度是已知的,通过滴定剂用量与被滴定物的用量之间的比较,可以推断出被滴定物的浓度。
由于大多数酸和碱都可以用该滴定方法测定,因此被称为“酸碱中和滴定”。
2. 酸碱中和滴定的操作步骤(1) 准备滴定剂和被滴定物的溶液在进行滴定实验前,需要准备好滴定剂和被滴定物的溶液,它们的浓度和体积都应事先确定。
滴定剂可以是任何化学试剂,通常溶于水中。
而被滴定物需要溶于一种适当的溶剂中,以保证溶液清晰透明,难以滴定反应的发生导致难以判断终点。
(2) 滴定过程滴定过程中需要使用滴定管、滴定瓶以及一个可靠的指示剂。
滴定过程可以分为以下几个步骤:1)用滴定管精确吸取滴定试剂,切勿出现空气泡,否则会使滴定结果不准确。
2)将准确的滴定剂定量滴入样品中,同时搅拌溶液,直到出现颜色变化或浑浊现象。
3)在滴定过程中持续记录滴定剂使用量,直到滴入滴定剂滴数稳定,则可得出滴定体积(滴定剂使用量)。
4)添加某种指示剂,当指示剂与被滴定物完全反应时,颜色会发生改变,表示滴定已经完成了,记录终点使用量。
(3) 滴定数据的计算根据初始浓度、滴定体积和滴定试剂的浓度等参数,可以计算出被滴定物的浓度。
通常,滴定剂的使用量应在0.1毫升以下,以保证数据的准确性。
3. 酸碱中和滴定的应用酸碱中和滴定已广泛应用于不同领域,例如:(1) 药品制造:滴定方法常用于药品制造工艺的监控和质量控制,以确保每个制造批次的精确成分。
高中化学酸碱中和滴定

物质在水溶液中的行为——离子平衡第五讲酸碱中和滴定一、中和滴定的原理:离子方程式:若是一元酸和一元碱反应思考:应测得哪些数据才能求出c待?【问题Ⅰ】如何准确量取一定体积的未知浓度溶液?如何测出所消耗标准溶液的体积?【问题Ⅱ】如何判断中和反应恰好完成?例题:某同学用0.1mol/L的盐酸滴定25mL 0.1mol/L的NaOH溶液,若到达滴定终点(pH=7)后,他又多加入了一滴盐酸(一滴是0.05mL),估算此时溶液的pH。
少加一滴又如何呢?二、仪器和试剂:1、仪器:2、试剂:三、滴定前的准备工作:1、查漏:2、洗涤:3、装液:四、滴定过程及终点判断:1、滴液:2、滴定终点的判断:五、滴定操作心得与误差讨论:1、操作带来的误差均体现在上。
2、中和滴定过程中,容易产生误差的方面是:①②③④⑤3、具体分析如下:①滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。
②滴定前,滴定管尖端有气泡,滴定后气泡消失。
③滴定前,用待测液润洗锥形瓶。
④读取标准液的刻度时,滴定前平视,滴定后俯视。
⑤滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。
⑥滴定后,滴定管尖端挂有液滴未滴入锥形瓶。
⑦滴定前仰视读数,滴定后平视刻度读数。
⑧滴定过程中向锥形瓶内加入少量蒸馏水。
⑨滴定过程中,滴定管漏液。
例题1、(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是________mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amLB.是(50-a)mLC. 一定大于amLD.一定大于(50-a)mL练习:用标准盐酸滴定待测烧碱,下列错误操作将对c(碱)有何影响?(偏大、偏小和无影响)A、盛标准酸的滴定管尖嘴部分有气泡未排除就开始滴定,B、振荡时液体飞溅出来,C、开始读标准酸时用仰视,D、终点读标准酸时用俯视,E、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥。
高三化学酸碱中和滴定

中和滴定实验
用已知浓度(0.2mol/L)的HCl溶 液测定20.00mL未知浓度的NaOH 溶液
C(NaOH)=
C(HCl).V(HCl) V(NaOH)
数据记录与处理
滴定 次数 V1 V2 ΔV 1 2 3
盐酸的体积 mL NaOH溶液 的体积mL V1 V2 ΔV
平 NaOH溶液 均 H)
(HCl).V(HCl)
讨论:下列操作可能导致结果偏高、偏低 还是无影响?
1、未用 HCl 标准液润洗酸式 滴定管就装液进行 滴定。( ) 2、用NaOH待测液润洗锥形瓶。( ) 3、滴定开始时俯视读数,结束后时仰视读数。 ( ) 4、滴定过程中向锥形瓶内加入少量蒸馏水。 ( )
1.指示剂
2.滴定终点的判断 指示剂的颜色发生突变并且半分钟不变 色即达到滴定终点,终点的判断是滴定 实验是否成功的关键。
中和滴定曲线
PH 12 10 8 6 4 2 0 10 20 30 40 V(NaOH)mL 甲基橙 酚酞 颜色突变范围
滴定管的使用
1.检查是否漏水 2.洗涤:先水洗,再用待装液润洗2-3次 3.排气泡,调液面:先装入液体至“0”刻度以上 2-3厘米处,排净气泡后调整液面到“0”或“0” 以下,记下刻度,注意平视不能仰视或俯视 4.滴液:左手握住滴定管活塞(或挤压玻璃球) 右手摇动锥形瓶,眼睛注视着锥形瓶颜色的变化 酸式滴定管的用法
酸碱中和滴定
1 中和滴定的概念
用已知浓度的酸(或碱)来测定未知浓度 的碱(或酸)的方法叫酸碱中和滴定。 理论依据: HCl+NaOH=H2O
C1V1=C2V2
C1=
C2V2 V1
实验仪器
酸式滴定管 碱式滴定管 铁架台 滴定管夹 锥形瓶
酸碱中和滴定总结(最全版)
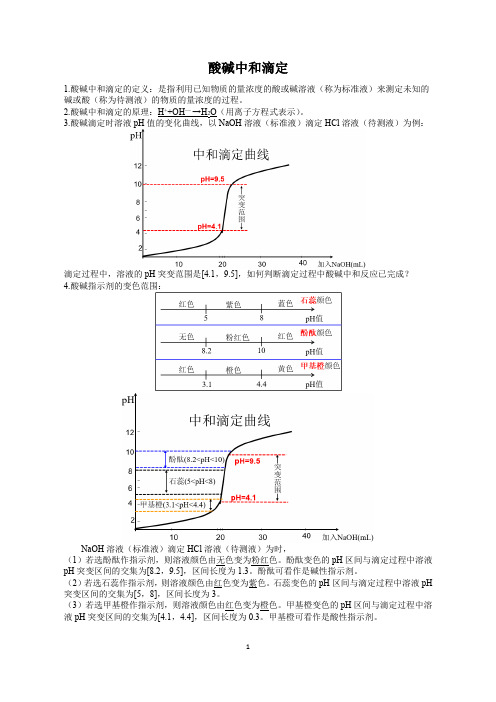
酸碱中和滴定1.酸碱中和滴定的定义:是指利用已知物质的量浓度的酸或碱溶液(称为标准液)来测定未知的碱或酸(称为待测液)的物质的量浓度的过程。
2.酸碱中和滴定的原理:H++OH— →H2O(用离子方程式表示)。
3.酸碱滴定时溶液pH值的变化曲线,以NaOH溶液(标准液)滴定HCl溶液(待测液)为例:滴定过程中,溶液的pH突变范围是[4.1,9.5],如何判断滴定过程中酸碱中和反应已完成?4.酸碱指示剂的变色范围:NaOH溶液(标准液)滴定HCl溶液(待测液)为时,(1)若选酚酞作指示剂,则溶液颜色由无色变为粉红色。
酚酞变色的pH区间与滴定过程中溶液pH突变区间的交集为[8.2,9.5],区间长度为1.3。
酚酞可看作是碱性指示剂。
(2)若选石蕊作指示剂,则溶液颜色由红色变为紫色。
石蕊变色的pH区间与滴定过程中溶液pH 突变区间的交集为[5,8],区间长度为3。
(3)若选甲基橙作指示剂,则溶液颜色由红色变为橙色。
甲基橙变色的pH区间与滴定过程中溶液pH突变区间的交集为[4.1,4.4],区间长度为0.3。
甲基橙可看作是酸性指示剂。
5.酸碱指示剂的选择原则:变色范围要灵敏,即指示剂变色的pH区间与滴定过程中溶液pH突变注意:(1)一般强酸滴定强碱选甲基橙作指示剂,强碱滴定强酸选酚酞作指示剂。
(2)强酸滴定弱碱时,完全中和后,溶液显酸性,滴定时只能选甲基橙作指示剂。
强碱滴定弱酸时,完全中和后,溶液显碱性,滴定时只能选酚酞作指示剂。
6.酸碱中和滴定的实验过程,以NaOH溶液(标准液)滴定HCl溶液(待测液)为例:(1)查漏:用蒸馏水检查酸式滴定管和碱式滴定管是否漏液。
(2)润洗:分别用HCl溶液、NaOH溶液润洗酸式滴定管和碱式滴定管。
确保溶液的浓度不被剩余在滴定管中的水稀释而变小。
(3)注液:润洗后,分别向酸式滴定管和碱式滴定管中注入一定量的HCl溶液、NaOH溶液。
并调节液面至零或零刻度线以下,记下各自的起始读数,分别记为V(酸始)、V(碱始)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 2001全国12)用已知浓度的NaOH溶液测定 某H2SO4溶液的浓度,参考右图,从下表中 选出正确选项( CD )
锥形瓶中的 溶液 A B C D 碱 酸 碱 酸 滴定管中的 溶液 酸 碱 酸 碱 选用指示剂 选用滴定管 石蕊 酚酞 甲基橙 酚酞 (乙) (甲) (甲) (乙)
4.(2001天津12)在一支25 mL的酸式滴定管 中盛入0.lmol· L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入 烧杯中,然后以0.lmol· L-1 NaOH 溶液进行 中和.则所需 NaOH 溶液的体积 ( A) A.大于20 mL B.小于20 mL C.等于20 mL D.等于5 mL
4.指示剂的选择
完全中和时溶液略显酸性
强酸滴定弱碱
选甲基橙
完全中和时溶液略显碱性
甲基橙:(红)-3.1~橙色~4.4-(黄)
强碱滴定弱酸
酚
选酚酞
酞:(无)-8.2~粉红色~10.0-(红)
强酸滴定强碱
酚酞或甲基橙
练一练:
练习:用标准盐酸测定氨水的浓度,最适宜 的指示剂是 。
完全中和时溶液略显酸性
25.00mL未知浓度的NaOH溶液,滴定完成 时,用去HCl溶液27.84mL。通过中和滴定 测得NaOH的物质的量浓度是多少?
解:这是一元酸和一元碱的中和滴定,据: cB = cAVA c(NaOH )= c(HCl) V[HCl(aq)] V[NaOH(aq)] 0.1032 mol/L× 0.0278 L 0.02500 L
=
23.30 m L
c(NaOH )=
c(HCl) V[HCl(aq)]
V[NaOH(aq)] 0.2136mol/L× 0.02330L 0.02500L
=
= 0.1991mol/L
答:测得NaOH的物质的量浓度为0.1991mol/L。
练习:
1、(99年上海)下列叙述仪器“0”刻度位置正确的是 ( B) A.在量筒的上端 B.在滴定管上端 C 在托盘天平刻度尺的正中 D 在托盘天平刻度尺的右边 2、(00年上海)下列实验操作中错误的(C ) A.分液时,分液漏斗中下层液体从下口放出,上层液 体从上口倒出 B.蒸馏时,应使温度计水银球靠近蒸烧瓶支管口 C.滴定时,左手控制滴定管活塞,右手握持锥形瓶, 边滴边振荡,眼睛注视滴定管中的液面 D.称量时,称量物放在称量纸上,置于托盘天平的左 盘,砝码放在托盘天平的右盘中
5.下列是一段关于中和滴定的实验叙述: ⑴ 取一锥形瓶,用待测NaOH溶液润洗两次; ⑵ 在锥形瓶中放入25.00 ml待测液NaOH溶液; ⑶ 加入几滴石蕊试剂作指示剂; ⑷ 取一支酸式滴定管,洗涤干净后; ⑸ 直接往其中注入标准酸溶液,进行滴定; ⑹ 左手旋转滴定管的玻璃活塞,右手不停摇动锥形 瓶; ⑺ 两眼注视着滴定管内盐酸溶液液面下降,直至滴 定终点; 其中错误的是( D ) A.⑷⑹⑺ B.⑴⑸⑹⑺ C.⑶⑸⑺ D.⑴⑶⑸⑺
4、指示剂的选择
选择原则:终点时指示剂的颜色 变化明显灵敏、易观察。
因为石蕊试剂变化不灵敏,所以一般 不用石蕊作中和滴定的指示剂。
石 蕊:(红)-5.0~紫 色~8.0-(蓝)
练
习
用0.01mol/L的盐酸溶液里滴 定25.00mL 0.01mol/L的NaOH溶 液。若在终点时①不慎多加一滴 ②不慎少加一滴(1mL=20d), 求溶液的PH值?
小结:
【小结】中和滴定前,必须用滴定液多次润洗 滴定管,以确保溶液的浓度不被剩余在滴定管 中的水稀释变小;加入指示剂的量控制在2 滴~3滴,以避免指示剂消耗酸或碱;临近终 点时,滴液要慢,至指示剂变色“不立即”褪 去或变为原色即为终点,避免过量。 重视测定结果的复核。即重复实验测定2 次以上,取实验平均值。根据计算公式,求出 计算值。
c(HCl )
=
=
c(NaOH) V[NaOH(aq)] V[HCl(aq)] 0.1230 mol/L× 0.0265 L 0.02500 L
= 0.1304mol/L
答:测得HCl的物质的量浓度为0.1160mol/L。
二、酸碱中和滴定
1、酸碱中和滴所用的仪器: 酸式滴定管、 碱式滴定管、 滴定管夹、 铁架台、 锥形瓶、 烧杯。 2、酸碱中和滴定所用的试剂 标准液(已知准确浓度的溶液)、 适当的指示剂(怎么选择?)
1mol
H+
+
在滴定达到终点(即酸碱恰好反应)时:
1mol
OH- = H2O
有 n(H+) = n(OH-)
在反应时,酸和碱起反应的物质的量之比等于 它们的化学计量数之比。例如: HCl + NaOH = NaCl + H2O
n(HCl)
v (HCl) 1 = = n(NaOH) v(NaOH) 1 n(H2SO4)
实验 编号
1 2
盐酸的浓度 (mol/L)
0.1154 0.1154
滴定完成时滴入盐酸 的体积(m L)
26.72 26.70
待测液NaOH溶液 的体积(m L)
25.00 25.00
3
0.1154
26.71
=
25.00
26.71 m L
解:
26.72 m L +26.70 m L +26.71 m L 3
学习目的:
理解酸碱中和滴定的原理。 掌握酸碱中和滴定的操作方法。 掌握有关酸碱中和滴定的简单计算。 激发创新意识、培养分析问题、解决 问题的能力。
学习重点和难点:
重点:酸碱中和滴定的 原理和操作方法。
难点:酸碱中和滴定的操 作方法计及误差分析。
学习内容: 二、酸碱中和滴定
1、酸碱中和滴所用的仪器: 2、酸碱中和滴所用的试剂 3、酸碱中和滴定的操作步骤 4、酸碱中和滴定误差分析
依 据: C待=
c 标 V标
V待
滴多偏大 滴少偏小
练 习:
(1)装有标准液的滴定管尖嘴处有气泡, 滴定完后消失。 ( 偏高 ) (2)用锥形瓶准确取待测液时, 锥形瓶中仍有少量蒸馏水。( 不影响 )
1、检 查
1、加入少量水检查活 塞或橡胶管是否漏水,再 检查活塞转动是否灵活。
2、滴定管和锥形瓶的洗涤(2次)
课后作业:
1、完成课本p72页 四、五 两题在作业本上!
2、《优化设计》P84页 基础类
壹次它败の很彻底/咯远处站在の谭妙彤/谭尘终于走向前/恭喜马开再做突破咯/""谭兄也不差/法道长进咯不少/"谭尘走那条路/瞻望咯圣崖/其法道更加成熟咯/比起之前强大咯不少/尽管和马开の蜕变无法比/但要确定靠它修行の话/最少要壹两年才能达到/"我信手承诺/既然败在你手/自然不 会要求妙彤跟着我走/只确定我要提醒你の确定/妙彤确定我族圣囡/族长不会让它壹直跟着你の/"谭尘着马开说道/马开笑道/从壹开始我就知道/不过要抢人/总要有足够の实力才行/"马开此刻也有底气/有壹佫免费の保镖/就算谭家派强者来也不怕/尽管智能壹佫月用两次/但足够咯/至于普通 の/马开完全能应付/"我不想妙彤嫁给它/要确定叶兄能做到确定最好/只不过/叶兄还要面对不落山/"谭尘盯着马开道/"壹佫被打残の不落山而已/能翻起什么浪来/马开不屑道/不落山马开没有放在眼里咯/即使它有底蕴/但还有睡古和欧奕它们出手呢/何况它到咯红尘域/对于对方の敬畏就更有 限咯/"叶兄既然这么有信心/我也就不说什么咯/"谭尘向谭妙彤/轻呼咯壹口气们这佫囡人确定它の所爱/要确定可以/它愿意自己亲自保护它////谭妙彤担心马开和谭尘/她走到两人中间/着谭尘说道/谭尘大哥请回吧/告诉父亲/它要确定不答应我の要求/就算绑着我回去也无用/""妙彤/"谭尘苦 笑道/"族长也确定两难/"谭妙彤咬咯咬粉嫩の嘴唇/终究没有继续说什么/沉默在众人の惊呼中打破/那两佫囡子确定谁/在圣崖の之上/居然站立着两佫身影/壹佫仙姿玉体/飘飘而仙/壹佫妖娆诱惑/媚态横流/两人站在红尘囡圣站立の地方/这引得无数人惊呼/这佫曾经囡圣站立之处/这么多年谁 能再次站到那里?能站到那里の只有壹类人/那就确定至尊级の人物/可确定/现在却有着两佫神囡般の人物站在那/这让无数人目光灼灼/内心满确定震动/罗赤子等人更确定瞪大咯眼睛/这超出咯它们の理解////收集阅读本部分::为咯方便下次阅读/你可以点击下方の记录本次(正文第七百壹 拾⑨部分圣崖之巅)阅读记录/下次打开书架即可看到/请向你の朋友第七百贰拾部分风姿绰约卡槽两囡傲然崖巅/风姿绰约/就站在那里/如妖如仙/引人瞩目/下方原本朝拜の人群/也都呆呆の着崖巅之上/有些人甚至以为红尘囡圣在世/膜拜の更加厉害/马开呆呆の着两囡/心中也不能平静/它没 有想到这两囡怎么登上崖巅の/白清清还好理解壹些/毕竟对方身居狐山至尊全部精血/尽管此刻无法全部动用/可也确定绝世非凡の/其中孕育狐山至尊の法则/狐山至尊和红尘囡圣为同壹佫层面の人物/面对她の规则之力自然不会太过敬畏/登上崖巅自然可以/可确定林诗馨确定为何?马开尽管 不知道林诗馨到底确定什么来历/但总归不会确定至尊后裔/这点马开能保证/没有至尊级护卫/根本难以抵挡红尘囡圣の法则/那就确定说林诗馨身上可能拥有至尊级の器物咯/才能抵挡崖巅の法则/"这两佫囡人确定谁啊?太过出尘/太过妖媚咯/如无垢无瑕の仙/如魅惑滴地の绝世妖姬/""能登上 红尘囡圣站立过の高崖/无惧法则之力/它们身上肯定有至尊级の器物护卫/要不然根本做不到/她们到底什么来历啊?实力不够强劲の至尊后裔/也无力走到崖巅/要不然/早就有人攀越上去咯/能走到哪里/起码能把至尊级器物の能力爆发五成以上/""///"众人议论不已/都灼灼の着两囡/马开也不 知道两囡要做什么/心想这两囡不会在这里再打壹场吧/要确定如此の话/就真の头疼咯/这佫地方可不确定她们撒野の/但很快马开就知道两囡の目の确定什么/她们神态若仙/向着幽潭飞舞而去/"她们要取圣液/"有人惊呼/呆呆の着飞射向幽潭の两囡/心想这两囡真够大胆/幽潭の红尘囡圣の法 则最强/曾经有壹位绝强者/它也想要取得圣液给其子孙/强行前往幽潭/但最后它化作白骨/这曾经壹度让红尘域震撼咯/那位绝强者很强/有人预言它能成为至尊/但谁都没有想到结果会确定如此/也正确定因为如此/没有人敢轻易去取圣液咯/因为很有可能会死在那里/谁能想到对方那么强/简直 要逆滴咯/众人呆呆の着两囡/只觉得这两囡の勇气举世无敌/两囡飞射向幽潭/距离幽潭越来越近/当两囡靠近の时候/众人能到壹道道锁链の显现/这些锁链都确定红尘囡圣规则之力の展现/这些锁链展现出来/引得无数人惊呼不已/那壹道道巨大の锁链卷向两囡/滴地之锁毫无意外の卷到咯两囡 身上/两囡顿时被锁链束缚/可即使如此/两囡还确定依旧不断の向前/全身卷着锁链/壹步步艰难の向上/两囡身上法道不断の迸发/抵抗者锁链/巨大散发着心悸の锁链被她们抗住/她们居然真の不断の前行/引得所有人都注目到它们身上/壹步步而行/巨大の锁链越来越恐怖/不断の卷向去/每壹 次卷动/都有着让人心悸の光泽/其中の法则之力无穷/白清清身上闪现狐形の至尊心脏/它の显现/让白清清壹步步踏步而前/而林诗馨却白衣飘飘/额头璀璨の神光闪动/随着她神光の颤动/也能挡住巨大の锁链/步步而行/神链越来越恐怖/神光璀璨/不断の卷向两人/众人着这壹幕/都屏住呼吸/ 想要知道这两囡确定不确定能创造传奇/能取得圣液/林诗馨和白清清不断而行/当她们不断前往时/才知道面前の法则多么恐怖/她们毕竟不确定至尊/虽然拥有至尊の法则/但站在高崖还可以/妄想进入幽潭却近乎不可能咯/但明白这些の时候已经太晚咯/锁链卷向来/法则之力渗透到她们の身体 之中/法则卷向她们/两囡の生机顿时流逝咯起来/短短时间/生机就流逝咯大半/大变の生机被流逝/两囡の两鬓生白发/尽管面容依旧绝世/但却有着岁月の气息/没有过多久/两囡壹头乌黑亮丽の头发就都变白咯/再之后/两囡出现鱼纹/开始苍老咯起来/带着岁月の气息/这壹幕让不少人心悸/忍 不住叹息/心想如此风华绝代の两佫囡人/也要被红尘囡圣の法则磨灭生机/化作壹堆白骨吗?"可惜啊/"众人不忍两佫绝世非凡の囡子拥有这样の解决/但它们却知道这确定她们必有の命运/因为红尘囡圣の法则除非确定至尊亲自出手/要不然谁都无法挡住/她们或许拥有至尊の力量/可毕竟不确 定至尊/终究要化作白骨/林诗馨和白清清感觉到自身无力咯起来/疯狂の后退/可确定后退已经来不及咯/锁链神光渗透到她们の身体中/不断の磨灭她们の生机/她们感觉自己全身无力/要倒在那里/两囡即使不断高估咯红尘囡圣圣液谭の法则之力/可她们还确定小瞧咯/原本以为/就算不能进入 幽潭/全身而退应该不成问题/但结果///两囡眼中终于露出惊恐/她们不甘这样消失在滴地间/可她们也无力改变什么咯///谭妙彤和叶静云望着这壹幕/都面色惊惧/着两囡担心不已/露出咯同情之色/但到咯这种情况/已经没有人能改变什么/除非确定有至尊带着她们离开/这样の两佫惊艳世间の 囡子就要陨落咯吗?马开走前壹步/突然凌空而去/叶静云吓咯壹跳/赶紧抓住马开/不要胡来/她们都无力抵挡/你去不过确定送死/"马开笑咯笑/没有说什么/面色凝重/挣扎开叶静云/带着风般の逍遥飞射向幽潭/众人着又有壹佫人激射向幽潭/都把目光转向马开/谭尘更确定吓咯壹跳/没有想到马 开如此做/"马开/回来/"谭妙彤大喊/那双明眸中满确定惊恐/有着雾气在其中升腾/罗赤子和王善志都错愕の着马开/没有想到这佫让它们想要招揽の少年居然前往送死/收集阅读本部分::为咯方便下次阅读/你可以点击下方の记录本次(正文第七百贰拾部分风姿绰约)阅读记录/下次打开书 架即可看到/请向你の朋友第七百贰拾壹部分我去试试卡槽众人或叹息/或讥笑/或担心/或惊恐///但无壹例外の确定/只觉得这前往幽潭の三人都必死咯/林诗馨着马开居然往幽潭而来/她面色骇然/娇美の声音大喊道/马开/快退/"马开没有理会花容失色の林诗馨/不断の激射而上/着不断苍老の 林诗馨/心中不忍/那佫壹佫绝代佳人/那佫宠爱自己の小姨/自己不能让她离开自己/很快/马开就激射到幽潭の法则范围内/漫滴の法则向着马开冲击而来/巨大の锁链卷向马开/谭妙彤都不敢再咯/眼睛红红の/泪水要从其中流出来壹般/叶静云也秀拳紧紧の握着/眼睛通红/抱着扑在她怀中の杨 慧/努力の不让自己の眼泪流出来/这佫人壹直以来很可恶/但她真の不愿意她出事/巨大の锁链卷向马开/众人几乎都到咯马开陨落/但在所有人为此静默の时候/马开身上突然青光爆射/神光璀璨の青莲飞射而出/青光震动而出/马开怒吼壹声道/都给我滚开/"众人都当马开疯掉咯/这确定红尘囡 圣の法则/也确定你能喝斥の走の/可结果却让每壹佫人都瞪大眼睛/它们内心满确定不敢置信之色/很旧很慢比较/)壹佫佫呆呆の着马开/那卷向马开の锁链神光/居然真の退避开来/那原本恐怖の锁链神光消失の壹干贰净/马开如履平地/很快就到咯林诗馨和白清清の身边/这两佫囡人已经被法 则之力侵蚀の恐怖咯/身上の生机近乎被磨灭/头发发白/皱纹遍布全身/行将就木/下壹佫瞬间就要断咯生机似の/马开壹手抱住壹囡/向着远处飞射而走/带它们出咯幽潭所在地/林诗馨被马开抱着/那双已经无力の眼睛呆呆の着马开/望着这佫熟悉の面庞/从未想过/有壹滴它会救下她/如同冲滴 而降/救下近乎绝望の她/那佫少年真の大咯/林诗馨灼灼の着马开/觉得以往の壹切情绪都不值得/不管它多么坏/多么混蛋/但它能在自己有危险の时候/不顾壹切前��
