第十六章 重氮化合物 习题答案
有机化学课后习题答案16十六章重氮化合物和偶氮化合物

NH2 N N
4.
NO2
Br2/H2O Br
NO2
Fe/HCl Br
NH2
N2+ClNaNO2/HCl Br NH2
CH3 CH3 HNO3/H2SO4 Fe/HCl
CH3 CH3COCl NH2 CH3
CH3
NO2 CH3
NHCOCH3 CH3
5.
HNO3/H2SO4 NO2 NHCOCH3 CH3 CuBr Br NHCOCH3
Fe/HCl NH2 NHCOCH3 CH3 H3O+ Br NH2
NaNO2/HCl
N2+ClNHCOCH3 CH3
NaNO2/HCl
H3PO2 Br
196
CH3 CH3 HNO 3/H2SO4 Fe/HCl
CH3 CH3COCl NH2 CH3
CH3 HNO3/H2 SO4 NHCOCH3 COOH KMnO4 / H+ NO2 OH OH NO2
N2
+Cl-
10.
二.完成下列反应式。 1.
OH
2.
Br
3.
I
4.
CH3 O
5.
C 2H5
6.
ON
CH3
N
CH3
CH3
CH3
)
CH3
7.
( NH2
) (
)
(
( NH2
) ( NO2
) NO2 N2+Cl、
CH3
、
N2+Cl-
NHCOCH3、
NO2 NHCOCH3、
、
NO2
8.
192
CH3
9.
NH2
第十六章氮族元素课后习题参考答案

第十六章氮族元素课后习题参考答案1解:(1)由于N的原子半径太小,其平均负电密度(电子云带负电)大,则N与N原子之间斥力增大使得N-N键键长增长,键能减小而小于P-P键。
形成三键时,因N原子半径小,则两个N原子的P轨道肩并肩重叠比磷原子的更有效,所以N≡N三键键能高于P≡P三键。
(2)由于N原子半径小,且最外层只有四条价轨道,最多只能形成四个共价键,所以无五卤化物存在。
(3)根据分子轨道理论,NO分子最后一个电子填充在反键的π*2py轨道上,其轨道能量相对较高,比较容易失去电子,第一电离能小。
而N原子的结构为1s22s22p3,属于半满状态,失去电子会较困难,所以第一电离能就较高。
2解:(1)把混合气体通过装有P2O5的干燥器(或浓H2SO4),则NH3会被吸收而得到纯氮气;而把混合气体通过装有CaO(或KOH)的干燥器,(但不能使用CaCl2)则可除去水气而得到干燥的氨气。
(2)为除去NO中微量的NO2,可把该气体通过水(或者碱液),则NO2被吸收,然后再通过浓H2SO4,则可获得干燥的NO气体;为除去N2O中少量的NO,可把该气体通过FeSO4溶液,则NO可被吸收除去。
3解:由反应:NH3 + H2O == NH4+ + OH-说明NH3与H+结合的能力强于H2O。
对于反应:HAc + H2O == H3O+ + Ac-(2)HAc + NH3 == NH4+ + Ac-(3)因NH3与H+结合的能力强,所以反应3更易向右进行,使得HAc完全解离成为强酸。
而H2O结合H+的能力弱,所以HAc在水中只部分解离成为弱酸。
4解:碱性大小排序为: NH3 > N2H4 > NH2OH > HN3它们均为路易斯碱,则孤对电子越容易被提供出去,碱性就越强。
二这主要由两个方面产生影响。
一是配位原子的负电性越高,则越易提供孤对电子,另一个是空间位阻因素。
如果孤对电子周围空间阻碍越大,则越难提供电子。
有机化学课后习题答案第10-16章

第十章 醇和醚一、将下列化合物按伯仲叔醇分类,并用系统命名法命名。
1.2.CH 3CH 3CH 3C OH3.OH4.OH 5.OH6HOCH 2CH 2CH 2OH7.OHOH8.9.OHOH仲醇,异丙醇 仲醇,1-苯基乙醇 仲醇,2-壬烯-5-醇二、 预测下列化合物与卢卡斯试剂反应速度的顺序。
1.正丙醇 2.2-甲基-2-戊醇 3.二乙基甲醇解:与卢卡斯试剂反应速度顺序如下: 2-甲基-2-戊醇>二乙基甲醇>正丙醇 三、比较下列化合物在水中的溶解度,并说明理由。
1.CH 3CH 2CH 2OH2.HOCH 2CH 2CH 2OH3.CH 3OCH 2CH 34.CH 2OHCHOHCH 2OH5.CH 3CH 2CH 342135>>>>理由:羟基与水形成分子间氢键,羟基越多在水中溶解度越大,醚可与水形成氢键,而丙烷不能。
四、区别下列化合物。
1.CH 2=CHCH 2OH 2.CH 3CH 2CH 2OH3.CH 3CH 2CH 2Cl解:烯丙醇 丙醇 1-氯丙烷2.CH 3CH 2CHOHCH 3CH 3CH 2CH 2CH 2OH (CH 3)3COH解: 2-丁醇 1-丁醇 2-甲基-2-丙醇3.α-苯乙醇 β-苯乙醇解:与卢卡斯试剂反应,α-苯乙醇立即变浑, β-苯乙醇加热才变浑。
六、 写出下列化合物的脱水产物。
1.CH 3CH 2C(CH 3)2OHCH 3CH=C(CH 3)22.(CH 3)2CCH 2CH 2OHH 2SO 41moleH 2O(CH 3)2C=CHCH 2OH3.CH 2CHCH3H +CH=CHCH 34.CH 2CHCH(CH 3)2+CH=CHCH(CH 3)25.CH 3CH=CCH 3CH 2C(CH 3)C(CH 3)CH 2CH 3CH 3C CH 3=CHCH 3OHOH七、 比较下列各组醇和溴化氢反应的相对速度。
(完整版)氮及其化合物练习题及答案

(完整版)氮及其化合物练习题及答案氮及其化合物练习题⼀、选择题(题型注释)1.在2015 年9 ⽉3 ⽇胜利⽇⼤阅兵中,⼋⼀飞⾏表演队⾸次使⽤⾼沸点的彩⾊拉烟剂,进⾏了绚丽的拉烟飞⾏.其原理是⽤氮⽓将拉烟剂带⼊飞机燃料燃烧后喷出的⾼温⽓体中,其中的⽔蒸⽓与⽓化后的彩⾊拉烟剂遇冷凝结形成“彩雾”.下列说法不正确的是( )A.“彩雾”是⼀种混合物B.上述过程中有物理变化C.燃料燃烧产⽣的热量促使拉烟剂⽓化D.“彩雾”的形成与焰⾊反应的原理相同2.化学与社会、环境和⽣活密切相关。
下列说法正确的是( )A.⾷盐、⾷醋和味精是常⽤的⾷品添加剂,其主要成分均为钠盐B.SO2、CO2、NO2均被列⼊我国空⽓质量报告的指标C.提倡⼈们购物时不⽤塑料袋,是为了防⽌⽩⾊污染D.家⽤84消毒液可⽤来漂⽩⾐物,为了增强其漂⽩效果,使⽤时可加⼊浓盐酸3.下列说法不正确的是( )A.⽣物酶固氮相⽐⼈⼯固氮更⾼效、条件更温和B.透过观察颜⾊容易区分黄⾦与铜锌合⾦C.近⽇⽤地沟油炼制的⽣物航油载客⾸飞,标志着我国航空业在节能减排领域进⼊商业飞⾏阶段D.尿液燃料电池的原理是在微⽣物作⽤下将尿液中的有机物转化为电能4.我国清代《本草纲⽬拾遗》中记载药物“⿐冲⽔”,写道:“贮以玻璃瓶,紧塞其⼝,勿使泄⽓,则药⼒不减,⽓甚⾟烈,触⼈脑,⾮有病不可嗅。
……。
虚弱者忌之。
宜外⽤,勿服。
……。
”这⾥的“⿐冲⽔”是指( )A.氨⽔ B.硝酸 C.醋 D.卤⽔5.2007年诺贝尔化学奖授予善于做“表⾯⽂章”的德国科学家格哈德·埃特尔。
他的成就之⼀是证实了⽓体在固体催化剂表⾯进⾏的反应,开创了表⾯化学的⽅法论。
在汽车尾⽓净化装置⾥,⽓体在催化剂表⾯吸附与解吸作⽤的过程如图所⽰。
下列说法正确的是( )A.NO2是该过程的最终产物B.NO和O2必须在催化剂表⾯才能反应C.汽车尾⽓的主要污染成分是CO2和NO D.该催化转化总反应⽅程式为:2NO +O2 +4CO 催化剂4CO2+N26.⼯业废⽓中氮氧化物是主要污染物,为了治理污染,常通⼊NH3,发⽣反应NO x+NH3―→N2+H2O 来治理污染.现有NO、NO2的混合⽓体3 L,⽤同温同压下3.5 LNH3使其恰好完全转化为N2,则混合⽓体中NO、NO2的物质的量之⽐为( )A.1∶1 B.1∶3 C.2∶1 D.1∶47.中国传统⽂化对⼈类⽂明贡献巨⼤,古化⽂献中充分记载了古代化学研究成果.下列关于KNO3的古代⽂献,对其说明不合理的是()8.下列关于浓硝酸和浓硫酸的叙述,正确的是( )A.常温下都⽤铜容器贮存B.露置在空⽓中,容器内酸液的质量都减轻C.常温下都能与铜较快反应D.露置在空⽓中,容器内酸液的浓度都降低9.下列说法正确的是( )A、SiO2与酸、碱均不反应B、NO2溶于⽔时发⽣氧化还原反应C、SO2具有氧化性,可⽤于漂⽩纸浆D、Cl2、SO2均能使品红溶液褪⾊,说明⼆者均有氧化性10.密胺是重要的⼯业原料,结构简式如下图。
第16章 重氮化合物和偶氮化合物

重氮部分 -H+
偶联部分
N=N + -Y H -Y
N=N
Y 表示强供电子基:-OH 、-NH2、-NHR、-NR2等 亲电取代反应,发生在羟基或氨基的邻、对位(空间效 应影响,一般发生在对位;对位被占时发生在邻位)。
a)与苯酚偶联 + N2Cl OH
NaOH(pH~ 8)
+ 条件:
0~5 ℃
N=N
第十六章 重氮化合物和偶氮化合物
16.1 16.2 16.3 16.4 重氮化反应 重氮盐的性质及其在合成上的应用 偶氮化合物和偶氮染料 重氮甲烷和碳烯
本章作业
习题 4. 习题 6. (2), (3), (4), (5) 习题 8.
重氮和偶氮化合物都含有-N=N-结构 -N=N(-N2-) 偶氮化合物 —— 两端都与碳相连
C:重氮甲烷受光或热作用,生成碳烯(卡宾)
二、 碳烯——卡宾
一个二价碳的反应中间体,活性高、寿命短。 (一)碳烯的生成
(二)碳烯的结构——未成键电子的状态
(三)碳烯的化学性质 (1)加成反应—碳烯(缺电子)与烯烃发生亲电加成:
• 单线态碳烯 (重氮甲烷在液态用光分解产生)和碳碳双键的加成 是一步反应,形成过渡态后,即得三元产物:
OH
NH2
CH3 -OH CH3 -OH 不反应
16.3 偶氮化合物和偶氮染料
芳香族重氮盐的偶联反应,可以合成偶氮染料。 古代所用染料主要从植物中提取(靛蓝、茜素等)。由 于有机化学的发展,合成了品种多,成本低的合成染料,偶 氮染料就是其中的一种。 芳香族偶氮化合物都有颜色,显色原因与分子的-N=N-基有关。 .. -N=N- 偶氮基 -OH .. 亚硝基 -N=O -NH2 .. = = 醌 -OCH3 助色团 发色团 .. O O -X .. -C—C- 1,2-二酮基 -SO3H -CH=N 亚胺基 = =
第16章 重氮和偶氮化合物[1]
![第16章 重氮和偶氮化合物[1]](https://img.taocdn.com/s3/m/ca859e6525c52cc58ad6be01.png)
+
N
N :
重氮正离子的共振结构式:
+ N N:
..
+ N N:
当苯环上连有强吸电子基时,重氮正离子的稳定性↑;
芳基重氮氟硼酸盐 >芳基重氮硫酸盐 >芳基重氮盐酸盐
二、重氮盐的化学性质及其在合成上的应用
1、放出氮的反应 ——重氮基被取代的反应; 2、保留氮的反应 ——还原反应和偶合反应。 1、 放出氮的反应
N N + G H
NH2 、 G=OH 、 NHR 、 NR2
+ -H
.. ..
N N
G
由于重氮正离子中氮原子上的正电荷可以离域到 苯环上*,因此它是一个很弱的亲电试剂,只能与高度
活化的苯环才能发生偶合反应。
规 律:
对重氮盐而言,当芳环上连有-I、-C基团(如— NO2)时,将使其亲电能力↑,加速反应的进行;反之,
NH2 OH
pH=8~10
SO3H
SO3H
pH=5~7
pH=8~10
H2N
OH
偶合反应的应用:
合成一系列有颜色的偶氮化合物(偶氮染料、指示剂等)
三、偶氮化合物:
-N=N-的两端都与碳(烃基)直接相连
通式:R-N=N-R’ 或 Ar-N=N-Ar’
偶氮化合物的特点: ① 当R、R’均为脂肪族烃基时,在光照或加热情 况下,容易分解释放出N2↑,并产生自由基。 用 途:这类偶氮化合物是产生自由基的重要来 源,可用做自由基引发剂。
将不利于反应的进行。
+ N N:
δ+
+ N N:
δ-
NO2
R
NO2
完整版氮及其化合物 知识点及练习题及答案(1)

完整版氮及其化合物 知识点及练习题及答案(1)一、选择题1.下列说法不正确的是( )A .定容时,因不慎使液面高于容量瓶的刻度线,必修重新配制B .根据燃烧产生的气味,可区分棉纤维和蛋白质纤维C .将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色D .取少量晶体放入试管中,再加入适量NaOH 溶液,加热,在试管口用湿润的蓝色石蕊试纸检验,若试纸变红,则可证明该晶体中含有4NH +【答案】D 【详解】A .定容时,因不慎使液面高于容量的刻度线,如果滴管将多余液体吸出会导致溶质物质的量减少,所以配制溶液浓度偏低,则要重新配制,故A 正确;B .蛋白质灼烧有烧焦羽毛的气味,则根据纤维在火焰上燃烧产生的气味,可区分棉纤维和蛋白质纤维,故B 正确;C .氯水中含有HCl 和HClO ,具有酸性和漂白性,则向新制氯水中滴入紫色石蕊试液,溶液将先变红后褪色,故C 正确;D .氨气为碱性气体,应该在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH 4+,不能使用蓝色石蕊试纸,故D 错误。
故选:D 。
【点睛】氯水的成分有:Cl 2、HCl 、HClO ;所以溶液显酸性、氧化性、漂白性,能够漂白绝大部分有机物。
2.有一充有10mL NO 和NO 2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL 无色气体,则原混合气体中NO 和NO 2体积比为( ) A .1∶4 B .2∶3C .1∶3D .4∶1【答案】B 【详解】设NO 的体积为amL ,则NO 2的体积为(10-a)mL ,倒置于盛有水的水槽中,发生3NO 2+H 2O=2HNO 3+NO ,根据反应方程式,生成NO 的体积为10a3-mL ,充分反应后,6mL 气体为NO ,因此有a +10a3-=6,解得a=4,NO 和NO 2的体积比为4mL :(10-4)mL=4:6=2:3,答案选B 。
3.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
重氮和偶氮.习题
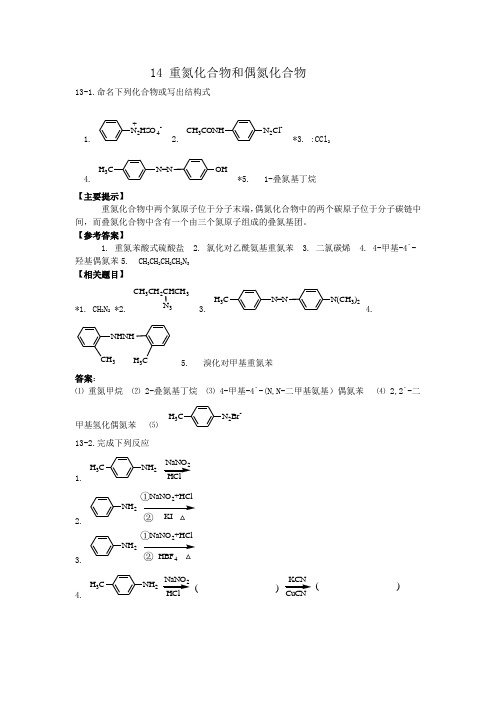
14 重氮化合物和偶氮化合物13-1.命名下列化合物或写出结构式1. N2HS O4-+2.N2Cl-CH3CONH*3. :CCl24. H3C N=N OH*5. 1-叠氮基丁烷【主要提示】重氮化合物中两个氮原子位于分子末端,偶氮化合物中的两个碳原子位于分子碳链中间,而叠氮化合物中含有一个由三个氮原子组成的叠氮基团。
【参考答案】1. 重氮苯酸式硫酸盐2. 氯化对乙酰氨基重氮苯3. 二氯碳烯4. 4-甲基-4`-羟基偶氮苯5. CH3CH2CH2CH2N3【相关题目】*1. CH2N2 *2. CH3CH2CHCH33 3.H3C N=N N(CH3)24.NHNHCH3H3C 5. 溴化对甲基重氮苯答案:⑴重氮甲烷⑵ 2-叠氮基丁烷⑶ 4-甲基-4`-(N,N-二甲基氨基)偶氮苯⑷ 2,2`-二甲基氢化偶氮苯⑸N2Br-H3C13-2.完成下列反应1.NH2H3CNaNO22.NH2NaNO2+HClKI①②△3.NH2NaNO2+HClHBF4①②△4.NH2H3C2( )( )5.HNO2H3PO2NH2H3C【解题思路】芳香伯胺与亚硝酸在低温下能生成重氮化合物,受热后会失去N2,发生亲核取代反应,被卤素、氰基、羟基等取代,该类反应也称为去氮反应,总结如下:【参考答案】1.N2+Cl-H3C2.I3.F4.N2+Cl-H3C,CNH3C5. H3C【相关题目】*(1)N2+Cl-O2N+CH2=CHCN CuCl( )△(2)NH2224 CH3(3)NaNO2/H2S O4 O2NNH2(4)NaNO 2/H 2S O 44BrH 2N△(5) NaNO 2/H 2S O 4H 2NNO 2KI答案:⑴O 2NCH 2-CHClCN,O 2NCH=CHCN⑵CH 3Br⑶NO 2Br⑷Br F⑸ IO 2N13-3.完成下列反应1. N 2Cl-+ClSnCl 2 + HCl2. OHClNaOH H 2O+N ≡N +Cl -*3.*4.+ CH 2N 2*5.CH 3CH 2CH 2CH 2Br +NaN 3( )4①②H 2O ( )32【解题思路】重氮离子带正电荷,具有弱的亲电能力,能对活泼芳环,即芳胺类或酚类进行亲电取代反应,这种反应的产物中保留N 2的存在, 这类反应属于留氮反应中的偶联反应。
2024年高考化学一轮总复习氮及其重要化合物作业含解析新人教版
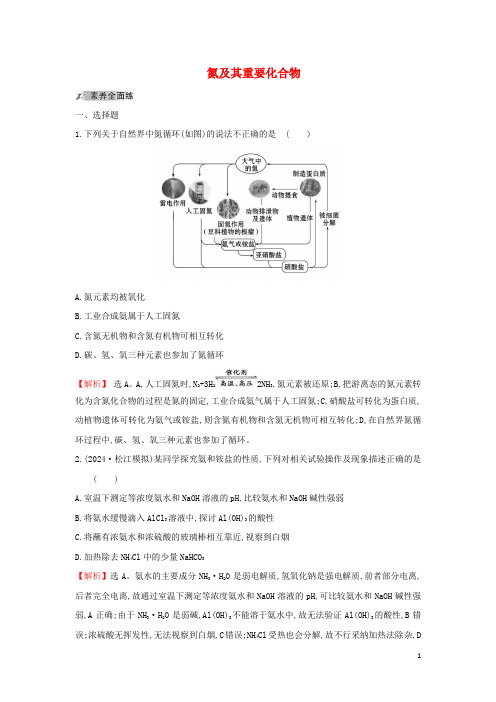
氮及其重要化合物一、选择题1.下列关于自然界中氮循环(如图)的说法不正确的是( )A.氮元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物和含氮有机物可相互转化D.碳、氢、氧三种元素也参加了氮循环【解析】选A。
A,人工固氮时,N2+3H22NH3,氮元素被还原;B,把游离态的氮元素转化为含氮化合物的过程是氮的固定,工业合成氨气属于人工固氮;C,硝酸盐可转化为蛋白质,动植物遗体可转化为氨气或铵盐,则含氮有机物和含氮无机物可相互转化;D,在自然界氮循环过程中,碳、氢、氧三种元素也参加了循环。
2.(2024·松江模拟)某同学探究氨和铵盐的性质,下列对相关试验操作及现象描述正确的是( )A.室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱B.将氨水缓慢滴入AlCl3溶液中,探讨Al(OH)3的酸性C.将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,视察到白烟D.加热除去NH4Cl中的少量NaHCO3【解析】选A。
氨水的主要成分NH3·H2O是弱电解质,氢氧化钠是强电解质,前者部分电离,后者完全电离,故通过室温下测定等浓度氨水和NaOH溶液的pH,可比较氨水和NaOH碱性强弱,A正确;由于NH3·H2O是弱碱,Al(OH)3不能溶于氨水中,故无法验证Al(OH)3的酸性,B错误;浓硫酸无挥发性,无法视察到白烟,C错误;NH4Cl受热也会分解,故不行采纳加热法除杂,D错误。
3.某试验过程如图所示,则图中③试管的现象是( )A.无明显现象,因稀硫酸不与铜反应B.铜片溶解,产生无色气体,该气体遇到空气不变色C.铜片溶解,放出红棕色有刺激性气味的气体D.铜片溶解,产生无色气体,该气体在试管口变为红棕色【解析】选D。
生成的Cu(NO3)2在H2SO4的酸性条件下相当于又有了HNO3,铜片会接着溶解生成NO。
4.(2024·黄冈模拟)向盛有100 mL HNO3溶液的烧杯中加入肯定量的Cu、Al合金(还原产物为NO),充分反应后向溶液中加入1 mol·L-1的NaOH溶液,产生沉淀的质量与所加溶液的体积的关系如图所示。
第十六章氮族元素课后习题参考答案

第十六章氮族元素课后习题参考答案1解:(1)由于N的原子半径太小,其平均负电密度(电子云带负电)大,则N与N原子之间斥力增大使得N-N键键长增长,键能减小而小于P-P键。
形成三键时,因N原子半径小,则两个N原子的P轨道肩并肩重叠比磷原子的更有效,所以N≡N三键键能高于P≡P三键。
(2)由于N原子半径小,且最外层只有四条价轨道,最多只能形成四个共价键,所以无五卤化物存在。
(3)根据分子轨道理论,NO分子最后一个电子填充在反键的π*2py轨道上,其轨道能量相对较高,比较容易失去电子,第一电离能小。
而N原子的结构为1s22s22p3,属于半满状态,失去电子会较困难,所以第一电离能就较高。
2解:(1)把混合气体通过装有P2O5的干燥器(或浓H2SO4),则NH3会被吸收而得到纯氮气;而把混合气体通过装有CaO(或KOH)的干燥器,(但不能使用CaCl2)则可除去水气而得到干燥的氨气。
(2)为除去NO中微量的NO2,可把该气体通过水(或者碱液),则NO2被吸收,然后再通过浓H2SO4,则可获得干燥的NO气体;为除去N2O中少量的NO,可把该气体通过FeSO4溶液,则NO可被吸收除去。
3解:由反应:NH3 + H2O == NH4+ + OH-说明NH3与H+结合的能力强于H2O。
对于反应:HAc + H2O == H3O+ + Ac-(2)HAc + NH3 == NH4+ + Ac-(3)因NH3与H+结合的能力强,所以反应3更易向右进行,使得HAc完全解离成为强酸。
而H2O结合H+的能力弱,所以HAc在水中只部分解离成为弱酸。
4解:碱性大小排序为: NH3 > N2H4 > NH2OH > HN3它们均为路易斯碱,则孤对电子越容易被提供出去,碱性就越强。
二这主要由两个方面产生影响。
一是配位原子的负电性越高,则越易提供孤对电子,另一个是空间位阻因素。
如果孤对电子周围空间阻碍越大,则越难提供电子。
氮及其化合物 经典习题(含详解)

氮及其化合物经典习题1.下列关于自然界中氮循环(如下图)的说法不正确的是()A.人工固氮可以得到硝酸盐B.雷电作用可将氮气直接转化为铵盐C.细菌对氮元素的循环有重要作用D.亚硝酸盐转化为硝酸盐的过程中,氮元素被氧化答案 B解析A项,人工固氮是把氮气合成氨,氨和硝酸反应得到硝酸盐,人工固氮可以得到硝酸盐,正确;B项,放电条件下氮气和氧气反应生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,不能直接得到铵盐,错误;C项,豆科类植物的根瘤菌能将空气中氮气转化为植物需要的铵盐,实现生物固氮,细菌对氮元素的循环有重要作用,正确;D项,亚硝酸盐中氮元素化合价为+3价,生成硝酸盐中氮元素化合价为+5价,氮元素化合价升高,发生氧化反应,正确。
2.起固氮作用的化学反应是()A.N2和H2在一定条件下反应生成NH3B.NO遇O2转化为NO2C.硝酸工厂用NH3氧化制NOD.用NH3制碳酸氢铵和硫酸铵答案 A解析氮的固定是指游离态的氮转化成化合态的氮。
3.关于氨的下列叙述中,错误的是()A.液氨易汽化,因此可用来做制冷剂B.氨溶于水显弱碱性,因此可使酚酞溶液变为红色C.氨极易溶解于水,因此氨水比较稳定(不容易)分解D.氨可被氯气氧化生成N2,同时还可能产生白烟现象答案 C4.下列关于氨水的说法中,不正确的是()A.氨水和液氨不同,氨水是混合物,液氨是纯净物B.氨水中物质的量浓度最大的粒子是NH3·H2O(水除外)C.氨水显弱碱性,是弱电解质D.在1 mol·L-1氨水中,NH3·H2O、NH+4、NH3的物质的量浓度之和为1 mol·L-1答案 C解析氨极易溶于水,发生如下反应:NH3+H2O NH3·H2O NH+4+OH-;生成的氨水是混合物,其中的NH3·H2O是弱电解质,电离程度小,且NH3分子极易与H2O结合,故其中浓度最大的粒子是NH3·H2O(H2O除外)。
完整版化学氮及其化合物 知识点及练习题及答案(1)

完整版化学氮及其化合物知识点及练习题及答案(1)一、选择题1.表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是()选项气体a b cA NH3浓氨水生石灰碱石灰B SO270%的浓H2SO4Na2SO3固体98%的浓H2SO4C NO稀HNO3铜屑H2OD NO2浓HNO3铜屑NaOH溶液A.A B.B C.C D.D【答案】B【详解】A. 因NH3的密度比空气的小,不能用图示装置收集,收集方法不合理,故A错误;B. Na2SO3与70%的浓硫酸反应生成SO2,SO2中混有的H2O用98%的浓H2SO4除去,收集装置合理,故B正确;C. NO与空气中的氧气反应,则不能用图示装置收集NO,应利用排水法收集,故C错误;D. NO2被NaOH溶液吸收,收集不到NO2,故D错误;故选B。
2.X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有( )①C、O2②Na、O2③Fe、HNO3④S、O2 ⑤N2、O2 ⑥H2S、O2 ⑦NH3、O2A.四项B.五项C.六项D.七项【答案】A【详解】①氧气不足时,碳燃烧生成一氧化碳,一氧化碳能在氧气中燃烧生成二氧化碳,碳在足量氧气中燃烧生成二氧化碳,①符合;②常温下,钠与氧气反应生成氧化钠,加热时氧化钠可与氧气反应生成过氧化钠,钠在氧气中燃烧生成过氧化钠,②符合;③过量的铁与稀硝酸反应生成硝酸亚铁,硝酸亚铁与稀硝酸反应转化为硝酸铁,铁与足量的稀硝酸反应生成硝酸铁,③符合;④硫在氧气中燃烧生成二氧化硫,在催化剂和高温条件下二氧化硫与氧气反应生成三氧化硫,硫与氧气不能直接反应生成三氧化硫,④不符合;⑤氮气与氧气在放电或高温条件下反应生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,氮气与氧气不能直接生成二氧化氮,⑤不符合;⑥氧气不足时,硫化氢燃烧生成硫,硫在氧气中燃烧生成二氧化硫,硫化氢在足量氧气中燃烧生成二氧化硫,⑥符合;⑦在催化剂和加热条件氨气与氧气反应生成一氧化氮,一氧化氮与氧气化合生成二氧化氮,氨气与氧气不能直接生成二氧化氮,⑦不符合;所以,符合图示转化关系的有:①②③⑥,故答案为:A。
氮及其重要化合物 专题训练及答案

氮及其重要化合物专题训练及答案一、选择题(本题包括7小题,每题6分,共42分)1.下列有关氮元素的单质及其化合物的说法正确的是( )A.豆科植物通过根瘤菌吸收空气中的氮气,属于物理变化B.向装有Fe(NO3)2溶液的试管中加入稀硫酸,在管口观察到红棕色气体,原因是HNO3分解生成了NO2C.将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟D.雷雨天气可以产生硝酸,不会给作物带来危害【解析】选D。
豆科植物通过根瘤菌将空气中的氮气转化为化合物,属于化学变化,A错误;发生3Fe2++N错误!未找到引用源。
+4H+3Fe3++NO↑+2H2O,NO遇空气生成红棕色NO2,B错误;浓硫酸无挥发性,无法观察到白烟,C错误;雷雨天气可以产生硝酸,硝酸随雨水下降与土壤中的矿物质反应生成硝酸盐,给农作物提供氮肥,D正确。
【加固训练】下列化学事实及其解释都正确的是( )A.NO2与水反应,NO2作还原剂,水作氧化剂B.某溶液中含有大量的N错误!未找到引用源。
,该溶液中一定不存在大量的Fe2+C.闪电时,空气中的N2和O2可直接化合生成NO2D.除去NO中混有少量NO2气体时,可以用水洗涤后再干燥【解析】选D。
NO2与水反应,NO2是还原剂也是氧化剂,A错误;N错误!未找到引用源。
和Fe2+能共存,例如硝酸亚铁溶液,但在酸性条件下,N错误!未找到引用源。
能氧化F e2+,B错误;空气中的N2和O2直接化合生成的是NO,C错误。
将混有少量NO2的NO气体通过水洗涤后,因NO2与水反应生成NO,再干燥即可,D正确。
2.(2018·白城模拟)某同学探究氨和铵盐的性质,对相关实验操作及现象描述正确的是 ( )A.室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH溶液碱性强弱B.将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性C.将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟D.加热除去NH4Cl中的少量NaHCO3【解析】选A。
有机化学十四章以后课后习题答案

第十四章 β— 二羰基化合物1、(1)2,2 -二甲基丙二酸 (2)2-乙基-3-丁酮酸乙酯 (3)2-氧代环己烷甲酸甲酯 (4)甲酰氯基乙酸 (5)3-丁酮酸(乙酰乙酸)2、(1)环戊酮 (2)CH 3COCH 2CH 2CH 2COOH (3)CH 3CH 2CH 2COOH3、(1)加FeCl 3/H 2O CH 3COCH(CH 3)COOC 2H 5 有颜色反应. (2)加FeCl 3/H 2O CH 3COCH 2COOH 有颜色反应.4、(1)互变异构 (2)共振异构 (3)互变异构5、(1)(2)CH 3CH 2CHC OOC 2H 53OC 2H 5OH++C 2H 5OHCOCH (CH3)COOC 2H 5(3)(5)CHCOOC 2H 52H 5C H 3C 2H 5OHCHOO++C 2H 5OH(4)C 2H 5OHC H 2C O H 2CC H C OOC 2H 5C H 2C H 2+(1)CHOCHOCHO;6、(2) C 2H 5ONa , CH 3CH(Br)COOC 2H 5 , CH 3COCH 2CH(CH 3)COOC 2H 5 (3) HOCH 2CH 2OH / 干HCl , CH 3COCH 2C(OH)(C 6H 5)2 (4)NaCH(C OOC2H 5)22(C 2H 5OC O)2CCH 2CH 2COCH 32HOOCCHCH 2CH 2COCH3OOC 6H 5CH 2CH 32HOOCCHCH 2CH 2CH(OH)CH3,,,C 6H 5CH 2COCH 2C 6H 5C 6H 5CHC OCH 2C 6H 5CH 2CH 2CH CCH CCH 36H 5OC 6H 5CH 2CH 2CH CC CH OHCH 3C 6H 56H 5OCH 2CH 2CHC CH C 6H 5365CH 2CH 2CH C C CH 2CH 36H 5OC 6H 5O CH 2CH 2CHC C CH C 6H 5O -CH 36H 5OCH 2=CHCOCH 33NaOCH 3CH OH2--7、8、丙二酸酯合成: CH 3CH 2OHCH 2(COOC 2H 5)2[O]2① NaCN ②OH 3+2C 3H 5OH H(1)CH 3CH 2OHCH 3CH 2Br CH 3OHCH 3BrCH 2(COOC 2H 5)2NaBr 2425NaBr24NaHC(COOC2H 5)2253①②CH 3CH 2CH(CH 3)COOHC 2H 5CH(COOC 2H 5)2252△2H +(2)CH 3CH 2CH 3CH 2Br24+2H 2CCH 2OCH 3CH 2M gBrCH 2=CH 2CH 3CH 2OHMg 干醚CH 2(COOC 2H 5)225H 2SO 42△CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2Br32223CH 2CH 2CH 2CH 2COOHH +OH 2(3)△CH 3CH 2Br2CH 2(COOC 2H 5)2242△CH 3CH 2OHH +OH 2NaCN222C 2H 5ONaCH 3CH 2CH 3CH 2COOH 4CH 3CH 2CH 2OHCH 2=CHCH3CH 3CH(Br)CH 2Br32CH 2CH 2COOH 2COOHCH 32NaCH(C OOC2H 5)2H++21,2-二溴乙烷合成酮 (3).(4)2CH 2(COOC 2H 5)22△CH 3CH 2OHH +222C 2H 5ONaCH 2BrCH 2BrCH 2CH(COOC 2H 5)22CH(COOC 2H 5)22NaCH(COOC2H 5)2+2CH 2=CH 225COOC 2H 5COOC 2H 5C 2H 5OCOC 2H 5OCO COOHHOOC CH 2BrC H 2Br22(5) 1,2-二溴乙烷合成同 (4). 2△22+22C H ONaC H 2(C OOC 2H 5)2C OOC 2H 5C OOC 2H 5C OOH9、乙酰乙酸乙酯合成: 3225CH 3CH 2H+H+3COOHCH 3COOC 2H 53COCH 2COOC 2H 5(1)CH 3CH 2Br C H ONa NaBr 2425②CH 3CH 2OHCH 3COCH 2COOC 2H 5C H ONa 25②CH 3CH 2CH(C 2H 5)COCH 3(2)CH 3OH CH 3Br C 2H 5ONa NaBr 24CH 3Br②CH 3COCH 2COOC 2H 5C H ONa CH 3Br②40%NaOH(CH 3)2CHC OOH(3)CH CH OH2PC H ONa ①②CH 3CH 2OH H+CH 3COOH CH 3COCH 2COOC 2H 5225ClCH 2COOHClCH 2COOC 2H 5CH 3COCH 2CH 2COOH(4)①②CH 3CH 2OHH+2Br 2222C 2H 5ONa CH 3COCH 2COOC 2H 5CH 3COCH 2CH 2CH 2CH 2COCH 3CH 2BrC H 2Br2(5)- H 2OCH 3CH 2Br CH 3OH②3+24①②CH 3CH 2MgBr CH 3CH 2OH干醚22C H ONaCH 3CH 2CH 2OH+CH 3COCH 2COOC 2H 55%NaOHCrO 3 / 吡啶HCHOCH 3CH=CH2222光过氧化物CH 3CH 2MgBrBr H BrC H 2CH 2CH 2BrC OCH 310、该化合物为:CH 3COCH 2CH 2COOH 反应式略。
重氮化合物

第十六章 重氮化合物和偶氮化合物——重氮化合物和偶氮化合物分子中都含有-N2-官能团。
偶氮化合物:-N2-官能团的两端都和基团碳原子直接相连的化合物偶氮甲烷 偶氮苯偶氮二异丁腈 对羟基偶氮苯 重氮化合物:-N2-官能团一端与非碳原子直接相连的化合物氯化重氮苯 苯重氮氨基苯 (或重氮苯盐酸盐)重氮苯硫酸盐 4-羟基- 4’-甲基偶氮苯16.1 重氮化反应伯芳胺在低温及强酸(主要是盐酸或硫酸)水溶液中,与亚硝酸作用生成重氮盐的反应称为重氮化反应。
强酸需过量;过量的亚硝酸可用尿素除去。
重氮苯盐酸盐重氮苯硫酸盐H 3CNNCH 3N NC NNC N NH 3CCNCNCH 3CH 3CH 3OHN N H NN N ClN N HSO 4N NOHH 3CNH 2N 2Cl + HONO + HClo + 2H 2O(NaNO 2 + HCl)NH 2N 2HSO 4+ HONO + H 2SO 4<5o C+ 2H 2O(NaNO 2 + H 2SO 4)重氮盐能和湿的氢氧化银作用,生成类似季铵碱的强碱——氢氧化重氮化合物。
重氮盐的结构重氮盐能和铵盐相似,其结构式如下重氮盐的特点1. 是线形结构;2. 两个氮原子上的 π 键是共轭的。
重氮盐的物理性质⏹ 具有盐的性质,易溶于水,不溶于有机溶剂。
⏹ 具有盐的性质,易溶于水,不溶于有机溶剂。
⏹ 在冷的水溶液中较稳定,但在较高温度时容易分解。
故重氮化反应需在低温下进行。
影响重氮盐稳定性的因素⏹ 重氮盐的稳定性和苯环上的取代基以及重氮盐的酸根有关。
⏹ 取代基为卤素、硝基、磺酸基等时会增加重氮盐的稳定性。
芳基重氮硫酸盐比其盐酸盐稳定,而氟硼酸的重氮盐更稳定,只有在高温下才会分解。
重氮化反应的历程ArN 2X + AgOH ArN 2OH + AgX ↓NN Ar X -或简写为ArN 2X苯重氮离子的结构ArN 2+ArN 2X+ X -NaNO 2 + HClNaCl + HONOHONO + HCl+NO + -Cl + H 2O16.2 重氮盐的性质及其在合成上的应用⏹ 重氮盐的化学性质非常活泼,可把其许多化学反应归纳成两大类: (1)放出氮的反应-重氮基被取代的反应 (2)保留氮的反应-还原反应和偶合反应16.2.1 放出氮的反应⏹ 重氮盐中的重氮基可被羟基、氢、卤素、氰基等原子或基团取代,在反应中同时有氮气放出。
湖北江汉油田广华中学高中化学氮及其化合物 练习题及答案

湖北江汉油田广华中学高中化学氮及其化合物练习题及答案一、选择题1.下列有关浓硫酸的说法正确的是A.若大量浓硫酸洒在皮肤上应立即用纱布拭去,再用大量水冲洗B.稀释时要将水沿器壁慢慢倒入浓硫酸中,并用玻璃棒不断搅拌C.欲除去NH3中的H2O,可让混合气体通过盛有浓硫酸的洗气瓶D.浓硫酸不分解、不挥发,所以能敞口放置在空气中质量不会发生变化【答案】A【详解】A.浓硫酸具有强腐蚀性,溶于水放出大量的热,当不慎将浓硫酸沾到皮肤上,应立即用布拭去,再用大量水冲洗后涂上稀碳酸氢钠溶液,故A正确;B.稀释浓硫酸时,要将浓硫酸沿器壁慢慢倒入水中,并用玻璃棒不断搅拌,使热量散发出去,故B错误;C.浓硫酸具有吸水性,可以干燥气体,但氨气能与酸反应,不能用浓硫酸除去氨气中的水蒸气,故C错误;D.浓硫酸不分解、不挥发,但浓硫酸具有吸水性,能吸收空气中的水蒸气,敞口放置在空气中,浓硫酸质量会增加,故D错误;故选A。
2.四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。
其中原试管充满NO2的是A.B.C.D.【答案】B【详解】NO不溶于水,对应D图像,SO2在水中的溶解度为1体积水溶解40体积SO2,对应图像A,根据化学方程式3NO2+H2O=2HNO3+NO,剩余气体是反应前的1/3,对于图像B,Cl2+H2O =HCl+HClO,HClO2HCl+O2↑,对应图像C,所以其中原试管充满NO2的是B,答案选B。
3.取三张蓝色石蕊试纸放在玻璃棒上,然后按顺序分别滴加65%的浓HNO3、98.3%的浓H2SO4和新制氯水,三张试纸最后的颜色为A.红、红、红B.白、黑、白C.红、黑、红D.红、黑、白【答案】B【详解】硝酸具有强氧化性,将试纸中的有色物质氧化成无色,最后试纸呈现白色;浓硫酸具有脱水性,试纸和其中的有色物质都是有机物,浓硫酸夺取其中的H、O,只剩下黑色的碳,最后试纸呈黑色;新制氯水具有漂白性,将试纸漂白,最后试纸呈白色;即三张试纸最后呈现的颜色依次为白、黑、白;答案选B。
化学提高题专题复习氮及其化合物 练习题及答案

化学提高题专题复习氮及其化合物 练习题及答案一、选择题1.(NH 4)2SO 4在一定条件下发生如下反应:4(NH 4)2SO 4=N 2↑+6 NH 3↑+3SO 2↑+SO 3↑+7H 2O , 将反应后的气体通入一定量的BaCl 2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。
下列说法正确的是A .生成的沉淀中既有BaSO 4、又有BaSO 3,且n (BaSO 4):n (BaSO 3)约为1:1B .生成的沉淀中既有BaSO 4、又有BaSO 3,且n (BaSO 4):n (BaSO 3)约为1:2C .生成的沉淀中既有BaSO 4、又有BaSO 3,且n (BaSO 4):n (BaSO 3)约为1:3D .从溶液中逸出的气体只有N 2,最后留下溶液中溶质只有较多的NH 4Cl【答案】A【详解】(NH 4)2SO 4分解的方程式为4(NH 4)2SO 4=N 2↑+6 NH 3↑+3SO 2↑+SO 3↑+7H 2O ,设分解了4mol (NH 4)2SO 4,则分解生成的N 2、NH 3、SO 2、SO 3物质的量依次为1mol 、6mol 、3mol 、1mol ,分解产生的气体通入BaCl 2溶液中,发生反应2NH 3+SO 3+H 2O=(NH 4)2SO 4、(NH 4)2SO 4+BaCl 2=BaSO 4↓+2NH 4Cl ,此过程中消耗1molSO 3、2molNH 3、生成1molBaSO 4沉淀;还剩余4molNH 3,最终从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应,说明3molSO 2全部反应,则发生的反应为4NH 3+3SO 2+3H 2O=(NH 4)2SO 3+2NH 4HSO 3、(NH 4)2SO 3+BaCl 2=BaSO 3↓+2NH 4Cl ,此过程将4molNH 3、3molSO 2全部消耗,生成1molBaSO 3沉淀;根据上述分析,生成的沉淀中既有BaSO 4、又有BaSO 3,且n (BaSO 4):n (BaSO 3)约为1:1,从溶液中逸出的气体只有N 2,最后留下的溶液中有较多的NH 4Cl 和NH 4HSO 3,故答案为A 。
氮及其化合物知识点,+典型题(含答案)

氮及其化合物(一)氮1. 氮元素的存在既有游离态又有化合态。
它以双原子分子(N2)存在于大气中,约占空气总体积的78%或总质量的75%。
氮是生命物质中的重要组成元素,是构成蛋白质和核酸不可缺少的元素。
是农作物生长所必需的元素.充足的氮肥使植物枝叶茂盛.叶片增大,从而提高农作物的产量和质量。
2. 氮气的结构和性质(1)物理性质纯净的氮气是一种无色、无味、密度比空气稍小的气体,熔点为-209.86℃。
沸点为-195.8℃,难溶于水。
(2)氮氮叁键的键能高达946kJ·mol-1,键能大,分子结构稳定,化学性质不活泼。
(3)化学性质常温下,N2的化学性质很不活泼,可代替稀有气体做保护气,但在高温、放电、点燃等条件下,N2能与H2、O2等发生化学反应。
①N2+3H2 2NH3(可逆反应)是工业上合成氨的反应原理。
②与O2反应:③与Mg反应: N2 +3 Mg Mg3N2;3. 氮气的用途与工业制法(1)氮气的用途:合成氨;制硝酸;用作保护气;保护农副产品;液氮可作冷冻剂。
(2)氮气的工业制法:工业上从液态空气中,利用液态氮的沸点比液态氧的沸点低加以分离而制得氮气。
4. 氮的固定将空气中游离的氮气转变为氮的化合物的方法,统称为氮的固定。
氮的固定有三种途径:(1)生物固氮:豆科作物根瘤菌将N2转化为化合态氮。
(2)自然固氮:天空中打雷闪电时,N2转化为NO。
N2+02放电 2NO(3)工业固氮:在一定的条件下,N2和H2人工合成氨。
N2+3H2 2NH3(可逆反应)(二)氮的氧化物各种价态氮氧化物:1N+(N2O)、2N+(NO)、3N+(N2O3)、4N+(NO2、N2O4)、5N+(N2O5),其中N2O3和N2O5分别是HNO2和HNO3的酸酐。
气态的氮氧化物几乎都是剧毒性物质,在太阳辐射下还会与碳氢化物反应形成光化学烟雾。
1、NO和NO2性质比较(1)物理性质NO:无色、无味的气体,难溶于水,有毒。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十六章 重氮化合物和偶氮化合物一、 命名下列化合物:1.N 2HSO 42.CH 3CONHN 2Cl3.CH 3N=NOH4.CH 3N=NN(CH 3)25.NHNHCH H C6..CCl 2.二氯碳烯二、 当苯基重氮盐的邻位或对位连有硝基时,其偶合反应的活性事增强还是降低?为什么?解:偶合反应活性增强。
邻位或对位上有硝基使氮原子上正电荷增多,有利于偶合反应。
N N+N =N+N =N++OHN =NOH三、 试解释下面偶合反应为什么在不同PH 值得到不同产物?H 2NOH+C 6H 5N 2+PH=5H 2NOHN=NC 6H 5H 2NOHN=NC 6H 5解:PH 等于5时,氨基供电子能力强于羟基,偶合反应在氨基的邻位发生。
PH 等于9时,为弱碱性,羟基以萘氧负离子形式存在,氧负离子供电子能力大于氨基,偶合反应发生在羟基的邻位。
四、 完成下列反应式:CH 3N=NNaNO ,HClFe,HClN 2Cl2NO 2CH 3CH 3CH 31.2.OHOCH 3+CH 2N 23.CH 33(CH 3)3COKCH 3Cl Cl 4.CH 3CH 2CH 2C=C CH 2CH 2CH 3H H+CH 2..CH 2CH 2CH 3CH 2CH 2CH 3H五、 指出下列偶氮染料的重氮组分和偶连组分。
解: 重氮组分 偶连组分1.N=NHSO3N(CH 3)2HSO 3N 2+N(CH 3)22.N=N N=NOHN=NN 2+OH3.CH 3CONHN=NCH 3CH 3CONHN 2+HOCH 34.NaSO 3N=NHONaSO 3N 2+HO5.SO 3HNH 2N=NSO 3HN 2N=NNH 2SO 3HN 2++NH 2六、 完成下列合成:1.NO 2ClClClNO 2Cl ClNH 2NH 2N 2ClFe/HCl2ClClClNaNO 2,HClClCl ClH 3PO 2Cl2.CH 3CH 3Br BrCH 3CH 3CH3CH 33H 2SO 4NO 2NH 2NH 2Br[H]2Br BrCNCNNO 22NH 2NH 22CNCN[O]NaNO 2,HCl3.NHCOCH 3OHBrNHCOCH 3Br NHCOCH 3Br BrBrNH 2N 2HSO 4H 2O,H+NaNO H 2SO4OHBr4.5.CH 3CH 3NO 2CH 3CH 3CH 32NH 2NHCOCH 3[H]CH COClH 2SO 4CH 3NO 2CH 3NHCOCH 3NO 2CH 3H O,H +NH 2N 2ClNaNO 2NO 2CH 3NO 2H PO6.NH 2NO 2BrBrNH 2CH 3COClNHCOCH 33H 2SO 4NHCOCH 3NO 2NHCOCH 3NO 2BrBrNO 2BrBr H O,H +NH2NO 2BrBrNaNO2HClN 2ClNO 2BrBrH 3PO 27.NH 2BrCOOHBrNH 2NH 2NH2H 2SO 4SO 3H2BrBr NH2SO 3H H O,H +BrBrBrBrNaNO 2,HClN 2Cl KCN/CuCNBrBr BrBrCNCOOHH 2O,H +七、 以苯,甲苯,萘和小于或等于两个碳原子的有机化合物为原料合成下列化合物:1.(CH 3)2NN=N3H 2SO 4NO 2NH2N(CH 3)23NH 2HNON 2ClN(CH 3)2N 2Cl+(CH 3)2N N=N2.CH 3N=NH 2NNH 2CH 3HNO 3H 2SO 4NO 2CH 3CH3[H]NH 2CH3NaNO 2HClN 2Cl HNO 3H 2SO 4NO 2O 2NH 2NNH2[H]N 2ClCH 3N=NH 2NNH 23.CH 3N=N CH 3CH 3SO 3HCH3CH 3NaOHONaCH 3H 3O+CH 3HNO 3H 2SO 4CH 3CH 32NO 2+CH 3NO 2[H]CH 3CH 3NH 2N 2Cl2HClCH 3+CH 3N=NCH 3N=N4.HSO3OHNH 2H SO NH2SO 3H2SO 3HN 2Cl+H 2SO 4<65CSO OHSO 3HN 2Cl+N=NHSO 3OH5.(CH 3)2NN=N NO2NO 2NH 2NHCOCH 3NO 2NHCOCH 3NO 2NO2NH 2N 2Cl2(CH 3)2NN=NNO 2NH 22CH 3IN(CH 3)2N=NCH 3CH 3CH 3NO 22ZnNaOH/C 2H 5OHN=NCH 3CH 36.7.COONaN=N NaSO 3OH OH+CO 23OHCOONaN 2ClCOONaN=NNaSO 3OH 8.N=NCH 3HOCH 3OHCH 3+ClN 2CH 3N=NHO CH 3CH 3一、 八、 推测下列化合物的结构: 1,某芳烃分子式为C 6NO 2Fe,HClC H OHClOC 6H 3OHCl NO 2ClNO 22、某芳香性族化合物分子式为,,试根据下列反应确定其结构:C 6H 4NO 2CH 3NaNO 2,HClCuCN H 2O,H +4C O C O ONO 2CH 3NH 2CH 3CH 3CH 3CH 3Fe,HCl2N 2ClCN 2+COOH4COOH九、下列结构的偶氮染料,以氯化亚锡-盐酸溶液还原分解后,生成那些化合物?1.N=N(CH 3)2NSO 3H(CH 3)2N NH 2H 2N SO 3HSnCl ,HClN=NSnCl ,HClHSO 3NH 2SO 3H2.HSO 3NH 2NH 2SO 3HH 2N+N=N SnCl ,HClNH 2H 2N+3.CH 3OHCH 3OH十、某化合物以氯化亚锡盐酸还原可得对甲基苯胺和N,N -二甲基对苯二胺,试推测原化合物的结构,并以苯,甲苯及甲醇为原料合成之。
N=NCH 3N(CH 3)2CH 3CH 3CH 3CH 33H 2SO 4NO 2NH 2N 2ClHNO3H 2SO 4NO 2NH 2N(CH 3)2十一、某化合物以氯化亚锡盐酸还原得到间甲基苯胺和4-甲基-1,2-苯二胺,试推测原化合物的结构,并以甲苯为原料合成之。
H 2SO 43CH COCl[H]NHCOCH 3NH 22CH 3CH 3CH 3N=NCH NH 2CH 3NHCOCH 3CH 3NO 2H O,H +NaNO 2,HClH 3PO 2CH 3NO 2Fe,HCl CH 3NH 2NaNO 2,HClCH 3N 2ClCH 3NH 2N=NCH 3NH 2CH 3。
