气体摩尔体积2
高一化学气体摩尔体积(2)

表2.几种1mol气体在标准状况下的体积
(标准状况:温度为0℃,压强为101KPa) 密度 体积 物质 物质的量 摩尔质量 -1 -1 mol g•mol g•L L 名称
H2
1
2.016 0.0899 22.4
O2 CO2
1 1
32.00 44.01
1.429 22.4 1.977 22.3
练习:(1)在标准状况下: 现有 2mol CO2 (相对分子质量为44) 摩尔质量是 44g/mol, 质量是 88g , 气体摩尔体积是 22.4L/mol , 体积是 44.8L .
的影响
气体体积变大 气体体积变小
3)T一定、P一定 分子间距离一定
相同分子数目 的气体体积近 似相等
•不同气体在一定的温度和压强 下,分子之间的距离可以看作 是相等的
• 小结: • 相同的温度和压强下,相同
分子数的任何气体的体积都 近似相等。
在相同的分子。
56 27 207 18 98
7.8 7.2 2.7 10 11.3 18.3 1 18 1.83 53.6
[结论] 相同条件下,1摩尔不同固体 或液体物质的体积是 不相同 的。
思考并讨论: 为什么1mol不同的固态 液态物质体积大小会不一样呢? 物质 体积大小跟哪些因素有关呢?
总结:物质体积的大小取决于:
第二节 气体摩尔体积
表1. 1mol固、液体的体积( 20℃101KPa )
物质 名称 状 物质 1mol物质 摩尔质量 密度 体积 g•mol-1 g•cm-3 Cm3 态 的量 的质量
mol g
Fe Al Pb H 2O H2SO4
固 固 固 液 液
1 1 1 1 1
56 27 207 18 98
新教材课标版高中化学教师用书232第二课时气体摩尔体积

第二课时气体摩尔体积学习目标:1.了解气体摩尔体积的含义和应用。
2.能运用气体摩尔体积进行简单计算。
1.分别计算在一定条件下,1 mol不同物质的体积分析表中的数据,能得出结论:(1)相同条件下1_mol固体、液体的体积差别较大。
(2)相同条件下,1_mol气体的体积近似相等,在标准状况下约为_L。
2.气体摩尔体积(1)定义:单位物质的量的气体所占有的体积。
符号:V m,单位L·mol-1(或L/mol)。
(2)计算公式:V m=V n。
(3)影响气体摩尔体积的因素:气体摩尔体积的数值取决于气体所处的温度和压强。
(4)标准状况下(即0℃、101_kPa),气体摩尔体积约为_L·mol-1。
3.阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同数目的粒子。
1.判断正误(正确的打“√”,错误的打“×”)(1)标准状况下,1 mol任何物质的体积都约是22.4 L()(2)标准状况下,1 mol H2和N2的混合气体的体积约为22.4 L()(3)1 mol CO和1 mol O2所含分子数相同,体积也相同()(4)22.4 L N2含阿伏加德罗常数个氮分子()(5)同温同压下,同体积的NH3、SO2、CH4三种气体中,质量最大的是SO2()[答案](1)×(2)√(3)×(4)×(5)√2.下列说法正确的是()A.在标准状况下,1 mol水的体积是22.4 LB.1 mol氢气所占的体积一定是22.4 LC.标准状况下,×1023个Cu原子所占有的体积约是22.4 LD.标准状况下,28 g N2与CO的混合气体,体积为22.4 L[解析]A项中的水、C项中的Cu均不是气体,而气体摩尔体积只适用于气体;B项未指明温度、压强;D项中N2和CO的摩尔质量均为28 g·mol-1,则其体积V=n·V m=mM·V m=28 g28 g·mol-1×22.4L·mol-1=22.4 L,D正确。
《1_3_2 气体摩尔体积》讲义
第2课时气体摩尔体积[引入]在化学反应中经常遇到气体物质,对于气体物质来说,测量体积往往比称量质量更方便。
那么气体体积与物质的物质的量以及物质的质量之间有什么关系呢?我们应如何建立气体体积与其物质的量的桥梁呢?而这个桥梁这就是我们这一节课所需要解决的问题——气体摩尔体积。
[思考]物质的体积与微观粒子间是否存在着一些关系呢?也就是说体积与物质的量之间能否通过一个物理量建立起某种关系呢?让我们带着这个问题,亲自动手寻找一下答案。
一、影响物质体积大小的因素o5[科学探究]1.为什么1mol不同状态的物质体积不同;2.为什么1mol不同物质的气体体积近似相等,且比固、液物质体积大的多;3.影响物质体积的因素究竟是什么?1.影响物质体积大小的因素有三个:(1)物质所含微粒数多少;(2)微粒间的距离(固态、液态距离小,排列紧密;气态分子间排列疏松);(3)微粒本身的大小;[思考]影响固体或液体及气体体积的因素是什么?[板书]2.影响固体或液体的体积大小的主要因素:①粒子的数目②粒子的大3.影响气体体积大小的主要因素:①粒子的数目②粒子之间的距离[教师强调]1mol固体、液体的体积规律性不强。
无数实验事实证明,外界条件(温度、压强)相同时,物质的量相同的任何气体都含有相同的体积。
这给我们研究气体提供了很大的方便,为此,我们专门引出了气体摩尔体积的概念,这也是我们这节课所要学习的内容。
二、气体摩尔体积1、概念:一定温度、压强下,单位物质的量的气体所占有的体积叫作气体摩尔体积。
2、符号:Vm3、定义式:Vm=V(气体)/n(气体)4、单位:升/摩尔(L/mol或L·mol-1);米3/摩尔(m3/mol或m3·mol-1)。
5、在标准状况下(STP),对于任何气体,Vm约为22.4L/mol注:气体摩尔体积由温度、压强决定。
同温、同压下:任何气体的摩尔体积Vm 都相同,但不一定等于22.4 L·mol-1。
课件4:1.2.2 气体摩尔体积

练习二
填写下列空白: (1)标准状况下,0.5molH2,占有的体积约是 11.2L (2)标准状况下,4.48LCO2 的物质的量是 0.2mol (3)标准状况下,16gO2 的体积约是 11.2L
(4)标准状况下,11.2LN2 中含有的N2
的分子数是 3.01x1023
练习三
现有3.4 g H2S和3.2g O2哪个分子数较多? 相同条件下,哪个该用较大的容器装?
【练习3】
在标准状况下,1.6g 某气态氧化物 RO2 的体积为 0.56 L.试求:①该气体的物质的量和摩尔质量;②R的相对原子质 量,并说出其元素名称。
解:①在标况下,由 n = V / Vm 有 n = 0.56 L / 22.4 L/mol = 0.025 mol 而M = m / n = 1.6 g / 0.025 mol = 64 g/mol ② R 的摩尔质量为: X = M -2×16 g/mol = (64 – 32) g/mol = 32 g/mol R 的相对原子质量为32 所以 R 是硫元素
【练习4】
标准状况下CO和CO2的混和气体 5g 所占体积为 3. 36L。 求CO的质量、CO2的体积及混和气体的平均式量。
解:可设 CO 的物质的量为 x mol,CO2 的物质的量为 y mol, 则有:
(28 g/mol) x + (44 g/mol) y = 5 g …… ① ( x + y) × 22.4L/mol = 3.36L …… ② 由两个方程有:x = 0.1mol ,y = 0.05mol 所以:m(co) = nM = (0.1 × 28) = 2.8 g
3. 标准状况下,1molO2和N2混合气体的体积约 为22.4L。 (对,气体体积与分子种类无关)
第二章 第三节 第2课时 气体摩尔体积
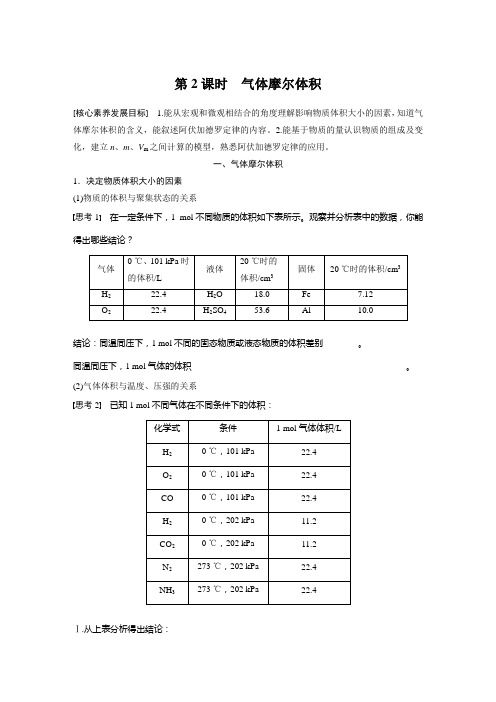
第2课时气体摩尔体积[核心素养发展目标] 1.能从宏观和微观相结合的角度理解影响物质体积大小的因素,知道气体摩尔体积的含义,能叙述阿伏加德罗定律的内容。
2.能基于物质的量认识物质的组成及变化,建立n、m、V m之间计算的模型,熟悉阿伏加德罗定律的应用。
一、气体摩尔体积1.决定物质体积大小的因素(1)物质的体积与聚集状态的关系思考1在一定条件下,1 mol不同物质的体积如下表所示。
观察并分析表中的数据,你能得出哪些结论?气体0 ℃、101 kPa时的体积/L液体20 ℃时的体积/cm3固体20 ℃时的体积/cm3H222.4 H2O 18.0 Fe 7.12O222.4 H2SO453.6 Al 10.0结论:同温同压下,1 mol不同的固态物质或液态物质的体积差别________。
同温同压下,1 mol气体的体积_________________________________________________。
(2)气体体积与温度、压强的关系思考2已知1 mol不同气体在不同条件下的体积:化学式条件 1 mol气体体积/LH20 ℃,101 kPa 22.4O20 ℃,101 kPa 22.4CO 0 ℃,101 kPa 22.4H20 ℃,202 kPa 11.2CO20 ℃,202 kPa 11.2N2273 ℃,202 kPa 22.4NH3273 ℃,202 kPa 22.4Ⅰ.从上表分析得出结论:①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积____(填“一定”“一定不”或“不一定”)相等。
Ⅱ.理论依据:相同温度和压强下,1 mol任何气体的体积几乎相等,原因是①_________________________________________________________________________,②________________________________________________________________________,③________________________________________________________________________。
第2课时 气体摩尔体积

3.相同温度和压强下,1 mol O2和1 mol空气的体积相同吗?为什 么?
[提示] 相同温度和压强下,1 mol O2和1 mol空气的体积相同,因 为当温度和压强相同时,任何气体粒子的粒子间距都近似相等,所以不
管1 mol单一气体还是混合气体的体积都近似相等。
1.在标准状况下相同体积的下列气体,其质量最大的是 ( B )
我们知道以下事实:①50个乒乓球与100个乒乓球分别紧密堆积, 后者体积大;②50个乒乓球与50个篮球分别紧密堆积,后者体积大;③ 50个乒乓球紧密堆积,50个乒乓球松散堆积,后者体积大。即构成物质 的微粒间的距离如图:
由上述内容分析,影响物质体积大小的因素有哪些?当构成物质的 粒子数目相同时,固体、液体、气体的体积分歧主要由什么决定?要想 了解以上的知识,那就赶快开始本课时的学习吧。
2.在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则: (1)混合气体的平均摩尔质量是_____3_0__g_·_m_o_l_-_1____。 (2)CO2和CO的体积之比是___1_∶__7__。 解析:(1)混合气体的物质的量=11.2 L/22.4 L·mol-1=0.5 mol,混合 气体平均摩尔质量=15 g/0.5 mol=30 g·mol-1;(2)设 CO 与 CO2 的物质 的量分别为 x、y,根据二者质量及物质的量,则:x+y=0.5 mol、28
[备选题]下列有关气体摩尔体积的描述中正确的是
( B)
A.相同条件下,气体物质的量越大,气体摩尔体积越大
B.通常状况下的气体摩尔体积大于22.4 L/mol
C.非标准状况下的气体摩尔体积不可能为22.4 L/mol
D.在标准状况下,混合气体的气体摩尔体积比22.4 L/mol大
高一化学气体摩尔体积 (2)

m(H2) 2.016g V( H 2 ) = = =22.4L p(H2) 0.089g/L 同样方法计算出: 1molO2的体积约为22.4L;1molCO2的 体积约为22.3L… (演示1) 结论: 在标准状况下, 1moL 的任何气体所占 2 2 的3 体 积 都 约 是 22.4L 。 单 位 为 L/moL 和 m /moL。 从哪几个方面理解这个概念? 标准状况、 1moL、 任何气体、 约是22.4L。
二、气体摩尔体积 1.气体容易压缩的原因
温度升高,气体分子之间的距离 ( 增加 ),气体体积( 增大 );温度降 低,气体分子之间的距离( 减小 ),气体 体积( 减小 ); 压强增大,气体分子之间的距离 ( 减小 ),气体体积( 减小 );压强减 小,气体分子之间的距离( 增加 ),气体 体积( 增大 ) 4.气体摩尔体积 0 *1) 标准状况下( 0 C 、 101kP )的气 体摩尔体积 标准状况下, 3 1molH2 的质量为 2.016g ,密度为0.089g/cm ,求体积?气体摩尔体积第一 Nhomakorabea时。
一、1摩尔固体、液体物质的体积 例:计算1molFe的体积 3 1molFe的质量为56g ,密度为7.8g/cm 56g m(Fe) V(Fe)= = 3 7.8g/cm p(Fe) 3 =7.2cm 同样方法计算出: 3 1molAI的体积为10cm ; 3 1molPb的体积为18.3cm ;
qtz42pts
好了,能帮咱们把地里家里今年的活计做完,已经是很够意思了,让他回家吧。只是啊,你这身子骨儿,我看一时半会儿的很难恢复成以 前那样了,可咱们尚武还太年轻„„”李长善说:“咱们就是再难,也不能再这样耽误耿兄弟了,他的心里已经够苦了„„”李妻轻轻地 叹一口气,说:“唉,那咱们就多给他带点儿银子,让他趁着秋后雨水稀少的季节回去吧!”李长善点点头说:“好,那我就抽空和他说 说这事吧!”李长善低落的情绪,耿老爹全都看在了眼里;而他的心事,耿老爹也猜得八九不离十。于是,还没有等到李长善先开口,耿 老爹就主动跟他提起了这事儿。那天晚饭后,尚英帮着娘洗刷完锅碟碗筷以后,就过义父这边来练习打算盘。此时,尚武已经爬在桌子上 开始写生字了。耿老爹吩咐尚英:“英子,你今儿个练练‘打百子’吧!”“好嘞!”看到尚英已经在按照练习规则打算盘了,耿老爹就 走出屋来。他想去和李长善夫妇好好谈一谈自己的打算,以消除这位善良大哥的后顾之忧。一出屋门,正好看到尚文扶着父亲小解了从茅 房出来,耿老爹走上前和尚文一起把李长善扶到屋里上床坐了,自己拉把椅子挨床边上也坐下,伸手轻轻给李长善揉着膝盖说:“李大哥, 咱今年多好的年景啊,应该高兴呢!你眼下身体有些不爽,可千万不要着急啊,有我和尚文呢,咱们什么事情也耽误不了!”李长善的眼 眶有些发热,声音里透着几分沙哑:“耿兄弟啊,你的心意大哥明白,看我现在这个样子,你是不放心走啊!可你现在已经完全康复了, 我,还有你嫂子和娃儿们不能再耽误你了!回家去吧,家里兄弟媳妇和小侄女还在等着你呢!”耿老爹亲切地看着李长善的眼睛坚定地摇 摇头,再抬头看看站在床边上憨厚善良的大义子尚文,落地有声地说:“李大哥,我会回老家去的,但不是现在!你只管放心养病,给我 们出谋划策就行!我已经决定了,四年之后再离开!到那时,我们的尚文就该是一个顶天立地的当家人了,你也可以不用再多操心„„” 李长善连连摆手,说:“不行,这绝对不可以„„”李妻也流着眼泪说:“耿兄弟,再耽误你四年„„这,这不可以啊„„”耿老爹却诚 恳地说:“大哥大嫂,不要再说了。这没有什么不可以的,我必须得看着李大哥完全好起来,或者尚文能够挑起咱家大梁的时候再走!” 听了义父的话,李尚文激动地流下了眼泪。他声音颤抖地说:“义父有能力有学识,我一定好好跟您学习,争取快快成长起来,好让您早 日回家与义母和小妹妹团聚„„”不幸被华老郎中言中了,李长善腰腿痛的老疾患非但没有能够再好转起来,反而越来越严重了。一年后, 这个还不到五十岁的李家顶梁柱竟然迈不开步,走不了路了。耿老爹就施展自己有限的木工手艺,精心为他制作了一个结结
学案1:1.2.2 气体摩尔体积

第2课时气体摩尔体积二、气体摩尔体积1.影响物质体积的因素{粒子数目粒子的大小粒子间的平均距离(1)决定固体或液体体积的主要因素{粒子数目粒子的大小(2)决定气体体积的主要因素{粒子的数目粒子间的平均距离{温度压强2.气体摩尔体积(1)定义:单位物质的量的物质所占的体积(2)符号:V m单位:L·mol-1、m3·mol-1(3)影响因素:温度、压强(4)标准状况数值:22.4 L·mol-1(5)物质的量(n)、气体摩尔体积(V m)、气体体积(V)的关系:V=n·V m3.阿伏加德罗定律(1)内容:同温、同压、同体积的任何气体含有相同数目的分子。
(2)适用范围:任何气体或混合气体(3)推论①同温、同压V1V2=n1n2②同温、同压ρ1ρ2=M1M2③同温、同体积p1p2=n1n2知识点一气体摩尔体积1.下列说法正确的是( )A.标准状况下,6.02×1023个分子所占的体积约是22.4 L B.0.5 mol H2所占的体积是11.2 LC.标准状况下,1 mol H2O的体积为22.4 LD.标准状况下,28 g CO与N2的混合气体的体积约为22.4 L知识点二阿伏加德罗定律及推论2.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )A.甲的分子数比乙的分子数多B.甲的物质的量比乙的物质的量少C.甲的摩尔体积比乙的摩尔体积小D.甲的相对分子质量比乙的相对分子质量小知识点三有关气体摩尔体积的计算3.在标准状况下有:①6.72 L CH4②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol氨气下列对这四种气体相关量的比较不正确的是( )A.体积:②>③>①>④B.密度:②>③>④>①C.质量:②>③>①>④D.氢原子数:①>④>③>②4.在标准状况下,H2和CO的混合气体7 L,质量为2.25 g,求H2和CO的体积分数。
人教版高中化学必修1-1.2《气体摩尔体积》参考课件2

36
4
32
1.8g
0.2g 1.6g
质量 H2 0.2g O2 1.6g
物质的量 0.1mol 0.05mol
H2和O2物质的量之比 2︰1
气体物质的量相等时体积也相等?
H2和O2物质的量之比 2︰1
H2和O2体积之比
2︰1
n(H2)
2
V(H2)
=
=
n(O2)
1
V(O2)
相同温度和压强下,1molH2和 1molO2的体积是 相等的 。
第2课时 气体摩尔体积
1.了解质量守恒定律的含义。 2.了解气体摩尔体积、阿伏加德罗定律的含义。 3.根据物质的量与微粒(原子、分子、离子等)数目、气 体体积(标准状况下)之间的相互关系进行有关计算。
涉及到气态物质时,测量体积往往比称量质量 更方便。所以,一般都是计量体积,而不是称 量质量。那么,气体体积与物质的量之间有什 么关系呢?
18.04 53.55
它们的体积都不相等啊 这究竟是什么原因呢?
下表是1mol下列物质在0°C、1.01×105Pa下的体积,仔 细分析,你有哪些启示?
物质 Fe Al H2O H2SO4 H2 O2 CO2
状态 固体 固体 液体 液体 气体 气体 气体
密度 7.8g/ml 2.7g/ml 1g/ml 1.83g/ml 0.0893g/L 1.429g/L 1.965g/L
一.气体摩尔体积 概念:单位物质的量气体所占的体积。
符号: Vm
公式: Vm=
V n
单位:L/mol(L·mol-1)和m3/mol。
标准状况下的气体摩尔体积约为22.4L/mol,这是特 定条件下的气体摩尔体积.
标准状况下的气体摩尔体积要点
化学计量考点二气体摩尔体积、阿伏加德罗定律

【要点解读】1.影响物质体积大小的因素(1)微粒的大小(物质的本性)(2)微粒间距的大小(由温度与压强共同决定)(3)微粒的数目(物质的量的大小)2.气体摩尔体积(1)含义:单位物质的量的气体所占的体积,符号为V m,标准状况下,V m约为22。
4_L·mol-1。
(2)相关计算①基本表达式:V m=错误!②与气体质量的关系:错误!=错误!③与气体分子数的关系:错误!=错误!(3)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强.3.阿伏加德罗定律及其推论应用(1)阿伏加德罗定律:同温同压下,相同体积的任何气体,含有相同数目的分子(或气体的物质的量相同).(2)阿伏加德罗定律的推论(可通过pV=nRT及n=错误!、ρ=错误!导出)【重难点指数】★★★【重难点考向一】气体摩尔体积的使用和计算【典型例题1】【2016年高考海南卷】利用太阳能分解制氢,若光解0。
02 mol水,下列说法正确的是()A.可生成H2的质量为0.02gB.可生成氢的原子数为2。
408×1023个C.可生成H2的体积为0.224L(标准情况)D.生成H2的量理论上等于0.04mol Na与水反应产生H2的量【答案】D考点:考查水的分解及简单方程式的计算【名师点睛】本类题的解题策略:(1)掌握基本概念,找出各化学量之间的关系;(2)加强与原子结构、元素化合物性质、有机物结构性质等相关知识的横向联系;(3)找出解题的突破口,在常规解法和计算技巧中灵活选用。
顺利解答该类题目的关键是:一方面要仔细审题,注意关键字词,熟悉常见的“陷阱";另一方面是要把各种量转化为物质的量,以此为中心进行计算。
【名师点睛】气体摩尔体积的解题思路错误!⇒错误!⇒错误!⇒错误!【重难点考向二】阿伏加德罗定律及推论的应用【典型例题2】下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )A.体积相等时密度相等B.原子数相等时具有的中子数相等C.体积相等时具有的电子数相等D.质量相等时具有的质子数相等【答案】C【解析】依据阿伏加德罗定律:在同温同压下的两种气体体积相同,分子数相同,而12C18O和14N2分子中所含电子数相同,C项正确;同温同压同体积条件下密度之比等于其摩尔质量之比,12C18O的摩尔质量为30 g·mol-1,14N2的摩尔质量为28g·mol-1,A项错误;1个12C18O分子中所含中子数为16,1个14N2分子中所含中子数为14,B项错误;12C18O和14N2分子中所含质子数相同,n=错误!,m相同、M不同,n不同,故等质量的两种气体所具有的质子数不同,D项错误.【名师点睛】(1)阿伏加德罗定律适用于任何气体(包括混合气体)。
第2课时 气体摩尔体积

返回目录
课前导学
要点突破
要点二:阿伏加德罗定律及其推论 1.阿伏加德罗定律 同温同压下,相同体积的任何气体都含有相同数目的分子。
2.阿伏加德罗定律的推论
相同条件 结论 公式 语言叙述 同温、同压下,气体的体积 与物质的量成正比
T、p 相同
n1 V1 = n2 V2
T、V 相同
p1 n1 = p 2 n2 p1 V2 = p 2 V1
温度、体积相同的气体,压 强与物质的量成正比
物质的量相等、温度相同的 气体,其压强与体积成反比
n、T 相同
返回目录
课前导学
要点突破
T、p 相同 T 、 p、V 相 同
1 M 1 = 2 M2
M1 M2 m = 1 m2
同温、同压下,气体的密度 与其摩尔质量(或是相对分 子质量,下同)成正比 同温、同压下、体积相同的 气体,其摩尔质量与其质量 成正比
特别提示:(1)阿伏加德罗定律的适用条件不仅仅是标准状况,也可以是其他温度 和压强条件下,只要物质的存在状态是气态即可。 (2)阿伏加德罗定律的推论不必死记公式,可通过阿伏加德罗定律或公式pV=nRT进 行推导,在理解基础上记忆。
返回目录
课前导学
要点突破
【例2】 (2010年重庆一中高一期末考试)同温、同压下,等体积的NH3和CH4两种气 体,下列有关说法错误的是( ) A.所含分子数目相同 B.所含氢原子物质的量之比为3∶4 C.质量之比为16∶17 D.密度之比为17∶16 解析:
返回目录
课前导学
要点突破
【问题探究2】 气体摩尔体积适用范围是气体,是否必须为纯净气体? 答案:气体摩尔体积的适用范围是气体,可以是单一气体,也可为混合气体,如标准状 况下0.2 mol H2和0.8 mol O2的混合气体约为22.4 L,但要特别注意以混合气体中气体之 间不发生化学反应为前提。
专题1 物质的分类及计量 第2单元 第2课时 气体摩尔体积

第2课时气体摩尔体积发展目标体系构建1.知道气体摩尔体积的概念,能够利用物质的量、气体摩尔体积、标准状况下气体的体积三者之间的关系,进行简单的计算。
2.了解阿伏加德罗定律及其推论,并能够运用阿伏加德罗定律解决简单问题。
一、影响物质体积大小的因素在相同条件下,微粒数相同的不同固态物质或液态物质的体积是否相同?[提示]不相同。
因为固态物质、液态物质体积主要受微粒的数目和微粒本身的大小不同影响,而不同的固态物质、液态物质的微粒大小各不相同。
二、气体摩尔体积气体摩尔体积适用范围是气体,是否必须为纯净气体?[提示]不是。
气体摩尔体积的适用范围是气体,可以是单一气体,也可为混合气体,如标准状况下0.2 mol H2和0.8 mol O2的混合气体约为22.4 L,但要特别注意以混合气体中气体之间不发生化学反应为前提。
[知识延伸] 阿伏加德罗定律1.内容:同温同压下相同体积的任何气体都含有相同数目的微粒。
2.适用范围:阿伏加德罗定律及其推论仅仅适用于气体,可以是单一气体,也可以是混合气体,对固体和液体不适用。
3.“三同定一同”规律:同温、同压、同体积、同分子数中只要有“三同”则必有第“四同”。
相同体积的两个容器,一个盛放氧气,一个盛放氢气,在同温、同压下,两容器中气体分子的数目有何关系?[提示]相同。
在同温、同压下,同体积的不同气体具有相同的微粒数。
1.判断正误(正确的打“√”,错误的打“×”。
)(1)在相同条件下,1 mol任何物质的体积均相同。
(×)(2)当温度和压强一定时,1 mol气体的体积均为22.4 L。
(×)(3)标准状况下,1 mol任何物质的体积都约为22.4 L。
(×)(4)当温度和压强一定时,相同物质的量的气体的体积相同。
(√)2.设N A 表示阿伏加德罗常数的值,下列叙述中正确的是( ) A .常温常压下,11.2 L CO 2所含的原子数为1.5N A B .常温常压下,48 g O 3含有的氧原子数为3N A C .标准状况下,22.4 L H 2O 所含分子数为N A D .标准状况下,22.4 L H 2所含原子数为N AB [常温常压(非标准状况)下,11.2 L CO 2的物质的量不是0.5 mol ,所含原子数不是1.5N A ;48 g O 3的物质的量为1 mol ,所含氧原子数为3N A ;标准状况下,H 2O 为液态,不能应用气体摩尔体积计算其物质的量;标准状况下,22.4 L H 2的物质的量为1 mol ,所含氢原子数为2N A 。
气体摩尔体积第二课时教案实用

气体摩尔体积第二课时教案实用一、教学目标1.理解气体摩尔体积的概念。
2.掌握气体摩尔体积的计算方法和应用。
3.能够运用气体摩尔体积的概念解决实际问题。
二、教学重点与难点1.教学重点:气体摩尔体积的概念、计算方法和应用。
2.教学难点:气体摩尔体积的计算方法和应用。
三、教学准备1.教材:《化学》选修4第三章第二节。
2.教学工具:PPT、黑板、粉笔。
四、教学过程1.导入新课通过提问方式引导学生回顾上节课所学的气体摩尔体积的概念,为新课的学习做好铺垫。
2.讲解气体摩尔体积的概念(1)介绍气体摩尔体积的定义:单位物质的量的气体所占的体积。
(2)讲解气体摩尔体积的单位:L/mol。
3.讲解气体摩尔体积的计算方法(1)根据理想气体状态方程PV=nRT,推导出气体摩尔体积的计算公式:V=nRT/P。
(2)讲解气体摩尔体积的计算公式中各物理量的含义及单位。
4.讲解气体摩尔体积的应用(1)计算气体的物质的量。
(2)计算气体的质量。
(3)计算气体的体积。
5.例题讲解(1)讲解例题1:已知某气体的压强为 1.01×10^5Pa,温度为273K,求该气体的摩尔体积。
解:根据气体摩尔体积的计算公式V=nRT/P,代入已知数据,计算得到V=22.4L/mol。
(2)讲解例题2:已知某气体的摩尔体积为22.4L/mol,压强为1.01×10^5Pa,求该气体的温度。
解:根据气体摩尔体积的计算公式V=nRT/P,代入已知数据,计算得到T=273K。
6.练习与讨论(1)让学生独立完成课后练习题,巩固所学知识。
(2)组织学生进行小组讨论,分享解题思路和经验。
(2)引导学生思考如何运用气体摩尔体积的概念解决实际问题。
五、课后作业1.完成课后练习题。
2.收集有关气体摩尔体积的实际应用案例,下节课分享。
六、教学反思1.本节课通过讲解气体摩尔体积的概念、计算方法和应用,使学生掌握了相关知识。
2.通过例题讲解和练习,提高了学生的解题能力。
气体摩尔体积2(hcf)

液体物质
固体物质
相同条件下,当分子数目一定时,固、 液物质的体积主要取决于分子本身的大小。
气体分子间距离很大
2 3 4 5 6 7 8 9 10
气体分子间的平均距离是分子直径的10 倍左右,因此分子本身的大小可忽略不计。
相同条件下,分子数目一定时, 其体积取决于分子间的距离。
(3)现有篮球20个,平均分为两组,每组十个。第 一组球与球之间间隔5米,第二组球与球之间的间隔 为10米,哪组占的空间大? 与球间的平均距离有关 物体体积的大小取决于: (1)微粒数目 (2)微粒大小 (3)微粒的平均间距
阅读课本P14思考:
1.当粒子数一定时,固、液、气态物质的体积 主要取决于什么因素?
推论二:
同温同压下,任何气体密度之比 相对分子质量之比 =
即: (T,P相同)
练一练
1.同温同压下列气体,密度与其它三者不同的是 D (A)N2 (B)C2H4 (C)CO (D)H2S
反馈练习:
1、在标准状况下,22.4LCO和17gNH3的体 积之比为 1:1 ,所含分子数之比为 1:1 所含原子数之比为 1:2
科学探究
1.(1)观察不同时间管内气体体积的变化, 生成 O2和H2的体积比各约是多少? 体积比为1:2
电 解 水 的 实 验
(2)假设电解了1.8gH2O,根据电解水的方程式计 算生成的O2、H2的质量。根据O2、H2的摩尔质量,计 算物质的量,并通过下表进行比较。
质量 H2 O2 0.2g 物质的量 0.1mol 2:1 H2和O2的物质的量之比
= 64 g / mol
0 . 03 mol
反馈练习:
5、下列说法正确的是(D)
人教版化学必修一1.2化学计量在实验中的应用---气体摩尔体积_2

[自我测评]————(做一做)
判断正误
4L氧气的分子数大于11.
C2、.1体m(积o1l比气)固为体1的:1体体积没都约有为22摩. 尔体积的概念,只有气体才有摩尔体积的概念。
(3)气体摩尔体积只针对气体而言,可以是
( × ) 1、定律:在___________________下,__________________的任何气体都含有____________的分子,这积
分子数
栏目 导引
1.(双选)两个体积相同的容器,一个盛有 NO,另一个盛有 N2
和 O2,在同温、同压下,两容器内的气体一定具有相同的(AC )
A.原子总数
B.质子总数
C.分子总数
D.质量
栏目 导引
阿伏加德罗定律的推论 1.同温、同压→气体的体积与物质的量成正比→V1=n1;
V2 n2 2.同温、同压→气体的密度与摩尔质量成正比→ρρ21=MM12; 3.同温、同体积→气体的压强与其物质的量成正比→pp12=nn12;
(4)22.4 L 的气体只要不在标准状况下就不是 22.4 L。( × )
栏目 导引
1.下列叙述中,正确的是( A ) A.在标准状况下某气体的体积是 22.4 L,则可认为该气体的 物质的量约是 1 mol B.常压下,在 20 ℃时,1 mol 的任何气体的体积可能比 22.4 L 小 C.1 mol H2 和 O2 的混合气体,在标准状况下的体积是 44.8 L D.1 mol H2 的质量只是在标准状况下才约为 2 g
2.在标况下 1) 16克氧气的体积是多少? 2) 44.8L氮气中含有的分子数是多少?
3.同温同压下,质量相同的N2、CO2、Cl2、CH4、O 2 五种气体所占的体积由大到小的顺序是
气体摩尔体积(2)新人教版必修1

练习、在同温、同压下,相同体积的
下列气体,质量最大的是:
A. H2 推论2 B. O2 C. Cl2 D. SO2
同温,同压,同体积: M1 m
m2
1 ==
M2
练习. 标准状况下,13g某气体 的分子数与14g一氧化碳分子数
相等,则该气体的密度为( A. 11.6g/L C. 12.5g/L
B
)
B. 1.16g/L D. 1.25g/L
练习 有一真空储气瓶,净重500g,在 相同条件下装满 O2 后重508 g,装满 另一种气体A时重511 g ,求A的相对
分子质量。
M=44 32
同温,同压,同体积: M1 508g-500g m
m2
1 ==
M2
511g-500g
==
M
14、同温、同压下,某贮气瓶在空气 中称重为179 g,当充满后称得质量为 152 g,充满X3气体时质量为198 g,
CH4+ 2O2=CO2 +2 H2O(气)
常温度CO与O2在密闭容器恰好反应恢复到原 温度,反应前后容器内压强之比( 3:2 )
1 2 1 2 1mol 2mol 1mol 2mol :
2CO+ O2=2CO2
2 1 2 2mol 1mol 2mol
阿伏加德罗定律推论 同温同压下,任何气体
V1
V2
推论4
同温,同压,同质量:
ρ2 n1 M2 V1 N1 == == == == M1 n2 ρ1 V2 N2
4、在相同温度下,相同质量的下列气体分别 A. HF
推论5
通入相同容积的容器中,容器内压强最小的是:
B. Ar
C. SO2
高中化学——气体摩尔体积2

③混合气体的平均式量 — M=M1×a%+M2×b%+M3×c%+… 式中: 为气体的分子量, 式中:M1、M2、M3为气体的分子量, a%、b%、c%为气体在混合气体中 、 、 为气体在混合气体中 所占的体积百分比 所占的体积百分比 或者 物质的量百 分比。 分比。
【例题】 例题】 假设空气由体积百分数为80%的N2和体 假设空气由体积百分数为 的 积百分数为20%的O2组成,求空气的平 积百分数为 的 组成, 均式量是多少? 均式量是多少? — 解:M= 80%×28+ 20%×32=28.8 ≈29 × × 空气的平均式量是29. 答:空气的平均式量是
②同温同体积下:
p1 N1 n1 = = p 2 N 2 n2
③同温同压下: ρ1 M 1 = ρ2 M 2 同温同压 同体积 ④同温同压+同体积下:
m1 M 1 = m2 M 2
练习
同温同压下,相同体积的 同温同压下,相同体积的CO2和O2,它 们的分子数之比为 ︰1,原子数之比为 1︰ 3︰2 ,质量之比为11︰8 ,物质的量之 ︰ ︰ 比为1︰1 ,氧原子数之比为 1︰1 ,密 ︰ ︰ ︰ ︰ 度之比为11︰同压
3H2 +
N2 : 1 : 1 : 1
== 2NH3 : : : 2 2 2
方程式系数之比: 方程式系数之比:3 微粒数之比: 3 微粒数之比: 物质的量之比: 物质的量之比: 3
方程式系数之比= 方程式系数之比= 物质的量之比 =微粒数之比 =气体的体积之比
二、有关气体摩尔体积的计算
【例题】 例题】 同温同压下, 同温同压下,某种气体对空气的相对密 度为1.52,求该气体的分子量。(空气 。(空气 度为 ,求该气体的分子量。( 的平均相对分子质量为29) 的平均相对分子质量为 ) Mx=D×M空气 = 1.52×29=44.08(g/mol) × × ( 【思考】 思考】 实验室制取CO2、NH3时如何收集?依据 时如何收集? 实验室制取 是什么? 是什么?
气体的摩尔体积2

m (CO2) = (0. 25 mol)(44g/mol) = 11 g
1个CO2 分子的质量 = (44g)/(6.02)(1023) = (7.31)(10-23)g 答:(略)
[练习 2] 标准状况下,11. 2L CO2 所含分子数
与多少克 NH3 中所含氢原子数相等。 解: 设 氨的质量为 x CO2 11. 2L = 22.4L/mol NH3 (x)(3) 17g/mol
气体质量 气体体积 / 气体摩尔体积 ( 气体密度 ) ( 气体摩尔体积 )
=
=
[例 3] 在标准状况时, 0. 2 L的容器里所含一氧化
碳的质量为 0. 25g , 计算一氧化碳的式量。
解: 一氧化碳的摩尔质量
= 一氧化碳的密度 一氧化碳的摩尔体积 0.25g 22. 4 L/mol = 0.2L = 28g /mol 答:一氧化碳的的式量为 28。
0. 1mol
H2 22. 4L
x
CuO
80g y x = 2. 24L y = 8g
1mol : 0.1mol = 22. 4L : x 1mol : 0.1mol = 80g : y
答:产生 H2 2.24L,最多能还原 CuO 8g。
对在标准状况的气体来说
气体摩尔质量 =
气体质量 气体物质的量
思路:一氧化碳摩尔质量的数值等于它的式量。
[ 练习 4 ] 在标准状况时, 2. 24 L NOx 气体的质
量为 4.6g , 求气体的化学式。
解:
M ( NOx ) = 4. 6g 2.24L = 46g /mol 22. 4 L/mol
NOx 的分子量为 46 14 + 16x = 46 x=2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.已知某气体混合物的密度是相同条件下H2密度的14倍
,则该气体可能是(
)
A.N2、CO B.C2H4、O2 C.H2、O2 D.Cl2、HCl
E.CH4、C2H2、C3H6
F. H2、C2H4、Cl2
练习:如图所示,一密闭汽缸被一不漏气可滑动的活塞
隔开,左边充满N2,右边充有H2、O2,在室温下将右边 气体引燃,完全反应冷却至室温,活塞终止于汽缸的中
3、有一空瓶,抽成真空时质量为276.802 g,充满H2时 质量为277.204 g,相同条件下当充满某种气体时质量为
285.244 g,求此气体的相对分子质量。
4、同温同压下,a g 气体X和 b g气体Y含有相同的分 子数,下列说法不正确的是( )
A、X与Y的摩尔质量之比为a:b B、X与Y的密度之比为a:b C、相同质量的X和Y,分子数之比为a:b D、相同质量的X和Y在同温同压下的体积比为a:b
2.根据密度计算:
思考:标准状况下,CO和CO2的混合气体质量为12.8 g,体
积是8.96 L,求:CO和CO2的体积和质量各是多少?
练习1.某种氢气和CO的混合气体,其密度是氧气的一半,则 氢气的体积百分含量约为多少?
2.某CH4和O2的混合气体在标准状况下密度为1g/L,求: 混合气体中CH4和O2的分子数之比。
5、
平均摩尔质量:
补充:对于混合物,尤其混合气体,其平均摩尔质量
相当于将混合物看做一个“单一组分”,则:
其它计算方法: 1.根据混合物中各组分在混合物中所占的比例多少(物 质的量的分数或气体的体积分数)来衡量它们对相对分 子质量的贡献来计算:
设某混合物组分A、B、C……,对应的相对分子质量为MA、 MB、MC……,在混合物中所占的物质的量的分数分别为xA、 xB、xC……,则其平均相对分子质量为:
比为17:14。若气体是CO,则甲气体可能是( )
A.H2S
B.HCl
C.NH3
D.Cl2
2、在一个体积固定的容器中盛有32g SO2气体,压强 为2×105Pa。如果在相同温度下,把更多的SO2气体 充入该容器,是容器内压强增至10×105Pa,这时容器
内SO2气体的分子数为(
)
A. 2.5 NA B. 3.0 NA C. 3.5 NA D. 4.0 NA
点(水的体积忽略不计),则反应前后容器内的压强比
为_____,原来的H2、O2的体积比为_________ ,原混合 气体是相同条件下氢气密度的______倍。
N2
H2、O2
01 23 4
N2 01
余气 23 4
二、阿伏伽德罗定律 (气体定律)
同T、p、V n(或N)同 (四同)
推论:①同T、p,
②同T、V:
③同T、n:
④同T、p:(相对密度)D= ⑤同T、p、m:
理想气体状态方程: pV=nRT
p:压强 V:体积 n:物质的量 R:摩尔气体常数
T:温度
练习1、在同温同压下,相同体积的甲、乙两气体质量之
