高中化学选修分子的立体构型精选课件PPT
合集下载
人教化学选修3第二章第二节分子的立体构型(共23张PPT)
• (3)分工合作:操作员、声控员、记录
员、计时员、发言员
• 时间:5分钟 • 约定:“ 蓝矾苦矾,蓝色晶体”停止实
验,倒数五个数,归位并且安静。
实验探究2:CuSO4+NH3·H2O
化学
天蓝色 溶液
蓝色 沉淀
深蓝色 溶液
Cu 2+ +2NH3 . H2O
Cu(OH)2 + 4NH3 . H2O
蓝色沉淀
探究2 除实水验外探究,[是2—否2]有(其取实他验电[2子-1给]所予得硫体酸?铜溶
液1/3实验)根据现象分析溶液成分的变化并说 明你的推断依据,记录现象和写出相关的离子 方程式,找出配位键,配体?
• 任务: • (1)7人小组合作完成实验 • (2)将实验现象记录于小卡上,顺时针
交流,实验报告,实验最快小组把结果写 在大板卡上。
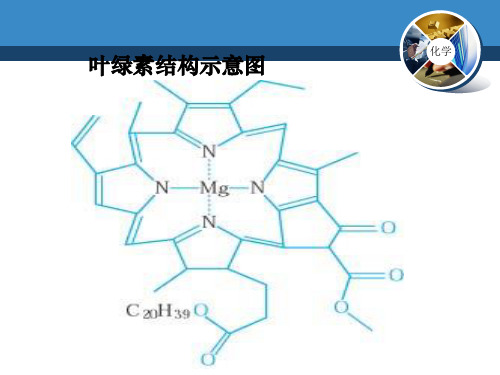
叶绿素结构示意图
化学
高二选修3 物质结构与性质
第二章第二节 分子的立体构型 ——配合物理论简介
化学
授课人:杨远贞
目标 化学
什么是配位键?
配位键属于 哪一类化学键?
探究1 为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
实验探究[2—1] 向盛有固体样品的试管中,分别加1/3试管
水溶解固体,观察实验现象并填写下表
固体
C白uS色O4
Cu绿Cl色2•2H2O
深Cu褐Br色2
NaCl
白色
K白2S色O4
KBr
白色
溶液
颜色
无色离子:
什么离子
呈天蓝色:
探究1 为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
• 任务: • (1)7人小组合作完成实验 • (2)将实验现象以表格的形式记录于小
员、计时员、发言员
• 时间:5分钟 • 约定:“ 蓝矾苦矾,蓝色晶体”停止实
验,倒数五个数,归位并且安静。
实验探究2:CuSO4+NH3·H2O
化学
天蓝色 溶液
蓝色 沉淀
深蓝色 溶液
Cu 2+ +2NH3 . H2O
Cu(OH)2 + 4NH3 . H2O
蓝色沉淀
探究2 除实水验外探究,[是2—否2]有(其取实他验电[2子-1给]所予得硫体酸?铜溶
液1/3实验)根据现象分析溶液成分的变化并说 明你的推断依据,记录现象和写出相关的离子 方程式,找出配位键,配体?
• 任务: • (1)7人小组合作完成实验 • (2)将实验现象记录于小卡上,顺时针
交流,实验报告,实验最快小组把结果写 在大板卡上。
叶绿素结构示意图
化学
高二选修3 物质结构与性质
第二章第二节 分子的立体构型 ——配合物理论简介
化学
授课人:杨远贞
目标 化学
什么是配位键?
配位键属于 哪一类化学键?
探究1 为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
实验探究[2—1] 向盛有固体样品的试管中,分别加1/3试管
水溶解固体,观察实验现象并填写下表
固体
C白uS色O4
Cu绿Cl色2•2H2O
深Cu褐Br色2
NaCl
白色
K白2S色O4
KBr
白色
溶液
颜色
无色离子:
什么离子
呈天蓝色:
探究1 为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
• 任务: • (1)7人小组合作完成实验 • (2)将实验现象以表格的形式记录于小
人教版高中化学选修三第二章第二节分子的立体结构 课件(共19张PPT)

分子的立体构型 ---杂化轨道理论
思考
↑↓
↑↓
1s 2s
↑↑
2p
根据碳原子的核外电子排布图,思考为什么碳原子与
氢原子结合形成CH4,而不是CH2 ?
↑↓碳原子的一个2S电子受外界影响跃迁到2P空轨道 上,使碳原子具有四个单电子,因此碳原子与氢原子 结合生成CH4。
思考
如果C原子就以1个2S轨道和3个2P轨道上的单电子,
D.H2O
B ❖ 2.下列分子中的中心原子杂化轨道的类型相同的是( )
❖ A.CO2与SO2
B.CH4与NH3
❖ C.BeCl2与BF3
D.C2H2与C2H4
❖ 3.ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与 O原子成键的,试推测下列微粒的立体结构
直线形
V形 三角锥形 正四面体
强调:杂化前后轨道数目不变。即杂化轨道数=参与杂化的轨道数目 如:1个s,1个p形成2个完全相同的sp杂化轨道,
1个s,2个p形成3个完全相同的sp2杂化轨道, 1个s,3个p形成4个完全相同的sp3杂化轨道, 杂化后轨道伸展方向、形状发生改变。
2说明:
(1)只有能量相近的原子轨道才能杂化。 (2)杂化轨道数目和参与杂化的原子轨道数目相等,杂 化轨道能量相同。
例题
❖ 例:有关乙炔分子中的化学键描述不正确的是( )
❖ A.两个碳原子采用sp杂化方式
B
❖ B.两个碳原子采用sp2杂化方式
❖ C.每个碳原子都有两个未杂化的2p轨道形成π键
❖ D.两个碳原子形成两个π键
返回
C ❖ 1.下列分子中心原子是sp2杂化的是 ( )
❖ A.PBr3
B.CH4
C.BF3
思考
↑↓
↑↓
1s 2s
↑↑
2p
根据碳原子的核外电子排布图,思考为什么碳原子与
氢原子结合形成CH4,而不是CH2 ?
↑↓碳原子的一个2S电子受外界影响跃迁到2P空轨道 上,使碳原子具有四个单电子,因此碳原子与氢原子 结合生成CH4。
思考
如果C原子就以1个2S轨道和3个2P轨道上的单电子,
D.H2O
B ❖ 2.下列分子中的中心原子杂化轨道的类型相同的是( )
❖ A.CO2与SO2
B.CH4与NH3
❖ C.BeCl2与BF3
D.C2H2与C2H4
❖ 3.ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与 O原子成键的,试推测下列微粒的立体结构
直线形
V形 三角锥形 正四面体
强调:杂化前后轨道数目不变。即杂化轨道数=参与杂化的轨道数目 如:1个s,1个p形成2个完全相同的sp杂化轨道,
1个s,2个p形成3个完全相同的sp2杂化轨道, 1个s,3个p形成4个完全相同的sp3杂化轨道, 杂化后轨道伸展方向、形状发生改变。
2说明:
(1)只有能量相近的原子轨道才能杂化。 (2)杂化轨道数目和参与杂化的原子轨道数目相等,杂 化轨道能量相同。
例题
❖ 例:有关乙炔分子中的化学键描述不正确的是( )
❖ A.两个碳原子采用sp杂化方式
B
❖ B.两个碳原子采用sp2杂化方式
❖ C.每个碳原子都有两个未杂化的2p轨道形成π键
❖ D.两个碳原子形成两个π键
返回
C ❖ 1.下列分子中心原子是sp2杂化的是 ( )
❖ A.PBr3
B.CH4
C.BF3
《分子的立体构型》完整ppt课件

SP
直线形
CH2O
0
CH4 0
SO2
1
NH3
1
0+3=3 0+4=4 1+2=3 1+3=4
SP2
平面三角形
SP3
正四面体形
SP2
V形
碳的sp2杂化轨道 .
三、杂化轨道理论简介 ②sp2杂化 C2H4
.
三、杂化轨道理论简介
③sp杂化
sp杂化:夹角为180°的直线形杂化轨道。
.
三、杂化轨道理论简介 乙炔的成键
.
三、杂化轨道理论简介
③sp杂化 大π 键
C6H6
.
.
基态N的最外层电子构型为 2s22p3,在H影响下, N 的一个2s轨道和三个2p 轨道进行sp3 不等性杂化, 形成四个sp3 杂化轨道。其中三个sp3杂化轨道中各 有一个未成对电子,另一个sp3 杂化轨道被孤对电 子所占据。 N 用三个各含一个未成对电子的sp3 杂 化轨道分别与三个H 的1s 轨道重叠,形成三个 N―H键。由于孤对电子的电子云密集在N 的周围, 对三个N―H键的电子云有比较大的排斥作用,使 N―H键之间的键角被压缩到 107 o18',因此NH3 的空 间构型为三角锥形。 .
0
H
H
..
H2O H O. . H
O HH
2
2
.. ..
.. ..
..
NH3 H N. . H H N H
3
1
H
H
.
立体结构
应用反馈:
0 1 2
0
1 0
0
0
PO43-
0
2 2 2
3 3
人教版化学《分子的立体构型》完美课件

迁移:两个原子构成的分子,将这2个原子看成两个点,则 它们在空间上可能构成几种形状?分别是什么?
O2
HCl
活动:
2、利用几何知识分析一下,空间分布的三个点是否一 定在同一直线上? 迁移:三个原子构成的分子,将这3个原子看成三个点, 则它们在空间上可能构成几种形状?分别是什么?
在多原子构成的分子中,由于原子间排列的空间 位置不一样,使得分子有不同的结构,这就是所 谓的分子的立体构型。
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)
早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进 行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪 器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立 体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外 线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红 外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各 吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息, 可分析出分子的立体结构。
一、形形色色的分子
1、三原子分子立体结构
CO2
直线形
180°
H2O
V形 105°
2、四原子分子立体结构
HCHO
平面三角形 120°
NH3
三角锥形 107°
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
3、五原子分子立体结构
正四面体
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
O2
HCl
活动:
2、利用几何知识分析一下,空间分布的三个点是否一 定在同一直线上? 迁移:三个原子构成的分子,将这3个原子看成三个点, 则它们在空间上可能构成几种形状?分别是什么?
在多原子构成的分子中,由于原子间排列的空间 位置不一样,使得分子有不同的结构,这就是所 谓的分子的立体构型。
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)
早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进 行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪 器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立 体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外 线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红 外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各 吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息, 可分析出分子的立体结构。
一、形形色色的分子
1、三原子分子立体结构
CO2
直线形
180°
H2O
V形 105°
2、四原子分子立体结构
HCHO
平面三角形 120°
NH3
三角锥形 107°
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
3、五原子分子立体结构
正四面体
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
人教版化学《分子的立体构型》课件完美版

人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
同为三原子分子,CO2 和 H2O 分子的空间结构却不 同,什么原因?分析中心原子的价电子是否全部参加成 键?
同为四原子分子,CH2O与 NH3 分子的的空间结构 也不同,什么原因?
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
物
原子数
对
子对 子对数
: : :: : : : :
H2O H :O : H
2
2
2
4
NH3 H :N :H
3
HH
CH4 H :C :H
4
H
CO2 :O::C::O: 2
3
14
4
0
4
2
0
2
价层电子对数 =δ键个数+中心原子上的孤对电子对个数
δ键电子对数 = 与中心原子结合的原子数
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
孤电子对的计算
=½ (a-xb)
分子或 中心原 a
x
b
离子 子
H2O
O
6
2
1
SO2
S
6
2
2
NH4+
N
5-1=4
4
1
CO32- C
4+2=6 3
2
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
中心原子 上的孤电 子对数
高中化学:分子的立体结构1精品PPT课件

1.CO2
激发
提示:C:1S22S 2P
C:1S22S 2P
σσ
OCO
O: 1S22S 2P
ππ C原子发生SP杂化生成了两个SP轨道分别与两个O原子 的一个P轨道形成两个σ键; C原子剩余的两个P轨道分 别与两个O原子剩余的1个P轨道形成两个π键。
2 .H2O
2021/2/21
O原子发生SP3杂化生成了四个SP3杂化轨道,其 中的两个分别与两个H原子的S轨道形成两个σ键; O原子剩余的两个SP3杂化轨道分别被两对孤对电 子占据。 该课件由【语文公社】友情提供
V形 三角锥形
★价层电子对互斥模型(VSEPR模型)是一种可以用来预 测分子立体结构的理论模型,总的原则是分子的中心原 子上孤对电子对与成键电子对之间的排斥力最小(注意: 分子中的双键、叁键等多重键要作为一对电子看待)。
这种理论把分子分为两类:一类是中心原子上的价电子 都用于形成共价键,这种分子中,中心原子周围的原子 数决定着分子的立体结构。 如HCN的空间结构为直线形; 另一类是中心原子上有孤对电子(未用于形成共价键的电 子)的分子,由于中心原子上的孤对电子也要占据中心原 子周围的空间,并参与互相排斥。所以H2O的空间结构 为V形。
示为[Cu(H2O) 4]2+。在四水合铜离子中,铜离子与水分子之 间的化学键是由水分子中的O原子提供孤对电子对给予铜离
子(铜离子提供空轨道),铜离子接受水分子的孤对电子形
成的,这类“电子对给予—接受键”被称为配位键。 H2O
2+
H2O Cu OH2
2021/2/21
该课件由【语文公社】友情提供
H2O
2
0
直线形
CH2O
H
H. . C
人教版高二化学上册选修三分子的立体构型PPT课件

S6
2
N 5-1=4 4
C 4+2=6 3
b 中心原子上 价层电 的孤电子对 子对
2
1
3
1
0
4
2
0
3
人教版 高二化学(上册)选修三 第二章 2.2分子的立体构型
人教版 高二化学(上册)选修三 第二章 2.2分子的立体构型
确定VSEPR构型
价层电子 对数目
2
3
4
价层电子 对构型
直 线
平面 三角型
四面体
培养学生严谨认真的科学态度和空间想象能力, 并提高用数学的思想解决化学问题的能力。 【重点难点】
利用价层电子对互斥模型预测分子的立体结构
形形色色的分子
P4
C60
分子世界如此形形色色,异彩纷呈,美不胜收, 常使人流连忘返。那么分子结构又是怎么测定的呢
?
复习导入 引入新课
人教版 高二化学(上册)选修三 第二章 2.2分子的立体构型
2、价层电子对互斥模型把分子分成两类: (1)含有孤对电子 (2)不含孤对电子
人教版 高二化学(上册)选修三 第二章 2.2分子的立体构型
人教版 高二化学(上册)选修三 第二章 2.2分子的立体构型
2、VSEPR模型:
电子对相互排斥,在空间达到平衡取向。
电子对数
目与立体 2
结构
3
4
电子对数
目与立体
人教版 高二化学(上册)选修三 第二章 2.2分子的立体构型
人教版 高二化学(上册)选修三 第二章 2.2分子的立体构型
二、价层电子对互斥理论(VSEPR) 1、要点:对ABn型的分子或离子,中心原子A价层 电子对(包括用于形成共价键的共用电子对和没有成 键的孤对电子)之间存在排斥力,将使分子中的原子 处于尽可能远的相对位置上,以使彼此之间斥力最小, 分子体系能量最低。
人教版高中化学选修3课件 第二章第二节分子的立体结构(共54张PPT)

四、配合物理论简介
(一)配位键和配位化合物
1、配位键
⑴概念:共用电子对由一个原子单方向提供给另一
原子共用所形成的共价键。
⑵表示: A
B
电子对给予体 电子对接受体
⑶条件:其中一个原子必须提供孤对电子。另一原
子必须有能接受孤对电子的空轨道。
举例: NH4 +
H3O+
实验2-1 CuSO4 CuCl2.2H2
共轭大л键
苯分子中6个碳原子连接成环,每个碳原子上再连一个 氢原子,所有原子处在同一个平面上。
苯的结构式里的碳-碳键有单键和双键之分,这种结构满 足了碳的四价,可是事实上苯分子的单键和双键的键长和键能 并没有区别,苯的结构式并不能反映这个事实。苯形成p-p大 键。
大π 键
C6H6
C6H6的大π键(离域键)
• 杂化 轨道:原子轨道组合杂化后形成的 一组新轨道
• 杂化轨道类型:sp、sp2、sp3、sp3d2等 • 杂化结果:重新分配能量和空间方向,组
成数目相等成键能力更强的原子轨道 • 杂化轨道用于容纳σ键和孤对电子
1、sp3 杂
化
思考: 学习价层电子互斥模型知道: NH3和H2O的模型和甲烷
分子一样,也是四面体形的, 它们的中心原子是不是sp3杂化呢?
ABn 立体结构 n=2 直线型 n=3 平面三角形 n=4 正四面体型
范例 C02
CH20 CH4
另一类是中心原子上有孤对电子(未用于形成共价键 的电子对)的分子,如H2O和NH3,中心原子上的孤对电子也 要占据中心原子周围的空间,并参与互相排斥。
例如,H20和NH3的中心原子工分别有2对和l对孤对电 子,跟中心原子周围的σ键加起来都是4,它们相互排斥, 形成四面体,因而H:O分子呈V形,NH3分子呈三角锥形。
人教版高中化学选修三第二章第二节分子的立体结构 课件(共23张PPT)

C原子轨道子轨道排布图
1s1
2021/4/24
3
杂化轨道理论简介
C:2s22p2
2s
2p
激发
2s
2p
sp3杂化
sp3
由1个s轨道和3个p轨道混杂并重新组合成4个 能量与形状完全相同的轨道。我们把这种轨道称之 为 sp3杂化轨道。
2021/4/24
4
人教版高中化学选修三第二章第二节分子的立体结构 课件(共23张PPT)
2.要点:
(1)参加杂化的各原子轨道能量要相近;杂化后的轨道能量相 同。 (2)杂化前后原子轨道数目不变:参加杂化的轨道数目等于形 成的杂化轨道数目;但杂化轨道改变了原子轨道的形状方向, 在成键时更有利于轨道间的重叠; (3)杂化轨道只能用于形成σ键或容纳孤电子对,不能形成 π键,未参与杂化的P轨道可用于形成π键。
z
z
z
z
109°28′
y
y
y
y
x
x
x
x
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,
形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小,含
有 1/4 s 轨道和 3/4 p 轨道的成分,每两个轨道间的
夹角为109.5°,空间构型为正四面体型
2021/4/24
9
杂化轨道理论简介
2021/4/24
18
杂化轨道理论简介
试用杂化轨道理论分析乙烯和乙炔分子 的成键情况
2021/4/24
19
杂化轨道理论简介
C原子在形成乙烯分子时,碳原子的2s轨道与2个2p轨 道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形 的三个顶点。每个C原子的2个sp2杂化轨道分别与2个H原 子的1s轨道形成2个相同的σ键,各自剩余的1个sp2杂化 轨道相互形成一个σ键,各自没有杂化的l个2p轨道则垂 直于杂化轨道所在的平面,彼此肩并肩重叠形成π键。 所以,在乙烯分子中双键由一个σ键和一个π键构成。
人教版选修3 化学:2.2 分子的立体构型 课件(共41张PPT)

过程: 激发→杂化→轨道重叠
碳原子杂化之前都要发生电子跃迁
Sp3杂化
三、杂化轨道理论简介
1.概念 同一原子中能量相近的原子轨道,重新组合 形成能量相等新轨道的过程叫做原子轨道杂 化,所形成的新轨道叫做杂化轨道
理论要点
①杂化轨道数等于参加杂化的原子轨道数 ②杂化改变了原子轨道的形状、方向。杂化 轨道形成的键比简单原子轨道形成的键更牢 固。 ③杂化轨道用于形成σ键和容纳孤电子对, 未参与杂化的p轨道,可用于形成 π键
子的电荷数
对于阴离子,a=中心原子的价电子数 + 离 子的电荷数 b:与中心原子结合的原子最多能接受的电子 数,氢为1,其他原子等于“ 8-该原子的价 电子数 ” x:与中心原子结合的原子数
阅读:课本P38表2-4
关于公式的说明
中心原子上的孤电子对数 = ½(a-xb)
a为中心原子的价电子数(最外层电子数), 减去结合其他原子时所提供的电子数(xb), 所剩余的电子即为未参与成键的电子,一半 即为孤对电子数。
一般为2、4、6。 配离子的电荷数= 中心原子电荷数+配体总电荷数。
如[Zn(CN) 4 ]2-的电荷数是:+2+(-1)×4=-2;
3.配合物形成时的性质改变 (1)引起离子颜色的改变,如Fe(SCN)3的形 成; (2)引起离子溶解度的改变,如 AgCl→[Ag(NH3)2]+。
注意:配合物溶于水易电离为内界配离子和 外界离子,而内界配离子不能电离。
实验2-1
CuSO4 CuCl2.2H2O CuBr2 NaCl K2SO4 KBr
固体颜色 白色
绿色
深褐色 白色 白色 白色
溶液颜色天蓝色 天蓝色 天蓝色 无色 无色 无色
碳原子杂化之前都要发生电子跃迁
Sp3杂化
三、杂化轨道理论简介
1.概念 同一原子中能量相近的原子轨道,重新组合 形成能量相等新轨道的过程叫做原子轨道杂 化,所形成的新轨道叫做杂化轨道
理论要点
①杂化轨道数等于参加杂化的原子轨道数 ②杂化改变了原子轨道的形状、方向。杂化 轨道形成的键比简单原子轨道形成的键更牢 固。 ③杂化轨道用于形成σ键和容纳孤电子对, 未参与杂化的p轨道,可用于形成 π键
子的电荷数
对于阴离子,a=中心原子的价电子数 + 离 子的电荷数 b:与中心原子结合的原子最多能接受的电子 数,氢为1,其他原子等于“ 8-该原子的价 电子数 ” x:与中心原子结合的原子数
阅读:课本P38表2-4
关于公式的说明
中心原子上的孤电子对数 = ½(a-xb)
a为中心原子的价电子数(最外层电子数), 减去结合其他原子时所提供的电子数(xb), 所剩余的电子即为未参与成键的电子,一半 即为孤对电子数。
一般为2、4、6。 配离子的电荷数= 中心原子电荷数+配体总电荷数。
如[Zn(CN) 4 ]2-的电荷数是:+2+(-1)×4=-2;
3.配合物形成时的性质改变 (1)引起离子颜色的改变,如Fe(SCN)3的形 成; (2)引起离子溶解度的改变,如 AgCl→[Ag(NH3)2]+。
注意:配合物溶于水易电离为内界配离子和 外界离子,而内界配离子不能电离。
实验2-1
CuSO4 CuCl2.2H2O CuBr2 NaCl K2SO4 KBr
固体颜色 白色
绿色
深褐色 白色 白色 白色
溶液颜色天蓝色 天蓝色 天蓝色 无色 无色 无色
中学化学选修三人教版 2.2 分子的立体构型(共32张PPT)

思考ห้องสมุดไป่ตู้
根据电荷分布是否均匀,共价键有极 性、非极性之分,以共价键结合的分 子是否也有极性、非极性之分呢?
分子的极性又是根据什么来判定呢?
3.分子的极性
非极性分子: 电荷分布均匀对 称的分子
正电荷重心和负电荷重心相重合的分子
Cl
Cl
Cl
Cl
共用电子对 2个 Cl原子吸引电子的能力相同,共用电 子对不偏向任何一个原子,整个分子的 电荷分布均匀,∴为非极性分子
分子对称性与分子的许多性质如极性、 旋光性及化学性质都有关
2.手性分子
左手和右手不能重叠
左右手互为镜像
手性异构体和手性分子
概念:如果一对分子,它们的组成和原 子的排列方式完全相同,但如同左手和右手 一样互为镜像,在三维空间里不能重叠,这 对分子互称手性异构体。有手性异构体的分 子称为手性分子。 条件:当四个不同的原子或基团连接在碳 原子上时,形成的化合物存在手性异构体。 其中,连接四个不同的原子或基团的碳原子 称为手性碳原子。
道混合起来,重新组合成一组新轨道。这 种轨道重新组合的过程叫做杂化,所形成 的新轨道就称为杂化轨道。
① 有多少个原子轨道发生杂 化就形成多少个杂化轨道。
②杂化轨道的电子云一头大, 一头小,成键时利用大的一头, 可以使电子云重叠程度更大, 形成的化学键更稳定。即杂化 轨道增强了成键能力。
③杂化轨道之间在空间取最大 夹角分布,使相互间的排斥能最 小,故形成的键较稳定。不同类 型的杂化轨道之间夹角不同,成 键后所形成的分子就具有不同的 空间构型。
碳原子的p轨道
杂化轨道理论解释苯分子的结构:
C为SP2杂化 C-C (sp2-sp2 ) ; C-H (sp2-s )
人教版高中化学选修三第二章第二节 《分子的立体构型》 课件 (共25张PPT)

思考与 交流2
2、请根据H3O+的形成提出
[Cu(H2O)4]2+中 Cu2+与H2O结合方 式的设想,并将你的想法与同学交流。
H2O 提供孤电子对
H+
提供空轨道接
受孤对电子
HOH H
H2O
Cu2+
H2O
2+
H2O Cu OH2
H2O
配合物理论简介
2、配合物
(1) 定义 通常把接受孤电子对的金属离子
H
同其他相同原子形成的
共价键键参数完全相同
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
无色离子:Na+ Cl- K + SO42 – Br - K + 什么离子 呈天蓝色:[Cu(H2O)4]2+
配合物理论简介
思考与 交流2 Cu2+与H2O是如何结合的呢? 1、在强酸溶液电离的过程中, H2O能与H+结 合形成H3O+,请用电子式表示H与O形成H2O的 过程,比较H2O和H3O+的电子式,讨论H2O与 H+是如何形成H3O+?
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不 能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2021/11/162021/11/162021/11/162021/11/16
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
资料卡片: 形形色色的分子 C60
C 2021/3/2
20
C40
C70 6
2021/3/2
7
2021/3/2
8
• 分子世界如此形形色色,异彩纷呈, 美不胜收,常使人流连忘返。
• 那么分子结构又是怎么测定的呢
2021/3/2
9
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)
早年的科学家主要靠对物质的宏观性质进行系统总结得 出规律后进行推测,如今,科学家已经创造了许许多多测 定分子结构的现代仪器,红外光谱就是其中的一种。
3、确定分子构型
在价层电子对构型的基础上,去掉孤电子对 由真实原子形成的构型
2021/3/2
18
分子 或离子
H2O CO2 SO2 NH3 CO32- SO3 CH4
SiCl4
价层电 子对数
4 2 3 4 3 3 4
4
VSEPR 模型名称
四面体
孤电子 对数2Βιβλιοθήκη 直线形 0 平面三角形 1
四面体 1 平面三角形 0 平面三角形 0
2021/3/2
10
测分子体结构:红外光谱仪→吸收峰→分析。
2021/3/2
11
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
2021/3/2
直线形 V形
12
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
2021/3/2
平面三角形
三角锥形
13
二、价层电子对互斥(VSEPR)理论
2021/3/2
24
课堂练习
• 美国著名化学家鲍林(L.Pauling, 1901— 1994)教授具有独特的化学想象力:只要 给他物质的分子式,他就能通过“毛估” 法,大体上想象出这种物质的分子结构模 型。请你根据价层电子对互斥理论,“毛 估”出下列分子的空间构型。
A.CO2
B.H2S
B
C.PCl3
D.SiCl4
2.下列分子立体结构其中属于直线型分子的是
A.H2O C.C2H2
B.CO2
BC
D.P4
2021/3/2
23
课堂练习
• 3.若ABn型分子的中心原子A上没有未用于形 成共价键的孤对电子,运用价层电子对互斥模
型,下列说法正确的(C )
• A.若n=2,则分子的立体构型为V形 • B.若n=3,则分子的立体构型为三角锥形 • C.若n=4,则分子的立体构型为正四面体形 • D.以上说法都不正确
子所带电荷数, 阴离子中,a为中心原子价
电子数加上离子所带电荷数。
2021/3/2
15
化学式
HCN
SO2 NH2-
BF3
H3O+
SiCl4
CHCl3
NH4+
SO 2021/3/2
2- 4
价层电 结合的原 孤对电子
子对数 子数
对数
2
2
0
3
2
1
4
2
2
3
3
0
4
3
1
4
4
0
4
4
0
4
4
0
4
4
0
16
化学式
H2O SO3 NH3 CO2 SF4 SF6 PCl5 PCl3 CH 2021/3/2
分子中的原子不是固定不动的,而是不断地振动着的。 所谓分子立体结构其实只是分子中的原子处于平衡位置时 的模型。当一束红外线透过分子时,分子会吸收跟它的某 些化学键的振动频率相同的红外线,再记录到图谱上呈现 吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个 化学键、哪种振动方式引起的,综合这些信息,可分析出 分子的立体结构。
4
价层电 子对数
4 3 4 2 5 6 5 4 4
结合的原 孤对电子
子数
对数
2
2
3
0
3
1
2
0
4
1
6
0
5
0
3
1
4
0
17
②确定价层电子对构型
价层电子 对数目
2
3
4
价层电子 直 平面 正四 对构型 线 三角型 面体
5
三角 双锥
6
正八 面体
注意:孤对电子的存在会改变键合电子对 的分布方向,从而改变化合物的键角
有孤对电子
2021/3/2
H2O NH3
2
AB2
V形
3
AB3 三角锥形
20
化学式
HCN SO2 NH2- BF3 H3O+ SiCl4 CHCl3 NH 2021/3/2 +
4
应用反馈:
中心原子 孤对电子数
0 1 2
中心原子结 合的原子数
2 2 2
0
3
1
3
0
4
0
4
0
4
空间构型
直线形 V形 V形
平面三角形 三角锥形 正四面体 四面体 正四面体21
正四面体形 0
正四面体形 0
分子或离子 立方体构型
V形 直线形 V形 三角锥形
平面三角形 平面三角形 正四面体形
正四面体形
2021/3/2
19
小结: 价层电子对互斥模型
中心原子 中心原子 代表物 结合的原子数
CO2
2
无孤对电子 CH2O
3
CH4
4
分子 类型
AB2 AB3 AB4
空间构型 直线形
平面三角形 正四面体
( Valence Shell Electron Pair Repulsion )
1、理论要点
共价分子中,中心原子周围电子对排布的 几何构型主要取决于中心原子的价层电子 对的数目。价层电子对各自占据的位置倾 向于彼此分离得尽可能的远,此时电子对 之间的斥力最小,整个分子最稳定。
价层电子对包括成键的σ电子对和孤电子对
共价键
复习回顾
σ键 成键方式 “头碰头”,呈轴对称
π键 成键方式 “肩并肩”,呈镜像对称
键参数
2021/3/2
键能
衡量化学键稳定性
键长 键角 描述分子的立体结构的重要因素
1
一、形形色色的分子
1、双原子分子(直线型)
O2
HCl
2、三原子分子立体结构(有直线形和V形)
H O 2021/3/2
2
CO2
2
ABn型分子空间构型快速判断方法: 1、n=2时,中心原子无孤对电子的是直线形,中心原
子有孤对电子为V形,如CO2直线形,H2O为V形。 2、n=3时,中心原子无孤对电子的为平面三角形,有
孤对电子的为三角锥形。BF3为平面三角形,H3O+ 三角锥形。
3、n=4时,为正四面体。
2021/3/2
22
1.下列物质中分子立体结构与水分子相似的是
2021/3/2
不包括成键的π电子对 !
14
2、价层电子对数计算
①确定中心原子价层电子对数目
价层电 子对数
=配位原子数+孤电子对数
=σ键电子对数+孤电子对数
孤电子对数=(a-xb)/2
分子中a为中心原子的价电子数 ,x为配 原子数,b为配原子达稳定结构所需的电子数
阳离子中,a为中心原子价电子数减去离
3、四原子分子立体结构(直线形、平面三 角形、三角锥形、正四面体)
(平面三角形,三角锥形)
C2H2
CH2O
COCl2
NH 2021/3/2
3
P4
3
4、五原子分子立体结构 最常见的是正四面体
CH4
2021/3/2
4
5、其它:
CH3CH2OH
CH3COOH
C H 6 6 2021/3/2
C8H8
CH3OH5
