游离三碘甲腺原氨酸(FT3)测定试剂盒(化学发光法)产品技术要求科美
游离三碘甲状腺原氨酸(FT3)测定试剂盒(电化学发光免疫分析法)产品技术要求lztk

游离三碘甲状腺原氨酸(FT3)测定试剂盒(电化学发光免疫分析法)组成:适用范围:本试剂盒用于体外定量测定人体血清样本中游离三碘甲状腺原氨酸(FT3)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.4pmol/L。
2.3 准确度用FT3企业参考品进行检测,其测量结果的相对偏差应在±15%范围内。
2.4 线性在[1.0,50.0]pmol/L范围内,线性相关系数的绝对值(|r|)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(5.0±1.0pmol/L)和(30.0±6.0pmol/L)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(5.0±1.0pmol/L)和(30.0±6.0pmol/L)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 特异性2.6.1 与甲状腺素(T4)浓度不低于200ng/mL的T4样品,在本试剂盒测定结果应不大于0.4pmol/L;2.6.2 与3、3’、5’-三碘甲腺原氨酸(rT3)浓度不低于200ng/mL的rT3样品,在本试剂盒测定结果应不大于0.4pmol/L。
2.6.3 与3、3’-二碘甲腺原氨酸浓度不低于200ng/mL的T2样品,在本试剂盒测定结果应不大于0.4pmol/L。
2.7 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.8 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至罗氏诊断生产的FT3定标液。
化学发光全套检查项目及临床意义
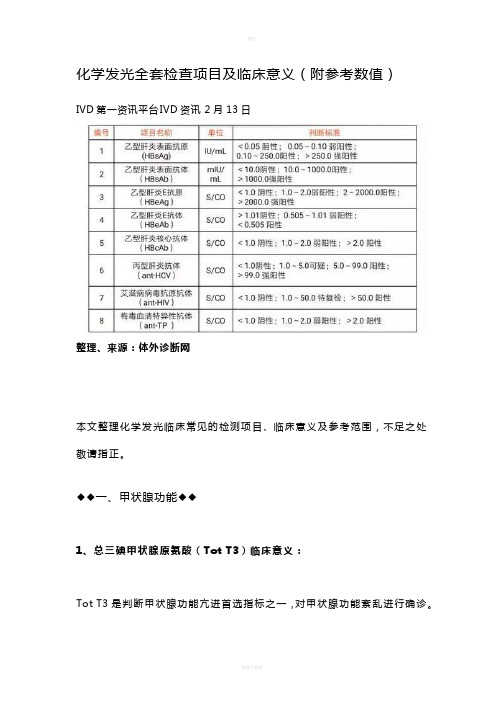
化学发光全套检查项目及临床意义(附参考数值)IVD第一资讯平台IVD资讯2月13日整理、来源:体外诊断网本文整理化学发光临床常见的检测项目、临床意义及参考范围,不足之处敬请指正。
◆◆一、甲状腺功能◆◆1、总三碘甲状腺原氨酸(Tot T3)临床意义:Tot T3是判断甲状腺功能亢进首选指标之一,对甲状腺功能紊乱进行确诊。
增高:Grave 病,大多数是由于甲状腺机能亢进引起(特发性T3型甲亢、新生儿一过性甲亢、亚急性甲状腺炎、TBG、白蛋白增高时、地方性缺碘甲状腺肿、服用外源性T3等)。
降低:原发性甲状腺机能减低(如呆小症、Hashimoto 甲状腺炎、先天性甲状腺形成异常、新生儿甲状腺机能减退症、特发性粘液性水肿等);继发性甲状腺机能减低(如垂体功能低下、TSH单独缺乏症等);下丘脑功能障碍、重症消耗性疾病;先天性TBG减少症;65岁以上。
参考范围 1.34~2.73 nmol/L (0.87–1.78 ng/mL)2、总甲状腺素(Tot T4 )临床意义:增高:甲亢;妊娠、新生儿;服用雌激素和避孕药;高TBG血症;急性肝炎;服用碘时;亚急性甲状腺炎;TSH分泌性肿瘤;甲状腺激素过度使用。
降低:甲减;TSH不应症;甲状腺形成异常;母体抗甲状腺制剂的应用;TBG低下症;某些严重肝病、禁食、高热病、肾病综合症。
参考范围78.38~157.4 nmol/L (6.09~12.23 ug/dL)3、游离三碘甲状腺原氨酸(FT3)临床意义:甲亢增高,甲减降低,与病理生理相一致,不受TBG等的影响,故可诊断妊娠性甲亢,并是诊断甲亢的最佳指标。
参考范围 3.8~6.0 pmol/L (2.5~3.9 pg/mL)4、游离甲状腺素(FRT4)临床意义:甲亢、T4中毒症、恶性肿瘤等增高,甲减降低,与病理生理相一致,不受TBG等影响,是诊断甲减的最佳指标。
参考范围7.86~14.41 pmol/L (0.61~1.12 pg/mL)5、促甲状腺素(超敏)(hTSH)临床意义:评估甲状腺的状态,确定亚临床的或潜在性的甲状腺功能减退或甲状腺功能亢进,是筛选亚临床甲状腺功能异常最灵敏的诊断指标,也是产前诊断先天性甲低的最佳指标,并可对原发性甲状腺功能衰退的治疗进行疗效考核并指导用药。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(化学发光免疫分析法)产品技术要求kangrun

游离三碘甲状腺原氨酸(FT3)测定试剂盒(化学发
光免疫分析法)
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;R1 组分应为棕色含固体微粒的液体,无板结、无絮状物。
R2 和R3 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
其中R1≥5.6mL,R2≥6.0mL,R3≥6.0mL。
2.3准确度
对具有溯源性的两个浓度水平的工作校准品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4空白限
空白限应不大于0.8 pg/mL。
2.5线性
试剂盒在0.8-30 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 8%。
2.7批间差
变异系数CV 应≤ 15%。
2.8特异性
浓度不低于300ng/mL 的L-T4 样本,检测结果应不高于空白限。
浓度不低于10µg/mL 的rT3 样本,检测结果应不高于空白限。
游离三碘甲腺原氨酸(Free T3)标准操作规程

游离三碘甲腺原氨酸(Free T3)标准操作规程1.【实验目的】为了保证游离三碘甲腺原氨酸测定结果的准确性,以及可靠性。
2.【职责】2.1 实验室工作人员均应熟知并严格遵守本SOP,室负责人监督落实。
2.2 本SOP的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:室负责人、科主任。
3.【样品类型及实验前准备】3.1 样本类型:血清和血浆,稳定性: 2-8℃可稳定6天,如需存放大于6天时,请于-20℃或更低的温度下保存。
3.2 患者准备:实验前正常饮食,晨起空腹,安静状态下抽取静脉血,条件特殊情况下可非空腹抽血检测。
3.3 容器,添加剂类型:血清(包括在血清分离器管中采集的血清),血浆(EDTA三钾、肝素锂、肝素钠),使用玻璃管或塑料管分离样本。
3.4 仪器设备:雅培ARCHITECT i1000SR, 低速离心机3.5 实验试剂:3.5.1.1 ARCHITECT Free T3试剂盒(6C28)(绵羊)包被的磁性微粒子抗T3吖啶酯标记的T33.5 .1.2其他试剂:激发液、预激发液、清洗缓冲液(需另行配置)3.5.2校准品:名称:美国雅培i2000SR 游离T3校准品 LIST NO.: 6C48--01规格:CAL 1: 1.4pg/mL 1LX4mlCAL 2: 30pg/mL 1LX4ml 3.5.3质控品名称:美国雅培i1000SR 游离T3质控品 LIST NO:6C48-10水平浓度(pg/mL ) 范围(pg/mL ) 体积(ml)质控L 3.1 2.02 - 4.09 8质控M 6.0 4.20 - 7.80 8质控H 10.5 7.88 - 14.18 84.【实验原理】ARCHITECT i1000SR 游离T3是采用化学发光微粒子免疫分析(ChemiluminesentMicroparticle ImmunoAssay, CMIA)技术,两步法对待测样品中的游离三碘甲腺原氨酸(游离T3)进行定量检测。
游离三碘甲状腺原氨酸(FT3)校准品产品技术要求hkt
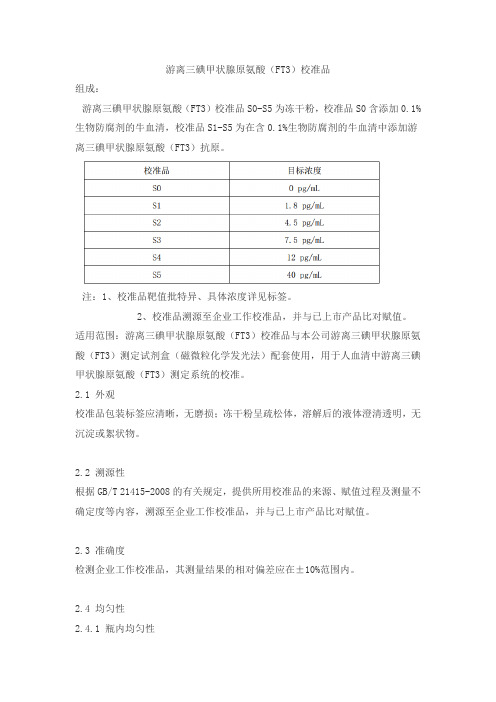
游离三碘甲状腺原氨酸(FT3)校准品
组成:
游离三碘甲状腺原氨酸(FT3)校准品S0-S5为冻干粉,校准品S0含添加0.1%生物防腐剂的牛血清,校准品S1-S5为在含0.1%生物防腐剂的牛血清中添加游离三碘甲状腺原氨酸(FT3)抗原。
注:1、校准品靶值批特异、具体浓度详见标签。
2、校准品溯源至企业工作校准品,并与已上市产品比对赋值。
适用范围:游离三碘甲状腺原氨酸(FT3)校准品与本公司游离三碘甲状腺原氨酸(FT3)测定试剂盒(磁微粒化学发光法)配套使用,用于人血清中游离三碘甲状腺原氨酸(FT3)测定系统的校准。
2.1 外观
校准品包装标签应清晰,无磨损;冻干粉呈疏松体,溶解后的液体澄清透明,无沉淀或絮状物。
2.2 溯源性
根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 准确度
检测企业工作校准品,其测量结果的相对偏差应在±10%范围内。
2.4 均匀性
2.4.1 瓶内均匀性
各浓度点(除零外),变异系数(CV)应不高于10%。
2.4.2 瓶间均匀性
各浓度点(除零外),变异系数(CV)应不高于15%。
2.5 稳定性
2.5.1 复溶稳定性
校准品复溶后,-20℃以下储存,有效期15天,在效期内赋值结果的变化趋势不显著。
2.5.2 效期稳定性
校准品原包装2℃~8℃储存,有效期12个月,在效期内赋值结果的变化趋势不显著。
FT3操作规程

4.1时间分辨荧光分析仪;
4.2微孔洗涤机;
4.3微孔振荡器;
5.操作步骤
5.1.试剂的准备
⑴洗涤液:将40ml浓缩洗液和960ml蒸馏水在干净的洗液瓶中混合,作为工作洗涤液。
⑵加入1.0ml蒸馏水于冻干铕标记小瓶中,待铕标记充分溶解(静置至少30分钟)。
⑶加入1.0ml蒸馏水于各冻干校准品小瓶中,待校准品充分溶解(静置至少30分钟)。
9.11所有的样本和本试剂盒应作为潜在的传染原看待,按传染病实验室检查规程操作。
9.12如对实验结果有疑问,应重复试验。
9.13为保证实验的准确性,处理后得到的血样应不含纤维蛋白、红细胞、血脂等,并要保证血样吸取的量的准确性,否则容易引起测量值的差异。
9.14本试剂盒应置2—8℃保存,有效期参考瓶上所贴标签。
⑷将分析缓冲液、校准品、待测样品和所需数量的微孔反应条平衡至室温(20~250C)。
⑸使用前一小时内,按照需要用量以分析缓冲液稀释铕标记(1:100)(详见操作流程图)
5.2.吸取25μl校准品和待测样品,加入反应板微孔内。
5.3.在各微孔内加入150μl已稀释的铕标记溶液,在室温(20~25℃)下慢速振动1小时。
7.临床意义
血清中约80%以上的T3由T4脱碘生成,其余直接由甲状腺合成。进入血液循环的T3大部分与结合蛋白结合,仅约0.3% T3呈游离状态。FT3被认为是循环血中甲状腺激素的活性部分。FT3浓度分析不受血液中甲状腺激素结合蛋白浓度的影响,是甲状腺功能亢进的敏感指标,并且是评价T4-替代疗法疗效的常用分析手段。
c.校准品(A、B、C、D、E、F):一套,1.0ml/瓶(冻干品)
d.浓缩洗液:一瓶,40ml
e.荧光增强液:一瓶,30ml
血清三碘甲状腺原氨酸(T3)实验室检测

血清三碘甲状腺原氨酸【试剂名称】通用名称:血清三碘甲状腺原氨酸(T3)测定试剂盒(化学发光法)1.用途本试剂用于定量测定人血清或血浆内三碘甲状腺原氨酸(T3)的含量。
本方法适用标本的浓度范围为0-10 ng/ml(0-15.5 nmol/l)。
该测试必须在M AGLU MI® 1000 分析仪上进行。
2.概述与说明-健康人中,甲状腺每天大约分泌5-10μg的T3。
然而,循环的T3最主要由外周脱碘作用产生,从而,每天总T3的分泌水平高达20μg(5)。
在血清中,甲状腺激素与载体蛋白结合,只有它们的游离部分是生理活性的。
- 定量测定T3在可疑甲状腺疾病中的临床意义主要在于诊断及评估甲状腺机能亢进(2,3)。
尤其在单独的T3型甲亢中,观察到T3浓度升高,TBG及T4水平正常。
在甲状腺外科手术切除及用I-131治疗后,T3与T4浓度可能保持一个很高的水平甚至还会升高(甲亢的复发)。
- 在大约50%与甲亢有关的自发性腺瘤病人中发现T3水平的偶尔升高。
这种升高也可出现在早期甲亢、与潜伏性甲亢有关的内分泌性眼疾、甲亢的治疗(甲状腺拮抗剂)过程中、甲状腺肿或非甲状腺肿性碘缺乏及H a shim oto氏甲状腺炎中(代谢状态可能是正常的)。
3.测试原理本试剂盒利用免疫发光竞争法的原理检测T3;采用抗T3单克隆抗体标记ABEI,T3纯抗原标记FITC。
标本,定标液,(质控液)与ABEI标记的单抗,F ITC标记的纯抗原,包被有羊抗F I TC抗体的纳米免疫磁性微珠置37℃孵育形成免疫复合物,然后外加磁场沉淀,去掉上清液,用洗液循环清洗沉淀复合物1次,直接进入样品测量室,仪器自动泵入发光底物1和2,自动监测3秒钟内发出的相对光强度(RLU)。
甲状腺功能的实验室检测的原理及方法

甲状腺功能的实验室检测的原理及方法甲状腺功能实验室检查主要包括甲状腺激素、促甲状腺激素、甲状腺激素结合球蛋白和相关自身抗体检测。
目前认为,联合进行游离三碘甲状腺原氨酸,游离甲状腺素和超敏促甲状腺激素测定,是甲状腺功能评估的首选方案和第一线指标。
甲状腺激素的测定多采用免疫分析法,但传统的放射免疫法灵敏度有限,不能区别正常人低值和原发性甲亢。
化学发光免疫法和时间分辨荧光免疫法都更为灵敏、准确,其检测限可达0.001mIU/L。
但无论检测方法灵敏度多高,结果多准确,都必须结合临床和其他甲状腺功能检查才能做出正确诊断和治疗决策。
一、甲状腺素甲状腺素(thyroxine,T4)检测具有多种方法,传统检测方法采用放射性碘标记的放射免疫法。
但其操作过程繁琐,在临床应用中受到一定限制。
时间分辨荧光免疫法和电化学发光法均是目前最先进的标记免疫测定技术,其检测快捷,敏感度高,近年来在临床T4 检测中被广泛应用。
时间分辨荧光免疫法测定血清总甲状腺素如下:1.原理加入待测血清、铕标记T4和鼠抗T4的单克隆抗体(单抗)温育,试剂中的8-苯胺-1-萘磺酸(ANS)能将结合状态的T4游离出来。
抗T4单抗和包被在微孔板上的二抗结合的同时,样本中的T4和铕标记T4竞争结合抗T4单抗上的结合位点,温育后洗板,加入解离增强液将标记在复合物中的铕离子解离至溶液中,与增强液中的有关成分形成荧光螯合物微囊,发出的荧光强度与样品中的总甲状腺素(total thyroxin,TT4)浓度成反比。
2.试剂与仪器购买成套的商品试剂盒,主要成分如下:已包被第二抗体的96微孔反应板,T4标准品(6瓶,分别含0、20、50、100、150和300nmol/L 的T4标准品),抗T4单克隆抗体(含ANS),铕标记T4(含ANS),浓缩洗液(25×),缓冲溶液,增强液。
3.操作(1)试剂准备:1)洗涤液:40ml浓缩洗液加960ml蒸馏水混合(pH 7.8)。
DXI800化学发光分析仪性能验证报告

性能验证报告单位名称:AAA医院科室名称:检验科实验室:临床化学与免疫学(生化组)实验室仪器名称:全自动微粒子化学发光免疫分析仪型号规格:DXI800仪器编号:SH006/SH028验证人员:审核人:批准人:验证日期:2012年6月1日—2012年8月31日目录游离甲状腺素(FT4)定量方法学验证 (1)铁蛋白(Fer)定量方法学验证 (6)叶酸定量方法学验证 (11)游离三碘甲状原氨酸(FT3)定量方法学验证 (16)肌钙蛋白I(TnI)定量方法学验证 (21)促甲状腺激素(TSH)定量方法学验证 (26)维生素B12 定量方法学验证 (31)游离甲状腺素( FT4)定量方法学验证一.检测系统信息:项目:游离甲状腺素( FT4)仪器名称:贝克曼DXI800 全自动微粒子化学发光免疫分析仪仪器型号:DXI800 试剂及厂商:贝克曼公司标准试剂检测方法:化学发光法. 相关参数:如CLIA'88 有规定,批内精密度<1/4 CLIA'88 ;批间精密度<1/3CLIA'88 ;如无规定,批内精密度<1/4 卫生部临检中心室间质评最大允许误差,批间精密度<1/3 卫生部临检中心室间质评最大允许误差。
三. 验证过程:1. 精密度( Precision ):1.1批内精密度:目的:考察方法的随机误差标本来源:浓度分别处于正常和病理水平的混合新鲜临床标本,正常水平标本来源条码号:12072210044 ;12072110068;12072310075;12072310067 ;12072218003 ;12072210356;12072310372;12072310353;12072310344。
病理水平标本来源条码号:12071810387;12072310332;12072310225;12072210030;12072110272;12072110191;12072019005;12072410365。
化学发光免疫类体外诊断试剂(盒)产品技术审评要求规范(2017版)1204

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
三碘甲腺原氨酸(T3)测定试剂盒(酶联免疫法)产品技术要求beifang
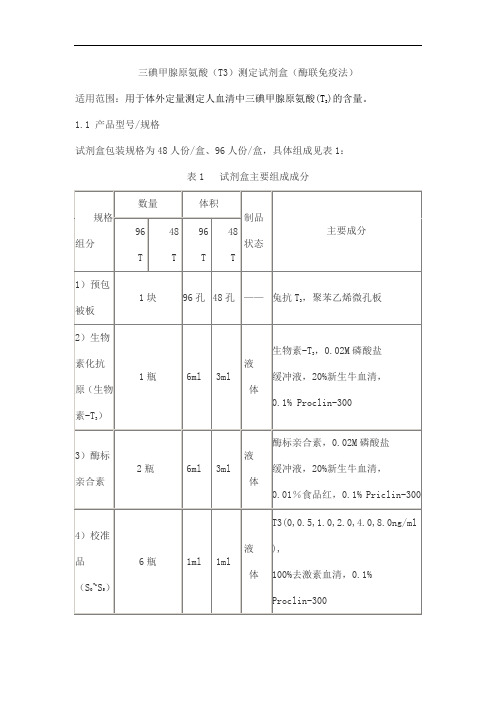
三碘甲腺原氨酸(T3)测定试剂盒(酶联免疫法))的含量。
适用范围:用于体外定量测定人血清中三碘甲腺原氨酸(T31.1 产品型号/规格试剂盒包装规格为48人份/盒、96人份/盒,具体组成见表1:表1 试剂盒主要组成成分2.1外观和物理检查试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
各组分装量不少于表1中要求。
2.2准确性试剂盒内校准品与相应浓度的国家标准品同时进行分析测定,用百分结合率对数(logit-ln)数学模型拟合,要求两条剂量-反应曲线不显著偏离平行(t检验);以国家标准品为对照品,试剂盒内校准品的实测效价与标示值效价的比应在0.900~1.100之间。
2.3线性用logit-ln数学模型拟合,在0.5~8.0ng/mL范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4精密度2.4.1分析内精密度试剂盒质控品测定结果的变异系数(CV)应不大于15.0%。
2.4.2批间精密度在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.0% 2.5最低检出限应不高于0.4ng/mL。
2.6质控品测定值每次检测结果均应在允许范围内。
2.7特异性)结果不高于0.5ng/mL。
检测浓度为5000ng/mL的甲状腺素(T4)结果不高于0.5ng/mL。
检测浓度为500ng/mL的反三碘甲状腺原氨酸(rT32.8稳定性2.8.1效期内稳定性试剂盒在2~8℃储存12个月,测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5、2.6要求。
2.7.2热稳定性将试剂盒在37℃条件下放置7天,测定结果应符合上述2.1、2.2、2.3、2.4.1、2.5、2.6要求。
游离三碘甲状腺原氨酸(FT3)测定试剂盒(免疫荧光法)产品技术要求珠海市丽拓

游离三碘甲状腺原氨酸(FT3)测定试剂盒
(免疫荧光法)
2.性能指标
2.1外观和性状
2.1.1试剂盒各组分应齐全、完整、液体无渗漏。
2.1.2缓冲液应为清澈透明,无沉淀、无悬浮物、无絮状物液体。
2.1.3质控品应为无色至淡黄色。
2.2物理指标
2.2.1净含量
每支缓冲液装量的相对偏差应在标识量的±5%范围内。
2.2.2膜条宽度
使用游标卡尺测量试纸条宽度,应不低于2.5mm。
2.2.3液体移行速度
液体移行速度应不低于10mm/min。
2.3准确性
在试剂盒规定的测量范围内检测国家标准品,其实测值与理论值之比在0.850-1.150之间。
2.4空白限
空白限应不高于0.35pmol/L。
2.5最低检出限
最低检出限不大于0.60pmol/L。
2.6线性范围
该试剂盒的线性范围为0.70pmol/L~45.00pmol/L,回归系数r≥0.990。
2.7精密度
2.7.1分析内精密度
随机抽取同一个批号的试剂盒,对质控品进行检测,变异系数CV≤15%。
2.7.2批间精密度
随机抽取三个不同批号的试剂盒,对质控品进行检测,变异系数CV≤20%。
2.8溯源性
生产企业应根据GB/T21415及有关规定提供所用校准品的来源、赋值过程以及不确定度等内容。
2.9质控品
2.9.1质控品准确度
质控品实测值在标示值的±15%范围内。
2.9.2质控品瓶内均一性
变异系数CV≤10.0%。
2.9.3质控品瓶间均一性
变异系数CV≤15.0%。
化学发光全套检查项目及临床意义

化学发光全套检查项目及临床意义(附参考数值)IVD第一资讯平台IVD资讯 2月13日整理、来源:体外诊断网本文整理化学发光临床常见的检测项目、临床意义及参考范围,不足之处敬请指正。
◆◆一、甲状腺功能◆◆1、总三碘甲状腺原氨酸(Tot T3)临床意义:Tot T3是判断甲状腺功能亢进首选指标之一,对甲状腺功能紊乱进行确诊。
增高:Grave 病,大多数是由于甲状腺机能亢进引起(特发性T3型甲亢、新生儿一过性甲亢、亚急性甲状腺炎、TBG、白蛋白增高时、地方性缺碘甲状腺肿、服用外源性T3等)。
降低:原发性甲状腺机能减低(如呆小症、Hashimoto 甲状腺炎、先天性甲状腺形成异常、新生儿甲状腺机能减退症、特发性粘液性水肿等);继发性甲状腺机能减低(如垂体功能低下、TSH单独缺乏症等);下丘脑功能障碍、重症消耗性疾病;先天性TBG减少症;65岁以上。
参考范围~ nmol/L (– ng/mL)2、总甲状腺素(Tot T4 )临床意义:增高:甲亢;妊娠、新生儿;服用雌激素和避孕药;高TBG血症;急性肝炎;服用碘时;亚急性甲状腺炎;TSH分泌性肿瘤;甲状腺激素过度使用。
降低:甲减;TSH不应症;甲状腺形成异常;母体抗甲状腺制剂的应用;TBG低下症;某些严重肝病、禁食、高热病、肾病综合症。
参考范围~ nmol/L (~ug/dL)3、游离三碘甲状腺原氨酸(FT3)临床意义:甲亢增高,甲减降低,与病理生理相一致,不受TBG等的影响,故可诊断妊娠性甲亢,并是诊断甲亢的最佳指标。
参考范围~ pmol/L (~pg/mL)4、游离甲状腺素(FRT4)临床意义:甲亢、T4中毒症、恶性肿瘤等增高,甲减降低,与病理生理相一致,不受TBG等影响,是诊断甲减的最佳指标。
参考范围~ pmol/L (~pg/mL)5、促甲状腺素(超敏)(hTSH)临床意义:评估甲状腺的状态,确定亚临床的或潜在性的甲状腺功能减退或甲状腺功能亢进,是筛选亚临床甲状腺功能异常最灵敏的诊断指标,也是产前诊断先天性甲低的最佳指标,并可对原发性甲状腺功能衰退的治疗进行疗效考核并指导用药。
FT3中文说明书

定标频率:每批试剂必须用新鲜试剂(试剂经仪器注册24小时以内) 标定一次,如再次标定即根据下列要求: E170/Elecsys2010: · 一个月(同一批号试剂) · 4天(放置仪器上的同一试剂盒) Elecsys1010: · 每一试剂盒做一次 · 7天(室温20-25 度) · 3天(室温25-32 度) 各种分析仪均适用的情况: ·根据要求进行标定:如质控结果超出范围时。 质控: Elecsys通用质控品l和2以及其它合适的质控品。各浓度区域的质控至少每 24工作时、每个试剂盒或每一次定标后测定一次。质控间隔期应适用于各
定分析仪。
· Elecsys测量池清洗液(CleanCell M)货号12135027
· Elecsys系统缓冲液/测量池清洗液预热杯(PC/CC-Cup)货号03023141
概述:
· Elecsys反应杯/吸样头盒(AssayCups/AssayTips Combimagazine M)
三碘甲腺原氨酸(T3)是血清中的甲状腺激素之一,起调节代谢作用。
· Elecsys 1010反应杯(Assay Cup) 货号11706829 Elecsys 2010反应杯(Assay Cup) 货号11706802
稀释: 标本不可以稀释,因为血中的T3是以游离状态以及结合状态两种形式存在, 并处在平衡状态中。结合蛋白质浓度的变化可改变这种平衡。
正常参考值: 2.8-7.1pmol/l或1.8-4.6pg/ml(范围:第2.5百分位-第97.5百分位, n=962)。 如有必要,各实验室应自己测定一个正常值范围。
开封后,2-8 度12周; 放在E170上,5周; 放在Elecsys2010上,8周; 放在Elecsys1010上,7周(使用后放回2-8度 ;如置20-25 度,约20 小时)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
游离三碘甲腺原氨酸(FT3)测定试剂盒(化学发光法)
适用范围:本试剂盒用于定量测定人血清中游离三碘甲腺原氨酸(FT3)的含量。
规格:
2.1外观
FT3试剂盒组分齐全、完整;溶液无混浊,无沉淀或絮状物;微孔板包装袋无破损、漏气现象。
2.2 准确性
用Siemens公司FT3试剂和本公司的FT3试剂,同时测定新鲜血样,检测结果的相关系数r>0.975。
2.3 剂量反应曲线的线性
在(1.8~50.0 pg/mL)范围内,用Log-Logit或其他适当的数学模型拟合,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.4 空白检测限
应不大于0.80pg/mL。
2.5精密度
2.5.1分析内精密度
测定QC血清,变异系数(CV)应小于15.0%。
2.5.2分析间精密度
测定QC血清,变异系数(CV)应小于20.0%。
2.6批间差
用三个批号的试剂盒,分别测量同一质控血清,FT3试剂盒变异系数(CV)应小于20.0%。
2.7 质控血清测定值
用FT3试剂盒测定质控血清,结果应在允许的质控范围内。
2.8 特异性
2.8.1与甲状腺素(T4)的交叉反应
检测浓度为1000ng/mL的T4,交叉反应率应不大于0.01%。
2.8.2与反三碘甲腺原氨酸(rT3)的交叉反应
检测浓度为1000ng/mL的rT3,交叉反应率应不大于0.02%。
2.9 稳定性
FT3试剂盒在2~8℃避光保存,有效期12个月。
在FT3试剂盒有效期满后2个月内,分别检测2.1、2.2、2.3、2.4、2.5.1、2.7项,结果应符合各项目的要求。
