泛素化蛋白检测方法[精华]
癌症中泛素化研究常用的实验方法

癌症中泛素化研究常用的实验方法
癌症是当今社会面临的一大健康难题。
泛素化是一种重要的细胞调控机制,在肿瘤发生、发展中也起着至关重要的作用。
因此,研究泛素化在癌症中的作用具有重要的意义。
下面介绍一些癌症中泛素化研究常用的实验方法。
1. Co-IP实验:该实验通过利用抗体将特定蛋白质从细胞裂解液中富集出来,然后用Western blot技术检测与之结合的其他蛋白质,从而研究泛素化作用。
2. 蛋白质纯化:通过利用某一蛋白质的特异性结合性质和物理化学性质,将目标蛋白质从复杂样品中纯化出来,以便进行进一步的研究。
3. 免疫荧光染色:该实验通过利用特异性抗体与目标蛋白质结合,然后用荧光显微镜观察细胞中该蛋白质的分布情况,以研究泛素化在细胞中的作用。
4. 蛋白质组学分析:该实验利用高通量质谱技术,对复杂蛋白质混合样品进行分析,从而鉴定出样品中的泛素化蛋白质,以研究泛素化在癌症细胞中的作用。
5. 分子动力学模拟:通过数学模型模拟泛素化蛋白质的结构和动态,以研究泛素化作用的机制和规律。
以上是癌症中泛素化研究常用的实验方法,这些方法可以帮助研究者更加深入地了解泛素化在癌症中的作用,从而为癌症的治疗提供新的思路和方法。
蛋白质泛素化的检测方法

蛋白质泛素化的检测方法Protein ubiquitination is a post-translational modification process that involves the attachment of ubiquitin molecules to target proteins. This modification plays a crucial role in the regulation of various cellular processes, such as protein degradation, DNA repair, and signal transduction. Detection of protein ubiquitination is essential for understanding the molecular mechanisms underlying these cellular processes.蛋白质泛素化是一种后转录修饰过程,涉及将泛素分子附加到靶蛋白上。
这种修饰在调控各种细胞过程中起着至关重要的作用,如蛋白降解、DNA修复和信号转导。
检测蛋白质泛素化对于理解潜在这些细胞过程的分子机制至关重要。
There are several methods available for detecting protein ubiquitination, each with its own advantages and limitations. One common method is immunoblotting, which involves using specific antibodies to detect ubiquitinated proteins in a sample. This technique is relatively simple and widely used, but it may lack specificity and sensitivity. Another method is immunoprecipitation,which involves pulling down ubiquitinated proteins using specific antibodies and then analyzing them using techniques like immunoblotting or mass spectrometry.有几种方法可用于检测蛋白质泛素化,每种方法都有其优点和局限性。
揭开细胞奥秘:蛋白泛素化水平的检测方法大揭秘!
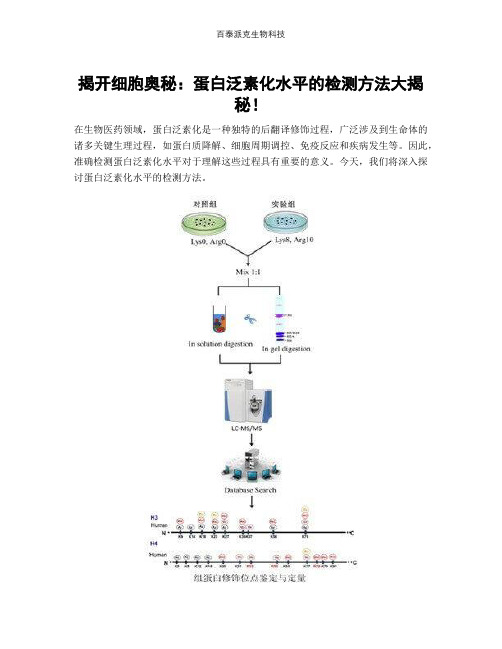
揭开细胞奥秘:蛋白泛素化水平的检测方法大揭秘!在生物医药领域,蛋白泛素化是一种独特的后翻译修饰过程,广泛涉及到生命体的诸多关键生理过程,如蛋白质降解、细胞周期调控、免疫反应和疾病发生等。
因此,准确检测蛋白泛素化水平对于理解这些过程具有重要的意义。
今天,我们将深入探讨蛋白泛素化水平的检测方法。
图1。
1.免疫检测法免疫检测法是一种常用的蛋白泛素化水平检测方法。
通过使用特异性抗体,可以准确地检测到蛋白质是否进行了泛素化修饰。
这种方法包括免疫印迹法(Western Blot)、免疫荧光检测和流式细胞术等。
比如,泛素专一性抗体的应用,使得在电泳后的免疫印迹法中,可以清晰地看到泛素化蛋白的条带。
2.质谱检测法质谱技术是一个强大的分析工具,被广泛应用于蛋白泛素化修饰的检测。
通过质谱,我们可以在单一蛋白质水平上定量泛素化程度,并鉴定特定的泛素化位点。
例如,液相色谱串联质谱(LC-MS/MS)可以用于鉴定泛素化修饰的精确位置,以及定量泛素化水平。
3.活性检测法蛋白泛素化是由三种酶联酶系统(E1、E2和E3)催化的。
因此,通过检测这些酶的活性,我们可以间接地了解蛋白质的泛素化水平。
例如,通过实时荧光检测技术,我们可以监测酶催化反应的过程,从而了解泛素化水平。
4.细胞荧光报告系统利用细胞荧光报告系统,我们可以在活细胞中直观地观察和测量蛋白质的泛素化水平。
这种方法使用含有荧光蛋白的报告基因,当蛋白质发生泛素化修饰时,该荧光蛋白会发出信号,从而可以检测到蛋白质的泛素化水平。
总结,蛋白泛素化水平的检测涉及多种方法,包括免疫检测法、质谱检测法、活性检测法和细胞荧光报告系统。
这些方法各有优势和局限性,而选择哪种方法,需要根据具体的研究需求和实验条件来决定。
未来的研究可能会引入新的技术和工具,以提高蛋白泛素化水平检测的灵敏度和准确度。
图2。
泛素化水平检测方法有哪些,各自的优缺点是什么?
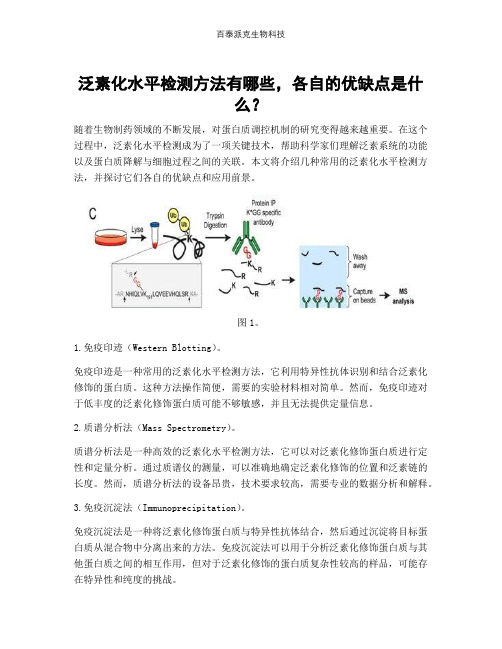
泛素化水平检测方法有哪些,各自的优缺点是什么?随着生物制药领域的不断发展,对蛋白质调控机制的研究变得越来越重要。
在这个过程中,泛素化水平检测成为了一项关键技术,帮助科学家们理解泛素系统的功能以及蛋白质降解与细胞过程之间的关联。
本文将介绍几种常用的泛素化水平检测方法,并探讨它们各自的优缺点和应用前景。
图1。
1.免疫印迹(Western Blotting)。
免疫印迹是一种常用的泛素化水平检测方法,它利用特异性抗体识别和结合泛素化修饰的蛋白质。
这种方法操作简便,需要的实验材料相对简单。
然而,免疫印迹对于低丰度的泛素化修饰蛋白质可能不够敏感,并且无法提供定量信息。
2.质谱分析法(Mass Spectrometry)。
质谱分析法是一种高效的泛素化水平检测方法,它可以对泛素化修饰蛋白质进行定性和定量分析。
通过质谱仪的测量,可以准确地确定泛素化修饰的位置和泛素链的长度。
然而,质谱分析法的设备昂贵,技术要求较高,需要专业的数据分析和解释。
3.免疫沉淀法(Immunoprecipitation)。
免疫沉淀法是一种将泛素化修饰蛋白质与特异性抗体结合,然后通过沉淀将目标蛋白质从混合物中分离出来的方法。
免疫沉淀法可以用于分析泛素化修饰蛋白质与其他蛋白质之间的相互作用,但对于泛素化修饰的蛋白质复杂性较高的样品,可能存在特异性和纯度的挑战。
4.紫外可见光谱法(UV Spectroscopy)。
紫外可见光谱法是一种测定泛素化修饰蛋白质浓度的常用方法。
通过测量特定波长下的吸光度,可以间接地推断泛素化修饰蛋白质的浓度。
然而,紫外可见光谱法只能提供浓度信息,无法提供泛素化修饰的具体位置和类型。
5.荧光共振能量转移法(Fluorescence Resonance Energy Transfer)。
荧光共振能量转移法是一种利用荧光标记分子之间的能量传递来检测泛素化修饰的方法。
它可以用于实时监测泛素化修饰的动态变化,并提供定量和定位信息。
泛素化定量蛋白组学

泛素化定量蛋白组学泛素化定量蛋白组学是一种先进的蛋白质组学技术,它通过研究蛋白质与泛素连接的数量和位置,可以揭示蛋白质在细胞内的功能和调控机制。
在本文中,我们将深入探讨泛素化定量蛋白组学的原理、应用和未来发展趋势。
一、原理和方法1. 泛素化的基本概念泛素是一种小分子蛋白质调控标记,可以与其他蛋白质形成共价键。
泛素化是指将泛素与特定的蛋白质共价连接的过程,这个过程在细胞中由泛素连接酶(E3酶)调控。
泛素化在细胞信号传导、蛋白质降解和修复等生物学过程中起着重要作用。
2. 定量蛋白组学技术定量蛋白组学技术是研究蛋白质组中蛋白质存在量的一种方法。
常用的定量蛋白组学技术包括二维凝胶电泳、液相色谱质谱联用(LC-MS/MS)和同位素标记等方法。
其中,液相色谱质谱联用是当前最常用的定量蛋白组学技术之一。
3. 泛素化定量蛋白组学的原理泛素化定量蛋白组学结合了泛素化和定量蛋白组学技术的优势。
它通过将泛素化与液相色谱质谱联用相结合的方式,可以定量分析细胞中被泛素化的蛋白质。
4. 泛素化定量蛋白组学的方法泛素化定量蛋白组学的方法主要包括以下几个步骤:提取蛋白质样品、泛素化蛋白的富集和识别、质谱分析和数据处理。
在泛素化蛋白的富集和识别中,常用的方法包括免疫富集、亲和纯化和泛素结合蛋白质鉴定等。
二、应用领域1. 揭示蛋白质功能和调控泛素化定量蛋白组学可以帮助研究人员揭示蛋白质在细胞生物学过程中的功能和调控机制。
通过定量分析被泛素化的蛋白质,可以了解它们在细胞信号传导、蛋白质降解和修复等过程中的作用。
2. 疾病研究泛素化在多种疾病的发生和发展中起着重要作用。
泛素化定量蛋白组学可以帮助研究人员鉴定和定量分析疾病相关的泛素化蛋白,从而揭示蛋白质泛素化异常与疾病的关联。
3. 药物开发泛素连接酶(E3酶)作为泛素化的调控因子,被认为是潜在的药物靶标。
泛素化定量蛋白组学可以帮助研究人员评估药物对泛素化酶的影响,为新药物的开发提供理论依据和研究方法。
泛素化蛋白检测方法样本

泛素化蛋白检测方法蛋白质泛素化简介蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。
与磷酸化修饰过程一样, 泛素化修饰过程也是一种可逆的共价修饰过程, 它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。
泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽, 它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。
泛素蛋白本身也含有7个赖氨酸残基, 因此它们之间也能够经过这些位点互相连接, 形成多泛素蛋白链( polyubiquitin chain) 。
当前研究显示, 如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连, 会介导靶蛋白进入蛋白酶体而被降解; 如果与被修饰蛋白上其它位点, 比如第63位赖氨酸残基相连, 则靶蛋白能够发挥信号通路功能而不会被降解。
与磷酸化修饰途径一样, 泛素化修饰途径也是可逆的, 即能够经过去泛素化酶( DUB) 将泛素蛋白修饰物去除掉。
靶蛋白经泛素化途径修饰之后, 连接在靶蛋白上的泛素蛋白单体或多聚体能够被各种泛素蛋白结合结构域( UBD) 所识别和结合。
人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD, 这说明泛素修饰途径在细胞调控中起到了多么重要的作用。
E3酶是泛素修饰途径中决定底物特异性的关键酶, 它能够分为两大类, 即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域( 比如U-box或PHD结构域) 的E3酶。
这两种E3酶都在免疫调控过程中起到了关键性的作用。
蛋白质泛素化的检测方法研究蛋白质的泛素化首先需要明确的三个基本点: 哪些蛋白发生了泛素化; 发生了泛素化的蛋白质, 具体是哪个位点的赖氨酸残基发生了泛素化; 进行定量。
明确了上述几点后, 进一步需要弄清楚的是, 我们感兴趣的泛素化蛋白, 是如何发生泛素化的, 影响这一泛素化过程的关键分子是什么? 或者说这一过程中的E3酶是什么?然后需要研究的是, 这一蛋白质发生泛素化之后能够产生那些分子效应? 对下游的信号通路有什么影响?研究上述内容的实验方法和实验流程:方法一: western blot and strip经过WB检测所有发生泛素化的蛋白条带, 拍照后, 将膜strip。
泛素化试验步骤

泛素化试验步骤1.什么是泛素化试验泛素化试验(Ubiquitination assay)是一种研究泛素修饰作用的实验技术。
泛素是一种小分子蛋白,可以选择性地附加到其他蛋白上,对其进行标记,以促进它们的降解、修复和调节等功能。
泛素化试验可以用于研究泛素化过程的机制、泛素化的底物和酶、以及泛素化和其他生物学过程之间的相互作用等方面。
2.泛素化试验步骤2.1.突变和荧光标记的构建首先,需要构建带有突变或荧光标记的泛素和底物蛋白。
这通常通过克隆和基因工程技术进行。
例如,可以在泛素的K48位点上构建荧光标记,以便在下一步实验中监测底物蛋白的泛素化修饰。
2.2.固相分析接下来,需要进行固相分析,以评估底物蛋白的泛素化修饰水平。
这通常涉及在一个固相上固定底物蛋白,并向其添加泛素化酶和泛素化反应所需的其他材料。
底物蛋白和泛素可以在体外或体内进行泛素化修饰。
然后,用特定的抗体或荧光探针检测泛素化修饰水平。
2.3.在体修饰此外,可以进行在体修饰,以评估底物蛋白在细胞内的泛素化修饰水平。
这通常涉及将带有荧光标记的底物蛋白转染到细胞中,然后在不同条件下进行培养,以评估泛素化修饰的水平。
例如,在添加特定抑制剂的情况下,其影响底物蛋白的泛素化修饰水平等。
3.结论泛素化试验是一种关键的实验技术,可用于研究泛素化修饰在细胞生物学和生物化学过程中的作用和机制。
通过构建突变和荧光标记的泛素和底物蛋白,并进行固相分析和在体修饰,可以评估底物蛋白的泛素化修饰水平,并研究其在不同条件下的变化和影响。
这种技术的发展有望为生物学和医学研究提供更多的思路和方法。
泛素化蛋白检测方法

v1.0 可编辑可修改泛素化蛋白检测方法蛋白质泛素化简介蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。
与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。
泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。
泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。
目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。
与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。
靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。
人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB 酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。
E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT 结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。
这两种E3酶都在免疫调控过程中起到了关键性的作用。
蛋白质泛素化的检测方法研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。
明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么或者说这一过程中的E3酶是什么然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应对下游的信号通路有什么影响研究上述内容的实验方法和实验流程:方法一:western blot and strip通过WB检测所有发生泛素化的蛋白条带,拍照后,将膜strip。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
泛素化蛋白检测方法[精华]
泛素化蛋白检测方法
, 蛋白质泛素化简介
蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。
与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。
泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。
泛素蛋白本身也含有7个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitin chain)。
目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。
与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB)将泛素蛋白修饰物去除掉。
靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD)所识别和结合。
人类蛋白质组中含有两种E1酶、50种E2酶、600种E3酶、90种DUB酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。
E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT结构域的E3酶和其它含有RING结构域或RING样结构域(比如U-box或PHD结构域)的E3酶。
这两种E3酶都在免疫调控过程中起到了关键性的作用。
, 蛋白质泛素化的检测方法
研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。
明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么,或者说这一过程中的E3酶是什么,
然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应,对下游的信号通路有什么影响,
研究上述内容的实验方法和实验流程:
方法一:western blot and strip
通过WB检测所有发生泛素化的蛋白条带,拍照后,将膜strip。
然后与特定蛋白的抗体和特定泛素化位点的抗体反应,显色拍照。
通过阳性条带的对比来初步判断某一特定蛋白的特定位点发生了泛素化。
【具体实验流程附后】方法二:western blot and immunoprecipitations 通过免疫共沉淀方法将某一特定蛋白以及与其结合的蛋白分离出来。
分离出来的蛋白再进行SDS电泳和western blot分析。
【具体实验流程附后】。
这一方法可以明确具体哪个蛋白的哪个赖氨酸残基发生了泛素化修饰。
方法三:in vitro ubiquitination assay
将要研究的目的基因转染293细胞,使其大量表达。
24h后提取并分离目的蛋白。
在体外反应buffer中将我们要研究的蛋白A(被泛素化的那个蛋白)与UBE1,UbeH13-Uev 1 a heterodimer complex ,HA-ubiquitin以及我们要研究的蛋白
B(引起蛋白A泛素化的蛋白),共同进行孵育。
将孵育后的产物进行IP和WB分析。
【具体实验流程附后】。
这一方法可以明确引起哪个蛋白是引起某蛋白发生泛素化修饰的E3连接酶。
方法四:in vitro ubiquitin-binding assay
将我们要研究的蛋白(被泛素化的蛋白)基因转染293细胞,大量表达后提纯。
或者直接提取内源性蛋白。
在体外与K63- or K48-linked ubiquitin chain petides孵育,然后通过SDS电泳并用泛素化抗体进行检测。
这一方法可以明确要研究的蛋白哪个赖氨酸残基容易发生泛素化。
方法一:WB strip实验流程
提取组织/细胞的总蛋白
使用总泛素化抗体检测所有发生了泛素化的蛋白
(此时可以观察到发生了泛素化的蛋白主要分布
在哪些分子量区间)
Stripping the blot
用特定蛋白的抗体用Ub K63抗体与与膜反应显色膜反应显色
Merge
如果总的泛素化蛋白的条带,与特定蛋白的条带,以及K63位点泛素化条带发生了重合,此时可以初步推测,特定蛋白的第63位赖氨酸残基发生了泛素化方法二:Western blot and immunoprecipitations
提取组织/细胞总蛋白用琼脂糖珠或磁珠包被的特异蛋白抗体,将与该蛋白结合的所有蛋
白分离出来
SDS电泳
用泛素化抗体进行反应
Stripping the blot
用特异抗体进行反应
方法三:in vitro ubiquitination assay
将要研究的蛋白基因转染
293细胞使其大量表达
提取蛋白,通过免疫共沉
淀方法分离目的蛋白
将可能发生相互作用的两种蛋白与UBE1,UbeH13-Uev 1 a heterodimer complex ,HA-ubiquitin共同进行孵育。
使泛素化过程发
生。
通过IP和WB方法检测发生了泛素化的蛋白,并明确这一反应中促进泛素化发生的蛋白。
