化学人教版选修精品教学案:原电池学案
高中化学 人教版选修4 第四章第一节 原电池 教学设计、教案、学案
第一节原电池1.以锌铜原电池为例,了解原电池的工作原理。
2.学会判断原电池的正、负极,并能正确书写电极反应式和总反应方程式。
3.认识化学能与电能的相互转化,并能设计简单的原电池。
原电池的基础知识1.原电池(1)概念:将化学能转化为电能的装置。
(2)实质:利用能自发进行的氧化还原反应,把化学能转化为电能。
(3)形成条件①两个活泼性不同的电极;②电解质溶液或熔融电解质;③形成闭合回路;④能自发进行的氧化还原反应。
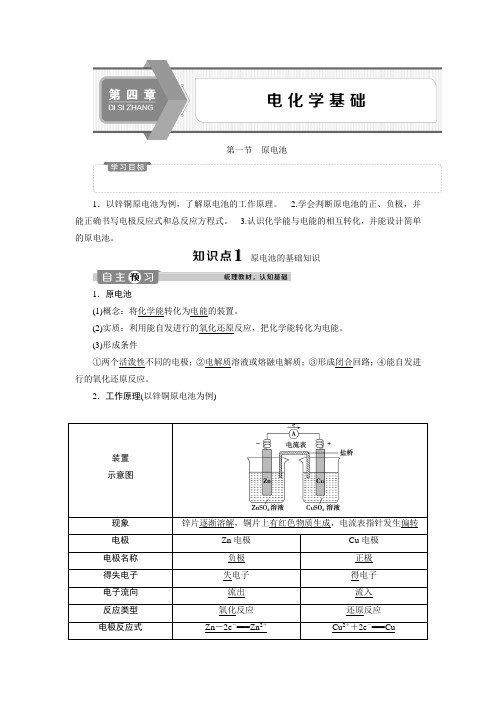
2.工作原理(以锌铜原电池为例)装置示意图现象锌片逐渐溶解,铜片上有红色物质生成,电流表指针发生偏转电极Zn电极Cu电极电极名称负极正极得失电子失电子得电子电子流向流出流入反应类型氧化反应还原反应电极反应式Zn-2e-===Zn2+Cu2++2e-===Cu总反应式Zn+Cu2+===Zn2++Cu3.盐桥及其作用(1)成分:含有琼胶的KCl饱和溶液。
(2)离子移动方向:Cl-移向负极区,K+移向正极区。
(3)作用①通过离子在盐桥中的定向移动,使两个隔离的电解质溶液连接起来,可使电流持续传导。
②将两个半电池完全隔开,使副反应减至最低程度,可以获得单纯的电极反应,有利于最大程度地将化学能转化为电能。
1.正误判断:正确的打“√”,错误的打“×”,并阐释错因或列举反例。
语句描述正误阐释错因或列举反例(1)在原电池构成的闭合回路中,电子从原电池的正极通过导线流向负极(2)原电池的正极一定是化学性质较不活泼的金属(3)原电池工作时,正极上发生氧化反应,负极上发生还原反应(4)只有自发进行的氧化还原反应才能设计成原电池(5)反应Cu+2Ag+===2Ag+Cu2+能以原电池的形式来实现(2)×不一定,如Mg、Al和NaOH溶液构成原电池时,Al为负极,Mg为正极;导电非金属也可做正极(3)×原电池工作时,正极上发生还原反应,负极上发生氧化反应(4)√(5)√2.锌片和铁片紧贴在一起,放置于稀硫酸溶液中,能否形成原电池?答案:能。
人教版选修第一节《原电池》word学案

第一节 原电池学习目标:1、能举例说明 原电池的工作原理.2、能说出原电池的构成条件.3、会判断原电池的正负极,并正确书写电极反应式,和电池反应方程式4、根据原电池反应原理设计简单的原电池学习重点:原电池的工作原理、书写电极反应式,和电池反应方程式学习难点:原电池的工作原理复习回顾:1、 氧化还原反应的本质是______________2、 写出下列反应的离子方程式Z n +H 2S O 4 Fe+ Cu S O 4Fe+ FeC l 3新课思考:如图装置中1、 锌片插入稀硫酸中有什么现象?写出反应的离子方程式。
铜片插入稀硫酸呢?2、锌片和铜片用导线连接后插入稀硫酸中,现象又怎样?锌片和铜片上变化的反应式怎样书写?一、原电池的工作原理. 1.原电池概念:_______能转化为_________能的装置叫做原电池。
2.实质:一个能自发进行的氧化还原反应,把氧化还原反应分开在__________进行,让电子的不规则转移变成__________ ,便能形成电流。
即将化学能转化成电能的形式释放。
3.原理:(1)当铜片与锌片不连接,一同浸入稀硫酸铜溶液时,锌直接把电子给了_________,反应的离子方程式为_____________________________,反应把_________转化为_________。
(2)当铜片与锌片用导线连接,一同浸入稀硫酸铜溶液时,由于锌比铜活泼,锌容易_____电子被_________成Zn 2+进入溶液,电极反应式为_____________________。
锌片上的电子通过________流向_________,溶液中的______从铜片上______电子,被______成______. 电极反应式为________________________.反应的总方程式是______________________ 。
反应是将_______________转化为_______________________.练习:资料P65基础巩固1、二、归纳原电池的构成条件三、有盐桥存在时的原电池工作原理1、如图所示有盐桥存在时电流表指针_______,即有_____通过电路,说明该装置是____________,他的反应原理是,在硫酸锌中______________锌片______________,电极反应式为______________稀硫酸 锌 铜铜片______________,电极反应式为______________电子由______________经过______________若取出盐桥,______________2、盐桥中装有______________和______________。
高中化学《原电池》精品教案新人教版选修4【精品教案】

ZnCu ×第四章电化学基础第一节原电池一、探究目标体验化学能与电能相互转化的探究过程二、探究重点初步认识原电池概念、原理、组成及应用。
三、探究难点通过对原电池实验的研究,引导学生从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。
四、教学过程【引入】电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。
例如,日常生活中使用的手提电脑、手机、相机、摄像机……这一切都依赖于电池的应用。
那么,电池是怎样把化学能转变为电能的呢?我们这节课来一起复习一下有关原电池的相关内容。
【板书】§4.1 原电池一、原电池实验探究讲:铜片、锌片、硫酸都是同学们很熟悉的物质,利用这三种物质我们再现了1799年意大利物理学家----伏打留给我们的历史闪光点!【实验探究】(铜锌原电池)实验步骤现象1、锌片插入稀硫酸2、铜片插入稀硫酸3、锌片和铜片上端连接在一起插入稀硫酸【问题探究】1、锌片和铜片分别插入稀硫酸中有什么现象发生?2、锌片和铜片用导线连接后插入稀硫酸中,现象又怎样?为什么?3、锌片的质量有无变化?溶液中 c (H+)如何变化?4、锌片和铜片上变化的反应式怎样书写?5、电子流动的方向如何?讲:我们发现检流计指针偏转,说明产生了电流,这样的装置架起了化学能转化为电能的桥梁,这就是生活中提供电能的所有电池的开山鼻祖----原电池。
【板书】(1)原电池概念:学能转化为电能的装置叫做原电池。
问:在原电池装置中只能发生怎样的化学变化?学生: Zn+2H+=Zn2++H2↑讲:为什么会产生电流呢?答:其实锌和稀硫酸反应是氧化还原反应,有电子的转移,但氧化剂和还原剂热运动相遇发生有效碰撞电子转移时,由于分子热运动无一定的方向,因此电子转移不会形成电流,而通常以热能的形式表现出来,激烈的时候还伴随有光、声等其他的形式的能量。
显然从理论上讲,一个能自发进行的氧化还原反应,若能设法使氧化与还原分开进行,让电子的不规则转移变成定向移动,便能形成电流。
4.1 原电池 学案(人教版选修4)

4.1 原电池学案(人教版选修4)4.1 原电池学案(人教版选修4)[学习目标] 1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.掌握构成原电池的条件。
3.能设计原电池装置。
[重点•难点]电极反应和电池反应方程式的书写。
1.原电池原理(1)概念:利用______________反应原理将________能转化为____能的装置。
(2)原电池工作原理(以锌铜原电池为例)装置示意图现象锌片________________,铜片上有____________,电流表指针发生________电极Zn电极Cu电极电极名称得失电子失电子得电子电子流向反应类型电极反应式总反应式2.原电池形成的条件(1)两个________不同的电极(材料可以是金属或非金属)负极:活泼性____,________电子发生氧化反应。
正极:活泼性____,________电子发生还原反应。
(2)电极均插入________________中。
(3)构成________________。
(4)能自发地发生的________________反应。
3.下列装置中,属于原电池的是()4.关于下图装置的叙述,正确的是()A.铜是阳极,铜片上有气泡产生B.铜片质量逐渐减少C.电流从锌片经导线流向铜片D.氢离子在铜片表面被还原后生成H25.理论上,能自发进行的氧化还原反应均能设计成原电池。
实际设计时应该注意以下几方面。
(1)外电路负极(________________的物质)――→e-导线正极(2)内电路将两极浸入________________溶液中,使正、负离子作________________。
(3)闭合电路一、原电池的正负极的判断方法1.由组成原电池的两极材料判断较活泼的金属为____极,较不活泼的金属或能导电的非金属为____极。
2.根据电流方向或电子流向判断外电路中,电流由____极流向____极,电子由____极流向____极。
原电池的优秀教学设计【优秀5篇】

原电池的优秀教学设计【优秀5篇】高二必修一化学原电池教案篇一【教学目标】1、掌握原电池的构成条件,理解原电池的工作原理,能正确判断原电池的正负极,正确书写电极反应式、电池反应式,能根据氧化还原原理设计简单的原电池。
2、通过实验探究学习,体验科学探究的方法,学会分析和设计典型的原电池,提高实验设计、搜索信息、分析现象、发现本质和总结规律的能力。
3、在自主探究、合作交流中感受学习快乐和成功喜悦,增强学习的反思和自我评价能力,激发科学探索兴趣,培养科学态度和创新精神,强化环境保护意识以及事物间普遍联系、辨证统一的哲学观念。
【教学重点】原电池的构成条件【教学难点】原电池原理的理解;电极反应式的书写【教学手段】多媒体教学,学生实验与演示实验相结合【教学方法】实验探究教学法【课前准备】将学生分成几个实验小组,准备原电池实验仪器及用品。
实验用品有:金属丝、电流表、金属片、水果。
先将各组水果处理:A组:未成熟的橘子(瓣膜较厚),B组:成熟的橘子(将瓣膜、液泡搅碎),C组:准备两种相同金属片,D组:准备两种不同金属片。
【教学过程】[师]:课前我们先作个有趣的实验。
请大家根据实验台上的仪器和药品组装:将金属片用导线连接后插入水果中,将电流表串联入线路中,观察会有什么现象发生?(教师巡视各组实验情况)。
[师]:请大家总结:有什么现象发生?[生]:总结:出现两种结果:①电流表指针偏转②电流表指针不发生偏转[师]:电流表指针偏转说明什么?为什么会发生偏转?[生]:说明有电流产生。
[师]:这个装置就叫做原电池。
这节课我们共同研究原电池。
请大家列举日常使用的原电池都有哪些?[展示干电池]:我们日常使用的电池有下面几种,大家请看:[播放幻灯片]:化学电池按工作性质可分为:一次电池(原电池);二次电池(可充电电池)铅酸蓄电池。
其中:一次电池可分为:糊式锌锰电池、纸板锌锰电池、碱性锌锰电池、扣式锌银电池、扣式锂锰电池、扣式锌锰电池、锌空气电池、一次锂锰电池等。
人教版高中化学选修四41《原电池》第一课时教案

人教版高中化学选修四41《原电池》第一课时教案教学目标- 了解原电池的基本概念和构造- 掌握原电池的工作原理和电化学反应- 能够分析原电池在实际应用中的优缺点教学重点- 原电池的构造和工作原理- 原电池的电化学反应教学难点- 掌握原电池的电化学反应机理- 分析原电池在实际应用中的优缺点教学准备- 教材:人教版高中化学选修四- 多媒体教学设备- 实验器材和化学药品教学过程导入(5分钟)- 利用多媒体展示一些与电池相关的实际应用,引起学生的兴趣和思考。
知识讲解(15分钟)1. 介绍原电池的基本概念和构造,引导学生了解原电池的组成部分和工作原理。
2. 讲解原电池中的电化学反应,包括正极、负极和电解质之间的电子转移和离子迁移过程。
3. 通过示意图和实例,帮助学生理解原电池的工作过程。
实验演示(20分钟)1. 进行原电池的实验演示,展示原电池的组装和工作原理。
2. 引导学生观察电池的正负极变化以及电池的工作状态。
知识巩固(15分钟)1. 分组进行小组讨论,让学生分析原电池在实际应用中的优缺点。
2. 每个小组汇报讨论结果,进行全班讨论。
拓展应用(10分钟)1. 利用多媒体展示一些原电池的实际应用案例,让学生了解原电池在生活和工业中的作用。
2. 鼓励学生思考原电池的未来发展方向和可能的改进措施。
课堂作业1. 思考并写下一篇关于原电池的应用文章。
2. 预习下节课内容。
总结反思- 对本节课的教学过程进行总结,强调原电池的重要性和实际应用。
- 确保学生对原电池的基本概念和工作原理有清晰的理解。
参考资料- 人教版高中化学选修四教材- 多媒体教学资料- 实验教材和实验指导书。
4.1原电池学案(人教选修4)

4.1 原电池学习目标:1.了解能源与化学能之间的关系;能设计简单的原电池;能分析电池反应。
2.用直观形象的教具来表现电池的工作原理。
情感目标:够感觉到能源危机,能认识到自己的行为对环境的作用。
学习重点难点:能源与化学能之间的关系;分析电池反应,设计简单的原电池。
学习过程:【知识要点】1、原电池定义:将转变为的装置。
2、实质:将氧化还原反应的电子转移变成电子的定向移动。
即将化学能转化成电能3、组成原电池的条件:a 、有两种活泼性不同的金属作电极(或金属与能导电的非金属或化合物)注意:燃料电池中两极可同选石墨或铂b 、有电解质溶液c 、构成闭合的回路d 、能自发发生氧化还原反应练习1:下列哪些装置能组成原电池?()1、如图:若在上述f装置中接上检流计并插入盐桥(盐桥通常是装有饱和KCl琼脂溶胶的U形管,溶液不致流出来,但离子则可以在其中自由移动)。
检流计指针偏转,说明有电流通过。
从检流计指针偏转的方向可以知道电流的方向是Cu极→Zn极。
根据电流是从正极流向负极,因此,Zn极为负极,Cu极为正极。
电子从Zn极→Cu极。
2、若取出盐桥,检流计指针归零,重新放入盐桥,指针又发生偏转,说明盐桥起到了使整个装置构成通路的作用。
沿导线盐桥是怎样构成原电池中的电池通路呢?Zn棒失去电子成为Zn2+进入溶液中,使ZnSO4溶液中Zn2+过多,带正电荷。
Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO42-过多,溶液带负电荷。
当溶液不能保持电中性,将阻止放电作用的继续进行。
盐桥的存在,其中Cl-向ZnSO4溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。
盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触。
4、电极名称及其判断:(1)根据电极材料:两种金属(或金属与非金属)组成电极,若它们都与(或都不与)电解质溶液单独能反应,则较活泼的金属作负极;若只有一种电极与电解质溶液能反应,则能反应的电极作负极。
原电池教案(优秀3篇)

原电池教案(优秀3篇)(经典版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的经典范文,如工作资料、求职资料、报告大全、方案大全、合同协议、条据文书、教学资料、教案设计、作文大全、其他范文等等,想了解不同范文格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of classic model essays, such as work materials, job search materials, report encyclopedia, scheme encyclopedia, contract agreements, documents, teaching materials, teaching plan design, composition encyclopedia, other model essays, etc. if you want to understand different model essay formats and writing methods, please pay attention!原电池教案(优秀3篇)在教学工作者开展教学活动前,就不得不需要编写教学设计,借助教学设计可以更好地组织教学活动。
化学 人教版选修教学设计: 原电池

问题实验探究【环节2实验探究学习新知】【设疑】如何避免氧化剂和还原剂直接接触?【设疑】分开的装置如何构成闭合回路?【设疑】如何设计离子通道?提供的实验用品CuSO4溶液分开在两个不同的区域。
【分析讨论】用导线将两装置连接。
【探究实验二】设计装置并进行实验通过实验学生发现该装置不能构成原电池。
【分析讨论】得出是内电路出了问题,并想到原电池的内电路靠的是离子的定向移动形成电流,而导线不能传导离子。
【讨论】可以通过“连隧道”或“搭桥”的方式连接电解质溶液提供离子通道。
【实验】学生使用浸有饱和KCl溶液的滤纸搭桥做实验,产生电流。
【探究实验三】盐桥电池通过教师设疑引导学生一步步解决问题。
培养学生发现问题、解决问题的能力。
培养学生分析问题、解决问题的能力。
学习新知实验创教师进一步指出实验室中常用盐桥构成闭合回路,并向学生介绍盐桥。
【模型建构】双液原电池【环节3实验创新突破定式】【膜结构电池】基于盐桥在原电池的作用,引出膜结构电池。
【学习新知】盐桥中阴阳离子的定向移动构成了内电路。
该原电池有锌半电池和铜半电池共同组成。
【探究实验四】创新盐桥设计利用装有半U型管饱和KCl溶液的琼胶进行实验。
交流感受。
引出新知识认识到盐桥在该装置中的重要作用建立双液原电池的模型培养了学生的创新思维能力学生对盐桥的作用有了更加全面的认识。
回顾电池发展史,激发学生学习兴趣,感受原电池原理应用于化学电源开发的关键作用。
展望未来电池发展,激发学生的爱国情感,激励学生研发属。
原电池教学案例(五篇模版)

原电池教学案例(五篇模版)第一篇:原电池教学案例原电池原理的教学案例一、教学背景1,学生:中学2,学科:化学 3,课时:1 4,准备实验材料: 桔子锌片铜片电线小灯泡二、教学目标知识目标1、了解并掌握原电池形成的原理及原电池的定义。
2、能利用实验进行探究原电池形成的条件。
3、能利用所学知识进行知识的运用。
能力目标培养学生利用化学实验进行探究原电池原理和形成条件的能力。
情感、态度目标引导学生通过化学实验对原电池原理进行探究,培养学生的动手能力和相互合作精神及科学探究问题的能力。
三、探究重点初步认识原电池概念、原理、组成及应用。
四、探究难点通过对原电池实验的研究,引导学生从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。
五、教学方法思考探究观察分析:实验教学,合作探究,分析讨论,总结归纳。
六、探究过程【引入】电池与我们的生活息息相关,在生活中哪些地方会用到电池?(学生踊跃回答)电池对我们的生活如此重要,那么你知道世界上第一个电池是谁发明的吗?告诉大家世界上第一个电池是意大利物理学家伏打于1799年发明的,又称伏打电池,也就是今天我们要学习的原电池【提问]原电池的工作原理是什么呢?【展示】西红柿电池。
(观看趣味实验,激发探究原电池工作原理的欲望。
)【转引】下面我们通过分组实验探究原电池的工作原理【实验探究】介绍实验桌上的物品,指导学生做以下三个实验:实验1:把一块锌片插入盛有稀硫酸的烧杯里。
测量溶液的温度,分析能量变化情况实验2:把一块铜片插入盛有稀硫酸的烧杯里。
实验3:把铜片和锌片用导线连起来插入稀硫酸的烧杯里。
要求同学认真观察现象,并思考原因【学生回答】1、锌片上有气泡,因为锌能和稀硫酸反应放出氢气化学能转化为热能2、铜片上没有气泡,因为铜不能和稀硫酸反应3、铜片上有气泡【教师设疑】铜不与稀硫酸反应,铜片上的气体是哪里来的?【学生讨论】学生激烈讨论的焦点问题有:1、铜片上的气体是什么?2、氢离子转变为氢气所需的电子从何而来?3、锌片有什么变化?溶液中氢离子浓度发生了什么变化?讨论结果:锌失去的电子通过导线转移到铜片上,氢离子在铜片上得电子转变为氢气【引导】怎样通过实验来证明锌片上的电子是否通过导线转移到了铜片上?【学生回答】在铜片和锌片中间连接一个灵敏电流计,检测有无电流【实验验证】在连接锌片和铜片的导线中接入一个灵敏电流计。
新人教版选修4-原电池教案

× 第四章 電化學基礎§4.1 原電池一、探究目標體驗化學能與電能相互轉化的探究過程二、探究重點初步認識原電池概念、原理、組成及應用。
三、探究難點通過對原電池實驗的研究,引導學生從電子轉移角度理解化學能向電能轉化的本質,以及這種轉化的綜合利用價值。
四、教學過程【引入】電能是現代社會中應用最廣泛,使用最方便、污染最小的一種二次能源,又稱電力。
例如,日常生活中使用的手提電腦、手機、相機、攝像機……這一切都依賴於電池的應用。
那麼,電池是怎樣把化學能轉變為電能的呢?我們這節課來一起復習一下有關原電池的相關內容。
【板書】§4.1 原電池一、原電池實驗探究講:銅片、鋅片、硫酸都是同學們很熟悉的物質,利用這三種物質我們再現了1799年義大利物理學家----伏打留給我們的歷史閃光點!【實驗探究】(銅鋅原電池) 實 驗 步 驟現 象 1、鋅片插入稀硫酸2、銅片插入稀硫酸3、鋅片和銅片上端連接在一起插入稀硫酸【問題探究】1、鋅片和銅片分別插入稀硫酸中有什麼現象發生?2、鋅片和銅片用導線連接後插入稀硫酸中,現象又怎樣?為什麼?3、鋅片的品質有無變化?溶液中c (H +)如何變化?4、鋅片和銅片上變化的反應式怎樣書寫?5、電子流動的方向如何?講:我們發現檢流計指針偏轉,說明產生了電流,這樣的裝置架起了化學能轉化為電能的橋樑,這就是生活中提供電能的所有電池的開山鼻祖----原電池。
【板書】(1)原電池概念:學能轉化為電能的裝置叫做原電池。
問:在原電池裝置中只能發生怎樣的化學變化?學生: Zn+2H +=Zn 2++H 2↑講:為什麼會產生電流呢?答:其實鋅和稀硫酸反應是氧化還原反應,有電子的轉移,但氧化劑和還原劑熱運動相遇發生有效碰撞電子轉移時,由於分子熱運動無一定的方向,因此電子轉移不會形成電流,而通常以熱能的形式表現出來,激烈的時候還伴隨有光、聲等其他的形式的能量。
顯然從理論上講,一個能自發進行的氧化還原反應,若能設法使氧化與還原分開進行,讓電子的不規則轉移變成定向移動,便能形成電流。
选修4原电池教案

选修4原电池教案篇一:人教版高二化学选修4《原电池》教学设计[精华] - 副本人教版高二化学选修4《原电池》教学设计海口市灵山中学—化学组—柯劲松一、设计思想:本节课的的教材依据是人教版高二年级选修4第四章第一节《原电池》,原电池是把化学能转化为电能的装置,也是化学与能源联系的很关键的内容,这些知识不但能让学生大开眼界,而且还为环境,能源与可持续发展提供良好的教学内涵,所以这部分知识是应该以全新的教学理念进行这部分知识的教学。
在设计本节课教学时遵循新课改的理念,引导学生从高一所学习过的原电池的概念,组成要素引入课程,上课过程中,注重与学生的沟通和交流,让课堂成为学生自主设计和自主学习、自主探究的环境。
本节课采用“实验操作—分析讨论—得出结论”的学习方法,在实验探究中学习原电池的工作原理和盐桥的的作用,让学生在“做中学”。
二、教材分析:1、教材地位:本节是在高一电化学基础知识的基础上,深入学习原电池的工作原理。
○1原电池的工作原理○2能量的转换重点内容○3电极反应式及总反应式○4盐桥的作用○5原电池的用途2、教材作用:通过对原电池工作原理的学习之后,学生形成一个将氧化还原反应、能量转换、元素化合物知识、电解质溶液,金属腐蚀和防护、电解原理和有关计算等知识联系起来的知识网络。
对培养学生从实践到理论,又从理论到实践的认知规律的提高有很大的作用。
而且原电池在实际生活、工农业生产、科学研究中应用十分广泛,因此学好本节知识,具有比较重要的理论意义和现实意义。
三、学情分析:本节教材,不仅仅是前面必修课学习的复习,更重要的是学习的角度有了一定的变化,从能量的角度、从电流产生的本质以及最后的应用两方面进行了编排,应该说符合认知规律,既是复习旧知,又是加深学习,提升能力。
虽然学生的学习有了知识与能力的基础,但是必修课中学习经过较长的时间,学生对知识淡忘了较多,所以要进行教学还是有一定的难度,但学生对于这方面的学习兴趣还是非常浓厚的,应该利用好这一点。
化学 人教版选修教学设计: 原电池

1、(2)通过原电池的探究实验,体验科学探究的艰辛与愉悦,增强为人类的文明进步学习化学的责任感和使命感,同时激发学生的学习兴趣与投身科学追求真理的积极情感。
四、教学环境
三、教学目标
1知识与技能
(1)理解原电池的工作原理、组成及应用;
(2)能根据原电池的原理设计简单的原电池并能解决原电池的有关问题。
2过程与方法
(1)通过实验探究培养学生的观察能力、分析思维能力和动手;
(2)通过反应物之间电子的转移的回顾,理解原电池的形成是氧化还原反应的本质的拓展和运用。
3态度情感与价值观
铜(正极)2 H++2e=H2↑(铜板上冒出气泡,发生还原反应)
【引导分析】原电池中电子流动与电流的方向与电极是什么样的关系
【动画模拟】铜锌原电池中电子与电流的方向及其与电极的关系
【分析与讨论进行模拟,使之直观形象(要提醒学生只是按本课的需要进行模拟,事实并非完全如此)
拓展延伸
【引导拓展】
上述实验装置有无将化学能转化为电能
【引导分析】
从能量转化的角度看,下图的装置起到什么样的作用
【板书】原电池
原电池——把化学能转变成电能的装置
【观察并思考】通过讨论得出初步结论
引导学生探究出化学能转化为电能的可行性及条件
合作探究
【引导探究活动】
问题:形成原电池都需要哪些条件?通过实验来探究
【指导实验】装置如下图
【演示实验】在烧杯中盛有稀H2SO4溶液,放入Cu丝,Ag丝用导线联结后,观察电流计指针位置有无变化
【拓展】能否用一种较活泼金属和石墨(惰性电极)组成电极?电解质溶液都包括哪些
人教版化学选修四第四章第一节原电池学案

Z nC u × 课题:第四章第一节 原电池【学习目标】知识目标:能记住原电池概念、原理、组成及应用能力目标:能说出化学能与电能相互转化的过程【学习重点、难点】通过对原电池实验的研究,从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。
【学习过程】 自学教材P71~72,完成学案.【课始检测】1、原电池是______________________的装置。
原电池反应的本质是____________反应。
2、如右图所示,组成的原电池,写出电极名称、电极反应式:(1)当电解质溶液为稀H 2SO 4时:(2)当电解质溶液为CuSO 4溶液时:【学习新知识】一、对锌铜原电池工作原理的进一步探究【自学指导一】观察实验4-1,说出实验现象。
【思考与交流】:上述原电池装置是将 反应的化学能转换成电能的,指出电池的正负极,并分别写出其中负极和正极的电极反应式以及该电池的总反应方程式。
负极( 片):正极( 片):电池反应(总化学方程式):【思考与交流】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?[附:盐桥制法:1)将热的琼胶溶液倒入U 形管中(注意不要产生裂隙),将冷却后的U 形管浸泡在KCl 或NH 4NO 3的饱和溶液中即可。
2)将KCl 或NH 4NO 3的饱和溶液装入U 形管,用棉花堵住管口即可]产生持续、稳定的电流的原因 . 盐桥的作用 .二、由两个半电池组成原电池的工作原理(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用较强的物质作为负极,负极向外电路提供电子;用较强的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向移动而形成内电路。
【尝试练习1】:锌铜原电池产生电流时,阳离子()A.移向Zn极,阴离子移向Cu极 B.移向Cu 极,阴离子移向Zn 极C.和阴离子都移向Zn极 D.和阴离子都移向Cu 极(2)探究组成原电池的条件(2)组成原电池的条件(1)。
人教版选修4第一节《原电池》学案

人教版选修4第一节《原电池》学案4章电化学基础第一节原电池学习目标1.了解原电池的工作原理。
2.能表示电极反应式和电池反应方程式。
3.能设计原电池装置。
学习重点:①原电池原理及构成条件;②原电池电极反应方程式的书写;学习难点原电池电极反应方程式的书写感悟教材学与思原电池装置,是借助将能转化为能的装置。
a是极,b是极,外电路电子由电极通过导线流向电极,请分别写出电极反应式和总反应方程式:a极:;b极:;总反应方程式:。
问题探究1:盐桥内盛放的是什么物质?其作用是什么?二、原电池工作原理1.原电池工作原理是把反应分开进行,还原剂在极上失去电子发生反应,电子通过导线流向极,氧化剂在极上得到电子发生反应。
2.原电池形成的条件(1) 电极,其中一个相对来说较活泼,另一个相对来说较不活泼。
(2) 溶液。
(3)形成。
(4)能自发地发生反应。
3.原电池电极及电极反应特点(1) 极为电子流出极,相对活泼。
通常是活动性较强的金属或某些还原剂,电极被,发生反应。
(2) 极为电子流入极,相对不活泼,通常是活动性较差的金属或非金属导体,一般是电解质溶液中的氧化性较强的离子被还原或电极上附着物本身被,发生反应。
问题探究2:如何判断一个装置是否是原电池?核心突破 导与练原电池的判定先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池;然后依据原电池的形成条件分析判断,主要是“四看”:一看电极——两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极)。
二看溶液——两极插入电解质溶液中。
三看回路——形成闭合回路或两极直接接触。
四看本质——有无自发的氧化还原反应发生。
特别提醒:多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。
例 1 如图所示的番茄水果电池中外电路上的电流从电极X 流向(A 线所连接的电极)电极Y(B 线所连接的电极),若X 为铁,则Y 可能是( ) A .镁 B .铜 C .石墨 D .铂 变式训练:一个原电池反应的离子方程式是Zn +Cu2+===Zn 2++Cu ,该原电池的正确组成是( )要点二 原电池正负极的判断方法 1.由组成原电池的两极材料判断较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
人教版高中化学选修四41《原电池》第一课时教案

人教版高中化学选修四41《原电池》第一课时教案教案名称:人教版高中化学选修四《原电池》第一课时教案一、教学目标1. 让学生了解原电池的概念、组成和分类。
2. 使学生掌握原电池的工作原理及其能量转化过程。
3. 培养学生运用化学知识解决实际问题的能力。
二、教学内容1. 原电池的概念2. 原电池的组成和分类3. 原电池的工作原理4. 原电池的能量转化过程三、教学重点与难点1. 教学重点:原电池的概念、组成、分类和工作原理。
2. 教学难点:原电池的能量转化过程。
四、教学方法1. 采用问题驱动法,引导学生主动探究原电池的相关知识。
2. 利用多媒体课件,形象直观地展示原电池的工作原理和能量转化过程。
3. 结合实例分析,让学生体会化学知识在生活中的应用。
五、教学步骤1. 引入新课1.1 展示干电池、燃料电池等日常生活中的原电池实例,引导学生关注原电池的应用。
1.2 提问:什么是原电池?原电池是如何工作的?2. 讲解原电池的概念2.1 讲解原电池的定义:原电池是一种能够将化学能直接转换为电能的装置。
2.2 强调原电池的特点:自发的氧化还原反应、两极性、闭合回路。
3. 介绍原电池的组成和分类3.1 讲解原电池的组成:负极、正极、电解质、导线。
3.2 介绍原电池的分类:酸性电池、碱性电池、中性电池、燃料电池等。
4. 讲解原电池的工作原理4.1 展示原电池工作原理的示意图,讲解负极和正极的反应过程。
4.2 强调电子转移和离子迁移在原电池工作中的重要性。
5. 分析原电池的能量转化过程5.1 讲解化学能转化为电能的过程:氧化还原反应、电子转移、离子迁移。
5.2 举例说明原电池在实际应用中的能量转化过程。
6. 巩固知识,解决问题6.1 提问:原电池的工作原理和能量转化过程有哪些实际应用?6.2 让学生结合生活实例,分析原电池的工作原理和能量转化过程。
7. 课堂小结7.1 回顾本节课所学内容,总结原电池的概念、组成、分类和工作原理。
人教版选修化学反应原理原电池教学设计

第四章电化学基础第一节原电池一、教材分析本节课的教学内容“原电池”,是人教版《普通高中课程标准实验教科书化学选修 4 化学反应原理》中第四章电化学基础的第一节内容。
高中选修阶段的化学学习,是在必修的相关知识的基础上加以进一步的提高深化。
电化学这一章属化学能的转化知识范畴,之所以将化学能与电能的转化和化学能与热能的转化分列选修课本的第一章和最后一章,一方面是由于从学习内容的难易程度上来看,化学能与热能的转化相对简单,学生在初中和高中必修阶段都有了较多的涉及且有比较丰富的生活经验,而电化学部分相对显得抽象,学生理解起来存在困难,比较难以掌握。
另一方面,电化学一章的知识有涉及到弱电解质的相关内容,因此将其安排在了全书的最后一章。
选修阶段的电化学部分的内容为学生提供了一个较为完整和系统的电化学原理相关知识,也为学生理解和运用电化学的知识奠定了基础。
另一方面课本将实验探究充分融入到理论知的学习过程当中,让学生经历科学探究的过程,为学生进一步提高科学探究能力创设了平台。
同时,也充分联系原理在实际生产生活中的运用,让学生体会到化学的有用性,体验科学、技术、社会与环境的密切关系,达到提高学生科学素养的目标。
学生在本节课的学习中,课本从学生已有的知识基础入手,进一步深化巩固原电池的工作原理及其构成条件,并随之引入盐桥的概念,结合实验探究和理论探究,学习盐桥的作用,并从围观本质上学习掌握盐桥的工作原理。
之后,在教师引导下让学生学会判断原电池的正负极和正确书写电极反应方程式。
同时,也进一步让学生了解原电池的本质及其实质应用,为后续较为深入地学习化学电源、燃料电池等打下基础。
二、学情分析学生此前通过必修阶段的电化学部分知识的学习,已经初步掌握了原电池的定义、工作原理和构成条件。
同时,对于原电池的实验操作的相关技能和规范也有了了解,可以说对原电池的学习已经有了一定的基础。
同时,作为高二理科班的同学也有相对较强的实验观察能力、科学研究能力和问题分析能力,对化学的学习也有较为浓厚的兴趣,尤其是对于与“电”,这一日常生活中最常见元素之一的知识的学习,更容易激发学生探究思考,并进一步学习理论知识的热情。
人教选修4原电池教学设计

人教选修4原电池教学设计【教学目标】1.了解电池的基本概念和工作原理;2.掌握电池的使用方法和注意事项;3.能够通过实验探究电池的特性和使用规则;4.培养学生观察、实验、分析和解决问题的能力。
【教学重点】1.电池的基本概念和工作原理;2.电池的使用方法和注意事项;3.通过实验探究电池的特性和使用规则。
【教学难点】1.电池的工作原理和化学反应过程;2.分析实验结果,总结电池的特性和使用规则。
【教学准备】实验器材:干电池、镍镉电池、锂电池、醋酸、铜片、纸巾等;实验设备:万用表、灯泡等;教学材料:电池的工作原理和使用方法的PPT,实验操作指导书等。
【教学过程】一、导入(10分钟)1.利用PPT介绍电池的基本概念和作用,引发学生对电池的兴趣。
2.提问:大家平时使用电池的经验有哪些?电池有哪些不同类型?请举个例子说明。
二、讲解(20分钟)1.电池的工作原理:通过化学反应产生电能。
结构上由正极、负极和电解质组成。
2.电池的化学反应:以干电池为例,将电池的正负极分别与铜片和纸巾接触,浸泡在醋酸中,实验观察放电现象。
3.电池的电压和电流:电压是电能转化为另一种形式的能力,电流是电荷流动的速度。
4.电池的注意事项:不要将电池短路,避免过度充放电,及时更换电池等。
三、实验操作(20分钟)1.实验一:比较不同类型电池的电流大小。
材料:干电池、镍镉电池、锂电池、万用表、灯泡。
方法:将不同类型的电池串联,连接到灯泡两端,测量灯泡亮度。
结果:干电池亮度较弱、镍镉电池亮度适中、锂电池亮度较强。
2.实验二:测量电池的电压。
材料:干电池、万用表。
方法:将万用表的正负极分别接触电池的正负极,测量电压。
结果:干电池电压约为1.5V,符合标称电压。
四、实验结果分析(15分钟)1.从实验一结果中,我们可以发现不同类型电池的电流大小不同,主要取决于电池的化学反应过程和结构设计。
2.从实验二结果中,我们可以验证电池的电压与标称电压基本相符,说明电池的设计和制造工艺成熟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 电化学基础
第一节 原电池
课前预习学案
一、预习目标
预习预习醛的结构以及物理和化学性质初步学会书写相关反应方程式。
二、预习内容
温故而知新1:如右图回答问题:
1、定义:把 转换为 的装置。
2、写出Zn 片和Cu 片上发生的电极反应和电池总反应
负极:
正极:
总反应:
3、图上注明外电路中的电子流向。
内电路:阳离子向_______极移动,阴离子向_______极移动。
4、原电池反应本质: 反应。
温故而知新2:判断下列装置能否形成原电池
形成原电池的条件:
1、___________________________________________
2、___________________________________________
3、___________________________________________
H 2SO
4
CuSO
ZnSO 4 CuSO
4 酒精
CuSO 4
课内探究学案
一、学习目标
1. 掌握构成原电池的条件
2. 理解原电池的原理
3. 学会原电池的正负极及电极反应式的书写方法
学习重难点:原电池的原理
二、学习过程
一、原电池
1、原电池的构成条件
实验探究:Zn与Cu插入稀硫酸的现象与解释(表1)
(1)原电池的概念:将能转化为能的装置。
(2)写出上面原电池负极和正极的电极反应式和原电池总反应。
负极(Zn):
正极(Cu):
总反应(离子方程式)
探究:以下装置哪些能构成原电池,哪些不能构成原电池,并说明理由。
(3)构成原电池的条件
①。
电极名称:极电子流向,发生反应,材料活泼性
极电子流向,发生反应,材料活泼性
②。
外电路:电子从极流向极,电流从极流向极。
内电路:阴离子移向极,阳离子移向极,电流从极流向极。
③。
电解质溶液作用:。
④。
2、原电池的工作原理
反应过程中,极失电子,发生反应,电子经导线流向极,电解质溶液电离出的离子在该极得电子,发生反应。
科学探究1:
科学探究2 :
新知识梳理:
分析:(1)比较这两个装置哪个能够持久、高效的放电?
(2)装置②中的实验现象:
a、有盐桥时电流计指针
b、锌片逐渐
c、铜片
d、取出盐桥后,电流计指针
(3)写出装置②中电极反应式和原电池的总反应。
(4)分析盐桥的作用:①。
②。
当堂检测:
1、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则这四种金属的活动性顺序由大到小为
A.A>b>c>d B.A>c>d>b
C.C>a>b>d D.B>d>c>a
2、如图4—14所示的装置能够组成原电池且产生电流的是
3、用Cu + 2AgNO3 = Cu(NO3)2 +2 Ag设计原电池,画出装置图,并写出电极反应式。
课后练习与提高
一、选择题
1.下列各组成金属和溶液,能组成原电池的是()
A. Cu、Cu、稀硫酸
B. Zn、Cu、稀硫酸
C. Cu、Zn、酒精
D. Zn、Cu、CuSO4溶液
2.有a、b、c、d四种金属。
将a与b用导线联接起来,浸入电解质溶液中,b不易腐蚀。
将a、b分别投入等浓度盐酸中,d比a反应剧烈。
将铜浸入b的盐溶液里,无明显变化。
如果把铜浸入c的盐溶液里,有金属c析出。
据此判断它们的活动性由强到弱的顺序是
( )
A. dcab
B. dabc
C. dbac
D. badc
3.在稀硫酸中放入一块镀层严重损坏的白铁片,放出气体的速率是()
A.时快时慢
B.先慢后快
C.先快后慢
D.保持不变
4.将铁片和银片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,下列各叙述正确的是( )
A. 负极有Cl-逸出,正极有H+逸出
B. 负极附近Cl-的浓度减小
C. 正极附近Cl-的浓度逐渐增大
D. 溶液中Cl-的浓度基本不变
5.把铁钉和碳棒用铜线联接后,浸入0.01 mol / L的食盐溶液中,可能发生的现象是( )
A.碳棒上放出氯气
B. 碳棒近旁产生OH-
C. 碳棒上放出氧气
D. 铁钉上放出氢气
E. 铁钉被氧化
6.钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A. 2H++2e-=H2
B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH-
D. Fe3++e-=Fe2+
7.某原电池的总反应是Zn +Cu2+=Zn2++Cu,该原电池的正确组成是( )
A. B. C. D.
正极Zn Cu Zn Cu
负极Cu Zn Cu Zn
电解质溶液CuCl2CuCl2ZnCl2ZnCl2
8.钢铁发生电化学腐蚀时,负极发生的反应是()
A. 2H++2e → H2
B. 2H2O+O2+4e→ 4OH-
C. Fe―2e→ Fe2+
D. 4OH-―4e→ 2H2O+O2
9.等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是( )
10.氢氧燃料电池是一种污染小,效率高的新型化学电源,可应用于航天器上。
其总反应的化学方程式为:2H2+O2=2H2O 该电池的负极反应式为可表示为( )
A. 2H+-4e-=4H+
B. 4H++4e-=2H2
C. 2H2O+O2+4e-=4OH-
D. 4OH--4e-=2H2O+O2
二、填空题
1.有人将铂丝插入氢氧化钾溶液中作电极,又在两个极片上分别通入甲烷和氧气则形成电池,从而设计出一种燃料电池。
该电池中通甲烷的铂丝为______极,发生的电极反应为
____________________________________________;该电池工作时(放电)的总化学方程式为
__________________________________________;电池工作时溶液的pH值将(填“不变”、“变大”、“变小”)_____________。
2.有人设计以Pt和Zn为电极材料,埋入人体内作为某种心脏病人的心脏起博器的能源。
它依靠人体内体液中含有一定浓度的溶解氧、H+和Zn2+进行工作。
请写出两极反应的方程式。
正极______________________________,负极_________________________。
