免疫检查点抑制剂的抗体药总结
免疫检查点抑制剂相关生物标志物汇总

免疫检查点抑制剂相关生物标志物汇总免疫检查点抑制剂原理T细胞活化需要两个信号:①MHC呈递的免疫原性肽抗原能与TCR结合;②共刺激,通过将T细胞共刺激表面受体CD28连接到专业抗原呈递细胞(APCs)表面的配体CD80(B7-1)和CD86(B7-2)转导。
(CTLA-4与CD28竞争结合CD80和CD86,CTLA-4可抑制T细胞活化,CD28可激活T细胞活化)。
T细胞杀伤识别杀伤肿瘤细胞的过程中,PD-1与其配体PD-L1的结合会抑制TCR下游的信号传递,从而阻断了信号1。
PD-L1经常在肿瘤或肿瘤微环境中表达。
因此,PD-1靶向或PD-L1靶向抗体疗法可以在肿瘤部位重新激活“疲惫”的T细胞。
▲ 免疫检查点抑制剂的原理免疫检查点就好像是一个关卡,告诉免疫系统是该继续杀,还是“下班休息”。
肿瘤细胞正是利用了免疫检查点的指挥功能,让机体的免疫系统一直处于“下班休息”的状态,不能正常工作。
免疫检查点抑制剂正是通过抑制肿瘤细胞发出的“下班休息”的信号,恢复免疫系统的正常工作,进而对肿瘤细胞发动进攻。
免疫检查点抑制剂主要包括CTLA-4抑制剂与PD-(L)1抑制剂,主要针对免疫T 细胞激活过程中的两个关键免疫检查点通路:CTLA-4/B7-1/2和PD-1/PD-L1。
免疫检查点抑制剂是通过激活T细胞发挥抗肿瘤作用,影响其疗效的因素可以大致分为两类:①与激活T细胞相关的肿瘤基因组特征,包括激活T细胞的新生抗原、产生新生抗原的体细胞突变、决定抗原提呈的HLA、识别新生抗原的TCR等;②与肿瘤相互作用的免疫微环境,包括肿瘤中PD-L1表达、T细胞浸润以及其它免疫细胞等。
免疫检查点抑制剂40种生物标志物在免疫检查点抑制剂的所有的生物标志物中,TMB、PD-L1表达和dMMR/MSI是经过三期临床试验验证的,在临床上使用比较普遍:1. TMB可以预测ICIs 疗效,并且可以作为泛癌种免疫治疗的标志物(正相关)。
肿瘤免疫治疗中的免疫检查点抑制剂

肿瘤免疫治疗中的免疫检查点抑制剂近年来,肿瘤免疫治疗在癌症治疗领域中引起了广泛的关注和研究。
在肿瘤发展的过程中,免疫检查点抑制剂作为一种新型的治疗手段,正逐渐展现出其独特的价值和潜力。
本文将对肿瘤免疫治疗中的免疫检查点抑制剂进行深入探讨。
一、免疫检查点抑制剂的概念与作用机制免疫检查点抑制剂是一类可以激活机体免疫系统,增强对肿瘤细胞的识别和消除能力的药物。
它的作用机制基于对免疫系统中的抑制性信号途径进行干预,以增强正常免疫应答。
免疫检查点抑制剂主要通过抑制免疫检查点分子与相应的配体结合,从而刺激T细胞的活化和增强免疫应答。
二、免疫检查点抑制剂的应用及疗效免疫检查点抑制剂已经被证实在多种恶性肿瘤的治疗中具有显著的疗效。
例如,抗CTLA-4单克隆抗体和抗PD-1/PD-L1单克隆抗体已经成功应用于黑色素瘤、肺癌、肾癌等多种癌症治疗中。
它们可通过激活机体免疫系统,增强对肿瘤细胞的杀伤能力,从而达到抗癌的效果。
三、免疫检查点抑制剂的副作用及安全性尽管免疫检查点抑制剂在肿瘤治疗中取得了显著的突破,但其副作用也不容忽视。
常见的副作用包括免疫相关性皮炎、肝炎、胃肠道反应等。
此外,免疫检查点抑制剂还可能引发免疫介导的器官毒性反应,如免疫介导的甲状腺炎、免疫性肺炎等。
因此,在使用免疫检查点抑制剂进行治疗时,需要密切监测患者的不良反应并及时进行干预。
四、免疫检查点抑制剂的发展前景免疫检查点抑制剂作为肿瘤免疫治疗的重要组成部分,其发展前景十分广阔。
目前,许多研究机构正在进行与免疫检查点抑制剂相关的研究,以深化对其作用机制和应用范围的理解。
未来,随着研究的不断深入,我们可以预见,免疫检查点抑制剂将在肿瘤治疗中发挥越来越重要的作用,为患者提供更加有效的治疗手段。
五、结语肿瘤免疫治疗中的免疫检查点抑制剂作为一种新型的疗法,已经在多种癌症治疗中取得了显著的疗效。
然而,其副作用和安全性也需要高度关注和重视。
为了更好地应用免疫检查点抑制剂进行肿瘤治疗,我们需要进一步加强研究,并制定出科学合理的用药策略。
抗肿瘤免疫检查点抑制剂的作用机制及其在临床治疗中的应用

抗肿瘤免疫检查点抑制剂的作用机制及其在临床治疗中的应用癌症,这个让人闻之色变的词汇,一直是医学界努力攻克的难题。
随着科技的进步,抗肿瘤免疫检查点抑制剂的出现,为癌症治疗带来了新的希望。
那么,这些神奇的药物是如何发挥作用的呢?它们又如何在临床治疗中大放异彩呢?今天,我们就来深入探讨一下这个话题。
一、作用机制1.1 T细胞活化的基本原理要想了解抗肿瘤免疫检查点抑制剂,我们得先知道T细胞是怎么工作的。
T细胞是免疫系统的重要成员,就像人体内的“警察”,负责识别并消灭异常细胞,比如癌细胞。
但是,T细胞可不是随便就干活的,它需要接收到“敌人”的信号才会行动。
这个信号就是抗原。
当T细胞遇到带有特定抗原的细胞时,它会识别这个抗原,并开始准备攻击。
1.2 免疫检查点的作用T细胞的活化并不是一帆风顺的。
为了防止T细胞误伤友军或者过度活跃导致自身免疫性疾病,人体内还存在一套“刹车系统”——免疫检查点。
这些检查点就像是T细胞身上的“安全带”,时刻提醒它别太激动。
其中最重要的两个检查点就是CTLA4和PD1。
CTLA4主要在T细胞活化的早期阶段发挥作用,而PD1则主要在后期。
当T细胞遇到癌细胞时,这些癌细胞会通过表达一种叫做PDL1的蛋白来与PD1结合,从而给T细胞发送一个“别打了”的信号。
这样,T细胞就被抑制住了,无法发挥应有的攻击力。
1.3 抗肿瘤免疫检查点抑制剂如何解除“刹车”那么,抗肿瘤免疫检查点抑制剂是如何解除这个“刹车”的呢?其实,这些药物的原理并不复杂。
它们就像是T细胞的“鼓励师”,告诉T细胞不要害怕,尽管去攻击那些坏蛋细胞。
具体来说,抗CTLA4抗体和抗PD1/PDL1抗体就是通过阻断这些抑制性信号来激活T细胞的。
一旦这些“刹车”被解除,T细胞就会重新获得攻击力,对肿瘤细胞发起猛烈的攻击。
二、核心观点一:重塑T细胞功能,增强免疫响应抗肿瘤免疫检查点抑制剂的第一个核心作用就是重塑T细胞功能,增强免疫响应。
如前所述,这些药物能够解除T细胞的“刹车”,让T细胞重新获得攻击力。
免疫检查点抑制剂作用原理 -回复

免疫检查点抑制剂作用原理-回复【免疫检查点抑制剂作用原理】免疫检查点抑制剂(Immune Checkpoint Inhibitors)是一类新型的肿瘤治疗药物,它通过干预免疫系统中的负调节通路,激活机体自身的免疫反应,从而实现对肿瘤的攻击。
这一类药物的出现,为许多难治性癌症的治疗带来了新的希望。
本文将详细介绍免疫检查点抑制剂的作用原理,并逐步回答相关问题。
一、什么是免疫检查点抑制剂免疫检查点抑制剂是一类药物,通过抑制免疫调节通路中的负调节机制,激活机体自身的免疫反应,增强对癌细胞的攻击力。
目前已经获得批准上市的免疫检查点抑制剂主要有抗CTLA-4抗体(如伊普利莫骚、尼伐替尼等)和抗PD-1/PD-L1抗体(如帕姆单抗、露伴单抗、诺伐替尼等)。
二、免疫检查点抑制剂的作用机制2.1 免疫调节通路免疫调节通路是机体内调节免疫应答的一套复杂网络。
其中,CTLA-4和PD-1是两个重要的负调节分子。
CTLA-4主要在活化的T细胞和透明细胞中表达,通过竞争性结合到B7分子上,抑制T细胞的激活。
PD-1主要在活化的T细胞、B细胞及NK细胞中表达,与PD-L1和PD-L2结合后,抑制细胞免疫应答。
2.2 抑制负调节分子的作用免疫检查点抑制剂的主要作用是阻断CTLA-4和PD-1的抑制作用,从而激活机体免疫系统,增强免疫细胞对肿瘤细胞的攻击。
具体机制如下:(1)CTLA-4抑制:抗CTLA-4抗体能够与CTLA-4竞争性结合到B7分子上,阻止CTLA-4与其结合,从而抑制细胞因子IL-2表达的负调节信号。
这样一来,T细胞的活化和增殖就得以增强。
(2)PD-1抑制:抗PD-1/PD-L1抗体能够与PD-L1或PD-L2结合,阻止PD-1与其结合,从而解除免疫细胞的负调节作用。
这样一来,T细胞的活化和功能恢复,进一步增强抗肿瘤免疫应答。
2.3 免疫细胞的激活免疫检查点抑制剂通过抑制负调节分子的作用,激活机体中的免疫细胞,增强其对肿瘤细胞的攻击力。
癌症免疫治疗中的免疫检查点抑制剂

癌症免疫治疗中的免疫检查点抑制剂癌症是当免疫系统无法有效识别和抑制异常细胞生长时,体内细胞失控增殖的一种疾病。
而免疫检查点抑制剂则是一种用于激活患者自身免疫系统来抑制癌细胞生长的治疗手段。
本文将介绍癌症免疫治疗中的免疫检查点抑制剂的作用机制与临床应用,并探讨其在癌症治疗中的前景。
一、免疫检查点抑制剂的作用机制免疫检查点抑制剂通过抑制T细胞上的免疫检查点,从而激活免疫系统,增强对癌细胞的免疫应答。
免疫检查点是一种自我调节机制,用于防止自身免疫反应过度或持续激活。
然而,肿瘤细胞可以利用这些免疫检查点来逃避免疫系统的攻击。
免疫检查点抑制剂主要针对CTLA-4和PD-1/PD-L1通路进行干预。
CTLA-4是一种位于T细胞表面的抑制性分子,通过与B7配体结合,抑制T细胞的活化。
使用CTLA-4的抗体来阻断CTLA-4和B7的结合,可以增强T细胞的活化,进而增强对肿瘤细胞的攻击。
PD-1/PD-L1通路在肿瘤免疫逃逸中也起到重要作用。
PD-1是一种位于T细胞表面的抑制性受体,与PD-L1结合后可以抑制T细胞的活化。
癌细胞可以通过PD-L1的高表达来逃避免疫系统的攻击。
使用PD-1或PD-L1的抗体来阻断PD-1与PD-L1的结合,可以解除T细胞的抑制状态,增强对肿瘤细胞的免疫应答。
二、免疫检查点抑制剂的临床应用免疫检查点抑制剂已经在多种癌症治疗中取得了突破性的进展。
以CTLA-4抑制剂为例,该类药物已被FDA批准用于黑色素瘤和晚期结直肠癌的治疗。
PD-1和PD-L1抑制剂则被批准用于多种肿瘤类型的治疗,包括非小细胞肺癌、黑色素瘤、肾细胞癌、膀胱癌等。
临床试验结果显示,免疫检查点抑制剂在某些患者中具有持久的疗效。
例如,在非小细胞肺癌患者中,使用PD-1抑制剂与化疗相比显示出了更长的生存期和更高的总体生存率。
这些突破性的临床结果为免疫检查点抑制剂的应用提供了充分的依据。
然而,不同患者对免疫检查点抑制剂的治疗效果存在差异。
{史上最全的总结}免疫抑制剂的最全指南总结

{史上最全的总结}免疫抑制剂的最全指南总结PD-1/PD-L1免疫疗法(immunotherapy)是当前备受全世界瞩⽬、正掀起肿瘤治疗的⾰命,引领癌症治疗的变⾰,为患者带来新的希望的新⼀类抗癌免疫疗法,旨在充分利⽤⼈体⾃⾝的免疫系统抵御、抗击癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜⼒,实质性改善患者总⽣存期。
如在⿊⾊素瘤患者的临床试验中,50%的患者在12个⽉内死亡,使⽤PD-1和CTLA-4的的患者70%能存活3年以上。
已上市的PD-1截⽌⽬前,已有6种PD-1抑制剂在欧美⼏⼗个国家上市,包括3种PD-1抗体和3种PD-L1抗体。
分别是:Nivolumab(商品名Opdivo,简称O药);Pembrolizumab(商品名Keytruda,简称K药);Cemiplimab-rwlc(Libtayo);Atezolizumab(商品名Tecentriq,简称T药);Avelumab(商品名Bavencio,简称B药);Durvalumab(商品名Imfinzi,简称I药)。
在国内上市的分别是Opdivo和keytruda。
2018年是振奋⼈⼼的⼀年,两⼤PD-1治疗药物欧狄沃(Opdivo)、可瑞达(Keytruda)进⼊中国,并且在国内的价格已经有所下降,紧接着两⼤国产PD-1药物--特瑞普利单抗(拓益)、信迪利单抗(达伯舒)上市,7200元/⽀的价格可谓全球最低,让国内患者真正的看到了希望,中国的患者终于迎来了真正的免疫治疗元年!全球肿瘤医⽣⽹医学部将药物⽤药信息总结如下,供病友们参考。
药品名称⽣产商作⽤靶点FDA批准的适应症上市时间使⽤周期使⽤剂量剂型规格全球⽐价国内上市PD-1通⽤名帕博利珠单抗纳武利尤单抗特瑞普利单抗信迪利单抗商品名可瑞达欧狄沃拓益达伯舒上市时间2018年7⽉2018年6⽉2018年12⽉2018年12⽉适应症⿊⾊素瘤⾮⼩细胞肺癌⿊⾊素瘤经典型霍奇⾦淋巴瘤价格17918元9260元7200--关于PD-1癌症患者必须要知道的七点!⼀、PD-1抑制剂的疗效如何?在绝⼤多数、未经挑选的实体瘤中,单独使⽤PD-1抑制剂的有效率,其实并不⾼:10%-30%左右。
肿瘤免疫治疗中免疫检查点抑制剂的作用机制

肿瘤免疫治疗中免疫检查点抑制剂的作用机制肿瘤免疫治疗是近年来癌症治疗领域的一项重要突破。
免疫检查点抑制剂作为肿瘤免疫治疗的重要手段,已经在多种癌症治疗中取得了显著的疗效。
本文将探讨免疫检查点抑制剂的作用机制,以及其在肿瘤免疫治疗中的应用。
免疫检查点抑制剂的作用机制主要涉及免疫检查点分子和免疫细胞之间的相互作用。
在正常情况下,免疫检查点分子通过负向调节机制,限制免疫细胞的活化,以避免过度免疫反应。
然而,在肿瘤发展过程中,肿瘤细胞可以利用免疫检查点分子来抑制免疫细胞的功能,从而逃避免疫系统的攻击。
免疫检查点抑制剂通过抑制免疫检查点分子的作用,恢复免疫细胞的功能,增强免疫系统对肿瘤的攻击能力。
免疫检查点抑制剂最为广泛研究和应用的是抗CTLA-4和抗PD-1/PD-L1抗体。
CTLA-4是一种免疫检查点分子,其主要作用是抑制T细胞的活化。
抗CTLA-4抗体可以与CTLA-4结合,阻断其抑制作用,从而增强T细胞的活化和攻击能力。
PD-1和PD-L1是另一对重要的免疫检查点分子。
PD-1主要表达在激活的T细胞上,PD-L1则主要表达在肿瘤细胞和免疫细胞上。
PD-1与PD-L1结合后,可以抑制T细胞的活化。
抗PD-1/PD-L1抗体可以阻断PD-1与PD-L1的结合,恢复T细胞的活化能力。
免疫检查点抑制剂的应用已经在多种癌症治疗中取得了显著的疗效。
例如,抗CTLA-4抗体已经被广泛应用于黑色素瘤的治疗。
研究表明,抗CTLA-4抗体可以显著提高患者的生存率和治疗效果。
抗PD-1/PD-L1抗体在多种癌症治疗中也取得了显著的进展。
例如,抗PD-1抗体已经被批准用于非小细胞肺癌、黑色素瘤和肾细胞癌等多种癌症的治疗。
这些疗效的取得,使得免疫检查点抑制剂成为癌症治疗领域的一项重要突破。
然而,免疫检查点抑制剂在肿瘤治疗中仍面临一些挑战。
首先,免疫检查点抑制剂并非所有患者都能获得显著疗效。
研究表明,肿瘤的免疫微环境、免疫细胞的功能状态以及肿瘤的遗传变异等因素都会影响免疫检查点抑制剂的疗效。
免疫检查点抑制剂的免疫相关不良反应及管理

皮肤毒性的管理:
大多数检查点抑制剂皮疹可用局部皮质类固醇药膏治疗。如果瘙痒为主要症状,口服 止痒剂(如羟嗪,苯海拉明)可能会有帮助。严重皮疹(3级)应口服皮质类固醇治 疗,并应按照既定管理方案进行检查点阻滞治疗。极少数患者会出现严重皮疹,如 Stevens-Johnson综合征/中毒性表皮坏死松解症。此类反应通常需要住院治疗,静 脉注射类固醇,进行皮肤学检查并监测,警惕体液和电解质状态异常。任何未及时用 皮质类固醇药膏处理或出现起泡迹象的皮疹应立即由皮肤科医生和活检进行评估。
全身不良事件
疲劳
疲劳是最常见的副作用之一,据估计抗PD-1/PD-L1抗体治疗患者疲劳总频率 为16%-24%,约40%的患者使用的是ipilimumab治疗。轻微疲劳很常见,严 重疲劳较罕见。患者出现疲劳症状时,应排除甲状腺,垂体和其它内分泌紊乱 (如原发性肾上腺皮质功能不全)。发热、发冷和输液反应很少见。
毒性管理的一般方法
美国临床肿瘤学会(ASCO)召集多个领域的专随机对照试验和病例系列进行系统评估,制定临床实践指南。 由于缺乏免疫相关不良事件管理的高质量证据,因此所有推荐均基于专家共识:
▪ 虽然不良事件管理因器官系统而异,但ICPi治疗应密切监测1级毒性(神经学、血 液学和心脏毒性除外)。
免疫相关不良反应(irAEs)的缓解时间
免疫相关不良反应的发生时间不尽相同,但大体都在1-6个月内出现,但 大部分免疫相关不良反应是可逆的。
免疫相关不良反应(irAEs)的处理
免疫相关不良反应的缓解率差别巨大,与及时的预防、治疗关系密切。
irAE分级一般临床分为4级。通常需要停药,并给予激素及免疫相关的抑制剂去处理。 ▪ 一般1-2级irAE属于轻度,3-4级属于重度。1、2级irAE可门诊就诊,3、4级需要住院处理。 ▪ 非常轻的1级irAE,患者出现不良反应,但并没有严重影响其治疗和生活时,一般不推荐激素和 免疫抑制剂治疗。是否需要停用免疫治疗,要根据患者具体的不良反应程度和受累器官综合判断。 ▪ 2级irAE,需要口服激素,甚至静脉的、全身的激素治疗,具体给药形式可能需根据患者具体的 免疫反应和他的器官表现而定。 ▪ 比较严重的,3级和4级irAE需住院治疗,在口服的基础上,必须强调静脉应用激素或者免疫抑制 剂。特别是4级,甚至要考虑进入ICU,在全身激素治疗同时时进行相应的器官支持治疗。
免疫检查点抑制剂的免疫相关不良反应及管理

皮肤毒性的管理:
大多数检查点抑制剂皮疹可用局部皮质类固醇药膏治疗。如果瘙痒为主要症状,口服 止痒剂(如羟嗪,苯海拉明)可能会有帮助。严重皮疹(3级)应口服皮质类固醇治 疗,并应按照既定管理方案进行检查点阻滞治疗。极少数患者会出现严重皮疹,如 Stevens-Johnson综合征/中毒性表皮坏死松解症。此类反应通常需要住院治疗,静 脉注射类固醇,进行皮肤学检查并监测,警惕体液和电解质状态异常。任何未及时用 皮质类固醇药膏处理或出现起泡迹象的皮疹应立即由皮肤科医生和活检进行评估。
免疫相关不良反应(irAEs)的出现时间
对于不同部位的免疫相关毒性的出现似乎有规律可循,毒性作用出现时间一 般来说为:皮肤>胃肠炎>肝脏>肺炎>内分泌>肾脏毒性。皮肤毒性通常 用药后2-3周开始出现,胃肠道毒性通常用药后5周左右出现,肝脏和内分 泌毒性通常用药后6-7周出现。但大多数副作用不会在治疗的前四周出现。
免疫检查点抑制剂的免疫相关不良反应及管理
背景介绍
随着免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)从临床研究走向临床实 践,在关注免疫治疗疗效的同时,临床医生和患者也开始更加地关注免疫治疗相关不良反 应(irAE)。 根据一项研究发现,irAE可能比我们想象中的更加常见。该研究使用来自大量 非小细胞肺癌(NSCLC)患者的“真实世界数据”,这些患者2015年1月1日至2017年12 月31日期间接受了PD-1/L1单抗治疗。研究发现大多数irAE发生率高于之前报道的发生率, 例如垂体炎的发生率比之前报道的高了4倍。这也提示我们应该更加重视对irAE的管理。
输液相关反应
多达25%的抗PD-1/PD-L1药物治疗患者出现了轻微输注相关副作用。据报道, 严重或危及生命的输注相关反应发生率不足2%。接受avelumab治疗的患者 在前四个周期中应用对乙酰氨基酚和抗组胺药预处理,随后根据需要处理。
肿瘤免疫治疗中免疫检查点抑制剂的应用

肿瘤免疫治疗中免疫检查点抑制剂的应用免疫治疗作为肿瘤治疗新兴领域,近年来备受关注。
其中,免疫检查点抑制剂的应用产生了革命性的影响。
这些药物通过抑制肿瘤细胞与T细胞之间的相互作用,使得T细胞增强攻击肿瘤细胞的能力,从而达到减少肿瘤负荷、延长患者生存期的目的。
本文将深入探讨肿瘤免疫治疗中免疫检查点抑制剂的应用。
1. 免疫检查点抑制剂的发现历史免疫检查点抑制剂的发现具有一定的偶然性。
首先,免疫检查点的存在是早期发现的,但其具体功能不为人们所知。
2006年,美国科学家詹姆斯·艾利森发现,CTLA-4是一种可用于治疗癌症的蛋白质分子。
此后,他发现CTLA-4与B7-1和B7-2受体结合,促进了T细胞的激活。
如果抑制B7-1和B7-2,可以达到抑制T细胞激活的效果。
这种反功能启发了研究者将CTLA-4抑制剂用于肿瘤治疗。
此后,科学家们发现,这种免疫治疗方法具有很高的疗效,如在黑色素瘤治疗中,CTLA-4治疗组患者的5年总生存率从25%提高到50%。
这种发现带动了免疫治疗的研究和发展。
2. 免疫检查点抑制剂的作用原理免疫检查点抑制剂的作用原理简述如下:T细胞是免疫系统的核心细胞,能够攻击癌症细胞。
但癌症细胞具有抗体,可以抑制T细胞的免疫系统效果。
一些免疫检查点分子(例如CTLA-4和PD-1)是由癌细胞产生的,这些分子可以抑制T细胞的活动,抑制它们攻击癌症细胞。
免疫检查点抑制剂可以封锁这些分子,促进T细胞对恶性肿瘤的直接打击。
3. 免疫检查点抑制剂的种类和治疗效果目前,有多种免疫检查点抑制剂已经获得FDA批准,包括PD-1、PD-L1和CTLA-4抑制剂。
这些药物已经被证明在多种癌症治疗中有效,例如黑色素瘤、肺癌、乳腺癌、结直肠癌等等。
此外,临床试验还在进行中,研究人员正在评估免疫检查点抑制剂在其他癌症领域的治疗效果。
4. 免疫检查点抑制剂的应用限制免疫检查点抑制剂在肿瘤治疗中具有比较广泛的应用,但同时还有一定的限制。
免疫检查点抑制剂治疗的基本机制

免疫检查点抑制剂治疗的基本机制引言免疫检查点抑制剂作为一种新型的肿瘤治疗药物,近年来受到了广泛的关注。
它通过干扰肿瘤细胞与免疫系统之间的相互作用,从而增强机体的免疫应答,达到治疗肿瘤的目的。
本文将对免疫检查点抑制剂治疗的基本机制进行全面、详细、完整且深入地探讨。
免疫检查点抑制剂的作用机制免疫检查点抑制剂通过靶向免疫系统的调节分子,解除免疫系统对肿瘤细胞的抑制作用,从而恢复机体的免疫功能,并增强对肿瘤细胞的杀伤作用。
1. 免疫检查点抑制剂免疫检查点抑制剂是一类特殊的药物,它通过阻止或减少免疫检查点分子的活性,从而增强机体的免疫应答。
目前,经批准用于临床应用的免疫检查点抑制剂主要包括抗CTLA-4抗体、PD-1抗体和PD-L1抗体等。
2. CTLA-4信号通路CTLA-4是一种重要的免疫检查点分子,它主要表达在活化的T细胞的表面。
CTLA-4可以与B7分子结合,抑制T细胞的活化和增殖,从而减弱机体对肿瘤细胞的免疫杀伤作用。
免疫检查点抑制剂抗CTLA-4抗体可以与CTLA-4竞争性结合B7分子,阻止CTLA-4抑制T细胞的功能,从而增强机体免疫应答。
3. PD-1/PD-L1信号通路PD-1是另外一种重要的免疫检查点分子,它主要表达在活化的T细胞、B细胞和巨噬细胞等免疫细胞的表面。
PD-L1则是PD-1的配体,主要表达在多种免疫细胞和肿瘤细胞表面。
PD-1与PD-L1结合后可以抑制T细胞的活化和增殖,并诱导T细胞的凋亡,从而降低机体对肿瘤细胞的免疫杀伤作用。
免疫检查点抑制剂PD-1抗体和PD-L1抗体可以与PD-1和PD-L1竞争性结合,阻止PD-1和PD-L1的相互作用,从而恢复机体的免疫应答。
免疫检查点抑制剂的应用免疫检查点抑制剂已经被广泛应用于多种肿瘤的治疗中,并取得了显著的疗效。
1. 乳腺癌免疫检查点抑制剂已经被应用于乳腺癌的治疗中。
研究表明,乳腺癌患者中PD-L1的表达与预后相关。
免疫检查点抑制剂PD-L1抗体的应用可以阻止PD-L1与PD-1的结合,恢复机体对乳腺癌细胞的免疫杀伤作用。
免疫抑制剂的研究和应用

免疫抑制剂的研究和应用免疫抑制剂是一种能够抑制免疫功能的药物,被广泛应用于肿瘤、移植和自身免疫性疾病等领域。
这些药物的出现,使得许多曾经绝症无法治愈的患者有了新的希望。
本文将介绍免疫抑制剂的研究进展以及其在各个领域中的应用。
一、免疫抑制剂的研究进展免疫抑制剂最早是用于预防移植排异反应的药物,但是后来发现它们在治疗其他疾病时也有很好的效果。
随着科技的不断发展,研究人员发现各种新的免疫抑制剂并对其进行了不断的改良。
最早的免疫抑制剂是环孢素A和甲氨蝶呤。
环孢素A可通过抑制T淋巴细胞的IL-2转录和分泌,从而达到抑制免疫系统的效果。
甲氨蝶呤则是一种抑制DNA的合成,从而抑制细胞增殖的药物。
这两种药物虽然效果很好,但是它们也有一些不良反应。
在使用时,需要严格控制用药剂量和疗程,才能保证疗效和安全。
现在,研究人员已经发现了许多新的免疫抑制剂,其中包括:小分子免疫抑制剂、单克隆抗体和基因疗法等。
这些新的药物,具有更好的效果和更少的不良反应,使得免疫治疗的前景更加广阔。
二、免疫抑制剂在移植领域中的应用移植手术是治疗某些疾病的有效方法。
然而,由于移植物与宿主免疫系统之间的不兼容,容易导致排异反应。
因此,需要使用免疫抑制剂来抑制宿主免疫系统的功能,以避免排异反应的发生。
免疫抑制剂广泛用于心脏、肾脏、肝脏和肺移植等手术中。
例如,环孢素A、他克莫司、美罗华等药物,可抑制T淋巴细胞的功能,减少移植物的排斥。
然而,这些药物也会增加感染的风险,因此需要定期检查感染情况,并及时治疗。
随着免疫治疗技术的不断发展,研究人员也正在探索各种新的免疫抑制剂。
例如,利用单克隆抗体对抗免疫系统中的关键分子,能够更加有效地抑制免疫反应并减少不良反应。
三、免疫抑制剂在肿瘤治疗中的应用免疫治疗是近年来发展最快的治疗方式之一。
免疫抑制剂可以抑制肿瘤细胞的免疫逃逸机制,使免疫系统重新攻击肿瘤细胞,从而达到治疗的效果。
临床应用中主要包括两种免疫抑制剂:一种是单克隆抗体,另一种是免疫检查点抑制剂。
免疫检查点抑制剂研究进展和用药管理2023教育

免疫检查点抑制剂研究进展和用药管理2023教育引言免疫检查点抑制剂是一类新型的癌症治疗药物,通过解除免疫系统对肿瘤细胞的抑制,增强免疫系统的攻击能力,从而达到治疗恶性肿瘤的效果。
近年来,免疫检查点抑制剂取得了显著的研究进展,并已经在临床中得到广泛应用。
然而,随着研究的不断深入,对于免疫检查点抑制剂的用药管理也日益凸显其重要性。
本文将介绍免疫检查点抑制剂的研究进展,并重点探讨其用药管理的相关问题。
免疫检查点抑制剂的研究进展免疫检查点抑制剂作为一种新型的抗癌药物,具有其独特的工作机制和抗肿瘤效果。
目前已经开发出多种免疫检查点抑制剂,包括抗CTLA-4抗体、抗PD-1抗体和抗PD-L1抗体等。
这些抑制剂通过激活免疫系统中的T细胞,增强其对肿瘤细胞的攻击能力,从而达到治疗恶性肿瘤的效果。
以抗PD-1抗体为例,该类药物已经在多种恶性肿瘤的治疗中得到广泛应用。
临床研究表明,抗PD-1抗体可以显著提高患者的生存率和治疗效果。
除此之外,抗PD-L1抗体和抗CTLA-4抗体等免疫检查点抑制剂也在临床中取得了显著的疗效。
然而,免疫检查点抑制剂的研究仍面临一些挑战。
由于不同患者的免疫系统状态存在差异,对于免疫检查点抑制剂的响应也存在差异。
因此,如何进一步优化免疫检查点抑制剂的疗效,是当前研究的重要方向。
免疫检查点抑制剂的用药管理免疫检查点抑制剂的用药管理是确保患者获得最佳治疗效果的关键。
用药管理涉及免疫检查点抑制剂的选择、剂量控制、用药时间和副作用管理等方面。
首先,选择合适的免疫检查点抑制剂对于患者的治疗效果至关重要。
根据患者的具体情况和恶性肿瘤类型,医生需要综合考虑药物的疗效、安全性和经济性等因素,选择适合患者的免疫检查点抑制剂。
其次,剂量控制是免疫检查点抑制剂用药管理的重要环节。
剂量过大可能导致严重的副作用,而剂量过小则可能影响治疗效果。
因此,医生需要根据患者的具体情况和免疫检查点抑制剂的推荐用量,合理控制药物的剂量。
癌症免疫治疗中的免疫检查点抑制剂

癌症免疫治疗中的免疫检查点抑制剂随着科技的进步和医学的不断发展,癌症治疗方法也在不断改进。
传统的放化疗虽然能够有效地杀灭癌细胞,但往往也会对正常细胞造成伤害,导致患者出现种种副作用。
而免疫治疗则是一种崭新的癌症治疗方式,它通过激活人体自身的免疫系统来攻击肿瘤细胞,这种方法更为精准和有效,同时也减少了一些不必要的副作用。
在免疫治疗中,免疫检查点抑制剂是一类比较重要的药物。
那么什么是免疫检查点呢?它们是一些负责维持T细胞功能和限制自身攻击的子句,阻止自身攻击机制被不适当激活,这一过程被称为免疫检查点。
而免疫检查点抑制剂的作用就是阻止这些信号的传递,消除对T细胞的干扰,从而激活更多的T细胞参与肿瘤的清除。
免疫检查点抑制剂早期主要是用于治疗多种恶性肿瘤,包括黑色素瘤、晚期肺癌、肾细胞癌等。
最著名的免疫检查点抑制剂是IgG1抗体阻断抗原检查点的CTLA-4和PD-1。
该抗体被认为是治疗癌症的一个突破,因为它能够有效地提高患者的生存率,同时减少患者的副作用。
在免疫检查点抑制剂的治疗中,PD-1和PDL-1是非常重要的分子。
PD-1是一种负性免疫调节分子,它广泛表达于活体的T细胞和其他免疫细胞表面。
当它与其配体PDL-1或PDL-2结合时,会发出抑制性信号,从而减弱免疫细胞的攻击活性。
肿瘤细胞可以通过表达PDL-1来逃避免疫攻击,因此抑制PD-1信号路径可以减少这种逃避机制,并增强T细胞对肿瘤细胞的攻击。
免疫检查点抑制剂在治疗癌症上的效果得到了许多研究者的认可。
研究表明,免疫检查点抑制剂能够减少胃癌、肺癌、结直肠癌等多种癌症的死亡率。
同时,免疫检查点抑制剂也在一些临床研究中体现出了很好的疗效,可以帮助患者恢复体力,提高生活质量。
当然,免疫检查点抑制剂也并不是适用于所有的癌症患者。
研究表明,约20-30%的癌症患者对免疫检查点抑制剂有显著疗效,而另外约70-80%的患者则不太适合。
免疫检查点抑制剂也会引起一些副作用,包括疲劳、食欲减退、手足症候群等,严重的话还会导致免疫系统过度激活,导致自身免疫性疾病的发生。
免疫检查点抑制剂的抗体药总结
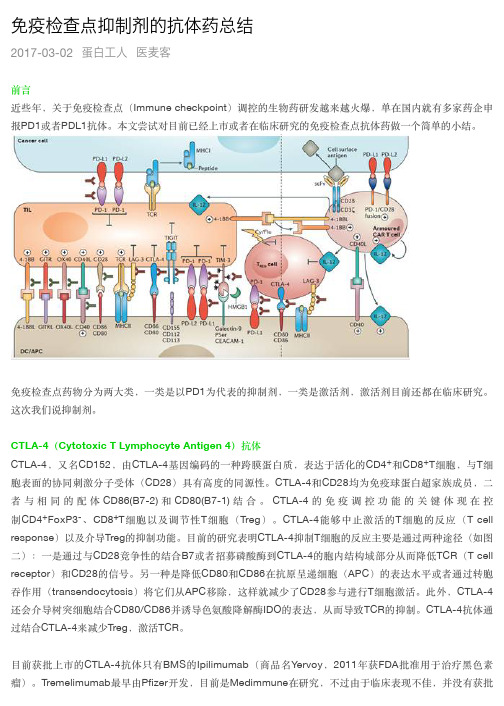
免疫检查点抑制剂的抗体药总结2017-03-02蛋白工人医麦客前⾔言近些年,关于免疫检查点(Immune checkpoint)调控的⽣生物药研发越来越⽕火爆,单在国内就有多家药企申抗体。
本⽂文尝试对⽬目前已经上市或者在临床研究的免疫检查点抗体药做⼀一个简单的⼩小结。
报PD1或者PDL1免疫检查点药物分为两⼤大类,⼀一类是以PD1为代表的抑制剂,⼀一类是激活剂,激活剂⽬目前还都在临床研究。
这次我们说抑制剂。
CTLA-4(Cytotoxic T Lymphocyte Antigen 4)抗体CTLA-4,又名CD152,由CTLA-4基因编码的⼀一种跨膜蛋⽩白质,表达于活化的CD4+和CD8+T细胞,与T细胞表⾯面的协同刺激分⼦子受体(CD28)具有⾼高度的同源性。
CTLA-4和CD28均为免疫球蛋⽩白超家族成员,⼆二者与相同的配体CD86(B7-2) 和CD80(B7-1) 结合。
CTLA-4 的免疫调控功能的关键体现在控制CD4+FoxP3-、CD8+T细胞以及调节性T细胞(Treg)。
CTLA-4能够中⽌止激活的T细胞的反应(T cell response)以及介导Treg的抑制功能。
⽬目前的研究表明CTLA-4抑制T细胞的反应主要是通过两种途径(如图⼆二):⼀一是通过与CD28竞争性的结合B7或者招募磷酸酶到CTLA-4的胞内结构域部分从⽽而降低TCR(T cell receptor)和CD28的信号。
另⼀一种是降低CD80和CD86在抗原呈递细胞(APC)的表达⽔水平或者通过转胞吞作⽤用(transendocytosis)将它们从APC移除,这样就减少了CD28参与进⾏行T细胞激活。
此外,CTLA-4还会介导树突细胞结合CD80/CD86并诱导⾊色氨酸降解酶IDO的表达,从⽽而导致TCR的抑制。
CTLA-4抗体通过结合CTLA-4来减少Treg,激活TCR。
⽬目前获批上市的CTLA-4抗体只有BMS的Ipilimumab(商品名Yervoy,2011年获FDA批准⽤用于治疗⿊黑⾊色素瘤)。
免疫学中的免疫调控疗法CART细胞治疗与免疫检查点抑制剂

免疫学中的免疫调控疗法CART细胞治疗与免疫检查点抑制剂免疫学中的免疫调控疗法CART细胞治疗与免疫检查点抑制剂是近年来备受关注的治疗癌症的新兴领域。
这两种治疗方法的出现,为许多晚期肿瘤患者提供了新的希望。
本文将介绍CART细胞治疗和免疫检查点抑制剂的基本原理和应用情况,探讨其在免疫学中的重要性和未来发展前景。
CART细胞治疗是一种个体化的免疫疗法,主要用于治疗恶性肿瘤。
该技术通过提取患者的T细胞并对其进行基因工程改造,使其表达CAR(嵌合抗原受体)蛋白。
这种CAR蛋白能够识别癌细胞特异性抗原,并激活T细胞杀伤癌细胞。
CART细胞治疗的优势在于其高度个体化和特异性,通过改变CAR蛋白的结构和亲和性,可以适应不同类型的肿瘤。
CART细胞治疗已经在治疗B细胞恶性淋巴瘤和急性淋巴细胞白血病等血液肿瘤方面取得了非常显著的临床效果。
与CART细胞治疗相比,免疫检查点抑制剂是一种能够激活患者自身免疫系统的药物。
正常情况下,机体通过调节免疫检查点分子的表达来保持免疫系统的平衡,防止自身免疫反应过度激活。
然而,某些肿瘤细胞可以通过高表达免疫检查点分子来逃避免疫攻击。
免疫检查点抑制剂的作用是通过阻断这些免疫检查点分子的相互作用,恢复患者的体液免疫应答。
目前,抗CTLA-4抗体和抗PD-1抗体是免疫检查点抑制剂中最为重要的代表性药物。
CART细胞治疗和免疫检查点抑制剂在临床应用中存在一定的利弊。
CART细胞治疗的主要副作用是细胞因子释放综合征(CRS)和神经毒性。
CRS通常在治疗后数天内发生,表现为发热、低血压、呼吸困难等。
神经毒性主要表现为颅内高压症状和急性脑脊髓炎。
免疫检查点抑制剂的副作用主要包括免疫相关性皮炎、肠道毒性和内分泌毒性等。
尽管这些治疗方法可能带来一定的不良反应,但相对于传统的化疗和放疗,其治疗效果和患者生活质量的改善还是非常明显的。
在免疫学中,CART细胞治疗和免疫检查点抑制剂的出现,不仅仅带来了对恶性肿瘤新的治疗思路,也为免疫相关疾病的治疗提供了新的契机。
最新:免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识重点内容

最新:免疫检直点抑制剂引起的内分泌系统免疫相关不良反应营家共识重点内容摘要免疫检查点抑制剂(immunecheckpointinhibitors,ICPiS)通过阻断免疫抑制分子,重新激活效应T细胞特异性杀伤肿瘤细胞的功能,发挥抗肿瘤作用。
ICPis 通过调控免疫应答杀伤肿瘤的同时,过度活化的免疫细胞也可能导致机体产生自身免疫损伤,即免疫相关不良反应(immune-re1atedadverseevents,irAEs)0内分泌不良反应是最为常见的不良反应之一,主要涉及垂体、甲状腺、胰腺、肾上腺等内分泌腺体,引起相应的内分泌功能紊乱。
ICPis致内分泌腺体损伤是临床医学技术发展带来的新问题,很多临床医生对其诊治存在诸多疑惑。
国内外虽已陆续推出多个指南/共识,但目前国内尚无针对ICPiS引起的内分泌系统免疫相关不良反应的诊治流程和共识。
为规范和提高临床诊治水平,中华医学会内分泌学分会免疫内分泌学组组织专家根据国内外专家共识和相关临床研究,综合肿瘤学、免疫学专家意见后撰写制订本共识,以供在临床实践和临床研究中参考。
一.前言免疫检查点抑制剂(immunecheckpointinhibitors,ICPiS)是目前最受瞩目的肿瘤免疫治疗药物之一,此类药物的研究和临床应用飞速发展,已获批在多种肿瘤中应用。
ICPiS通过调控免疫应答杀伤肿瘤的同时,过度活化的免疫细胞也可能导致机体产生自身免疫损伤,即免疫相关不良反应(immune-re1atedadverseevents,irAEs)o内分泌不良反应是最为常见的不良反应之一,主要涉及垂体、甲状腺、胰腺、肾上腺等内分泌腺体,引起相应的内分泌功能紊乱。
临床上诊断和治疗的延误,势必影响患者的生活质量,甚至危及生命。
因此早期识别和治疗,对于改善患者预后具有重要意义。
本共识旨在总结、吸取我国现有ICPis引起的内分泌不良反应的诊疗经验,结合我国的实际情况,综合肿瘤、免疫学专家的意见和建议,参考国际主流指南、大型临床研究结果,提高对ICPiS引起的内分泌系统不良反应的认识,倡导规范化的诊断和治疗的管理模式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫检查点抑制剂的抗体药总结2017-03-02蛋白工人医麦客前⾔言近些年,关于免疫检查点(Immune checkpoint)调控的⽣生物药研发越来越⽕火爆,单在国内就有多家药企申抗体。
本⽂文尝试对⽬目前已经上市或者在临床研究的免疫检查点抗体药做⼀一个简单的⼩小结。
报PD1或者PDL1免疫检查点药物分为两⼤大类,⼀一类是以PD1为代表的抑制剂,⼀一类是激活剂,激活剂⽬目前还都在临床研究。
这次我们说抑制剂。
CTLA-4(Cytotoxic T Lymphocyte Antigen 4)抗体CTLA-4,又名CD152,由CTLA-4基因编码的⼀一种跨膜蛋⽩白质,表达于活化的CD4+和CD8+T细胞,与T细胞表⾯面的协同刺激分⼦子受体(CD28)具有⾼高度的同源性。
CTLA-4和CD28均为免疫球蛋⽩白超家族成员,⼆二者与相同的配体CD86(B7-2) 和CD80(B7-1) 结合。
CTLA-4 的免疫调控功能的关键体现在控制CD4+FoxP3-、CD8+T细胞以及调节性T细胞(Treg)。
CTLA-4能够中⽌止激活的T细胞的反应(T cell response)以及介导Treg的抑制功能。
⽬目前的研究表明CTLA-4抑制T细胞的反应主要是通过两种途径(如图⼆二):⼀一是通过与CD28竞争性的结合B7或者招募磷酸酶到CTLA-4的胞内结构域部分从⽽而降低TCR(T cell receptor)和CD28的信号。
另⼀一种是降低CD80和CD86在抗原呈递细胞(APC)的表达⽔水平或者通过转胞吞作⽤用(transendocytosis)将它们从APC移除,这样就减少了CD28参与进⾏行T细胞激活。
此外,CTLA-4还会介导树突细胞结合CD80/CD86并诱导⾊色氨酸降解酶IDO的表达,从⽽而导致TCR的抑制。
CTLA-4抗体通过结合CTLA-4来减少Treg,激活TCR。
⽬目前获批上市的CTLA-4抗体只有BMS的Ipilimumab(商品名Yervoy,2011年获FDA批准⽤用于治疗⿊黑⾊色素瘤)。
Tremelimumab最早由Pfizer开发,⽬目前是Medimmune在研究,不过由于临床表现不佳,并没有获批治疗任何癌症。
PD-1(Programmed death-1)抗体/PD-L1抗体PD-1是表达在T细胞表⾯面的另⼀一种重要的免疫抑制跨膜蛋⽩白,为CD28超家族成员,其最初是从凋亡的⼩小⿏鼠T 细胞杂交瘤2B4.11克隆出来。
PD-1有两个配体,PD-L1(又叫CD274或B7-H1)和PD-L2(又叫CD273或B7-DC)。
PD-L1⽐比PD-L2表达更为⼴广谱,主要在造⾎血和⾮非造⾎血细胞(包括上⽪皮细胞、⾎血管上⽪皮细胞、基质细胞等)中,由促炎症细胞因⼦子(proinflammtory cytokine,包括I型和II型Interferon, TNFα以及VEGF)诱导表达。
在肿瘤的微环境中,肿瘤细胞能够表达PD-L1或者PD-L2。
这两个配体与PD-1的结合会导致PD-1的胞内结构域的酪氨酸磷酸化,并招募酪氨酸磷酸酶SHP-2,从⽽而减少TCR信号通路的磷酸化,降低了TCR通路下游的激活信号以及T细胞的激活和细胞因⼦子的⽣生成。
因此PD-1通路的抑制会加速和加强⾃自⾝身免疫。
⽬目前批准上市的PD-1抗体有Merck的pembrolizumab(商品名Keytruda)和BMS的nivolumab(商品名Opdivo)。
这两个药去年(2016年)都获得⽐比较好的销售成绩(Opdivo46亿美⾦金,Keytruda14亿美⾦金)。
⽬目前Opdivo的适应症有⿊黑⾊色素瘤、⾮非⼩小细胞肺癌(NSCLC)、肾细胞癌(renalcell carcinoma)、经典型霍奇⾦金淋巴瘤(classicalHodgkin Lymphoma)、头颈鳞状细胞癌(SquamousCell Carcinoma Of The Head And Neck)、膀胱上⽪皮癌(Urothelialcarcinoma)。
Keyruda的适应症范围相对⼩小⼀一些,主要⽤用于⿊黑⾊色素瘤(melanoma),⾮非⼩小细胞肺癌和头颈鳞状细胞癌。
其他在临床研究的PD-1抗体有Curetech的Pidilizumab和MedImmune的AMP-514(MEDI0680)。
上市的PD-L1抗体⽬目前只有Roche/Genentech的Atezolizumab(商品名Tecentriq),2016年5⽉月份获批膀胱癌,10⽉月份获批⾮非⼩小细胞肺癌,上市仅半年时间拿下销售额1.566亿美⾦金。
其他在临床研究的包括BMS的BMS936559,Astrazeneca的Durvalumab和EMDserono与Pfizer合作的Avelumab。
LAG-3(Lymphocyte Activation Gene-3)抗体LAG-3(lymphocyte activation gene 3,LAG-3,CD223)和CD4是同源蛋⽩白,但是以更⾼高的亲和⼒力与主要组织相容性复合体Ⅱ类分⼦子(major histocompatibility complex classⅡ,MHCⅡ)结合,主要表达在活化的T淋巴细胞、B淋巴细胞、⾃自然杀伤细胞(natural killer cell, NK)和浆细胞样树突状细胞(plasma cytoid dendritic cells, pDCs),并负调控T细胞功能。
研究表明LAG-3选择性地上调Treg表⾯面的CD4,因此LAG-3抗体在体内可降低Treg活性。
抑制或敲除LAG-3会解除Treg对T细胞的抑制功能。
另外,在缺少CD4+T细胞的情况下,LAG-3抗体能够增加CD8+T细胞的功能。
T细胞失能或者耗竭时会表达多种免疫检查点分⼦子,在慢性感染模型及⾃自⾝身抗原识别模型中LAG-3和PD-1通常都有共表达现象。
协调抑制LAG-3及PD-1能够增强免疫应答,因此⽬目前关于LAG-3抗体的临床试验都是单独或者与PD-1联⽤用来观察效果。
⽬目前主要有以下⼏几家公司进⾏行LAG-3的临床试验:BMS的BMS986016,Regeneron和Sanofi合作的REGN3767,Novartis的LAG525。
TIM-3 (T cell immunoglobulin-3)抗体TIM-3是TIM家族的⼀一个受体蛋⽩白,在T细胞,Treg细胞,先天免疫细胞(树突细胞、⾃自然杀伤细胞、单核细胞)表⾯面表达。
TIM-3有多种配体,如磷脂酰丝氨酸(phosphatidylserine)、半乳凝素9(galectin-9)、HMGB1和CEACAM-1。
和其他免疫检查点分⼦子不同的是,TIM-3并⾮非在所有T细胞激活后得以上调,仅在CD4+辅助T 细胞1(Th1)和 CD8+细胞毒性 T 细胞中上调,参与协同抑制作⽤用。
在由其配体galectin-9 激活后,TIM-3 会抑制效应 T 细胞的活性,并引起外周耐受。
TIM-3 在 T 细胞在肿瘤中的损耗中起着关键作⽤用。
TIM-3在⽤用抗PD-1治疗产⽣生耐药性的动物的T细胞中⾼高表达。
在独⽴立实验中,当抗TIM-3抗体与抗PD-1药物联⽤用时可抑制抗PD-1治疗耐药性的产⽣生。
⽬目前在临床试验的TIM-3抗体在仅查到Tesaro的TSR-022(⽤用于单独或者和PD-1抗体联⽤用治疗晚期或转移性实体瘤)和诺华的MBG-453(⽤用于单独或者和PD-1抗体PDR001联⽤用治疗晚期恶性肿瘤)。
TIGIT (T cell immunoglobulin and ITIM domain protein)抗体TIGIT(又叫Vsig9,Vstm3, or WUCAM),是含Ig及ITIM结构域的T细胞和NK细胞共有的抑制性受体,是Ⅰ型跨膜蛋⽩白,包括IgV胞外段以及免疫球蛋⽩白酪氨酸尾巴样磷酸化⽚片段。
TIGIT和CD226(DNAM-1)竞争结合配体CD155(PVR,NECL5)和CD113(PVRL3,nectin-3(如图六)。
体外阻断TIGIT后能增强NK和T细胞的活化及脱颗粒⽔水平,并且也能增加细胞因⼦子如IFN-γ的分泌;不同⼩小⿏鼠肿瘤模型中,TIGIT在NK和T细胞上表达显著上调。
⽬目前在临床研究的TIGIT抗体主要是Genentech的MTIG7192A,单独或者和PD-L1抗体Atezolizumab联⽤用治疗晚期或者转移性肿瘤。
VISTA(V-Domain Immunoglobulin-Containing Suppressor of T Cell Activation)抗体VISTA,又叫Dies1(Differentiation of embryonic stems cells 1)、⾎血⼩小板受体 Gi24、PD-1 同源蛋⽩白(PD-1H),属于免疫球蛋⽩白家族,胞外结构域和PD-L1同源。
⼈人源的VISTA主要表达在CD4+细胞、 CD8+T细胞、CD11b+亚群的单核细胞、淋巴细胞、⾻骨髓细胞、树突细胞亚群和中性粒细胞。
⽬目前VISTA的细胞表⾯面受体尚不清楚。
VISTA对于抗原呈递细胞和T细胞有抑制作⽤用。
⽬目前在临床阶段的VISTA抗体是强⽣生的JNJ-61610588。
⼩小结免疫检查点抑制剂在临床上的成功使癌症的免疫治疗焕发了新⽣生命。
未来我们需要做的是如何提⾼高免疫检查点阻断的效率以及免疫检查点抑制剂组合疗法来使那些单独阻断剂不能治疗的病⼈人获得持久的抗肿瘤响应。
要完成这个⽬目标,有以下⼏几个问题需要解决:免疫检查点抑制剂的响应和抵制机制是什么?越来越多的证据表明对免疫检查点抑制剂有响应的肿瘤,对肿瘤衍⽣生新表位有持续但是⽆无效的免疫响应。
更好地理解共抑制通路的相似性和差异,以及共抑制通路的协同作⽤用机制,对于免疫检查点组合疗法的优化设计是必须的。
确定共抑制的通路是影响相似还是不同的分⼦子通路也许会找到线索。
免疫检查点阻断的耐久性的机制是什么?免疫检查点阻断获得的较长的效果是很显著的,但是,相⽐比之下耐久性的机制以及疗法所必须的时间是不清楚的。
将来的⼯工作需要搞清楚免疫检查点阻断是如何影响记忆T细胞亚群的传代、功能和维持。
有没有⽣生物标志物(biomarker)能够预测对免疫检查点阻断的反应?开发⽣生物标志物对于帮助患者分层以及预估患者是否对免疫阻断单独疗法有反应,是否需要组合疗法或者接受其他的治疗是必要的。
如何开发有效的免疫检查点阻断的联合疗法来增加疗效以及减少副作⽤用。
肿瘤使⽤用多种⼿手段来逃避免疫消除,因此更好地理解肿瘤微环境的免疫抑制是必要的。
⼀一些⾮非免疫治疗的⼿手段能够影响肿瘤对免疫的反应。
