饱和碳原子上的亲核取代反应
亲核取代反应及其影响因素

亲核取代反应及其影响因素摘要:饱和碳原子上的亲核取代反应主要有两种:单分子亲核取代反应(S N1)与双分子亲核取代反应(S N2)。
大多数反应介于这两种极端情况之间。
人们提出离子对机理与邻近基团参与的理论来解释反应情况与构型变化的问题。
亲核取代反应的反应速度,与烃基的数量、离去集团的大小、亲核试剂的活性以及溶剂的极性等有关。
一般来说,烃基数量少,离去基团大,亲核试剂亲核性强,溶剂的极性弱,对S N2反应有利;烃基数量多,离去基团大,溶剂的极性强,对S N1反应有利。
另外,亲核取代反应和对应的消除反应(单分子消除反应E1、双分子消除反应E2与S N1、S N2)互为竞争性反应。
强碱和较高的温度有利于消除,弱碱和强亲核试剂有利于取代;有利于碳正离子生成的条件,有利于按单分子机理进行;不利于底物异裂的条件,有利于双分子反应。
正文:一、烷基结构的影响1.烷基的结构对S N2 反应的影响反应中,如果中心碳原子上连接的取代烷基(支链)越多,它们对亲在卤代烷的SN2核试剂从碳卤键背后进攻中心碳原子的空间位阻就越大,使得发生有效碰撞的概率大为下降;而在过渡态时众多的支链与中心碳原子要保持在同一个平面内,其张力是很大的,这就使形反应的活性下降,反应速成过渡态需要有非常高的活化能,这些都将导致卤代烷进行SN2率减小。
例如,I-与下面各溴代烷的丙酮溶液中于25℃发生S N2 反应时的相对反应速率为:反应的速率也有明显的影响,即卤如果在卤代烷的β- 碳原子上连有支链烷基时,对SN2代烷中心碳( α- 碳)原子上连接的烷基体积越大,其空间位阻越大,不利于亲核试剂的攻击。
反应时,在其它条件相同时,不同结构卤代烷的反应活性综上所述,卤代烷进行SN2次序为:2.烷基的结构对S N1 反应的影响在S N1 反应中,由于决定反应速率的步骤是碳正离子的生成。
因此,烷基子离子越稳,越易形成,生成时的活化能越低,反应速率也越快,由于烷基正离子稳定性的顺序是:(CH3)3C+>(CH3)2CH+>CH3CH2+>CH3+所以,在S反应中,卤代烷的活性顺序为:R3CX > R2CHX > RCH2X > CH3X N1(3°>2°>1°>CH3X),例如:卤代烷与AgNO溶液的反应被认为是S N1 机理。
有机化学中的亲核取代反应

有机化学中的亲核取代反应孙金鱼;赵三虎;赵明根【摘要】亲核取代反应是有机化学中的一类非常重要的反应,可分为四种类型:①饱和碳原子上的亲核取代反应(SN1和SN2);②不饱和碳原子(主要是芳环)上的亲核取代反应;③经苯炔中间体的亲核取代反应;④底物为羧酸衍生物(酰卤、酸酐、酯、酰胺)的亲核取代反应。
这些亲核取代反应在有机合成上有着极其广泛的应用,但因反应机理的差异性较大,学生学买并掌握起来困难较大。
文章拟将上述四种类型的亲核取代反应进行系统分析和比较,找出反应的规律性,以期帮助学生学习之需要。
%As a kind of very important organic chemistry reactions, nucleophilic substitution reactions are generally di- vided into four types:①nucleophilic substitution reactions on the saturated carbon atoms(SN1 and SN2);②nucleophilic substitution reactions on the u nsaturated carbon atoms (mainly aromatic ring); ③nucleophilic substitution reactions through such intermediate as benzyne, ④nucleophilic substitution reactions which substrates are carboxylic derivatives (acyl halides, anhydrides, esters, amides). These nucleophilic substitution reactions have an extremely wide range of ap- plications, but due to the differences of reaction mechanisms, we have found it difficult for students to learn and master these reactions. In this paper, we will analyse and compare the four types of nucleophilic substitution reactions systemati- cally and find out their regularities so as to meet the need of students.【期刊名称】《海南师范大学学报(自然科学版)》【年(卷),期】2012(025)001【总页数】7页(P109-114,118)【关键词】有机化学;亲核取代反应;机理【作者】孙金鱼;赵三虎;赵明根【作者单位】忻州师范学院化学系,山西忻州034000;忻州师范学院化学系,山西忻州034000;忻州师范学院化学系,山西忻州034000【正文语种】中文【中图分类】O621.13在有机化学中,亲核取代反应是一种特别重要的反应,按照其反应机理可以归纳为四种类型.即①饱和碳原子上的亲核取代(SN1和SN2);②不饱和碳原子(主要是芳环)上的亲核取代;③经苯炔中间体的亲核取代;④底物为羧酸衍生物(酰卤、酸酐、酯、酰胺)的亲核取代.这些反应本质上都是亲核取代,但由于反应机理的差异性较大,学生学习并掌握起来困难较大.只有从反应机理上彻底认识并掌握各类亲核取代反应,才是解决问题的根本方法.1.1 一般的饱和碳原子上的亲核取代反应这类反应主要涉及卤代烷烃(RX)、醇(ROH)以及饱和碳原子上连有羟基、卤原子等的其他类型的有机物.从反应机理讲,分为SN1和SN2两种极限历程.SN1为单分子亲核取代历程,中间体为碳正离子,整个反应分两步完成,立体化学为外消旋化.SN2为双分子亲核取代历程,经过渡态一步完成,立体化学为瓦尔登(Walden)翻转,即构型翻转.简要表示其通式[1]如下:①SN1的反应通式为:②SN2的反应通式为:在SN1中,反应的快慢取决于离去基团的性质.离去基团的亲核性弱,则易于离去;反之,则不易离去.离去基团的碱性、中心原子的半径大小等影响着它亲核性的强弱.一般来说,碱性弱则亲核性弱,易于离去;中心原子的半径大则变形性大(强),也易于离去.在SN2中,反应的快慢与底物结构、离去基团、亲核试剂的性质有关,有时还与溶剂的极性有关.底物结构简单、试剂的亲核性强,离去基团的碱性弱(即易于离去),都有利于反应的快速进行;反之,反应则不易进行.对于亲核试剂,碱性强则亲核性强;中心原子的半径大则变形性大,亲核性也强.对于离去基团,则与SN1相同.对于那些碱性特别强的离去基团如羟基(-OH)、氨基(-NH2)等,须在酸催化下才能顺利离去,以实现取代.醇分子间脱水成醚的反应属于亲核取代,反应一般按SN2历程进行.例如[2]:Williamson合成法制醚的反应也属于亲核取代,反应一般按SN2历程进行.反应通式为:RX+NaOR′(或NaOAr)→ROR′(或ROAr)因醇钠或酚钠碱性较强而容易引起脱卤化氢的消除反应,反应中所用卤代烃一般要求是一级卤代烃.醚键断裂的反应是重要的亲核取代反应,特别是环氧乙烷衍生物的开环反应更为重要.醚键断裂反应的通式为:反应中氢卤酸的活性顺序为:HI>HBr>HCl.一般用HI进行反应,偶尔用HBr进行反应,几乎不用HCl,因其反应活性差.对于脂肪族混合醚,醚键优先在较小烃基一边断裂(SN2机理)[2].对于含有叔烃基的脂肪族混合醚,醚键优先在叔烃基一边断裂,因这种断裂可生成稳定的叔碳正离子(SN1机理)[3].对于芳基烷基混合醚与HX反应,醚键总是在脂肪族烃基一边断裂,这是因为芳基碳氧键结合得很牢固(p-π共轭).显然,二芳基醚在HI作用下也不会发生断裂反应.环氧乙烷衍生物的开环反应是一种特殊的亲核取代反应.环氧乙烷衍生物因其具有三元环而能与许多含有活泼氢化合物(如水、醇、胺、酚、氢卤酸等)发生反应,可用酸或碱作催化剂.不对称环氧乙烷衍生物的开环反应有一个方向问题.在碱性条件下开环,亲核试剂优先进攻空间位阻较小的环碳原子(SN2机理).而在酸性条件下开环,亲核试剂优先进攻取代程度高的环碳原子(带有SN1机理性质)[4]:从立体化学上讲,酸性开环和碱性开环反应都属于SN2类型的反应[2],如下列两个例子:1.2 特殊的饱和碳原子上的亲核取代反应1.2.1 邻近基团参与的亲核取代反应邻近基团参与的亲核取代反应简称邻基参与.当能够提供电子的基团处于底物中心碳原子的邻近位置时,它们通过某种环状中间体先于亲核试剂参与亲核取代反应,其结果不仅加快了反应速率,而且使产物保持原构型(但有时也会得到重排产物).其反应分两步进行,先发生分子内亲核取代形成环状结构(此时构型已发生翻转),然后亲核试剂沿着离去基团离去路径反方向进攻,发生取代(此时构型再次发生翻转),两次构型翻转(SN2)等于构型不变,即构型保持.反应通式[2]如下:常见的邻近基团有:COO-、O-、S-、OH、OR、NH2、NR2-、SR、Cl、Br、I、以及苯基、烯基等.列举三例如下:例1 (S)-α-溴代丙酸盐的水解反应例2 β-苯基溴代烷的水解反应例3 β-碘代醇的溴化反应1.2.2烯胺为亲核试剂的亲核取代反应烯胺与活泼卤代烃可进行亲核取代反应.五元环酮或六元环酮形成烯胺后可与活泼卤代烃进行亲核取代,在羰基α-位引入烷基(烃基),生成取代环酮.其反应通式[2]如下:R′X=CH2=CHCH2Cl,BrCH2COOC2H5,RCOCl,CH3I,BrCH2COR等1.2.3 丙二酸二乙酯、乙酰乙酸乙酯中活泼亚甲基为亲核试剂的亲核取代反应丙二酸二乙酯、乙酰乙酸乙酯作为特殊的试剂在有机合成上非常有用,可合成众多有机化合物.它们的反应是在强碱作用下形成碳负离子,并作为亲核试剂进行亲核取代反应,从而引入各种不同的基团,再经酮式或酸式分解,可得到不同结构的酮、酸或二酸等.应该特别指出的是,如果引入两个相同的烃基,丙二酸二乙酯可一次完成,而乙酰乙酸乙酯由于无法形成双钠盐,必须分步进行才能完成.1.2.3.1 丙二酸二乙酯在有机合成上具体应用反应通式:其中R1X或R2X=使用二卤代烃还可合成环状产物:1.2.3.2 乙酰乙酸乙酯在有机合成上具体应用反应通式:2.1 苯环上的亲核取代反应当芳环上连有强拉电子基时可使环上的电子云密度降低,不利于发生亲电取代反应,有利于发生亲核取代反应.亲核试剂首先同芳环加成,然后离去基团离去,重新恢复环的芳香性,反应机理为加成-消除历程[1]:当环上连有拉电子基,尤其是在邻、对位有拉电子基时,会使反应速率加快.因邻对位拉电子基通过共轭效应,使连有离去基团的碳原子上的电子云密度降低,有利于亲核试剂进攻,也有利于碳负离子中间体的稳定.当卤原子的邻对位有拉电子基团存在时,可以发生水解、醇解、氰解、氯解等亲核取代反应.例如[2]:应该指出:①乙酰乙酸乙酯亚甲基上的取代产物可以分别在稀碱或浓碱的作用下发生酮式分解或酸式分解.由于在浓碱的作用下酸式分解时往往伴随有酮式分解,因此,合成羧酸最好使用丙二酸二乙酯.②由于乙酰乙酸乙酯不像丙二酸二乙酯那样能形成双钠盐,因此不能合成三四元环.③如果反应底物为卤代烃、α-卤代酮、α-卤代酸酯等,则机理一般为SN2;如果反应底物为酰卤,则机理为加成-消除历程. 反应活性顺序与脂肪族卤代烃的亲核取代反应活性顺序正好相反,原因在于反应机理为加成-消除机理,与饱和碳原子上的亲核取代反应机理不同.一个典型的例子是氯苯水解时随着环上硝基数目的增多,取代反应越来越易[3,5]:拉电子基主要活化其邻、对位,对间位的活化作用很弱.例如:在制备脂基芳基混合醚(Williamson合成法)时,一般选择酚钠和脂肪族卤代烃进行反应.但在芳环上邻、对位连有拉电子基的卤代芳烃,可以和醇钠作用,生成脂基芳基混合醚.例如:2.2 吡啶环上的亲核取代反应吡啶具有芳香性,属于含氮芳杂环化合物.由于环上氮原子的拉电子作用,在2-位或4-位上容易发生亲核取代反应.例如齐齐巴宾(Chicibabin A E)反应:反应机理:当吡啶的2-位或4-位上有易离去基团(如Cl、Br、NO2等)时能与亲核试剂发生亲核取代反应.例如:反应机理为加成-消除历程:2.3 经苯炔中间体的亲核取代反应苯炔(benzyne)是许多芳族亲核取代反应中的中间体.例如,用强碱(如KNH2)处理不活泼芳卤,在生成正常取代产物的同时,也会得到变位(cine)取代的异构产物.这些反应的机理均为消除-加成历程.一般是未被活化的芳基卤代物在强碱作用下发生消除反应生成苯炔中间体,而后亲核试剂再对苯炔进行加成反应得到产物:当生成的苯炔不对称时,就产生苯炔的生成方向及加成方向问题.以芳卤的氨解反应为例讨论如下.2.3.1 苯炔的生成方向取决于取代基Z的诱导效应上述反应可能生成的苯炔中间体为:式(3)中生成两种苯炔中间体.到底哪一种占优势,取决于碳负离子的稳定性,而碳负离子的稳定性又与取代基的诱导效应有关.当Z为拉电子基时,(1)比(2)要稳定,因为前者负电荷更靠近拉电子基Z,相应的主要生成苯炔(1′).当Z为推电子基时,(2)比(1)要稳定,主要生成苯炔(2′).2.3.2 苯炔的加成方向也取决于取代基Z的诱导效应羧酸衍生物(酰卤、酸酐、酯、酰胺)的结构特点是:分子中都有酰基,而且酰基都直接与带有未共用电子对的原子或基团相连,既存在诱导效应,又存在p-π共轭效应.这类化合物发生亲核取代反应的一般通式为:羧酸衍生物的水解、醇解、氨解均属于这类亲核取代,反应活性次序为:酰氯>酸酐>酯>酰胺.此外,酯缩合反应也属于羧酸衍生物的亲核取代反应,其机理加成-消除历程,并且非常重要.如Claisen酯缩合反应和Dieckmann缩合反应.Claisen酯缩合反应[2]:例1 完成反应(中南大学2007年硕士研究生招生试题)例2 完成反应(上海师大2007年硕士研究生招生试题)例3 完成反应(江苏大学2009年硕士研究生招生试题)Dieckmann缩合反应[2]:反应机理为:例4 完成反应(四川大学2008年、天津大学2007年硕士研究生招生试题)【相关文献】[1]高鸿宾.有机化学[M].北京:高等教育出版社,2005:243,252.[2]王积涛,张宝申,王永梅,等.有机化学[M].2版.天津:南开大学出版社,2003:313,318,332,239,550,507,508.[3]曾昭琼.有机化学(下册)[M].北京:高等教育出版社,2004:299-300,81.[4]王永梅,王桂林.有机化学提要·例题和习题[M].天津:天津大学出版社,1999:125.[5]曾昭琼.有机化学(上册)[M].北京:高等教育出版社,2004:293.。
脂肪族饱和碳原子上的亲核取代反应、消除反应

根据反应机理和产物的不同,可以将亲核取代反应和消除反应分为多种类型,如 SN1、SN2、E1、E2等。
反应机理概述
亲核取代反应机理
亲核取代反应可以按照SN1或SN2机理进行。在SN1机理中 ,碳正离子首先形成,然后亲核试剂进攻碳正离子,形成产 物。在SN2机理中,亲核试剂直接从背面进攻碳原子,同时 发生取代反应。
要点二
不同点
亲核取代反应是进攻一个亲核试剂到碳原子上,而消除反 应是进攻一个水分子到碳正离子中间体上;亲核取代反应 的产物是稳定的,而消除反应的产物是不稳定的;亲核取 代反应的反应机理是形成中间体,而消除反应的反应机理 是形成碳正离子中间体。
THANKS
感谢观看
详细描述
E2反应需要离去基团具有较弱的酸性,如醇和酯等。在反应过程中,离去基团与碳原子上的两个氢原 子结合形成不饱和键,同时释放一个氢分子。由于是双分子反应,E2反应的速率主要取决于底物浓度 和催化剂的存在。
E1cb反应
总结词
E1cb反应是一种特殊的单分子消除反应,其中离去基团和碳原子上的一个非邻近氢原 子结合形成不饱和键。
详细描述
E1cb反应需要离去基团具有较强的酸性,如羧酸和酯等。在反应过程中,离去基团与 碳原子上的一个非邻近氢原子结合形成不饱和键,同时释放一个氢离子。由于是单分子
反应,E1cb反应的速率主要取决于底物浓度。
04
CATALOGUE
脂肪族饱和碳原子上的亲核取代反应与消 除反应的比较
反应机理比较
亲核取代反应
应用领域比较
亲核取代反应
在有机合成中广泛应用于碳-碳键的 形成,如酯化、水解等反应。
消除反应
在有机合成中常用于制备不饱和键, 如醇的脱水、卤代烃的脱卤素等反应 。
饱和碳键上的亲核取代反应

Nu
-
+
C L
Nu C L
δ
δ
Nu C
Walden 转化
由于试剂从离去基团的背后进攻中心碳原子,所以产物发生 构型转化-Walden转化。
Nu:
L
Nu
+ L-
构型
翻转
NaOH SN 2
H
C6H13 C Br CH3
C6H13 HO C H CH3
(S) - (-) - 2 - 辛醇 [α]25D= -9.90° 对映体的纯度=100%
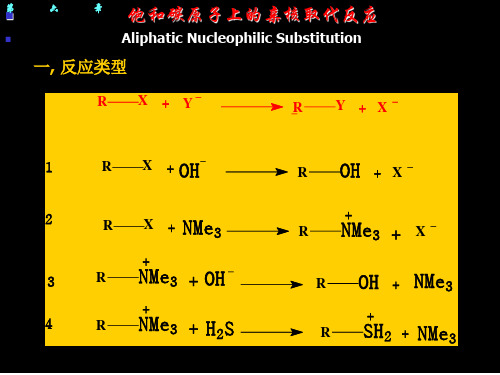
第五章 饱和碳原子上亲核取代反应 (Aliphatic Nucleophilic Substitution)
一. 反应类型 二. 反应机理 (Reaction Mechanism) 1. SN1机理 2. SN2机理 3. 离子对机理 三. 立体化学 1. SN2反应 2. SN1反应
四. 影响反应活性的因素
R Nu++ L
(CH3)4N++(CH3)2S
(CH3)3S + (CH3)3N
+
+
⑷ 底物带有正电荷,亲核试剂带有负电荷:
R Nu +L RL + Nu+ + Cl CH3Cl +H2O CH3OH2
二. 反应机理
1. 单分子亲核取代 (Substitution Nucleophilic Unimolecular) (SN1)反应机理 + L Nu R R L + Nu ν = k1 R L
b)排斥电子和吸引电子原子团的影响,如:
Z 为吸引电子的原子团时, SN1 反应速度减慢, α- 卤代酮、 酸、酯等与此类似; Z为排斥电子的原子团时,使 SN1 反 应速度增加,Z排斥电子使碳正离子的正电荷分散,使碳 正离子稳定。
取代反应机理及应用

从而使产物具有不同程度的旋光性,而某些情况下还能得到构型保持的产物,例如:
5
以上几种情况到底发生哪一种?它与反应底物的结构、 试剂的种类与浓度以及反应环 境等因素有关。如果生成的碳正离子十分稳定,则生成外消旋化的产物,如果生成的碳正 离子不稳定,在离去基团(L)还未完全离开之前,亲核试剂(Nu)就开始进攻中心碳原子,由 于 L 的屏蔽效应,妨碍了 Nu 从 L 离去方向进攻中心碳原子,Nu 只能从 L 的背面进攻中 心碳原子,所以得到的产物往往是外消旋化的同时,还得到部分构型转化的产物。外消旋 化产物与构型转化产物二者的比例取决于碳正离子的稳定性和亲核试剂的浓度, 如果碳正 离子较稳定,亲核试剂的浓度较低,则产物外消旋化所占比例就高,反之,则外消旋化所 占比例就低。例如 Ph-CHClCH3 在不同条件下的水解反应,有如下数据: 虽然在实际的 SN1 反应中,往往只发生部分外消旋化,但这并不影响外消旋化作为 SN1 反应机理的证据, 至于在 SN1 反应中得到构型保持的产物, 则是由于邻基参与的结果。
6
该反应显然是通过 SN1 反应机理先离解成一级碳正离子,但一级碳正离子很不稳定, 立即发生重排,得到比较稳定的三级碳正离子,然后3)3C++Br-
如果外加一些与离解的离子相同的离子,例如 Br-离子,就会使平衡向左移动,这样对叔 丁基溴的离解起到了抑制作用,使反应速度减慢,这种作用叫做同离子效应,同离子效应 是反应的一个特征。 1.3 桥头碳上的 SN1 反应 对桥头碳上带有潜离去基团的化合物进行动力学研究,也能为 SN1 机理提供证据[3]。 例如, 将 1-氯代阿朴莰烷在 80%乙醇和 30%KOH 溶液中煮沸 2h 或者在硝酸银的乙醇水溶 液中煮沸 48h,都不发生反应,而类似的开链体系化合物则很容易反应。这是因为在 SN1 反应中反应底物首先离解成碳正离子,碳正离子为平面 (或近乎平面)结构,而桥头碳原子 上因空间效应的阻碍,它不能或很难伸展成平面结构,因此桥头碳正离子很难形成,以致 使该化合物在条件下不能发生反应,这就从反面为 SN1 反应机理提供了证据,见图 2:
饱和碳原子上的亲核取代反应

有更强的亲核性,因此生成硝基化合物为主。 如果将试剂换为 Ag +,则为:
R2CHBr + AgNO2
+ R2CHNO2 (次要产物) R2CHONO (主要产物)
这里 Ag +易于把 Br 拉下来,R2 CH+有助于产生, 反应发生在电子云密度高的 氧上,静电吸引,一般得到混合物。 (3)烷基结构的影响: 对 SN1 反应碳正离子越稳定,越容易生成,反应速度也越快,碳正离子的 稳定性主要取决于电子效应和空间效应。 例如: CH3-CH2 +和 CH3+ 相比,前者有 σ-P 超共轭效应,比后者更稳定, (CH3)3 C+则更稳定。 3°C+>2°C+>1°C+ 从空间因素看:三级卤代烷上有三个烷基,比较拥挤,互相排斥,当变成 C+成平面结构,彼此远离,互成 120°角,解除了后张力(B 张力) 。 例如:溴代烷在甲酸水溶液中,水解反应,相对 SN1 反应速度为:
Nu Nu
+
Nu
Nu 从平面两边进攻机会相等,因此得到外消旋混合物(在很多反应中,构 型翻转和保持几乎相等,即 100%外消旋体,有时构型翻转居多些)例如:
Br OCH 3
CH3OH
C6H 5 CH CH 3 C 6H 5 CH CH 3
产物:73%外消旋化,27%构型翻转 (2)SN 2(Substitution nucleophilic bimolecular) 亲核试剂从离去基团的背面进攻离去基团,旧键的断裂与新键的生成协同 进行。 当新键与旧键生成达到势均力敌的时候, 体系具有最高的能量是为过度态。 即:
离子化 R -L Nu Nu 紧密离子对 SN 2 构型翻转 翻转(主要) Nu 溶剂介入 R+ L 溶剂介入
影响亲核取代反应的因素

影响亲核取代反应的因素2010-04-27 08:55饱和碳原子上的亲核取代反应可按SN1和SN2两种不同历程进行。
亲核取代反应的两种历程,在反应中同时存在,相互竞争。
但对一种反应物来说, 在一定条件下, 与亲核试剂作用时, 我们能否知道, 反应究竟按什么历程进行?如果对不同的反应物, 我们能否预计哪一个快, 哪一个慢?对于这样类似的一系列问题, 通过许多科学家的研究, 现在已经找到明确而肯定的答案。
研究表明, 反应历程和反应活性与反应物中的烃基结构, 离去基团性质, 亲核试剂性质以及溶剂性质等因素都有关系, 下面分别讨论。
5.5.1烃基结构的影响影响反应历程的因素很多,卤代烃本身结构是主要因素之一。
在卤代烃分子中,反应中心是a-C原子。
a-C原子上电子密度的高低,直接影响反应历程。
如果a-C原子上电子密度低,则有利于Nu-进攻,有利于反应按双分子历程进行。
反之,如果a-C原子上电子密度高,则有利于卤素夺取电子而以X-的形式离解,所以有利于按单分子历程进行反应.从反应中间体来看如果能形成稳定的正离子,则有利于反应按SN1历程进行。
反之,则有利于SN2历程。
烃基结构对亲核取代反应的影响, 可以通过分析烃基的电子效应和空间效应来确定。
先看看SN1和SN2两个决速步骤中过渡态的结构(见表5.8)。
表5.8 SN1和SN2过渡态结构反应历程SN2SN1过渡态结构电荷分散集中体积比反应物拥挤比反应物宽松在卤代烃的亲核取代反应中, 烃基的立体效应和电子效应对SN1和SN2影响程度不同。
对SN2历程,烃基的立体效应是主要的,而对SN1历程,烃基的电子效应是主要的。
5.5.1.1 烃基的立体效应由于SN2历程中形成的过渡态比较拥挤, 所以SN2历程对烃基的立体效应比较敏感。
(1)当中心碳原子上的支链增多时, 不利于SN2反应, 有利于SN1反应。
考虑立体因素时,伯卤代烃有利于SN2反应,叔卤代烃有利于SN1反应。
有机化学基础知识点碳原子的亲核取代反应

有机化学基础知识点碳原子的亲核取代反应亲核取代反应是有机化学中重要的反应类型之一。
在这篇文章里,我将介绍碳原子的亲核取代反应的基础知识点。
亲核取代反应是一种化学反应,涉及到一个亲核试剂攻击一个电子云密度较低的碳原子,并将其取代。
这种反应可以发生在饱和碳原子上,也可以在环上的碳原子上发生。
1. 亲核试剂的选择亲核试剂是亲核取代反应中至关重要的一部分。
常见的亲核试剂包括卤代烷、醇、胺等。
选择适当的亲核试剂可以有效地促进反应的进行。
2. 亲核试剂的攻击在亲核取代反应中,亲核试剂攻击碳原子的位置非常重要。
碳原子可以通过两种方式进行亲核攻击:SN1和SN2机理。
- SN1机制:这是一种两步反应,首先,亲核试剂离去一个离子,形成一个带电的中间体。
然后,亲核试剂攻击中间体上的位点,取代离去的离子。
- SN2机制:这是一种一步反应,亲核试剂直接攻击碳原子,并同时取代离去的基团。
3. 碳原子的离去基团在亲核取代反应中,碳原子上的离去基团是影响反应速率和反应机理的重要因素。
常见的离去基团包括卤素原子、氨基和醇基等。
不同的离去基团会导致不同的反应速率和产物选择。
4. 反应条件的影响亲核取代反应的条件也会对反应的进行产生影响。
常见的反应条件包括溶剂的选择、温度和反应时间等。
选择合适的反应条件可以提高反应的收率和选择性。
5. 反应机理的解释了解亲核取代反应的机理对于理解反应过程和预测产物是非常重要的。
通过观察亲核试剂攻击碳原子的位置、反应速率以及产物选择等因素,可以确定反应机理。
在总结中,亲核取代反应是有机化学中基本的反应类型之一。
了解碳原子的亲核取代反应的基础知识点可以帮助我们理解反应机理、预测产物以及进行有机合成的设计。
当然,亲核取代反应还有很多细节和应用等待我们深入探索和学习。
亲核取代
CH2C6H5 C CH3 H OH TsCl
CH2C6H5 C CH3 H O H Cl
O S O Me
A R
R
AcO B
CH 2 C 6 H 5 AcO C H
S
CH 2 C 6 H 5 OH HO C H
S
CH 3
C
CH 3
H Br H OH CH3 CH3 H H
Br H CH3 CH3 Br CH3 CH3 H Br H CH3 Br
H Br
-
CH3
OH
H Br H OH CH3 CH3 H H
Br H CH3 CH3 Br CH3 Br H CH3 Br
-
H CH3 Br H
CH3
OH
内消旋体
第
六
章
饱和碳原子上的亲核取代反应
NMe 3 NMe 3
R
R
第
六
章
饱和碳原子上的亲核取代反应
Aliphatic Nucleophilic Substitution
如:
第
六
章
饱和碳原子上的亲核取代反应
Aliphatic Nucleophilic Substitution
二. 反应机理与反应中的立体化学 1 SN1与SN2机理 (1).单分子亲核取代(SN1)
CH 2 ph CH 3 a=( + OAc B a=( CH
33
o
OH )
TsCl A CH 2 ph
CH 2 ph CH 3 CH OTs a=( + 31.1o ) OH C CH 3 a=( CH 2 ph CH
邢其毅《基础有机化学》(第3版)(上册)课后习题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应(

解:
习题 6-9 选择合适的卤代烃为原料,并用合适的反应条件合成:
5 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:
习题 6-10 完成下列反应,并将它们按反应难易排列成序,简单阐明理由。
解:
反应从易到难的顺序为:(ii)>(i)>(iii) 分子内成环反应,五元环最易形成,其次是六元环,四元环最不易形成。
6 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-11 下列各组中,哪一个化合物更易进行 sN1 反应?
解:SN1 反应碳正离子的形成反应是速控步骤,稳定的碳正离子最易形成。 3°碳正离子最易形成。 苯甲型碳正离子最易形成。
3°碳正离子最易形成。 能形成最大离域体系的碳正离子最稳定。 刚性越小的桥环分子越易形成碳正离子。 离去基团最易离去,碳正离子最稳定。
7 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-12 下列反应在哪种情况下进行对得到目标化合物有利,简单阐明理由。 (i)在乙醇中溶剂解
石油醚 解:在(ii)中最容易进行。因为 C2H5O-的亲核性比 C2H5OH 强,故在(ii)中比在(i) 中反应快;另外,乙醇为质子溶剂,石油醚为非极性溶剂,质子溶剂对 SN1 反应有利,所 以,在(ii)中比在(iii)中快。
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 6 章 脂肪族饱和碳原子上的亲核取代反应 β-消除反应 习题 6-1 根据下列实验数据判断:与羧基相连的基团的诱导效应是吸电子的还是给电 子的?并将它们按吸电子诱导效应(或给电子诱导效应)由大到小的顺序排列。
(完整版)有机化学反应机理

双分子反应一 步活化能较高
O
H+
CH3C-OH
+OH CH3C-OH HOC2H5
按加成--消除机理进行 反应,是酰氧键断裂
加成
OH CH3-C-OH
HO+ C2H5
质子转移
四面体正离子
OH CH3-C-O+ H2
OC2H5
-H2O 消除
+OH
-H+
CH3C-OC2H5
O CH3C-OC2H5
*2 碳正离子机理
OH
H+
(CH3)3C-OH
+OH R-C-OC(CH3)3
(CH3)3CO+ H2 -H2O (CH3)3C+
O=C-R
属于SN1机理
O -H+
R-C-OC(CH3)3
按SN1机理进
行反应,是烷
氧键断裂
* 3oROH按此反应机理进行酯化。 * 由于R3C+易与碱性较强的水结合,不易与羧酸结合,
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
1 自由基取代反应
有机化合物分子中的某个原子或基团被其 它原子或基团所置换的反应称为取代反应。若 取代反应是按共价键均裂的方式进行的,即是 由于分子经过均裂产生自由基而引发的,则称 其为自由基型取代反应。
自由基反应包括链引发、链转移、链终止三个
阶段。链引发阶段是产生自由基的阶段。由于键的 均裂需要能量,所以链引发阶段需要加热或光照。 链转移阶段是由一个自由基转变成另一个自由基的 阶段,犹如接力赛一样,自由基不断地传递下去, 像一环接一环的链,所以称之为链反应。链终止阶 段是消失自由基的阶段。自由基两两结合成键。所 有的自由基都消失了,自由基反应也就终止了。
饱和碳原子上的一种新的亲核取代反应—SRN1反应

饱和碳原子上的一种新的亲核取代反应—SRN1反应第lO卷第4期大学化学1995年8月一饱和碳原子上的一种新的亲核取代反应——sRNI反应田来进田君根之.厂t肘田来进田君廉高根之u(曲云山东273165)A摘蔓介绍谨,辛敬译S1反应的机理,反应的底物所有的有机化学教科书都详细讨论饱和碳原子上的亲核取代反应,它有两种典型的机理.一是单分子亲核取代反应机理即SI反应,反应底物在亲核试剂进攻之前即离解成正碳离子中间体}RX—R+x一—二RN+x一一是双分子亲核取代反应机理即sw2反应,反应底物直接受亲核试剂进攻形成过渡态.6一—Rx+N一…IN-R…x]一RN+x一1966年,人们”在研究卤代烷RX与硝基烷烃负离子(如(CH).CNO.)反应时发现产物R.C(CH.)NO:不能用通常的s机理来解释,而且反应可被光加速,被自由基清除剂所抑制.由此便提出了亲核取代反应的第三种机理——自由基机理,其一般过程为:RX-Fe-一RX’①RX’一R’+x②R+N一一RN’⑧RN’+RX—RN-FRx’④中性底物首先接纳一个电子形成自由基负离子,随后这个自由基负离子裂解为有机自由基和离去基团负离子,紧接着亲核试剂进攻自由基形成新的自由基负离子,最后新生成的自由基负离子把多余的一个电子转移给另一底物分子而形成产物,完成一个链循环①式为引发过程,②⑧④式为传递过程,后三式相加即得亲核取代反应:RX+N一——RN+X一由于反应过程有自由基生成,而且离去基团键的断裂类似于S1中的单分子过程,因此,上述反应称为单分子自由基链式亲核取代反应,用s1表示0].sRNl反应的确立,丰富和发展了sNl和s2反应的基本概念,饱和碳原子上的这一反应现已扩展到许多反应体系,因此,它不仅具有理论意义,而且还具有合成价值.sl反应的底物和亲核体在饱和碳原子的Sw1反应中,常见的底物RX有硝基化合物和非硝基化合物(见表1).对于前者,硝基可以在R中,也可以是离去基团.R中硝基的位置在连有离去基团x的a-C原子]3上(如RC(NO.)x)或者在.一C原子上的苯基对位上(如P—NO.CeHCRzx).硝基具有能量较低的LUMO轨道,它的存在有利于底物接受一个电子形成自由基负离子(①式),进而发生S1反应.不舍硝基的底物大致有:(1)氰基等强吸电子基活化的烷基衍生物,(2)烷基汞卤化物,(3)全氟烷基碘化物,(4)新戊基卤化物,(5)桥头卤代化合物,(6)卤代环丙烷衍生物等对于(1)如p-NCCHCRX,氰基的作用和硝基类似,而其它各类化合物对s1或Sw2反应均有相同的活性模式一或者反应相当慢或者根本不反应.这样,它们在适当条件下即可按SRs1过程而发生反应表1一些饱和碳藤子的sl反应实铡…‘(RX+一—RN+X-)SRNI反应中,离去基团X可以是各种各样的,包括那些在s1或S2反应中极不活泼的基团,如cl,Br,I,ArSO.,NOz,SCN,Ns,CH.,CH等SRN1反应中的亲核体N 一大都是些强碱性的负离子,包括碳负离子如RCNORe(COEt),磷负离子如(EtO).po,(EtO)PS,硫负离子如ArSO,ArS一等.亲核体对自由基亲核进攻形成产物的自由基负离子RN’(③式)是sR1过程的关键步骤,R或N一中的硝基,NCCH,CHCO,CH等能通过低能量的LUMO或MO稳定RN’t有利于RN’的生成.因此,像对硝基苯基烷基自由基可被RCNO,eH(CO.Et),(EtO)p0等许多亲核体进攻,而烷基自由基如Rx(x—R,COEt…)其能被RCNO,phzCR,phS一等进攻形成产物的自由基负离子而完成SRS1反应.sl反应的引发和立体化学饱和碳原子上的SRsl反应通常需要在引发的条件下才能进行.常用的引发条件是光照,加入碱金属(产生溶剂化电子),电化学方法(通过电解池阴极产生电子),在某些情况下也可用热引发一般认为这些过程或者直接产生自由基R或者导致底物RX接受一个电子形成fRX],然后进行链循环SRN1反应的立体化学通常认为是外消旋化.自由基一般以较为稳定的平面结构存在.亲核试剂对自由基的进攻是加到平面体系上,很少受空间因素的影响.这样亲核试剂从两面进攻的机会均等?结果形成外消旋化产物.比如光学活性的2一对硝基苯基一2一硝基丁烷与CHS一在HMPA中反应,结果得到的是外消旋体.对于那些由于空间结构的要求而不能转变为平面]4结构的锥形自由基则往往得到构型保持产物.如:2-甲基4叔丁基一1一硝基环己烷与phS一反应时,底物的自由基负离子离解成的锥形自由基既可被亲核试剂直接进攻?也可转变成平面自由基.因此,在phS浓度高时(r》rJ),锥形自由基还未转变成平面结构之前即被phS一进攻而得到构型保持产物,而在phS一浓度低时(r《rJ).锥形自由基转变成平面自由基后被phS一进攻而得到几乎外消旋化的产物.NO2q/,,士A0t—Bu善—√cH.一,Ar一\Ar/{)A—一i7\Sph所以,SI反应中立体结构的保持只发生在底物很难转变成平面结构自由基的反应过程中.总之,一个反应底物要发生SI反应,它接受电子形成自由基负离子必须比它离解成离子对(s1)或被亲桉试剂进攻形成碳亲桉试弃键(s2)要快.所以一些底物象I一卤代金刚烷,7一溴代降蒈烷等只进行S1反应.底物要快速接受电子,它通常必须是一个好的电子接受体.因此,硝基化合物在s1反应中最常见.当然,饱和碳原子上的s1反应还需进一步完善和发展,但从广泛的意义上讲它是自由基反应和离子型反应的结合,它不仅在理论上有重要意义,而且在合成上有着广阔的前景.s1反应的研究和应用将会进一步丰富有机化学的内容.参考文献lRussellGAa1J.A卅.Chera.S…1996l88:56632LowryTH.RichardsonKS.MechanismandTheoryinO~ganicChemistry.athEdHarpveaadRowNY,l987:409—4803尚振海.有机反应中的电子教应北京:高等教育出版社,1902:2204Bethe[Chem,1987l23:Z76.(…l986;51:606(上接第12页)综上所述,四丁基三溴化铵是一种用途广泛的试剂.作为溴化剂,它具有易于定量称量,操作简便,反应条件温和的特点,同时其溴化产率高,后处理方便,原料可以回收的优点使其在多数情况下可代替液溴在实验室使用.此外,TBABr还可作为一些反应的催化剂用于有机合成.目前,日本,加拿大的学者正在研究该试剂的新用途.可以预期,随着有机合成技术的进展,四丁基三溴化铵必将得到更为广泛的应用.参考文献栀返昭二,柿井孝田.有机台成化学(日),l98846(10>:989丁新腾,刘国斌.有机化学,lg88;8:327Knjiga~hiSeta1..Bul1.Chem.Soc.n.,1987l60:1159KajigaeshiSeta1..BullChem.w.,1987l69;4187BerthelotJ㈨m…,1986;19:1942KajigaeshiSeta1..BullChem.Soc.加,19881:068lDe8heReMA,BertheIotJ-DesbnePL_J.ChemEd.1987l64(1):86 BerthelotJ,BermmraarY,LangeC.TetrahedronLett..1991门2(33)41350 TsutomuIeta1.BuZlC哪1.Sw.加.1991;64:796Fujisak~Seta1.BudtChem.Soc.Jn.,1988;61:140l。
高等有机第四章+饱和碳原子上的亲核取代反应

Nu + R'CH2 L
δ
H H
δ
Nu C L R'
R'CH2 Nu +L-
1、P533 SN2立体化学(Walden转化)发展历史
2、SN2的进攻方式 进攻试剂从C——X键的反面进攻,电子首先进入C——X键 的反键轨道,在过渡态中,分子呈直线性。
Nu
C
L
P534~535磺酸酯分子间反应,证明直线性反应
苏型
外消旋体
机制:
H H CH 3 S Br R OH 的构型为2R,3S,其稳定构象是 CH 3 CH 3 H S Br R H HO CH 3 H3C 即 Br H HO H CH 3
H3C Br
H HO H + HBr CH 3
H3C
H Br H2O H CH 3 S Br R Br CH 3 +Br CH 3
CH3 CH3
Cl
Cl
烯丙型和苄基型卤代烃的SN2速度加快。
当烯丙型和苄基型卤代烃以SN2历程进行时,由于键的存在, 可以和过渡态电子云交盖,形成p-π共轭,使过渡态能量降 低,从而有利于SN2反应。
X
HO CH2 CH CH2
Cl
H H
OH
烯丙基氯 的SN2反应
k1
CH 2SEt
SEt + SCN CH 2SCN
S- 1-氯苯乙烷
H
O
S Ph C Cl H3C O
+ HCl
在乙醚中,HCl不溶,挥发掉。
H O Ph H3C H C O S Ph C Cl H3C O Cl S O H C + SO2 Ph Cl H3C R-1-氯苯乙烷 (构型保持)
卤代烃

第七章卤代烃1)卤代烃的系统命名2)饱和碳原子上的亲核取代反应①水解:卤代烃与强碱(稀)的水溶液共热,卤原子被羟基(﹣OH)取代生成醇。
②与醇钠作用:卤代烃与醇钠在相应的醇中反应,卤原子被烷氧基(RO﹣)取代生成醚。
③与氰化钠(钾)作用:卤代烃与氰化钠或氰化钾作用,卤原子被氰基(﹣CN)取代生成腈(R﹣CN)。
④与氨作用:卤代烃与氨作用,卤原子被氨基(﹣NH₂)取代生成伯氨。
⑤卤原子交换反应:在丙酮中,氯代烷和溴代烷分别与碘化钠反应,生成碘化烷。
⑥与硝酸银作用:卤代烃与硝酸银的乙醇溶液反应,生成卤化银沉淀。
3)卤代烃的消除反应①脱卤化氢:卤代烃与浓碱的醇溶液共热反应,生成烯烃。
补:A.查氏规则:氢原子主要从含氢较少的β-碳原子上脱去,生成双键碳原子上连有较多的取代基的烯烃。
B.多卤代烃发生消除反应时,在可能的结构中,优先生成共轭烯烃。
②脱卤素:连二卤代烷与锌粉在乙酸或乙醇中反应,或与碘化钠的丙酮溶液反应,则脱去卤素生成烯烃。
(注:二卤代烷与锌或者钠作用,则发生内偶联,脱去卤原子生成(小)环烷烃)4)卤代烃与金属反应①金属镁:卤代烃与金属镁在无水乙醚中反应,生成烷基卤化镁(格氏试剂)注:格式试剂(强碱)易与含有活泼氢的化合物(酸,水,醇,氨和端炔烃)作用而被分解为烃。
②金属锂:在惰性气体(乙醚,戊烷)中反应,生成烷基锂。
补:A.金属化反应制有机锂——烷基锂与含有活泼氢的化合物反应B.烷基锂与卤化亚铜反应生成二烃基铜锂(R₂CuLi)合成:二烃基铜锂与卤代烷反应生成烷烃。
5)亲核取代反应机理①SN2:一步反应,旧键断裂与新键生成同时进行,不经历中间态碳正离子,产物构型发生了Walden转化。
补:影响因素:A.烷基结构越拥挤,背面进攻越难。
B.离去基团越易离去,越易反应C.极性非质子溶剂D.亲核试剂亲核能力强,体积小易反应②SN1:分步完成,解离成碳正离子,结合亲核试剂,产物外消旋化。
补:影响因素:A.烷基解离后能生成稳定的碳正离子B.亲核试剂无影响,Ag正离子能促进解离C.易离去基团D.极性溶剂注:SN1经历碳正离子,而越稳定的碳正离子越易生成,so常伴有碳正离子重排现象。
影响亲核取代反应的因素

影响亲核取代反应的因素摘要亲核取代反应是有机化学中一类重要的反应,饱和碳原子上的亲核取代反应可按S N1和S N2两种不同历程进行。
亲核取代反应的两种历程,在反应中同时存在,相互竞争。
对同一反应物来说,在不同的反应条件下反应速率是不同的;在相同的条件下,不同的反应物的活性也不同。
本文讨论了影响亲核取代反应的因素,并总结了某些规律。
关键词亲核取代反应速率影响因素卤代烃的亲核取代反应是一类重要的反应。
由于这类反应可用于各种官能团的转变以及碳碳键的形成,因此在有机合成中具有广泛用途。
本文将以卤代烃的亲核取代反应为例,讨论影响亲核取代反应的因素,即亲核取代反应的反应活性。
大量研究表明,亲核取代反应的活性与反应物的结构(包括烃基和离去基团的结构)、亲核试剂的亲核性和溶剂的性质等因素都有密切的联系。
1反应物的结构1.1烃基的结构烃基的影响体现在两个方面,一个是电子效应,另一个是空间(立体)效应。
一般来说,烃基的电子效应对S N1反应的影响更大,烃基的空间效应对S N2反应的影响更显著。
1.1.1在S N2反应中,烃基的空间效应影响占主导地位,α—碳或β—碳上支链增加,阻碍了亲核试剂从离去基团的背面进攻,且会造成过渡态拥挤程度增加,降低了过渡态的稳定性,使反应速率明显下降。
例如,不同的烷基发生S N2反应的平均相对速度如下:R-CH3-CH3CH2-(CH3)2CH-相对速度30 1 2.5⨯10-2卤代烃按S N2机理进行的活性次序是:烯丙型、苄基型、甲基卤代烷>伯>仲>叔>乙烯型、芳卤、桥头卤代烷在烯丙卤、苄卤的S N2反应中,当亲核试剂进攻α-碳原子时,其反应过渡态应该有p轨道的重叠,旁边的碳碳双键能帮助它分散电荷,起稳定作用。
在乙烯型、芳卤的S N2反应中,因其分子中存在着p-π共轭,使碳卤键键长缩短,键能增加,卤原子不易离去。
桥头卤代烷因桥环的立体障碍,亲核试剂不能从背面进攻α-碳原子,故不易发生S N2反应。
第六章饱和碳原子上的亲核取代反应和消除反应-文档资料

(2) 消去一个-H+------消去反应,生成双键
+ β H C H H C H C H C H 3C 2 3C 2
(3) 重排成更稳定的碳正离子
C H 3 C H H 3 C C 2 C H 3 C H 3 C H H H 3 C C 2C 3
第三节 手性碳原子的构型保持和构型翻转 Walden(瓦尔顿)转换(P249)
提示: 一级反应和二级反应
反应速度只取决于一种化合物浓度的反应,在 动力学上称为一级反应。V=k[A] 反应速度取决于两种化合物浓度的反应,在动 力学上称为二级反应。V=k[A][B]
第六节 亲核取代反应的机理
两个实验事实(补):
N aO H 1. CH Br O H CH O H Br + + 3 3 H O 2 O H 二级反应(SN2) k[CH Br][ ] v= 3 N aO H 2. (CH ) CBr O H (CH ) CO H Br + + 33 33 H 2O
C l C C C
-
+
+
+
3. 比较标准:以H为标准 常见的吸电子基团(吸电子诱导效应用-I表示) -NO2 > -CN > -F > -Cl > -Br > -I > -CC > -OCH3 > -OH > -C6H5 > -C=C > -H 常见的给电子基团(给电子诱导效应用+I表示) -C(CH3)3 > -CH(CH3)2 > -CH2CH3 > -CH3 > -H
+ + + + -
3. 给电子共轭效应 用+C表示
饱和碳原子上的亲核取代反应

CCCCCC
LLLLLLL
若是卤素连在 手性碳原子上的卤
烷发生S N 2反应,
则产物的构型与原 来反应物的构型相 反,这称为瓦尔登转 化或瓦尔登反转
举例:溴甲烷碱性水解
反应速率=k[BrCH3][OH-] 举例:2-溴辛烷碱性水解
反应速率=k[C6H13CHBrCH3][OH-]
四、邻基参与作用(分子内亲核取代反应历程) Neighboring group participation
2. 离去基团的影响 在SN1和SN2反应中,C-L键断裂,L带着一对电子离去。若离 去基团L容易离去,那么反应中有较多的碳正离子中间体生成, 反应按SN1历程进行,反之,则按SN2进行.
(1) 离去基团的碱性越弱越易离去 •酸性:HI > HBr > HCl > HF •碱性:I- < Br- < Cl- < F•离去倾向:I- >Br- >Cl- >F•卤代烷的活性:RI > RBr > RCl > RF。
高等有机化学
饱和碳原子上的 亲核取代反应
Substitution Nucleophilic reaction
本章内容
第一节 脂肪族亲核取代反应
一、脂肪族亲核取代反应概述 二、SN1机理及立体化学 三、SN2机理及立体化学 四、邻基参与作用(分子内亲核取代反应历程) 五、离子对机理
第二节 影响亲核取代反应的因素
CH 3CH2CH2Br
SN1
(CH 3)2CHCH 2Br
(CH 3)3CCH 2Br
共同点:都为伯卤代烃。 结论:随着位取代基的增多,反应速率明显下降。 原因:SN2反应是亲核试剂从离去基团的背面进攻中 心碳原子, 位取代基越多,空间阻力越大,亲核试 剂越不容易接近中心碳原子,反应速率减小。说明 空间效应是影响SN2的主要因素。
有机化学反应机理总结

CH 3
CH 3 H2SO4(浓) CH 3
CH 3
O
+C
CH 3
CH 3
+O
C
CH 3
CH 3
CH 3
CH 3
CH 3
CH 3
属于SN1机理
CH3OH
CH 3
OH
C-
O
+
CH3 CH 3
-H+
CH 3
O
C- O C H 3 CH 3
Hale Waihona Puke 78%CH 3CH 3
仅有少量空阻大的羧酸按此反应机理进行
*1. 碱性水解
NO2
在芳香亲核取代反应中,吸电子基是一个活化的邻对位定位基。
应用实例
O 2 N
O C 2 H 5 + H 2 N N O 2
-X
1 8 0 o C
O 2 N
O
OCH3
HN+ E tO H
N O 2
H
X
HO
OCH3
-NO2
HNO2
SN1Ar反应机理
[C 6H 5N 2]+C l- H B F4 [C 6H 5N 2]+B F4- -N 2
实例:卤代烃单分子亲核取代反应的反应机理(SN1)
R1 R2 C
R3
反应物
Br
慢
R1 R2 C
R3
-Br-
Br
过渡态
R2 R1
Nu-
C+
快
R3
中间体
R1 R2 C
R3
Nu
+
Nu
R1 C R2
R3
R1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3 Br HO CH3 H Br
CH3 H
+ HBr
H Br CH3 H
+ H2O
赤式
(meso)
CH3 Br HO CH3 H H HO
Br H H CH3 CH3
Br CH3 H OH CH3 H
Br
H+
H
CH3 CH3 OH2
H
-H2O
+
Br
H a CH3CH3
H3C
Br H H Br CH3 CH3 Br H Br
态的稳定性来达到的。 在绝大多数 SN1 反应中,TS 是由中性分子离解形成带电荷的离子,过渡态 的电荷比作用物有所增强。因此,溶剂极性增强,对 TS 稳定化作用大,使 TS 能量降低,反应速度增大。与此相反的是,TS 与作用物相比电荷减少,则溶剂 极性增加,更稳定作用物,反应速率减慢。 例:
(CH3)3C S (CH3)2 + SOL-OH (CH3)3C SOL 80%C2H5OH 0.659 H2O 0.32 + H+ + S(CH3)2
三、离子对历程 有些化合物的亲核取代反应, 其动力学和立体化学特征介于 SN1 和 SN2 之间, 故提出了离子对历程来统一说明亲核取代反应的历程。
离子对历程认为,反应物在溶液中是分步离解的:1. 紧密离子对;2. 溶剂 分隔离子对;3. 自由正负离子。整个过程是可逆的,反应时亲核剂(Nu-或溶剂
O R O S O
CH3
R
+
O O S O
CH3
(即 OTs)
(CH3)3C X + H2O X: F
80%C2H5OH-H2O Cl 1.0 Br 39
(CH3)3C OH + X I 99 OTs >105
相对速率:10-5
因此,可以理解,当离去基团为 OH、OR、NR2 时,亲核取代反应受到质子酸催 化。
代烷易按 SN1 进行,二级卤代烷介乎其间。
CH2X > RCH = CHCH2X 烯丙型 卤代烷 RX > RCH = CHX 乙烯型 X
(2)离去基团的性质。SN2 的 rds 也涉及 R-L 键的断裂,与 SN1 反应一样,
L 离去能力增强将加速反应。如反应物既可能起 SN2,也可能起 SN1 反应(含仲
-H2O
H H CH3 Br
Br b
Br H CH3
+
H Br CH3
Br H
(a)
(b)
(2) π 参与
C=O、C=C 的 π 键作为邻基参与反应。
反式-7-降冰片烯基对甲苯磺酸酯的乙酸解比顺式异构体快 107 倍, 比相应的饱和
酯快 1011 倍,还得到构型未变的产物都说明 C=Cπ 键的参与: 例 1:
(CH3)3C Br 80%C2H5OH/H2O SN1相对速率 1 10-3 10-6 10-12
Br Br
Br
2.影响 SN2 反应速度的因素
(1)烃基的结构。a-C 的立体障碍越大,RL 越不活泼:CH3L > RCH2L >
R2CHL > R3CL。综合电子效应和空间效应,一级卤代烷易按 SN2 进行,三级卤
B. 离去基离去后生成的负离子越稳定(负电荷愈分散) ,则越易离去。
负离子稳定性及离去倾向:
NO2 SO2OSO2O> Br > ISO2O- > H SO2O- > CH3 SO2O- >
H3CO
(3)亲核剂(Nu)的性质对 SN1 反应速度影响不大。 (4)溶剂,溶剂对亲核取代反应的影响,主要是通过溶剂化效应影响过渡
CH3 H H CH3
Br
H
Br
消旋体
例 2:
CH3 H HO CH3 Br H CH3 CH3 Br H CH3
HBr
H Br
+
Br H
H Br CH3
苏式
CH3 H HO CH3 Br H CH3
外消旋体 a
CH3 Br H CH3
CH3
CH3 H Br
H
+
H H2O
恰与碱性次序相反,而与可极化性的大小次序一致:
RS- > RO-, RSH > ROH, I- > Br- > Cl- > Fe.空间因素对亲核性的影响,亲核剂体积大,按 SN2 历程,从 L 的背后进攻反
应中心是有困难的。因此,亲核性的次序有:
(CH3)3CO- < (CH3)2CHO- < CH3CH2O- < CH3O-,与碱性大小顺序相反。 3.与 SN2 反应竞争的副反应是消去反应,见第六章。
TS 比作用物电荷分散,速度减慢。
又如,
(CH3)3N + CH3Cl δ[ (CH3)3N CH3 δCl ] (CH3)4N+ + Cl-
与中性作用物(CH3)3N 和 CH3Cl 相比,TS 出现一定程度的电荷分散,溶剂极性 增大,反应速度加快。 (4)亲核剂对 SN2 反应速度影响很大。亲核剂是都具有未共享电子对的路 易斯碱,有碱性和亲核性。碱性是其与 H+结合的能力;亲核性是其与缺电子碳 原子中心的结合能力。试剂亲核性强,浓度大,SN2 反应速度快。
Br + HBr
一、SN1 历程 单分子亲核取代反应 SN1 反应,单分子意指反应的决定速率步骤(rds)中, 发生共价键变化的只有一种分子。
1.历程
(CH3)3C Br + (CH3)3C + d(t-BuOH) dt k1 慢 (CH3)3C+ + Brk2快
OH-
(CH3)3C+ + Br-1 K-1[Br ] K2[OH-]
H OTs H H OAc
反应相对速率 -OTs OAc
1011 构型保持产物
Nu
SOL-OH
Nu RNu NuR
SOL-OH RO-SOL SOL-OR
NuR SOL-OR 构型转化
构型转化
RNu RO-SOL 构型保持或转化
外消旋化
四、邻基参与历程, 邻基参与历程,非经典碳正离子 在亲核取代反应中,在离去基团的 β-位(或更远)上有一带有未共享电子对 或带有负电荷的原子或原子团以及 π 体系等参与了反应,对亲核取代反应的速 度、 立体化学等都产生很大影响, 这种作用称为邻基参与。 其历程一般可表示为:
-
= K1(t-BuBr) 1 +
≈ K1[t-BuBr]
因为 K2[OH-] >> K-1[Br-]
第一步为 rds
(CH3)3C+,Br-,OHt-BuBr, OH-
t-BuOH,Br-
因此,由于活性中间体是平面构型,亲核剂从平面两侧进攻碳正离子中心的机会 相等,反应中心若有手性,必将产生构型保持和构型转化产物各半(外消旋化) 。 事实上, 只有在极限 SN1 的情况下, 才会形成非手性的 “自由” 碳正离子中间体。 如果碳正离子能量较高,活性较强,一经生成便受亲核试剂进攻,此时离去基团 (L)尚未远离反应中心(碳正离子与离去基团处于紧密离子对阶段) ,它将阻 止亲核剂的正面进攻,结果导致构型转化产物。
(2)离去基团的性质。rds 涉及 R-L 的断裂,因此 L 越易离去,反应速度 越大。离去倾向:I > Br > Cl > F。因为 F 与 C 价轨道能量相近,重叠很有效,
C-F 键能大不易断裂;而 I 与 C 价轨道能量相差大,重叠得较差,C-I 键键能较
小,易断裂。—OTs 是很好的离去基团,由于共轭效应所致。
CH3CH2CHCH3 OH + HBr CH3CH2CHCH3 + Br OH2 CH3CH2CHCH3 + Br CH3CH2CHCH3 Br
比较各离去基团离去的难易常用的方法如下:
A. 离去基碱性愈弱,愈易离去。而碱性越弱的基团,其共轭酸酸性愈强。例:
酸性:HI > HBr > HCl > HF 碱性:I- < Br- < Cl- < F离去倾向:I- < Br- < Cl- < F卤代烷的活性:RI > RBr > RCl > RF
第三章 饱和碳原子上的亲核取代反应
学习要求: 学习要求 1.熟悉亲核取代反应的几种历程(SN1、SN2、离子对) ,影响 SN1、SN2 反应速 度的因素,碳正离子重排及亲核性。 2.掌握邻基参与反应(历程、立体化学、非经典碳正离子) 。 3.熟悉 RX、ROH、环氧乙烷及其衍生物,碳负离子亲核剂等的亲核取代反应 及其应用。
1.历程
HO
C Br 背后进攻
δ[ HO
C 双三角锥形 TS
δBr ]
HO C
+ Br
瓦尔登转化 构型转化的产物
TS G H3C CH3
R P 反应坐标 SN2反应的位能曲线
TsO
不发生SN2的刚性环进行SN1也是困难 的
因此,刚性桥头碳上不发生 SN2 反应(背后进攻受到空间阻碍,Walden 转化没 有可能) ,就是发生 SN1 也是困难的,因此生成的碳正离子不能形成平面结构。
SOL-OH: C2H5OH 相对速度: 1
3.竞争反应
与 SN1 竞争的副反应有消去反应和重排反应。 重排总是形成更稳定的碳正离 子,再与亲核剂反应。
H2O (CH3)3CCH2Br C2H5OH/H2O (CH3)3CCH2+ 1o 重排 + (CH3)2C CH2CH3 3o C2H5OH -H+ OH (CH3)2C CH2CH3 (CH3)2C CH2CH3 OC2H5 (CH3)2C=CHCH3
