Friedel-Crafts烷基化反应
傅克反应资料讲解

傅克反应傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
有机催化吲哚的不对称Friedel-Crafts烷基化反应研究进展

(收稿日期:20180320)
625.
檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽檽
文章编号: ( ) 16732995 2019 04027904
·综 述·
有机催化吲哚的不对称FriedelCrafts 烷基化反应研究进展
[15] 杨昆政. 门冬氨酸鸟氨酸联合乳果糖治疗肝性脑病的 [19] 蔡丽秋,杨丽雄. 门冬氨酸鸟氨酸联合乳果糖治疗肝性
疗效探讨[J]. 中外医疗,2016,35(6):118120.
脑病的疗效观察[J]. 海峡药学,2017,29(7):9193.
[16] 肖政,尹雄章,黄泽中. 门冬氨酸鸟氨酸联合乳果糖治 疗肝性脑病30 例[J]. 医药导报,2013,32 (5):623
吴 昊1,马静洁1,陈 哲2,金 瑛2 (1. 延边大学药学院,吉林延吉 133002;2. 吉林医药学院药学院,吉 林吉林 132013)
摘要:
FriedelCrafts
烷基化反应是构建与芳香化合物直接相连的CC
键最有效的方法之一,是有机合成领
域中的重要反应且被广泛使用。吲哚的不对称FriedelCrafts 烷基化反应是合成手性吲哚衍生物的直接途径。
[14] 占国清,郑三菊,胡波,等. 门冬氨酸鸟氨酸联合乳果糖
效观察[J]. 实用肝脏病杂志,2011,14(2):151157.
治疗肝性脑病的疗效分析[J]. 临床肝胆病杂志,2009, [18] 崔英. 门冬氨酸鸟氨酸联合乳果糖治疗肝性脑病的疗
(): 25 5 359361.
效评价[J]. 中外医疗,2010,29(19):9192.
2006 年,Deng[5]报道了金鸡纳碱衍生物有机催 化吲哚与羰基化合物的不对称FriedelCrafts 反应,该 实验的ee 值高达99% (图2)。
傅-克(friedel-crafts)酰基化反应例子

傅-克(friedel-crafts)酰基化反应例子下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!傅-克(Friedel-Crafts)酰基化反应示例1. 介绍在有机化学中,傅-克(Friedel-Crafts)反应是一种重要的烷基化和酰基化反应,它通过烷基卤化物或酰卤与芳香化合物在Lewis酸催化下反应来引入烷基或酰基基团。
Friedel-crafts反应Grignard 反应Oppenauer氧化

Friedel-crafts反应
制药工程15(研)
反应简介
3
Friedel-crafts反应
酰基化反应 烷基化反应Leabharlann 亲电取代反应酰 基 化
烷基化
应用
Grignard 反应
格氏试剂 Grignard reagent 一种金属有机化 合物,通式RMgX(R代表烃基,X代表卤素)。 1901年由F.-A.V.格利雅首次使用卤代烃RX与 镁在醚类溶液中反应制得。又称格利雅试剂。
Oppenauer氧化 反应机理
应用
Oppenauer氧化法既可以氧化饱和醇,也可以氧 化不饱和醇。
Grignard 反应
维克多· 格林尼亚 。1871 年5月6日-1935年12月 13日),法国化学家, 因发明了格氏试剂与他的 同事保罗· 萨巴捷一同获 得诺贝尔化学奖。
Grignard 反应机理
Oppenauer氧化
沃氏氧化反应(Oppenauer氧化),也译作 欧芬脑尔氧化,是二级醇与丙酮(或甲乙酮、 环己酮)在碱存在下一起反应,醇被氧化为 酮,同时丙酮被还原为异丙醇的反应。
药物合成反应综合习题与答案-2

《药物合成反应》综合习题与答案(答案附后)一、判断题。
1.NBS是N-氯代丁二酰亚胺。
2.烃化试剂如R-Br,一般提供烃化反应的负电中心。
3.酰化试剂一般提供酰化反应的正电中心,表现在羰基的碳原子上。
4.SN1反应的典型特征是生成构型反转的产物。
5.Friedel-Crafts烷基化底物中苯环上存在给电子基团,会促进反应的发生。
6.LiAlH4的还原性弱于NaBH4。
7.卤仿反应为甲基酮类化合物在酸性条件下发生的α-H的多次卤代水解。
8.还原反应是有机分子中增加H的反应。
9.氰基是一种吸电子能力极强的基团,这种能力强于硝基。
10.不饱和烃与卤素的加成反应中,Cl2易按桥型卤正离子机理进行。
二、选择题。
1. 药物合成反应的主要任务是。
A. 研究药物的毒性反应B. 研究药物的生物活性C. 研究药物合成及修饰方法D. 研究药物的剂型改造2.下列碳正离子稳定性最弱的是。
A. RCH2+B. H3C+C. R2CH+D. R3C+3.以下有关Friedel-Crafts烷基化反应的影响因素正确的是。
A.底物芳环上存在吸电子基团,有助于反应的发生B.底物芳环上存在给电子基团,有助于反应的发生C.质子酸的催化活性强于Lewis酸D. HF的催化活性弱于磷酸4.氰基还原得到的产物类型是。
A. 酰胺B. 脂肪胺C. 羟基D.亚甲基5.以下基团的吸电子能力最强的是。
A. 硝基B. 苯基C. 磺酰基D. 酯基6.亲核反应、亲电反应最主要的区别是。
A. 反应的动力学不同B. 反应要进攻的活性中心的电荷不同C. 反应的热力学不同D. 反应的立体化学不同7.共轭二烯烃与烯烃、炔烃(亲二烯)进行环化反应,生成环己烯衍生物的反应称为。
A. Diels-Alder反应B. Perkin反应C. Michael反应D. Blanc反应8.由羧酸为原料制备酰氯的过程中,最常的优良试剂是。
A. PCl5B. SOCl2C.PCl3D. POCl39. 自由基反应的条件通常是。
Williamson合成法(精)

谢谢观赏
Make Presentation much more fun
Friedel-Crafts反应
——廖云鹏 刘宾
Friedel-Crafts反应
定义: 芳烃在Lewis酸( 无水氯化铝、氯化锌、三氯化铁、 三氟化 硼 等)存在下发生的酰基化和烷基化反应。 Friedel-Crafts 反应常用的催化剂有 AlCl3 、FeCl3、 H2SO4 等, 目前,对Friedel-Crafts 反应已经开发出多种新型催化剂, 如三氟甲 磺酸盐、杂多酸、离子交换树脂等。 概括说明: 该反应是合成芳基酮、烷基苯的重要方法。是有 机合成中最有用的 下,苯与酰氯 或酸酐反应生成芳基酮。
2、烷基化反应:在无水氯化铝或无水三氯化 铁存在下,苯与卤代烷反应生成烷基苯。
Williamson 合成法
• 卤代烃与醇钠在无水条件下反应生成醚: • 如果使用酚类反应,则可以在氢氧化钠水溶液中进行:
酚醚的制备方法
• 是否可以以苯酚为原料,用Williamson法合 成酚醚? 如果可以,那么是否会发生苯环上的 Friedel-Crafts反应干扰合成
• 可以 • 因为williamson反应的本质就是Sn2反应, 反应能否进行主要在于卤代烃的位阻。而且 Friedel-Crafts反应不会干扰合成,FriedelCrafts反应的发生需要路易斯酸(路易斯酸 (Lewis Acid,LA)是指电子接受体,(即 有可以用来接收电子对的空轨道)。也可看作 形成配位键的中心体。)催化卤代烃形成碳正 离子,对苯环进行亲电取代,Williamson法 中只需要碱来催化
friedel-crafts羟烷基化聚合

英文回答:The process known as Friedel-Crafts hydroxyalkylation polymerization involves the incorporation of hydroxyalkyl groups into a polymer chain utilizing the Friedel-Crafts reaction mechanism. The Friedel-Crafts reaction itself is classified as an electrophilic aromatic substitution reaction, wherein an aromatic ring is substituted with an alkyl or acyl group. In the context of hydroxyalkylation polymerization, the substituent introduced onto the aromatic ring takes the form of a hydroxyalkyl group, such as hydroxymethyl or hydroxyethyl. This method of polymerization can yield a variety of hydroxyalkylated polymers with distinct properties and applications.称为Friedel—Crafts 羟基化聚合的过程涉及利用Friedel—Crafts反应机制将羟基团并入聚合链。
Friedel—Crafts反应本身被归类为电离芳香取代反应,其中芳香环被烯烃或烯烃组取代。
在羟基化聚合中,引入到芳香环上的亚基采取羟基团的形式,如羟基甲基或羟基乙基。
这种聚合法可以产生多种具有不同特性和应用的羟基化聚合物。
Friedel_Crafts反应的发现史

化学史Fr iedel -Craf ts 反应的发现史张殷全(广州师范学院化学系 广州 510405)张殷全 男,52岁,副教授,从事有机合成及化学史研究。
1999209221收稿摘 要 介绍F riedel 和C rafts 在进行Gustavson 反应的实验过程中如何发现了Zincke 反应的本质,从而创立了以无水三氯化铝等金属卤化物为催化剂的烷基化和酰基化反应。
关键词 傅克反应 烷基化反应 酰基化反应 化学史1999年4月20日,是F riedel 逝世一百周年的纪念日。
回顾他们创立F riedel 2C rafts 反应的过程,是一件很有意义的事情,从中我们会得到一些有益的启发。
在芳环上引入烃基的反应,最初是由德国化学家Zincke (T heodo r Zincke ,1843~1928)在1869年首次报道的[1]。
当时他想从苄氯和氯乙酸(以苯为溶剂)出发,在铜粉(或银粉)催化和封管加热下,通过类似W u rtz 反应的方法制备苯丙酸:PhCH 2C l +C lCH 2COOH Cu PhH PhCH 2CH 2COOH +C l 2但是他发现反应时放出了大量的氯化氢,所得产物中竟含有二苯甲烷。
他意识到这是苄氯与溶剂苯发生下列反应造成的:PhCH 2C l +PhH Cu 150~160℃ PhCH 2Ph +HC l于是他饶有兴致地研究起在苯环上引入苄基的方法。
在1871~1872年间,他改进了反应条件,用锌粉或还原铁粉代替铜粉或银粉,用普通烧瓶在100℃下的加热回流代替封管强热,以此实现了若干苄基化反应:PhCH 2C l +PhH Zn PhCH 2Ph PhCH 2C l +PhCH 3 Zn PhCH 2CH 3这种反应在历史上曾被称为“Zincke 反应”。
类似的现象也出现在苯甲酰氯的反应中。
1873年,Zincke 试图在铜粉(银粉或锌粉)存在下,通过两分子苯甲酰氯的W u rtz 型偶联反应来制备联苯酰:2PhCOC l Zn PhH PhCOCO Ph +C l 2但他再次观察到有大量的氯化氢气体放出。
乙酰二茂铁制备的注意事项

乙酰二茂铁制备的注意事项乙酰二茂铁(Acetylferrocene)是一种重要的有机金属化合物,具有广泛的应用。
制备乙酰二茂铁的方法主要有四种:Grignard试剂法、Friedel-Crafts烷基化反应、酰化反应和溶剂交换法。
下面我将针对乙酰二茂铁的制备注意事项进行详细介绍。
首先,通过Grignard试剂法制备乙酰二茂铁时,应注意以下几个方面。
首先,乙酰二茂铁的合成需要使用无水环己烷等惰性溶剂,因此需要对溶剂进行干燥处理,以避免水分和氧气对反应的干扰。
其次,应注意对环己酸的干燥和保护,环己酸是制备Grignard试剂的前体,其干燥程度会影响反应的进行和产率的高低。
另外,制备Grignard试剂时,应保持反应体系的无氧和无湿的条件,避免与空气和水分接触。
其次,通过Friedel-Crafts烷基化反应制备乙酰二茂铁时,需注意以下几个要点。
首先,合成时选择合适的芳烃底物,选用易与乙酰氯反应的芳烃,如苯、甲苯等。
同时,应选择适当的Lewis酸催化剂,常用的有硼氟化镁、氯化铝等,以促进反应的进行。
其次,反应温度对于该反应的选择也很重要,通常采用低温条件进行,以避免副反应的发生。
此外,反应物和催化剂的摩尔比例也需合理控制,以保证产率和选择性。
第三种方法是通过酰化反应制备乙酰二茂铁。
在酰化反应中,乙酰氯与二茂铁在较强的催化剂存在下反应生成乙酰二茂铁。
制备过程中需注意若干方面。
首先,合成过程需要使用无水氯化亚铁作为催化剂,因此应注意对催化剂的选择和处理。
其次,在该反应中,乙酰氯的用量应控制得当,过量的乙酰氯可能会导致副反应的发生,降低产率。
同时,反应温度也会影响反应的进行,通常在室温下进行较好。
最后一种方法是溶剂交换法制备乙酰二茂铁。
溶剂交换法是在二茂铁和乙酰乙酸铁之间进行配合物的交换反应,制备乙酰二茂铁。
制备时需注意以下几点。
首先,应选择合适的溶剂,如二氯甲烷、丙酮等,以促进反应的进行,同时应保证溶剂的质量纯净。
药物合成反应综合习题与答案-3

30. 以下哪个试剂为常用的缩合试剂?
A.
B.
C.
D.
三、请解释以下反应的历程。 1. 2.
3.
4.
四、完成反应式。 1. 2. 3. 4.
5. 6. 7. 8. 9.
10.
五、 问答题。 1. 根据本学期的实验“磺胺醋酰钠的合成”,回答以下问题:
(1) 该反应属于你学习过的什么反应类型? (2) 请解释以上反应的机理。
。
A. 硝基
B. 苯基
C. 磺酰基
D. 甲氧基
6.脂肪胺的 N-酰化产物的类型是
。
A、 酯 B、 酰胺 C、 酮 D、 酸酐
7.Friedel-Crafts 酰基化反应常与 联用,以制备带侧链芳烃的纯品。
A. Diels-Alder 反应 B. Perkin 反应 C. Clemmensen 反应 D. Blanc 反应
B.仲醇
C. 叔醇
D. 苄醇
14. 以下试剂与醇发生 O-酰化反应,活性最强的是哪一种 。
A. 乙酰胺
B. 苯甲酰氯 C. 丁酸酯
D. 乙酸酐
15.酸性最强的羧酸是 。
A. 苯甲酸 B. 对硝基苯甲酸 C. 对氰基基苯甲酸 D. 对甲氧基苯甲酸
16. 以下反应属于哪种反应类型 。
A. Hundriecker
8.由羧酸制备酰氯最常用最有效的试剂是 。
A. PCl5
B. SOCl2 C. PCl3
D. POCl3
9. 烯丙位 H 的卤取代反应的条件是什么?
。
A. 光照或引发剂 B. 碱性环境 C. 酸性环境 D. 质子溶剂
10. 以下催化剂中,不能够夺取 H 原子,起到碱性作用的是 。
2017.8.14-傅克反应

(3)由于烷基化反应是可逆的,烷基苯在强酸的催化下,能够发生烷基 的歧化和转移。当苯过量时,则有利于发生烷基的转移,使多烷基苯向单 烷基苯转化。利用这一性质,在制备单取代烷基苯时,可使副产物的多烷 基苯与苯发生烷基转移,即脱烷基再与苯进行烷基化,以增加单取代烷基 苯的收率。 (4)芳环上的取代基对傅克烷基化反应有较大影响,当芳环上连有硝基、 氰基等吸电子基团时,反应不易进行,甚至不能发生。
傅克反应原理及实验技巧
目录
简介
Friedel–Crafts 烷基化反应
Friedel–Crafts 酰基化反应 傅克反应的操作方法 烷基化与酰基化的异同
一、简介
傅里德-克拉夫茨反应,简称傅-克反应,英文Friedel–Crafts reaction,是 一类芳香族亲电取代反应,1877年由法国化学家查尔斯· 傅里德(Friedel C) 和美国化学家詹姆斯· 克拉夫茨(Crafts J)共同发现。 Friedel–Crafts 反应是一种重要的形成碳碳单键的反应,而碳碳单键的形 成是有机合成中极为重要的一部分内容。
ቤተ መጻሕፍቲ ባይዱ
离产物。
如用氟化氢作催化剂,就把反应物溶解在大量液体氟化氢中, 在室温下放置一定时间,让氟化氢自行蒸发掉,设备要用聚乙 烯材料,铜、镍和不锈钢器具也可以用。 用氟化硼为催化剂时,可以把反应物和溶剂混合,在搅拌下通 入氟化硼气体。
五、烷基化与酰基化的异同
相同点:催化剂相同;反应机理相似;苯环上带有强吸电子基时 (如硝基、磺基、酰基和氰基等),一般不发生反应。 不同点:烷基化反应是可逆的,而酰基化反应不可逆;由于烷基 化反应的可逆性,所以常常伴随着歧化反应,即一份子的烷基苯 脱烷基,另一分子则增加烷基。
蒽与叔丁醇Friedel-Crafts烷基化反应

t e r t F r i e d e l -C r a f t s r e a c t i o n o f a n t h r a c e n e w i t h - b u t a n o l c a t a l z e d b t h e z e o l i t e c a t a l s t w a s i n v e s t i a t e d . T h e r o d u c t s w e r e y y y g p
叶金鑫 ,孙 京 ,王 欣 ,周明东
) ( 辽宁 抚顺 1 辽宁石油化工大学 化学与材料科学学院 , 1 3 0 0 1 摘 要: 环保 、 绿色的具有特定空 间 结 构 的 固 体 酸 催 化 剂 , 被广泛应用于石油化工 分子筛催化剂是一种高效 、 和有机合成等领域 。 利用离子交换方法合成了一种酸性微孔 β分子筛催化剂 , 并且研究了该分子筛催化剂催化蒽与 1 , 、 、 、 叔丁醇的 F 烷基化反 应 通 过 元 素 分 析 等手段对反应产物进行了细致的表 r i e d e l r a f t s G C-M SF T R H-NMR -C - I 征 。 在此基础上 , 对蒽与叔丁醇的 F 所合成的酸性分子 r i e d e l r a f t s烷基化反应机理进行了初步的探讨 。 结果表明 , -C 筛催化剂具有较高的催化活性 , 异辛烷不仅 仅 作 为 反 应 溶 剂 , 还能与分子筛形成叔丁基碳正离子促进反应进行, 反 应主要生成 2 具有很好的工业应用前景 。 6 -叔丁基蒽和 2, -二叔丁基蒽两种产物 , 关键词 : -C 蒽; 酸性分子筛 ; F r i e d e l r a f t s烷基化 : / 中图分类号 : T E 6 2 4. 4; TQ 0 3 1. 2 文献标志码 : A d o i 1 0. 3 9 6 9 i . s s n . 1 6 7 2 9 5 2. 2 0 1 7. 0 1. 0 0 3 - 6 j
傅克反应

傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
FeCl3催化羰基化合物与芳烃的还原Friedel-Crafts 烷基化反应

2009年第29卷有 机 化 学V ol. 29, 2009 第3期, 403~408Chinese Journal of Organic ChemistryNo. 3, 403~408* E-mail: gqlai@hznu.eReceived April 23, 2008; revised September 11, 2008; accepted November 3, 2008.浙江省自然科学基金(No. Y4080380)和浙江省钱江人才计划基金(No. 2008R10018)资助项目.404有 机 化 学 V ol. 29, 20091 实验1.1 试剂所用FeCl 3, AlCl 3, ZnCl 2, TiCl 4, InCl 3, CuCl 2, 有机溶剂, 羰基化合物和芳香烃及杂环化合物均为市售化学纯药品; 氯硅烷为市售分析纯药品. 溶剂和氯硅烷在使用前需经过干燥或蒸馏. 1.2 仪器GC-MS 采用Trace DSQ GC-MS Column 测定; 核磁共振谱采用Bruker Advance 400 M Hz 型核磁共振仪测定, CDCl 3为溶剂, TMS 为内标; 红外光谱采用液膜或压片法, 在Bruker Tensor-27型红外仪上测定. 1.3 羰基化合物的还原烷基化反应在25 mL 三口烧瓶中加入路易斯酸催化剂(0.025 mmol), 5 mL 有机溶剂, 羰基化合物1 (0.5 mmol), 噻酚或者芳烃2 (0.55 mmol)和二甲基氯硅烷(0.5 mmol), 在氮气保护下加热回流数小时. 实验过程中通过薄层硅胶板(TLC)跟踪, 用紫外灯检测. 反应完全后, 加入稀盐酸终止反应. 乙醚萃取, 有机层用饱和碳酸氢钠和氯化钠溶液各洗两次, 然后用无水硫酸镁干燥, 减压蒸去有机溶剂, 经柱层析得烷基化产物3.Scheme 12.3 产物数据2-(1-苯基乙基)噻吩(3a )[15a]: 1H NM R (400 M Hz, CDCl 3) δ: 7.30~7.17 (m, 5H, ArH), 7.11 (d, J =8.0 Hz, 1H, thiophene-H), 6.94~6.87 (m, 1H, thiophene-H), 6.78 (d, J =8.0 Hz, 1H, thiophene-H), 4.32 (q, J =4.6 Hz, 1H, CH), 1.69 (d, J =4.8 Hz, 3H, CH 3); 13C NMR (100 MHz, CDCl 3) δ: 150.84, 146.41, 128.64, 128.40, 127.69, 126.89, 126.67, 125.52, 123.77, 123.11, 41.05, 23.32; IR (film) νmax : 3026.5, 2968.6, 1610.2, 1492.9, 1451.5, 1383.5, 1262.8, 1223.6, 1047.9, 1027.3, 850.6, 828.9, 760.0, 698.1 cm -1; MS m /z (%): 188 (M +, 45), 173 (100), 129 (10).2-[1-(4-氯)苯基乙基]噻吩(3b ): 1H NM R (400 M Hz, CDCl 3) δ: 7.32~7.16 (m, 5H, Ar-H and thiophene-H), 6.97 (t, J =8.0 Hz, 1H, thiophene-H), 6.83 (d, J =8.0 Hz, 1H, thiophene-H), 4.36 (q, J =4.2 Hz, 1H, CH), 1.72 (d,J =3.0 Hz, CH 3CH); 13C NM R (100 M Hz, CDCl 3) δ: 150.01, 144.45, 132.28, 128.70, 127.70, 126.63, 125.70, 124.14, 123.15, 120.08, 40.28, 23.17; IR (film) νmax : 3080.3, 3040.2, 3026.0, 2965.2, 2891.3, 2843.5, 1594.5, 1492.3, 1451.6, 1390.4, 1372.5, 1060.2, 1092.0, 1014.1, 950.6, 827.7, 804.5, 761.6, 745.2, 698.7 cm -1; M S m /z(%): 223 (M +, 19), 222 (52), 209 (36), 207 (100), 172 (25), 171 (30).2-[1-(4-甲氧基)苯基乙基]噻吩(3c ): 1H NM R (400 MHz, CDCl 3) δ: 7.27~7.14 (m, 3H, ArH), 6.92 (d, J =8.0 Hz, 1H, ArH), 6.88~6.84 (m, 2H, thiophene-H), 6.80 (d, J =8.0 Hz, 1H, thiophene-H), 4.31 (q, J =4.2 Hz, 1H, CH), 3.80 (s, 3H, CH 3OAr), 1.69 (d, J =4.6 Hz, 3H, CH 3CH);13C NM R (100 M Hz, CDCl 3) δ: 158.15, 151.34, 138.29,128.24, 126.53, 123.44, 122.74, 119.70, 113.84, 55.27, 39.98, 23.35; IR (film) νmax : 2965.8, 2910.3, 2812.5, 1610.6, 1582.3, 1462.1, 1403.7, 1302.5, 1266.7, 1246.2, 1178.4, 1035.1, 862.6, 631.0, 810.8, 697.9, 581.3 cm -1;MS m /z (%): 218 (M +, 40), 203 (100), 160 (9).2-[1-(4-硝基)苯基乙基]噻吩(3d )[15a]: 1H NM R (400 MHz, CDCl 3) δ: 8.48~7.89 (m, 4H, ArH), 7.75~7.36 (m, 2H, thiophene-H), 7.25 (d, J =8.2 Hz, 1H, thiophene-H), 4.25 (q, J =4.2 Hz, 1H, CH), 1.71 (d, J =5.6 Hz, 3H, CH 3CH); MS m /z (%): 233 (M +, 51), 218 (100), 172 (28).2-(1-苯基正丁基)噻吩(3e ): 1H NM R (400 M Hz, CDCl 3) δ: 7.30~7.24 (m, 3H, ArH), 7.20~7.15 (m, 2H, ArH), 7.11 (d, J =8.6 Hz, 1H, thiophene-H), 6.89 (t, J =8.2 Hz, 1H, thiophene-H), 6.80 (d, J =8.0 Hz, 1H, thio-phene-H), 4.12 (dd, J =4.2, 4.2 Hz, 1H, CHC 3H 8), 2.04 (m, 2H, CH 2C 2H 5), 1.29 (m, 2H, CH 2CH 3), 0.91 (t, J =5.2 Hz, 3H, CH 3); 13C NM R (100 M Hz, CDCl 3) δ: 149.93, 146.43, 144.92, 128.51, 127.84, 126.38, 125.32, 123.55, 119.98, 46.72, 39.69, 21.13, 14.05; IR (film) νmax : 3062.6, 3026.6, 2957.0, 2929.4, 2870.7, 1598.2, 1493.5, 1452.6, 1350.8, 1259.6, 1221.3, 1067.4, 1031.3, 851.2, 806.0, 775.6, 749.3, 679.3 cm -1; MS m /z (%): 216 (M +, 16), 173(100), 129 (8).2-(1,1-二苯基甲基)噻吩(3f )[15b]: 1H NMR (400 MHz, CDCl 3) δ: 7.30~7.18 (m, 11H, ArH and thiophene-H), 6.92 (dd, J =8.2, 8.2 Hz, 1H, thiophene-H), 6.68 (d, J =8.6 Hz, 1H, thiophene-H), 5.67 (s, 1H, CH); 13C NM R (100 M Hz, CDCl 3) δ: 143.88, 129.07, 129.01, 128.92, 128.83, 128.75, 128.60, 128.54, 128.45, 126.79, 126.65, 126.52, 126.15, 125.57, 124.61, 122.85, 52.45; IR (KBr) νmax : 3060.5, 3022.6, 1597.4, 1493.6, 1448.4, 1075.6, 1029.4,No. 3 李志芳等:FeCl3催化羰基化合物与芳烃的还原Friedel-Crafts烷基化反应405750.6, 737.3, 698.5 cm-1; MS m/z (%): 250 (M+, 100), 217 (20), 173 (68), 165 (30).2-苄基噻吩(3g)[15c]: 1H NM R (400 M Hz, CDCl3) δ: 7.35~7.18 (m, 5H, Ar-H), 7.12 (d, J=8.2 Hz, 1H, thio-phene-H), 6.93~6.89 (m, 1H, thiophene-H), 6.80 (d, J=8.0 Hz, 1H, thiophene-H), 3.97 (s, 2H); MS m/z (%): 174 (M+, 100), 129 (11), 96 (42).2-(4-氯代苄)噻吩(3h)[15d]: 1H NM R (400 M Hz, CDCl3) δ: 7.29~7.09 (m, 4H, ArH), 7.03 (d, J=8.0 Hz, 1H, thiophene-H), 6.95~6.91 (m, 1H, thiophene-H), 6.82 (d, J=8.0 Hz, 1H, thiophene-H), 4.15 (s, 2H); M S m/z (%): 210 (29), 208 (M+, 88), 173 (100), 171 (25.29), 129(18), 97 (36), 85 (27).(E)-1-苯基-3-(2-噻吩)-1-丙烯(3i)[15e]:1H NM R (400 MHz, CDCl3) δ: 7.48~7.29 (m, 5H, ArH), 7.25 (d, J=8.0 Hz, 1H, thiophene-H), 7.08~7.01 (m, 1H, thiophene-H), 6.96 (d, J=8.2 Hz, 1H, thiophene-H), 6.60 (d, J=8 Hz, 1H, CH(Ar)=CH), 6.50~6.43 (m, 1H, CH(CH2)=CH), 3.82 (d, J=4.6 Hz, 2H, CH2); MS m/z (%): 200 (M+, 100), 184 (21), 167 (25), 114 (32), 96 (20).2-环己基噻吩(3j)[15e]: 1H NMR (400 MHz, CDCl3) δ: 7.10 (d, J=8 Hz, 1H, thiophene-H), 6.92~6.90 (m, 1H, thiophene-H), 6.81 (d, J=8 Hz, 1H, thiophene-H), 3.10~3.02 (m, 1H, CH), 2.13~2.09 (m, 2H), 1.81~1.75 (m, 2H), 1.69~1.64 (m, 2H), 1.62~1.58 (m, 2H); M S m/z (%): 152 (M+, 31), 86 (100), 68 (89), 56 (65).1,1-二苯基乙烷(3k)[15c]: 1H NMR (400 MHz, CDCl3) δ: 7.29~7.12 (m, 10H, ArH), 4.14 (dd, J=8.0, 8.0 Hz, 1H, CH), 1.63 (d, J=4.0 Hz, 3H, CH3); MS m/z (%): 182 (M+, 37), 167 (100), 65 (21), 152 (19).1-对甲苯基苯乙烷(3l)[15a]: 1H NM R (400 M Hz, CDCl3) δ: 7.21~7.02 (m, 9 H, ArH), 4.08 (dd, J=8.0, 8.0 Hz, 1H, CH), 2.27(s, 3H, CH3Ar), 1.58 (d, J=4.6 Hz, 3H, CH3CH); 13C NMR (100 MHz, CDCl3) δ: 146.57, 143.39, 135.39, 130.39, 129.03, 128.41, 127.64, 126.07, 125.80, 44.36, 21.92, 20.94; MS m/z (%): 196 (M+, 36), 184 (100), 166 (35), 114 (9), 89 (15).1-(2,5-二甲基苯基)-1-苯基乙烷(3m)[15a]: 1H NM R (400 MHz, CDCl3) δ: 7.38~7.07 (m, 9H, ArH), 4.40 (dd, J=8.0 Hz, 8.0 Hz, 1H, CH), 2.42 (s, 3H, CH3Ar), 2.31 (s, 3H, CH3Ar), 1.74 (d, J=5.6 Hz, 3H, CH3CH); M S m/z (%): 210 (M+, 46), 195 (100), 180 (29), 165 (28).4-(1-苯基乙基)苯酚(3n)[15a]: 1H NM R (400 M Hz, CDCl3) δ: 7.38~7.02 (m, 9H, ArH), 4.62 (s, 1H, OH), 4.34 (q, J=5.6 Hz, 1H, CH ), 1.60 (d, J=5.6 Hz, 3H, CH3); MS m/z (%): 198 (M+, 47), 183 (100), 165 (25), 153 (12).2-甲基-5-(1-苯基乙基)噻吩(3p)[15a]:1H NM R (400 MHz, CDCl3) δ: 7.34~7.13 (m, 5H, ArH), 7.08 (d, J=8.6 Hz, 1H, thiophene-H), 6.79 (d, J=8.0 Hz, 1H, thiophene- H), 4.21 (q, J=5.6 Hz, 1H, CH), 2.39 (s, 3H, CH3-thio- phene), 1.61 (d, J=4.6 Hz, 3H, CH3CH); MS m/z (%): 202 (M+, 15), 200 (46), 200 (31), 187 (100), 185 (39).3-甲基-2-(1-苯基乙基)噻吩(3q)[15c]:1H NM R (400 MHz, CDCl3) δ: 7.26~7.15 (m, 5H, ArH), 7.11~7.06 (m, 1H, thiophene-H), 6.57~6.53 (m, 1H, thiophene-H), 4.34 (q, J=5.2 Hz, 1H, CH), 2.06 (s, 3H, CH3-thiophene), 1.62 (d, J=5.2 Hz, 3H, CH3CH); M S m/z (%): 202 (M+, 17), 200 (36), 187 (100), 185 (41).2-氯-5-(1-苯基乙基)噻吩(3r):1H NM R (400 M Hz, CDCl3) δ: 7.25~7.15 (m, 3H, ArH), 7.08 (d, J=8.0 Hz, 2H, ArH), 6.63 (d, J=7.8 Hz, 1H, thiophene-H), 6.46 (d, J=8.0 Hz, 1H, thiophene-H), 4.11 (q, J=4.6 Hz, 1H, CH), 1.53 (d, J=5.6 Hz, 3H, CH3CH); 13C NM R (100 M Hz, CDCl3) δ: 148.80, 143.68, 132.54, 128.77, 128.57, 128.41, 128.05, 125.59, 123.03, 40.49, 22.77; IR (film) νmax: 2951.3, 2920.2, 2854.6, 1491.3, 1446.3, 1416.5, 1094.0, 1022.7, 1014.1, 976.2, 829.0, 786.2 cm-1; MS m/z (%): 222 (M+, 22), 207 (100).2 结果和讨论2.1 苯乙酮的还原烷基化反应以苯乙酮和噻吩为底物, 二甲基氯硅烷为质子源, 选用不同的催化剂和溶剂研究苯乙酮和噻酚的还原烷基化反应, 优化反应条件(表1).首先考察不同的路易斯酸催化苯乙酮的还原烷基化反应, 从表1可以看出FeCl3的催化效果最佳(Entry 1), 以良好的收率得到目标产物2-(1-苯基乙基)噻吩, 区域选择性也较为理想(o∶m=89∶11). 在InCl3催化下, 得到2-(1-苯基乙基)噻吩和2,5-二(1-苯基乙基)噻吩的混合物, 二者的比例是2∶1 (Entry 2). 其它路易斯酸, 如: ZnCl2和AlCl3虽然也能得到预期的产物, 但收率较低(Entries 3和4). 而TiCl4和CuCl2对该反应没有催化效果(Entries 5和6) .我们还考察了不同溶剂对该反应的影响. 在THF, CH3CN, CHCl3和CH2Cl2溶剂中, 以较低的收率得到烷基化产物2-(1-苯基乙基)噻吩(Entries 8, 9, 10和11). 而在DM E, DM F和DMSO溶剂中, 没有检测到目标产物(Entries 12, 13和14). 同时, 温度对该反应的影响也比406有 机 化 学 V ol. 29, 2009表1 二甲基氯硅烷作用下FeCl 3催化苯乙酮和噻酚的还原Friedel-Crafts 烷基化反应Table 1 FeCl 3 catalyzed reductive Friedel-Crafts alkylation of thiophene with acetophenone in the presence of chlorodimethyl-silaneEntry Solvent Lewis acid Yield a/% Regiosel. (o ∶m )b1 n -Hexane FeCl 3 93 89∶112 n -Hexane InCl3 20c 3 n -Hexane ZnCl 2 104 n -Hexane AlCl 3 105 n -Hexane CuCl 2 06 n -Hexane TiCl 4 0 7dn -Hexane FeCl 3 88 THFFeCl 3 109 CH 3CN FeCl 3 35 71∶29 10 CHCl 3 FeCl 3 45e 67∶3311 CH 2Cl 2 FeCl 3 75 81∶19 12 DME FeCl 3 0 13 DMFFeCl 3 0 14 DMSO FeCl 3 0a Isolated yields based on 1 used.b Selectivities were determined by GC-MS. cThe ratio of 2,5-di(1-phenyl ethyl )thiophene to 2-(1-phenyl ethyl )thiophenewas 2∶1. d r.t., 24 h. e 2,5-Di(1-phenylethyl)thiophene was obtained in 15% isolated yield.较大, 在室温下, 把反应时间延长至24 h, 产率只有8% (En try 7). 因此, 羰基化合物的还原烷基化的最佳反应条件为: FeCl 3为催化剂, 以正己烷为溶剂, 在回流状态下进行反应.2.2 FeCl 3催化羰基化合物和噻酚的还原烷基化反应在上述优化的反应条件下考察了该试验方法的使用范围, 从表2可以发现, 芳香族酮和醛都可以与噻吩进行还原烷基化反应, 以良好的收率得到相应的烷基化噻吩衍生物.在该反应条件下醚键、硝基和C =C 双键不受影响. 但是, 当二苯甲酮作为反应底物时, 由于位阻效应, 在相同的反应条件下反应8 h, 产率只有15% (En try 6). 在不使用其它任何有机溶剂, 而以过量的噻吩作为溶剂, 则以93%的收率得到烷基化产物2-(1,1-二苯基甲基)噻吩, 区域选择性为99∶1 (Entry 7). 在FeCl 3催化下, 环己酮也能与噻吩进行反应, 以77%的收率和99%的区域选择性得到2-环己基噻吩(Entry 11). 链状脂肪族醛和酮在该体系下不能进行还原烷基化反应, 只得到羰基化合物的还原氯代物和醚[14].在FeCl 3催化下, 芳烃, 2-甲基噻酚, 3-甲基噻酚和2-氯噻酚也能与苯乙酮进行还原烷基化反应, 以良好的收率得到相应的烷基化产物(表3). 由于氯苯的反应活性较差, 仅以31%的收率得到烷基化产物(Entry 5). 2.3 反应机理探讨FeCl 3催化的羰基化合物的还原烷基化反应的可能表2 FeCl 3催化羰基化合物和噻酚的还原Friedel-Crafts 烷基化反应Table 2 FeCl3 catalyzed reductive Friedel-Crafts alkylation of thiophene with carbonyl compoundsEntry R 1 R 2 Time/h Yield a /% Major product Regiosel. (o ∶m )b1 PhCH 3 493 3a 89∶11 2 4-ClC 6H 4 CH 3 4 89 3b 75∶25 3 4-MeOC 6H 4 CH 3 4 93 3c 91∶9 4 4-NO 2C 6H 4 CH 3 8 84 3d 65∶35 5 Ph n -C 3H 7 5 87 3e 83∶17 6 Ph Ph 8 15 3f 7cPh Ph 4 93 3f99∶18 PhH 4933g 92∶8 9 4-ClC 6H 4 H 4 89 3h 77∶23 10 C 6H 5CH =CH H 8 80 3i 80∶20 11 (C 2H 4)5 4 77 3j 99∶112 C 5H 11 CH 3 40d13 C 4H 9 H 4 0aIsolated yields based on 1 used . b Selectivities were determined by GC-MS. c FeCl 3 (5 mol%), benzophenone (1 mmol), thiophene (5 mL), chlorodimethylsilane (1mmol), reflux. dA mixture of 2-chloroheptane (17%) and ether (65%). e A mixture of 1-chloropentane (51%) and dipentyl ether (47%).No. 3李志芳等:FeCl 3催化羰基化合物与芳烃的还原Friedel-Crafts 烷基化反应 407表3 FeCl 3催化苯乙酮与芳烃的还原烷基化反应Table 3 FeCl 3catalyzed reductive Friedel-Crafts alkylation of arenes with acetophenoneEntry ArH Time/h Yield a /% Major product Regiosel.b1 Benzene 4 93 3k2 Toluene 4 96 3l o ∶p =28∶723 1,4-Dimethylbenzene4 983m 4 Phenol 4 95 3n o ∶p =44∶565 Chlorobenzene8 313o 6 2-Methylthiophene 4 99 3p o ∶m =95∶5 7 3-Methylthiophene 4 99 3q o ∶m =72∶28 8 2-Chlorothiophene 4 963ro ∶m =99∶1 aIsolated yields based on 1 used. b Selectivities were determined by GC-MS.机理为(Scheme 2): (1) FeCl 3催化下, 羰基化合物被二甲基氯硅烷还原成相应的硅醚A ; (2)硅醚A 生成碳正离子中间体B ; (3)该中间体B 与芳烃进行亲电取代反应生成相应的烷基化产物C . 反应过程中, 如果碳正离子中间体稳定性较弱会产生氯代物和醚. 如: 2-庚酮与噻吩的反应(表2, En try 12), 得到2-氯庚烷和二庚醚的混合物. 说明脂肪族的酮所形成的碳正离子中间体B 稳定性比较差, 反应按Step 2'或者Step 3'进行[11].Scheme 23 结论在二甲基氯硅烷作用下, FeCl 3能催化羰基化合物与芳香烃及噻酚的还原Friedel-Crafts 烷基化反应, 以良好的收率和区域选择性得到相应的烷基化产物.References1 (a) Bastock, T. W.; Clark, J. H. Spec iality Chemic als , El-sevier, London, 1991.(b) Khadilkar, B. M.; Borkar, S. D. J . Chem . Technol . Bio-technol . 1998, 71, 209.(c) Miller, L. L., Zhou, Q. X. Macromolecules 1987, 20, 1594.(d) Aoki, T.; Tanono, M.; Sanui, K.; Ogata, N.; Kumakura, K. Biomaterials 1996, 17, 1971.(e) Ahn, S. H.; Czae, M.; Kim, E. R.; Lee, H.; Han, S. H.; Noh, J.; Hara, M. Macromolecules 2001, 34, 2522.2 (a) Olah, G. A. Friedel -Crafts and Related Reac tions ,Wiley-Interscience, New York, 1964.(b) Roberts, R. M.; Khalaf, A. A. Friedel -Crafts Alkylation Chemistry , A Century of Disc overy , Dekker, New York, 1984.(c) Olah, G. A.; Krishnamurti, R.; Prakash, G. K. S. Friedel -Crafts Alkylations in Comprehensive Organic Syn-thesis , Pergamon Press, Oxford, 1991.(d) For a pharmacologically important intramolecular Friedel-Crafts benzylation reaction, see: Tanabe, K.; Holderich, W. F. Appl . Catal ., A 1999, 181, 399.3 (a) Friedel, C.; Crafts, J. M. Compt . Rend . 1877, 84, 1392.(b) Friedel, C.; Crafts, J. M. Compt . Rend . 1877, 85, 74. (c) Choudary, B. M.; Kantam, M. L.; Sateesh, M.; Rao, K. K.; Santhi, P. L. Appl . Catal . 1997, 149, 257.4 (a) Harrington, P. E.; Kerr, M. A. Synlett 1996, 1047.(b) Manabe, K.; Aoyama, N.; Kobayashi, S. Adv . Synth . Catal . 2001, 343, 174.(c) Bandini, M.; Cozzi, P. G.; Giacomini, M.; Melchiorre, P.; Selva, S.; Umani-Ronchi, A. J . Org . Chem . 2002, 67, 3700.(d) Bandini, M.; Melchiorre, P.; Melloni, A.; Umani-Ron-chi, A. Synthesis 2002, 1110.(e) Bandini, M.; Fagioli, M.; Melloni, A.; Umani-Ronchi,408有机化学V ol. 29, 2009A. Synthesis2003, 397.(f) Srivastava, N.; Banik, B. K. J. Org. Chem. 2003, 68,2109.5 (a) Yamauchi, T.; Hattori, K.; Mizutaki, S.; Tamaki, K.;Uemura, S. Bull. Chem. Soc. Jpn. 1986, 59, 3617.(b) Yamato, T.; Hideshima, C.; Prakash, G. K. S.; Olah, G.A. J. Org. Chem. 1991, 56, 2089.(c) Yamato, T.; Fukumoto, M.; Sakaue, N.; Furusawa, T.;Tashiro, M. Synthesis 1991, 699.(d) Wang, Y. G.; L ei, M.; Geng, L. Chin. J. Org. Chem.2003, 23, 438 (in Chinese).(王彦广, 雷鸣, 耿亮, 有机化学, 2003, 23, 438.)(e) Tsuchimoto, T.; Tobita, K.; Hiyama, T.; Fukuzawa, S. I.Synlett 1996, 557.(f) Tsuchimoto, T.; Tobita, K.; Hiyama, T.; Fukuzawa, S. I.J. Org. Chem. 1997, 62, 6997.(g) Li, G.; Wu, T. H.; Zhang, H. J. Acta Chim. Sinica 2002,60, 759 (in Chinese).(李工, 吴通好, 章慧杰, 化学学报, 2002, 60, 759.)6 (a) Yokoshima, S.; Ueda, T.; Kobayashi, S.; Sato, A.; Ku-boyama, T.; Tokuyama, H.; Fukuyama, T. J. Am. Chem.Soc. 2002, 124, 2137.(b) Mi, Y.; Schreiber, J. V.; Corey, E. J. J. Am. Chem. Soc.2002, 124, 11290.(c) Elango, S.; Yan, T. H. Tetrahedron2002, 58, 7335.(d) Nagumo, S.; Miyoshi, I.; Akita, H.; Kawahara, N. Tet-rahedron Lett. 2002, 43, 2223.(e) Taylor, S. K.; May, S. A.; Stansby, E. S. J. Org. Chem.1996, 61, 2075.(f) Linares-Palomino, P. J.; Prakash, G. K. S.; Olah, G. A.Helv. Chim. Acta2005, 88, 1221.7 (a) Zhuang, W.; Gathergood, N.; Hazell, R. G.; Jorgensen,K. A. J. Org. Chem. 2001, 66, 1009.(b) Corma, A.; Garcia, H.; Moussaif, A.; Sabater, M. J.;Zniber, R.; Redouane, A. Chem. Commun. 2002, 1058.(c) Torok, B.; Abid, M.; L ondon, G.; Esquibel, J.; Torok,M.; Mhadgut, S. C.; Yan, P.; Prakash, G. K. S. Angew.Chem., Int. Ed. 2005, 44, 3086.8 (a) Hashimoto, Y.; Hirata, K.; Kihara, N.; Hasegawa, M.;Saigo, K. Tetrahedron Lett. 1992, 33, 6351.(b) Hashimoto, Y.; Hirata, K.; Kagoshima, H.; Kihara, N.;Hasegawa, M.; Saigo, K. Tetrahedron1993, 49, 5969.9 (a) Tsuchimoto, T.; Hiyama, T.; Fukuzawa, S.-I. Chem.Commun. 1996, 2345.(b) Tsuchimoto, T.; Tobita, K.; Hiyama, T.; Fukuzawa S.-I.J. Org. Chem. 1997, 62, 6997. 10 Fukuzawa, S.-I.; Tsuchimoto, T.; Hiyama, T. J. Org. Chem.1997, 62, 151.11 (a) Miyai, T.; Onishi, Y.; Baba, A. Tetrahedron Lett. 1998,39, 6291.(b) Miyai, T.; Onishi, Y.; Baba, A. Tetrahedron 1999, 55,1017.12 (a) Taylor, R. Elec trophilic Aromatic Substitution, Wiley,Chichester, 1990.(b) Olah, G. A., Friedel-Crafts and Related Reactions, Ed.Wiley-Interscience, New York, 1963~1965, Vol. I~IV.(c) Olah, G. A. Friedel-Crafts Chemistry, Wiley, NewYork, 1973.(d) Heaney, H. In Comprehensive Organic Synthesis, Vol.2, Ed.: Trost, B. M., Pergamon Press, Oxford, 1991, p. 733.(e) Olah, G. A.; Kobayashi, S.; Tashiro, M. J. Am. Chem.Soc. 1972, 94, 7448.(f) For reviews on iron-catalyzed Friedel-Craft acylations,see: Effenberger, F.; Steegmtiller, D. Chem. Ber. 1988, 121, 117.(g) Marquie, J.; L aporterie, A.; Dubac, J.; Roques, N.;Desmurs, J.-R. J. Org. Chem. 2001, 66, 421.(h) Choudary, B. M.; Chowdari, N. S.; Kantam, M. L.;Kannan, R. Tetrahedron Lett. 1999, 40, 2859.(i) Bolm, C.; L egros, J.; L e Paih, J.; Zani, L. Chem. Rev.2004, 104, 6217.13 (a) Mertins, K.; Iovel, I.; Kischel, J.; Zapf, A.; Beller, M.Angew. Chem., Int. Ed. 2005, 44, 238.(b) Iovel, I.; Mertins, K.; Kischel, J.; Beller, M. Angew.Chem., Int. Ed. 2005, 44, 3913.(c) Kischel, J.; Jovel, I.; Mertins, K.; Zapf, A.; Beller, M.Org. Lett. 2006, 8, 19.14 (a) Li, Z.; Sheng, C.; Qiu, H.; Zhang, Y. Org. Prep. Proced.Int. 2007, 39, 429.(b) Li, Z.; Sheng, C.; Qiu, H.; Zhang, Y. Org. Prep. Proced.Int. 2007, 39, 608.15 (a)Rueping, M.; Nachtsheim, B. J.; Scheidt, T. Org. Lett.2006, 8, 3717.(b) Avendano, C.; Diego, C.; Elguero, J. Monatsh. Chem.1990, 121, 649.(c) Hall, S. S.; Farahat, S. E. J. Heterocycl. Chem. 1987, 24,1205.(d) Zhang, S.; Marshall, D.; Liebeskind, L. S. J. Org. Chem.1999, 64, 2796.(e) Onodera, G.; Imajima, H.; Yamanashi, M.; Nishibaya-shi, Y.; Hidai, M.; Uemura, S. Organometallics 2004, 23, 5841.(Y0804233 L u, Y.; L u, Z.)。
药物合成反应综合习题与答案-1

《药物合成反应》综合习题与答案(答案附后)一、判断题。
1.Gabriel反应能得到纯净伯胺。
2.DCC为缩合试剂。
3.亚甲基上连有给电子基团时,使亚甲基上氢原子的活性增大,该亚甲基被称为活性亚甲基。
4.酰化试剂一般提供酰化反应的正电中心,表现在羰基的碳原子上。
5.SN1反应的典型特征是生成构型反转的产物。
6.Friedel-Crafts烷基化底物中苯环上存在给电子基团,会促进反应的发生。
7.还原反应是有机分子中减少氢的反应。
8.药物合成反应主要研究反应类型、反应机理、影响因素和应用特点。
9.Lewis碱常被用于Friedel-Crafts反应的催化剂。
10.亲核反应、亲电反应最主要的区别是反应要进攻的活性中心的电荷不同。
二、选择题。
1. 本门课主要的研究内容是A. 研究药物的毒性反应B. 研究药物的生物活性C. 研究药物合成及修饰方法D. 研究药物的剂型改造2.下列碳正离子稳定性最强的是。
A. RCH2+B. H3C+C. R2CH+D. R3C+3.以下有关Friedel-Crafts烷基化反应的影响因素正确的是。
A.底物芳环上存在吸电子基团,有助于反应的发生B.底物芳环上存在给电子基团,有助于反应的发生C.质子酸的催化活性强于Lewis酸D. Friedel-Crafts反应的催化剂只能是Lewis酸4.不同的卤化磷对羧羟基卤置换反应活性顺序正确的是。
A. PCl5 > PCl3 > POCl3B. PCl5 > POCl3 > PCl3C. PCl3 > PCl5 > POCl3D. POCl3 > PCl5 > PCl35.化学制药工业的特点不包括。
A. 药物的化学结构一般都较为复杂,需经过多步化学反应才能得到产品B. 质量要求严格, 符合GMP要求C. 生产技术复杂,工艺流程长,所需设备种类多,生产成本高D. 新药创制周期短、耗资多6.下列化合物最易发生卤取代反应的是。
傅克反应
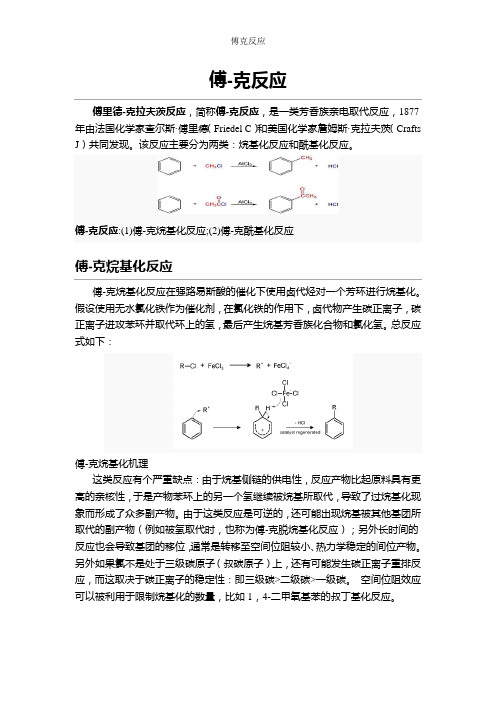
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
friedel crafts烷基化反应

friedel crafts烷基化反应
Friedel-Crafts烷基化反应是一种重要的有机合成方法,它可以将烷基基团引入芳香烃分子中。
该反应通过使用无机铝卤化物催化剂和烷基卤化物进行反应,生成烷基苯。
反应机理如下:
1. 铝卤化物与烷基卤化物形成复合物。
2. 铝卤化物与芳香烃发生Lewis酸碱反应,使芳香烃生成活性的电子空缺。
3. 烷基卤化物经由亲电取代作用进攻芳香烃的活性电子,芳香烃负电荷被消除。
4. 重复以上步骤,直到反应结束。
该反应具有高效、高选择性和多样性的优点,被广泛应用于有机合成领域。
Friedel-crafts反应Grignard 反应Oppenauer氧化

Grignard 反应
维克多· 格林尼亚 。1871 年5月6日-1935年12月 13日),法国化学家, 因发明了格氏试剂与他的 同事保罗· 萨巴捷一同获 得诺贝尔化学奖。
Grignard 反应机理
Oppenauer氧化
沃氏氧化反应(Oppenauer氧化),也译作 欧芬脑尔氧化,是二级醇与丙酮(或甲乙酮、 环己酮)在碱存在下一起反应,醇被氧化为 酮,同时丙酮被还原为异丙醇的反应。
1
Friedel-crafts反应
制rafts反应
酰基化反应 烷基化反应
亲电取代反应
酰 基 化
烷基化
应用
Grignard 反应
格氏试剂 Grignard reagent 一种金属有机化 合物,通式RMgX(R代表烃基,X代表卤素)。 1901年由F.-A.V.格利雅首次使用卤代烃RX与 镁在醚类溶液中反应制得。又称格利雅试剂。
Oppenauer氧化 反应机理
应用
Oppenauer氧化法既可以氧化饱和醇,也可以氧 化不饱和醇。
傅克反应
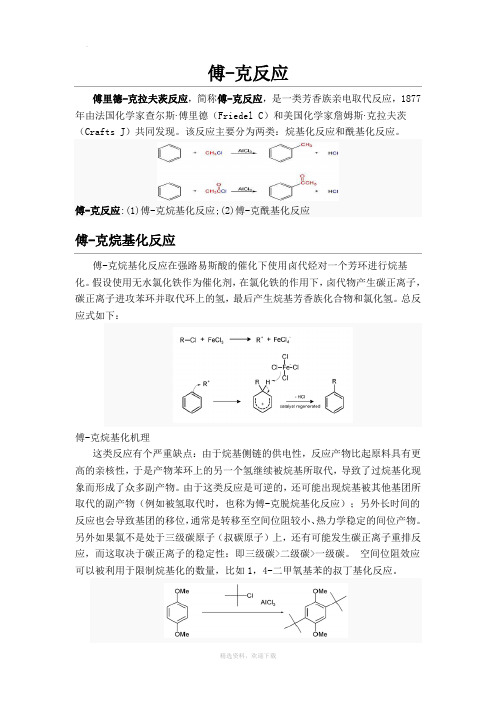
傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Friedel-Crafts烷基化反应芳烃与卤代
烃、醇类或烯类化合物在Lewis催化剂(如AlCl,FeCl, HSO, HPO, BF, HF3442333等)存在下,发
生芳环的烷基化反应。
卤代烃反应的活泼性顺序为:RF > RCl > RBr > RI ; 当烃基超过3个碳原子时,反应过程中易发生重排。
反应机理
首先是卤代烃、醇或烯烃与催化剂如三氯化铝作用形成碳正离子:
所形成的碳正离子可能发生重排,得到较稳定的碳正离子:
碳正离子作为亲电试剂进攻芳环形成中间体??络合物,然后失去一个质子得到发生亲电取代产物:
反应实例。
