医疗器械 指导原则清单
医疗器械临床试验设计指导原则

医疗器械临床试验设计指导原则1.试验目标和研究问题的明确性:试验设计必须明确试验的主要目标和研究问题,以及试验的主要研究对象和研究指标。
2.样本量的合理估计:根据试验目标和研究问题,合理估计样本量,确保样本量足够大以能够检测到所关注的效应。
3.随机分组和对照组设计:采用随机分组的方式将试验对象分为不同的组,并设置合适的对照组,以便比较不同治疗方法的疗效差异。
4.盲法和预测法设计:试验中应使用盲法或预测法,对于试验对象和观察者都不知道接受的治疗是实验组还是对照组,以避免观察者和被观察者的主观影响。
5.实施前试验的必要性:在正式试验前,可以进行一些实施前的试验,以验证试验方案的可行性和准确性,减少试验中的不确定性和随机误差。
6.数据采集和统计分析:选择合适的数据采集方式和工具,确保数据质量和可靠性。
采用合适的统计方法分析试验结果,得出科学结论。
7.试验流程的规范化:制定严格的试验流程和操作规范,确保试验的一致性和可重复性。
8.伦理审查的必要性:在试验开始前,必须通过伦理审查机构的审查和批准,确保试验过程符合伦理原则和法律法规,并保护试验对象的权益和安全。
9.试验报告的透明性和完整性:试验结束后,应及时公布试验结果,并对试验过程中的所有信息进行透明披露,确保试验结果的科学性和可对比性。
10.持续监测和评估:试验过程中应定期进行监测和评估,确保试验进展顺利,并及时解决可能出现的问题和风险。
总之,医疗器械临床试验设计指导原则是为了确保试验过程的科学性、可靠性和伦理性,从而为新的医疗器械的上市提供可靠的数据支持。
这些原则的执行能够最大程度地减少误差和偏差,提高试验结果的可靠性和可比性,为医疗器械的安全性和疗效提供可靠的证据。
同时,这些原则也能够保障试验对象的权益和安全,避免试验过程中出现不必要的风险和伤害。
医疗器械技术要求指导原则

医疗器械技术要求指导原则医疗器械技术要求指导原则是为了确保医疗器械的安全性、有效性和可靠性而制定的一系列规范。
这些技术要求涵盖了医疗器械的设计、生产、使用和维护等方面,旨在保障医疗器械的质量和安全,同时也为医护人员提供了正确使用和维护医疗器械的指导。
一、医疗器械设计与生产技术要求1. 设计原则:医疗器械设计应符合人体工程学原理,能够满足临床需求,同时具有安全可靠的性能。
2. 材料选择:医疗器械所选用的材料应符合国家标准,并经过必要的检测和验证。
对于直接接触人体组织的部位,应选用无毒无害、无致敏反应等特点的材料。
3. 制造工艺:制造过程中应严格遵守相关标准和规范,确保产品质量稳定可靠。
同时还需要建立完善的质量控制体系,对每批产品进行检测和验证。
4. 标识要求:医疗器械应在产品上标注清晰的型号、生产厂家、生产日期、有效期等信息,以方便用户正确使用和维护。
二、医疗器械使用技术要求1. 操作规程:医护人员应在严格遵守产品说明书和操作规程的基础上,正确使用医疗器械。
2. 操作环境:医疗器械的使用环境应符合相关标准和规范,确保产品正常工作。
3. 消毒灭菌:对于需要消毒灭菌的医疗器械,应选择合适的消毒灭菌方法,并按照相应的操作规程进行消毒灭菌。
4. 维护保养:医疗器械在使用过程中需要进行定期维护保养,以确保其正常工作。
维护保养应按照相应的操作规程进行。
三、医疗器械质量控制技术要求1. 质量管理体系:医疗器械生产企业应建立完善的质量管理体系,并进行认证。
同时还需要对供应商进行严格的审核和管理。
2. 生产过程控制:生产过程中需要进行严格的质量控制,确保产品符合相关标准和规范。
3. 产品检测:对每批产品都需要进行必要的检测和验证,确保产品质量稳定可靠。
4. 不良品处理:对于不合格的产品应及时处理,并建立相应的记录。
同时还需要对不良品进行分析,找出原因并采取相应的改进措施。
综上所述,医疗器械技术要求指导原则是为了确保医疗器械的安全性、有效性和可靠性而制定的一系列规范。
医疗器械注册指导原则汇总汇总

医疗器械注册指导原则汇总汇总医疗器械注册指导原则是指为了保障人们的生命安全和身体健康,对医疗器械的生产、销售及使用进行管理的指导原则。
而体外诊断试剂则是一种能够通过检测人体体液、血液或组织来帮助诊断疾病的医疗器械。
下面是医疗器械注册(体外诊断试剂)的指导原则的汇总。
其次,医疗器械注册(体外诊断试剂)的指导原则之二是安全性和无害性。
体外诊断试剂应安全可靠,其使用在一定条件下不会对人体产生伤害和危害。
制造商需要提供相关的安全性评估文件,证明其产品的无害性和风险控制措施。
另外,医疗器械注册还要求产品标识清晰明确,便于使用者正确操作和识别。
第三,医疗器械注册(体外诊断试剂)的指导原则之三是合规性和合法性。
体外诊断试剂的注册申请需要符合国家相关的法律法规和技术要求。
注册机构将会对申请资料进行审核,并进行实地检查和评估,以确保产品符合法律法规和技术要求。
第四,医疗器械注册(体外诊断试剂)的指导原则之四是诊断效能和临床适应性。
体外诊断试剂需要具有一定的诊断效能,能够在临床实践中发挥一定的作用。
申请注册的产品应提供临床试验数据,证明其在一定范围内的临床可靠性和有效性。
第五,医疗器械注册(体外诊断试剂)的指导原则之五是产品质量和稳定性。
体外诊断试剂需要具有一定的质量和稳定性,能够在一定的使用期限内保持稳定的性能和效果。
申请注册的产品应提供相关的质量管理文件,证明其产品质量和稳定性的可控性。
最后,医疗器械注册(体外诊断试剂)的指导原则之六是信息透明和可追溯性。
体外诊断试剂需要提供充分的产品信息,包括产品的成分、使用说明、贮存条件等。
同时,制造商需要建立相应的追溯体系,追踪产品的生产过程和流通环节,保证产品的追溯能力。
总之,医疗器械注册(体外诊断试剂)的指导原则是为了保障医疗器械的质量和安全性,在注册过程中制定的一系列要求和标准。
这些指导原则包括准确性和精确度、安全性和无害性、合规性和合法性、诊断效能和临床适应性、产品质量和稳定性,以及信息透明和可追溯性。
医疗器械指导原则

医疗器械指导原则引言医疗器械是医疗行业中不可或缺的一部分,它们被广泛应用于医疗诊断、治疗和康复过程中。
然而,由于医疗器械的特殊性,其安全性和有效性至关重要。
为了确保医疗器械的正确使用和管理,制定了一系列的医疗器械指导原则。
本文将详细探讨医疗器械指导原则的相关内容。
医疗器械分类医疗器械根据其用途和风险等级可以分为不同的类别。
根据国际标准,常见的医疗器械分类包括: 1. 一类医疗器械:低风险,如体温计、口罩等。
2. 二类医疗器械:中风险,如输液泵、血压计等。
3. 三类医疗器械:高风险,如人工心脏、植入式心脏起搏器等。
医疗器械注册与监管为了确保医疗器械的质量和安全性,各国都设立了医疗器械注册与监管机构。
这些机构负责对医疗器械进行注册、审核和监督,以确保其符合相关法规和标准。
医疗器械注册与监管的主要内容包括: 1. 注册申请:医疗器械生产企业需要向监管机构提交注册申请,并提供相关的技术资料和临床试验数据。
2. 审核评价:监管机构对注册申请进行审核评价,包括对器械的安全性、有效性和质量控制体系的评估。
3. 监督检查:注册后的医疗器械需要进行定期的监督检查,以确保其符合注册时的要求和标准。
医疗器械标准与认证医疗器械标准是医疗器械设计、生产和使用的规范。
医疗器械标准的制定和认证是保证医疗器械质量和安全性的重要手段。
医疗器械标准与认证的主要内容包括: 1. 标准制定:制定医疗器械标准需要考虑器械的功能、材料、设计和使用等方面的要求,并结合国际标准进行修订。
2. 认证评价:医疗器械生产企业可以选择进行认证评价,以证明其产品符合相关标准和法规的要求。
3. 标志标识:通过认证评价的医疗器械可以获得认证标志标识,以便于用户和监管机构辨别其合格性。
医疗器械质量管理医疗器械质量管理是医疗器械生产和使用过程中的重要环节。
通过建立和实施质量管理体系,可以确保医疗器械的质量和安全性。
医疗器械质量管理的主要内容包括:1. 质量控制体系:医疗器械生产企业需要建立和实施质量控制体系,包括质量手册、程序文件和记录等。
医疗器械具体产品指导原则汇总

20150127
59 透明质酸钠类面部注射填充材料临床试验基本要求(征求意见稿) 20150127
无源 无源 无源
60 外科纱布敷料(第二类)产品注册技术审查指导原则 61 胃管产品注册技术审查指导原则 62 吻(缝)合器产品注册技术审查指导原则 63 无源植入性和动物源性医疗器械注册申报资料指导原则 64 无源植入性医疗器械产品注册申报资料指导原则 65 无源植入性医疗器械货架寿命申报资料指导原则 66 血液透析浓缩物产品注册技术审查指导原则 67 牙科树脂类充填材料产品注册技术审查指导原则 68 牙科种植体(系统)产品注册技术审查指导原则 69 一次性使用鼻氧管产品注册技术审查指导原则 70 一次性使用避光输液器产品注册技术审查指导原则
体外诊断
15
20101109
报批稿
指导原则(报批稿)
试剂
16 金标类检测试剂注册技术审查指导原则
体外诊断 20130104
试剂
17 流式细胞仪配套用检测试剂注册技术审查指导原则
体外诊断 20130517
试剂
酶联免疫法检测试剂主要原材料、生产工艺及质量控制注册技术
体外诊断
18
20101109
报批稿
审查指导原则(报批稿)
20091224
有源 有源 有源
114 视野计产品注册技术审查指导原则
20131023 有源
115 手术电极产品注册技术审查指导原则
20120510 有源
116 手术动力设备产品注册技术审查指导原则
20120510 有源
117 心电图机产品注册技术审查指导原则
20090318 有源
20091224 无源 20090318 无源 20120510 无源 20091230 无源 20091230 无源 20110324 无源 20140514 无源 20140514 无源 20110324 无源 20131023 无源 20140514 无源
医疗器械注册技术审查指导原则目录

植入式心脏起搏器技术审查指导原则(2016年修订版)
75
脉搏血氧仪设备临床评价技术指导原则
76
治疗呼吸机注册技术审查指导原则
77
强脉冲光治疗仪注册技术审查指导原则
78
磁疗产品注册技术审查指导原则(2016年修订版)
79
电子血压计(示波法)注册技术审查指导原则(2016年修订版)
80
X射线诊断设备(第二类)注册技术审查指导原则(2016年修订版)
183
裂隙灯显微镜注册技术审查指导原则
184
输液泵注册技术审查指导原则
185
电动洗胃机注册技术审查指导原则(2017年修订版)
186
全自动血型分析仪注册技术审查指导原则
187
ABO、RhD血型抗原检测卡(柱凝集法)注册技术审查指导原则
188
人表皮生长因子受体2基因扩增检测试剂盒(荧光原位杂交法)注册技术审查指导原则
162
中频电疗产品注册技术审查指导原则(2017年修订版)
163
脉搏血氧仪注册技术审查指导原则(2017年修订版)
164
牙科手机注册技术审查指导原则(2017年修订版)
165
超声多普勒胎儿监护仪注册技术审查指导原则(2017年修订版)
166
超声理疗设备注册技术审查指导原则(2017年修订版)
167
超声洁牙设备注册技术审查指导原则(2017年修订版)
93
大型蒸汽灭菌器注册技术审查指导原则
94
腹膜透析机注册技术审查指导原则
95
医用内窥镜冷光源注册技术审查指导原则
96
振动叩击排痰机注册技术审查指导原则
97
碱性磷酸酶测定试剂盒注册技术审查指导原则(2016年修订版)
医疗器械安全和性能基本原则基本清单编写指导
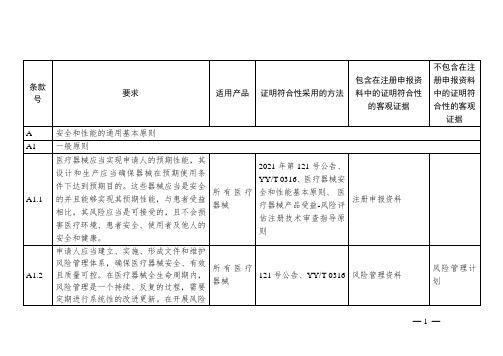
GB 18278.1、GB 18279系列、GB 18280系列、YY/T 1276、YY/T 1464、
GB/T 19974、YY/T 1463、无菌医疗器械灭菌工艺注册技术审查指导原则、其他适用的标准或指导原则
灭菌研究、稳定性研究、包装说明、产品技术要求及检测报告
包装过程确认
A4.4
无菌医疗器械应按照经验证的方法进行加工、生产、包装和灭菌,其货架有效期应按照经验证的方法确定。
无菌医疗器械
GB 18278.1、GB 18279系列、GB 18280系列、YY/T 1276、YY/T 1464、
GB/T 19974、YY/T 1464、无菌医疗器械灭菌工艺注册技术审查指导原则、其他适用的标准或指导原则
所有医疗器械
2021年第121号公告、YY/T 0316、医疗器械安全和性能基本原则、医疗器械产品受益-风险评估注册技术审查指导原则
注册申报资料
A1.2
申请人应当建立、实施、形成文件和维护风险管理体系,确保医疗器械安全、有效且质量可控。在医疗器械全生命周期内,风险管理是一个持续、反复的过程,需要定期进行系统性的改进更新。在开展风险管理时,申请人应当:a)建立涵盖所有医疗器械风险管理计划并形成文件;b)识别并分析涵盖所有医疗器械的相关的已知和可预见的危险(源);c)估计和评价在预期使用和可合理预见的误使用过程中,发生的相关风险;
适用的标准或指导原则
标签
A5
环境和使用条件
A5.1
如医疗器械预期与其他医疗器械或设备整合使用,应确保整合使用后的系统,包括连接系统,整体的安全性,且不影响器械本身的性能。整合使用上的限制应明确标识和/或在使用说明书中明确。对于需要使用者处理的连接,如液体、气体传输、电耦合或机械耦合等,在设计和生产过程中尽可能消除或降低所有可能的风险,包括错误连接或安全危害。
医疗器械临床试验指导原则

医疗器械临床试验指导原则在现代医疗领域中,临床试验是评估医疗器械安全性和有效性的重要手段之一。
为确保临床试验的科学性、规范性和伦理性,制定一系列的规程和标准是必不可少的。
本文将探讨医疗器械临床试验的指导原则,其中包括试验设计、试验对象、数据处理等各个方面的规范。
I. 研究目标与试验设计医疗器械临床试验的首要目标是评估其安全性和有效性,因此试验设计应尽可能客观、科学、严谨。
首先,研究者应明确试验的目的和假设,确保试验的科学性。
其次,要确定试验的控制组和实验组,以便比较不同治疗方法或方案的效果。
同时,应充分考虑样本量的合理性,以保证试验结果的可靠性。
II. 试验对象的选择与纳入标准医疗器械临床试验的试验对象通常是符合一定条件的患者群体。
试验对象的选择和纳入标准应明确并合理,以确保试验结果的准确性和可推广性。
这涉及到病种的定义、诊断标准、纳入和排除标准等方面。
同时,在试验过程中应保障试验对象的权益和安全,加强监测和管理。
III. 伦理审批与知情同意医疗器械临床试验涉及人体参与,必须严格遵守伦理原则。
在开始试验之前,研究者必须获得伦理委员会的批准,并且保护试验对象的知情同意权。
试验对象应充分了解试验的目的、方法、可能的风险和福利,自主决定是否参与试验。
IV. 试验过程与数据收集医疗器械临床试验的过程应严格按照规定的步骤和操作要求进行。
试验前,研究者需要记入试验方案,制定操作规程,对试验对象进行必要的评估和检查。
试验过程中,要保证数据的准确性和完整性,进行必要的记录和存储。
此外,试验过程中需要严格控制可能的干扰因素,确保试验结果的可靠性。
V. 数据处理与统计分析医疗器械临床试验的数据处理和统计分析是评估试验结果的重要步骤。
研究者需要对试验数据进行合理的统计分析,以评估治疗效果和安全性。
在数据处理过程中,需要注意选择适当的统计方法,并对数据进行质量控制和校验。
统计分析的结果应客观、真实地反映试验的效果和差异。
医疗器械指导原则

医疗器械指导原则随着现代医疗技术的不断发展,医疗器械在临床诊断和治疗中起到了至关重要的作用。
为了确保医疗器械的安全性和有效性,相关的指导原则被制定出来。
本文将介绍医疗器械指导原则的相关内容。
一、适用人群和临床使用医疗器械在使用之前需要根据适用人群和临床使用进行评估和验证。
适用人群的属性和临床使用的特点决定了医疗器械的设计和生产标准。
在使用医疗器械之前,医务人员需要对其进行充分的培训和了解,以确保正确的操作和安全使用。
二、质量控制和监测医疗器械的质量控制和监测是确保其安全性和有效性的重要环节。
质量控制系统需要确保医疗器械的设计、生产、销售和使用符合相关的法律法规和标准要求。
同时,对医疗器械的监测需要进行定期的质量评估和反馈,确保其性能和安全性。
三、注册和审批为了保证医疗器械的质量和安全性,医疗器械需要进行注册和审批。
注册和审批的过程需要严格按照相关规定进行,包括申请材料的准备、技术资料的评估和实验验证等。
只有通过注册和审批的医疗器械才能在市场上销售和使用。
四、信息披露和风险评估医疗器械的信息披露和风险评估是保证患者知情权和安全性的重要手段。
医疗器械的生产厂商需要向患者提供充分的产品信息和使用说明,以便患者了解医疗器械的适用范围、风险和预防措施等。
同时,医疗器械的风险评估需要进行全面的临床试验和安全性评价。
五、技术监测和后续管理医疗器械的技术监测和后续管理是确保其安全性和有效性的重要环节。
医疗器械的技术监测包括对其性能和使用效果的定期检测和评估。
后续管理包括对意外事件和不良反应的报告和处理,以及对产品使用中出现的问题进行跟踪和处理。
总结:医疗器械指导原则是保证医疗器械安全有效使用的基础。
适用人群和临床使用的合理评估、质量控制和监测、注册和审批、信息披露和风险评估以及技术监测和后续管理等方面的要求都是为了确保医疗器械的质量和安全性。
医疗器械行业在不断发展,相关指导原则也需要不断完善,以适应不同的技术和临床需求。
医疗器械指导原则

医疗器械指导原则在现代医疗领域中,医疗器械是不可或缺的关键工具。
医疗器械的选择、使用和管理对于医疗机构以及患者来说都至关重要。
因此,制定一套科学的医疗器械指导原则具有重要意义。
本文将从医疗器械的选择、使用和管理三个方面,分析医疗器械指导原则的重要性,并提出相关建议。
一、医疗器械选择的原则正确选择合适的医疗器械对于提高医疗质量和患者安全至关重要。
在选择医疗器械时,应考虑以下几个方面:1. 安全性:医疗器械必须符合相关的国家法规和标准,且具备良好的安全记录。
对于高风险医疗器械,还需要进行临床试验证明其安全性。
2. 适用性:医疗器械的功能必须与临床需求相匹配。
医疗机构应根据临床需要制定相应的规范,确保所选医疗器械能够满足患者的治疗和诊断要求。
3. 效能:医疗器械的质量和性能决定了其在临床实践中的应用效果。
医疗机构应选择具备稳定性能和可靠质量的医疗器械,提高患者的治疗效果。
二、医疗器械使用的原则正确合理地使用医疗器械不仅能够减少医疗事故的发生,还能提高医疗效果。
在医疗器械的使用过程中,应遵循以下几个原则:1. 操作规范:医疗机构应建立完善的医疗器械使用标准化操作规程,并对医务人员进行相关培训,提高操作技能和安全意识。
2. 维护保养:医疗器械需要定期维护和保养,以确保其性能和功能的稳定性。
医务人员应按照医疗器械的说明书和维护手册进行维护和保养,确保其在使用过程中的可靠性。
3. 监测和评估:医疗机构应建立医疗器械使用情况的监测和评估制度,及时发现和排除医疗器械使用中的问题和隐患,提高医疗安全水平。
三、医疗器械管理的原则科学有效地管理医疗器械是保证医疗质量和患者安全的基础。
医疗器械管理的原则如下:1. 规范管理:医疗机构应建立科学的医疗器械管理制度,包括医疗器械的库存管理、采购管理、分发和使用管理等,确保医疗器械的规范化管理。
2. 信息化管理:医疗机构应建立医疗器械信息化管理系统,实现医疗器械的全程追溯和信息共享,提高医疗器械管理的效率和准确性。
医疗器械指导原则目录汇编(15.8.5)

文件编号 国食药监械 [2003]222号 国食药监械 [2007]240号 国食药监械 [2007]345号 国食药监械 [2007]609号 国食药监械 [2007]762号 食药监办械函 [2011]116号 食药监办械函 [2011]143号 食药监办械函 [2011]540号 2013年第8号 通告 2014年第3号 通告
发布日期 2003年8月26日 2007年4月28日 2007年6月15日 2007年9月30日 2007年12月18日 10月23日 2014年4月17日
文件名称 高强超声聚焦治疗机有关技术要求 体外诊断试剂临床研究技术指导原则 体外诊断试剂说明书编写指导原则 医疗器械生物学评价和审查指南 关于发布体外诊断试剂注册申报资料形式与基本要求的公告 组织工程医疗产品研究及申报相关要求 无源植入性医疗器械货架寿命申报资料指导原则 肿瘤标志物类定量检测试剂注册申报资料指导原则 角膜塑形用硬性透气接触镜说明书编写指导原则 流行性感冒病毒核酸检测试剂注册申报资料指导原则 流行性感冒病毒抗原检测试剂注册申报资料指导原则 便潜血(FOB)定性检测试剂注册申报资料指导原则 人绒毛膜促性腺激素定性检测试剂(胶体金法)注册申报资料指导原则 软性亲水接触镜说明书编写指导原则 硬性角膜接触镜说明书编写指导原则
医疗器械指导原则

医疗器械指导原则医疗器械是指用于预防、诊断、治疗、缓解疾病或医疗保健的任何设备、仪器、工具、仪表或装置。
在医疗保健行业中,医疗器械的使用具有极其重要的意义。
为了确保医疗器械的安全和有效性,制定了一系列的医疗器械指导原则。
首先,医疗器械的研发和上市应当符合严格的科学依据和法律法规,提供充分的临床验证数据。
在研发过程中,需要充分考虑生物学、工程学和临床学的因素,确保器械的性能和安全性得到充分评估。
同时,也需要遵循适当的法律法规和技术规范,包括医疗器械注册和上市许可等程序。
其次,医疗器械的生产和质量控制需要符合相关标准和质量管理体系要求,并进行有效的监督检查。
制造商应当建立和实施科学合理的生产工艺和质量控制体系,确保医疗器械的安全性和有效性。
同时,还需要监测医疗器械在生产和使用过程中的安全性和质量,及时采取措施进行修正和改进。
第三,医疗器械的流通和销售需要遵循合规的程序。
医疗器械经销商需要依法取得经营许可证,并对医疗器械进行配送和销售的全程追溯。
同时,需要对医疗器械在流通过程中的质量进行监督检查和药械零售企业的备案。
此外,需要建立健全的医疗器械不良事件报告和召回制度,及时发现和处理医疗器械存在的问题,保障患者和医务人员的安全。
第四,医疗器械的使用需要经过专业的培训和指导。
医务人员需要具备相应的专业知识和技能,熟悉医疗器械的使用方法和注意事项,能够正确操作、维护和保养医疗器械。
同时,还需要关注医疗器械的适应症和禁忌症,避免不当使用引起的安全风险。
最后,医疗器械的监管和管理需要加强。
政府和监管部门应当建立健全的医疗器械监管体系,加强对医疗器械的注册审评、生产质量控制和流通监管。
同时,还需要加大对医疗器械的宣传和教育力度,提高患者和医务人员对医疗器械的认知水平和安全意识。
总之,医疗器械指导原则的制定和实施是确保医疗器械安全和有效使用的关键。
只有通过科学合理的研发、严格的质量控制、合规的流通销售、专业的使用培训和加强的监管管理,才能保障医疗器械的安全和有效使用,最终提升医疗保健服务的质量和效果。
食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知

食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2015.09.25•【文号】食药监械监〔2015〕218号•【施行日期】2015.09.25•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文食品药品监管总局关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知食药监械监〔2015〕218号各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局:为加强医疗器械生产监督管理,指导监管部门对医疗器械生产企业实施《医疗器械生产质量管理规范》及其相关附录的现场检查和对检查结果的评估,根据《医疗器械生产质量管理规范》及其相关附录,国家食品药品监督管理总局组织制定了《医疗器械生产质量管理规范现场检查指导原则》《医疗器械生产质量管理规范无菌医疗器械现场检查指导原则》《医疗器械生产质量管理规范植入性医疗器械现场检查指导原则》《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》。
现印发给你们,请遵照执行。
指导原则用于指导监管部门对医疗器械生产企业实施《医疗器械生产质量管理规范》及相关附录的现场检查和对检查结果的评估,适用于医疗器械注册现场核查、医疗器械生产许可(含延续或变更)现场检查,以及根据工作需要对医疗器械生产企业开展的各类监督检查。
在医疗器械注册现场核查、生产许可(含变更)现场检查中,检查组应当依据指导原则对现场检查情况出具建议结论,建议结论分为“通过检查”“未通过检查”“整改后复查”三种情况。
现场检查中未发现企业有不符合项目的,建议结论为“通过检查”。
现场检查中发现企业关键项目(标识“*”项)不符合要求的,或虽然仅有一般项目(未标识“*”项)不符合要求,但可能对产品质量产生直接影响的,建议结论为“未通过检查”。
仅存在一般项目不符合要求,且不对产品质量产生直接影响的,建议结论为“整改后复查”。
医疗器械指导原则

医疗器械指导原则随着科技的发展和医疗水平的提高,医疗器械在疾病预防、诊断和治疗过程中扮演着重要的角色。
医疗器械指导原则旨在确保医疗器械在安全、有效和适当地使用的基础上为人类的健康服务。
一、安全性为首要原则医疗器械作为从事医疗工作的一种工具或设备,其安全性是应该得到高度重视的。
医疗器械生产商在设计和制造过程中应该充分考虑产品的安全性,确保其在正常操作情况下不会对患者或操作人员产生危害。
同时,医疗器械的使用者也需要妥善保管和使用器械,避免产生不必要的事故或意外。
二、有效性保证医疗效果医疗器械的使用必须具备一定的有效性,即能够达到预期的医疗效果。
对于存在多款同类型医疗器械的情况,医护人员需要选择最适合患者需求和情况的器械。
医疗器械的有效性也需要在使用过程中得到不断的评估和监测,确保其能够持续满足医疗需求。
三、适宜性考虑患者需求在选择和使用医疗器械时,需充分考虑患者的生理和心理特点,以及他们的需求。
不同年龄段、不同疾病和不同性别的患者对医疗器械的需求可能有所不同,在使用过程中需要做出相应的调整。
此外,对于特殊群体如孕妇和婴幼儿等,医护人员需要更加慎重地选择和使用器械。
四、规范性确保合法合规医疗器械的生产、流通和使用必须符合相关法律法规和行业规范。
医疗器械企业在生产和销售过程中需要获得相应的许可和认证,确保产品质量和安全性。
医疗机构应严格按照标准操作程序,确保医疗器械的有效使用和安全管理。
五、专业性要求医护人员医护人员在使用医疗器械过程中需要具备一定的专业知识和技能。
他们需要接受相关培训,了解医疗器械的使用方法、注意事项和维护保养等。
医护人员通过不断学习和实践,提高自身的专业水平,保证医疗器械的正确应用。
六、质量管理确保持续改进医疗器械的质量管理是确保其安全、有效和可靠使用的关键要素。
医疗器械企业应建立和实施有效的质量管理体系,包括质量标准的制定、生产过程的控制和产品质量的监测等。
同时,医护人员也应通过不断反馈和总结经验,对使用过程中的问题进行分析和改进,提高医疗器械的质量和效能。
医疗器械安全和性能基本原则清单

医疗器械安全和性能基本原则清单1.设计符合人机工程学原则:医疗器械的设计应考虑用户的人体特征和操作习惯,以确保操作的便捷性和准确性。
必须提供易于理解和使用的界面和操作控制,避免误操作和意外伤害。
2.材料和构造安全性:医疗器械的材料应符合卫生和安全要求,能够抵抗腐蚀、磨损和生物负荷。
器械的构造应该经过充分的工程设计,以保证其稳定性和耐用性。
3.功能和性能可靠性:医疗器械的设计和制造应保证其功能和性能的准确性、可靠性和一致性。
在设计和制造过程中,应采取合适的质量控制措施,以确保器械的性能达到预期的标准。
4.安全性和保护功能:医疗器械在使用过程中应具备相应的安全保护功能,以减少使用者和患者的潜在风险。
例如,对于高风险的器械,应设计安全机制和报警系统,以及限制使用者权限的功能。
5.清洁和消毒易于操作:医疗器械应具备易于清洁和消毒的特性,以确保器械的卫生和安全。
清洁和消毒程序的设计应符合标准操作规程,并提供相关指导和培训材料。
6.信息和文档支持:医疗器械应提供详细的信息和文档支持,包括用户手册、使用说明、维护和保养指南等。
这些信息应易于理解,并提供必要的技术支持和培训。
此外,对于高风险的器械,还应提供相关的风险评估和应急措施。
7.使用者培训:医疗器械制造商应提供适当的使用者培训,以确保使用者能够正确、安全地操作和维护器械。
培训内容应涵盖器械的正确使用方法、使用要点和注意事项等,并提供相关的教育材料和培训工具。
8.反馈和改进机制:医疗器械制造商应建立健全的反馈机制,接收用户的反馈和建议,并及时处理和改进。
此外,制造商还应定期对器械进行质量评估和风险分析,以进一步提高器械的安全性和性能。
总之,医疗器械安全和性能的基本原则清单包括设计符合人机工程学原则、材料和构造安全性、功能和性能可靠性、安全性和保护功能、清洁和消毒易于操作、信息和文档支持、使用者培训、反馈和改进机制。
这些原则的遵循将有助于确保医疗器械的安全和性能,并提高医疗行业的质量和效率。
现行医疗器械注册指导原则汇总

现行医疗器械注册指导原则汇总在当今社会中,医疗器械的注册和监管是非常重要的。
它确保了医疗器械的安全性和有效性。
为了规范医疗器械的注册过程,各国纷纷制定了相应的指导原则。
本文将对现行医疗器械注册指导原则进行汇总,并探讨其对医疗器械行业的意义和影响。
首先,医疗器械注册指导原则要求制造商提交详细的技术文件。
这些文件必须包括产品的设计图纸,材料和成分的说明,工艺流程以及其他相关信息。
这些文件对于评估医疗器械的性能和安全性非常重要。
通过对这些文件的审核,注册机构可以判断医疗器械是否符合相应的标准和要求。
制造商必须确保这些文件的准确性和完整性,以保证医疗器械在市场上的合法性和可用性。
其次,医疗器械注册指导原则要求进行严格的技术评估和临床试验。
技术评估是对医疗器械性能和特性进行全面评估的过程,包括机械性能、电气性能、生物相容性等。
临床试验是评估医疗器械在真实临床环境中使用效果和安全性的关键环节。
通过严格的技术评估和临床试验,可以有效地评估医疗器械的性能和安全性,确保其符合患者的实际需求。
此外,医疗器械注册指导原则要求建立完善的质量管理体系。
质量管理体系是确保医疗器械质量的关键因素。
包括制定质量管理手册、建立质量控制流程、培训员工等。
制造商必须建立一套科学合理的质量管理体系,以保证医疗器械的质量和安全性。
此外,医疗器械注册指导原则还要求制定严格的市场监管措施。
医疗器械市场监管是确保医疗器械安全和有效的重要环节。
各国纷纷制定了相应的监管法规和标准,对医疗器械的生产、流通、使用进行监管。
监管机构负责对医疗器械进行市场监测和风险评估,及时发现和处理存在问题的医疗器械,确保患者的安全和利益。
综上所述,现行医疗器械注册指导原则在医疗器械行业中起到了重要的作用。
通过严格的技术文件审核、技术评估和临床试验,可以确保医疗器械的性能和安全性符合标准和要求。
建立完善的质量管理体系,可以有效地保证医疗器械的质量和安全性。
制定严格的市场监管措施,可以及时发现和处理存在问题的医疗器械,确保患者的安全和利益。
医疗器械指导原则

医疗器械指导原则-有效性、安全性医疗器械指导原则可分为:医疗器械软件注册技术审查指导原则、医疗器械临床评价技术指导原则、医疗器械产品注册技术审查指导原则。
指导原则包括:适用范围、注册申报资料要求、审查要点、注册单元划分、临床评价要求、说明书要求等内容。
指导原则的使用:指导原则是供申请人和审查人员使用的指导文件,指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行。
申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据。
如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
一医疗器械软件注册技术审查指导原则。
医疗器械软件注册技术审查指导原则见附件1。
二医疗器械临床评价技术指导原则。
医疗器械临床评价技术指导原则见附件2。
三医疗器械产品注册技术审查指导原则。
由于医疗器械产品的不同,其产品注册技术审查指导原则内容也有相应的不同,但总体格式相同。
总体格式:审查指导原则1.适用范围2.注册申报资料要求2.1综述资料2.2主要原料研究资料2.3主要生产工艺及反应体系的研究资料2.4分析性能评估资料2.5参考区间确定资料2.6稳定性研究资料2.7临床评价资料2.8产品风险分析资料2.9产品技术要求2.10产品注册检验报告2.11产品说明书3.审查关注点3.1产品名称的要求3.2器械产品组成3.3反应机理或工作机理3.4产品主要性能指标及计算方法3.5产品适用的相关标准3.6产品说明书和标签样稿4.名词解释5.参考文献医疗器械指导原则的安全性和有效性体现在编写这些指导原则的要求中,安全性是医疗器械指导原则最基本的核心体现,有效性是医疗器械价值的体现。
1.基本要求1.1医疗器械产品技术要求的编制应符合国家相关法律法规。
1.2医疗器械产品技术要求中应采用规范、通用的术语。
如涉及特殊的术语,需提供明确定义,并写到“4.术语”部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号指导原则状态发布日期1气管插管产品注册技术审查指导原则现行2009-03-18 2B型超声诊断设备(第二类)产品注册技术审查指导原则现行2009-06-18 3无源植入性医疗器械产品注册申报资料指导原则现行2009-12-30 4自测用血糖监测系统注册申报资料指导原则现行2010-10-18 5接触镜护理产品注册技术审查指导原则现行2011-03-24 6同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则现行2011-03-24 7体外诊断试剂分析性能评估(准确度—方法学比对)技术审查指导原则现行2011-03-24 8体外诊断试剂分析性能评估(准确度—回收试验)技术审查指导原则现行2011-03-24 9肿瘤标志物类定量检测试剂注册申报资料指导原则现行2011-03-24 10一次性使用输注器具产品注册技术审查指导原则现行2011-03-24 11乳房植入体产品注册技术审查指导原则现行2011-03-24 12角膜塑形用硬性透气接触镜说明书编写指导原则现行2011-04-11 13一次性使用真空采血管产品注册技术审查指导原则现行2011-05-11 14天然胶乳橡胶避孕套产品注册技术审查指导原则现行2011-05-11 15一次性使用手术衣产品注册技术审查指导原则现行2011-05-11 16流行性感冒病毒核酸检测试剂注册申报资料指导原则现行2011-12-23 17流行性感冒病毒抗原检测试剂注册申报资料指导原则现行2011-12-23 18麻醉机和呼吸机用呼吸管路产品注册技术审查指导原则现行2012-05-10 19酶联免疫法检测试剂注册技术审查指导原则现行2013-01-04 20发光免疫类检测试剂注册技术审查指导原则现行2013-01-04 21核酸扩增法检测试剂注册技术审查指导原则现行2013-01-04 22金标类检测试剂注册技术审查指导原则现行2013-01-04 23生物芯片类检测试剂注册技术审查指导原则现行2013-01-04 24一次性使用透析器产品注册技术审查指导原则现行2013-01-04 25乙型肝炎病毒脱氧核糖核酸定量检测试剂注册技术审查指导原则现行2013-05-17 26病原体特异性M型免疫球蛋白定性检测试剂注册技术审查指导原则现行2013-05-1727人类免疫缺陷病毒检测试剂临床研究注册技术审查指导原则现行2013-05-17 28流式细胞仪配套用检测试剂注册技术审查指导原则现行2013-05-17 29疝修补补片产品注册技术审查指导原则现行2013-10-12 30负压引流装置产品注册技术审查指导原则现行2013-10-23 31一次性使用无菌手术包类产品注册技术审查指导原则现行2013-10-23 32一次性使用配药用注射器产品注册审查指导原则现行2013-10-23 33义齿制作用合金产品注册技术审查指导原则现行2013-10-23 34鼻氧管产品注册技术审查指导原则现行2013-10-23 35医用磁共振成像系统注册技术审查指导原则现行2014-03-13 36弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒抗体及G型免疫球蛋白抗现行2014-03-13 37肿瘤个体化治疗相关基因突变检测试剂技术审查指导原则现行2014-03-13 38药物滥用检测试剂技术审查指导原则现行2014-03-13 39软性亲水接触镜说明书编写指导原则现行2014-04-17 40硬性角膜接触镜说明书编写指导原则现行2014-04-17 41心脏射频消融导管产品注册技术审查指导原则现行2014-05-14 42牙科树脂类充填材料产品注册技术审查指导原则现行2014-05-14 43一次性使用避光输液器产品注册技术审查指导原则现行2014-05-14 44一次性使用血液分离器具产品注册技术审查指导原则现行2014-05-14 45血液透析浓缩物产品注册技术审查指导原则现行2014-05-14 46金属接骨板内固定系统产品注册技术审查指导原则现行2014-05-14 47医用口罩产品注册技术审查指导原则现行2014-05-20 48一次性使用引流管产品注册技术审查指导原则现行2014-05-20 49一次性使用皮肤缝合器产品注册技术审查指导原则现行2014-05-20 50医疗器械产品技术要求编写指导原则现行2014-05-30 51植入式心脏电极导线产品注册技术审查指导原则现行2014-06-04 52体外诊断试剂临床试验技术指导原则现行2014-09-11 53体外诊断试剂说明书编写指导原则现行2014-09-1154雌激素受体、孕激素受体抗体试剂及检测试剂盒技术审查指导原则现行2015-04-17 55医疗器械临床评价技术指导原则现行2015-05-19 56乙型肝炎病毒基因分型检测试剂技术审查指导原则现行2015-07-15 57影像型超声诊断设备新技术注册技术审查指导原则现行2015-07-15 58医疗器械软件注册技术审查指导原则现行2015-08-05 59结核分枝杆菌复合群核酸检测试剂注册技术审查指导原则现行2015-09-21 60丙型肝炎病毒核糖核酸测定试剂技术审查指导原则现行2015-11-26 61过敏原特异性IgE抗体检测试剂技术审查指导原则现行2015-11-26 62人乳头瘤病毒(HPV)核酸检测及基因分型试剂技术审查指导原则现行2015-11-26 63全自动化学发光免疫分析仪技术审查指导原则现行2015-11-26 64质子/碳离子治疗系统技术审查指导原则现行2015-12-31 65离心式血液成分分离设备技术审查指导原则现行2015-12-31 66影像型超声诊断设备(第三类)技术审查指导原则(2015年修订版)现行2015-12-31 67一次性使用膜式氧合器注册技术审查指导原则现行2016-01-14 68α-氰基丙烯酸酯类医用粘合剂注册技术审查指导原则现行2016-01-14 69可吸收止血产品注册技术审查指导原则现行2016-01-18 70腹腔、盆腔外科手术用可吸收防粘连产品注册技术审查指导原则现行2016-01-18 71透明质酸钠类面部注射填充材料注册技术审查指导原则现行2016-01-18 72高频手术设备注册技术审查指导原则现行2016-02-06 73医用X射线诊断设备(第三类)技术审查指导原则(2016年修订版)现行2016-02-06 74植入式心脏起搏器技术审查指导原则(2016年修订版)现行2016-02-06 75脉搏血氧仪设备临床评价技术指导原则现行2016-02-06 76治疗呼吸机注册技术审查指导原则现行2016-02-06 77强脉冲光治疗仪注册技术审查指导原则现行2016-02-06 78磁疗产品注册技术审查指导原则(2016年修订版)现行2016-02-06 79电子血压计(示波法)注册技术审查指导原则(2016年修订版)现行2016-02-06 80X射线诊断设备(第二类)注册技术审查指导原则(2016年修订版)现行2016-02-0681尿液分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 82凝血分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 83半自动化学发光免疫分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 84生化分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 85血糖仪注册技术审查指导原则(2016年修订版)现行2016-02-06 86血液透析用制水设备注册技术审查指导原则(2016年修订版)现行2016-02-06 87牙科综合治疗机注册技术审查指导原则(2016年修订版)现行2016-02-06 88医用雾化器注册技术审查指导原则(2016年修订版)现行2016-02-06 89助听器注册技术审查指导原则(2016年修订版)现行2016-02-06 90自动尿液有形成分分析仪注册技术审查指导原则(2016年修订版)现行2016-02-06 91医学图像存储传输软件(PACS)注册技术审查指导原则现行2016-02-26 92正压通气治疗机注册技术审查指导原则现行2016-02-26 93大型蒸汽灭菌器注册技术审查指导原则现行2016-02-26 94腹膜透析机注册技术审查指导原则现行2016-02-26 95医用内窥镜冷光源注册技术审查指导原则现行2016-02-26 96振动叩击排痰机注册技术审查指导原则现行2016-02-26 97碱性磷酸酶测定试剂盒注册技术审查指导原则(2016年修订版)现行2016-02-26 98人绒毛膜促性腺激素检测试剂(胶体金免疫层析法)注册技术审查指导原现行2016-02-26 99C反应蛋白测定试剂盒注册技术审查指导原则(2016年修订版)现行2016-02-26 100大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册技术审查指导原现行2016-02-26 101缺血修饰白蛋白测定试剂盒注册技术审查指导原则(2016年修订版)现行2016-02-26 102肌酸激酶测定试剂(盒)注册技术审查指导原则(2016年修订版)现行2016-02-26 103白蛋白测定试剂(盒)注册技术审查指导原则现行2016-02-26 104糖化血红蛋白测定试剂盒(酶法)注册技术审查指导原则现行2016-02-26 105乳酸脱氢酶测定试剂盒注册技术审查指导原则现行2016-02-26 106促甲状腺素检测试剂注册技术审查指导原则现行2016-02-26 107甘油三酯测定试剂盒注册技术审查指导原则现行2016-02-26108唾液酸检测试剂盒(酶法)注册技术审查指导原则现行2016-02-26 109β2-微球蛋白检测试剂盒(胶乳增强免疫比浊法)注册技术审查指导原则现行2016-02-26 110牙科种植体(系统)注册技术审查指导原则(2016年修订版)现行2016-04-14 111牙科基托聚合物材料注册技术审查指导原则现行2016-04-14 112一次性使用脑积水分流器注册技术审查指导原则现行2016-04-14 113可吸收性外科缝线注册技术审查指导原则现行2016-04-14 114脊柱后路内固定系统注册技术审查指导原则现行2016-04-14 115椎间融合器注册技术审查指导原则现行2016-04-14 116人红细胞反定型试剂注册技术审查指导原则现行2016-09-26 117一次性使用血液透析管路注册技术审查指导原则现行2016-11-02 118眼科超声乳化和眼前节玻璃体切除设备及附件注册技术审查指导原则现行2016-12-06 119人工耳蜗植入系统临床试验指导原则现行2017-01-04 120光固化机注册技术审查指导原则现行2017-01-10 121体外除颤产品注册技术审查指导原则现行2017-01-10 122口腔颌面锥形束计算机体层摄影设备注册技术审查指导原则现行2017-01-10 123医用磁共振成像系统临床评价技术审查指导原则现行2017-01-10 124医疗器械网络安全注册技术审查指导原则现行2017-01-20 125钙磷/硅类骨填充材料注册技术审查指导原则现行2017-01-22 126中心静脉导管产品注册技术审查指导原则现行2017-01-22 127袜型医用压力带注册技术审查指导原则现行2017-01-22 128髋关节假体系统注册技术审查指导原则现行2017-02-10 129人工颈椎间盘假体注册技术审查指导原则现行2017-02-10 130结核分枝杆菌复合群耐药基因突变检测试剂注册技术审查指导原则现行2017-02-13 131电动病床注册技术审查指导原则(2017年修订版)现行2017-02-17 132腹腔镜手术器械技术审查指导原则现行2017-02-17 133手术无影灯注册技术审查指导原则现行2017-02-17 134人工耳蜗植入系统注册技术审查指导原则现行2017-02-28135可见光谱治疗仪注册技术审查指导原则现行2017-03-10 136纤维内窥镜(第二类)注册技术指导原则(2017年修订版)现行2017-03-10 137硬管内窥镜(第二类)注册技术审查指导原则(2017年修订版)现行2017-03-10 138注射泵注册技术审查指导原则(2017年修订版)现行2017-03-10 139手术电极注册技术审查指导原则(2017年修订版)现行2017-03-10 140医用电子体温计注册技术审查指导原则(2017年修订版)现行2017-03-10 141半导体激光治疗机(第二类)注册技术审查指导原则(2017年修订版)现行2017-03-10 142腔镜用吻合器产品注册技术审查指导原则现行2017-03-13 143牙科纤维桩产品注册技术审查指导原则现行2017-03-13 144聚氨酯泡沫敷料产品注册技术审查指导原则现行2017-03-13 145胎儿染色体非整倍体(T21、T18、T13)检测试剂盒(高通量测序法)注现行2017-03-30 146超声多普勒胎儿心率仪注册技术审查指导原则现行2017-04-24 147电动牵引装置注册技术审查指导原则(2017年修订版)现行2017-04-24 148电动手术台注册技术审查指导原则(2017年修订版)现行2017-04-24 149影像型超声诊断设备(第二类)注册技术审查指导原则现行2017-04-24 150无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)现行2017-05-12 151牙科种植机注册技术审查指导原则现行2017-08-02 152红外乳腺检查仪注册技术审查指导原则(2017年修订版)现行2017-09-05 153医用臭氧妇科治疗仪注册技术审查指导原则(2017年修订版)现行2017-09-05 154骨组织手术设备注册技术审查指导原则(2017年修订版)现行2017-09-05 155酶标仪注册技术审查指导原则现行2017-09-25 156一次性使用心电电极注册技术审查指导原则现行2017-09-25 157动态血压测量仪注册技术审查指导原则现行2017-09-25 158心电图机注册技术审查指导原则(2017年修订版)现行2017-09-25 159病人监护产品(第二类)注册技术审查指导原则(2017年修订版)现行2017-09-25 160红外线治疗设备注册技术审查指导原则(2017年修订版)现行2017-11-02 161医用控温毯注册技术审查指导原则(2017年修订版)现行2017-11-02162中频电疗产品注册技术审查指导原则(2017年修订版)现行2017-11-02 163脉搏血氧仪注册技术审查指导原则(2017年修订版)现行2017-11-02 164牙科手机注册技术审查指导原则(2017年修订版)现行2017-11-02 165超声多普勒胎儿监护仪注册技术审查指导原则(2017年修订版)现行2017-11-02 166超声理疗设备注册技术审查指导原则(2017年修订版)现行2017-11-02 167超声洁牙设备注册技术审查指导原则(2017年修订版)现行2017-11-02 168视野计注册技术审查指导原则(2017年修订版)现行2017-11-02 169防褥疮气床垫注册技术审查指导原则(2017年修订版)现行2017-11-02 170超声骨密度仪注册技术审查指导原则现行2017-11-06 171电动轮椅车注册技术审查指导原则现行2017-11-06 172耳腔式医用红外体温计注册技术审查指导原则现行2017-11-06 173医用吸引设备注册技术审查指导原则(2017年修订版)现行2017-11-06 174小型分子筛制氧机注册技术审查指导原则(2017年修订版)现行2017-11-06 175医疗器械注册单元划分指导原则现行2017-11-17 176小型蒸汽灭菌器注册技术审查指导原则现行2017-12-06 177动态心电图系统注册技术审查指导原则现行2017-12-06 178血管内球囊扩张导管用球囊充压装置注册技术审查指导原则现行2017-12-06 179验光仪注册技术审查指导原则现行2017-12-06 180中央监护软件注册技术审查指导原则现行2017-12-06 181紫外治疗设备注册技术审查指导原则现行2017-12-06 182生物显微镜注册技术审查指导原则 现行2017-12-06 183裂隙灯显微镜注册技术审查指导原则现行2017-12-06 184输液泵注册技术审查指导原则 现行2017-12-06 185电动洗胃机注册技术审查指导原则(2017年修订版)现行2017-12-06 186全自动血型分析仪注册技术审查指导原则现行2017-12-14 187ABO、RhD血型抗原检测卡(柱凝集法)注册技术审查指导原则现行2017-12-14 188人表皮生长因子受体2基因扩增检测试剂盒(荧光原位杂交法)注册技术现行2017-12-14189丙型肝炎病毒核酸基因分型检测试剂盒注册技术审查指导原则现行2017-12-14 190治疗呼吸机临床评价技术审查指导原则现行2017-12-18 191子宫内膜去除(热传导、射频消融)设备临床评价技术审查指导原则现行2017-12-18 192促黄体生成素检测试剂(胶体金免疫层析法)注册技术审查指导原则现行2017-12-18 193心肌肌钙蛋白I/肌红蛋白/肌酸激酶同工酶MB检测试剂(胶体金免疫层析现行2017-12-18 194电解质钾、钠、氯、钙测定试剂注册技术审查指导原则现行2017-12-18 195高密度脂蛋白胆固醇测定试剂注册技术审查指导原则现行2017-12-18 196胱抑素C测定试剂(胶乳透射免疫比浊法)注册技术审查指导原则现行2017-12-18 197移动医疗器械注册技术审查指导原则现行2017-12-22 198动物源性医疗器械注册技术审查指导原则(2017年修订版)现行2017-12-25 199全血及血液成分贮存袋注册技术审查指导原则现行2018-01-03 200一次性使用输注泵(非电驱动)注册技术审查指导原则现行2018-01-03 201血液浓缩器注册技术审查指导原则现行2018-01-03 202医疗器械临床试验设计指导原则现行2018-01-04 203质子碳离子治疗系统临床评价技术审查指导原则现行2018-01-04 204丙氨酸氨基转移酶测定试剂注册技术审查指导原则现行2018-01-08 205尿液分析试纸条注册技术审查指导原则现行2018-01-08 206同型半胱氨酸测定试剂注册技术审查指导原则现行2018-01-08 207胰岛素测定试剂注册技术审查指导原则现行2018-01-08 208C-肽测定试剂注册技术审查指导原则现行2018-01-08 209载脂蛋白A1测定试剂注册技术审查指导原则现行2018-01-08 210载脂蛋白B测定试剂注册技术审查指导原则现行2018-01-08 211D-二聚体测定试剂(免疫比浊法)注册技术审查指导原则现行2018-01-08 212接受医疗器械境外临床试验数据技术指导原则现行2018-01-10 213X射线计算机体层摄影设备注册技术审查指导原则现行2018-02-01 214人表皮生长因子受体(EGFR)突变基因检测试剂(PCR法)注册技术审查现行2018-02-11 215幽门螺杆菌抗原/抗体检测试剂注册技术审查指导原则现行2018-02-11216抗人球蛋白检测试剂注册技术审查指导原则现行2018-02-11 217肠道病毒核酸检测试剂注册技术审查指导原则现行2018-02-11 218超声软组织切割止血系统注册技术审查指导原则现行2018-02-11 219眼科光学相干断层扫描仪注册技术审查指导原则现行2018-02-26 220眼科飞秒激光治疗机注册技术审查指导原则现行2018-03-16 221眼科超声诊断设备注册技术审查指导原则现行2018-03-16 222持续葡萄糖监测系统注册技术审查指导原则现行2018-03-16 223结核分枝杆菌特异性细胞免疫反应检测试剂注册技术审查指导原则现行2018-03-16 224硬性光学内窥镜(有创类)注册技术审查指导原则现行2018-03-16 225口腔曲面体层X射线机注册技术审查指导原则现行2018-04-11 226气腹机注册技术审查指导原则现行2018-04-17 227医用低温保存箱注册技术审查指导原则现行2018-04-17 228电子尿量计注册技术审查指导原则现行2018-04-17 229电子阴道显微镜注册技术审查指导原则现行2018-04-17 230软性接触镜注册技术审查指导原则现行2018-04-25 231人类体外辅助生殖技术用液注册技术审查指导原则现行2018-04-25 232冠状动脉药物洗脱支架临床前研究指导原则现行2018-05-04 233冠状动脉药物洗脱支架临床试验指导原则现行2018-05-04 234手术显微镜注册技术审查指导原则现行2018-05-10 235医用洁净工作台注册技术审查指导原则现行2018-05-10 236眼压计注册技术审查指导原则现行2018-05-10 237脉搏波速度和踝臂指数检测产品注册技术审查指导原则现行2018-05-10 238麻醉咽喉镜注册技术审查指导原则现行2018-05-25 239内镜清洗消毒机注册技术审查指导原则现行2018-05-25 240睡眠呼吸监测产品注册技术审查指导原则现行2018-05-25 241无源植入性医疗器械临床试验审批申报资料编写指导原则现行2018-06-04 242角膜塑形用硬性透气接触镜临床试验指导原则现行2018-06-29243软性接触镜临床试验指导原则现行2018-06-29 244鼻饲营养导管注册技术审查指导原则(2018年修订)现行2018-08-28 245一次性使用无菌导尿管注册技术审查指导原则(2018年修订)现行2018-08-28 246定制式义齿注册技术审查指导原则(2018年修订)现行2018-08-28 247用于罕见病防治医疗器械注册审查指导原则现行2018-10-12 248骨科外固定支架注册技术审查指导原则(2018年修订)现行2018-10-25 249一次性使用医用喉罩注册技术审查指导原则(2018年修订)现行2018-10-25 250骨水泥套管组件注册技术审查指导原则现行2018-10-25 251护脐带注册技术审查指导原则(2018年修订)现行2018-11-07 252全瓷义齿用氧化锆瓷块注册技术审查指导原则(2018年修订)现行2018-11-07 253手动轮椅车注册技术审查指导原则现行2018-11-07 254外科纱布敷料注册技术审查指导原则(2018年修订)现行2018-11-28 255吻(缝)合器产品注册技术审查指导原则(2018年修订)现行2018-11-28 256一次性使用吸痰管注册技术审查指导原则现行2018-11-28 257一次性使用胆红素血浆吸附器注册技术审查指导原则现行2018-12-10 258一次性使用活检针注册技术审查指导原则现行2018-12-10 259医用激光光纤产品注册技术审查指导原则现行2018-12-17 260主动脉覆膜支架系统临床试验指导原则现行2019-02-25 261生物可吸收冠状动脉药物洗脱支架临床试验指导原则现行2019-02-25 262经导管植入式人工主动脉瓣膜临床试验指导原则现行2019-02-25 263眼科高频超声诊断仪注册技术审查指导原则现行2019-02-28 264双能X射线骨密度仪注册技术审查指导原则现行2019-02-28 265麻醉机注册技术审查指导原则现行2019-02-28 266口腔颌面锥形束计算机体层摄影设备临床评价指导原则现行2019-02-28 267脑利钠肽 氨基末端脑利钠肽前体检测试剂注册技术审查指导原则现行2019-03-05 268总甲状腺素检测试剂注册技术审查指导原则现行2019-03-05 269孕酮检测试剂注册技术审查指导原则现行2019-03-05270降钙素原检测试剂注册技术审查指导原则现行2019-03-05 271人工晶状体临床试验指导原则现行2019-03-18 272透明质酸钠类面部注射填充材料临床试验指导原则现行2019-03-18 273用于角膜制瓣的眼科飞秒激光治疗机临床试验指导原则现行2019-03-18 274牙科车针注册技术审查指导原则现行2019-04-03 275一次性使用配药用注射器注册技术审查指导原则现行2019-04-03 276一次性使用皮肤缝合器注册技术审查指导原则(2019年修订)现行2019-04-03 277医疗器械动物实验研究技术审查指导原则 第一部分:决策原则现行2019-04-18 278腹腔内置疝修补补片动物实验技术审查指导原则现行2019-04-18 279有源医疗器械使用期限注册技术审查指导原则现行2019-05-08 280离心式血液成分分离设备临床评价注册技术审查指导原则现行2019-05-10 281合成树脂牙注册技术审查指导原则现行2019-05-20 282宫内节育器注册技术审查指导原则现行2019-05-20 283植入式给药装置注册技术审查指导原则现行2019-05-20。
