06手性分子
手性分子
纸面上旋转180° 纸面上旋转180° 180
= HO
CH3 H
OH
COOH
COOH
H
纸面上旋转90° 纸面上旋转90° 90
H CH3 OH H3C OH COOH
投影式不能离开纸面进行翻转。 2、 Fischer 投影式不能离开纸面进行翻转。 3、如果使Fischer 投影式中的一个基团保持 如果使Fischer 固定, 固定,而把另外三个基团顺时针或逆时针调换 位置,不会改变原化合物的构型。 位置,不会改变原化合物的构型。
外消旋体:等量左旋体与右旋体的混合物。 外消旋体:等量左旋体与右旋体的混合物。无 混合物 旋光性。 用 (±) 、RS或 (dl)表示。 旋光性。 ± 或 表示。 表示 (±) –乳酸 ± 乳酸
原因:一对映体,旋光度相等,旋光方向相反。 原因:一对映体,旋光度相等,旋光方向相反。 性质: 性质:外消旋体的物理性质与纯的单一对映体 比较有所不同。 比较有所不同。
课堂练习:问题 - 课堂练习:问题5-2
第二节
一、投影方法
费歇尔投影式
COOH
HO
H
CH3
把主链竖 立,编号 最小碳放 在上端
划十字线, 划十字线, 交点代表手性 横键向前, 碳,横键向前,竖键向 。
含有两个手性碳的手性分子的投影
CH3 HO
HO C C OH CH3 H
H OH CH3
H
H H3 C
立体化学基础: 第五章 立体化学基础:手性分子
碳链异构 位置异构 构造异构 同分异构 立体异构 构象异构 官能团异构 互变异构 构型异构 对映异构 顺反异构
构造异构:分子组成相同而原子( 构造异构:分子组成相同而原子(团)相互连接方 异构 式和顺序不同 空间排列方式不同 立体异构:分子中原子( 立体异构:分子中原子(团)在空间排列方式不同
手性分子现象及其在药学中的应用

手性分子现象及其在药学中的应用手性分子现象是化学中一个重要且引人注目的现象。
在自然界中存在许多手性分子,它们的结构与镜像对称体不重合,因此被称为手性分子。
手性分子在药学中具有广泛的应用,尤其在药物设计与合成过程中扮演着重要的角色。
本文将重点讨论手性分子现象及其在药学中的应用。
手性分子的定义是指它们无法与其镜像对称体完全重合的分子。
这意味着手性分子存在两种立体异构体,分别为左旋体(L-体)和右旋体(D-体)。
这种立体异构体的存在导致许多手性分子在生物活性方面表现出不同的药理特性。
举例来说,左旋肾上腺素和右旋肾上腺素具有截然不同的生理效应。
由于左右旋体药理活性的差异,手性分子的研究在药学领域具有重要意义。
手性分子现象在药学中的应用主要体现在以下几个方面。
首先,手性药物研究与合成。
手性药物以其特殊的立体异构体存在形式,对于几乎所有临床治疗领域都至关重要。
实际上,据估计,全球药物市场上约有60%的药物是手性药物。
令人感兴趣的是,同一个手性药物的两种立体异构体通常具有不同的生理效应和药物代谢途径。
因此,对手性药物立体化学性质的研究和药物代谢途径的探索对合成理论、合成方法、合成途径以及更广泛的药物制剂发展起着至关重要的作用。
其次,手性分离技术的应用。
由于雌激素类药物、哌替啶等手性分子对人体的作用差异性很大,需要通过药物分离技术将其手性异构体进行分离。
目前广泛应用的手性分离方法有结晶、色谱、电泳以及化学反应等。
手性分离技术的发展为更精确地衡量药物的药效学提供了可能。
此外,手性药物的制剂设计也是药学中一个重要的研究方向。
手性分子根据其不同的立体构型和活性可能有不同的物理化学特性,因此在制剂的设计过程中需要考虑其合适的载体、剂型等,以保持其稳定性和药效性。
最后,手性分子现象在药物代谢研究中也有重要的应用。
手性药物的代谢是一个非常复杂的过程,其中手性酶和其他酶参与并影响药物的代谢路径和代谢速率。
通过研究手性分子的代谢途径,可以更好地了解药物在人体内的代谢机制和药效学特性,从而提高药物的临床应用安全性和疗效。
手性分子的判断方法

手性分子的判断方法手性分子是指具有非重合镜像的分子或物质。
它由手性中心、对映体、手性异构体等组成。
手性分子的判断方法包括物理方法、化学方法和计算方法。
物理方法是基于手性分子的光学活性性质进行判断的。
主要包括旋光度测定和比旋光度测定。
旋光度测定是通过测定物质对极化光产生的旋光角来判断其是否为手性分子。
极化光在通过手性分子后会分为两束独立的旋转的光线,其旋转方向和角度可测得并用来计算旋光度。
若旋光度不为零,则可以断定分子为手性分子。
比旋光度测定是通过测量两种对映体的旋光度差来判断其是否为手性分子。
一般情况下,两种对映体的旋光度差应该是固定值,若差值在测定误差范围内,则可以断定为手性分子。
化学方法是通过手性分子的反应性质判断其是否为手性分子。
主要包括光学活性试剂法和配位试剂法。
光学活性试剂法是用具有手性基团的试剂与待测分子进行反应,通过反应结果来判断待测分子是否具有手性。
如果存在转化物,则可以判定为手性分子。
配位试剂法是利用具有光学活性的配体与手性分子形成配合物,通过测定配合物的旋光参数来判断分子是否为手性分子。
如果配位物具有非零的旋光度,则可以断定分子为手性分子。
计算方法是通过计算分子的化学键、能级结构等参数来判断其是否为手性分子。
主要包括量子化学计算、密度泛函理论等方法。
量子化学计算是将分子的几何构型输入计算软件中,通过计算分子的最低能量结构和能级结构等参数来判断其是否具有手性。
如果计算结果表明存在非重合的镜像异构体,则可以判定分子为手性分子。
密度泛函理论是一种基于电子密度的理论计算方法,通过计算分子的电子密度来判断其手性性质。
如果电子密度分布在空间中不能通过旋转和平移使得与其镜像式重合,则可以断定分子为手性分子。
总结起来,手性分子的判断方法包括物理方法、化学方法和计算方法。
物理方法主要是通过旋光度和比旋光度测定来判断;化学方法主要是通过光学活性试剂法和配位试剂法来反应性质判断;计算方法主要是通过量子化学计算和密度泛函理论等方式进行计算分析来判断。
06 第六章 对映体

CH2OH
(Ⅱ)
CH2OH
H F F H
H
有对称中心
镜象和实物能重叠,无手性
结论:有对称中心的分子,实物和镜象能重叠,无手
性,无对映异构体,无旋光性。
20
21
3. 对称轴 定义: 穿过分子画一直线,以它为轴旋转一定角度后,可 以获得于原来分子相同的构型,这一直线叫对称 轴.
H H H H
Cn
H H H
C4
( 360 ) 90
29
COOH H C
CH 3
COOH
OH
对映异构体:
HO
H3 C
C H
S–(+)–乳酸
(R)
注意: R、S与右旋、左旋没有一定关系。
CH3 C H OH CH2CH3 CH3CH2 OH CH3 C H
(S)–2–丁醇
(R)–2–丁醇
30
H H3C C OH CH CH2
H
OH COOH C
(S)–3–丁烯–2–醇 (S)–2–羟基苯乙酸 2. 对映异构体的表示方法 常有两种表示方法
18
2. 对称中心( i ) 定义:分子中有一点 P ,以分子任何一点与其连线,
都能在延长线上找到自己的镜象,则 P 点为
该分子的对称中心。
19
例:环丁烷
H H H H H
H H H H H H H H
P
H H
H
有对称中心
镜象和实物能重叠,无手性。
Cl
Cl H F H H F H Cl
例:
H Cl
O C OH CH3 H H H
28
O C CH3 O O C
第二较优
O C H O O H
化学分子的手性研究

化学分子的手性研究手性是化学中一个重要的概念,它指的是物质在空间中的非对称性。
在化学分子中,手性是指分子的镜像和原始分子无法通过旋转和平移重合。
手性分子是由手性中心所引起的,在自然界中存在着大量手性分子的原因是其存在两种不对称的构型。
手性分子的研究在化学领域具有重要的理论和应用价值。
一、手性分子的定义和特点1. 定义:手性分子是指不对称的分子,其镜像和原始分子无法通过旋转和平移重合。
2. 特点:手性分子在物理、化学性质上与其非手性镜像分子有明显的差异,如旋光性、光学活性、生物活性等。
二、手性分子的研究方法1. 空间构型分析:通过X射线衍射、核磁共振等技术来确定分子内部的空间构型。
2. 旋光度测定:利用旋光度仪等仪器测定手性分子的旋光性。
3. 显示手性试剂:使用显示手性试剂,如酒石酸铵等,观察其对手性分子的特异性反应。
三、手性分子的应用领域1. 药物合成:药物分子通常都是手性的,研究手性分子的性质和构型有助于合成优异的药物。
2. 化学合成:手性催化剂在有机合成中起到重要作用,控制手性选择性能够合成具有特殊功能的化合物。
3. 生物领域:研究手性分子的生物活性和与生物体的作用,有助于理解生物分子的结构和功能。
四、手性分子的发展趋势1. 多功能手性分子的设计:通过合理设计手性分子的结构,实现多功能性质和应用。
2. 手性分子的催化研究:发展更高效、选择性更好的手性催化剂,促进有机合成反应的发展。
3. 生物手性研究:深入研究手性分子在生物体内的作用机制,为药物研发提供更多的信息。
综上所述,手性分子的研究在化学领域具有重要的意义。
通过研究手性分子的定义和特点、研究方法、应用领域以及发展趋势,可以更好地理解手性分子的性质和应用。
希望在未来的研究中,能够深入探索手性分子的奥秘,为科学研究和应用领域带来更多的突破和创新。
有机化学基础知识点整理手性分子的定义与分类

有机化学基础知识点整理手性分子的定义与分类手性分子的定义与分类手性分子是指具有非对称碳原子或其他不对称中心的分子。
在有机化学中,手性分子是一类非常重要的分子,它们的不对称性决定了它们在化学反应中特殊的性质和行为。
本文将对手性分子的定义和分类进行整理,以帮助读者更好地理解有机化学中的手性分子。
一、手性分子的定义手性分子是指在空间中无法与其镜像重合的分子。
手性分子具有两个互为镜像的异构体,称为对映异构体,即“左手”和“右手”。
这种对称性的缺失使得手性分子的物理性质和化学反应与非手性分子截然不同。
手性分子的不对称性通常来自于碳原子上的取代基或其他中心原子上的取代基的配置不同。
在有机化学中,碳原子上的取代基可以有四种不同的取代方式,即氢、烷基、卤素或其他取代基。
二、手性分子的分类手性分子可以根据其不对称中心的数量进行分类。
根据不对称中心的数量,手性分子可以分为单手性分子和多手性分子。
1. 单手性分子单手性分子是指只有一个不对称中心的手性分子。
在这种分子中,只存在两个对映异构体,即一对“左手”和“右手”。
典型的例子是乙醇分子(C2H5OH),它在空间中有一个不对称碳原子,因此存在两种对映异构体。
2. 多手性分子多手性分子是指具有两个或多个不对称中心的手性分子。
在这种分子中,存在更多的对映异构体。
多手性分子的对映异构体数量可以通过2的n次方计算,其中n是不对称中心的数量。
例如,丙二醇(C3H8O2)是一种多手性分子,它有两个不对称碳原子,因此存在4种对映异构体。
这些对映异构体可以用R和S来表示,以帮助区分它们的构型。
总结:手性分子是具有非对称碳原子或其他不对称中心的分子。
手性分子的不对称性决定了它们特殊的性质和行为。
根据不对称中心的数量,手性分子可以分为单手性分子和多手性分子。
对映异构体的存在使得手性分子的化学反应和物理性质与非手性分子有所不同。
理解手性分子的定义和分类对于研究有机化学以及相关领域的学生和科研人员非常重要。
有机化学基础知识点手性分子和手性中心

有机化学基础知识点手性分子和手性中心手性分子和手性中心是有机化学中重要的基础知识点。
在分子中存在手性中心的化合物称为手性分子,它们具有非对称的空间结构,在化学性质和生物活性上表现出与其镜像异构体不同的特性。
本文将介绍手性分子和手性中心的概念、性质及其在化学、药学领域中的重要应用。
一、手性分子的概念和性质手性分子是指分子结构中存在手性中心的有机化合物。
手性中心是指一个原子与四个不同的基团连接而形成的碳原子或其他原子。
根据手性中心的不对称性质,手性分子的镜像异构体称为对映异构体或镜像异构体。
手性分子的对映异构体之间在理论上是完全一样的,但在物理性质、化学性质、生物活性等方面却存在明显的差异。
手性分子的不对称性导致其旋光性质,即能使平面偏振光改变振动方向。
对映异构体的旋光性相等但方向相反,可以通过测定旋光度来区分和鉴定手性分子。
二、手性分子的分类和表示方法手性分子可以分为R体和S体两种类型,它们是通过Cahn-Ingold-Prelog规则进行分类的。
当四个连接在手性中心上的基团按照优先级由高到低顺序排列时,如果顺时针方向排列则为R体,逆时针方向排列则为S体。
表示手性分子时一般使用立体式投影图或楔形/横杠式表示,以准确展示手性中心的立体构型。
三、手性分子的化学性质手性分子的化学性质常常与它们的对映异构体有明显的差异。
例如,L-和D-丙氨酸是两种对映异构体,具有完全相同的化学成分,但在生物活性、酶的反应速率、光学活性度等方面存在差异。
这是由于生物体内的酶对手性分子的选择性较强,可以与特定的对映异构体发生特定的反应。
四、手性分子的应用领域手性分子在化学合成、医药研究等领域有广泛的应用。
在有机合成中,手性催化剂可以选择性地催化手性底物的反应,从而有效合成目标手性化合物。
在药学领域,由于手性分子的对映异构体在生物活性方面的差异,合成和使用手性药物成为一种重要的手段。
通过选择性制备特定手性的药物,可以提高治疗效果,减少副作用。
手性分子的概念

手性分子的概念把手性分子作为一种新概念来关注,虽然已经有一段时间了,但手性分子还是相当有意义的一个概念,它不仅有着丰富的应用前景,而且在理论上也具有十分重要的地位。
手性分子指的是一种具有不对称结构的分子,它可以是有机分子,也可以是无机分子。
由于它们的结构不对称,它们在物理和化学上的性质也将会不对称,从而对生命的过程有着重要的影响。
可以说,手性分子是生命的基础,它可以改变生物体的物理和化学性质,从而控制许多生命过程,如果没有手性分子,我们没有办法掌握生命的奥秘,就不可能有任何生物存在。
那么,什么是手性分子?它是一类具有异构结构的分子,也就是说,一个分子的结构可以由两个或多个结构不同的部分组成,这些部分是相互竞争和互补的,它们的反应路线也是不同的,可以产生不同的效果。
手性分子的存在是因为它的结构不对称,它可以具有两种不同的反应路线,称为aldiabatic和diabatic。
aldiabatic反应路线指的是分子在不变形的情况下,能够被一个外部力场改变它们的内部结构,从而产生新的反应,而diabatic反应路线则指的是分子结构可以被外界力场改变,但这种改变是可逆的。
手性分子有其独特性,它们可以把生物体们被一般的有机分子所没有的差异化,从而为生物体提供了更多的变化能力,这也就是为什么它们在生命过程中如此重要的原因。
此外,手性分子也能用于工业制造,例如陶瓷、新材料等,因为它们本身的特性,可以赋予材料一种新的性质,例如磁性、耐高温性等,从而为工业制造提供新的技术。
综上所述,手性分子是一种相当重要的分子,可以影响生物体生理和化学性质,也可用于工业制造,是一种有着广泛应用前景的概念。
未来可期,随着手性分子的研究及应用的深入,将为科学研究和社会发展带来更多福祉。
手性分子的判断方法

手性分子的判断方法手性分子是指旋光性质不可重叠镜像异构体,即左旋与右旋镜像异构体。
手性分子在化学和生物学领域中起着重要的作用。
判断一些分子是否是手性分子,通常可以通过以下三种方法进行。
1.对称性分析法2.手性圆二色谱法3.X射线晶体学分析法接下来,我们将详细说明这三种方法。
1.对称性分析法:对称性分析法是一种简单且直观的方法,用于判断分子是否具有手性。
具体步骤如下:(1)确定分子是否具有对称面,即分子可以对称折叠。
如果分子有平面对称面,那么它是一个非手性分子。
(2)确定分子是否具有中心对称。
中心对称分子是指具有旋转轴并且轴上的每一点都与该轴上的一个等距离的点对称。
如果分子具有中心对称,则为非手性分子。
(3)如果分子不具有对称面或中心对称,则可能是手性分子。
需要进一步进行实验确认。
2.手性圆二色谱法:手性圆二色谱法是一种通过测量手性分子的光学活性来确定其手性性质的方法。
它利用分子的吸收螺旋度、光旋和偏振度来进行分析。
具体步骤如下:(1)用手性圆二色仪测量样品在可见光区域的吸光度。
(2)比较左旋和右旋样品的吸光度。
如果两者相等,则该分子是非手性的。
(3)如果左旋和右旋样品的吸光度不相等,则该分子是手性的。
3.X射线晶体学分析法:X射线晶体学是一种用于确定有机化合物和无机化合物的分子结构的方法。
它可以提供有关分子的空间排列和立体构型的信息。
具体步骤如下:(1)生长手性晶体。
在晶体生长过程中,手性分子会形成手性晶体,而非手性分子不会。
(2)通过X射线衍射确定晶体结构。
X射线通过晶体时会产生衍射,通过分析衍射图样可以确定晶体的三维结构。
(3)通过晶体结构确定分子手性。
在分析晶体结构的过程中,可以观察到分子的手性特征,从而确定分子的手性性质。
总结起来,对称性分析法是一种简单而常用的方法,而手性圆二色谱法和X射线晶体学分析法则是用来对手性分子进行更准确的判断和确认的方法。
这些方法在判断分子手性性质和研究手性分子在化学和生物学中的作用方面具有重要的意义。
化学课:简单介绍手性分子

人们在研究对映异构体时,由左旋和右旋两种对映 异构体的分子中,原子在空间的排列是不重合的实 物和镜象关系,这与左手和右手互为不能重合的实 物和镜象关系类似,从而引入了手性及手性分子的 概念。所谓手性,是指物体和它的镜象不能重合的 特征。所谓手性分子,顾名思义为具有手性的分子。 即构型与其镜象不能重合的分子。手性分子都存在 对映异构现象,一对对映异构体在性质上的表现为:
在手性条件下具有手性。
识别手性分子的方法
手性识别与分离的技术发展迅速,其中色谱法、传感器法和光谱法等具有适用性好、应用范围广、灵敏 度高、检测速度快等优点,在分离识别和纯化手性化合物中受到研究者的极大关注。 色谱法 色谱法可满足各种条件下对映体拆分和测定的要求,能够快速对手性样品进行定性、定量分析和制备拆 分。目前,高效液相色谱、气相色谱、超临界流体色谱、模拟移动床色谱和毛细管电泳等在手性研究中 得 到 了 广 泛 应 用。其 中,高 效 液 相 色 谱 法(HPLC) 进行手性药物对映体的光学拆分已成为药学研 究中的一大热点,开发一些新型、具有不对称中心的手性固定相成为发展手性色谱技术的前沿领域之一。 在手性固定相材料中,手性选择剂和手性分子间形成非对映异构体络合物,但由于不同对映体分子间存 在空间结构的差异,直接影响两者的结合和络合物的稳定性。根据这些差异有望实现对手性底物的拆分。 以环糊精衍生物、多糖衍生物和蛋白质等为手性选择剂的手性固定相材料备受研究者的关注,它们对许 多手性药物对映体表现出良好的分离性能,已有许多填充手性固定相的色谱柱实现商品化,广泛应用在 制药工业、化学品和食品等行业中。 手性传感器识别法 手性传感器识别法具有简单快捷、高效灵敏和选择性高的特点。电化学传感器主要通过主体选择性键合 客体分子引起传感器的电信号变化而实现手性识别;荧光传感器基于对映体分子和手性选择剂形成缔合 物的荧光差异来实现识别。在压电传感器中,手性选择膜镀在石英晶体上,当手性分子与手性膜发生作 用时,会引起石英晶体的质量和振动频率改变,故称为石英晶体微天平(Quartz CrystalMicrobalance, QCM)QCM技术始于20世纪60年代初期,因具有灵敏度高、检测限低( 达到纳克级)、快速、容易实现在 线分析检测的特点,在手性化合物的识别和检测方面得到很好的应用。 光谱法 采用紫外-可见光谱、荧光光谱、红外光谱和圆二色光谱法等考察手性选择剂和手性底物的混合溶液在 光谱上的细微变化,辅助以化学计量学分析或其它光谱联用也可用于手性识别研究。Fra bibliotek谢谢观看
手性分子简介

专题5.手性分子Chiral Molecules 一、概念准备 1.手性chirality :手性一词指一个物体不能与其镜像相重合,如我们的双手,左手与互成镜像的 右手不重合;手性一词在化学医药领域运用更加普遍,一个手性分子与其镜像不重合,分子的 手性通常是由不对称碳引起,即一个碳上的四个基团互不相同;2.手性分子chiral molecules :手性分子是指与其镜像不相同不能互相重合的具有一定构型或构象 的分子;3.波wave :波是指振动的传播;包括横波transverse waves 和纵波longitudinal waves ;⎩⎨⎧波与波的传播方向一致的纵波:质点的振动方向波与波的传播方向垂直的横波:质点的振动方向波4.光light :光是一种电磁波,电磁波是横波;5.偏振光polarized light :只有横波才有偏振现象;普通光中各种波长的光在垂直于前进方向的各 个平面内振动,振动平面和光波前进方向构成的平面叫振动面;光的振动面只限于某一固定方 向的,叫做平面偏振光,简称偏振光,6.旋光性optical activity :当平面偏振光通过手性化合物溶液后,偏振面的方向就被旋转了一个角 度,这种能使偏振面旋转的性能称为旋光性,也称为光学活性;⎩⎨⎧旋转的物质平面偏振光振动面发生非旋光性物质:不能使转的物质面偏振光振动面发生旋旋光性物质:可以使平物质7.旋光度optical rotation :当平面偏振光通过盛有旋光性化合物的旋光管后,偏振面就会被旋转(向 右或向左)一个角度,这时偏振光就不能通行无阻的穿过与起偏镜棱轴相平行的检偏镜;只有检 偏镜也旋转(向右或向左)相同的角度,旋转了的平面偏振光才能完全通过;观察检偏镜上携带的 刻度盘所旋转的角度,即为该旋光性物质的旋光度;偏振面被旋光性物质所旋转的角度叫旋光 度,用α表示;⎩⎨⎧动平面向左旋转的物质左旋体:能使偏振光振动平面向右旋转的物质右旋体:能使偏振光振旋光性物质 8.比旋光度specific rotation①比旋光度一般用[α]表示,即单位浓度和单位长度下的旋光度,是旋光物质的特征物理常数; ②旋光性物质的旋光度和旋光方向可用旋光仪进行测定;③样品管的长度、溶剂的种类、溶液的浓度、温度及所用光的波长等因素对特定物质的旋光度 的数值都有影响;④为了使其旋光度成为特征物理常数,通常用1dm 长的旋光管,待测物质的浓度为1g/mL ,用 波长为589nm 的钠光(D 线)条件下,所测得的旋光度,称为比旋光度;⑤比旋光度计算公式:[]cl t D ⋅=αα t ---测定时的温度(℃); D ---钠光D-线波长589nm ;α---实验观察的旋光值(°); l ---旋光管的长度(dm);c ---溶液浓度(g/mL);⑥若被测物质是纯液体,则按下式进行换算[]ραα⋅=l t D ,(ρ表示纯液体密度g/cm 3);二、手性分子chiral molecules1.起源①在偏振光发现之后,人们很快认识到某些物质能使偏振光的偏振面发生偏转,产生旋光现象;②1848年法国巴黎师范大学年轻的化学家Pasteur细心研究了酒石酸钠铵的晶体及水溶液的旋光现象,从而得出物质的旋光性与分子内部结构有关,提出了对映异构体的概念;人们在研究对映异构体时,由左旋和右旋两种对映异构体的分子中,原子在空间的排列是不重合的实物和镜象关系,这与左手和右手互为不能重合的实物和镜象关系类似,从而引入了手性及手性分子的概念;Louis Pasteur,1822--18952.手性分子的普遍性和重要性①自然界存在的糖以及核酸、淀粉、纤维素中的糖单元,都为D-构型;②地球上的一切生物大分子的基元材料α-氨基酸,都是左旋氨基酸(甘氨酸无旋光性);③蛋白质和DNA的螺旋构象是右旋的;④海螺的螺纹和缠绕植物也都是右旋的;⑤酶是由蛋白质与核酸组成的巨大的手性分子,是不对称催化剂,有强烈的选择性;⑥除了少数动物或昆虫的特定器官内含有少量的右旋氨基酸之外,组成地球生命体的几乎都是左旋氨基酸,而没有右旋氨基酸;⑦人是由左旋氨基酸组成的生命体,它不能很好地代谢右旋分子,所以食用含有右旋分子的药物就会成为负担,甚至造成对生命体的损害;⑧沙利度胺只有它的(R)-异构体有镇静作用,而它的(S)-异构体则是具有致畸作用;⑨芳香基丙酸类除草剂,只有(R)-异构体是有效的;⑩3.手性分子的性质①旋光性;②镜面对称;③右旋分子是人体生命的克星;。
手性分子与光学活性物质

手性分子与光学活性物质手性分子是一类具有非对称碳原子的有机分子,它们的镜像异构体无法通过旋转或平移重叠。
这种非对称性使得手性分子具有许多特殊的性质,其中最重要的就是光学活性。
光学活性物质是指能够旋转光的偏振面的物质,这种旋转现象被称为光学旋光。
本文将探讨手性分子与光学活性物质之间的关系以及其在科学研究和实际应用中的重要性。
手性分子的非对称性来源于其分子结构中的手性中心,也就是一个碳原子上连接着四个不同的基团。
这种非对称性使得手性分子的镜像异构体成为可能,而这两种异构体又被称为对映异构体。
对映异构体之间的关系就像我们的左右手一样,无法通过旋转或平移重叠。
这种非对称性不仅仅存在于有机分子中,还存在于生物体内的许多分子中,如葡萄糖、氨基酸等。
手性分子的非对称性使得它们具有许多特殊的性质,其中最重要的就是光学活性。
光学活性是指手性分子能够旋转光的偏振面的现象。
当线偏振光通过光学活性物质时,光的振动方向会发生旋转,这种旋转的方向和角度与物质的结构有关。
对映异构体之间的旋光方向相反,而旋光角度则由分子结构和物质浓度等因素决定。
这种旋光现象可以通过光学旋光仪来测量,从而确定手性分子的结构和浓度。
手性分子和光学活性物质在科学研究和实际应用中具有广泛的应用价值。
首先,它们在有机合成领域中扮演着重要的角色。
手性分子的合成和分离是有机合成的重要课题之一,因为许多药物和农药的活性是由其手性决定的。
通过控制手性分子的合成和分离,可以得到具有特定活性和选择性的化合物。
此外,手性分子还广泛应用于手性催化反应中,通过催化剂的选择性作用,可以实现对手性化合物的高效合成。
其次,手性分子和光学活性物质在医药领域中也具有重要的应用。
许多药物都是手性分子,而它们的对映异构体往往具有不同的药理活性和毒性。
因此,对手性药物的研究和开发需要考虑到其对映异构体的区别。
此外,光学活性物质还被广泛应用于药物的分析和质量控制中,通过测量旋光角度可以确定药物的纯度和含量。
有机化学中的手性分子与对映体

有机化学中的手性分子与对映体在有机化学领域中,手性分子与对映体是一个重要而复杂的话题。
手性分子是指分子具有非对称碳原子或其他手性中心,无法与其镜像重合的分子。
手性分子的对映体则是指由同一分子组成的两个镜像异构体,它们在空间结构上完全相同,但无法通过旋转或平移使其重合。
手性分子与对映体不仅在化学性质和生物活性上存在差异,而且在科学研究和工业应用中也有着广泛的应用。
手性分子与对映体的概念最早由法国化学家Pasteur在19世纪提出。
他通过研究成脱水酒石酸晶体的性质,发现晶体存在两种不同的结构,它们的镜像关系无法重合。
这一发现揭示了手性分子和对映体的存在,并为后来的研究奠定了基础。
手性分子和对映体之间的差异可以从多个方面来理解。
首先,手性分子的旋光性质是一个重要的特征。
手性分子由于对于平面偏振光的旋光方向特异性,可以分为两种光学异构体,即左旋体和右旋体。
左旋体的旋光方向为逆时针方向,表示为(-),右旋体的旋光方向为顺时针方向,表示为(+)。
这种旋光性质可以通过光电旋光仪来测定和研究,对于鉴别和分离手性分子起到了重要的作用。
其次,手性分子和对映体在化学性质和生物活性上也有显著的差异。
由于手性分子的空间结构不对称,它们在化学反应中的反应性和立体选择性也会有所不同。
例如,药物分子通常是手性的,而其对映体可能具有完全不同的药理学效果和毒性。
这就需要在合成和应用中对手性分子进行选择和分离,以确保药物的有效性和安全性。
此外,手性分子和对映体还在药物合成、光学材料、农药和香料合成等领域具有广泛的应用。
手性药物合成是医药化学领域的重要研究方向,对于提高药物的选择性和活性至关重要。
光学材料中,手性分子常被用于制备具有特殊性质和相位的光学材料,如液晶显示屏和激光器。
农药和香料的合成中也会使用手性分子,以获得特殊的味道和效果。
在手性分子和对映体的研究中,分离和鉴别是一个关键的步骤。
目前常用的方法包括手性色谱、核磁共振和质谱等技术。
手性分子的概念

手性分子的概念随着科学技术的迅速发展,人类对物质世界的认识不断深入和拓展,已经发现许多物质分子是具有一种特定的不对称结构的,也就是所谓的手性分子。
这类分子在自然界中占据了重要地位,它们在生命现象和生物过程中发挥着重要作用。
在本文中,我们将重点介绍手性分子的基本概念,研究这类分子的特性和重要性,以及如何分离出手性分子。
一、什么是手性分子手性分子,也称为不对称分子,是指分子的结构不对称的分子,即具有左旋结构和右旋结构的分子,它们可以区分为左旋结构和右旋结构。
手性分子可以是固体和液体,甚至可以是气体,只要其分子结构具有不对称特征,都属于手性分子。
手性分子可以是有机分子,也可以是无机分子,也可以是金属分子。
二、特征及重要性由于手性分子具有不对称结构,因此它们具有独特性质,这些性质不仅有助于科学家研究有关物质的特性,而且也为实际应用提供了可能。
手性分子的特性可概括为:由于手性分子具有不对称结构,它们具有特异的极性特征,并可表现出特定的光谱特征;手性分子具有强烈的光吸收特性,可用于制备光学元件;此外,手性分子也具有生物活性,可用于制备药物等。
手性分子在自然界中占据着重要地位,它们在生活中起着重要的作用。
它们可以用于制备药物、染料、农药、杀虫剂、生物试剂等;它们可用于制备光学元件,如激光器和滤光片;此外,它们还可以用于研究生物体的特性,如蛋白质、RNA、DNA等的结构和功能。
三、如何分离出手性分子要分离出手性分子,可以采用一种称为“静电分离”的方法。
其基本原理是将样品与阴阳极结合,将阴极上的离子排放到阳极上,使带有不同电荷的离子产生偏特性,从而实现离子分离。
该方法采用了精细的分离装置,能够准确分离出带有不同电荷的离子,而不影响其它离子。
此外,还可以使用晶体场效应(CFE)方法分离手性分子。
其基本原理是将样品与晶体阵列相结合,使其中的离子在晶体中沿着有亲有异的力线分布,从而实现离子的分离。
该方法可以准确分离出带有不同电荷的离子,而且具有高精度和稳定性,可以用于分离复杂的样品。
手性分子优秀课件
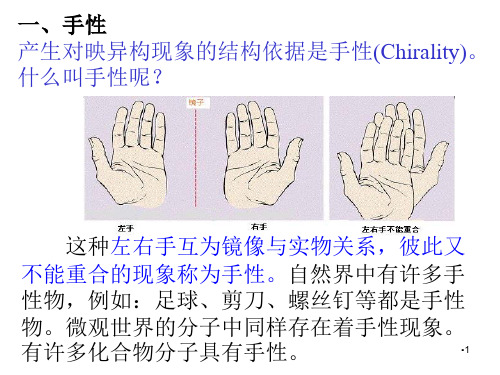
这种左右手互为镜像与实物关系,彼此又
不能重合的现象称为手性。自然界中有许多手
性物,例如:足球、剪刀、螺丝钉等都是手性
物。微观世界的分子中同样存在着手性现象。
有许多化合物分子具有手•. 性。
•1
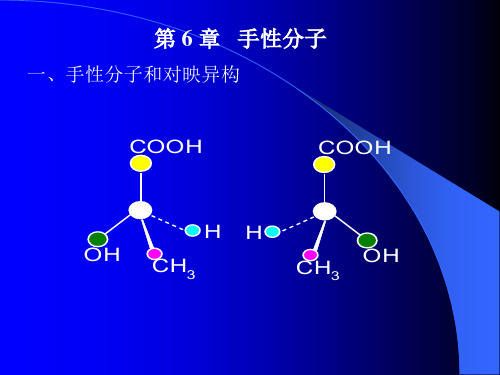
二、手性分子和对映体
如图是一 对互为镜 像关系的 乳酸分子 的立体结 构式(透 视式):
•.
•2
a和b 两个立体结构式之间有何种关系?它们代表 相同的分子?还是代表不同的分子?不妨观察上 述乳酸分子的两个立体结构式的球棍模型图示
图3-3-1乳酸球棍模型
图3-3-2乳酸球棍模型
•.
•3
小结:手性分子:不能与其镜像重合的分子。 对映体:彼此成镜像关系,又不能重合
的一对立体异构体互为对映体。 手性碳原子:连有四个不同原子或基团
•.
•5
的碳原子。
三、对称面和非手性分子
•.ቤተ መጻሕፍቲ ባይዱ
•4
四、判断对映体(手性分子)的方法
第一 建造一个分子和它的镜像的模型。如果两 者不能重合,就是手性分子。
第二 寻找有无对称面、或对称中心。有对称面 或对称中心它就不存在对映体,为非手性分子。
第三 寻找手性碳原子(或手性中心)。只要有一个 手性碳原子,就是手性分子,有一对对映体 (两个以上C﹡有例外。见内消旋体)
手性分子的判断方法

手性分子的判断方法判断一个化合物是否具有手性,一种直观可靠的方法是做出一对实物和镜象的模型,若二者不能完全重叠,它们代表的分子就是手性分子;能重叠,则它们所代表的分子是非手性分子。
但是要判断一个化合物是否具有手性,并非一定要用模型来考察它与镜像能否叠合起来。
一个分子是否能与其镜像叠合,与分子的对称性有关,只要考虑分子的对称性就能判断它是否具有手性。
在一个分子中,若存在对称因素,这样的分子往往能与自己的镜像相重叠,因此就不是手性分子;若不存在对称因素,则是手性分子。
对称因素包括对称面、对称中心及对称轴等。
下面简单介绍一下对称面和对称中心。
1、对称面。
对于大多数有机化合物来说,尤其是链状化合物,一般只需考察分子中是否具有对称面,就可以推断出该分子是否为手性分子。
假设有一个平面能将分子切成两半,而这两半彼此又互为实物和镜像关系,那么这个平面就是这个分子的对称面。
这种具有对称面的分子就不是手性分子,没有旋光性。
如2-氯丙烷分子中有对称面,是非手性分子;而2-氯丁烷中没有对称面,是手性分子。
如果分子中所有的原子都在同一平面上,那么这个平面就是分子的对称面。
如E-1,2-二氯乙烯这种分子不是手性分子,没有旋光性。
2、对称中心。
假设分子内有一个中心点,通过中心点作任意一直线,在直线上距中心点等距离的异向两端,有相同的原子或基团,该中心点称为分子的对称中心。
具有对称中心的分子必定能和其对映体重叠,不是手性分子,没有旋光性。
化合物(Ⅰ)有一个对称中心,能与它的镜像重叠,所以是非手性分子,不存在对映体。
事实上,若在(Ⅰ)的环平面下放一面镜子,则得到(Ⅰ)的镜像(Ⅱ),但如果以通过(Ⅰ)的对称中心垂直于环平面的直线为轴旋转180°,得到的构型(Ⅲ)正好是它的镜像。
由此可见,有对称中心的分子能与其镜像相重叠,即无手性。
总的来说,判断一个分子有无手性,主要看它与其镜像能否重叠,不能重叠则是手性分子。
如果一个分子具有对称面或对称中心,则这个分子无手性;反之,这个分子有手性,即有旋光性。
高中化学手性分子归纳总结

高中化学手性分子归纳总结手性分子是化学中一个非常重要的概念,它具有对称性,镜像对称的分子不是同一个分子。
这篇文章将对高中化学中的手性分子进行归纳总结。
一、手性分子的定义与特点手性分子是指具有非超可重叠镜像关系的分子,也就是说,镜像对称的分子不是同一个分子。
手性分子具有以下特点:1. 非对称性:手性分子在空间上没有内部平面、中心对称或轴对称元素,导致其不具有对称性。
2. 光学活性:手性分子可以使线偏振光发生旋光现象,称为光学活性。
它可以将线偏振光分为左旋光和右旋光,分别记作(−)和(+)。
3. 可旋光性:手性分子的旋光度与物质的浓度、温度、溶剂等因素有关。
其旋光度可以通过旋光仪进行测量。
二、手性分子的分类手性分子可分为两类:单一手性分子和混合手性分子。
1. 单一手性分子:单一手性分子指的是只存在一种手性的分子。
例如,氨基酸和糖类分子都是单一手性分子。
其中,氨基酸具有左旋和右旋两种手性,而糖类分子具有多种手性。
2. 混合手性分子:混合手性分子指的是同时存在多种手性的分子。
例如,含有两种以上手性中心的有机化合物就是混合手性分子。
三、手性分子的表达式与命名化学中通常使用化学式、结构式或三维投影式来表达手性分子。
1. 化学式:手性分子的化学式可以使用分子式进行表示,例如,D-葡萄糖的化学式为C6H12O6。
2. 结构式:手性分子的结构式可以通过二维平面结构来表示手性中心和它们之间的连接关系。
3. 三维投影式:手性分子的三维结构可以使用立体投影式表示,常见的有锥式投影、新兰投影和沙夫投影等。
手性分子的命名则依据其结构进行。
常见的手性分子命名规则有R/S命名法、D/L命名法和E/Z命名法。
四、手性分子的应用手性分子在化学、药学、生物学等领域中具有重要的应用价值。
1. 药学应用:许多药物中的活性成分是手性分子,因为手性分子对生物体的相互作用具有明显的差异,例如,左旋多巴是帕金森病的常用药物。
2. 合成化学:手性分子的合成对于有机合成非常重要。
第六章 手性分子
2、构型的表示方法 1)球棒模型
COOH
H OH CH3
COOH C OH
2)透视式(或伞形式)
H
透视式
CH3
“楔前虚后实平面”
3)菲舍尔(Fischer)投影式
COOH HO CH3 H
投影规则: ①手性碳放在纸面上, ②伸向纸面前方的键放在横键上,伸向纸面后方的 键放在竖键上(横前竖后); ③主链竖着写,命名时编号小的碳在最上方。
含有两个相同手性碳原子的化合物
2,3-二羟基丁二酸(酒石酸):
COOH H HO OH H COOH HO H COOH H OH COOH
* HOOCCH OH
COOH H H OH OH COOH
* CHCOOH OH
COOH HO HO H H COOH
(2R,3R)
(2S,3S)
(2R,3S)
注:
1)不能任意调换两基团的位置,对调偶数次构型 不变,对调奇数次则为原构型的对映体;
2)将投影式在纸面内平移或转动180°时,分子 构型保持不变; 3)离开纸面翻转180°或在纸面内旋转90°的奇 数倍,构型反转。
3、构型的标记
1)D-L标记法——相对构型标记
CHO H OH CH2OH HO CHO H CH2OH
尼克尔 棱 镜
普通光线
平面偏振光
2)旋光性
介质
能使偏振光发生偏转的性质,称为旋光性;具有这 种性质的物质,称为旋光性物质(光活性物质); 反之 为非光活性物质。 使偏振光振动方向旋转的角度称为旋光度,用α表示。 使偏振光振动方向向左旋称为左旋体,用“-”表示; 向右旋的称为右旋体,用 “+”表示。
HOOC
COOH
手性分子的性质

什么是手性分子英文名:chiral molecules我们知道,生命是由碳元素组成的,碳原子在形成有机分子的时候,4个原子或基团可以通过4根共价键形成三维的空间结构。
由于相连的原子或基团不同,它会形成两种分子结构。
这两种分子拥有完全一样的物理、化学性质。
比如它们的沸点一样,溶解度和光谱也一样。
但是从分子的组成形状来看,它们依然是两种分子。
这种情形像是镜子里和镜子外的物体那样,看上去互为对应。
由于是三维结构,它们不管怎样旋转都不会重合,就像我们的左手和右手那样,所以又叫手性分子。
对于非碳原子手性中心的分子,只要没有对称面和对称中心即为手性分子。
手性分子的基本标志一个化合物的分子与其镜像不能互相叠合,则必然存在一个与镜像相应的化合物,这两个化合物之间的关系,相当于左手和右手的关系,即互相对映。
这种互相对应的两个化合物成为对映异构体(enantiomers)。
这类化合物分子成为手性分子(chiral molecule)。
不具有对称面和对称中心的分子有一个重要的特点,就是实体和镜象不能重叠,镜面不对称性是识别手性分子与非手性分子的基本标志。
生物分子手性原则是什么生物分子都有手性,即分子形式的右撇子和左撇子(或左旋、右旋)。
在法国生物学家巴斯德发现酒石酸晶体的镜像后就更激起了科学家的兴趣。
然而,手性分子是如何形成的却一直让人迷惑不解。
过去,生物化学领域趋向于认为,单一手性形式的分子合成通常从一开始就要利用手性本体,也就是说生物分子自身在催化着手性形式的形成。
而且在一些化学反应中手性产物的形成进一步扩大了。
2006年6月16日出版的英国《自然》刊发文章称,最近,美国研究人员发现,物质的固(体)-液(体)相平衡可能参与了生物分子手性的形成。
比如,氨基酸固(体)-液(体)相的平衡,可以由刚开始时的小小的不平衡导致严重偏向一种手性形式,即左旋或右旋。
而这种现象出现在水溶液中,因而也可以解释生命起源以前的左手性和右手性,即为何左右手性数量相当的分子为何会转变成生物分子偏爱一种手性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(–)–2–溴丁烷
图6.11Fischer 投影式旋转90°的分子模型
• 将投影式在纸面上旋转180°,得到相同的 CH3 2CH3 分子: H Br Br CHH
CH2CH3 CH3
图6.12 Fischer 投影式旋转180°的分子模型
6.4.3 构型的标记法p150 (1) D,L–标记法
长瓣兜兰 花两侧长瓣的螺旋是左右对称的,右侧是左旋, 左侧是右旋。 ——《科学》2002,Vol.54, No.55
手性药物
O O N H O N O
(S)-thalidomide(致畸)
O N O O N H O
(R)-thalidomide(有效成分)
反应停:五十年恩怨
1–氟–1–氯甲烷为非手性分子
镜面
图6.3 2–丁醇的对映异构体
图6.4 2–丁醇对映异构体的比例模型
6.3.2 对称因素 与手性判断p140 (1) 对称面 (σ) 有两种对称面:(a)一个平面把分子分成 两部分,而一部分恰好是另一部分的镜像。 例如:2–氯丙烷
图6.5 分子中的对称面的示意图 (I)
(b) 组成分子的所有原子都在一个平面上 例如: (E)–1,2–二氯乙烯
图 6.2 1–氟–1–氯甲烷分子模型示意图
CH3 H C OH CH2CH3
H3CH2C
CH3 C H OH
对映体 对映体的特点: • 具有相同的分子构造 • 两者的关系为:实物与镜像 • 不能相互重叠 • 物理性质相同,化学性质相似 手性分子一定有其对映体 对映体也称旋光异构体
2–丁醇:
H H3C C CH2CH3 OH H C H3CH2C HO CH3
CH3CH2 C* Br H CH3
COOH H C CH3 HO
*
2–溴丁烷
CH3 D H C* Cl Cl
(–)–乳酸
CH3 D H
H
61 2 5* 3 4
C
CH3
CH2
CH 3
*C
H * H2C C O CH3
柠檬油精
1,2–环氧丙烷
含一个手性中心的分子具有一对对映体
使偏振光反时针旋转的对映体——左旋体(–), 使偏振光顺时针旋转的对映体——右旋体(+)。 等量的对映体的混合物——外消旋体(±)
CHO H OH CH2OH
D–(+)–甘油醛
CHO H OH CH2OH
L–(–)–甘油醛
COOH H OH CH3
CHO H HO CH2OH
D–(+)–甘油醛
D–(–)–乳酸
COOH OH H H HO COOH
Bijroet J.M. 1951 X射线衍射
L–(+)–酒石酸
(2) R,S–标记法 • 将手性碳原子的4个原子或基团按 “次序规则”排列次序
(±)–乳酸: mp : 18℃
葡萄糖发酵得到
从肌肉中 得到
1–氘氯乙烷:
图 6.10 1–氘氯乙烷对映体的示意图
H CH3 C D Cl
D
H C Cl CH3
6.4.2 构型的表示法p149 (1) 透视式 化合物分子在纸面上的立体表达式。 H H
HO CH3 C COOH HOOC C OH CH3
H HO C COOH CH3
H C OH HOOC CH3
H CH3 C
O CH2 H 2C
O C H CH3
(+)-Lactic acid
(+)–乳酸
(-)-Lactic acid
(-)–乳酸
1,2–环氧丙烷
6.4 具有一个手性中心的对映异构p145 6.4.1 对映体和外消旋体的性质
手性中心(C*):不对称中心 与四个不同原子或基团相连的碳原子
COOH OH H C CH3
HO
COOH CH3
(R)–2–丁醇
(R)–(–)–乳酸
(R)–甘油醛
(S)–甘油醛
6.5 具有两个手性中心的对映异构 6.5.1 具有两个不同手性碳原子的对映异构
COOH COOH COOH COOH H * OH HO * H H * OH HO * H H * Cl Cl * H H * Cl Cl * H COOH COOH COOH COOH
COOH COOH H * OH HO * H H * OH H * OH COOH COOH (2S,3S) (2R,3S)
* H HO (I) HO * H (III) COOH
COOH 非对映体
(II)
(I)
H Br
内消旋体 内消旋体为 (对映异构体) (meso form) 非手性分子 (II) (III)
两个分子为实物和镜像的关系:彼此不能重合, 如同人的左、右手一样。
图 6.1 2–溴丁烷分子模型示意图
手性分子(chiral molecules): 不能与自身镜像重合的分子。 非手性分子(achiral molecules) : 能够与自身镜像重合的分子。
手性分子是不对称分子;非手性分子是对称 分子。 手性分子具有两种构型。 手(征)性(chirality) : 分子与它的镜像不能重合的 性质 对映异构体(enantiomers): 具有相同的分子构造,构型不同的两个分 子,互为镜像,不能重合。
②物质的旋光度,需要通过改变浓度或者改变盛 液管长度的方式测定两次,才能确定。
(–)–2–丁醇
CH3 HO H CH2CH3
(+)–2–丁醇
CH3 OH H CH2CH3
[α]D = +13.25°
[α]D = –13.25°
自动旋光仪
圆盘旋光仪
6.3 旋光性与对映异构
Br H C CH3 CH2CH3 CH3 Br C H CH2CH3
手性分子
(立体化学)
6.1 异构体的分类
构造异构 (constitutional isomerization)
碳架异构
位置异构
官能团异构 互变异构 顺反异构
异构现象 (isomerization)
分子式同,原子 连接顺序不同
立体异构 (stereoisomerization 构象异构 原子连接顺序同,原子或 基团在空间的排布不同。
反式
Cl Cl R Cl S R
Cl
Cl R Br
S R
S R
Br
四、六员环
Cl Cl
Cl Cl Cl Cl
有对称面无对映体
有对映体
环化合物除三员环外,其它环的碳原子并不在 同一个平面之上,我们把它们都视作平面环
来处理,是否合理呢?我们以1,2—二氯环己
烷为例,从构象的角度来进行分析:
思考题:
这是手性分子吗?为什么? H 它的反式异构体是怎样的?分子 Br 中的手性中心的构型是什么?
图 6.13内消旋体的分子模型(I)
图6.14 内消旋体的分子模型(II)
6.6 环状化合物的立体异构
写单环化合物的立体异构体时,可将环看 作平面来对待,思路: 先顺反→后判断→再照镜.
一、三元环
CH3CH2 CH3
H C OH
(+)–乳酸
(–)–乳酸
(+)–2–丁醇
(2) Fischer投影式 平面形式 具有手性碳原子的分子 立体模型 表示 规则: • 用 • 将最长的碳链置于垂直的位置上
• 将编号最小的碳原子置于顶端 • 两线的交点为手性碳原子 • 竖线两端上的基团在纸面的下方; 横线两端上的基团在纸面的上方
Cl
Cl
Cl
Br
Cl
Cl
Cl
Br
无论顺反,分子中都有对称面,都无对映异 构体。
三、五员环
顺式
1、1,2-二取代物
反式
Cl R Cl R Cl S S Cl
Cl S
Cl R
Br S
Cl R S
Cl
Br
R R Br
Cl R
Cl S S Br
2、1,3—二取代物
顺式
Cl R Cl S
S Cl
Br R Cl Cl Br S S
CH3 CH3NH 2 H HO 1 H Ph
CH3 CH3 H NHCH3 CH3NH H OH H OH H Ph Ph
(1S,2R) (1R,2S) (1R,2R) (1S,2S) (I) (II) (III) (IV) mp: 34℃ 118 ℃ [α]D:+35° –35 ° –26.5 ° +26.5 ° 麻黄碱(1–苯基–2–甲氨基–1–丙醇)
例如:2–丁醇的两个对映体 (–)–2–丁醇, (+)–2–丁醇
外消旋体(racemate) :(±)–2–丁醇
图 6.8 2–丁醇对映体的示意图
乳酸:
图 6.9 乳酸对映体的示意图
(+)–乳酸 (–)–乳酸 15 15 [α]D = –3.82 ° [α]D = + 3.82 ° mp : 26℃
(2S,3S) (2R,3R) (2S,3R) (2R,3S) (I) (II) (III) (IV) 氯代苹果酸 (2–羟基–3–氯丁二酸)
含有n个手性碳原子的分子,应有2n个立体 异构体 非对映异构体 立体异构体的相互关系: (diastereomers:) (II) (I) 对映体: (III) (IV) (III) (II) (I) 不是实物与镜像关系的 (IV) 立体异构体 ——非对映异构体。
图6.6 分子中的对称面的示意图 (II)
(2) 对称中心(i) 任何的直线通过分子的中心,在距中心 等距离处遇到相同的原子。例如: 反–1,3–二氟–反–2,4–二氯环丁烷
图6.7 分子中的对称中心的示意图
