(一)根据分子式的计算
分子的摩尔质量和分子量

分子的摩尔质量和分子量一、基本概念1.分子:由两个或两个以上原子通过化学键连接在一起构成的粒子。
2.摩尔质量:物质的量的单位,符号为mol,定义为包含与12g碳-12同位素中含有的原子数目相同数量的基本实体(如原子、分子、离子等)的物质的量。
3.分子量:分子中所有原子质量的总和,以“Dalton”(D)为单位,也常用“g/mol”表示。
二、关系与计算1.关系:摩尔质量与分子量在数值上相等,但单位不同,摩尔质量的单位为“g/mol”,而分子量的单位为“Dalton”(D)。
2.计算公式:–分子量 = 各原子质量的总和–摩尔质量 = 分子量(以g/mol为单位)3.化学反应的计算:根据化学方程式,通过物质的摩尔质量计算反应物和生成物的物质的量。
4.物质的纯度分析:通过测定物质的摩尔质量和分子量,可以判断物质的纯度。
5.生物大分子的研究:如蛋白质、核酸等生物大分子的分子量测定,对了解其结构和功能具有重要意义。
四、注意事项1.摩尔质量和分子量是两个不同的概念,但在实际应用中,人们常常将它们等同对待。
2.在计算摩尔质量时,应注意原子的相对原子质量,且质量单位一般为克。
3.分子量的大小与分子的稳定性和生物活性有关,但不是绝对的。
分子的摩尔质量和分子量是化学中的基本概念,了解它们的定义、关系和应用,有助于我们更好地理解化学反应和生物大分子的性质。
在学习过程中,应注意区分这两个概念,并掌握相关的计算方法。
习题及方法:1.计算一个分子中含有5个碳原子和8个氢原子的分子量。
解题方法:根据分子量计算公式,分子量 = 各原子质量的总和,可得:分子量 = 5 × 12.01(碳原子质量)+ 8 × 1.01(氢原子质量)= 60.05 + 8.08 = 68.13。
答案:68.13。
2.计算10g CO2的物质的量(以mol为单位)。
解题方法:根据摩尔质量计算公式,物质的量n = 质量m / 摩尔质量M,可得:摩尔质量M(CO2) = 12.01(碳原子质量)+ 2 × 16.00(氧原子质量)= 44.01g/mol。
化学式量的计算

根据分子式的计算(一)一:填空题1、NH 4NO 3 的式量是( 80 );其中氮元素的质量分数是( 35% );氢元素的质量分数是( 5% );氧元素的质量分数是( 60% )。
2.在NaNO 3中N 的化合价是( +5 )价;在NH 4Cl 中N 的化合价是( -3 )价。
3.X 、Y 、Z 三种元素组成的化合物里,Y 为+2价,Z 为+5价,X 为-2价。
X 、Z 两元素在化合物里组成的原子团为-3价,且有5个原子。
此化合物的化学式为(Y 3(ZX 4)2)。
4.某化合物的化学式为H n RO 2n ,则R 的化合价为( 3n );若R 的化合价为奇数,则R 的氧化物的化学式为( R 2O 3 );若R 的相对原子质量为A ,则化合物HnRO2n 的相对分子质量为( A+33n )。
二:选择题1、A 、B 两种元素的相对原子质量之比为7:2,在它们形成的一种化合物中,A 、B 两种元素的质量比为21:8,则该化合物的化学式可表示为( A )A 、A 3B 4 B 、A 2B 3C 、A 3B 2D 、AB2、由X 、Y 两种元素组成的两种化合物甲与乙,甲的化学式是XY 2,其中X 的质量分数为44%,若化合物乙中X 的质量分数为34.4%,则乙的化学式为 ( B )。
A 、 X 3YB 、 XY 3C 、 X 2YD 、 XY3、某含氮的氧化物里,氮元素和氧元素的质量比7:20,则氮的氧化物的化学式为( C )。
A 、 N 2OB 、 N 2O 5C 、 N 2O 5D 、 NO4.下列化学式中正确的是( B )。
A 、ZnCl 3B 、Ca(NO 3)2C 、K 2OHD 、AlCl 25、一瓶二氧化硫和一瓶三氧化硫中,硫元素的质量比为5∶1,则这两瓶二氧化硫和三氧化硫气体的质量比为( B )。
A 、1∶1B 、4∶1C 、4∶5D 、2∶36、当二氧化硫与三氧化硫中氧元素的质量比为5:6时,则SO2与SO3的质量比为( )。
172-例题-由分子式计算配方
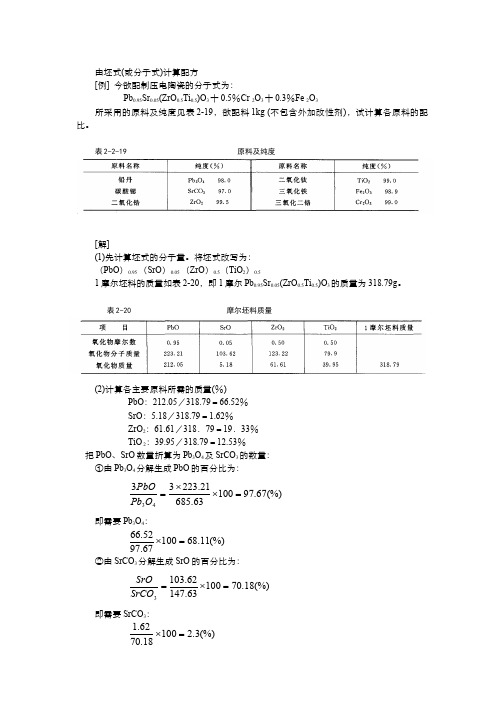
由坯式(或分子式)计算配方[例] 今欲配制压电陶瓷的分子式为:Pb 0.95Sr 0.05(ZrO 0.5Ti 0.5)O 3十0.5%Cr 2O 3十0.3%Fe 2O 3所采用的原料及纯度见表2-19,欲配料1kg (不包含外加改性剂),试计算各原料的配比。
表2-2-19 原料及纯度[解](1)先计算坯式的分子量。
将坯式改写为:(PbO )0.95 (SrO )0.05 (ZrO )0.5(TiO 2)0.51摩尔坯料的质量如表2-20,即1摩尔Pb 0.95Sr 0.05(ZrO 0.5Ti 0.5)O 3的质量为318.79g 。
表2-20 摩尔坯料质量(2)计算各主要原料所需的质量(%)PbO :212.05/318.79=66.52%SrO :5.18/318.79=1.62%ZrO 2:61.61/318.79=19.33%TiO 2:39.95/318.79=12.53%把PbO 、SrO 数量折算为Pb 3O 4及SrCO 3的数量:①由Pb 3O 4分解生成PbO 的百分比为: (%)67.9710063.68521.2233343=⨯⨯=O Pb PbO 即需要Pb 3O 4: (%)11.6810067.9752.66=⨯②由SrCO 3分解生成SrO 的百分比为: (%)18.7010063.14762.1033=⨯=SrCO SrO 即需要SrCO 3:(%)3.210018.7062.1=⨯③计算外加剂铅及改性剂的质量(%)在坯料烧结过程中氧化铅会挥发一部分,为弥补这个损失,配料时通常多加一些氧化铅,其质量约占总质量的0.5%~1.5%。
这里确定多加入Pb3O41.5%。
表2-2-21 按原料纯度计算的原料用量(%)外加改性剂的质量百分数在分子式中给出为:0.5%Cr2O3,0.3%Fe2O3。
④按原料纯度计算原料用量,见表2-21。
高中化学非常详细关于不饱和度

计算方法1)从有机物分子结构计算不饱和度的方法根据有机物分子结构计算,Ω=双键数+三键数×2+环数如苯:Ω=3+0×2+1=4 即苯可看成三个双键和一个环的结构形式。
补充理解说明:单键对不饱和度不产生影响,因此烷烃的不饱和度是0(所有原子均已饱和)。
一个双键(烯烃、亚胺、羰基化合物等)贡献1个不饱和度。
一个三键(炔烃、腈等)贡献2个不饱和度。
一个环(如环烷烃)贡献1个不饱和度。
环烯烃贡献2个不饱和度。
一个苯环贡献4个不饱和度。
一个碳氧双键贡献1个不饱和度。
一个-NO2贡献1个不饱和度。
例子:丙烯的不饱和度为1,乙炔的不饱和度为2,环己酮的不饱和度也为2。
2)从分子式计算不饱和度的方法第一种方法为通用公式:Ω=1+1/2∑Ni(Vi-2)其中,Vi 代表某元素的化合价,Ni代表该种元素原子的数目,∑代表总和。
这种方法适用于复杂的化合物。
第二种方法为只含碳、氢、氧、氮以及单价卤素的计算公式:Ω=C+1-(H-N)/2其中,C代表碳原子的数目,H代表氢和卤素原子的总数,N代表氮原子的数目,氧和其他二价原子对不饱和度计算没有贡献,故不需要考虑氧原子数。
这种方法只适用于含碳、氢、单价卤素、氮和氧的化合物。
第三种方法简化为只含有碳C和氢H或者氧的化合物的计算公式:Ω =(2C+2-H)/2其中C和H 分别是碳原子和氢原子的数目。
这种方法适用于只含碳和氢或者氧的化合物。
补充理解说明:(1)若有机物为含氧化合物,因为氧为二价,C=O与CH2“等效”,如CH2=CH2(乙烯)、CH3CHO(乙醛)、CH3COOH(乙酸)的不饱和度Ω为1。
(2)有机物分子中的卤素原子取代基,可视作氢原子计算不饱和度Ω。
Cl的Ω为1,其他基团如-NH2、-SO3H等都视为氢原子。
如:C2H3(3)碳的同素异形体,可将其视作氢原子数为0的烃。
如C60(足球烯,或者富勒烯,Buckminster fullerene) (4)烷烃和烷基的不饱和度Ω=0如CH4(甲烷)(5)有机物分子中含有N 、P 等三价原子时,每增加1个三价原子,则等效为减少1个氢原子。
有机物分子式确定的计算方法

有机物分子式确定的计算方法有机物分子式的确定,即是确定有机物分子里所含元素的种类及各原子的数目。
有机物分子式的确定是有机物学习中,最为重要的知识点之一。
关于确定有机物分子式的计算题目,也是有机物计算题目当中的重要考题之一。
那么,如何确定有机物的分子式呢?总体来讲,先得确定有机物的组成元素,然后再确定各原子的数目从而确定有机物的分子式。
下面笔者重点介绍一下在确定有机物分子式的计算当中的一些具体计算方法。
1、确定元素的组成一般来说,有机物完全燃烧后,各元素对应的产物为c→co2,h→h2o。
若有机物完全燃烧后的产物只有co2和h2o,则其组成的元素可能为c、h或c、h、o。
欲判断该有机物是否含有氧元素,首先应求出产物中co2中的碳元素质量及h2o中的氢元素的质量,然后将这两种元素的质量相加,再和原有机物的质量进行比较,若相等,则原有机物中不含氧元素,若不相等则原有机物中必定含有氧元素。
2、确定分子式在确定有机物的组成元素之后,接下来根据题目条件来最终确定这几种元素构成的物质的分子式。
在确定分子式进行计算的时候,通常可以采用以下几种计算方法。
方法一、实验式法(即最简式法)根据有机物的分子式为最简式的整数倍,利用其相对分子质量及求得的最简式便可确定其分子式。
如烃的最简式求法为:例1:某含c、h、o三元素的有机物,其c、h、o的质量比为6:1:8,该有机物蒸汽的密度是相同条件下的h2密度的30倍,求该有机物的分子式。
【解析】该有机物中的原子个数比为故其实验式为ch2o,设其分子式为(ch2o)n,根据题意得:。
则该有机物的分子式为c2h4o2。
方法二、单位物质的量法根据题目中的已知条件,确定有机物的元素组成后,直接求出1mol该有机物中各元素原子的物质的量,即可推算出分子式。
若给出一定条件下该有机物气体的密度(或相对密度)及各元素的质量分数,则求解分子式的基本途径为:密度(或相对密度)→m→1mol有机物气体中各元素原子的物质的量→分子式。
化学式与化合价的计算与理解

化学式与化合价的计算与理解化学是一门研究物质组成、结构、性质、变化的科学,其中化学式和化合价是化学中最基本的概念之一。
化学式反映了物质的元素组成和相对比例,而化合价则是元素在化合物中的相对电价。
正确计算和理解化学式与化合价对于理解物质的化学性质及其变化过程至关重要。
本文将介绍化学式与化合价的计算方法,并探讨其在化学研究与实践中的应用。
一、化学式的计算化学式是用化学符号和数字表示化合物的组成,包括分子式和实质式两种形式。
分子式一般用于表示分子化合物,实质式则用于表示离子化合物或复杂化合物。
1. 分子式的计算分子式反映了化学物质中各元素的种类和相对数量。
计算分子式时,首先需要根据实验数据或已知信息确定元素的原子数目,然后按照元素的符号和原子数目进行写出。
在写出分子式时,通常使用化学符号表示元素,而元素的相对原子数目则通过下标位置表示。
例如,将甲烷(CH4)的分子式计算出来。
根据实验数据,我们知道甲烷由1个碳原子和4个氢原子组成,因此可以写出分子式为CH4。
2. 实质式的计算实质式表示离子化合物或复杂化合物中各元素的相对比例。
对于离子化合物,实质式中的离子应当写在方括号内,并在右上角写出其电荷数目。
例如,氯化钠(NaCl)是由钠离子(Na+)和氯离子(Cl-)组成的。
因此,可以将其实质式写为[Na+][Cl-]。
二、化合价的计算与理解化合价是元素在化合物中的相对电价,一般用于描述离子化合物和共价化合物中元素的化学性质和反应类型。
1. 离子化合物中的化合价对于离子化合物,化合价是指元素在该化合物中所带的电荷数目。
在离子化合物中,金属元素通常以正离子形式存在,而非金属元素则以负离子形式存在。
化合价的计算可以通过交换法、电子亏损法或电子吸引力法进行。
以氯化钠(NaCl)为例,钠的化合价在该化合物中为+1,氯的化合价为-1。
这是因为钠是一价金属,倾向于失去一个电子,而氯是一价非金属,倾向于接受一个电子。
因此,化合价表示了在化合物中,钠和氯所带的电荷数目。
计算化合物分子式的五种方法

计算化合物分子式的五种方法
一、根据合成反应式计算
此方法是利用化学反应原理进行计算,通过分析复杂化合物能发生反应的原子数,依次将其单质、化合物分子式表示出来,最终得到化合物分子式,相对简单易懂。
二、根据恒量法计算
此方法是利用化学恒量原理进行计算,它要求两种或多种元素在组成某个化合物时,在固定的条件下,总共量比不变,以此为前提基础上,将多种元素以合理分子式表示出来。
三、根据离子式计算
此方法是甘取到物质的离子式,然后通过结合各个离子的化学构成,使其在结构上满足电荷平衡的条件,在理论上形成一个稳定的离子协同体,最终得到离子的化合物分子式。
四、根据分子式计算
此方法是由化合物分子结构出发,利用原子的组合能够形成的各种化合物分子结构,通过拓扑结构,可以得出某种化合物分子式表达式,进而计算出化合物分子式。
五、根据等价式计算
此方法要求根据物理或化学的途径将原子的等价式转换为化学反应式后,再根据化学反应式求出分子式,有时也需要加以判断或做出选择,最终得到该物质分子式。
中考化学计算题及详细答案

(一)根据化学式计算一、基础知识1.化学式:用元素符号来表示物质组成的式子.2.化学式(分子式)表示的含义:(1)表示该物质的一个分子.(2)表示构成一个分子的各种原子的原子个数.(3)表示一种物质及组成该物质的各种元素.3.常用的计算关系式(以化合物A m B n为例):(1)相对分子质量=A的相对原子质量×m+B的相对原子质量×n(2)A的质量分数(3)A、B元素的质量比(4)A元素的质量=化合物质量×A的质量分数(5)在混合物中,某物质的质量分数(纯度)(杂质不含该元素时)4.两种物质的质量比等于相对分子质量×分子个数之比.5.两种元素的原子个数比等于它们的质量比除以相对原子质量之比.一·例题解析例1、为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘盐。
碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。
1000g碘盐中约含0.02g碘。
(相对原子质量:K-39 I-127 O-16)(1)__________g碘酸钾中含有0.02g碘。
(保留小数点后3位)(2)成人每天约需1.5×10-4g碘,假设这些碘是从碘盐中摄取的,成人每天需要食用碘盐解析:碘盐中碘元素的质量=碘盐中碘酸钾的质量×碘酸钾中碘元素的质量分数(1)碘酸钾中碘元素的质量分数为:×100%=59.3%需碘酸钾的质量为:0.02g/59.3%=0.034g(2)需要食用碘盐的质量为:1.5×10-4g/x=0.02g/1000g x=7.5g答案:(1)0.034(2)7.5例2、研究表明,Al3+在人体内会阻止小肠壁对磷的吸收,使血液和其它组织内磷的含量减少,造成记忆力减退,免疫功能下降,被世界卫生组织确定为食品污染源之一。
营养学家指出每天铝的安全摄入量为每千克体重0.7mg。
请回答下列问题:(1)传统食品加工过程中,一般在1kg面粉中加入1g明矾(已知:明矾的化学式为KAl(SO4)2·12H2O,其相对分子质量是474;1g = 1000mg)。
化学式的推导与分子式的计算

化学式的推导与分子式的计算化学式是化学物质的组成公式,可以通过化学反应和分子间的结合规律进行推导。
而分子式是用化学元素符号表示的一个化合物的相对原子数。
化学式的推导主要包括两个方面:元素间原子数比例关系的确定和化学键的构成。
对于简单的离子化合物,原子比例是根据它们的电荷确定的。
例如,氯化钠的化学式为NaCl,其中钠离子(Na^+)和氯离子(Cl^-)以1:1的比例组成化合物。
对于共价化合物,化学键的构成是根据原子间共享电子对的形成确定的。
例如,甲烷的化学式为CH4,其中碳原子与四个氢原子共享形成四条共价键。
在化学式的推导过程中,需要根据化合物的性质和反应特点进行分析。
例如,根据氧化还原反应的特点,可以推导出一些常见的氧化物和酸化物的化学式。
硫酸的化学式为H2SO4,其中氢原子与硫原子形成两条共价键,氢原子与氧原子形成一条极性共价键,硫原子与四个氧原子形成四条极性共价键。
又如,硫化氢的化学式为H2S,其中氢原子与硫原子形成一条极性共价键。
通过对元素间原子数比例关系和化学键的推导,可以得到化学式的准确表示。
分子式的计算是根据化合物的分子量和元素的相对原子质量进行的。
相对原子质量是指一个元素原子质量相对于碳-12同位素质量的比值。
例如,氧的相对原子质量为16,氢的相对原子质量为1。
根据元素的相对原子质量和其在化合物中的相对原子数,可以计算出化合物的分子量。
分子量是一个化合物中所有原子质量的总和。
以乙酸为例,其分子式为CH3COOH。
乙酸由一个碳原子、两个氢原子、一个氧原子和一个羧基(COOH)组成。
通过查找各个元素的相对原子质量,可以计算乙酸的分子量。
碳的相对原子质量为12,氢的相对原子质量为1,氧的相对原子质量为16。
根据乙酸的分子式和相对原子质量,可以计算得到乙酸的分子量为60。
化学式的推导和分子式的计算是化学研究和实验中的重要内容。
准确推导和计算化学式对于深入理解化学反应和物质性质,以及解决实际问题具有重要意义。
有机物分子式求解方法

有机物分子式求解方法浙江省玉环县玉城中学刘瑞东发表于《中学化学教学参考》2000年第5期求有机物分子式的途径有很多,笔者根据多年的教学就有机物分子式的求解总结出八种通用的方法。
一、“单位物质的量”法根据有机物的摩尔质量(或分子量)和有机物中各元素的质量分数(或质量之比),推算出1mol该有机物中各元素原子的物质的量,从而确定分子中的各原子个数来确定有机物的分子式。
例1.某化合物由碳、氢两种元素组成,其中含碳的质量分数为85.7%,在标准状况下11.2L此化合物气体的质量为14g,求此化合物的分子式。
(高中化学必修本第二册P65。
)解:此烃的摩尔质量为:Mr=14g÷(11.2L÷22.4L/mol)=28gmol1mol此烃中碳原子和氢原子的物质的量分别为:C:(1mol×28g/mol×85.7%)÷12g/mol=2molH:(1mol×28g/mol×14.3%)÷1g/mol=4mol∴1mol烃中含2molC和4molH。
即此烃的分子式为C2H4。
二、最简式法根据有机物各元素的质量分数求出分子组成中各元素的原子个数之比(最简式),然后结合该有机物的摩尔质量(或分子量)求有机物分子式。
例1另解:由前面求得此烃的分子量为28,C和H的个数之比为:(85.7%÷1)∶(14.3%÷1)=1∶2∴此烃的最简式为CH2,分子式为(CH2)n。
则有:12n+2n=28,解得:n=2即此烃的分子式为C2H4。
三、燃烧通式法根据有机物完全燃烧反应的通式以及依据反应物和生成物的质量、物质的量或体积关系求分子式。
如烃的分子式可设为C x H y,由于x和y是相对独立的,计算中数据运算简便。
根据烃的燃烧反应方程式。
借助通式C x H y进行计算,解出x,y最后得出烃的分子式。
例2.0.1mol某烃完全燃烧后,生成13.2gCO2和7.2gH2O,求该烃的分子式。
化学基本计算

化学基本计算(一)关于化学式的计算:——基础计算关键:抓住化学的概念,理解化学式中各种符号、数字的函义,掌握的部分和整体的关系,此类计算就不难掌握了。
1、根据化学式的计算:相对分子质量(式量)等于化学中各原子的相对原子质量的总和。
注意——化学式前边的数字与相对分子质量之间是“相乘”的关系。
例1:求CuSO 4·5H 2O 的相对分子质量解:CuSO 4·5H 2O 的相对分子质量()=++⨯+⨯+=643216*********例2:求2Mg(OH)2相对分子质量总和解:2Mg(OH)2相对分子质量总和 ()[]=++=22421611162、计算化合物中各组成元素的质量比:注意——化合物的化学式中各元素原子的相对原子质量之和最简单的整数比;就是化合物中各组成元素的质量比。
例1:求CuSO 4中各组成元素的质量比。
解:CuSO 4中铜元素、硫元素、氧元素的质量比是:64∶32∶16×4 = 2∶1∶2例2:求Na 2CO 3中各组成元素的质量比。
解:Na 2CO 3中钠元素、碳元素、氧元素的质量比是:23×2∶12∶16×3 = 2∶6∶243、计算化合物某组成元素的质量分数:注意——化合物的化学式中,某元素原子的相对原子质量之和与该化合物相对分子质量之比,就是化合物中该元素的质量分数。
即化合物中某元素的质量分数:化合物中某元素的相对原子质量×原子个数化合物的相对分子质量⨯100%例1:计算硝酸铵中氮元素的质量分数。
解:NH 4NO 3的相对分子质量 = 14+1×4+14+16×3= 80硝酸钾中氮元素的质量分数:2N NH NO 100%14280100%35%43⨯=⨯⨯=例2:计算氯酸钾(KClO 3)中氧元素的质量分数。
解:KClO 3的相对分子质量= 39+35.5+16⨯3= 122.5氯酸钾中氯元素的质量分数: 3O KClO 100%163122.5100%39.2%3⨯=⨯⨯=(二)有关化学方程式的计算:关键:①正确写出反应的化学方程式。
傅立叶红外图谱详细分析方法大全

傅立叶红外光谱图详细解析一、分析红外谱图(1)首先依据谱图推出化合物碳架类型,根据分子式计算不饱和度。
公式:不饱和度=F+1+(T-O)/2其中:F:化合价为4价的原子个数(主要是C原子);T:化合价为3价的原子个数(主要是N原子);O:化合价为1价的原子个数(主要是H原子)。
F、T、O分别是英文4,3 1的首字母,这样记起来就不会忘了举个例子:例如苯(C6H6),不饱和度=6+1+(0-6)/2=4,3个双键加一个环,正好为4个不饱和度。
(2)分析3300~2800cm^-1区域C-H伸缩振动吸收,以3000 cm^-1为界,高于3000cm^-1为不饱和碳C-H伸缩振动吸收,有可能为烯、炔、芳香化合物吗,而低于3000cm^-1一般为饱和C-H伸缩振动吸收。
(3)若在稍高于3000cm^-1有吸收,则应在2250~1450cm^-1频区,分析不饱和碳碳键的伸缩振动吸收特征峰,其中:炔—2200~2100 cm^-1烯—1680~1640 cm^-1芳环—1600、1580、1500、1450 cm^-1若已确定为烯或芳香化合物,则应进一步解析指纹区,即1000~650cm^-1的频区,以确定取代基个数和位置(顺反,邻、间、对)。
(4)碳骨架类型确定后,再依据其他官能团,如C=O,O-H,C-N 等特征吸收来判定化合物的官能团。
(5)解析时应注意把描述各官能团的相关峰联系起来,以准确判定官能团的存在,如2820、2720和1750~1700cm^-1的三个峰,说明醛基的存在。
解析的过程基本就是这样吧,至于制样以及红外谱图软件的使用,一般的有机实验书上都有比较详细的介绍的。
二、记住常见常用的健值1.烷烃3000-2850 cm-1C-H伸缩振动1465-1340 cm-1C-H弯曲振动一般饱和烃C-H伸缩均在3000 cm-1以下,接近3000 cm-1的频率吸收。
2.烯烃3100~3010 cm-1烯烃C-H伸缩1675~1640 cm-1C=C伸缩烯烃C-H面外弯曲振动(1000~675cm^1)。
分子式的化学成分计算与表达

分子式的化学成分计算与表达化学是一门研究物质组成、性质和变化的科学。
在化学中,分子式是一种用来表示化合物中元素种类和数量的符号组合。
它是化学式的一种简化形式,通过分子式,我们可以了解到化合物中元素的种类和相对比例,进而推断出化合物的性质和反应规律。
本文将探讨分子式的化学成分计算与表达的相关内容。
一、分子式的基本概念与计算方法分子式由元素符号和下标构成,元素符号表示元素的化学符号,下标表示该元素在分子中的原子数目。
例如,H2O表示水分子,其中H表示氢元素,2表示氢原子的数量,O表示氧元素。
分子式的计算方法主要有以下几种。
1. 原子价数法:根据化合物的离子价数,确定分子式中各元素的原子数目。
例如,氯化钠的离子价数为+1和-1,因此其分子式为NaCl,表示钠离子和氯离子的比例为1:1。
2. 元素价数法:根据元素的原子价数,确定分子式中各元素的原子数目。
例如,硫酸的分子式为H2SO4,其中H的原子价数为+1,S的原子价数为+6,O的原子价数为-2,根据元素价数法计算可得H2SO4。
3. 元素质量法:根据元素的相对原子质量,确定分子式中各元素的原子数目。
例如,二氧化碳的分子式为CO2,根据元素质量法计算可得C和O的相对原子质量分别为12和16,因此C和O的比例为1:2。
二、分子式的化学成分表达分子式可以有效地表达化合物的化学成分。
通过分子式,我们可以了解到化合物中元素的种类和数量,从而推断出化合物的性质和反应规律。
下面以几种常见的化合物为例,探讨分子式的化学成分表达。
1. 酸类化合物:酸类化合物通常以H开头,例如盐酸的化学式为HCl,硫酸的化学式为H2SO4。
通过分子式,我们可以了解到酸类化合物中氢离子的数量,进而推断出其酸性强弱。
2. 碱类化合物:碱类化合物通常以OH结尾,例如氢氧化钠的化学式为NaOH,氢氧化铜的化学式为Cu(OH)2。
通过分子式,我们可以了解到碱类化合物中氢氧根离子的数量,进而推断出其碱性强弱。
化学式与分子式的表示与计算

化学式与分子式的表示与计算化学式和分子式是化学中用于表示化学物质组成的重要工具。
化学式用化学符号表示化学元素,描述了化学物质中元素的种类和相对数量。
分子式是化学物质的分子中原子的具体组成。
一、化学式的表示化学式是化学物质的组成用化学符号表示的方式。
它可以分为分子式、实际式和简化式三种形式。
1. 分子式分子式是化学物质中原子的种类和数量的表达式,通常用化学符号表示。
在分子式中,化学元素的符号通常以大写字母开头。
例如,水的分子式是H2O,表示每个水分子由两个氢原子和一个氧原子组成。
2. 实际式实际式是描述化学物质中元素比例的最简整数倍关系。
实际式不一定和分子式相同,但它们之间的比例关系必须保持一致。
例如,二氧化碳的实际式是CO2,表示每个二氧化碳分子由一个碳原子和两个氧原子组成。
3. 简化式简化式是用最简整数比例表示化学物质中元素的组成。
简化式是实际式的一种简化形式,通过化简原始实际式得到。
简化式中的原子比例是最简比例。
例如,氢氧化铁的实际式是Fe(OH)3,通过化简可以得到简化式为FeO3H3。
二、分子式的计算计算分子式时,需要根据元素的原子价和化合价进行配平。
化合价是元素在化合物中所具有的结合能力。
元素的化合价可以通过它在化合物中的氧化态得到。
氧化态是描述元素与氧元素的相对电荷状态。
计算分子式的步骤如下:1. 确定化合物的离子类型根据化合物中元素的化合价,确定化合物类型是离子化合物还是共价化合物。
离子化合物是由阴阳离子组成,而共价化合物是由共用电子对组成的。
2. 计算化合物的总电荷对于离子化合物,根据阴阳离子的价数与其数量计算总电荷。
总电荷必须为零。
3. 配平元素的数量对于离子化合物,根据元素的价值和总电荷配平元素的数量。
对于共价化合物,根据元素的价值和原子的共价键数来配平元素的数量。
4. 写出分子式根据配平后的元素数量和原子价值,写出分子式。
例如,硫酸的分子式可以通过计算得到。
硫酸是一个离子化合物,它由一个硫离子和四个氧离子组成。
初三化学有关学式(分子式)的计算

初三化学有关化学式(分子式)的计算一. 本周教学内容:有关化学式(分子式)的计算二. 重点、难点:1. 根据元素的质量分数计算物质的质量比;2. 计算混合物中某一元素的质量分数;3. 根据元素的质量分数计算物质的纯度;4. 利用中位数的计算原理,合理推测混合物的组成;5. 利用元素的质量比、元素的质量分数推断化学式。
三. 知识点回顾物质的式量(分子量)←化学式(分子式)↔各元素的化合价、质量比、质量分数 解题时应注意须正确书写一种物质的化学式,并明确化学式中各个量的关系(原子个数比、质量比等)。
注意观察不同物质的化学式,发现和应用其中的某些特殊关系[如在FeSO 4、Fe 2(SO 4)3的混合物中,S 元素与O 元素的质量比是一定值],并注意应用数学思维方法(如化学式变形、估算、分解思想等)。
【典型例题】例1. 下列几种铁的化合物,其中铁元素的质量分数最大的是( )(A )Fe 3O 4 (B )Fe 2O 3 (C )FeO (D )FeS 2解法一:计算四种化合物中铁元素的质量分数分别为:%、70%、%、%,然后进行比较,得到该题的正确选项为(C )。
解法二:根据化合物中原子个数比值大小,进行推理比较,确定答案。
化 学 式: Fe 3O 4 Fe 2O 3 FeO FeS 2铁、氧原子个数比:3∶4 2∶3 1∶1 1∶4(硫的原子量是氧的2倍) 显然FeO 中铁、氧原子个数比值最大,所以FeO 中铁元素的质量分数最高。
例2. 由氧化镁和另一种金属氧化物组成的混合物4克,已知含氧元素1.8克,则另一种金属氧化物是( )(A )ZnO (B )Na 2O (C )Fe 2O 3 (D )Al 2O 3解:混合物中O %=48.1×100%=45% 纯MgO 中O %=4016×100%=40% ∴另一种氧化物中氧元素的质量分数必定大于45%分析比较:氧 化 物 ZnO Na 2O Fe 2O 3 Al 2O 3氧元素与金属元素的质量比 16:65 16:46 48:112 48:54 氧元素的质量分数 <45% <45% <45% >45%所以,正确答案是(D )例3. 已知某元素R 的原子量是51,在其氧化物中质量分数为68%,则R 元素氧化物的分子式为( )(A )R 2O 3 (B )RO (C )RO 2 (D )R 2O 5解:设氧化物的化学式为R x O y ,则10068165151=+y x x 得:x ∶y = 2∶3∴ 该化合物的化学式为R 2O 3∴选A例 4. 铁具有可变化合价,将14.4克草酸亚铁(FeC 2O 4)隔绝空气加热分解,最终得到7.2克铁的氧化物,则该铁的氧化物是( )(A )Fe 2O 3 (B )FeO (C )Fe 3O 4 (D )无法确定解:由题意可知,14.4克FeC 2O 4与铁的氧化物中所含铁元素的质量相等。
各种化学常数计算

各种化学常数计算化学常数是用来描述和计算化学反应和物质性质的重要参数。
本文将介绍几种常见的化学常数,并提供相应的计算方法。
1. 摩尔质量(molar mass):摩尔质量是指一个物质的单位摩尔数所对应的质量。
在计算摩尔质量时,需要知道化合物中各元素的原子质量,并根据不同元素的相对数量进行求和。
例如,对于水分子H2O(其中包含两个氢原子和一个氧原子),可以按照摩尔质量= 2 * 氢的摩尔质量 + 氧的摩尔质量进行计算。
氢的摩尔质量为1 g/mol,氧的摩尔质量为16 g/mol,因此水的摩尔质量为18 g/mol。
2. 分子量(molecular weight):分子量是指一个分子中各个原子的摩尔质量之和。
与摩尔质量类似,分子量也可以用来计算化合物的相对质量。
例如,对于H2O这个分子,可以直接将氢的摩尔质量乘以2,再加上氧的摩尔质量,得到水分子的分子量。
3.分子式计算:分子式是用来表示化合物中各元素的种类和相对数量的表示方法。
通过分子式,可以确定化合物中各元素的摩尔比例,进而计算分子量和摩尔质量。
例如,对于化合物C6H12O6(葡萄糖),可以通过分子式确定其中有6个碳原子、12个氢原子和6个氧原子。
再根据碳、氢、氧的摩尔质量,可以计算出葡萄糖的分子量和摩尔质量。
4. 绝对原子质量(atomic mass):绝对原子质量是指一个原子的质量,通常以原子质量单位(amu)表示。
绝对原子质量可以通过周期表上的原子质量找到。
例如,氢的绝对原子质量为1.0079 amu,氧的绝对原子质量为15.999 amu。
5. 摩尔体积(molar volume):摩尔体积是指1摩尔理想气体在标准条件下所占据的体积。
标准条件一般是指0摄氏度(273.15K)和标准大气压(1 atm)。
摩尔体积可以通过理想气体状态方程PV = nRT进行计算,其中P是气体的压强,V是气体的体积,n是气体的摩尔数,R是气体常数,T是气体的绝对温度。
计算分子个数的公式

计算分子个数的公式
计算分子个数的公式是根据化学物质的化学式来确定的。
化学式是用元素符号和下标表示的,它告诉我们一个分子中包含了哪些元素以及它们的比例关系。
根据化学式,我们可以确定分子中每个元素的原子个数,从而计算出分子的总个数。
例如,对于水分子(H2O),我们可以看到化学式中有两个氢原子和一个氧原子。
根据化学式,我们知道每个氢原子的原子个数为1,氧原子的原子个数也为1。
因此,水分子的总原子个数为2个氢原子加上1个氧原子,即3。
同样地,对于二氧化碳分子(CO2),化学式告诉我们有一个碳原子和两个氧原子。
根据化学式,我们知道碳原子的原子个数为1,氧原子的原子个数也为1。
因此,二氧化碳分子的总原子个数为1个碳原子加上2个氧原子,即3。
通过这样的方式,我们可以根据化学式计算出不同分子的总原子个数。
化学式提供了分子中元素的种类和比例关系,从而帮助我们确定分子的组成和特性。
计算分子个数的公式是根据化学式中每个元素的原子个数来确定的。
通过计算每个元素的原子个数并相加,我们可以得到分子的总原子个数。
这个公式帮助我们理解分子的组成和特性,对于化学研究和实践具有重要的意义。
分子乘除法简便计算专项训练

分子乘除法简便计算专项训练一、分子乘除法原理和步骤1、写出分子式。
首先,根据所给化学式写出分子式。
分子式是一种表示化合物中原子种类及元素相对个数的一种表示方法。
在分子式中,原子种类用化学符号表示,原子个数用下标表示。
2、计算分子质量。
在分子式中,我们将每个原子的个数与其对应的原子量相乘,然后相加得到分子的相对分子质量。
原子量是指单个原子的质量,它可以通过化学元素周期表查找到。
3、简化分子式。
根据分子的相对分子质量,我们可以将分子的式子进行简化。
简化分子式是为了方便描述和计算化合物的相对分子质量。
二、分子乘除法专项训练题接下来,我们提供一些分子乘除法的专项训练题目,帮助读者熟练掌握这一计算方法。
1、计算H2SO4的相对分子质量。
分子式H2SO4表示硫酸,其中包含了2个氢原子、1个硫原子和4个氧原子。
根据原子量表,氢的原子量为1,硫的原子量为32,氧的原子量为16因此,H2SO4的相对分子质量为:2*1+1*32+4*16=982、计算Fe(NO3)2的相对分子质量。
分子式Fe(NO3)2表示亚硝酸铁,其中包含了1个铁原子、2个亚硝酸根离子。
根据原子量表,铁的原子量为56,氮的原子量为14,氧的原子量为16因此,Fe(NO3)2的相对分子质量为:1*56+2*(14+3*16)=1763、计算Na2CO3的相对分子质量。
分子式Na2CO3表示碳酸钠,其中包含了2个钠原子、1个碳原子和3个氧原子。
根据原子量表,钠的原子量为23,碳的原子量为12,氧的原子量为16因此,Na2CO3的相对分子质量为:2*23+1*12+3*16=1064、计算C6H12O6的相对分子质量。
分子式C6H12O6表示葡萄糖,其中包含了6个碳原子、12个氢原子和6个氧原子。
根据原子量表,碳的原子量为12,氢的原子量为1,氧的原子量为16因此,C6H12O6的相对分子质量为:6*12+12*1+6*16=180。
三、结语分子乘除法是数学中常用的计算方法,在化学中也有着重要的应用。
碳谱中伯仲叔季的化学位移

碳谱中伯仲叔季的化学位移
13C的化学位移范围:0~250ppm;核对周围化学环境敏感,重叠少氢谱与碳谱有较多共同点;碳谱化学位移规律:
13CNMR谱的解析并没有一个成熟、统一的程序,应该根据具体情况,结合其他物理方法和化学方法测定的数据,综合分析才能得到正确的结论。
通常解析按以下步骤进行:
(1)确定分子式并根据分子式计算不饱和度。
(2)从13CNMR的质子宽带去偶谱,了解分子中含C的数目、类型和分子的对称性。
如果13C的谱线数目与分子式的C数相同,表明分子中不存在环境相同的含C基团,如果13C的谱线数小于分子式中的C 数,说明分子式中存在某种对称因素,如果谱线数大于分子中C数,则说明样品中可能有杂质或有异构体共存。
(3)分析谱线的化学位移,可以识别sp3、sp2、sp杂化碳和季碳,如果从高场到低场进行判断,0-40ppm为饱和烃碳,40-90ppm为与0、N相连的饱和碳,100-150ppm为芳环碳和烯碳,大于150ppm为炭基碳及叠烯碳。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一)根据分子式的计算
1.含K2O为23.5%的磷酸二氢钾的复合肥料中,P2O5的百分含量为
(A)52.3% (B)35.5% (C)40% (D)26%
2.化合物AB2和BC中,B的质量都占60%,那么,在化合物AC3中,A的质量占__________。
3.A、B两元素可形成A2B和A2B3两种化合物。
在A2B中,A与B的质量比为7 : 4,则在A2B3中,A、B的质量比为
(A)7 : 4 (B)7 : 8 (C)7 : 12 (D)7 : 16
4.A、B两元素可形成多种化合物,已知在A2B化合物中,A与B的质量比为7 : 5,则符合A、B质量比为7:15的化合物是
(A)AB2(B)A2B3(C)A3B2(D)A2B5
5.甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%。
若已知甲的分子式是XY2,则乙的分子式只能是
(A)XY (B)X2Y (C)X2Y3(D)X2Y5
6.10g元素R分别可和氧组成34g氧化物甲,66g氧化物乙,则甲、乙的化学式是
(A)R2O和R2O3(B)R2O3和R2O4
(C)R2O3和R2O5(D)R2O3和R2O7
7.有一Na2SO3、Na2SO4的混合物,经测定含硫25.6%,则此混合物含氧量为
(A)37.6% (B)51.2% (C)36.8% (D)无法计算
8.将a g的苯乙烯树脂溶于b L苯中,然后通入c mol乙炔气体,所得混合物中碳、氢两元素的质量比是
(A) 1 : 1 (B)12 : 1 (C)6 : 1 (D)3 : 1
9.取一定量的某乙酸乙酯和乙醛的混合物,测知其C元素的质量分数为58.5%,则此混合物H元素的质量分数是
(A)41.5% (B)32.5% (C)20.5% (D)9.75%
10.在苯和苯酚组成的混合物中,碳元素的质量分数为90%,则混合物中氧元素的质量分数是
(A) 2.5% (B)5% (C) 6.5% (D)7.5%
11.某由苯与苯酚组成的混合物中,测得氧元素的质量分数为2.5%,则混合物中氢元素的质量分数是
(A)5% (B)6.5% (C)7.5% (D)8.5%
12.某Cu2S与CuO组成的混合物中硫元素的质量分数是16 %,则混合物中铜元素的质量分数是(铜原子量按64计算)
(A)80% (B)75% (C)70% (D)无法计算
13.一包氯化铵晶体,其中混有一些硫酸铵,经测定,它的含氮量为25.7%,则该样品中氯化铵的含量为
(A)74.3% (B)75% (C)70% (D)80%
14.某钾肥含KCl 74.5%,则该钾肥中含钾的百分含量为
(A)30% (B)39% (C)41% (D)50%
答案:1 B,2 40%,3 C ,4 B,5 D,6 D,7 A,8 B,9 D,10 D,11 C,12 A,13 B,14 B。
