物理化学习题课
物理化学习题课

物理化学习题课1. 在密闭容器中,让NH4Cl(s)分解达到平衡后,体系中的相数是:( B )(A)1 (B)2 (C)3 (D) 42 气相中的大小相邻液泡相碰, 两泡将发生的变化是:( A )(A) 大泡变大, 小泡变小(B) 大泡变小, 小泡变大(C) 大泡、小泡均不变(D) 两泡将分离开3 半径为1×10-2 m 的球形肥皂泡的表面张力为0.025 N·m-1,其附加压力为:( D )(A) 0.025 N·m-2(B) 0.25 N·m-2(C) 2.5 N·m-2(D) 10 N·m-24 在同一温度下,微小晶粒的饱和蒸汽压和大块颗粒的饱和蒸压哪个大? ( A )(A) 微小晶粒的大(B) 大块颗粒的大(C) 一样大(D) 无法比较5 把细长不渗水的两张白纸互相靠近(距离为d ),平行地浮在水面上, 用玻璃棒轻轻地在两纸中间滴一滴肥皂液, 两纸间的距离将:( A )(A) 增大(B) 减小(C) 不变(D) (A).(B).(C)都有可能6 有两个电池,电动势分别为E1和E2:H2(p∃)│KOH(0.1 mol·kg-1)│O2(p∃) E1H2(p∃)│H2SO4(0.0l mol·kg-1)│O2(p∃) E2比较其电动势大小:( C )(A) E1< E2(B) E1> E2(C) E1= E2(D) 不能确定7下列电池不属于浓差电池的是:( D )(A) Tl(Hg)(a1)|Tl+(aq)|Tl(Hg)(a2)(B) Na(Hg)(a)|NaCl(m1)|| NaCl(m2)|Na(Hg)(a)(C) Na(Hg)(a)| NaCl(m1)|AgCl(s)|Ag(s)—Ag(s)|AgCl(s)| NaCl(m2)|Na(Hg)(a)(D) Ag(s)|AgCl(s)|NaCl(aq)|Na(Hg)(a)|NaCl(CH3CN溶液)|Na(s)9用铜电极电解0.1mol·kg-1的CuCl2水溶液,阳极上的反应为( B )(A) 2Cl- ─→Cl2+ 2e-(B) Cu ─→Cu2++ 2e-(C) Cu ─→Cu++ e-10. 将反应2Hg(l)+O2(g)+2H2O(l) = 2Hg2++4OH–设计成电池,当电池反应达到平衡时,电池的E必然是:( B )(A) E=E∃(B) E=0(C) E>0 (D) E<01. 在密闭容器中,让NH4CO3(s)分解达到平衡后,体系中的相数是:( C )(A)4 (B)3 (C )2 (D) 12在同一温度下,微小液滴的饱和蒸汽压和大块液体的饱和蒸压哪个大? ( A )(A) 微小液体的大(B) 大块液体的大(C) 一样大(D) 无法比较3 假如具有下列半衰期的等物质的量的放射性元素中, 哪一种对生态是瞬时最危险的? ( C )(A) 4.5×109 a (B) 65 a (C) 1 min (D) 12 d4催化剂能极大地改变反应速率,以下说法不正确的是:( C )(A) 催化剂改变了反应历程(B) 催化剂降低了反应的活化能(C) 催化剂改变了反应的平衡,以致使转化率大大地提高了(D) 催化剂能同时加快正向和逆向反应速率5 0.3 mol·kg-1Na2HPO4水溶液的离子强度是:( A )(A) 0.9 mol·kg-1(B) 1.8 mol·kg-1(C) 0.3 mol·kg-1(D)1.2 mol·kg-16有两个电池,电动势分别为E1和E2:H2(p∃)│KOH(0.2 mol·kg-1)│Cl2(p∃) E1H2(p∃)│H2SO4(0.5 mol·kg-1)│Cl2(p∃) E2比较其电动势大小:(C)(A) E1< E2(B) E1> E2(C) E1= E2(D) 不能确定7下列电池不属于浓差电池的是:(B )(A)Tl(Hg)(a1)|Tl+(aq)|Tl(Hg)(a2)(B)Na(Hg)(a)|NaCl(m1)|| MgCl2(m2)|Mg(Hg)(a)(C)Na(Hg)(a)| NaCl(m1)|AgCl(s)|Ag(s)—Ag(s)|AgCl(s)| NaCl(m2)|Na(Hg)(a)(D) Ag (s)│AgNO3(0.01mol.kg=0.90)║AgNO3(0.1mol.kg=0.72)│Ag (s)9用铜电极电解0.1mol·kg-1的ZnCl2水溶液,阳极上的反应为( B )(A) 2Cl- ─→Cl2+ 2e-(B) Zn ─→Zn2++ 2e-(C) Zn ─→Zn++ e-10. 将反应Ag (s),AgBr (s)│Br(a Br)║Cl(a Cl)│AgCl (s),Ag (s)设计成电池,当电池反应达到平衡时,电池的E必然是:(B)(A) E=E∃(B) E=0(C) E>0 (D) E<01浓度越大,摩尔电导率越大。
物理化学习题课

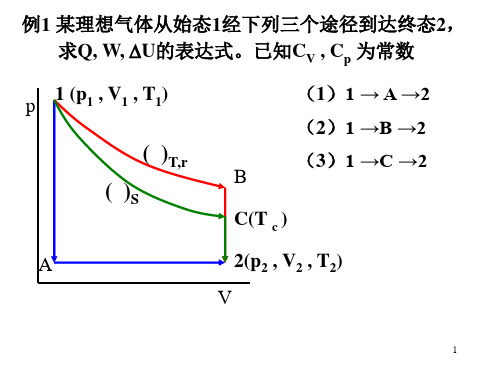
Vdp
∂V ∆S = − ∫ ( ) p dp p1 ∂ T
p2
∆ A = − ∫ pd V ,
V1
V2
∆ G = ∫ Vd p
p1
△G =V(p2- p1) T2,p2,V2
(2)理想气体
T1,p1,V1
∆U=CV(T2-T1); ∆H=Cp(T2-T1);
T2 V2 ∆ S = CV ln + nR ln T1 V1
习题课A 习题课A
一. 基本要求: 基本要求:
(1)明确热力学第一、二、三定律的意义,掌握各变化过程 明确热力学第一、 三定律的意义, 的能量转化规律和热功转化的不可逆性,自发变化的共同特征, 的能量转化规律和热功转化的不可逆性,自发变化的共同特征, 克劳修斯不等式及其应用。 克劳修斯不等式及其应用。 (2)掌握U、H、S、A、G的定义及相互关系,物理意义。 掌握U 的定义及相互关系,物理意义。 (3)熟练掌握各变化过程△U、 △H、Q、W 、△S、 的计算及其应用。 △A、△G的计算及其应用。 (4)掌握热力学基本公式及其衍生公式。掌握热力学公式的推导 掌握热力学基本公式及其衍生公式。 过程及方法。 过程及方法。 (5)熟练掌握熵判据、吉布斯自由能判据、亥姆霍兹自由能 熟练掌握熵判据、吉布斯自由能判据、 判据及应用。 判据及应用。
∂U ∂A )S = ( )T − p=( ∂V ∂V
−S =( ∂A ∂G )V = ( )p ∂T ∂T
∂U ∂H )V = ( )p 对应函数关系式 T = ( ∂S ∂S ∂H ∂G V =( )S = ( )T ∂p ∂p
Maxwell关系 Maxwell关系
∂T ∂p ( ) S = − ( )V , ∂V ∂S ∂S ∂p ( )T = − ( )V , ∂V ∂T
物理化学习题课(相平衡)参考答案

物理化学习题(相平衡)一.选择1.在α、β两相中均有A和B两种物质,达到相平衡时,下列各式正确的是(1)。
(1)μαB=μβB(2)μαA=μβA(3)μαB=μαA(4)μαB=μβA2.组分B从α相扩散到β相中,则下列说法中正确的是(4)。
(1)总是从浓度高的相扩散到浓度低的相(2)平衡时两相的浓度相等(3)总是从浓度低的相扩散到浓度高的相(4)总是从高化学势移向低化学势3. 室温下氨基甲酸铵分解反应为 NH2CO2NH4(s)====2NH3(g)+CO2 (g)若在300K时向系统中加入一定量的氨基甲酸铵固体,则此系统的物种数S和组分数C应为(3)。
(1)1,1(2)3,2(3)3,1(4)3,34.将克拉贝龙方程应用于水的液固两相,随压力的增长,水的凝固点将(2)。
(1)上升(2)下降(3)不变(4)无法判断5.在一定温度下,在水和CCl4组成的互不相溶的系统中,向水层中加入1:1的KI和I2,此系统的自由度是(2)。
(1)1(2)2(3)3(4)46.对于二组分系统,能平衡共存的最多相数为(4)。
(1)1(2)2(3)3(4)47.对于恒沸混合物,下列说法中错误的是(4)。
(1)不具有确定的组成(2)平衡时气相和液相组成相同(3)其沸点随外压的改变而改变(4)与化合物一样具有确定的组成二.填空1.在水的平衡相图中。
线是水的蒸发曲线,线是冰的升华曲线,线是冰的融化曲线,点是水的三相点。
.2.将过量NH4HCO3(s)放入密闭真空容器内,50℃时,按NH4HCO3(s)按下式进行分解:NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g)。
达平衡后则该体系的相数P= ,独立组分数C= ,自由度数F= 。
(2,1,0)3.(2)最合适的组成应配成w(联苯醚)=0.78,这一组成具有最低共熔点12℃,其凝固点最低,所以不至于因为凝固而堵塞管道。
4. 求下列系统③从X B=0.5开始蒸馏,馏出物或残留物分别是什么?(1)T M,T N,(2)所处的T,p及气液相组成y B、x B,达两相平衡气液相的相对量不同,(3)0。
物理化学习题课(一)

21. 在20℃和大气压力下,用凝固点降低法测物质的相对分 子质量。若所选的纯溶剂是苯,其正常凝固点为5.5℃,为 使冷却过程在比较接近于平衡状态的情况下进行,冷浴内的 恒温介质比较合适的是( ) (A)冰-水 (B)冰-盐水 (C)干冰-丙酮 (D)液氨
物理化学习题课(一)
热力学部分 何荣桓
假定气体为理想气体,计算下列过程的熵变: a) 将1mol N2 (T,p) 与 0.5mol N2 (T,p) 等温等压混合; b) 将1mol N2 (T,V)与 1 mol N2 (T,V) 等温等容混合 (Vmix=V) ;熵变与a)是否相同? c) 将1mol N2 (T,p)与 0.5mol O2 (T,p)等温等压混合,熵变与 a)是否相同?
21 答:A
22. 二组分理想液态混合物的蒸气总压( ) (A)与溶液的组成无关 (B)介于两纯组分的蒸气压之间 (C) 大于任一纯组分的蒸气压 (D)小于任一纯组分的蒸气压
22 答:B
23. A和B两组分在定温定压下混和形成理想液态混合物时,
则有:( )。
(A)ΔmixH=0 (C)ΔmixA=0 23 答:A
19 答:D
(C) Tb*> Tb, pA*< pA, ,μA* >μA
(D) Tb*< Tb, pA*> pA, ,μA* >μA
20. 已知环己烷、醋酸、萘、樟脑的凝固点降低系数 kf 分别是 20.2、9.3、6.9及39.7K•kg • mol-1。今有一未知物能在上述四 种溶剂中溶解,欲测定该未知物的相对分子质量,最适宜的溶 剂是( )
(A) 1 (B) 3/4 (C) 2/3 (D) 1/2
南京大学物理化学习题课

上一内容 下一内容 回主目录
返回
5/9/2020
辅导答疑
1.14 请指出所列公式的适用条件: (4) dH = Cp dT
答:适用于不作非膨胀功、状态连续变化的等压 过程。
上一内容 下一内容 回主目录
返回
5/9/2020
辅导答疑
1.15 用热力学概念判断下列各过程中功、热、热
力学能的变化值。第一定律 U Q 。 W
U = 0 根据热力学第一定律,能量守 恒,热力学能不变。
H 0 因为是在绝热刚瓶中发生的放
热反应,气体分子没有减少,
钢瓶内温度升高压力也增高。
上一内容 下一内容 回主目录
返回
5/9/2020
辅导答疑
1.15 用热力学概念判断下列各过程中功、热、热
力学能和焓的变化值。第一定律 U Q W。
(4) H2(g)+ Cl2(g)= 2HCl(g) 在非绝热钢瓶中进行
上一内容 下一内容 回主目录
返回
5/9/2020
辅导答疑
1.15 用热力学概念判断下列各过程中功、热、热
力学能和焓的变化值。第一定律 U Q W。
(3)H2(g)+ Cl2(g)= 2HCl(g) 在绝热钢瓶中进行
答:W = 0 在刚性容器中是恒容反应,
不作膨胀功。
Q = 0 绝热钢瓶
H2 Cl2
返回
5/9/2020
辅导答疑
1.16 下列状态函数中,哪些是容量性质?哪些是强 度性质?
压力 p,温度 T,体积V ,热力学能U,
焓 H, 粘度,密度,质量m,等压热容 Cp,等容
热容CV ,摩尔热力学能Um,摩尔焓Hm 等。
答: V ,U , H , m, Cp , CV 是容量性质;
物理化学习题课精讲附答案完整版讲解

化学反应等容过程或等压过程不管是一步完成
还是分几步完成,该反应的热效应相同,这一规律
在 1840 年由 Hess (赫斯)发现,称为 Hess 定律。 自热力学第一定律产生后,上述结论就成为必然结 果了。利用Hess定律可以通过已知的反应热效应求 算难以直接测量的反应热效应。热效应的种类有生
成焓、燃烧焓、溶解热、稀释热。人们规定在反应
p外V p外V
CV (T1 T2 )
( p V p2V2 ) 1 1 1
C dT
p
Qp pV
Qp
C dT
p
C C
V
dT dT
C dT
p
0
V
C dT
p
-
nR (T1 T2 ) 1
U W
C
V
dT
C dT
p
p外V p外V
Qp
Qp
Qp W Qp W
Qp (相变热)
Qp
B
rU m r H m B RT H H ( B) B f m r m B
三、Carnot(卡诺)循环
Carnot循环是热力学基本循环。由等温可逆膨胀、 绝热可逆膨胀、等温可逆压缩、绝热可逆压缩四步 构成一个理想热机。虽然实际上不可能实现,但却 得到了热功转换的极限公式:
与途径有关。为了应用需要,定义了一个状态函数
由该定义和热力学第一定律得到 H Qp 的关系式,此式 很有实用价值。因为大多数化学反应是在等压下进行的, 在非膨胀功为零的封闭系统中,系统在等压过程中所吸 收的热量全部用于焓的增加。 热力学第一定律应用于理想气体时,通过Joule实验得 到理想气体的热力学能和焓都仅是温度的函数的结论。 热力学第一定律应用于真实气体时通过 Joule-Thomson实 验得到实际气体的热力学能和焓不仅是温度的函数,且 与压力有关的结论。
物理化学课后习题答案(全)

第1章 物质的pVT 关系和热性质习 题 解 答1. 两只容积相等的烧瓶装有氮气,烧瓶之间有细管相通。
若两只烧瓶都浸在100℃的沸水中,瓶内气体的压力为0.06MPa 。
若一只烧瓶浸在0℃的冰水混合物中,另一只仍然浸在沸水中,试求瓶内气体的压力。
解: 21n n n +=2212112RT V p RT V p RT V p +=⋅2111121222112p T p T T p T T T T =+⎛⎝⎜⎞⎠⎟=+ ∴112222p T T T p ⋅+=MPa0.0507=MPa 06.02)15.273100()15.2730(15.2730⎥⎦⎤⎢⎣⎡××++++=2. 测定大气压力的气压计,其简单构造为:一根一端封闭的玻璃管插入水银槽内,玻璃管中未被水银充满的空间是真空,水银槽通大气,则水银柱的压力即等于大气压力。
有一气压计,因为空气漏入玻璃管内,所以不能正确读出大气压力:在实际压力为102.00kPa 时,读出的压力为100.66kPa ,此时气压计玻璃管中未被水银充满的部分的长度为25mm 。
如果气压计读数为99.32kPa ,则未被水银充满部分的长度为35mm ,试求此时实际压力是多少。
设两次测定时温度相同,且玻璃管截面积相同。
解:对玻璃管中的空气,p V p V 2211=kPa 0.96=kPa )66.10000.102(35251212−×==p V V p ∴ 大气压力 = kPa 28.100kPa )96.032.99(=+·28· 思考题和习题解答3. 让20℃、20 dm 3的空气在101325 Pa 下缓慢通过盛有30℃溴苯液体的饱和器,经测定从饱和器中带出0.950 g 溴苯,试计算30℃时溴苯的饱和蒸气压。
设空气通过溴苯之后即被溴苯蒸气所饱和;又设饱和器前后的压力差可以略去不计。
(溴苯Br H C 56的摩尔质量为1mol g 0.157−⋅)解:n pV RT 131013252010831452027315==×××+⎡⎣⎢⎤⎦⎥−().(.) mol =0.832 mol n m M 209501570==..mol =0.00605mol p py p n n n 22212101325732==+=×= Pa 0.006050.832+0.00605 Pa4. 试用范德华方程计算1000 g CH 4在0℃、40.5 MPa 时的体积(可用p 对V 作图求解)。
物理化学傅献彩习题课-第二、三、四章
21.偏摩尔量是容量性质的状态函数。 22. 化学势是容量性质的状态函数。 23.理想稀溶液中的溶剂遵从亨利定律,溶质遵从拉乌尔定律。 24.理想混合气体中任意组分B的逸度fB就等于其分压pB。 25.任何一个偏摩尔量(化学势)都是温度、压力和组成的函数。 26.对于非理想气体,Z<1表示实际气体极容易压缩。 27.对于纯组分,化学势等于Gibbs自由能。 28.热力学的不可逆过程就是不能向相反方向进行的过程。此 话对吗? 29.一个爆炸反应体系应看作是绝热系统。 30.一个隔离系统的熵永不减少。 31.理想稀溶液Raoult定律与Henry定律没有区别。 32.溶质在气相和在溶液中的分子状态不相同,Henry定律也 能适用。
(b)
∆vapS总,∆vapA,∆vapG是否均可用来判别这
一过程的方向?并叙述理由,其判断结果如何?
9
解:通过可逆过程进行计算
∆vapG = 0;∆vapS = n∆vapHm/T = 41.85 J· −1 K
∆vapA= ∆vapG − ∆vap(pV) = −nRT = −3325.6 J
椐,因 W = 0 ∴ −W ≤ − ∆vapA ∴ ∆vapA < 0,过程不可逆 ∵ 过程不恒压,不能用 ∆vapG 来判别
10
判断题 1.1摩尔100℃101325Pa下的水变成同温同压下的水蒸气,该过 程的ΔU=0。 2.ΔfHθm (C,金刚石,298K)=0。 3.298.15K时,H2(g)的标准摩尔燃烧焓与H2O(l)的标准摩尔生成 焓数值上相等。 4.绝热过程都是等熵过程。 5.体系经历一个不可逆循环过程,ΔS>0。 6.一定量理想气体的熵只是温度的函数。 7.dU=nCv,mdT, dH=nCp,mdT这两个公式对一定量的理想气体的任 何pVT过程均适用。 8.一个系统从始态到终态,只有可逆过程才有熵变。 9.系统从同一始态出发,经绝热不可逆到达的终态,若经过绝 热可逆过程,则一定达不到此终态。 10.对气态物质,其Cp-Cv=nR
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(D)
(A)
(D)
10. 公式U=Q + W适用于 A. 开放系统; B. 封闭系统; C. 孤立系统。
(B,C)
14. 对于封闭的热力学系统,下述哪一个描述正确 A. H>U;B. H=U ; C. H<U;D. H与U之间的大小不能确定 。
(D)
11. 在温度恒定的过程中,系统与环境之间能否产生热交换(B) A. 一定产生;B. 不一定产生; C. 一定不产生。 12. 某绝热系统在接受了环境所做的功之后,其温度 A. 一定升高; B. 一定降低; C. 一定不变;D. 不一定改变。 13. 公式H=U + pV中,p表示什么含义 A. 系统总压力; B. 系统各组分分压; C. 101325 Pa;D. 外压。 (A)
(左方)
21. 某理想气体从温度T1加热至温度T2,若此变化为非恒 (B) 容途径,则其热力学能的变化U应该为何值 A. U =0;B. U =CV(T2-T1); C. U不存在;D. U等于其它值 (C) 本题中的QV应为何值? A. QV =0;B. QV =CV(T2-T1); C. QV 不存在;D. QV 等于其它值
36.当以 5mol H2气与 4mol Cl2气混合,最后生成 2mol HCl 气。若以下式为基本单元,则反应进度ξ应是: H2(g) + Cl2(g) → 2HCl(g) (A) (A) 1 mol (B) 2 mol (C) 4 mol (D) 5 mol 37.有人认为封闭体系“不作功也不吸热的过程 △U = 0,因而 体系的状态未发生变化”,请对此加以评论并举例说明。 答:封闭体系不作功也不吸热的过程 △U = 0,这是正确 的,体系的状态未发生变化是不正确的。例如,在绝热钢 瓶内由 H2(g) 和 O2(g) 反应生成水便是。
(B)
44. 某高压容器中含有未知气体,可 能是N2, Ne或Ar. 今在298K时,取出 一些样品,从5 dm3绝热可逆膨胀到6 dm3, 温度下降了21 K.试判断为何种 气体?
解:由绝热可逆方程
T1 V2 T2 V1 T 298.2 lg 1 lg T2 1 277.2 1 1.40,故为N 2 6 V2 lg lg 5 V1
1. 物质的临界点的性质与什么有关 A. 与外界温度有关; B. 与外界的压力有关; C. 与外界物质有关;D. 是物质的本身特性。
(D)
习题课
2. 下列几种条件下的实际气体,哪一种最接近理想气体 (B) A. 高温高压; B. 高温低压; C. 低温高压;D. 低温低压。 3. 下列对某物质临界点性质的描述,哪一种是错误的 (D) A. 液相摩尔体积和气相摩尔体积相等; B. 液相与气相的相界面消失; C. 汽化热为零; D. 气、液、固三相共存
(A)
1
17. 恒压下,单组分系统的焓值随温度的升高而 A. 增加; B. 减少; C. 不变; D. 不一定 。
(A)
20. 理想气体从同一始态(p1, V1, T1)出发,分别经恒温可逆压缩 何绝热可逆压缩,环境所做功的绝对值分别为WT和WA。若 压缩至同一终态体积V2,下述答案中哪一个是正确的 A. WT>WA; B. WT<WA; C. WT=WA; (B) D. WT与WA无确定关系; 若压缩至同一压力,则上述答案中正确的是 (A)
22. 某理想气体进行等温自由膨胀,其热力学能U应为何(C) 值 A. U >0;B. U <0; C. U=0;D. 无法确定 23. 下述哪些变化中,熵值不变 A.可逆途径;B. 可逆循环; C. 不可逆循环;D. 绝热不可逆循环 (B,C)
25. 非理想气体经过一不可逆循环,下列哪些表达式是正 (A,D) 确的 A. S = 0 ;B. Q/T=0; C. S 0;D. Q/T0. 26. 非理想气体进行绝热可逆膨胀,下述答案中,哪一个 (B) 是正确的 A. S > 0 ;B. S <0; C. S = 0;D. 不一定. 27. 熵增加原理可用于下列哪些系统 A. 开放系统 ;B. 封闭系统; C. 孤立系统;D. 绝热系统. (C,D)
28. 为什么无非体积功的等压过程的热,只决定于系统的 初、终态? 答:因为无其它功的等压过程中Qp=ΔH,而 ΔH 是系统状态 函数的改变值,其大小只决定于系统的始终态,所以在无其 它功的等压过程 Qp 大小只决定于初终态。 29.反应 A(g)+2B(g)—→C(g) 的ΔrHm(298.2 K)>0,则此反应 进行时必定吸热,对吗? 为什么? 答:不对。只有在等压下,无非体积功时,Qp=ΔHm,ΔHm >0,故 Qp>0,体系必定吸热。但在有非体积功,或者非等 压条件下,ΔHm≠Qp ,ΔHm>0,Qp可以小于0,等于0,不一 定吸热。例如,绝热容器中H2与O2 燃烧,ΔHm>0,但Q= 0,不吸热。
40. 对于克劳修斯不等式 dS ≥δQ/T环,判断不正确的是: (C) (A) dS =δQ/T环必为可逆过程或处于平衡状态; (B) dS >δQ/T环必为不可逆过程 ; (C) dS >δQ/T环必为自发过程 ; (D) dS <δQ/T环违反卡诺定理和第二定律,过程不可能自发发生。
43.计算熵变的公式 ∆S = ∫(dU + pdV)/T 适用于下列: (A) 理想气体的简单状态变化 ; (B) 无体积功的封闭体系的简单状态变化过程 ; (C) 理想气体的任意变化过程 ; (D) 封闭体系的任意变化过程 ;
1
3
(C) 38. 绝热可逆过程为( )过程 (A)等热力学能(B)等焓(C)等熵(D)等Gibbs函数 39. 某气体经节流膨胀后温度降低,其J-T( (A)>0(B)<0(C)=0(D)无法确定 ) (填入、或) (A)
41.当理想气体在等温(500K)下进行膨胀时,求得体系的熵变 ∆S = l0 J·K-1,若该变化中所做的功仅为相同终态最大功的 1/10,该变化中从热源吸热多少? (B) (A) 5000 J ; (B) 500 J ; (C) 50 J ; (D) 100 J 。 42. 1mol双原子理想气体的(∂H/∂T)V是: (A) 1.5R ; (B) 2.5R ; (C) 3.5R ; (D) 2R 。 (B)
24. 两台不同形式的可逆热机,工作在两个相同热源T1与 (A) T2之间,则这两台热机的热效率有何关系 A.相等;B. 不等; C. 不一定相等 25. 系统由初态A经不同的不可逆途径到达终态B时,其熵(B) 变S应为何值 A.各不相等;B. 都相同; C. 不等于经可逆环后,下列哪些说法是错误的 (A,B) A. Q=0;B. W=0;C. U=0; D. Cp=0 ; E. CV=0 ; F. H=0 19. 为p0, 则在p-V图上,其终点位置在由同一始态出发的恒温 可逆膨胀至同一终态压力p0的终点位置的哪一方。 理想气体若发生一多方膨胀过程,pVn=C,至终态压力
4. 下列说法中,哪一种是错误的 A. 理想气体方程式中压力p是状态函数; B. 范德华方程式中的压力p是状态函数; C. 压缩因子气体方程中的压力p是状态函数; D. 外压是状态函数。 5.系统经某变化后热力学能值复原,哪一个是正确的 A.说明系统已经复原; B. 说明系统没有复原; C. 系统不一定复原。 6. 有一个状态函数始终保持不变的途径是什么途径 A.一定是可逆途径; B. 一定是不可逆途径; C. 不一定是可逆途径。
(B)
(B) △U = 0 , △H > 0 , W = 0 (D) Q = 0 , △U ≠ 0 , △H ≠ 0
2
33.有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与 筒外相等时关闭活塞,此时筒内温度将 (C) (A ) 不变 (B) 升高 (C) 降低 (D) 无法判定 (B) 34. H = Qp此式适用于下列那个过程 (A ) 理想气体从 1013250 Pa 反抗恒定的 101325 Pa膨胀到101325Pa (B) 0℃ ,101325 Pa下冰融化成水 (C) 电解 CuSO4水溶液 (D) 气体从 (298K,101325 Pa) 可逆变化到 (373K,10132.5 Pa) 35. 1mol 理想气体经历可逆绝热过程,功的计算式有下列几种, 其中哪一个是错误的 (B) (A ) CV(T2- T1) (B) Cp(T2-T1) (C) (p2V2- p1V1)/(-1) (D) R(T2-T1)/(-1)
(D)
(C)
(C)
7. H=Qp成立的条件是 A. 开放系统,只做体积功,p体=p外=常数; B. 封闭系统,可作任何功, p体=p外=常数; C. 封闭系统,只做有用功, p体=p外=常数; D. 封闭系统,只做体积功, p体=p外=常数; E. 封闭系统,只做体积功, p始= p终=p外=常数。 8. 下述说法中,哪一个是正确的 A. 水的生成热既是氢气的燃烧热; B. 水蒸气的生成热既是氢气的燃烧热; C. 水的生成热既是氧气的燃烧热; D. 水蒸气的生成热既是氧气的燃烧热。 9. 氧气的燃烧热应为何值 A. 大于零;B. 小于零; C. 等于零;D. 不存在。
15. 下述说法哪一个是正确的 (B) 液体的温度越高,则 A. 其所含的热量就越多;B. 其分子的热运动越剧烈 ; C. 其流动性越大;D. 其焓值越大 。 16. 下述说法哪一个不正确 (D) A. 焓只有在某些特定的条件下,才与系统吸热相等; B. 焓是人为定义的一种具有能量量纲的热力学量; C. 焓是状态函数; D. 焓是系统能与环境进行热交换的能量 。
(B) 30. 1. 恒容下,一定量的理想气体,当温度升高时内能将 (A) 降低 (B) 增加 (C) 不变 (D) 增加、减少不能确定 31. 在一刚性的绝热箱中,隔板两边均充满空气,(视为理想气 体),只是两边压力不等,已知 p右< p左,则将隔板抽去后应有 (A) (A) Q = 0 W = 0 △U = 0 (B) Q = 0 W < 0 △U > 0 (C) Q > 0 W < 0 △U > 0 (D) △U = 0 , Q = W ≠ 0 32.苯在一个刚性的绝热容器中燃烧, 则 C6H6(l) + (15/2)O2(g) = 6CO2+ 3H2O(g) (A ) △U = 0 , △H < 0 , Q = 0 (C) Q = 0 , △U = 0 , △H = 0
